RINIVENT nässpray, lösning 21 mikrog/dos
Kvalitativ och kvantitativ sammansättning
Ipratropiumbromid 21 mikrog/dos.
Rinivent 21 mikrog/dos nässpray är förpackad i en pumpflaska, som med varje pumpning ger 70 mikroliter lösning med styrka 0,3 mg/ml.
Den aktiva substansen är i form av monohydrat.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen
Hjälpämne med känd effekt:
1 spraydos innehåller 17,5 mikrogram bensalkoniumklorid (se avsnitt Varningar och försiktighet)
Läkemedelsform
Nässpray, lösning
Kliniska uppgifter
Terapeutiska indikationer
Symtomatisk behandling av allergisk eller icke-allergisk rinit.
Dosering och administreringssätt
Vanlig dos för vuxna är 2 sprayningar i vardera näsborren 2–3 gånger dagligen.
Pediatrisk population
Det är inte lämpligt att använda Rinivent nässpray vid behandling av barn och ungdomar under 18 år.
Kontraindikationer
Överkänslighet mot atropin, atropinliknande föreningar eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Vid ordination av Rinivent nässpray bör försiktighet vidtas hos patienter med trångvinkelglaukom eller patienter med urinflödesförträngning t.ex. på grund av prostatahyperplasi eller blåshalsobstruktion.
Personer med cystisk fibros kan vara mera mottagliga för störningar i magtarmkanalen.
Omedelbara överkänslighetsreaktioner kan förekomma; urtikaria, angioödem, hudutslag, bronkospasm, orofaryngealt ödem och anafylaxi har sällan rapporterats.
Hjälpämne
Rinivent innehåller konserveringsmedlet bensalkoniumklorid. som kan orsaka irritation och svullnad inuti näsan, särskilt vid längre tids användning av läkemedlet.
Ögonkomplikationer
Ögonkomplikationer såsom mydriasis, ökat intraokulärt tryck, trångvinkelglaukom och ögonsmärta har i enstaka fall rapporterats, när ipratropiumbromid ensamt eller i kombination med adrenerg beta2-agonist har kommit i ögonen vid sprayning. Därför ska man instruera patienterna att använda nässprayen på rätt sätt.
Smärta eller obehag från ögonen, dimsyn, halo- eller färgfenomen, tillsammans med rödögdhet beroende på svullnad i konjunktiva eller kornea, kan vara tecken på akut trångvinkelglaukom. Vid uppträdande av dessa symtom, ska behandling med miotikum inledas och specialistläkare omedelbart konsulteras.
Interaktioner
Samtidig användning av Rinivent och andra läkemedel som används för behandling av icke-säsongsbunden rinit, såsom antihistaminer, vasokonstriktorer eller steroider som administreras i näsan, har inte visats öka förekomsten av biverkningar.
Rinivent absorberas i den systemiska cirkulationen i mycket ringa grad. En ringa additiv interaktion är dock möjlig vid samtidig användning av andra antikolinerga läkemedel, t.ex. inhalationssprayer som innehåller ipratropiumbromid.
Fertilitet, graviditet och amning
Graviditet:
Säkerheten av Rinivent under graviditet har inte utretts. Fördelar med användning under konstaterad eller misstänkt graviditet ska vägas mot eventuella skador på fostret. Icke-kliniska studier med läkemedlet har dock inte visat några embryotoxiska eller teratogena effekter efter inhalation eller intranasal administrering vid doser som var betydligt större än de rekommenderade doserna för människa.
Amning:
Uppgift saknas om ipratropium passerar över i modersmjölk. Även om iptratropiumbromidliknande lipidlösliga katjoner utsöndras i bröstmjölk, är det osannolikt att läkemedlet skulle övergå till barnet i någon betydlig grad vid intranasal administrering. Försiktighet ska iakttas vid användning av Rinivent under amning.
Fertilitet:
Prekliniska studier som utförts med ipratropiumbromid visade ingen negativ effekt på fertilitet (se avsnitt Prekliniska säkerhetsuppgifter). Det finns inga kliniska data på fertilitet för ipratropriumbromid.
Effekter på förmågan att framföra fordon och använda maskiner
Inga studier om effekter på förmågan att framföra fordon och använda maskiner har utförts. Dock ska patienterna informeras om att de kan uppleva biverkningar som yrsel, ögats ackommodationsstörning, mydriasis och dimsyn under behandling med Rinivent . Därför uppmanas patienten till försiktighet vid bilkörning eller användning av maskiner. Om patienterna upplever ovan nämnda biverkningar bör de undvika potentiellt riskfyllda uppgifter som att framföra fordon eller använda maskiner.
Biverkningar
Flera av de uppräknade biverkningarna kan anses vara orsakade av de antikolinerga egenskaperna av Rinivent . Liksom alla läkemedel som sprayas i näsan kan Rinivent orsaka lokal irritation. Biverkningarna har samlats från kliniska prövningar och rapporter efter godkännande för försäljning.
De vanligaste biverkningarna som rapporterats i kliniska prövningar var näsblod, torrhet i näsan, huvudvärk, nasalt obehag och irritation i halsen.
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, <1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgänglig data).
| Immunsystemet | |
| Mindre vanlig | anafylaktisk reaktion, överkänslighet |
| Centrala och perifera nervsystemet | |
| Vanlig | huvudvärk |
| Mindre vanlig | yrsel |
| Ögon | |
| Mindre vanlig | ackommodationsstörning, mydriasis, ökat intraokulärt tryck, glaukom, ögonsmärta, dimsyn. synstörningar (halo), konjunktival hyperemi, kornealödem |
| Hjärtat | |
| Mindre vanlig | supraventrikulär takykardi, förmaksflimmer, ökad hjärtfrekvens |
| Sällsynta | palpitation |
| Andningsvägar, bröstkorg och mediastinum | |
| Vanliga | näsblod, torrhet i nässlemhinnan, halsirritation, obehag i näsan |
| Mindre vanlig | bronkospasm, laryngospasm, farynxödem, halstorrhet |
| Magtarmkanalen | |
| Mindre vanlig | stomatit, illamående, gastrointestinala motilitetsstörningar, munödem, muntorrhet |
| Hud och subkutan vävnad | |
| Mindre vanliga | angioödem, hudutslag |
| Sällsynta | urtikaria, klåda |
| Njurar och urinvägar | |
| Mindre vanliga | urinretention |
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Inga specifika symtom på överdosering har påvisats. På grund av administreringssättet och den stora terapeutiska bredden av Rinivent är det osannolikt att allvarliga antikolinerga symtom förekommer. Lindriga symtom som beror på antikolinerg effekt kan förekomma, såsom torra slemhinnor i munnen och näsan, ackommodationsstörningar och takykardi.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Övriga medel vid nässjukdomar,
ATC-kod: R01AX03
Ipratropiumbromid, kvarternärt ammoniumderivat av atropin, är ett antikolinergt läkemedel. Vid intranasal användning har ipratropiumbromid en lokal parasympatisk blockeringseffekt, som minskar överflödig vattnig utsöndring från näsans slemkörtlar. Kliniska prövningar på patienter med icke-säsongsbunden rinit visade att Rinivent förhindrade utsöndring av näsan inducerad med metakolin. Effekten började inom 15 minuter och var dosberoende. Även verkningstiden var dosberoende.
I en 8 veckor lång studie på vuxna med allergisk rinit var dosen 168 mikrog/näsborre 2 gånger dagligen vältolererad och effektiv.
Kontrollerade kliniska prövningar på människor med allergisk och icke-allergisk icke-säsongsbunden rinit har visat att ipratropiumbromid förhindrar symtom på rinnande näsa och förkortar varaktigheten av riniten. Två placebokontrollerade prövningar där Rinivent gavs 21 µg/dos två gånger dagligen, visade att med dosen 42 µg/näsborre var Rinivent effektivare vid behandling av icke-allergisk än allergisk icke-säsongsbunden rinit.
Användning av ipratropiumbromid som nässpray hade ingen effekt på luktsinnet, näsans mukosiliära funktion eller näsans fuktande och temperatursutjämnande effekt.
Farmakokinetiska egenskaper
Ipratropium absorberas snabbt från nässlemhinnan, men i liten omfattning. Hos friska försökspersoner utsöndrades mindre än 10 % av en nasalt given dos oförändrad i urinen under 24 timmar. Systemisk absorption över inflammerad nässlemhinna var inte förändrad efter en experimentellt inducerad förkylning. Då ipratropium gavs nasalt åt friska och infekterade en eller fyra gånger dagligen utsöndrades 6–8 % av dosen oförändrat i urinen. Efter kronisk dosering hos rinitpatienter var mängden ipratropium som utsöndrades oförändrat i urinen under 24 timmar 4–6 % av dosen vid steady state. 50 % av den intravenöst administrerade dosen utsöndras i urinen, så den uppskattade biotillgängligheten av ipratropium efter nasal administrering är mindre än 20 %.
De farmakokinetiska grundparametrarna av ipratropium har beräknats utifrån plasmakoncentrationer efter iv-administrering.
En snabb bifasisk nedgång i plasmakoncentration kan observeras. Den skenbara distributionsvolymen vid steady-state (Vdss) är ca 176 liter (2,4 l/kg). Bindningen till plasmaproteiner är liten (mindre än 20 %).
Ipratropium har inte observerats passerar blod-hjärnbarriären.
Ipratropiums terminala eliminerings halveringstiden är ca 1,6 h. Verksamma ämnet har en total clearance på 2,3 l/min och ett renalt clearance på 0,9 l/min. Efter intravenös administrering metaboliseras ca 60 % av en dos genom oxidation i levern.
I en utsöndringsstudie svarade den kumulativa renala utsöndringen (6 dagar) av läkemedelsrelaterad radioaktivitet (inkluderande modersubstans och alla metaboliter) för 72,1 % efter intravenös administrering, 9,3 % efter oral administrering och 3,2 % efter inhalation. Den totala radioaktiviteten som utsöndrades via faeces var i genomsnitt 6,3 % efter intravenös administrering, 88,5 % efter oral dosering och 69,4 % efter inhalation. Den dominerande utsöndringen av läkemedelsrelaterad radioaktivitet skedde via njurarna. De huvudsakliga metaboliterna i urinen binder svagt till muskarina receptorer och måste anses vara verkningslösa.
Prekliniska säkerhetsuppgifter
Den lokala och systemiska toleransen av ipratropiumbromid har studerats hos olika djurslag med olika administreringsvägar.
Vid administrering via inhalation till hanmarsvin var den minsta letala dosen av iptratropiumbromid 199 mg/kg. Hos råtta var de tekniskt högsta doserna (0,05 mg/kg/4 h eller 160 ipratropiumbromid-sprayningar, 0,02 mg/sprayning) inte letala. Det orala LD50 -värdet för mus var 1 585 mg/kg, för råtta 1 925 mg/kg och för kanin 1 920 mg/kg. LD50 -värdet vid intravenös administrering av iptratropium var 13,6 mg/kg för mus, 15,8 mg/kg för råtta och 18,2 mg/kg för hund. Kliniska symtom var mydrias, torra slemhinnor i munnen, andnöd, tremor, krampanfall och/eller takykardi.
Toxicitetsstudier med upprepad exponering har utförts på råtta, kanin, hund och rhesusapa. I sex månader långa studier där ipratropiumbromid administrerades som inhalation var NOAEL-dosen (no-observed adverse effect level) hos råtta 0,38 mg/kg/dag, hos hund 0,18 mg/kg/dag och hos rhesusapa 0,8 mg/kg/dag.
I sex månader långa studier orsakade intranasal administrering av en dos om 0,20 mg/kg/dag inga skadliga effekter hos hund.
Gentoxicitet observerades inte in vitro (Ames test) eller in vivo (mikrokärntest, dominant letaltest hos mus, cytogen bestämning med benmärgsceller från kinesisk hamster).
I långtidsstudier på mus och råtta observerades inga tumörframkallande eller karcinogena effekter.
Studier där iptratropiumbromids eventuella effekt på fertilitet, fostertoxicitet och peri/postnatal utveckling har gjorts på mus, råtta och kanin. Höga orala doser, såsom 1 000 mg/kg/dag hos råtta och 125 mg/kg/dag hos kanin, var modertoxiska hos båda djurslag och embryo/fostertoxiska hos råtta, då det orsakade minskad fostervikt. Inga missbildningar förknippade med användningen observerades. De högsta tekniskt möjliga aerosoldoserna vid inhalation, 1,5 mg/kg/ hos råtta och 1,8 mg/kg/dag hos kanin hade ingen skadlig effekt på reproduktionsförmågan.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Natriumklorid, bensalkoniumklorid, dinatriumedetat, klorvätesyra q.s. ad pH 4,7, renat vatten q.s.
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år.
Förbrukningstiden för öppnad förpackning är 12 månader.
Särskilda förvaringsanvisningar
Får inte frysas.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
RINIVENT nenäsumute, liuos
21 mikrog/annos (L:ei) 180 annosta (13,43 €)
PF-selosteen tieto
Rinivent 21 mikrog/dos nässpray är förpackad i en brun, 15 ml:s pumpflaska av glas, varav man får cirka 180 doser.
Läkemedlets utseende:
Klar, färglös vattenlösning med pH 4,0–5,0.
Särskilda anvisningar för destruktion och övrig hantering
Bruksanvisning
Läs bruksanvisningen noggrant och följ anvisningarna.
- Tag av skyddslocket.
-
Innan nässprayen används första gången, spraya flera gånger i luften tills en jämn dusch kommer från sprayflaskan (se bild.1).
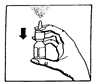
Bild 1
Vid fortsatt användning fungerar nässprayen omedelbart.
Snyt ur näsan före användning av nässprayen. -
För in spetsen på sprayflaskan i näsborren och spraya en gång (se bild 2).
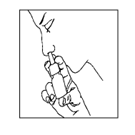
Bild 2
Upprepa i den andra näsborren. När sprayen är utlöst, andas sakta in genom näsan. - Sätt tillbaka skyddslocket efter användning av nässprayen.
Ta inga extra doser och sluta inte att använda Rinivent spray, utan att ta kontakt med läkaren eller apotekspersonalen.
Om nässprayen i misstag kommer i kontakt med ögonen, skölj då genast ögonen med ljummet vatten.
Rengöring
Rengör näsapplikatorn regelbundet. Ta bort plastlocket. Håll spetsen under rinnande varmt kranvatten under en minut. Skaka av vattnet och låt den torka. Sätt tillbaka plastskyddet.
Ersättning
RINIVENT nenäsumute, liuos
21 mikrog/annos 180 annosta
- Ei korvausta.
Atc-kod
R01AX03
Datum för översyn av produktresumén
15.07.2023
Yhteystiedot
PL 1310, Puolikkotie 8, 02230 Espoo (käyntiosoite)
00101 Helsinki
0207 416 888
