DEXAMETHASONE PHOSPHATE HAMELN injektionsvätska, lösning 4 mg/ml
Kvalitativ och kvantitativ sammansättning
1 ml lösning innehåller 4,00 mg dexametasonfosfat (som dexametasonnatriumfosfat).
2 ml lösning innehåller 8,00 mg dexametasonfosfat (som dexametasonnatriumfosfat).
Hjälpämnen med känd effekt
Detta läkemedel innehåller 20 mg propylenglykol per 1 ml – se avsnitt Dosering och administreringssätt, Varningar och försiktighet, Fertilitet, graviditet och amning och Biverkningar.
Detta läkemedel innehåller 0,42 mg natrium per 1 ml – se avsnitt Varningar och försiktighet.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska, lösning (injektion)
pH 7,5–8,7
Kliniska uppgifter
Terapeutiska indikationer
Systemisk användning
Intravenös eller intramuskulär administrering
Dexamethasone phosphate hameln rekommenderas för systemisk administrering genom intravenös eller intramuskulär injektion när oral behandling inte är möjlig eller önskvärd under följande tillstånd:
- Cerebralt ödem orsakat av hjärntumör, neurokirurgiska ingrepp, hjärnabscess, bakteriell meningit
- Posttraumatisk chock och förebyggande av posttraumatiskt akut andnödssyndrom (ARDS)
-
Coronavirussjukdom 2019 (COVID-19)
Behandling av coronavirussjukdom 2019 (COVID-19) hos vuxna och ungdomar (12 år och äldre med en kroppsvikt på minst 40 kg) som behöver extra syrgas. - Anafylaktisk chock (efter initial adrenalininjektion)
- Allvarlig akut astmaattack
- Initial parenteral behandling av omfattande, akuta, allvarliga hudsjukdomar, såsom erytrodermi, pemfigus vulgaris, akut eksem
- Initial parenteral behandling av autoimmuna sjukdomar, såsom systemisk lupus erythematosus (särskilt viscerala former)
- Aktiv reumatoid artrit med ett svårt progressivt förlopp, t.ex. snabbt destruktiva former och/eller med extraartikulära manifestationer
- Allvarliga infektionssjukdomar med toxiska tillstånd (t.ex. tuberkulos, tyfus, brucellos) endast med lämpliga antiinfektiva medel
- Palliativ behandling för maligna tumörer
- Profylax och behandling av postoperativ eller cytostatikainducerad kräkning i samband med antiemetisk behandling.
Subkutan administrering
- Palliativ behandling av maligna tumörer och förebyggande och behandling av illamående och kräkningar orsakad av kemoterapi (CINV)
I palliativ vård kan patienter som får kortikosteroider för symtom som trötthet, anorexi, eldfast illamående och kräkningar eller adjuvant analgesi och symtomatisk behandling av sladdkompression eller förhöjt intrakraniellt tryck, Dexamethasone phosphate hameln ges subkutant (se avsnitt Dosering och administreringssätt) som ett alternativ till den orala vägen när den senare är oacceptabel eller inte längre genomförbar.
Lokal administration
- Intraartikulära injektioner för ihållande inflammation i en eller flera leder efter allmän behandling av kronisk inflammatorisk ledsjukdom, aktiverad artros, akuta former av periarthropathia humeroscapularis
- Infiltrationsbehandling (när detta är strikt indikerat) för icke-bakteriell tendovaginit och bursit, periartropati, insertionstendinopati.
Dosering och administreringssätt
Dosering
Dosen måste individualiseras beroende på sjukdomen, sjukdomens svårighetsgrad och den enskilda patientens svar på behandlingen. I allmänhet bör relativt höga initiala doser användas, med betydligt högre doser som krävs för behandling av akuta allvarliga tillstånd än för kroniska sjukdomar.
Följande doseringsscheman rekommenderas:
Systemisk användning
Intravenös eller intramuskulär administrering
Vuxna
- Cerebralt ödem
Initialt 8–10 mg (upp till 80 mg) intravenöst (i.v.), sedan 16–24 mg (upp till 48 mg) / dag intravenöst (i.v.) i 3–4 (6) individuella doser under 4–8 dagar. Långvarig administrering av Dexamethasone phosphate hameln vid lägre doser kan vara nödvändig under bestrålning och som en del av konservativ behandling av hjärntumörer som inte går att operera.
Cerebralt ödem på grund av bakteriell meningit: 0,15 mg/kg kroppsvikt var 6:e timme under 4 dagar.
- Posttraumatisk chock och förebyggande av posttraumatisk ARDS
Initialt 40–100 mg intravenöst (i.v.) som upprepas efter 12 timmar. Alternativt 16–40 mg var 6:e timme under 2–3 dagar.
- Behandling av COVID-19
6 mg intravenöst (i.v.) en gång dagligen i upp till 10 dagar. Behandlingstiden bör styras av kliniskt svar och individuella patientbehov. Äldre patienter, nedsatt njurfunktion, nedsatt leverfunktion – ingen dosjustering behövs.
- Anafylaktisk chock
40–100 mg intravenöst (i.v.) efter en initial intravenös adrenalininjektion. Dosen kan upprepas vid behov.
- Allvarlig akut astmaattack
8–20 mg intravenöst (i.v.) så tidigt som möjligt. Injektionen kan upprepas vid behov i en dos av 8 mg var fjärde timme. Dessutom kan aminofyllin administreras intravenöst.
- Akuta hudsjukdomar
Dagliga doser på 8–40 mg intravenöst (i.v.), i enskilda fall upp till 100 mg följt av oral behandling vid minskande doser.
- Aktiva faser av systemisk reumatisk sjukdom såsom systemisk lupus erythematosus
Dagliga doser på 6–16 mg.
- Aktiv reumatoid artrit med ett svårt progressivt förlopp
Dagliga doser på 12–16 mg för behandling av sjukdom med snabbt förlopp. Dagliga doser på 6–12 mg rekommenderas vid extraartikulära manifestationer.
- Allvarlig infektionssjukdom med toxiska tillstånd (t.ex. tuberkulos, tyfus) endast som komplement till antiinfektionsbehandling)
Dagliga doser på 4–20 mg intravenöst (i.v.). I enskilda fall (t.ex. tyfus) initialt upp till 200 mg.
- Palliativ terapi för maligna tumörer
Initialt 8–16 mg/dag, vid långvarig behandling, 4–12 mg/dag.
- Profylax och terapi av cytostatikainducerad kräkning inom samband med antiemetisk behandling
10–20 mg intravenöst (i.v.) innan kemoterapi påbörjas, därefter vid behov 2 till 3 gånger dagligen 4–8 mg under 1–3 dagar (måttlig emetogen terapi) eller upp till 6 dagar (högemetogen kemoterapi).
- Profylax och behandling av postoperativa kräkningar
Individuell dos på 8–20 mg intravenöst (i.v.) innan operationen påbörjas.
Subkutan administrering
- Palliativ behandling för maligna tumörer, förebyggande och behandling av illamående och kräkningar induceradeav kemoterapi (CINV)
Vid palliativ vård kan subkutan Dexamethasone phosphate hameln administreras genom injektion eller kontinuerlig subkutan infusion (CSCI). Doser varierar vanligtvis mellan 4,8 mg och 19,3 mg under 24 timmar, med beaktande av lokala kliniska riktlinjer, och bör titreras enligt svar.
Pediatrisk population
-
Cerebralt ödem på grund av bakteriell hjärnhinneinflammation
0,4 mg/kg kroppsvikt hos barn var 12:e timme under 2 dagar, med början före den första administreringen av antibiotika. -
Posttraumatisk chock och förebyggande av posttraumatisk ARDS
Initialt 40 mg intravenöst (i.v.) hos barn som upprepas efter 12 timmar. -
Behandling av COVID-19
Ungdomar i åldern 12 år och äldre rekommenderas att ge 6 mg/dos intravenöst en gång dagligen i upp till 10 dagar. Behandlingstiden bör styras av kliniskt svar och individuella patientbehov. -
Anafylaktisk chock
40 mg intravenöst (i.v.) till barn efter en initial intravenös adrenalininjektion, dosen kan upprepas vid behov. -
Allvarlig akut astmaattack
0,15–0,3 mg/kg kroppsvikt intravenöst (i.v.) eller 1,2 mg/kg kroppsvikt som en bolus, följt av 0,3 mg/kg var 4–6 timmar. Dessutom kan aminofyllin administreras intravenöst. -
Profylax och behandling av postoperativa kräkningar
0,15–0,5 mg/kg kroppsvikt hos barn äldre än 2 år med en maximal dos på 16 mg.
Dexamethasone phosphate hameln rekommenderas vanligtvis inte för prematura nyfödda eller nyfödda (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING och Varningar och försiktighet).
Dexamethasone phosphate hameln innehåller propylenglykol (20 mg per ml), därför ska det användas med försiktighet hos spädbarn och barn yngre än 5 år, särskilt om höga doser krävs eller långvarig behandling övervägs (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING och Varningar och försiktighet).
Lokal användning
Den vanliga rekommenderade dosen för lokal infiltration eller intraartikulär administrering är 4–8 mg. En lägre dos på 2 mg behövs vanligtvis för en injektion i en liten led.
Användning hos patienter med nedsatt lever- eller njurfunktion
På grund av produktens propylenglykolinnehåll krävs medicinsk övervakning hos patienter med nedsatt lever- eller njurfunktion (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING och Varningar och försiktighet).
Vid hypotyros eller levercirros kan jämförelsevis låga doser räcka, eller en dosreduktion kan vara nödvändig.
Administreringssätt
Administreringens varaktighet beror på indikationen.
Dexamethasone phosphate hameln kan ges utan blandning eller spädning.
Intravenös, intramuskulär, intraartikulär injektion eller infiltration.
Alternativt kan Dexamethasone phosphate hameln tillsättas, förlust av styrka, natriumklorid 0,9 %, glukos 5 % eller Ringers lösning och ges genom intravenös infusion:
- kontinuerligt eller intermittent eller via droppslang hos vuxna
- över 15–20 minuter hos barn.
Vid palliativ vård kan Dexamethasone phosphate hameln spädas med 0,9 % natriumkloridlösning och ges genom kontinuerlig subkutan infusion (CSCI).
Infusionsblandningar måste användas inom 24 timmar och vanlig aseptisk teknik för injektioner bör följas.
Intraartikulär injektion ska ges under strikta aseptiska förhållanden. En enda intraartikulär injektion räcker i allmänhet för att framgångsrikt lindra symtom. Om en ytterligare injektion anses nödvändig, bör denna ges tidigast 3–4 veckor senare. Antalet injektioner per led bör begränsas till 3–4. Speciellt efter varje injektion i följd indikeras en medicinsk undersökning av leden.
Lokal infiltration bör utföras under stränga aseptiska förhållanden i området med de allvarligaste smärtorna eller senfästet. Försiktighet bör iakttas för att inte ge injektionen direkt i senan. Administrering med korta intervaller bör undvikas.
Om höga doser krävs för en enda behandling bör användning av dexametasonläkemedel med högre styrka/volym övervägas.
För instruktioner om utspädning av läkemedlet före administrering, se avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
- Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
- För lokal intraartikulär injektion: infektion i leden eller i närheten av leden som behandlas, bakteriell artrit, instabila leder, blödningsstörningar (spontana eller på grund av antikoagulantia), periartikulär förkalkning, avaskulär bennekros, senbristning, Charcot-led.
- För lokal infiltrationsbehandling: infektion på administreringsstället som inte behandlas primärt med antiinfektionsbehandling.
Varningar och försiktighet
Efter administrering av Dexamethasone phosphate hameln har allvarliga anafylaktiska reaktioner observerats hos enskilda patienter med cirkulationsstörningar, hjärtstopp, arytmier, bronkospasm och/eller blodtrycksfall/-höjning.
På grund av immunsuppression kan behandling med Dexamethasone phosphate hameln leda till en ökad risk för bakterie-, virus-, parasitiska, opportunistiska och svampinfektioner. Symtom på en befintlig eller utvecklande infektion kan maskeras, vilket försvårar diagnosen. Latenta infektioner, såsom tuberkulos eller hepatit B, kan återaktiveras.
Om under behandling med Dexamethasone phosphate hameln uppstår ovanligt stressande situationer eller fysisk stress (trauma, kirurgiskt ingrepp, förlossning etc.) kan en övergående dosökning behövas.
Behandling med systemiska kortikosteroider ska inte avbrytas för patienter som redan behandlas med systemiska (orala) kortikosteroider av andra skäl (t.ex. patienter med kroniskt obstruktiv lungsjukdom) men som inte behöver extra syrgas.
Särskilda försiktighetsåtgärder:
Behandling med Dexamethasone phosphate hameln bör endast övervägas när det är absolut nödvändigt och med ytterligare riktad antiinfektionsbehandling vid följande sjukdomar:
- Akuta virusinfektioner (hepatit B, Herpes zoster, Herpes simplex, vattkoppor, herpeskeratit)
- HBsAg-positiv kronisk aktiv hepatit
- Cirka 8 veckor före och upp till 2 veckor efter vaccinationer med levande vacciner
- Systemiska svampinfektioner
- Parasitoser (t.ex. nematoder)
- Hos patienter som misstänks för eller med bekräftad strongyloidiasis (trådmaskinfektion) kan glukokortikoider leda till aktivering och storskalig spridning av parasiter.
- Poliomyelit
- Lymfadenit efter BCG-immunisering
- Akuta och kroniska bakterieinfektioner
- Vid tuberkulos i anamnesen, använd endast med tuberkulostatiskt skydd
Behandling med Dexamethasone phosphate hameln bör endast övervägas när det är absolut nödvändigt och med ytterligare specifik behandling vid följande sjukdomar:
- Magsår i mag-tarmkanalen
- Osteoporos
- Allvarlig hjärtsvikt
- Dåligt/otillräckligt kontrollerad hypertoni
- Dåligt/otillräckligt kontrollerad diabetes mellitus
- Psykiatrisk sjukdom (inklusive tidigare anamnes av tillståndet), inklusive självmordstendenser. Neurologisk eller psykiatrisk övervakning rekommenderas.
- Smal- och vidvinkelglaukom. Oftalmologisk övervakning och samtidig behandling mot glaukom rekommenderas.
- Sår på hornhinnan och skador på hornhinnan. Oftalmologisk övervakning och samtidig behandling rekommenderas.
Synstörningar
Vid systemisk och topikal användning av kortikosteroider kan synstörningar uppstå. Om en patient uppvisar symtom som dimsyn eller andra synstörningar, bör hänvisning till en ögonläkare för att bedöma möjliga orsaker övervägas. Dessa inkluderar grå starr, glaukom eller sällsynta sjukdomar, t.ex. central serös korioretinopati (CSC), som har rapporterats efter användning av systemiska kortikosteroider eller topikala kortikosteroider.
På grund av risken för tarmperforering får Dexamethasone phosphate hameln endast användas när det är absolut nödvändigt och noggrann övervakning bör säkerställas vid följande samtidiga tillstånd:
- Svår ulcerös kolit med risk för perforering, eventuellt även utan peritoneal irritation
- Divertikulit
- Enteroanastomoser (omedelbart efter operation)
Feokromocytomrelaterad kris
Feokromocytomrelaterad kris, som kan vara dödlig, har rapporterats efter administrering av systemiska kortikosteroider. Kortikosteroider ska endast administreras till patienter med misstänkt eller identifierat feokromocytom efter en noggrann nytta–riskbedömning.
Tecken på peritoneal irritation efter gastrointestinal perforering kan saknas hos patienter som får höga doser av glukokortikoider.
Under behandling med Dexamethasone phosphate hameln hos diabetespatienter bör ökade krav på insulin eller orala antidiabetika tas i beaktan.
Under behandling med Dexamethasone phosphate hameln, särskilt när höga doser används och hos patienter med dåligt kontrollerad hypertoni, är blodtrycksmätningar nödvändiga.
Patienter med svår hjärtsvikt måste övervakas noggrant, eftersom det finns en risk för försämring.
Det finns en risk för bradykardi om höga doser av dexametason används.
Svåra anafylaktiska reaktioner kan också förekomma.
Risken för senrelaterade symtom, tendinit och senbristningar ökar när fluorokinolon och glukokortikoider administreras tillsammans.
Befintlig myasthenia gravis kan försämras under behandling med Dexamethasone phosphate hameln.
Immuniseringar med inaktiverade (avdödade) vacciner kan i princip genomföras. Det måste dock tas med i beräkningen att immunsvaret och därmed immuniseringens framgång kan försämras om högre doser av kortikosteroider används.
Om höga doser av kortikosteroid används bör ett tillräckligt stort kaliumintag säkerställas och dietbegränsning av natriumintag kan vara nödvändig. Serumnivån av kalium bör övervakas.
Samtidig behandling med CYP3A-hämmare, inklusive produkter som innehåller kobicistat, förväntas öka risken för systemiska biverkningar. Kombinationen bör undvikas om inte nyttan uppväger den ökade risken för systemiska kortikosteroidbiverkningar, i vilket fall patienter bör övervakas med avseende på systemiska kortikosteroidbiverkningar.
Plötsligt avbrytande av behandling med Dexamethasone phosphate hameln som administrerats i mer än cirka 10 dagar kan leda till förvärring eller återfall av den underliggande sjukdomen och till förekomst av akut binjuresvikt/kortisonavbrottssyndrom. Därför bör dosen sänkas långsamt när behandlingen avbryts.
Vissa virussjukdomar som vattkoppor eller mässling kan ha ett särskilt allvarligt förlopp hos patienter som behandlas med glukokortikoider. Immunsupprimerade patienter utan en viss anamnes av vattkoppor eller mässling löper särskild risk. Om dessa patienter kommer i kontakt med individer som lider av mässling eller vattkoppor under behandling med Dexamethasone phosphate hameln, bör förebyggande behandling påbörjas vid behov.
Efter marknadsföring har tumörlyssyndrom (TLS) rapporterats hos patienter med hematologiska maligniteter efter användning av dexametason ensamt eller i kombination med andra kemoterapeutiska medel. Patienter med hög risk för TLS, såsom patienter med hög celldelningsfrekvens, stor tumörbörda och hög känslighet för cytotoxiska medel, ska följas upp noga och lämpliga försiktighetsåtgärder ska vidtas.
Vid intravenös administrering ska injektionen ges långsamt under 2–3 minuter. Efter en för snabb administrering kan korta och i huvudsak ofarliga biverkningar uppträda i form av obehaglig stickningar eller parestesier, som varar upp till 3 minuter.
Dexamethasone phosphate hameln är endast avsett för kortvarig användning. Om detta läkemedel administreras under en lång period måste ytterligare varningar och försiktighetsåtgärder tas i beaktan för läkemedel som innehåller glukokortikoider avsedda för långvarig användning.
Efter lokal administration måste möjliga systemiska biverkningar och interaktioner beaktas.
Den intraartikulära administreringen av glukokortikoider ökar risken för ledinfektioner. Långvarig och upprepad användning av glukokortikoider i viktbärande leder kan leda till en försämring av slitagerelaterade lesioner på grund av eventuell överbelastning av leden efter en minskning av smärta eller andra symtom.
Barn och ungdomar
Under tillväxtfasen hos barn bör Dexamethasone phosphate hameln endast administreras efter bedömning av nytta och risker.
Prematura nyfödda
Tillgängliga bevis tyder på långvariga utvecklingsneurologiska biverkningar efter tidig behandling (< 96 timmar) hos prematura spädbarn med kronisk lungsjukdom vid startdoser på 0,25 mg/kg två gånger dagligen.
Hypertrofisk kardiomyopati
Hypertrofisk kardiomyopati rapporterades efter systemisk administrering av kortikosteroider, inklusive dexametason, till för tidigt födda spädbarn. I de flesta rapporterade fall var detta reversibelt när behandlingen sattes ut. Hos prematura spädbarn som behandlas systemiskt med dexametason ska diagnostisk utvärdering och övervakning av hjärtats funktion och struktur utföras (avsnitt Biverkningar).
Propylenglykolinnehåll
På grund av produktens propylenglykolinnehåll (20 mg per ml) bör försiktighet iakttas när höga doser av Dexamethasone phosphate hameln används hos spädbarn och barn yngre än 5 år och/eller under längre tid (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING och Dosering och administreringssätt). Särskilt följande pediatriska populationer riskerar att utveckla propylenglykoltoxicitet:
- Nyfödda (nyfödda barn yngre än 4 veckor)
Dexamethasone phosphate hameln rekommenderas inte för användning hos prematura nyfödda eller nyfödda. Efter en noggrann individuell bedömning kan produkten dock övervägas för nyfödda om användningen av produkten enligt hälso- och sjukvårdspersonalens /en förskrivares bedömning överväger potentiella risker.
När doser över 0,05 ml/kg/dag av Dexamethasone phosphate hameln krävs hos nyfödda kan motsvarande dos av propylenglykol överstiga säkerhetsgränsen på 1 mg/kg/dag. Att överskrida denna säkerhetsgräns hos nyfödda kan orsaka allvarliga biverkningar vid samtidig administrering med något substrat för alkoholdehydrogenas, såsom etanol, särskilt om de ges andra läkemedel som innehåller propylenglykol eller alkohol. Noggrann medicinsk övervakning av eventuella tecken på toxicitet är nödvändig.
- Spädbarn (barn äldre än 4 veckor) och barn yngre än 5 år
När doser över 2,5 ml/kg/dag av Dexamethasone phosphate hameln krävs kan motsvarande dos av propylenglykol överstiga säkerhetsgränsen på 50 mg/kg/dag. Samtidig administrering av propylenglykol i doser på 50 mg/kg/dag och högre med något substrat för alkoholdehydrogenas (såsom etanol) kan orsaka allvarliga biverkningar hos spädbarn och barn yngre än 5 år, särskilt om de får andra läkemedel. som innehåller propylenglykol eller alkohol. Dexamethasone phosphate hameln bör därför användas med försiktighet i denna population.
Under tillväxtfasen hos barn bör Dexamethasone phosphate hameln endast administreras efter bedömning av nytta och risker.
Äldre
Eftersom äldre patienter löper större risk för osteoporos, bör Dexamethasone phosphate hameln endast administreras efter bedömning av nytta och risker.
Nedsatt lever- och njurfunktion
På grund av produktens propylenglykolinnehåll är frekvent medicinsk övervakning nödvändig hos patienter med nedsatt njurfunktion eller med leversvikt, eftersom olika biverkningar som tillskrivs propylenglykol har rapporterats såsom nedsatt njurfunktion (akut tubulär nekros), akut njursvikt och leversvikt (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING och Dosering och administreringssätt). Daglig exponering för propylenglykol hos dessa patienter bör inte överstiga 50 mg/kg, vilket motsvarar 2,5 ml/kg / dag av Dexamethasone phosphate hameln.
Användning av Dexamethasone phosphate hameln kan leda till positiva resultat i dopningstester.
Natrium
Detta läkemedel innehåller upp till 1,9 mmol (43 mg) natrium per maximal enstaka dos av läkemedlet (350 mg för en person med 70 kg kroppsvikt), vilket motsvarar 2,15 % av WHO:s rekommenderade maximala dagliga intag av 2 g natrium för en vuxen.
Interaktioner
Det finns en ökad risk för gastrointestinala sår och blödningar vid användning med icke-steroida antiinflammatoriska läkemedel (NSAID), salicylater och indometacin.
Halveringstiden för glukokortikoider kan öka vid användning med östrogener (t.ex. ägglossningshämmare) och därför kan kortikoideffekten förbättras.
Läkemedel som inducerar CYP3A4 såsom fenytoin, barbiturater, karbamazepin, primidon, rifampicin kan öka kortikosteroiders metaboliska clearance, vilket kan leda till minskade läkemedelskoncentrationer i blodet och minskad fysiologisk aktivitet. Dosen kan behöva ökas.
CYP3A4-hämmare (inklusive ketokonazol, itrakonazol och kobicistat) kan minska clearance av dexametason, vilket kan leda till en ökad farmakologisk effekt och binjuresuppression/Cushings syndrom. Kombinationen bör undvikas om inte nyttan uppväger den ökade risken för systemiska kortikosteroidbiverkningar. I detta fall bör patienter övervakas med avseende på systemiska kortikosteroideffekter.
Efedrin kan öka metabolismen av glukokortikoider och därmed minska den farmakologiska effekten.
Samtidig behandling med ACE-hämmare (angiotensinkonverterande enzym) kan öka risken för ändringar i antalet blodkroppar.
Digoxintoxicitet (hjärtglykosider) kan utfällas av kortikosteroider via effekten av elektrolytobalans (kaliumbrist).
När kortikosteroider administreras samtidigt med kaliumnedbrytande diuretika eller laxermedel ska patienter observeras noggrant för utveckling av hypokalemi på grund av ökad kaliumutsöndring.
Effekten av kumarinantikoagulantia kan förändras genom samtidig kortikosteroidbehandling. Protrombintiden bör kontrolleras ofta hos patienter som får kortikosteroider och kumarinantikoagulantia samtidigt för att undvika spontan blödning. En dosjustering av antikoagulantia kan vara nödvändig vid samtidig användning.
De önskade effekterna av hypoglykemiska medel (inklusive insulin) motverkas med kortikosteroider.
Vid samtidig användning av glukokortikoider med atropin eller andra antikolinergika kan det intraokulära trycket öka.
Långvarig muskelavslappning kan uppstå när icke-depolariserande muskelavslappnande medel används samtidigt med glukokortikoider.
Kortikosteroider kan minska koncentrationen av praziquantel i blodet.
Det finns en ökad risk för myopatier och kardiomyopatier när dexametason används samtidigt med klorokin, hydroxiklorokin och meflokin.
Efter administrering av protirelin kan sköldkörtelstimulerande hormon (TSH) öka.
Vid samtidig administrering med andra immunsuppressiva medel finns en ökad känslighet för infektioner och möjlig försämring eller manifestation av latenta infektioner. Dessutom ökar nivån av cyklosporin i blodet och även risken för cerebrala anfall ökar i kombination med cyklosporin.
Samtidig användning med fluorokinoloner kan öka risken för senrelaterade symtom.
Hudreaktioner vid allergitester kan undertryckas.
Fertilitet, graviditet och amning
Graviditet
Dexametason passerar placentan.
Under graviditet, särskilt under den första trimestern, ska dexametason endast ges efter bedömning av nytta och risker. . Kortikosteroider bör endast ordineras när fördelarna för modern och barnet överväger riskerna.
Vid administrering under långa perioder eller upprepade gånger under graviditet kan kortikosteroider öka risken för intrauterin tillväxthämning.
Studier har visat en ökad risk för neonatal hypoglykemi efter prenatal administrering av en kort kur med kortikosteroider, inklusive dexametason, till kvinnor som riskerar att föda under den sena prematura perioden.
Administrering av kortikosteroider hos dräktiga djur kan orsaka abnormiteter i fostrets utveckling inklusive gomspalt, intrauterin tillväxthämning och effekter på hjärntillväxt och utveckling. Det finns inga bevis för att kortikosteroider resulterar i en ökad förekomst av medfödda abnormiteter, såsom gomspalt/läppspalt hos människa (se avsnitt Prekliniska säkerhetsuppgifter).
Om modern behandlas med glukokortikoider i slutet av graviditeten finns en risk för atrofi av binjurebarken hos fostret vilket kan kräva ersättningsbehandling hos det nyfödda barnet.
Dexamethasone phosphate hameln innehåller propylenglykol. Även om propylenglykol inte har visat sig orsaka reproduktionstoxicitet eller utvecklingstoxicitet hos djur eller människor, kan det nå fostret Dexamethasone phosphate hameln bör användas med försiktighet under graviditet. En noggrann bedömning av de potentiella fördelarna och därmed sammanhängande risker vid behandling med steroider och propylenglykoladministrering bör göras på individuell basis.
Amning
Dexametason utsöndras i bröstmjölk. Det är ännu inte känt om dexametason är skadligt för barnet.
Dexamethasone phosphate hameln bör endast användas med ammande kvinnor som ammar när det är absolut nödvändigt. En noggrann bedömning av de potentiella fördelarna och därmed sammanhängande risker med behandlingen måste göras på individuell basis.
Om högre doser är nödvändiga för behandling av en sjukdom, ska amningen avbrytas.
Dexamethasone phosphate hameln innehåller propylenglykol som också har detekterats i bröstmjölk. Även om propylenglykol inte har visat sig orsaka reproduktionstoxicitet eller utvecklingstoxicitet hos djur och människor ska Dexamethasone phosphate hameln användas med försiktighet av ammande kvinnor. En noggrann bedömning av de potentiella fördelarna och därmed sammanhängande risker vid behandling med steroider och propylenglykoladministrering bör göras på individuell basis.
Effekter på förmågan att framföra fordon och använda maskiner
Dexamethasone phosphate hameln har ingen eller försumbar inflytande på förmågan att framföra fordon och använda maskiner. Detsamma gäller för arbete i farlig miljö.
Biverkningar
Risken för biverkningar är låg vid kortvarig behandling med dexametason. Vid kortvarig parenteral behandling med hög dos måste dock risken för elektrolytförändringar, ödem, möjlig ökning av blodtrycket, hjärtsvikt, hjärtarytmier eller kramper övervägas, och även kliniska manifestationer av en infektion bör förväntas. Läkare bör vara uppmärksamma på risken för mag-och tarmsår som ofta är stressrelaterade, och som kan vara relativt asymtomatiska under kortikosteroidbehandling, och en minskning av glukostoleransen.
Incidensen av förväntade biverkningar, inklusive hämning av hypotalamus-hypofys-binjureaxeln, korrelerar med läkemedlets relativa styrka, dosering, tidpunkt för administrering och behandlingens varaktighet (se avsnitt Varningar och försiktighet).
Frekvensen för biverkningarna presenteras enligt följande konvention:
Mycket vanliga (≥1/10)
Vanliga (≥1/100 till <1/10)
Mindre vanliga (≥ 1/1 000 till <1/100)
Sällsynta (≥1/10 000 till <1/1 000)
Mycket sällsynt (<1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
| Systemorganklass | Frekvens | Biverkningar |
Infektioner och infestationer | Okänt | Maskering av infektioner, manifestation, förvärring eller återaktivering av virusinfektioner, svampinfektioner, bakterie-, parasit- och opportunistiska infektioner, aktivering av strongyloidiasis (se avsnitt Varningar och försiktighet). |
| Blodet och lymfsystemet | Okänt | Måttlig leukocytos, lymfopeni, eosinopeni, polycytemi. |
| Immunsystemet | Okänt | Överkänslighetsreaktioner (t.ex. läkemedelsinducerat exantem), allvarliga anafylaktiska reaktioner, såsom arytmier, bronkospasmer, högt blodtryck eller hypotoni, cirkulationskollaps, hjärtstillestånd, försvagning av immunsystemet. |
| Endokrina systemet | Okänt | Cushings syndrom (typiska symtom: månansikte, bukfetma och överflöd), binjuresuppression (se avsnitt Varningar och försiktighet). |
Metabolism och nutrition | Okänt | Natriumretention med ödem, ökad kaliumförlust (var uppmärksam på arytmier), viktökning, minskad glukostolerans, diabetes mellitus, hyperkolesterolemi och hypertriglyceridemi, ökad aptit. |
| Psykiska störningar | Okänt | Depressioner, irritation, eufori, ökad drift, psykoser, mani, hallucinationer, påverkad labilitet, ångestkänslor, sömnstörningar, självmordstendenser. |
| Centrala och perifera nervsystemet | Okänt | Cerebral pseudotumör, manifestation av latent epilepsi, ökning av sannolikheten för anfall vid uppvisad epilepsi. |
| Ögon | Okänt | Katarakt, i synnerhet med bakre subkapsulär opacifiering, glaukom, förvärring av symtom vid hornhinnesår, ökad risk för virus-, svamp- och bakterieinfektioner i ögat, förvärring av bakteriell inflammation i hornhinnan, ptos, mydriasis, kemos, iatrogen skleral perforering, korioretinopati. I sällsynta fall reversibel exoftalmos. Dimsyn (se även avsnitt Varningar och försiktighet). |
| Hjärtat | Okänt | Hypertrofisk kardiomyopati hos för tidigt födda spädbarn (se avsnitt Varningar och försiktighet). |
| Blodkärl | Okänt | Hypertension, ökad risk för åderförkalkning och trombos, vaskulit (även som abstinenssyndrom efter långvarig behandling), ökad kapillärbräcklighet. |
| Magtarmkanalen | Okänt | Mag-tarmsår, mag-tarmblödningar, pankreatit, gastriska symtom. |
| Hud och subkutan vävnad | Okänt | Striae rubrae, atrofi, teleangiektasi, petekier, ekkymoser, hypertrikos, steroidakne, rosacea-liknande (perioral) dermatit, förändringar i hudpigmentering. |
| Muskuloskeletala systemet och bindväv | Okänt | Myopati, muskelatrofi och svaghet, steroidmyopati, osteoporos (dosberoende också möjligt efter en kort behandling), aseptisk bennekros, senrelaterade symtom, tendinit, senbristning, epidural lipomatos, tillväxthämning hos barn. |
| Reproduktionsorgan och bröstkörtel | Okänt | Störningar i könshormonsekretion (orsakar oregelbunden menstruation samt amenorré, hirsutism, impotens). |
| Allmänna symtom och/eller symtom vid administreringsstället | Okänt | Fördröjd sårläkning. |
Lokal användning:
Lokala irritationer och intoleranser är möjliga (värmekänsla, relativt ihållande smärta). Utveckling av hudatrofi och atrofi av subkutan vävnad vid injektionsstället kan inte uteslutas om kortikosteroider inte injiceras försiktigt i en ledhålighet.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Symtom:
Akuta förgiftningar med dexametason har aldrig rapporterats. Vid kronisk överdosering förväntas intensifierade biverkningar (se avsnitt Biverkningar), särskilt i förhållande till det endokrina systemet, metabolism och elektrolytbalans.
Inget motgift är tillgängligt. Behandling är förmodligen inte indicerad för reaktioner på grund av kronisk förgiftning, såvida inte patienten har ett tillstånd som gör att patienten blir ovanligt mottaglig för biverkningar från kortikosteroider. I detta fall bör symtomatisk behandling inledas vid behov.
Anafylaktiska reaktioner och överkänslighetsreaktioner kan behandlas med adrenalin, konstgjord andning med positivt tryck, och aminofyllin.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Glukokortikoider, ATC-kod: H02AB02
Farmakodynamisk effekt
Dexametason är en monofluorerad glukokortikoid med uttalade antiallergiska, antiflogistiska och membranstabiliserande egenskaper och effekter på kolhydrat-, protein- och fettmetabolismen.
Dexametason har verkningar och effekter av andra basiska glukokortikoider och är bland de mest aktiva ämnen i sin klass.
Dexametason har ungefär 7,5 gånger större glukokortikoideffekt än prednisolon och prednison, och dess effekt är 30 gånger mer potent än hydrokortison; det finns inga mineralokortikoideffekter.
Den biologiska effekten av glukokortikoider såsom dexametason härrör från aktivering av transkriptionen av kortikosteroidkänsliga gener. De antiinflammatoriska, immunsuppressiva och antiproliferativa effekterna framkallas bland andra mekanismer genom minskad bildning, frisättning och aktivitet av inflammatoriska mediatorer och genom hämning av de specifika funktionerna och migrationen av inflammatoriska celler. Dessutom förhindras eventuellt effekten av sensibiliserade T-lymfocyter och makrofager på målceller av kortikosteroider.
Om långvarig kortikoidmedicinering är nödvändig måste den möjliga induktionen av övergående binjurinsufficiens beaktas. Hämning av hypotalamus-hypofys-binjureaxeln beror delvis på enskilda faktorer.
Klinisk effekt och säkerhet - COVID-19
Klinisk effekt
RECOVERY-prövningen (Randomized Evaluation of COVid-19 thERapY)1 är en prövarinitierad, individuellt randomiserad, kontrollerad, öppen, adaptiv plattformsstudie för att utvärdera effekterna av potentiella behandlingar hos patienter på sjukhus med COVID-19.
Prövningen genomfördes vid 176 sjukhus i Storbritannien.
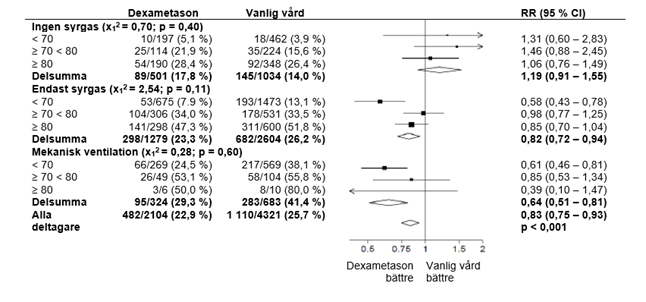
6 425 patienter randomiserades för att få antingen dexametason (2 104 patienter) eller endast vanlig vård (4 321 patienter). 89 % av patienterna hade laboratoriebekräftad SARS-CoV-2-infektion.
Vid randomisering fick 16 % av patienterna invasiv mekanisk ventilation eller extrakorporeal membransyresättning, 60 % fick endast syre (med eller utan icke-invasiv ventilation) och 24 % fick ingendera.
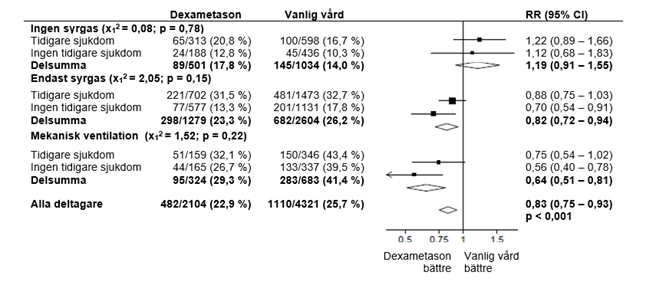
Medelåldern för patienter var 66,1 +/- 15,7 år. 36 % av patienterna var kvinnor. 24 % av patienterna hade diabetes i anamnesen, 27 % hade hjärtsjukdomar och 21 % hade kronisk lungsjukdom.
Primär slutpunkt
Dödligheten vid 28 dagar var signifikant lägre i dexametasongruppen än i den vanliga vårdgruppen, med dödsfall rapporterade hos 482 av 2 104 patienter (22,9 %) respektive 1 110 av 4 321 patienter (25,7 %) (frekvenskvot, 0,83; 95 % konfidensintervall [CI], 0,75 till 0,93; P <0,001).
I dexametasongruppen var förekomsten av dödsfall lägre än i den vanliga vårdgruppen bland patienter som fick invasiv mekanisk ventilation (29,3 % jämfört med 41,4%; hastighetsförhållande, 0,64; 95 % KI, 0,51 till 0,81) och hos dem som får extra syrgas utan invasiv mekanisk ventilation (23,3 %jämfört med 26,2 %; frekvenskvot, 0,82; 95 % KI, 0,72 till 0,94).
Det fanns ingen tydlig effekt av dexametason bland patienter som inte fick andningsstöd vid randomisering (17,8 % jämfört med 14,0 %; frekvenskvot, 1,19; 95 % KI, 0,91 till 1,55).
1 www.recoverytrial.net
Sekundära slutpunkter
Patienter i dexametasongruppen hade en kortare sjukhusvistelse än patienter i den vanliga vårdgruppen (medianvärde, 12 dagar jämfört med 13 dagar) och en större sannolikhet för utskrivning vid liv inom 28 dagar (frekvenskvot, 1,10; 95 % KI, 1,03 till 1,17).
I linje med den primära slutpunkten observerades den största effekten avseende utskrivning inom 28 dagar bland patienter som fick invasiv mekanisk ventilation vid randomisering (frekvenskvot 1,48; 95 % KI 1,16, 1,90), följt av endast syre (frekvenskvot, 1,15; 95 % KI 1,06–1,24) utan någon fördelaktig effekt hos patienter som inte fick syre (frekvenskvot 0,96; 95 % KI 0,85–1,08).
| Resultat | Dexametason (N = 2104) | Vanlig vård (N = 4 321) nr / totalt nr av patienter (%) | Ränta eller riskkvot (95 % KI) * |
| Primärt resultat | |||
| Dödlighet vid 28 dagar | 482/2104 (22,9) | 1110/4321 (25,7) | 0,83 (0,75–0,93) |
| Sekundära resultat | |||
| Utskrivning från sjukhus inom 28 dagar | 1413/2104 (67,2) | 2745/4321 (63,5) | 1,10 (1,03–1,17) |
| Invasiv mekanisk ventilation eller död † | 456/1780 (25,6) | 994/3638 (27,3) | 0,92 (0,84–1,01) |
| Invasiv mekanisk ventilation | 102/1780 (5,7) | 285/3638 (7,8) | 0,77 (0,62–0,95) |
| Död | 387/1780 (21,7) | 827/3638 (22,7) | 0,93 (0,84–1,03) |
* Frekvenskvoter har justerats för ålder med avseende på utfall av 28-dagars dödlighet och utskrivning från sjukhus. Riskförhållandena har justerats för ålder med avseende på resultatet av mottagande av invasiv mekanisk ventilation eller dödsfall och dess delkomponenter.
† Undantagna från denna kategori är patienter som fick invasiv mekanisk ventilation vid randomisering.
Säkerhet
Det fanns fyra allvarliga biverkningar (SAE) relaterade till studiebehandlingen: två SAE:s av hyperglykemi, en SAE av steroidinducerad psykos och en SAE av en övre gastrointestinal blödning. Alla händelser upphörde.
Undergruppsanalyser
Effekter av tilldelning av DEXAMETASON på 28-dagars dödlighet, enligt ålder samt andningsstöd som mottagits vid randomisering2
Effekter av allokering till DEXAMETASON på 28-dagars dödlighet genom andningsstöd som mottagits vid randomisering och tidigare kronisk sjukdom.3
2, 3 (källa: Horby P. ym., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1 ; doi: https://doi.org/10.1101/2020.06.22.20137273)
Farmakokinetiska egenskaper
Distribution
Dexametason binder sig till plasmaproteiner i mindre grad än de flesta andra kortikosteroider och uppskattas till cirka 77 %. Dexametason binds till plasmaproteiner på ett dosberoende sätt. Vid mycket höga doser cirkulerar den största delen fritt i blodet. Vid hypoalbuminemi ökar andelen obunden (aktiv) kortikoid. Efter intravenös applicering av radioaktivt markerad dexametason hos människor, uppmättes maximala dexametasonnivåerna i cerebrospinalvätskan, dvs. cirka 1/6 av motsvarande plasmakoncentration. Plasmahalveringstiden för dexametason är cirka 190 minuter.
Med en biologisk halveringstid på över 36 timmar tillhör dexametason en av de mycket långverkande glukokortikoiderna. På grund av den långvariga effekten kan kontinuerliga dagliga doser därför leda till ackumulering och överdosering.
Eliminering
(Serum-)eliminationshalveringstiden för dexametason hos vuxna är i genomsnitt cirka 250 minuter (+ 80 minuter).
Utsöndringen sker till stor del i njurarna i form av fri dexametasonalkohol. En viss metabolism äger rum och metaboliterna utsöndras huvudsakligen som glukuronater eller sulfater, likaledes till stor del genom njurarna. Upp till 65 % av en dos utsöndras i urinen på 24 timmar. Störningar i njurfunktionen påverkar inte eliminering av dexametason väsentligen. Å andra sidan förlängs eliminationshalveringstiden vid allvarlig leversjukdom.
Prekliniska säkerhetsuppgifter
Akut förgiftning:
LD 50 för dexametason efter en enda oral applicering inom de första 7 dagarna i möss är 16 g/kg kroppsvikt och i råttor mer än 3 g/kg kroppsvikt. Efter en enda subkutan applicering är LD50 hos möss mer än 700 mg /kg kroppsvikt och hos råttor cirka 120 mg/kg kroppsvikt under de första 7 dagarna. Vid observation under en period på 21 dagar sjunker dessa värden, vilket tolkas som ett resultat av allvarliga infektionsfrisatta sjukdomar, orsakade av hormoninducerad immunsuppression.
Kronisk toxicitet:
Det finns ingen information om kronisk toxicitet hos människor eller djur. Kortikoidinducerade manifestationer av berusning har aldrig rapporterats. Vid relativt långvarig behandling med doser över 1,5 mg/dag ska markerade biverkningar förväntas (se avsnitt Biverkningar).
Mutagen och cancerframkallande potential:
Tillgängliga studieresultat för glukokortikoider innehåller inga bevis för kliniskt relevanta genotoxiska egenskaper.
Reproduktionstoxicitet:
I experimentella djurstudier observerades gomspalt hos råttor, möss, hamstrar, kaniner, hundar och primater, men inte hos hästar eller får. I vissa fall kombinerades dessa avvikelser med defekter i centrala nervsystemet och hjärtat. Hos primater observerades förändringar i hjärnan efter exponering. Dessutom kan den intrauterina tillväxten försenas. Alla dessa effekter observerades vid administrering av höga doser.
Miljöriskbedömning (ERA):
Baserat på dexametasons endokrina verkningsmekanism kan en risk för vattenlevande organismer inte uteslutas (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Propylenglykol
Dinatriumedetat
Natriumhydroxid (för pH-justering)
Vatten för injektionsvätskor
Inkompatibiliteter
Dexametason är inkompatibelt med daunorubicin, doxorubicin, vankomycin, difenhydramin (med lorazepam och metoklopramid) och metaraminolbitartrat och ska därför inte blandas med lösningar som innehåller dessa läkemedel. Dexametason är också inkompatibelt med doxapram och glykopyrrolat i spruta och med ciprofloxacin, idarubicin och midazolam vid injektioner på Y-stället (1:1-blandning).
Kompatibilitetsdata för dexametason som ges kontinuerligt under 24 timmar via SC-sprutdrivare:
- Kompatibel med metoklopramid och morfin
- Möjlig inkompatibilitet med oktreotid (somatostatinanalog)
- Utfällningar vid användning med följande: cyklizin, midazolam, haloperidol, levomepromazin.
Hållbarhet
Oöppnade ampuller: 2 år
Öppnade ampuller: Produkten ska användas omedelbart efter första öppningen.
Utspädd lösning:
Kemisk och fysisk stabilitet vid spädning har visats i 24 timmar vid 25 °C. Ur mikrobiologisk synvinkel ska produkten användas omedelbart. Om det inte används omedelbart är förvaringstider och förhållanden före användning användarens ansvar och skulle normalt inte vara längre än 24 timmar vid 2 till 8 °C, såvida inte utspädning har skett under kontrollerade och validerade aseptiska förhållanden.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C. Frys inte.
Förvara ampullen i ytterkartongen för att skydda mot ljus.
Förvaringsförhållanden efter öppnande eller utspädning av läkemedlet, se avsnitt Hållbarhet.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
DEXAMETHASONE PHOSPHATE HAMELN injektioneste, liuos
4 mg/ml (L:ei) 10 x 1 ml (14,63 €)
PF-selosteen tieto
Ampuller av typ I av färglöst neutralt glas och enpunktsskärning (OPC), med en nominell volym på 1 ml eller 2 ml.
Förpackningen innehåller 5 eller 10 ampuller.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Klar och färglös lösning, fri från synliga partiklar.
Särskilda anvisningar för destruktion och övrig hantering
När Dexamethasone phosphate hameln ges som intravenös infusion rekommenderas glukos 5 %, natriumklorid 0,9 % och Ringers lösning som utspädningsmedel. Den exakta koncentrationen av dexametason per infusionsbehållare bestäms av önskad dos, patientens vätskeintag och dropphastigheten.
Vid palliativ vård kan Dexamethasone phosphate hameln spädas med natriumklorid och ges genom kontinuerlig subkutan infusion (CSCI).
Lösningen bör inspekteras visuellt före användning. Endast klara lösningar som är helt fria från partiklar ska användas.
Endast för engångsbruk.
Detta läkemedel kan utgöra en risk för miljön. Ej använt läkemedel eller avfall ska kasseras i enlighet med lokala krav.
Ersättning
DEXAMETHASONE PHOSPHATE HAMELN injektioneste, liuos
4 mg/ml 10 x 1 ml
- Ei korvausta.
Atc-kod
H02AB02
Datum för översyn av produktresumén
10.10.2024
Yhteystiedot
Inselstraße 1
31787 Hameln
Germany
www.hameln-pharma.com
quality@hameln-pharma.fi
