ALLUZIENCE injektioneste, liuos 200 Speywood-yksikköä/ml
Vaikuttavat aineet ja niiden määrät
Tyypin A Clostridium botulinum ‑toksiinin hemagglutiniinikompleksi 200 Speywood-yksikköä/ml.
Botuliinitoksiiniyksiköt ovat valmistekohtaisia. Speywood-yksikköinä suositeltuja annoksia ei voi soveltaa muihin botuliinitoksiinivalmisteisiin.
Yhdessä injektiopullossa on 0,625 ml liuosta, joka sisältää 125 Speywood-yksikköä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Alluzience on tarkoitettu otsaa maksimaalisesti rypistettäessä ilmaantuvien, kulmakarvojen välisten keskisyvien tai syvien pystysuorien uurteiden ulkonäön tilapäiseen korjaamiseen alle 65-vuotiailla aikuisilla, kun uurteiden syvyydellä on voimakas psyykkinen vaikutus potilaaseen.
Annostus ja antotapa
Annostus
Eri lääkevalmisteiden botuliinitoksiiniyksiköissä on eroja. Botuliinitoksiiniyksiköt ovat valmistekohtaisia. Speywood-yksikköinä suositeltuja annoksia ei voi soveltaa muihin botuliinitoksiinivalmisteisiin.
Pediatriset potilaat
Alluzience-valmisteen turvallisuutta ja tehoa alle 18-vuotiailla ei ole varmistettu. Alluzience-valmisteen käyttöä alle 18-vuotiaille potilaille ei suositella.
Antotapa
Alluziencea saa antaa vain lääkäri , jolla on asianmukainen pätevyys ja kokemusta hoidon antamisesta sekä tarvittavat välineet.
Alluzience-injektiopulloa saa käyttää vain yhden potilaan hoitoon vain yhdellä hoitokerralla. Meikki poistetaan, ja ihoalue puhdistetaan antiseptisellä aineella ennen antoa.
Lihakseen annettavat injektiot pitää antaa sopivan paksuisella steriilillä neulalla.
Hoitojen annostus ja antoväli riippuvat yksittäisen potilaan vasteesta arvion jälkeen.
Potilaiden raportoima vaikutuksen alkamiseen kulunut mediaaniaika oli 3 vrk hoidosta (suurin osa potilaista raportoi vaikutuksen alkaneen 2–3 vuorokauden kuluessa, ja joillakin se alkoi 24 tunnin kuluessa). Vaikutuksen on osoitettu kestäneen jopa 6 kuukautta injektion antamisesta.
Hoitoja ei saa antaa useammin kuin 3 kuukauden välein.
Seuraavassa esitetään suositellut injektiokohdat kulmakarvojen välisiin uurteisiin:
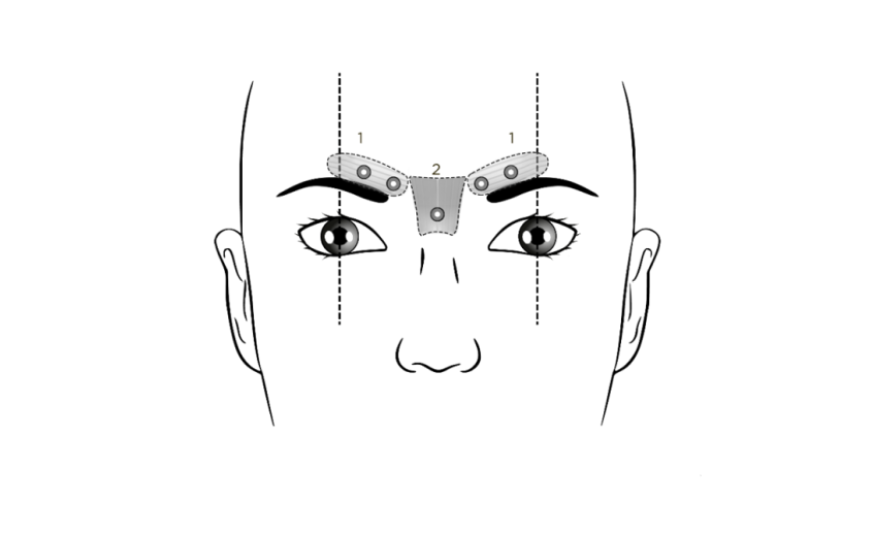
1. Corrugatorlihakset
2. Proceruslihas
Anto-ohjeet:
Suositusannos on 0,25 ml liuosta (50 Speywood-yksikköä) jaettuna 5 injektiokohtaan. Kuhunkin kohtaan annetaan 0,05 ml liuosta (10 Speywood-yksikköä) lihakseen. Kumpaankin corrugatorlihakseen annetaan 2 injektiota ja nenä-otsakulman lähellä sijaitsevaan proceruslihakseen yksi injektio. Kyseiset anatomiset kohdat on helpompi tunnistaa, jos ne etsitään ja palpoidaan potilaan rypistäessä otsaansa mahdollisimman paljon. Ennen injektion antamista peukalo tai etusormi painetaan lujasti silmäkuopan reunan alle, jotta silmäkuopan reunan alapuoliselta ekstravasaatiolta vältytään. Neulan viisteosan tulee osoittaa injektion aikana ylös ja mediaalisuuntaan. Ptoosiriskin minimoimiseksi on vältettävä injektioiden antamista levator palpebrae superioris ‑lihaksen lähelle etenkin, jos potilaan depressor supercilii ‑kompleksi on suuri. Corrugatorlihakseen annettavat injektiot annetaan kyseisen lihaksen keskiosaan, vähintään 1 cm silmäkuopan reunan yläpuolelle.
Yleistä tietoa
Jos hoito epäonnistuu tai sen teho heikkenee, kun hoitojaksot toistetaan, on käytettävä muita hoitomenetelmiä. Jos hoito epäonnistuu ensimmäisen hoitokerran jälkeen, voidaan harkita seuraavia lähestymistapoja:
- Selvitetään hoidon epäonnistumisen syyt (esim. injektion antaminen vääriin lihaksiin, epäasianmukainen injektiotekniikka ja toksiinia neutraloivien vasta-aineiden muodostus)
- A-tyypin botuliinitoksiinihoidon soveltuvuus potilaalle arvioidaan uudelleen.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Ehdotetuissa injektiokohdissa on infektio.
Potilaalla on myasthenia gravis, Lambert–Eatonin myasteeninen oireyhtymä (LEMS) tai amyotrofinen lateraaliskleroosi (ALS).
Varoitukset ja käyttöön liittyvät varotoimet
On varmistettava huolellisesti, että Alluzience-valmistetta ei injisoida verisuoneen.
Alluzience-injektioiden käyttöä ei suositella, jos potilaalla on aiemmin esiintynyt dysfagiaa tai aspirointia. Botuliinitoksiinin käytön yhteydessä on ilmoitettu hyvin harvoin haittavaikutuksia, jotka voivat liittyä toksiinin vaikutusten leviämiseen antopaikasta muualle elimistöön. Nielemis- ja hengitysvaikeudet ovat vakavia ja voivat johtaa kuolemaan.
Botuliinitoksiini A:n tai B:n annon jälkeen on raportoitu hyvin harvoja kuolemantapauksia, jotka silloin tällöin esiintyivät dysfagian tai pneumopatian (mukaan lukien, mutta ei näihin rajoittuen: hengenahdistus, hengityksen vajaatoiminta, hengityksen pysähtyminen) yhteydessä ja/tai potilailla, joilla on ollut merkittävä astenia.
Potilaalle pitää kertoa, että hänen on hakeuduttava välittömästi lääkärin hoitoon, jos hänelle kehittyy nielemis-, puhe- tai hengitysvaikeuksia.
Alluzience-valmisteen käytössä on noudatettava varovaisuutta, jos potilaalla on kliinistä näyttöä voimakkaista hermo-lihasliitoksen häiriöistä tai tällaisten häiriöiden riski. Nämä potilaat saattavat olla tavanomaista herkempiä botuliinitoksiinin kaltaisille aineille, mikä voi aiheuttaa liiallista lihasheikkoutta.
On erittäin tärkeää, että potilaan kasvojen anatomia tutkitaan ennen Alluzience-valmisteen antoa. Kasvojen epäsymmetria, ptoosi, silmäluomien ihon huomattava riippuminen, arvet ja aiempien kirurgisten toimenpiteiden aiheuttamat anatomiset muutokset on otettava huomioon.
Silmien kuivuutta on raportoitu käytettäessä Alluzience-valmistetta silmänympärysalueille (ks. kohta Haittavaikutukset). Tähän haittavaikutukseen on tärkeä kiinnittää huomiota, sillä silmien kuivuus voi altistaa sarveiskalvon häiriöille. Suojaavat tipat, voiteet tai silmän sulkeminen silmäpeitteellä tai muulla tavoin voivat olla tarpeen sarveiskalvon häiriöiden estämiseksi.
Suositusten mukaista Alluzience-annosta tai ‑antotiheyttä ei saa ylittää.
Suositusannoksia saaneilla potilailla voi esiintyä korostuneen voimakasta lihasheikkoutta.
Varovaisuutta on noudatettava, jos suunnitelluissa Alluzience-injektiokohdissa on tulehdusta tai kohdelihas on hyvin heikko tai atrofinen. Botuliinitoksiinin käytön jälkeen on raportoitu lihasatrofiaa (ks. kohta Haittavaikutukset).
Kuten kaikkia lihakseen annettavia injektioita käytettäessä, Alluzience-hoitoa ei suositella potilaille, joiden verenvuotoaika on pidentynyt.
Jokaista Alluzience-injektiopulloa saa käyttää vain yhden potilaan hoitoon ja vain yhdellä hoitokerralla.
Ylijäävä käyttämätön valmiste pitää hävittää kohdassa Käyttö- ja käsittelyohjeet kuvatulla tavalla. Käyttämättömän liuoksen inaktivoinnissa ja hävittämisessä pitää noudattaa erityisiä varotoimia (ks. kohta Käyttö- ja käsittelyohjeet).
Vasta-aineenmuodostus
Tavanomaista tiheämmin tai suurempina annoksina annetut injektiot voivat suurentaa botuliinitoksiinivasta-aineiden kehittymisriskiä. Neutraloivien vasta-aineiden kehittyminen voi heikentää myöhempien hoitojen kliinistä tehokkuutta.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Natriumsisältö
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 125 yksikön injektiopullo eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Alluzience-valmisteen ja aminoglykosidien tai muiden hermo-lihasliitoksen toimintaan vaikuttavien aineiden (esim. kuraren kaltaisten aineiden) samanaikaisessa käytössä on noudatettava varovaisuutta, sillä botuliinitoksiinin vaikutus saattaa voimistua.
Yhteisvaikutustutkimuksia ei ole tehty.
Raskaus ja imetys
Raskaus
Ei ole olemassa riittävästi tietoja A-tyypin botuliinitoksiinin käytöstä raskaana oleville naisille. Eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi Alluzience-valmistetta ei pidä käyttää raskauden aikana.
Imetys
Ei tiedetä, erittyykö Alluzience ihmisen rintamaitoon. Alluzience-valmistetta ei pidä käyttää rintaruokinnan aikana.
Hedelmällisyys
Alluzience-valmisteen vaikutuksesta hedelmällisyyteen ei ole olemassa kliinistä tietoa. Eläinkokeissa ei ole saatu näyttöä Alluzience-valmisteen suorasta vaikutuksesta hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Alluzience-valmisteella on vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Valmisteen käyttöön voi liittyä paikallisen lihasheikkouden tai näköhäiriöiden riski, mikä voi heikentää tilapäisesti ajokykyä ja koneidenkäyttökykyä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Suurin osa Alluzience-valmisteen käytön yhteydessä kliinisissä tutkimuksissa raportoiduista haittavaikutuksista oli lieviä tai keskivaikeita ja ohimeneviä. Yleisimmin raportoituja haittavaikutuksia olivat päänsärky ja injektiokohdan reaktiot. Haittavaikutusten esiintymistiheys yleensä pieneni, kun hoitojaksoja toistettiin.
Haittavaikutuksia, jotka johtuvat toksiinin vaikutuksen leviämisestä kauas antopaikasta, on raportoitu hyvin harvoin botuliinitoksiinin yhteydessä (liiallinen lihasheikkous, dysfagia, aspiraatiokeuhkokuume ja ne voivat joissakin tapauksissa olla fataaleja) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset on kerätty Alluzience-valmisteella tehdyistä kliinisistä, lumekontrolloiduista pivotaalitutkimuksista sekä samaa vaikuttavaa ainetta kuiva-aineen muodossa koskevista lumekontrolloiduista pivotaalitutkimuksista, ja ne on luokiteltu elinjärjestelmän (SOC-luokan) ja MedDRA-termien mukaan (Taulukko 1).
Haittavaikutustaulukko
Haittavaikutusten esiintymistiheys on luokiteltu seuraavasti:
hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000), hyvin harvinaiset (< 1/10 000), yleisyys tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1: Kliinisissä tutkimuksissa havaitut haittavaikutukset
Hermosto | Hyvin yleiset Päänsärky Yleiset Kasvojen pareesi* Melko harvinaiset Heitehuimaus* |
Silmät | Yleiset Silmäluomien ptoosi, silmäluomien turvotus, kulmakarvaptoosi, silmien kuivuminen, kyynelerityksen lisääntyminen, astenopia*, lihasnykäykset (silmänympäryslihasten nykiminen)* Melko harvinaiset Silmäluomien nykiminen, näön heikkeneminen*, näön hämärtyminen*, diplopia* Harvinaiset Silmien liikehäiriö* |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleiset Pistoskohdan reaktiot (periorbitaalinen hematooma, hematooma, mustelma, kipu, parestesia, eryteema, turvotus, kutina, edeema*, ihottuma*, ärsytys*, epämukavuus*, kirvely*), voimattomuus*, väsymys*, influenssan kaltainen sairaus* |
Immuunijärjestelmä | Melko harvinaiset Yliherkkyys (silmäallergia, yliherkkyys, ihottuma) |
Iho ja ihonalainen kudos | Melko harvinaiset Ihottuma*, kutina* Harvinaiset Nokkosihottuma* |
* vain samaa vaikuttavaa ainetta kuiva-aineen muodossa koskevissa kliinisissä tutkimuksissa esiintyneet muut haittavaikutukset
Myyntiluvan saamisen jälkeinen kokemus
Elinjärjestelmä | Haittavaikutus | Yleisyys |
Hermosto | Hypestesia | Tuntematon |
Luusto, lihakset ja sidekudos | Lihasatrofia | Tuntematon |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Liian suuret botuliinitoksiiniannokset voivat aiheuttaa hermo-lihasheikkoutta ja monia erilaisia oireita. Ventilaatiotuki voi olla tarpeen, jos liian suuri annos johtaa hengityslihasten halvautumiseen. Yliannostustapauksessa potilaan tilaa on tarkkailtava liiallisen lihasheikkouden tai lihasten halvautumisen varalta. Tarvittaessa on annettava oireenmukaista hoitoa.
Yliannoksen oireet eivät välttämättä ilmene heti injektion jälkeen.
Sairaalahoitoa pitää harkita, jos potilaalla on botuliinitoksiinin yliannostuksen merkkejä (esim. lihasheikkoutta, ptoosia, diplopiaa ja nielemis- ja puhehäiriöitä tai hengityslihasten pareesia).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Muut perifeerisesti vaikuttavat lihasrelaksantit
ATC-koodi: M03AX01
Vaikutusmekanismi
A-tyypin botuliinitoksiinin ensisijainen farmakodynaaminen vaikutus johtuu hoidetun lihaksen kemiallisesta denervaatiosta, joka johtaa lihaksen toimintapotentiaalin mitattavaan pienenemiseen. Tämä johtaa lihastoiminnan paikalliseen vähenemiseen.
A-tyypin botuliinitoksiini on lihasrelaksantti, joka tilapäisesti heikentää lihasten toimintaa. Injektion jälkeen A-tyypin botuliinitoksiini toimii estämällä hermovälittäjäaine asetyylikoliinin kuljetuksen läpi hermo-lihasliitoksen, joka sijaitsee hermonpäätteen ja lihassäikeen välillä. A-tyypin botuliinitoksiinin vaikutustapaan kuuluu neljä päävaihetta, joista kaikkien tulee toimia oikein, jotta vaikutus ilmenee. Vaikutus johtaa lihassupistuksen estymiseen kohdelihaksissa. Vaikutus jatkuu pitkäaikaisesti, kunnes hermo-lihasliitos on palautunut ja lihaksen toiminta palaa ennalleen.
Kliininen teho ja turvallisuus
Yhdistetyissä pivotaalitutkimuksissa sai hoitoa yhteensä 372 potilasta, joilla oli keskisyviä tai syviä pystysuoria uurteita kulmakarvojen välissä. Heistä 250 sai hoitoa 50 Speywood-yksikön suuruisilla suositusannoksilla, ja 122 potilasta sai lumelääkettä.
Suurin osa potilaista raportoi vaikutuksen alkaneen 2–3 vuorokauden kuluessa hoidosta, ja heistä 23 %:lla vaikutus alkoi vuorokauden kuluessa.
Tutkijoiden arvioima vasteprosentti oli tilastollisesti merkitsevästi suurempi Alluzience-hoitoa saavilla potilailla kuin lumelääkkeellä kuukausi injektion annon jälkeen (ensisijainen päätetapahtuma) sekä kaikkina muina ajankohtina (8 vrk–6 kk) (Taulukko 2).
Taulukko 2: Tutkijoiden suora arvio potilaan tilanteesta otsaa maksimaalisesti rypistettäessä – Vasteprosentti (%) eri ajankohtina
Injektion annon jälkeinen käynti | Alluzience (N=250) | Lumelääke (N=122) |
8 vrk | 80,0 % | 2,5 % |
1 kk | 87,6 % | 2,5 % |
2 kk | 76,8 % | 1,7 % |
3 kk | 57,6 % | 1,7 % |
4 kk | 36,3 % | 1,8 % |
5 kk | 17,5 % | 0,9 % |
6 kk | 10,0 % | 0,9 % |
Huom: Vasteen saaneeksi määritellään henkilö, jolla lähtötilanteessa on keskivaikea tai vaikea tilanne ja käynnin yhteydessä ei lainkaan tai vain lieviä uurteita.
Vasteprosentti, tehon ensisijainen päätetapahtuma päivänä 29, erosi tilastollisesti merkitsevästi lumelääkkeestä (p < 0,0001). Muina ajankohtina vasteprosentti erosi nimellisesti lumelääkkeestä (p-arvot olivat ≤ 0,0001–0,0008).
Vasteprosentti potilaiden itsearvioinnin perusteella oli suurempi Alluzience-hoitoa saaneilla potilailla kuin lumelääkettä saaneilla kaikkina ajankohtina (8 vrk–6 kk) (Taulukko 3).
Taulukko 3: Potilaiden itsearviointi – vasteprosentti (%) eri ajankohtina
Injektion annon jälkeinen käynti | Alluzience (N=250) | Lumelääke (N=122) |
8 vrk | 66,0 % | 4.9 % |
1 kk | 76,8 % | 5,7 % |
2 kk | 72,4 % | 2,5 % |
3 kk | 48,8 % | 3,4 % |
4 kk | 32,7 % | 4,3 % |
5 kk | 23,1 % | 4,3 % |
6 kk | 15,1 % | 2,6 % |
Huom: Vasteen saaneeksi määritellään henkilö, jolla lähtötilanteessa on keskivaikea tai vaikea tilanne ja käynnin yhteydessä ei lainkaan tai vain lieviä uurteita.
Vasteprosentti erosi nimellisesti lumelääkkeestä (p-arvo ≤ 0,0001) kaikkina ajankohtina.
Kun potilaat arvioivat tyytyväisyyttä kuukauden kuluttua injektion annosta, 85,2 % Alluzience-hoitoa saaneista oli joko tyytyväisiä tai erittäin tyytyväisiä. Lumelääkkeen kohdalla tyytyväisiä oli 9 % potilaista.
Tilanteen esteettinen ja psykologinen koheneminen arvioitiin Face-Q-asteikolla. Kasvojen kokonaisulkonäköä mittaavalla asteikolla (johon sisältyy henkilön arvio kasvojen tasapainosta, ulkonäöstä päivän päätteeksi, kasvojen raikkaudesta, levänneestä ilmeestä, ulkonäöstä herätessä ja ulkonäöstä kirkkaassa valossa) ja psykologista hyvinvointia mittaavalla asteikolla (johon sisältyy henkilön arvio hyvinvoinnista, itsensä hyväksymisestä, itsetyytyväisyydestä, hyvästä olosta, itsestään pitämisestä, onnellisuudesta, viehättävyydestä ja itsevarmuudesta) Alluzience-hoitoa saaneilla potilailla havaittiin kohenemista kaikissa osa-alueissa kuukauden kuluttua injektion annosta lumelääkehoitoa saaneisiin verrattuna (nimellinen p < 0,0001).
Yhteensä 595 potilasta sai enintään viisi Alluzience-hoitojaksoa 12 kuukauden pituisessa avoimessa vaiheen III pitkäaikaistutkimuksessa. Tutkijoiden arvioiden, potilaiden arvioiden, potilastyytyväisyyden ja FACE-Q-kyselylomakkeen perusteella teho säilyi 12 kuukauden pituisen jakson ajan.
Kun hoitojaksoja toistettiin ja tutkijat arvioivat potilaiden tilanteen otsan maksimaalisen rypistyksen yhteydessä kuukausi injektion annon jälkeen, vasteprosentti pysyi samana (82,2 %–87,8 %). Vasteprosentti kolme kuukautta injektion annon jälkeen oli 45,3 %–56,8 % näiden viiden hoitojakson aikana.
Yhdenkään potilaan (yhteensä 595 potilasta) toksiinia neutraloivien vasta-aineiden testitulos ei ollut positiivinen sen jälkeen, kun he olivat saaneet Alluzience-hoitoa yli 12 kuukauden ajan.
Farmakokinetiikka
Kun Alluzience annetaan suositusannoksina injektiona lihakseen, lääkettä ei oletettavasti esiinny ääreisveressä mitattavina pitoisuuksina. Näin ollen farmakokinetiikkaa ei ole tutkittu.
Prekliiniset tiedot turvallisuudesta
Rotalla ja kanilla tehdyissä lisääntymistutkimuksissa havaittiin vaikeaa emoon kohdistuvaa toksisuutta ja alkioiden kiinnittymisen heikkenemistä suuria annoksia käytettäessä. Alkio-/sikiötoksisuutta ei havaittu, kun kanille annettiin 60 kertaa ihmisen suositusannoksia (50 Speywood-yksikköä) ja rotalle 100 kertaa ihmisen suositusannoksia vastaavia annoksia. Näillä lajeilla ei havaittu teratogeenisuutta. Uros- ja naarasrottien hedelmällisyys heikkeni, sillä suurten annosten aiheuttama lihasten halvautuminen vähensi parittelua.
Rotalla tehdyssä pitkäaikaistoksisuustutkimuksessa ei havaittu mitään systeemiseen toksisuuteen viittaavaa, kun eläimille annettiin 75 kertaa ihmisen suositusannoksia (50 Speywood-yksikköä) vastaavia annoksia, jotka jaettiin puoliksi oikeaan ja vasempaan pakaralihakseen.
Akuuttia toksisuutta, pitkäaikaistoksisuutta ja pistoskohdan paikallista siedettävyyttä koskeneissa tutkimuksissa ei havaittu epätavallisia paikallisia tai systeemisiä haittavaikutuksia kliinisesti relevantteja annoksia käytettäessä.
Ympäristöön kohdistuvien riskien arviointi
Alluzience ei todennäköisesti aiheuta riskiä ympäristölle.
Farmaseuttiset tiedot
Apuaineet
L-histidiini
Sakkaroosi
Natriumkloridi
Polysorbaatti 80
Kloorivetyhappo pH-arvon säätöön
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
1 vuosi
Säilytys
Säilytä jääkaapissa (2 °C–8 °C). Ei saa jäätyä. Pidä injektiopullot ulkopakkauksessa. Herkkä valolle.
Kun injektiopullo on otettu jääkaapista, on suositeltavaa antaa sen lämmetä huoneenlämpöiseksi.
Alluzience-valmistetta voi säilyttää avaamattomana ja valolta suojattuna enintään 25 °C:ssa yhden 12 tunnin jakson ajan. Alluzience-valmiste on hävitettävä, jos sitä ei käytetä 12 tunnin kuluessa jääkaapista ottamisen jälkeen.
Valmiste on käytettävä välittömästi injektiopullon avaamisen jälkeen.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ALLUZIENCE injektioneste, liuos
200 Speywood-yksikköä/ml (L:ei) 2 x 0,625 ml (2x125 U) (255,53 €)
PF-selosteen tieto
Pakkaustyyppi/tulppa
Tyypin 1 lasinen injektiopullo, jossa butyylikumitulppa, alumiinikansi ja polypropeeninen irti napsautettava korkki.
Pakkaus
Yhdessä injektiopullossa on 0,625 ml liuosta, joka sisältää 125 Speywood-yksikköä A-tyypin Clostridium botulinum ‑toksiinin hemagglutiniinikompleksia.
Kirkas, väritön liuos.
Pakkauskoot:
Yksittäispakkaus:
Pakkauksessa on 1 tai 2 injektiopulloa, jossa on Alluzience 200 Speywood-yksikköä/ml injektionestettä.
Kerrannaispakkaus:
Kerrannaispakkauksessa on 6 yksittäispakkausta ja niissä kussakin 2 injektiopulloa, joissa on Alluzience 200 Speywood-yksikköä/ml injektionestettä.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas väritön liuos.
Käyttö- ja käsittelyohjeet
Heti potilaan hoitamisen jälkeen injektiopulloon tai ruiskuun ylijäänyt Alluzience on inaktivoitava laimennetulla hypokloriittiliuoksella (1 % vapaata klooria).
Alluzience-valmisteen roiskeet on pyyhittävä laimennettuun hypokloriittiliuokseen kastetulla imukykyisellä materiaalilla.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
SUOSITUKSET BOTULIINITOKSIININ KÄSITTELYN YHTEYDESSÄ MAHDOLLISESTI TAPAHTUVIEN VAHINKOJEN VARALTA
- Kaikki roiskeet pyyhitään kuivalla, imukykyisellä materiaalilla.
- Kontaminoituneet pinnat tulee puhdistaa natriumhypokloriittiliuokseen (valkaisuaineeseen) kastetulla imukykyisellä materiaalilla, minkä jälkeen pinnat kuivataan.
- Jos injektiopullo rikkoutuu, toimitaan edellä kuvattuun tapaan. Lasinsirpaleet kerätään ja valmiste pyyhitään varovasti, ihon rikkoutumista välttäen.
- Jos valmistetta joutuu iholle, altistunut alue pestään natriumhypokloriittiliuoksella (valkaisuaine) ja huuhdellaan sitten runsaalla vedellä.
- Jos valmistetta joutuu silmiin, ne tulee huuhdella runsaalla vedellä tai silmähuuhteella.
- Jos valmistetta joutuu haavaan, viiltoon tai ihovaurioon, alue huuhdellaan runsaalla vedellä, minkä jälkeen ryhdytään asianmukaisiin hoitotoimiin injisoidun annoksen mukaisesti.
Näitä käyttö-, käsittely- ja hävittämisohjeita on noudatettava tarkoin.
Korvattavuus
ALLUZIENCE injektioneste, liuos
200 Speywood-yksikköä/ml 2 x 0,625 ml
- Ei korvausta.
ATC-koodi
M03AX01
Valmisteyhteenvedon muuttamispäivämäärä
01.04.2025
Yhteystiedot
Seminariegatan 21
SE-752 28 Uppsala
Sverige
+46 18 444 0330
www.galdermanordic.com
nordic@galderma.com
