THERACAP kapseli, kova 37 MBq - 5,55 GBq
Vaikuttavat aineet ja niiden määrät
Theracap-kapseli sisältää keltaisessa kapselikuoressa natriumjodidia(131I) seuraavina annoksina: 37–740 MBq 37 MBq:n välein ja 0,925–5,55 GBq 185 MBq:n välein referenssipäivänä. Kukin kapseli sisältää korkeintaan 20 mikrog natriumjodidia.
I-131 valmistetaan uraani-235:stä fissioreaktiolla tai ydinreaktorissa neutronipommituksella stabiilista telluriumista. I-131:n puoliintumisaika on 8,02 päivää. Se hajoaa stabiiliksi Ksenon-131:ksi gammasäteilynä 365 keV:n (81,7 %), 637 keV:n (7,2 %) ja 284 keV:n (6,1 %) energialla ja maksimissaan 606 keV:n energian beetasäteilynä.
Apuaineet, joiden vaikutus tunnetaan:
Yksi kova kapseli sisältää enintään 50 mg natriumia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kapseli, kova
Kliiniset tiedot
Käyttöaiheet
Kilpirauhasen radiojodihoito on tarkoitettu aikuisille sekä 0–18-vuotiaille vastasyntyneille, imeväisikäisille, lapsille ja nuorille
- hypertyreoosiin: Gravesin taudin, toksisen monikyhmyisen struuman tai autonomisten kyhmyjen hoitoon
- papillaarisen ja follikulaarisen kilpirauhassyövän hoitoon, myös metastoituneet tilat.
Natriumjodidi(131I)‑hoito yhdistetään usein leikkaushoitoon ja tyreostaattiseen lääkehoitoon.
Annostus ja antotapa
Tätä lääkevalmistetta saavat antaa vain valtuutetut terveydenhuollon ammattilaiset asianmukaisissa kliinisissä olosuhteissa (ks. kohta Käyttö- ja käsittelyohjeet).
Annostus
Annettava aktiivisuus perustuu lääketieteelliseen arviointiin. Terapeuttinen teho saavutetaan useiden viikkojen kuluttua. Kapselin aktiivisuus on määritettävä ennen käyttöä.
Aikuiset
Hypertyreoosin hoito
Jos muu hoito epäonnistuu tai on mahdoton, hypertyreoosin hoitoon voidaan antaa radioaktiivista jodidia.
Potilas on lääkittävä eutyreoottiseksi, mikäli mahdollista, ennen kuin hänelle annetaan hypertyreoosin hoitoon radiojodia.
Annettava aktiivisuus riippuu diagnoosista, rauhasen koosta, kertymästä kilpirauhaseen ja jodin puhdistumasta. Se on yleensä 200–800 MBq keskipainoiselle potilaalle (70 kg), mutta uusinta-annos voi olla tarpeellinen jopa 5000 MBq:n kumulatiiviseen annokseen saakka. Uusinta-annos 6–12 kuukauden kuluttua on tarkoitettu pysyvään hypertyreoosiin.
Annettava aktiivisuus voidaan määrittää kiinteän annoksen hoito-ohjelman mukaan, tai se voidaan laskea seuraavan kaavan avulla:
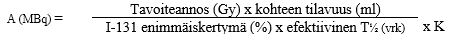
Selitteet:
tavoiteannos | koko kilpirauhaseen tai adenoomaan absorboitunut tavoiteannos |
kohteen tilavuus | koko kilpirauhasen tilavuus (Gravesin tauti, multifokaalinen tai disseminoitunut tauti) |
I-131:n enimmäiskertymä | I-131:n enimmäiskertymä kilpirauhaseen tai kyhmyihin prosentteina (%) annetusta aktiivisuudesta koeannoksen perusteella |
efektiivinen T½ | I-131:n efektiivinen puoliintumisaika kilpirauhasessa vuorokausina |
K | 24,67 |
Hoidossa voidaan käyttää seuraavia kohde-elinannoksia:
yksittäinen struumakyhmy | 300–400 Gy:n kohde-elinannos |
multifokaalinen tai disseminoitunut itsenäinen tauti | 150–200 Gy:n kohde-elinannos |
Gravesin tauti | 200 Gy:n kohde-elinannos |
Gravesin taudissa tai multifokaalisessa tai disseminoituneessa taudissa taulukossa ilmoitetut kohde-elinannokset liittyvät kilpirauhasen kokonaispainoon. Sen sijaan yksittäisen kyhmyn hoidossa kohde-elinannos liittyy vain adenooman painoon. Ks. taulukosta 11 kohde-elinten annossuositukset.
Kohde-elinannos (Gy) voidaan määrittää myös muilla dosimetrisillä menetelmillä, kuten mittaamalla natriumperteknetaatin (Tc-99m) kertymä kilpirauhaseen.
Kilpirauhasen ablaatio ja metastaasien hoito
Totaalisen tai osittaisen kilpirauhasen poistoleikkauksen jälkeinen jäljelle jäävän kilpirauhaskudoksen ablaatioannos on 1850–3700 MBq. Annos riippuu jäljellä olevan rauhasen koosta ja radiojodin kertymästä. Metastaasihoitojen annos on 3700–11100 MBq.
Erityisryhmät
Munuaisten vajaatoiminta
Annettava aktiivisuus on arvioitava tarkoin, koska potilailla, joiden munuaisten toiminta on heikentynyt, säteilyaltistus saattaa olla tavanomaista suurempi. Natriumjodidin(131I) terapeuttinen käyttö potilaille, joilla on merkittävä munuaisten vajaatoiminta, vaatii erityistä huomiota (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Natriumjodidin(131I) käyttöä lapsille ja nuorille on harkittava tarkoin kliinisen tarpeen ja tämän potilasryhmän hyöty-riskiarvion perusteella.
Lapsille ja nuorille annettava aktiivisuus määritetään tietyissä tapauksissa yksilöllisen dosimetrian perusteella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Lasten ja nuorten hyvänlaatuisia kilpirauhassairauksia voidaan hoitaa radioaktiivisella jodidilla perustelluissa tapauksissa, erityisesti silloin kun sairaus on uusiutunut tyreostaattihoidon jälkeen tai tyreostaatit ovat aiheuttaneet vakavia haittavaikutuksia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Antotapa
Theracap on tarkoitettu suun kautta otettavaksi. Kapseli otetaan tyhjään mahaan. Kapselit on nieltävä kokonaisena riittävän suuren nestemäärän kanssa, jotta kapseli saadaan mahaan ja ohutsuolen yläosaan.
Jos potilas on lapsi, etenkin pikkulapsi, on ennen kapselin antoa varmistettava, että lapsi pystyy nielemään kapselin kokonaisena pureskelematta. Kapselin antoa soseutetun ruoan seassa suositellaan.
Potilaan valmistelu, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Vasta-aiheet
- yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille
- raskaus ja imetys (ks. kohta Raskaus ja imetys)
- potilaalla on nielemisvaikeuksia, ruokatorven kurouma, ruokatorven ahtauma, ruokatorven divertikkeli, aktiivinen gastriitti, mahalaukun haavaumia ja peptinen haava
- potilaalla epäillään ruoansulatuskanavan motiliteetin hidastumista.
Varoitukset ja käyttöön liittyvät varotoimet
Yliherkkyyden tai anafylaktisten reaktioiden mahdollisuus
Jos potilaalle ilmaantuu anafylaktinen tai yliherkkyysreaktio, lääkevalmisteen antaminen on keskeytettävä heti ja tarvittaessa on aloitettava laskimoon annettava hoito. Tarvittavien lääkevalmisteiden ja hoitovälineiden, kuten intubaatioputken ja ventilaattorin, on oltava heti saatavilla, jotta välittömät toimenpiteet ovat hätätilanteissa mahdollisia.
Yksilöllinen hyöty-riskiarviointi
Säteilyaltistuksen on perustuttava aina kunkin potilaan kohdalla odotettavissa oleviin hyötyihin. Annettava aktiivisuus on pidettävä aina niin pienenä kuin halutun hoitotuloksen saavuttamiseen välttämättä tarvitaan.
Radiojodin laajasta käytöstä huolimatta ei ole näyttöä, että se hyvänlaatuisten kilpirauhassairauksien hoidossa lisäisi potilailla syövän, leukemian tai mutaatioiden ilmaantuvuutta. Pahanlaatuisten kilpirauhassairauksien hoidossa raportoitiin potilailla, joiden natriumjodidi(131I)-annos oli tutkimuksessa yli 3700 MBq, virtsarakon syövän suurempaa ilmaantuvuutta. Toisessa tutkimuksessa todettiin leukemian vähäinen lisääntyminen potilailla, jotka saivat erittäin suuria annoksia. Siksi yli 26000 MBq:n kumulatiivisia kokonaisannoksia ei suositella.
Sukupuolirauhasten toiminta miehillä
Siittiöpankin käyttöä voidaan harkita kompensoimaan sukupuolirauhasten toiminnan mahdolliset palautuvat vauriot miehillä (laajaan sairauden hoitoon tarvittavan suuren radiojodiannoksen takia).
Munuaisten vajaatoiminta
Näiden potilaiden hyöty-riskisuhde pitää arvioida tarkoin, koska säteilyaltistus voi tässä potilasryhmässä olla tavanomaista suurempi. Näillä potilailla saattaa olla tarpeen säätää annostusta.
Pediatriset potilaat
Käyttöaihe on harkittava tarkkaan, koska efektiivinen annos per MBq on suurempi kuin aikuisilla (ks. kohta 11). Lasten ja nuorten aikuisten hoidossa on huomioitava lasten kudosten suurempi herkkyys ja näiden potilaiden pidempi elinajanodote. Hoidon riskejä on verrattava muiden mahdollisten hoitojen riskeihin (ks. kohdat Annostus ja antotapa ja 11).
Lasten ja nuorten hyvänlaatuisia kilpirauhassairauksia voidaan hoitaa radiojodilla vain perustelluissa tapauksissa, erityisesti silloin kun sairaus on uusiutunut tyreostaattihoidon jälkeen tai tyreostaatit ovat aiheuttaneet vakavia haittavaikutuksia. Radiojodin laajasta käytöstä huolimatta ei ole näyttöä, että se hyvänlaatuisten kilpirauhassairauksien hoidossa lisäisi ihmisellä syövän, leukemian tai mutaatioiden ilmaantuvuutta.
Henkilöt, jotka ovat saaneet kilpirauhasen sädehoitoa lapsina ja nuorina, tulisi tutkia uudelleen kerran vuodessa.
Potilaan valmistelu
Potilaita on kehotettava lisäämään nesteen juomista ja tyhjentämään virtsarakko mahdollisimman usein, jotta säteily virtsarakossa vähenee, etenkin jos annettu aktiivisuus on suuri, esim. kilpirauhassyövän hoidossa. Jos potilaalla on vaikeuksia tyhjentää virtsarakko, potilas pitää katetroida suuren aktiivisuuden antamisen jälkeen.
Paksusuolen säteilyaltistuksen vähentämiseksi voi olla välttämätöntä käyttää lieviä laksatiiveja (mutta ei ulosteen pehmentimiä, jotka eivät stimuloi suolistoa) potilailla, jotka ulostavat harvemmin kuin kerran päivässä.
Sylkirauhastulehduksen (joka voi aiheutua suurista radiojodiannoksista) välttämiseksi potilasta on neuvottava nauttimaan sitruunahappoa sisältäviä karkkeja tai juomia (sitruunamehu, C-vitamiini) ennen hoitoa, sillä se stimuloi syljeneritystä. Lisäsuojana voi käyttää muitakin lääkkeitä.
Mahdollinen ruuan tai lääkehoidon aiheuttama jodin ylikuormitus on tutkittava ennen jodidin antamista (ks. kohta Yhteisvaikutukset). Niukasti jodia sisältävää ruokavaliota ennen hoitoa suositellaan, sillä se lisää kertymää terveeseen kilpirauhaskudokseen.
Kilpirauhasen korvaushoito on lopetettava ennen kilpirauhasen syöpään annettavaa radiojodihoitoa, jotta varmistetaan riittävä kertymä. Trijodityroniinin anto suositellaan lopetettavaksi 14 päivää ja tyroksiinin anto 6 viikkoa ennen radiojodihoitoa. Lääkkeiden anto on aloitettava uudelleen 2 päivän kuluttua radiojodihoidosta.
Karbimatsolin ja propyylitiourasiilin käyttö on lopetettava 1 viikko ennen radiojodihoitoa hypertyreoosiin, ja niiden käytön saa aloittaa uudelleen vasta useiden päivien kuluttua radiojodihoidosta.
Hyponatremia: Iäkkäillä potilailla, joille on tehty totaalinen tyreoidektomia, on raportoitu natriumjodidi(131I)‑hoidon jälkeen hyponatremian vakavia ilmenemismuotoja. Riskitekijöitä ovat muun muassa iäkkyys, naissukupuoli, tiatsididiureettien käyttö ja hyponatremia natriumjodidi(131I)‑hoitoa aloitettaessa. Näitä potilaita hoidettaessa on harkittava seerumin elektrolyyttipitoisuuksien tiheää mittaamista.
Gravesin tautia sairastaville on radiojodihoidon aikana annettava samanaikaisesti kortikosteroideja, varsinkin jos potilaalla on endokriinista oftalmopatiaa.
Erityistä varovaisuutta on noudatettava annettaessa natriumjodidi(131I)‑kapseleita potilaille, joilla epäillään gastrointestinaalialueen sairautta. Samanaikaisesti suositellaan annettavaksi H2-antagonisteja tai protonipumpun estäjiä.
Toimenpiteen jälkeen
Läheistä kontaktia pikkulapsiin ja raskaana oleviin naisiin pitää rajoittaa vähintään viikon ajan terapeuttisten annosten jälkeen.
Jos potilas oksentaa, on otettava huomioon kontaminaatioriski.
Kilpirauhashoitoa saavat potilaat on tutkittava uudelleen sopivin aikavälein.
Erityisvaroitukset:
Tämä lääkevalmiste sisältää 50 mg natriumia per kapseli, joka vastaa 2,5 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Ympäristöön kohdistuvia riskejä koskevat varotoimet, ks. kohta Käyttö- ja käsittelyohjeet.
Yhteisvaikutukset
Monilla farmakologisesti aktiivisilla aineilla on yhteisvaikutuksia radiojodin kanssa. Mahdolliset yhteisvaikutusmekanismit ovat moninaisia, ja ne voivat vaikuttaa proteiineihin sitoutumiseen, farmakokinetiikkaan tai leimatun jodidin dynaamisiin vaikutuksiin. On siis huomioitava, että yhteisvaikutukset voivat vähentää radiojodin kertymistä kilpirauhaseen. Siksi potilaan aiemmat lääkitykset on selvitettävä tarkoin ja tarkistettava, onko joidenkin lääkkeiden käyttö keskeytettävä ennen natriumjodidin(131I) antoa.
Esimerkiksi hoito seuraavilla aineilla on keskeytettävä:
Vaikuttavat aineet | Varoaika ennen natriumjodidin(131I) käyttöä |
Tyreostaatit (esim. karbimatsoli, metimatsoli, propyylitiourasiili), perkloraatti | 1 viikko ennen natriumjodidin(131I) antoa ja useita päiviä natriumjodidin(131I) annon jälkeen |
Salisylaatit, kortikosteroidit, natriumnitroprussidi, natriumsulfobromoftaleiini, antikoagulantit, antihistamiinit, antiparasiitit, penisilliinit, sulfonamidit, tolbutamidi, tiopentaali | 1 viikko |
Fenyylibutatsoni | 1–2 viikkoa |
Jodia sisältävät ekspektorantit ja vitamiinit | Noin 2 viikkoa |
Kilpirauhashormonivalmisteet | Trijodityroniini 2 viikkoa Tyroksiini 6 viikkoa |
Bentsodiatsepiinit, litium | Noin 4 viikkoa |
Amiodaroni* | 3–6 kuukautta |
Paikallisesti käytettävät jodivalmisteet | 1–9 kuukautta |
Vesiliukoiset jodia sisältävät varjoaineet | 6–8 viikkoa |
Rasvaliukoiset jodia sisältävät varjoaineet | Jopa 6 kuukautta |
* Amiodaronin pitkän puoliintumisajan vuoksi jodin kertyminen kilpirauhaskudokseen voi vähentyä useaksi kuukaudeksi.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Kun radioaktiivista lääkevalmistetta aiotaan antaa naiselle, joka voi tulla raskaaksi, on tärkeää selvittää, onko potilas raskaana. Jos potilaan kuukautiset ovat jääneet tulematta, hänen on oletettava olevan raskaana, kunnes on todettu toisin. Epäselvissä tilanteissa (jos naisen kuukautiset ovat jääneet tulematta tai kuukautiset ovat hyvin epäsäännölliset jne.) on pyrittävä myös harkitsemaan muita teknisiä vaihtoehtoja, joissa ei käytetä ionisoivaa säteilyä (jos sellaisia on käytettävissä). Natriumjodidia(131I) saaville naisille pitää kertoa, että he EIVÄT saa tulla raskaaksi 6–12 kuukauden kuluessa valmisteen annosta.
Ehkäisy naisille ja miehille
Kummallekin sukupuolelle suositellaan ehkäisyn käyttöä 6 kuukauden ajan (potilailla, joilla on hyvänlaatuinen kilpirauhassairaus) tai 12 kuukauden ajan (potilailla, joilla on kilpirauhassyöpä) natriumjodidin(131I) hoitokäytön jälkeen.
Miehen tulisi olla hedelmöittämättä kumppaniaan 6 kuukauteen radiojodihoidon antamisesta, jotta säteilyä saaneet siittiöt ehtivät korvautua säteilyä saamattomilla. Jos miehellä on pitkälle edennyt sairaus, hänen on harkittava siittiöiden talteenottoa, koska hoitoon saattaa olla tarpeen antaa suuria annoksia natriumjodidia(131I).
Raskaus
Natriumjodidi(131I) on kontraindisoitu raskauden aikana (ks. kohta Vasta-aiheet) tai epäiltäessä potilaan olevan raskaana tai kun raskauden mahdollisuutta ei ole poissuljettu, koska natriumjodidi(131I) imeytyy istukan kautta ja voi aiheuttaa vakavaa, mahdollisesti peruuttamatonta kilpirauhasen vajaatoimintaa vastasyntyneillä (kohdun saama absorboitunut annos tätä lääkevalmistetta on todennäköisesti 11–511 mGy ja sikiön kilpirauhanen kerää voimakkaasti jodia raskauden toisella ja kolmannella kolmanneksella) (ks kohta Vasta-aiheet).
Jos erilaistunut kilpirauhassyöpä diagnosoidaan raskauden aikana, natriumjodidi(131I)-hoito on lykättävä synnytyksen jälkeen.
Imetys
Ennen kuin radioaktiivista lääkettä annetaan imettävälle äidille, on harkittava, voidaanko hoitoa kohtuudella lykätä, kunnes imetys on loppunut tai onko valittu radioaktiivinen lääkevalmiste paras mahdollinen ottaen huomioon aineen erittymisen rintamaitoon.
Jos valmisteen antaminen katsotaan välttämättömäksi, imetys on lopetettava vähintään 8 viikkoa ennen natriumjodidin(131I) antamista, eikä sitä saa jatkaa (ks. kohta Vasta-aiheet).
Säteilysuojelun takia läheistä kontaktia imeväisen ja äidin välillä on suositeltavaa välttää vähintään viikon ajan terapeuttisten annosten jälkeen.
Hedelmällisyys
Kilpirauhassyövän radiojodihoidon jälkeen miehillä ja naisilla voi esiintyä annoksesta riippuvaa hedelmällisyyden heikkenemistä. Aktiivisuusannoksesta riippuen palautuva spermatogeneesin heikentyminen voi tapahtua yli 1850 MBq:n annoksilla. Kliinisesti merkityksellisiä vaikutuksia, mukaan lukien oligospermia ja atsoospermia, sekä kohonneita seerumin FSH-tasoja on kuvattu yli 3700 MBq annoksen annon jälkeen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tutkimuksia valmisteen vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Ilmoitettujen haittavaikutusten esiintymistiheydet perustuvat lääketieteellisestä kirjallisuudesta saatuihin tietoihin. Natriumjodidin(131I) turvallisuusprofiili vaihtelee suuresti annetun annoksen mukaan. Annettava annos puolestaan riippuu hoitotyypistä (eli onko hoidettava sairaus hyvän- vai pahanlaatuinen). Turvallisuusprofiiliin vaikuttavat myös annetut kumulatiiviset annokset ja käytetyt annosvälit. Siksi ilmoitetut haittavaikutukset on tässä ryhmitelty sen mukaan, ilmenivätkö ne hyvän- vai pahanlaatuisen sairauden hoidossa.
Usein esiintyviä haittavaikutuksia ovat kilpirauhasen vajaatoiminta, kilpirauhasen ohimenevä liikatoiminta, sylkirauhasten ja kyynelrauhasten häiriöt ja paikalliset säteilyvaikutukset. Syövän hoidossa voi lisäksi ilmetä usein maha-suolikanavan haittavaikutuksia ja luuydinlamaa.
Taulukkomuotoinen yhteenveto haittavaikutuksista
Ilmoitetut haittavaikutukset on ryhmitelty seuraavissa taulukoissa elinjärjestelmittäin. Oireet, jotka ovat toissijaisia lääkeaineryhmälle tyypilliselle oireyhtymälle (kuten kuivasilmäisyydelle), ovat sulkeissa kyseisen oireyhtymän perässä.
Haittavaikutusten esiintymistiheydet määritellään seuraavasti:
Hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Kussakin yleisyysluokassa haittavaikutukset on esitetty vakavuuden suhteen alenevassa järjestyksessä.
Hyvänlaatuisen sairauden hoidon jälkeen ilmenneitä haittavaikutuksia
Elinjärjestelmä | Haittavaikutus | Esiintymistiheys |
Immuunijärjestelmä | Yliherkkyys, mukaan lukien anafylaksiaa muistuttava reaktio | Tuntematon |
Umpieritys | Kilpirauhasen pysyvä vajaatoiminta, kilpirauhasen vajaatoiminta | Hyvin yleinen |
Kilpirauhasen ohimenevä liikatoiminta | Yleinen | |
Tyreotoksinen kriisi, kilpirauhastulehdus, lisäkilpirauhasten vajaatoiminta (veren kalsiumpitoisuuden pieneneminen, jäykkäkouristus) | Tuntematon | |
Silmät | Endokriininen silmäoireyhtymä (Gravesin taudissa) | Hyvin yleinen |
Kuivasilmäisyys | Tuntematon | |
Hengityselimet, rintakehä ja välikarsina | Äänihuulten halvaus | Hyvin harvinainen |
Ruoansulatuselimistö | Sylkirauhastulehdus | Yleinen |
Maksa ja sappi | Maksan toiminnan häiriöt | Ei tiedossa** |
Iho ja ihonalainen kudos | Jodin aiheuttama akne | Tuntematon |
Synnynnäiset ja perinnölliset/geneettiset häiriöt | Synnynnäinen kilpirauhasen vajaatoiminta | Tuntematon |
Yleisoireet ja antopaikassa todettavat haitat | Paikallinen turvotus | Tuntematon |
Pahanlaatuisen sairauden hoidon jälkeen ilmenneitä haittavaikutuksia
Elinjärjestelmä | Haittavaikutus | Esiintymistiheys |
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Leukemia | Melko harvinainen |
Kiinteät syöpäkasvaimet, virtsarakkosyöpä, paksusuolen syöpä, mahasyöpä, rintasyöpä | Tuntematon | |
Veri ja imukudos | Erytrosytopenia, luuytimen vajaatoiminta | Hyvin yleinen |
Leukopenia, trombosytopenia | Yleinen | |
Aplastinen anemia, pysyvä tai vaikea luuydinlama | Tuntematon | |
Immuunijärjestelmä | Yliherkkyys, mukaan lukien anafylaksiaa muistuttava reaktio | Tuntematon |
Umpieritys | Tyreotoksinen kriisi, kilpirauhasen ohimenevä liikatoiminta | Harvinainen |
Kilpirauhastulehdus (ohimenevä leukosytoosi), lisäkilpirauhasten vajaatoiminta (veren kalsiumpitoisuuden pieneneminen, jäykkäkouristus), kilpirauhasen vajaatoiminta, lisäkilpirauhasen liikatoiminta | Tuntematon | |
Hermosto | Hajuaistin heikentyminen, hajuaistin menetys | Hyvin yleinen |
Aivoturvotus | Tuntematon | |
Silmät | Kuivasilmäisyys (sidekalvotulehdus, silmien kuivuminen, nenän kuivuus) | Hyvin yleinen |
Kyynelkanavan tukkeutuminen (kyynelerityksen lisääntyminen) | Yleinen | |
Hengityselimet, rintakehä ja välikarsina | Hengenahdistus | Yleinen |
Nielun kurouma*, keuhkofibroosi, hengitysvaikeus, hengitysteiden tukkeutuminen, keuhkotulehdus, henkitorven tulehdus, äänihuulten toimintahäiriö (äänihuulten halvaus, dysfonia, käheys), suunielun kipu, vinkuva hengitys | Tuntematon | |
Ruoansulatuselimistö | Sylkirauhastulehdus (suun kuivuminen, sylkirauhaskipu, sylkirauhasten suureneminen, hammaskaries, hampaan irtoaminen), säteilysairaudesta johtuva oireyhtymä, pahoinvointi, makuaistittomuus, hajuaistittomuus, makuhäiriö, ruokahalun väheneminen | Hyvin yleinen |
Oksentelu | Yleinen | |
Mahatulehdus, nielemishäiriö | Tuntematon | |
Maksa ja sappi | Maksan toiminnan häiriöt | Ei tiedossa** |
Munuaiset ja virtsatiet | Säteilyn aiheuttama virtsarakkotulehdus | Tuntematon |
Sukupuolielimet ja rinnat | Munasarjojen vajaatoiminta, kuukautishäiriö | Hyvin yleinen |
Atsoospermia, oligospermia, miehen hedelmällisyyden heikkeneminen | Tuntematon | |
Synnynnäiset ja perinnölliset/geneettiset häiriöt | Synnynnäinen kilpirauhasen vajaatoiminta | Tuntematon |
Yleisoireet ja antopaikassa todettavat haitat | Influenssaa muistuttava sairaus, päänsärky, uupumus, kaulakipu | Hyvin yleinen |
Paikallinen turvotus | Yleinen |
*erityisesti jo entuudestaan olemassa olevassa henkitorven ahtaumassa
**tämä vaikutus voidaan havaita muilla vastaavilla valmisteilla, mutta sitä ei ole havaittu Theracap I-131 ‑valmisteella
Valittujen haittavaikutusten kuvaus
Yleistä
Altistuminen ionisoivalle säteilylle voi aiheuttaa syöpää ja perinnöllisiä vikoja. Hoidoista aiheutuva säteilyannos saattaa lisätä syövän ja mutaatioiden esiintyvyyttä. Aina on syytä varmistaa, että säteilystä aiheutuvat riskit ovat pienemmät kuin itse sairaudesta aiheutuvat riskit. Natriumjodidin(131I) terapeuttisten annosten jälkeen efektiivinen annos on 3 108 mSv, kun annetaan suurin suositeltu aktiivisuus 11 100 MBq (kertymä kilpirauhaseen 0 %).
Sairaudesta aiheutuvat patofysiologiset muutokset voivat vaikuttaa merkittävästi hoidosta aiheutuvaan säteilyannokseen, joka kohdistuu tiettyihin sellaisiin elimiin, jotka eivät välttämättä ole hoidon kohde-elimiä. Riski-hyötyarvioinnissa kehotetaan ennen valmisteen antoa laskemaan yksittäisen kohde-elimen tai kohde-elinten efektiivinen annos ja todennäköinen säteilyannos. Aktiivisuutta voidaan silloin säätää kilpirauhasen massan, biologisen puoliintumisajan ja recycling-kertoimen mukaan, mikä huomioi potilaan fysiologisen tilan (mukaan lukien jodivaje) ja taustalla olevan taudinsyyn.
Kilpirauhasen ja lisäkilpirauhasten häiriöt
Hypertyreoosin radiojodihoito voi aiheuttaa viiveellä annoksesta riippuvaisen kilpirauhasen vajaatoiminnan.
Kilpirauhasen vajaatoiminta on usein ilmoitettu haittavaikutus pahanlaatuisen sairauden hoidossa, jossa radiojodihoito tosin annetaan tavallisesti vasta kilpirauhasen poiston jälkeen.
Kilpirauhasen follikkelien tuhoaminen natriumjodidilla(131I) aiheutetulla säteilyllä saattaa pahentaa jo olemassa olevaa hypertyreoosia 2–10 päivän kuluessa hoidon antamisesta tai saattaa aiheuttaa jopa tyreotoksisen kriisin. Toisinaan kilpirauhasen toiminta voi ensin normalisoitua, mutta sitten potilaalle kehittyykin immuunivälitteinen hypertyreoosi (latenssiaika 2–10 kuukautta). Suuriannoksinen radiojodihoito voi aiheuttaa 1–3 vuorokauden kuluttua radiojodin annosta ohimenevän inflammatorisen kilpirauhastulehduksen ja henkitorven tulehduksen ja siihen mahdollisesti liittyvän henkitorven vaikean kurouman, erityisesti potilaalle, jolla on entuudestaan henkitorven ahtauma.
Joissakin harvinaisissa tapauksissa kilpirauhasen ohimenevää liikatoimintaa voitiin todeta jopa toiminnallisen kilpirauhassyövän hoidon jälkeen.
Joissakin tapauksissa radiojodihoidon jälkeen on havaittu lisäkilpirauhasten ohimenevää vajaatoimintaa; tällaisia potilaita on seurattava asianmukaisesti, ja heille on annettava korvaushoitoa.
Myöhäiset vaikutukset
Annoksesta riippuvaista kilpirauhasen vajaatoimintaa voi ilmetä viivästyneenä reaktiona hypertyreoosin radiojodihoidosta. Kilpirauhasen vajaatoiminta saattaa ilmetä viikkojen tai vuosien kuluttua hoidosta, joten kilpirauhasen toimintaa on seurattava ja potilaalle on annettava asianmukaista kilpirauhashormonien korvaushoitoa. Kilpirauhasen vajaatoiminta ilmenee yleensä vasta 6–12 viikon kuluttua radiojodin annosta.
Silmät
Hypertyreoosiin tai Gravesin tautiin annetun radiojodihoidon jälkeen endokriininen silmäoireyhtymä voi pahentua tai potilaalla voi ilmetä jokin uusi silmäsairaus. Gravesin tautia sairastavalle on radiojodihoidon aikana annettava samanaikaisesti kortikosteroideja.
Paikalliset säteilyvaikutukset
Natriumjodidin(131I) annon jälkeen on ilmoitettu äänihuulten toimintahäiriöitä ja halvauksia; joissakin tapauksissa ei voida kuitenkaan varmuudella sanoa, onko äänihuulten toimintahäiriön syynä ollut säteily vai leikkaushoito.
Suureen radiojodikertymään kudoksessa voi liittyä paikallista kipua, epämiellyttäviä tuntemuksia ja turvotusta; esimerkiksi kilpirauhasen jäännöskudoksen radiojodikäsittelyssä voi aiheuttaa pään ja kaulan alueella diffuusia ja vaikeaa pehmytkudoskipua.
Kun erilaistuneen kilpirauhassyövän diffuuseja keuhkoetäpesäkkeitä on tuhottu säteilyllä, on havaittu säteilyn aiheuttamaa keuhkokuumetta ja keuhkofibroosia. Näitä esiintyy lähinnä suuriannoksisen radiojodihoidon jälkeen.
Kun kyseessä on etäpesäkkeinen kilpirauhassyöpä, johon liittyy keskushermosto-oireita, on lisäksi pidettävä mielessä, että hoito voi aiheuttaa paikallista aivoturvotusta ja/tai jo olemassa olevan aivoturvotuksen lisääntymistä.
Ruoansulatuselimistö
Korkeat radioaktiivisuustasot voivat aiheuttaa myös ruoansulatuselimistön häiriöitä, jotka ilmenevät tavallisesti antoa seuraavan parin ensimmäisen tunnin tai päivän kuluessa. Katso kohdasta Varoitukset ja käyttöön liittyvät varotoimet, miten ruoansulatuselimistön häiriöt estetään.
Sylkirauhasten ja kyynelrauhasten häiriöt
Potilaalla voi ilmetä sylkirauhastulehdus, johon liittyy sylkirauhasten turvotusta ja kipua, makuaistin osittainen menetys ja suun kuivumista. Sylkirauhastulehdus korjaantuu tavallisesti itsestään tai tulehduslääkityksellä. Toisinaan on kuitenkin ilmoitettu tapauksia, joissa annoksesta riippuvaiset makuaistittomuus ja suun kuivuminen ovat kestäneet pitkään. Syljenpuutos voi aiheuttaa infektioita, esim. kariesta, joka voi puolestaan johtaa hampaiden irtoamiseen. Katso kohdasta Varoitukset ja käyttöön liittyvät varotoimet, miten syljenerityshäiriöt estetään.
Sylkirauhasten ja/tai kyynelrauhasten toimintahäiriö ja näistä kehittyvä kuivasilmäisyys voivat ilmetä myös viiveellä vasta useiden kuukausien tai pisimmillään kahden vuoden kuluttua radiojodihoidosta. Vaikka kuivasilmäisyys on useimmissa tapauksissa ohimenevä oire, se voi toisinaan kestää useita vuosia.
Luuydinlama
Myöhäisvaikutuksena voi ilmetä korjaantuva luuydinlama, johon liittyvä isoloitunut trombosytopenia tai erytrosytopenia voi olla kuolemaan johtava. Luuydinlama ilmenee todennäköisemmin yli 5000 MBq:n kerta-annoksen jälkeen tai alle 6 kuukauden välein toistuvassa annossa.
Toissijaiset pahanlaatuiset sairaudet
Suurten (tyypillisesti kilpirauhasen pahanlaatuisissa sairauksissa käytettyjen) aktiivisuuksien annon on todettu lisäävän leukemian ilmaantuvuutta. On olemassa myös merkkejä kiinteiden kasvainten lisääntymisestä korkeilla aktiivisuustasoilla (yli 7,4 GBq).
Pediatriset potilaat
Lapsilla ilmenevät haittavaikutukset ovat tyypiltään odotettavasti samanlaisia kuin aikuisillakin. Haittavaikutusten esiintymistiheydet ja vaikeusasteet voivat kuitenkin olla lapsilla erilaiset kuin aikuisilla, koska lasten kudokset ovat säteilylle herkempiä (ks. kohta 11) ja lasten elinajanodote on pidempi.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Tämä valmiste on tarkoitettu vain valtuutetun hoitohenkilökunnan käyttöön sairaaloissa. Yliannostusvaara on siksi lähinnä teoreettinen. Jos säteilyä annetaan yliannostus, potilaaseen imeytynyttä annosta on mahdollisuuksien mukaan vähennettävä lisäämällä radionuklidin eliminaatiota kehosta virtsaamalla usein sekä pakotetulla diureesilla ja tyhjentämällä virtsarakko usein. Kilpirauhaseen kohdistuvan säteilyaltistuksen vähentämiseksi suositellaan lisäksi kilpirauhasen salpausta (esim. kaliumperkloraatilla). Natriumjodidin(131I) kertymistä voidaan vähentää antamalla emeettisiä aineita.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä, Terapeuttiset radioaktiiviset lääkevalmisteet, natriumjodidi(131I), ATC-koodi: V10XA01
Farmakologisesti vaikuttava lääkeaine on natriumjodidi(131I), joka pidättyy kilpirauhaseen. Natriumjodidin(131I) fyysinen hajoaminen tapahtuu pääasiassa kilpirauhasessa pitkänä viipymäaikanaan ja säteilyttää näin nimenomaan kilpirauhasta. Terapeuttisina annoksina käytettynä natriumjodidilla(131I) ei tunneta farmakodynaamisia vaikutuksia.
Yli 90 % säteilyvaikutuksesta tulee beetasäteilystä, jonka kantama on keskimäärin 0,5 mm. Beetasäteily vähentää annoksesta riippuvaisesti solun toimintaa ja jakautumista, jolloin solu tuhoutuu. Koska natriumjodidin(131I) kantama on lyhyt eikä se juurikaan pidäty muihin elimiin kuin kilpirauhaseen, säteilyaltistus muualla kuin kilpirauhasessa on lähes olematonta.
Farmakokinetiikka
Imeytyminen
Suun kautta annettu natriumjodidi(131I) imeytyy nopeasti ruoansulatuskanavan yläosasta (90 % 60 minuutissa). Mahalaukun tyhjenemisnopeus vaikuttaa imeytymiseen. Hypertyreoosi lisää imeytymistä ja kilpirauhasen vajaatoiminta vähentää sitä.
Seerumin aktiivisuustasoja koskeneissa tutkimuksissa tasot nousivat ensin nopeasti (10–20 minuutin ajan), minkä jälkeen tasapainotila saavutettiin noin 40 minuutin kuluttua. Tasapainotila saavutettiin samaan aikaan, kun natriumjodidi(131I) annettiin liuoksena suun kautta.
Jakautuminen ja elimiin kertyminen
Farmakokinetiikka on samanlainen kuin leimaamattomalla jodilla. Vereen päästyään natriumjodidi jakautuu kilpirauhasen ulkopuolisiin nesteaitioihin. Niistä se pidättyy pääasiassa kilpirauhaseen; noin 20 % jodidista siirtyy kilpirauhaseen yhdellä kierrolla tai erittyy munuaisteitse. Jodidin kertymä kilpirauhaseen on suurimmillaan 24–48 tunnin kuluttua, enimmäiskertymästä 50 % saavutetaan 5 tunnin kuluttua. Jodin ottoon kilpirauhaseen vaikuttavat useat tekijät: potilaan ikä, kilpirauhasen tilavuus, munuaispuhdistuma, kiertävän jodidin määrä ja muut lääkkeet (ks. kohta Yhteisvaikutukset). Kilpirauhasen jodidipuhdistuma on tavallisesti 5–50 ml/min. Jodinpuutoksessa puhdistuma suurenee 100 ml:aan/min ja hypertyreoosissa enimmillään 1000 ml:aan/min. Jos jodia on liikaa, puhdistuma voi pienentyä 2–5 ml:aan/min. Jodidi kertyy myös munuaisiin.
Pieniä määriä natriumjodidia(131I) kertyy sylkirauhasiin, mahan limakalvoille ja myös rintamaitoon, istukkaan ja suonipunokseen.
Kilpirauhaseen pidättynyt jodidi metaboloituu samalla tavalla kuin kilpirauhashormonien tiedetään metaboloituvan, ja se yhdistyy orgaanisiin yhdisteisiin, joista kilpirauhashormonit syntetisoidaan.
Biotransformaatio
Kilpirauhaseen pidättynyt jodidi metaboloituu samalla tavalla kuin kilpirauhashormonien tiedetään metaboloituvan, ja se yhdistyy orgaanisiin yhdisteisiin, joista kilpirauhashormonit syntetisoidaan.
Eliminaatio
Aktiivisuudesta erittyy virtsaan 37–75 %, ulosteisiin noin 10 % ja hien mukana ei juuri mitään. Natriumjodidi erittyy virtsaan tyypillisesti munuaispuhdistuman kautta; puhdistuma on noin 3 % munuaisten verenvirtauksesta ja suhteellisen vakio yksilöstä riippumatta. Munuaispuhdistuma on tavanomaista pienempi kilpirauhasen vajaatoimintaa sairastavilla sekä henkilöillä, joiden munuaisten toiminta on heikentynyt, ja tavanomaista suurempi hypertyreoosia sairastavilla. Jos kilpirauhanen ja munuaiset toimivat normaalisti, 50–75 % annetusta aktiivisuudesta erittyy virtsaan 48 tunnissa.
Puoliintumisaika
Natriumjodidin(131I) aktiivisuuden efektiivinen puoliintumisaika on noin 12 tuntia, kun taas kilpirauhaseen kertyneen jodin radioaktiivisuuden puoliintumisaika on noin 6 vuorokautta. Näin ollen natriumjodidin(131I) annon jälkeen efektiivinen puoliintumisaika on noin 40 %:n aktiivisuusosuuden osalta 6 vuorokautta ja lopun 60 %:n osalta 8 vuorokautta.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavilla potilailla radiojodipuhdistuma voi vähentyä, mikä johtaa lisääntyneeseen altistukseen annetulle natriumjodidille(131I). Yksi tutkimus osoitti esimerkiksi, että munuaisten vajaatoimintaa sairastavilla potilailla, joille tehdään jatkuva ambulatorinen peritoneaalidialyysi (CAPD), radiojodin puhdistuma on viisi kertaa pienempi kuin potilailla, joilla on normaali munuaisten toiminta.
Prekliiniset tiedot turvallisuudesta
Koska annettu määrä on pieni verrattuna normaaliin jodinsaantiin ravinnosta (40–500 mikrog/vrk), akuuttia toksisuutta ei odoteta ilmenevän eikä sitä ole havaittu.
Saatavilla ei ole tietoa natriumjodidin toistuvan annon toksisuudesta, eikä myöskään vaikutuksista eläinten lisääntymiseen tai mahdollisesta mutageenisuudesta tai karsinogeenisuudesta.
Farmaseuttiset tiedot
Apuaineet
Natriumtiosulfaattipentahydraatti
Dinatriumfosfaatti, vedetön
Natriumhydroksidi
Vedetön kolloidinen piidioksidi
Maissitärkkelys
Injektionesteisiin käytettävä vesi
Liivatekapseli:
Liivate
Keltainen rautaoksidi (E 172)
Titaanidioksidi (E 171)
Natriumlauryylisulfaatti
Etikkahappo
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Valmisteen viimeinen käyttöpäivämäärä on 14 päivän kuluttua pakkaukseen merkitystä, aktiivisuutta kuvaavasta referenssipäivämäärästä.
Säilytys
Säilytä alle 25 °C. Ei saa jäätyä.
Säilytä alkuperäispakkauksessa estääksesi ulkoisen säteilyaltistuksen.
Radiofarmaseuttisten valmisteiden säilyttämisessä pitää noudattaa radioaktiivista materiaalia koskevia paikallisia säädöksiä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
THERACAP kapseli, kova
37 MBq - 5,55 GBq 0,925 - 5,55 GBq (-), 37 - 740 MBq (-)
PF-selosteen tieto
Kukin kapseli on polykarbonaattirasiassa, jossa on hiilikiekko I-131:tä absorboivana aineena. Rasia on lyijysuojuksessa.
Pakkauskoot: 37–740 MBq 37 MBq:n välein ja 0,925 - 5,55 GBq 185 MBq:n välein. Jokainen pakkaus sisältää yhden kapselin.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Keltainen liivatekapseli
Käyttö- ja käsittelyohjeet
Yleiset varoitukset
Radiofarmaseuttisia valmisteita saa vastaanottaa, käsitellä ja antaa potilaille vain valtuutettu henkilöstö tähän tarkoitukseen varatuissa tiloissa. Radiofarmaseuttisten valmisteiden vastaanotosta, säilytyksestä, käytöstä, kuljetuksesta ja hävittämisestä on määräykset paikallisten viranomaisten säädöksissä ja käyttöluvissa.
Radiofarmaseuttiset valmisteet pitää valmistaa sekä säteilyturvallisuuden että farmaseuttisten laatuvaatimusten edellyttämällä tavalla.
Varotoimenpiteet ennen lääkkeen käsittelyä tai antamista
Natriumjodidin(131I) antaminen hoitoannoksin johtaa todennäköisesti suhteellisen korkeaan säteilyannokseen useimmille potilaille ja voi johtaa merkittävään ympäristövahinkoon ja aiheuttaa riskejä muille henkilöille ulkoisena säteilynä tai kontaminaationa virtsaroiskeiden, oksennuksen jne. välityksellä. Tämä voi olla haitallista hoidettavien henkilöiden lähisukulaisille tai muille henkilöille riippuen annetusta aktiivisuudesta. Jotta vältetään kontaminaatiot potilaiden eliminoimasta aktiivisuudesta, on noudatettava kansallisten säännösten mukaisia riittäviä varotoimia.
Valmiste pitää antaa siten, että lääkevalmisteen kontaminaatioriski ja valmistetta antavan henkilökunnan säteilyriski ovat mahdollisimman pienet. Asianmukainen suojautuminen on pakollista.
Säiliön avaavan henkilön tulee tietää, että avaaminen voi aiheuttaa vapaan radioaktiivisuuden rekisteröitymistä mittareissa. Aktiivisuus johtuu Xe-131m:stä, jota muodostuu 1,17 %:n verran I-131:n hajotessa. Vaikka aktiivisuus näkyy mittareissa, se ei aiheuta merkityksellistä riskiä henkilökunnalle.
Muodostuneen Xe-131m:n efektiivinen annosnopeus inhaloituna on 0,1 % annosnopeudesta 1 m:n etäisyydellä lyijysuojatusta kapselista.
Varotoimet ja aktiivisuustiedot
1,3 % jodista(131I) hajoaa ksenonin(131mXe) kautta (puoliintumisaika 12 päivää), ja pakkauksessa voi olla diffuusion seurauksena pieni määrä ksenoniaktiivisuutta(131mXe). Siksi on suositeltavaa, että kuljetusastia avataan tuuletetussa tilassa ja että kapselin poistamisen jälkeen pakkausmateriaalien annetaan seistä yön yli ennen hävittämistä absorboituneen ksenonin(131mXe) vapautumisen mahdollistamiseksi.
Lisäksi kapselista saattaa vuotaa rajoitetusti haihtuvaa jodi-131-aktiivisuutta.
Kapselin aktiivisuus kello 12.00 GMT kalibrointipäivästä alkaen voidaan laskea taulukosta 1.
Taulukko 1
Päivä | Kerroin | Päivä | Kerroin |
-6 | 1,677 | 5 | 0,650 |
-5 | 1,539 | 6 | 0,596 |
-4 | 1,412 | 7 | 0,547 |
-3 | 1,295 | 8 | 0,502 |
-2 | 1,188 | 9 | 0,460 |
-1 | 1,090 | 10 | 0.422 |
0 | 1,000 | 11 | 0,387 |
1 | 0,917 | 12 | 0.355 |
2 | 0,842 | 13 | 0,326 |
3 | 0,772 | 14 | 0,299 |
4 | 0,708 |
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
THERACAP kapseli, kova
37 MBq - 5,55 GBq 0,925 - 5,55 GBq, 37 - 740 MBq
- Ei korvausta.
ATC-koodi
V10XA01
Valmisteyhteenvedon muuttamispäivämäärä
07.10.2021
Dosimetria
Alla luetellut tiedot ovat peräisin ICRP: n (International Commission on Radiological Protection, Radiation Dose to Potents from Radiopharmaceuticals) julkaisusta 128. Biokineettistä mallia kuvataan tilamallina, jossa epäorgaanista jodidia sekä orgaanisesti sitoutunutta jodia vapautuu kehon kudoksiin kilpirauhaseen kertymisen jälkeen. ICRP-malli viittaa oraaliseen antoon.
Yksittäiseen/-siin kohde-elimeen/-iin kohdistuvat efektiivinen annos ja todennäköiset säteilyannokset tulisi laskea osana hyöty-riskiarviointia jo ennen valmisteen antoa. Aktiivisuutta on sitten mahdollisesti säädettävä kilpirauhasen massan, biologisen puoliintumisajan ja ”kiertokertoimen” mukaan. Kiertokerroin huomioi potilaan fysiologisen tilan (myös jodinpuutoksen) ja perussairaudet.
Seuraavien kohde-elinten annoksia voidaan käyttää
Yhtenäinen autonomia
Kohde-elimen annos 300–400 Gy
Multifokaalinen tai levitetty autonomia
Kohde-elimen annos 150–200 Gy
Gravesin tauti (Morbus Basedow)
Kohde-elimen annos 200 Gy
Säteilyaltistus kohdistuu lähinnä kilpirauhaseen. Muiden elinten säteilyaltistus on tuhannesosia pienempi kuin kilpirauhasen. Säteilyaltistukseen vaikuttavat jodinsaanti ravinnosta (niillä, joiden asuinalueiden maaperässä jodia on vain vähän, radiojodin kertymä suurenee jopa 90 %, ja niillä, joiden asuinalueiden maaperässä jodia on runsaasti, kertymä pienenee 5 %). Säteilyaltistukseen vaikuttavat myös kilpirauhasen toiminta (normaali toiminta, liikatoiminta tai vajaatoiminta) ja elimistön jodia kerryttävät kudokset. (Esimerkiksi tilanteet, joissa kilpirauhanen on poistettu, etäpesäkkeet keräävät jodia tai kilpirauhasen toiminta on estetty lääkkeellisesti.) Kaikkiin muihin elimiin kohdistuva säteilyaltistus on vastaavasti joko suurempi tai pienempi sen mukaan, kuinka suuri kilpirauhasen kertymä on.
“blokattu” kilpirauhanen, kertymä 0 %, suun kautta annettuna
Absorboitunut annos annettua radioaktiivista yksikköä kohti (mGy/MBq) | |||||
Elin | Aikuinen | 15-vuotias | 10-vuotias | 5-vuotias | 1-vuotias |
Lisämunuaiset | 0,044 | 0,054 | 0,086 | 0,14 | 0,25 |
Luun pinta | 0,030 | 0,037 | 0,059 | 0,092 | 0,18 |
Aivot | 0,021 | 0,026 | 0,043 | 0,071 | 0,14 |
Rinta | 0,020 | 0,025 | 0,042 | 0,069 | 0,13 |
Sappirakon seinämä | 0,037 | 0,048 | 0,085 | 0,13 | 0,21 |
Ruuansulatuselimet | |||||
Mahalaukun seinämä | 0,87 | 1,1 | 1,6 | 2,8 | 5,9 |
Ohutsuolen seinämä | 0,035 | 0,044 | 0,070 | 0,11 | 0,19 |
Paksusuolen seinämä | 0,14 | 0,18 | 0,30 | 0,50 | 0,92 |
(Yläosan seinämä | 0,12 | 0,15 | 0,25 | 0,42 | 0,75) |
(Alaosan seinämä | 0,17 | 0,22 | 0,37 | 0,61 | 1,2) |
Sydämen seinämä | 0,062 | 0,080 | 0,13 | 0,20 | 0,37 |
Munuaiset | 0,27 | 0,32 | 0,46 | 0,69 | 1,2 |
Maksa | 0,050 | 0,065 | 0,10 | 0,16 | 0,30 |
Keuhkot | 0,053 | 0,068 | 0,11 | 0,18 | 0,36 |
Lihakset | 0,026 | 0,032 | 0,051 | 0,080 | 0,15 |
Ruokatorvi | 0,024 | 0,030 | 0,049 | 0,079 | 0,15 |
Munasarjat | 0,038 | 0,049 | 0,076 | 0,11 | 0,20 |
Haima | 0,060 | 0,073 | 0,11 | 0,16 | 0,28 |
Punainen luuydin | 0,031 | 0,038 | 0,061 | 0,095 | 0,18 |
Sylkirauhaset | 0,27 | 0,33 | 0,44 | 0,59 | 0,86 |
Iho | 0,019 | 0,023 | 0,038 | 0,062 | 0,12 |
Perna | 0,064 | 0,077 | 0,12 | 0,19 | 0,34 |
Kivekset | 0,025 | 0,033 | 0,055 | 0,084 | 0,15 |
Kateenkorva | 0,024 | 0,030 | 0,049 | 0,079 | 0,15 |
Kilpirauhanen | 2,2 | 3,6 | 5,6 | 13,0 | 25,0 |
Virtsarakon seinämä | 0,54 | 0,70 | 1,1 | 1,4 | 1,8 |
Kohtu | 0,045 | 0,056 | 0,090 | 0,13 | 0,21 |
Muut elimet | 0,029 | 0,037 | 0,060 | 0,10 | 0,18 |
Efektiivinen annos (mSv/MBq) | 0,28 | 0,40 | 0,61 | 1,2 | 2,3 |
Alhainen kilpirauhaskertymä, suun kautta annettuna
Absorboitunut annos annettua radioaktiivista yksikköä kohti (mGy/MBq) | |||||
Elin | Aikuinen | 15-vuotias | 10-vuotias | 5-vuotias | 1-vuotias |
Lisämunuaiset | 0,051 | 0,067 | 0,12 | 0,20 | 0,44 |
Luun pinta | 0,089 | 0,10 | 0,14 | 0,22 | 0,40 |
Aivot | 0,093 | 0,10 | 0,13 | 0,18 | 0,30 |
Rinta | 0,038 | 0,050 | 0,10 | 0,17 | 0,32 |
Sappirakon seinämä | 0,043 | 0,057 | 0,1 | 0,18 | 0,36 |
Ruuansulatuselimet | |||||
Mahalaukun seinämä | 0,77 | 1,0 | 1,5 | 2,5 | 5,3 |
Ohutsuolen seinämä | 0,033 | 0,043 | 0,073 | 0,11 | 0,22 |
Paksusuolen seinämä | 0,14 | 0,18 | 0,32 | 0,58 | 1,3 |
(Yläosan seinämä | 0,12 | 0,15 | 0,27 | 0,49 | 1,0) |
(Alaosan seinämä | 0,17 | 0,22 | 0,39 | 0,71 | 1,6) |
Sydämen seinämä | 0,089 | 0,12 | 0,21 | 0,36 | 0,77 |
Munuaiset | 0,27 | 0,34 | 0,50 | 0,84 | 1,8 |
Maksa | 0,093 | 0,14 | 0,24 | 0,46 | 1,2 |
Keuhkot | 0,10 | 0,13 | 0,22 | 0,38 | 0,79 |
Lihakset | 0,084 | 0,11 | 0,17 | 0,27 | 0,48 |
Ruokatorvi | 0,10 | 0,15 | 0,30 | 0,58 | 1,1 |
Munasarjat | 0,037 | 0,049 | 0,080 | 0,13 | 0,28 |
Haima | 0,064 | 0,080 | 0,13 | 0,21 | 0,41 |
Punainen luuydin | 0,072 | 0,086 | 0,12 | 0,19 | 0,37 |
Sylkirauhaset | 0,22 | 0,27 | 0,36 | 0,49 | 0,72 |
Iho | 0,043 | 0,053 | 0,080 | 0,12 | 0,25 |
Perna | 0,069 | 0,089 | 0,15 | 0,26 | 0,55 |
Kivekset | 0,024 | 0,032 | 0,056 | 0,095 | 0,20 |
Kateenkorva | 0,10 | 0,15 | 0,30 | 0,59 | 1,1 |
Kilpirauhanen | 280 | 450 | 670 | 1400 | 2300 |
Virtsarakon seinämä | 0,45 | 0,58 | 0,89 | 1,2 | 1,6 |
Kohtu | 0,042 | 0,054 | 0,090 | 0,15 | 0,28 |
Muut elimet | 0,084 | 0,11 | 0,17 | 0,25 | 0,44 |
Efektiivinen annos (mSv/MBq) | 14 | 23 | 34 | 71 | 110 |
Keskimääräinen kilpirauhaskertymä, suun kautta annettuna
| Absorboitunut annos annettua radioaktiivista yksikköä kohti (mGy/MBq) | ||||
Elin | Aikuinen | 15-vuotias | 10-vuotias | 5-vuotias | 1-vuotias |
Lisämunuaiset | 0,055 | 0,074 | 0,13 | 0,24 | 0,55 |
Luun pinta | 0,12 | 0,14 | 0,19 | 0,30 | 0,52 |
Aivot | 0,13 | 0,14 | 0,18 | 0,24 | 0,39 |
Rinta | 0,048 | 0,063 | 0,13 | 0,23 | 0,43 |
Sappirakon seinämä | 0,046 | 0,063 | 0,12 | 0,21 | 0,45 |
Ruuansulatuselimet | |||||
Mahalaukun seinämä | 0,71 | 0,95 | 1,4 | 2,4 | 5,0 |
Ohutsuolen seinämä | 0,032 | 0,043 | 0,075 | 0,11 | 0,24 |
Paksusuolen seinämä | 0,14 | 0,18 | 0,34 | 0,63 | 1,4 |
(Yläosan seinämä | 0,12 | 0,15 | 0,28 | 0,53 | 1,2) |
(Alaosan seinämä | 0,17 | 0,22 | 0,40 | 0,76 | 1,8) |
Sydämen seinämä | 0,10 | 0,14 | 0,25 | 0,45 | 1,0 |
Munuaiset | 0,27 | 0,34 | 0,53 | 0,93 | 2,1 |
Maksa | 0,12 | 0,18 | 0,31 | 0,62 | 1,7 |
Keuhkot | 0,13 | 0,16 | 0,28 | 0,50 | 1,0 |
Lihakset | 0,12 | 0,15 | 0,24 | 0,38 | 0,66 |
Ruokatorvi | 0,14 | 0,22 | 0,45 | 0,87 | 1,7 |
Munasarjat | 0,036 | 0,049 | 0,082 | 0,15 | 0,33 |
Haima | 0,066 | 0,084 | 0,14 | 0,24 | 0,49 |
Punainen luuydin | 0,095 | 0,11 | 0,15 | 0,24 | 0,48 |
Sylkirauhaset | 0,19 | 0,24 | 0,32 | 0,43 | 0,64 |
Iho | 0,057 | 0,070 | 0,10 | 0,16 | 0,33 |
Perna | 0,072 | 0,096 | 0,16 | 0,29 | 0,68 |
Kivekset | 0,023 | 0,032 | 0,056 | 0,1 | 0,23 |
Kateenkorva | 0,14 | 0,22 | 0,45 | 0,87 | 1,7 |
Kilpirauhanen | 430 | 690 | 1000 | 2200 | 3600 |
Virtsarakon seinämä | 0,39 | 0,51 | 0,79 | 1,1 | 1,5 |
Kohtu | 0,040 | 0,053 | 0,089 | 0,15 | 0,32 |
Muut elimet | 0,11 | 0,15 | 0,23 | 0,33 | 0,58 |
Efektiivinen annos (mSv/MBq) | 22 | 35 | 53 | 110 | 180 |
Korkea kilpirauhaskertymä, suun kautta annettuna
Absorboitunut annos annettua radioaktiivista yksikköä kohti (mGy/MBq) | |||||
Elin | Aikuinen | 15-vuotias | 10-vuotias | 5-vuotias | 1-vuotias |
Lisämunuaiset | 0,059 | 0,082 | 0,15 | 0,28 | 0,66 |
Luun pinta | 0,16 | 0,18 | 0,24 | 0,37 | 0,65 |
Aivot | 0,17 | 0,18 | 0,23 | 0,30 | 0,49 |
Rinta | 0,058 | 0,077 | 0,17 | 0,28 | 0,54 |
Sappirakon seinämä | 0,049 | 0,068 | 0,13 | 0,24 | 0,54 |
Ruuansulatuselimet | |||||
Mahalaukun seinämä | 0,66 | 0,88 | 1,3 | 2,2 | 4,7 |
Ohutsuolen seinämä | 0,032 | 0,043 | 0,077 | 0,12 | 0,26 |
Paksusuolen seinämä | 0,14 | 0,19 | 0,35 | 0,68 | 1,6 |
(Yläosan seinämä | 0,12 | 0,16 | 0,30 | 0,58 | 1,4) |
(Alaosan seinämä | 0,16 | 0,22 | 0,42 | 0,81 | 2,0) |
Sydämen seinämä | 0,12 | 0,16 | 0,30 | 0,55 | 1,2 |
Munuaiset | 0,27 | 0,35 | 0,55 | 1,0 | 2,4 |
Maksa | 0,14 | 0,22 | 0,39 | 0,79 | 2,2 |
Keuhkot | 0,15 | 0,20 | 0,35 | 0,61 | 1,3 |
Lihakset | 0,15 | 0,19 | 0,31 | 0,49 | 0,86 |
Ruokatorvi | 0,19 | 0,28 | 0,59 | 1,2 | 2,3 |
Munasarjat | 0,035 | 0,049 | 0,084 | 0,16 | 0,37 |
Haima | 0,068 | 0,088 | 0,15 | 0,27 | 0,57 |
Punainen luuydin | 0,12 | 0,14 | 0,19 | 0,29 | 0,59 |
Sylkirauhaset | 0,16 | 0,20 | 0,27 | 0,37 | 0,55 |
Iho | 0,71 | 0,087 | 0,13 | 0,19 | 0,41 |
Perna | 0,075 | 0,10 | 0,18 | 0,33 | 0,80 |
Kivekset | 0,22 | 0,031 | 0,057 | 0,11 | 0,27 |
Kateenkorva | 0,19 | 0,28 | 0,59 | 1,2 | 2,3 |
Kilpirauhanen | 580 | 940 | 1400 | 3000 | 4900 |
Virtsarakon seinämä | 0,34 | 0,44 | 0,68 | 0,95 | 1,3 |
Kohtu | 0,038 | 0,051 | 0,089 | 0,16 | 0,36 |
Muut elimet | 0,15 | 0,19 | 0,29 | 0,42 | 0,74 |
Efektiivinen annos (mSv/MBq) | 29 | 47 | 71 | 150 | 250 |
Radiofarmaseuttisten valmisteiden valmistusohjeet
Kapselit ovat käyttövalmiita. Määritä aktiivisuus ennen antoa.
Yhteystiedot
 OY GE HEALTHCARE BIO-SCIENCES AB
OY GE HEALTHCARE BIO-SCIENCES AB PL 400
00031 GE
010 39411
www.gehealthcare.fi
customerservicefinland@ge.com
