VAZKEPA kapsel, mjuk 998 mg
Kvalitativ och kvantitativ sammansättning
1 kapsel innehåller 998 mg ikosapentetyl.
Hjälpämnen med känd effekt
1 kapsel innehåller 30 mg maltitol (E965), 83 mg sorbitol (E420) och sojalecitin.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Kapsel, mjuk (kapsel).
Kliniska uppgifter
Terapeutiska indikationer
Vazkepa är avsett för att minska risken för kardiovaskulära händelser hos vuxna statinbehandlade patienter med hög kardiovaskulär risk och förhöjda triglycerider (≥ 150 mg/dl [≥ 1,7 mmol/l]) och:
- etablerad kardiovaskulär sjukdom eller
- diabetes och åtminstone ytterligare en kardiovaskulär riskfaktor.
För information om prövningar inklusive kardiovaskulära riskfaktorer och resultat vad gäller effekterna på kardiovaskulära händelser, se avsnitt Farmakodynamiska egenskaper.
Dosering och administreringssätt
Dosering
Rekommenderad daglig oral dos är 4 kapslar som tas som två 998 mg kapslar två gånger dagligen.
Om en dos glöms bort bör patienten ta den så snart han/hon kommer ihåg det. Om en daglig dos glöms bort, ska nästa dos inte dubbleras.
Äldre
Ingen dosjustering krävs hos äldre patienter (≥ 65 år) (se avsnitt Farmakokinetiska egenskaper).
Nedsatt njurfunktion
Ingen dosjustering rekommenderas (se avsnitt Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Ingen dosjustering rekommenderas (se avsnitt Varningar och försiktighet och Farmakokinetiska egenskaper).
Pediatrisk population
Det finns ingen relevant användning av ikosapentetyl hos barn < 18 års ålder för att minska risken för kardiovaskulära händelser hos statinbehandlade patienter med hög kardiovaskulär risk och förhöjda triglycerider och andra riskfaktorer för kardiovaskulär sjukdom.
Administreringssätt
Oral användning.
Vazkepa ska tas med eller efter en måltid.
För att säkerställa att hela den avsedda dosen tas bör patienterna uppmanas att svälja kapslarna hela och att inte öppna, krossa, lösa upp eller tugga på dem.
Kontraindikationer
Överkänslighet mot den aktiva substansen, soja eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Allergier mot fisk och/eller skaldjur
Ikosapentetyl utvinns ur fiskolja. Det är inte känt om patienter som är allergiska mot fisk och/eller skaldjur har en högre risk för en allergisk reaktion mot ikosapentetyl. Ikosapentetyl ska användas med försiktighet hos patienter med känd överkänslighet mot fisk och/eller skaldjur.
Nedsatt leverfunktion
Hos patienter med nedsatt leverfunktion ska koncentrationerna av alaninaminotransferas (ALAT) och aspartataminotransferas (ASAT) övervakas enligt klinisk indikation innan behandlingen påbörjas och vid lämpliga intervall under behandlingen (se avsnitt Dosering och administreringssätt och Farmakokinetiska egenskaper).
Förmaksflimmer eller förmaksfladder
Ikosapentetyl har förknippats med en ökad risk för förmaksflimmer eller förmaksfladder som krävde sjukhusvistelse i en dubbelblind, placebokontrollerad prövning. Incidensen av förmaksflimmer var högre hos patienter med en tidigare anamnes på förmaksflimmer eller förmaksfladder (se avsnitt Biverkningar). Patienter, särskilt de med en relevant anamnes, ska övervakas för kliniska tecken på förmaksflimmer eller förmaksfladder (t.ex. dyspné, palpitationer, synkope/yrsel, obehag i bröstet, förändring av blodtryck eller oregelbunden puls). Elektrokardiografisk bedömning ska utföras när det är kliniskt indicerat.
Blödning
Behandling med ikosapentetyl har förknippats med en högre incidens av blödning. När ikosapentetyl administreras samtidigt med antitrombotiska läkemedel kan lämpliga laboratorieundersökningar övervägas varje gång kliniska tecken som tyder på blödning uppkommer under behandling, t.ex. kontusion, näsblödning, hematuri eller gastrointestinal blödning. Patienter ska rådas att omedelbart rapportera alla tecken eller symtom på blödning till läkaren (se avsnitt Biverkningar).
Hjälpämnen med känd effekt
Maltitol (E965)
Detta läkemedel innehåller 30 mg maltitol per kapsel.
Patienter med följande sällsynta ärftliga tillstånd bör inte ta detta läkemedel: fruktosintolerans.
Sorbitol (E420)
Detta läkemedel innehåller 83 mg sorbitol per kapsel. Additiv effekt av samtidigt administrerade läkemedel som innehåller sorbitol (eller fruktos) och födointag av sorbitol (eller fruktos) ska beaktas.
Innehåll av sorbitol i läkemedel för oralt bruk kan påverka biotillgängligheten av andra läkemedel för oralt bruk som administreras samtidigt.
Patienter med hereditär fruktosintolerans bör inte använda detta läkemedel.
Sojalecitin
Detta läkemedel innehåller sojalecitin. Patienter som är allergiska mot soja eller jordnötter ska inte använda detta läkemedel.
Interaktioner
Ikosapentetyl studerades vid en dosnivå på fyra 998 mg kapslar/dag med följande läkemedel som är typiska substrat för cytokrom P450‑enzymer: omeprazol, rosiglitazon, warfarin och atorvastatin. Inga interaktioner observerades.
Patienter som tar ikosapentetyl tillsammans med antitrombotiska läkemedel, dvs. trombocytaggregationshämmare, inklusive acetylsalicylsyra och/eller antikoagulantia, kan ha högre risk för blödning och ska övervakas regelbundet.
Fertilitet, graviditet och amning
Graviditet
Det finns begränsad mängd data från användningen av ikosapentetyl hos gravida kvinnor. Djurstudier visar inga direkta eller indirekta skadliga reproduktionstoxikologiska effekter (se avsnitt Prekliniska säkerhetsuppgifter). Som en försiktighetsåtgärd bör man undvika användning av Vazkepa under graviditet, såvida inte nyttan anses överväga den potentiella risken för det ofödda barnet.
Amning
Det är okänt om ikosapentetyl utsöndras i bröstmjölk. Studier från litteraturen har visat att den aktiva metaboliten eikosapentaensyra (EPA) utsöndras i bröstmjölk i nivåer som är jämförbara med moderns kost. Tillgängliga toxikologiska data från råtta har visat att ikosapentetyl utsöndras i mjölk (se avsnitt Prekliniska säkerhetsuppgifter).
En risk för det nyfödda barnet/spädbarnet kan inte uteslutas.
Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med Vazkepa efter att man tagit hänsyn till fördelen med amning för barnet och nyttan med behandling för kvinnan.
Fertilitet
Det finns inga data om fertilitet hos människa från användningen av ikosapentetyl. Djurstudier visar inga direkta eller indirekta skadliga reproduktionstoxikologiska effekter (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
Vazkepa har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste rapporterade biverkningarna förknippade med ikosapentetyl är blödning (11,8 %) perifert ödem (7,8 %), förmaksflimmer (5,8 %), förstoppning (5,4 %), muskuloskeletal smärta (4,3 %), gikt (4,3 %) och utslag (3,0 %).
Biverkningstabell
Biverkningarna anges nedan och klassificeras enligt frekvens och MedDRA:s organsystemklass baserat på alla tillgängliga interventionella och icke-interventionella kliniska prövningar och spontan rapportering. Frekvenskategorierna definieras enligt följande konvention: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/ 100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom varje frekvensgrupp presenteras biverkningar i fallande allvarlighetsgrad.
Tabell 1 Biverkningar
| MedDRA‑klassificering av organsystem | Biverkning | Frekvens |
|---|---|---|
| Immunsystemet | Överkänslighet | Mindre vanliga |
| Svullnad i farynx | Ingen känd frekvens | |
| Metabolism och nutrition | Gikt | Vanliga |
| Centrala och perifera nervsystemet | Dysgeusi1 | Mindre vanliga |
| Hjärtat | Förmaksflimmer eller förmaksfladder2 | Vanliga |
| Blodkärl | Blödningar2 | Mycket vanliga |
| Magtarmkanalen | Förstoppning2 | Vanliga |
| Rapningar | Vanliga | |
| Hud och subkutan vävnad | Utslag | Vanliga |
| Muskuloskeletala systemet och bindväv | Muskuloskeletal smärta | Vanliga |
| Allmänna symtom och/eller symtom vid administreringsstället | Perifert ödem | Vanliga |
1 Dysgeusi motsvarar följande "ordagranna" term: Fisksmak
2 Se "Beskrivning av utvalda biverkningar"
Beskrivning av utvalda biverkningar
Blödning
Blödning uppkom hos 11,8 % av försökspersonerna som fick ikosapentetyl i en placebokontrollerad studie av kardiovaskulära resultat jämfört med 9,9 % hos försökspersonerna som fick placebo. Allvarliga blödningshändelser rapporterades oftare hos försökspersoner som fick ikosapentetyl än hos de som fick placebo vid administrering i kombination med ett samtidigt antitrombotiskt läkemedel (3,4 % mot 2,6 %), men uppkom vid samma frekvens (0,2 %) hos försökspersoner som inte samtidigt tog ett antitrombotiskt läkemedel/trombocytaggregationshämmare (se avsnitt Varningar och försiktighet).
De blödningshändelser som observerades oftast med ikosapentetyl var gastrointestinal blödning (3,1 %), kontusion (2,5 %), hematuri (1,9 %) och näsblödning (1,5 %).
Förmaksflimmer/förmaksfladder
Förmaksflimmer eller förmaksfladder uppkom hos 5,8 % av försökspersonerna som fick ikosapentetyl i en placebokontrollerad studie av kardiovaskulära resultat jämfört med 4,5 % av försökspersonerna som fick placebo. Förmaksflimmer eller förmaksfladder som krävde sjukhusvistelse i 24 timmar eller längre förekom hos 3 % av försökspersonerna som behandlades med ikosapentetyl jämfört med 2 % av försökspersonerna som fick placebo. Förmaksflimmer och förmaksfladder rapporterades oftare hos försökspersoner med en tidigare anamnes på förmaksflimmer eller förmaksfladder som fick ikosapentetyl än hos dem som fick placebo (12,5 % mot 6,3 %) (se avsnitt Varningar och försiktighet.)
Förstoppning
Förstoppning uppkom hos 5,4 % av försökspersonerna som fick ikosapentetyl i en placebokontrollerad studie av kardiovaskulära resultat jämfört med 3,6 % av försökspersonerna som fick placebo. Allvarlig förstoppning var mindre vanligt för ikosapentetyl (0,1 %) och placebo (0,2 %). Den relativa incidensen av förstoppning i denna prövning kan ha förväxlats med en kvarvarande laxerande effekt av placebo, vilken bestod av en subterapeutisk dos av lätt mineralolja (4 ml).
Följande biverkningar har identifierats vid användning av ikosapentetyl globalt efter godkännande för försäljning. Eftersom dessa biverkningar rapporteras frivilligt från en population av osäker storlek är det i allmänhet inte möjligt att göra en tillförlitlig uppskattning av deras frekvens eller fastställa ett orsakssamband med exponering för läkemedlet: förhöjda triglyceridhalter i blodet, artralgi, diarré, bukobehag och smärta i ben och armar.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Det finns ingen specifik behandling för överdosering av ikosapentetyl. Vid överdosering ska patienten behandlas symtomatiskt och stödjande åtgärder sättas in efter behov.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Medel som påverkar serumlipidnivåerna, övriga medel som påverkar serumlipidnivåerna, ATC-kod: C10AX06
Verkningsmekanism
Ikosapentetyl är en stabil etylester från omega‑3‑fettsyran eikosapentaensyra (EPA). Verkningsmekanismerna som bidrar till minskningen av kardiovaskulära händelser med ikosapentetyl är ännu inte helt klarlagda. Mekanismerna är troligtvis multifaktoriella och inkluderar förbättrad lipoproteinprofil med minskning av triglyceridrika lipoproteiner; antiinflammatoriska och antioxiderande effekter; minskning av makrofagackumulering; förbättring av endotelfunktion; tjockare/stabilare bindvävskapsel och trombocythämmande effekter. Var och en av dessa mekanismer kan ha en gynnsam inverkan på utveckling, progression och stabilisering av aterosklerotiska plack och även konsekvenserna av plackruptur. Prekliniska och kliniska studier stödjer sådana gynnsamma effekter av EPA. Systemiska och lokaliserade antiinflammatoriska effekter av EPA kan uppkomma på grund av dislokation av proinflammatorisk arakidonsyra (AA), som riktar katabolismen bort från eikosanoider (prostaglandiner av 2‑serien och tromboxaner samt leukotriener av 4‑serien) mot icke- eller antiinflammatoriska mediatorer. Den direkta kliniska betydelsen av individuella fynd är dock oklar.
Farmakodynamisk effekt
Ikosapentetyl förbättrar lipoproteinprofilen genom att hämma enzymer som syntetiserar kolesterol, fettsyra och triglycerider (TG), öka β‑oxidation av fettsyror och minska MTP (microsomal triglyceride transfer protein), vilket leder till lägre TG i levern och minskad syntes och frisättning av VLDL (very low‑density lipoprotein). Ikosapentetyl ökar även uttrycket av lipoproteinlipas, viket leder till att mer TG avlägsnas från cirkulerande VLDL och kylomikronpartiklar. Hos patienter med förhöjda TG‑nivåer sänker Ikosapentetyl TG, VLDL, kvarvarande lipoproteinkolesterol och nivåerna av inflammationsmarkörer som C‑reaktivt protein. TG‑minskningen verkar emellertid endast ha en svagt gynnsam inverkan på riskreduktionen för kardiovaskulära händelser med ikosapentetyl.
Klinisk effekt och säkerhet
REDUCE‑IT var en multinationell, dubbelblind, randomiserad, placebokontrollerad, händelsedriven studie med 8 179 (4 089 ikosapentetyl, 4 090 placebo) statinbehandlade, vuxna patienter som rekryterades med LDL‑C (low‑density lipoprotein cholesterol) > 1,03 mmol/l (40 mg/dl) och ≤ 2,59 mmol/l (100 mg/dl) och måttligt förhöjda triglycerid‑nivåer (≥ 1,53 mmol/l och < 5,64 mmol/l [≥ 135 mg/dl och < 500 mg/dl]) enligt mätningar som gjordes under patientscreening, dvs. kvalificeringsbesöken före rekryteringen) och antingen etablerad kardiovaskulär sjukdom (70,7 %) eller diabetes och andra riskfaktorer för kardiovaskulär sjukdom (29,3 %). Patienter med etablerad kardiovaskulär sjukdom definierades som patienter på minst 45 år med en dokumenterad anamnes på kranskärlssjukdom, cerebrovaskulär sjukdom eller sjukdom i karotisartär eller perifer arteriell sjukdom. Patienter i den andra riskgruppen definierades som minst 50 år med diabetes som krävde medicinsk behandling och minst en ytterligare riskfaktor dvs. hypertoni eller ett antihypertensivt läkemedel, ålder på minst 55 år (män) eller minst 65 år (kvinnor), låga nivåer av high‑density lipoprotein cholesterol, rökning, förhöjda nivåer av högkänsligt C‑reaktivt protein, nedsatt njurfunktion, mikro- eller makroalbuminuri, retinopati eller nedsatt ankel‑brakialindex. Patienterna randomiserades 1:1 för att få antingen ikosapentetyl eller placebo (som 4 kapslar dagligen). Mediantiden för uppföljningen var 4,9 år. Vitalvärdena följdes upp hos sammanlagt 99,8 % av patienterna fram till studiens slut eller deras död.
Baslinjeegenskaperna var jämförbara hos grupperna; medianåldern vid baslinjen var 64 år, (mellan 44 år och 92 år), där 46 % var minst 65 år; 28,8 % var kvinnor. Studiepopulationen var 90,2 % kaukasier, 5,5 % asiater, 4,2 % identifierade sig som latinamerikaner och 1,9 % var svarta. Vad gäller tidigare diagnoser för kardiovaskulär sjukdom, hade 46,7 % tidigare haft hjärtinfarkt, 9,2 % hade symtomatisk perifer arteriell sjukdom och 6,1 % tidigare okänd stroke eller transitorisk ischemisk attack (TIA). Utvalda ytterligare riskfaktorer vid baslinje omfattade hypertoni (86,6 %), diabetes mellitus (0,7 % typ 1; 57,8 % typ 2), eGFR < 60 ml/min per 1,73 m2 (22,2 %), kronisk hjärtinsufficiens (17,7 %) och pågående daglig cigarettrökning (15,2 %). De flesta av patienterna tog måttligt intensiv (63 %) eller högintensiv (31 %) statinbehandling vid baslinjen. De flesta av patienterna tog minst ytterligare ett kardiovaskulärt läkemedel, inklusive trombocytaggregationshämmare och/eller antitrombotiska medel (85,5 %), betablockerare (70,7 %), blodtryckssänkande läkemedel (95,2 %), ACE (angiotensin converting enzyme)‑hämmare (51,9 %) eller angiotensinreceptorblockerare (ARB; 26,9 %); 77,5 % tog en ACE‑hämmare eller ARB vid baslinjen. Protokollet exkluderade patienter som tog PCSK9‑hämmare. Vid stabil bakgrundsbehandling med lipidsänkande medel var medianen för [Q1, Q3] LDL‑C vid baslinjen 1,9 [1,6; 2,3] mmol/l (75 [62; 89] mg/dl); genomsnittet (SD) var 2 (0,5) mmol/l (76,2 [20,3] mg/dl). Vid stabil bakgrundsbehandling med lipidsänkande medel var medianen för [Q1, Q3] faste‑TG 2,4 [2; 3,1] mmol/l (216 [176; 272,5] mg/dl); genomsnittet (SD) var 2,6 (0,9) mmol/l (233,2 [80,1] mg/dl).
Ikosapentetyl minskade signifikant risken för det primära sammansatta effektmåttet (tid till första uppkomst av kardiovaskulär död, hjärtinfarkt, stroke, koronar revaskularisering eller sjukhusvistelse för instabil angina; p < 0,0001) och det huvudsakliga sekundära sammansatta effektmåttet (tid till första förekomst av kardiovaskulär död, hjärtinfarkt eller stroke; p < 0,0001). Resultaten för de primära och sekundär effektmåtten visas i tabell 2. Kaplan‑Meierberäkningarna för den kumulativa incidensen av det huvudsakliga sekundära sammansatta effektmåttet över tid visas i figur 1.
Tabell 2 Effekten av ikosapentetyl med avseende på tid till första uppkomst av kardiovaskulära händelser hos patienter med förhöjda triglyceridnivåer och kardiovaskulär sjukdom eller diabetes och andra riskfaktorer i REDUCE-IT
| Ikosapentetyl | Placebo | Ikosapentetyl jämfört med placebo | |
| N = 4 089 n (%) | N = 4 090 n (%) | Riskkvot (95 % CI) | |
| Primärt sammansatt effektmått | |||
| Kardiovaskulär död, hjärtinfarkt, stroke, koronar revaskularisering, sjukhusvistelse för instabil angina (5‑point MACE) | 705 (17,2) | 901 (22) | 0,75 (0,68; 0,83) |
| Huvudsakligt sekundärt sammansatt effektmått | |||
| Kardiovaskulär död, hjärtinfarkt, stroke (3‑point MACE) | 459 (11,2) | 606 (14,8) | 0,74 (0,65; 0,83) |
| Andra sekundära effektmått | |||
| Kardiovaskulär död1 | 174 (4,3) | 213 (5,2) | 0,80 (0,66; 0,98) |
| Död oberoende av orsak2 | 274 (6,7) | 310 (7,6) | 0,87 (0,74; 1,02) |
| Fatal eller icke‑fatal hjärtinfarkt | 250 (6,1) | 355 (8,7) | 0,69 (0,58; 0,81) |
| Fatal eller icke‑fatal stroke | 98 (2,4) | 134 (3,3) | 0,72 (0,55; 0,93) |
| Akut eller brådskande koronar revaskularisering | 216 (5,3) | 321 (7,8) | 0,65 (0,55; 0.78) |
| Koronar revaskularisering3 | 376 (9,2) | 544 (13,3) | 0,66 (0,58; 0,76) |
| Sjukhusvistelse för instabil angina4 | 108 (2,6) | 157 (3,8) | 0,68 (0,53; 0,87) |
1 Kardiovaskulär död inkluderar utvärderade kardiovaskulära dödsfall och dödsfall av okänd orsak.
2 Dödsfall oberoende av orsak, eller total dödlighet är inte en komponent av vare sig det primära sammansatta effektmåttet eller det huvudsakliga sekundära sammansatta effektmåttet.
3 Det fördefinierade sammansatta sekundära effektmåttet inkluderade akut eller brådskande revaskularisering (p < 0,0001); koronara revaskulariseringar är sammansättningen av alla revaskulariseringar och fördefinierades som ett tertiärt effektmått.
4 Fastställt att vara orsakat av myokardischemi enligt invasiva/icke‑invasiva tester och krävde akut sjukhusvistelse.
Figur 1 Incidens av huvudsakligt sekundärt sammansatt effektmått i REDUCE‑IT enligt Kaplan-Meier
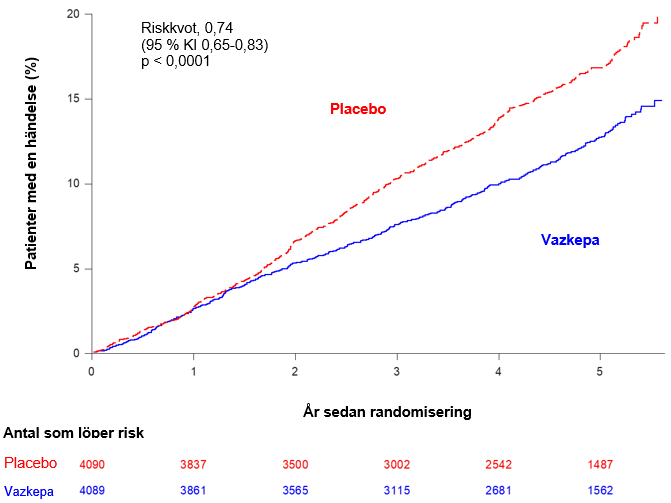
Huvudsakligt sekundärt sammansatt effektmått bestod av kardiovaskulär död, hjärtinfarkt eller stroke (3‑point MACE)
Förkortning: KI konfidensintervall
Medianvärden för TG och baslinjevärdena för LDL‑C var jämförbara mellan ikosapentetylgruppen och placebogruppen. Medianförändringen för TG från baslinjen till år 1 var ‑0,4 mmol/l (‑39 mg/dl, ‑18 %) i ikosapentetylgruppen och 0,1 mmol/l (5 mg/dl, 2 %) i placebogruppen. Medianförändringen för LDL‑C från baslinjen till år 1 var 0,1 mmol/l (2 mg/dl, 3 %) i ikosapentetylgruppen och 0,2 mmol/l (7 mg/dl, 10 %) i placebogruppen. Förspecificerade analyser av effekten av ikosapentetyl på kardiovaskulära resultat i REDUCE‑IT‑studien visade att det förelåg ringa eller ingen korrelation mellan varken TG- eller LDL‑C‑svaret och kardiovaskulär effekt baserat på baslinjenivåer eller nivåer uppnådda under studien för TG eller LDL‑C. Se avsnitt Farmakodynamiska egenskaper verkningsmekanism för mer information.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för ikosapentetyl för alla grupper av den pediatriska populationen för behandling av hypertriglyceridemi och minskning av risken för kardiovaskulära händelser (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Absorption
Efter oral administrering genomgår ikosapentetyl esterhydrolys under absorptionsprocessen och den aktiva metaboliten EPA absorberas i tunntarmen och når systemkretsloppet, huvudsakligen via stora lymfgången i lymfsystemet. Högsta plasmakoncentrationerna av EPA nås cirka 5 timmar efter orala doser av ikosapentetyl.
Ikosapentetyl administrerades med eller efter en måltid i alla kliniska studier; inga kosteffektstudier genomfördes (se avsnitt Dosering och administreringssätt).
Distribution
EPA:s genomsnittliga distributionsvolym vid steady‑state är cirka 88 liter. Huvuddelen av EPA som cirkulerar i plasma införlivas i fosfolipider, triglycerider och kolesterylestrar och < 1 % förekommer i form av den icke‑förestrade fettsyran. Över 99 % av icke‑förestrat EPA är bundet till plasmaproteiner.
Metabolism och eliminering
EPA metaboliseras huvudsakligen i levern via betaoxidation, ungefär som fettsyrorna från maten. Betaoxidation spjälkar EPA:s långa kolkedja till acetylkoenzym A, som omvandlas till energi via citronsyracykeln. Cytokrom P450‑medierad metabolism är en mindre elimineringsväg för EPA. EPA:s totala plasmaclearance vid steady‑state är 684 ml/timme. Halveringstiden för eliminering från plasma (t1/2) för EPA är cirka 89 timmar. Ikosapentetyl utsöndras inte via njurarna.
Farmakokinetiskt/farmakodynamiskt förhållande
Triglyceridnivå och triglyceridminskning vid hypertriglyceridemi
Ett linjärt förhållande mellan EPA‑nivåerna i plasma eller de röda blodkropparna och TG‑minskning observerades i två fas III‑studier.
Minskning av kardiovaskulär risk
Analyser av de primära (5‑point) och huvudsakliga sekundära (3‑point) effektmåtten för MACE tyder på att lipoproteinförändringarna under studien hade begränsad inverkan på kardiovaskulär riskreduktion, medan steady‑state‑nivåerna av EPA i serum under behandlingen svarade för merparten av den relativa riskreduktionen som observerades i REDUCE‑IT. Baslinjenivån av EPA i serum var 26 μg/ml; i jämförelse med de patienter som under behandlingen hade steady‑state‑nivåer av EPA i serum under 100 μg/ml, hade patienterna med EPA‑nivåer ≥ 175 μg/ml under behandlingen en riskreduktion på > 50 % för kardiovaskulär händelse.
Nedsatt njur- och leverfunktion
Farmakokinetiken för ikosapentetyl hos patienter med nedsatt njur- eller leverfunktion har inte studerats. I en välkontrollerad prövning av ikosapentetyl med avseende på kardiovaskulära resultat behövde patienterna ingen rutinmässig dosjustering på grund av sin nedsatta lever- eller njurfunktion.
Andra särskilda populationer
Äldre
Farmakokinetiken för ikosapentetyl hos äldre patienter (≥ 65 år) har inte studerats. I en välkontrollerad klinisk studie av ikosapentetyl behövde äldre patienter inte någon rutinmässig dosjustering.
Pediatrisk population
Farmakokinetiken för ikosapentetyl hos pediatriska patienter har inte studerats.
Prekliniska säkerhetsuppgifter
Gängse studier avseende allmäntoxicitet, gentoxicitet, karcinogenicitet, reproduktionseffekter och effekter på utveckling visade inte några särskilda risker för människa.
Vid de högsta dosnivåerna i reproduktions- och utvecklingsstudierna observerades inga biverkningar hos råtta eller kanin vid cirka 6 till 8 gånger den humanekvivalenta dosen baserat på jämförelse av kroppsyta. I en embryofetal prövning på råtta observerades inga biverkningar vid exponeringar som var 6,9 gånger högre än den kliniska exponeringen (baserat på AUC).
Djurstudier visar att ikosapentetyl passerar placentan och återfinns i fetal plasma.
Djurstudier visar att ikosapentetyl utsöndras i mjölk.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Kapselfyllning
All‑rac‑alfa‑tokoferol
Kapselskal
Gelatin
Glycerol
Maltitol, flytande (E965)
Sorbitol, flytande (icke‑kristalliserande) (E420)
Renat vatten
Sojalecitin
Tryckbläck
Titandioxid
Propylenglykol
Hypromellos
Inkompatibiliteter
Ej relevant.
Hållbarhet
5 år
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Flaska
Tillslut flaskan väl. Fuktkänsligt.
Blister
Förvaras i originalförpackningen. Fuktkänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
VAZKEPA kapseli, pehmeä
998 mg (L:ei) 120 kpl (211,85 €), 360 kpl (3x120) (591,71 €)
PF-selosteen tieto
Flaska
Flaskor av högdensitetspolyetylen (HDPE) med en barnskyddande, värmeförseglad polypropenförslutning innehållande 120 mjuka kapslar.
Förpackningsstorlek med en flaska eller tre flaskor per kartong.
Blister
Perforerade endosblisters av PVC/PCTFE/Al innehållande 4x2 mjuka kapslar.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Avlång, mjuk kapsel, 25 x 10 mm, präglad med ”IPE” med vitt bläck, med ett ljusgult till bärnstensfärgat skal innehållande en färglös till ljusgul vätska.
Särskilda anvisningar för destruktion och övrig hantering
Hur du öppnar flaskan
Tryck ned skruvlocket och vrid det moturs.
Destruktion
Inga särskilda anvisningar för destruktion.
Ersättning
VAZKEPA kapseli, pehmeä
998 mg 120 kpl, 360 kpl
- Alempi erityiskorvaus (65 %). Ikosapenttietyyli: Sydän- ja verisuonitapahtumien riskin vähentämiseen statiinihoitoa saaville aikuisille erityisin edellytyksin (258).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Ikosapenttietyyli: Sydän- ja verisuonitapahtumien riskin vähentämiseen statiinihoitoa saaville aikuisille erityisin edellytyksin (3077).
Atc-kod
C10AX06
Datum för översyn av produktresumén
15.01.2026
Yhteystiedot
Berzelius väg 8
171 65 Solna
Sverige
+46 8 545 802 30
www.recordati.com
