ENGERIX-B injektionsvätska, suspension i förfylld spruta 10 mikrog/0,5 ml
Kvalitativ och kvantitativ sammansättning
1 dos (0,5 ml):
Hepatit B ytantigen1,2 10 mikrogram
1 adsorberat på hydratiserad aluminiumhydroxid totalt 0,25 milligram Al3+
2 producerat i jästceller (Saccharomyces cerevisiae)
med rekombinant DNA-teknik
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsflaska
Injektionsvätska, suspension.
Förfylld spruta
Injektionsvätska, suspension i förfylld spruta.
Kliniska uppgifter
Terapeutiska indikationer
Engerix-B är indicerat för nyfödda, spädbarn, barn och ungdomar i åldern upp till och med 15 år för aktiv immunisering mot hepatit B-virusinfektion (HBV), orsakad av alla kända subtyper hos icke immuna personer. Nationella riktlinjer avgör vilka populationer som ska immuniseras.
Det kan förväntas att hepatit D-infektion också förhindras genom immunisering med Engerix-B eftersom hepatit D (orsakad av delta-agens) inte förekommer i frånvaro av hepatit B-infektion.
Dosering och administreringssätt
Dosering
Dosering
Engerix-B 10 mikrogram/0,5 ml är ämnat för personer upp till och med 15 år, inklusive nyfödda. Engerix-B 20 mikrogram/1 ml är ämnat för personer 16 år och äldre.
Engerix-B 20 mikrogram/1 ml kan även ges till personer från 11 till och med 15 år i ett 2-dosschema under förhållanden där det är låg risk för hepatit B-infektion under vaccinationsprogrammet och när fullföljande av hela vaccinationsschemat kan säkerställas (se avsnitt Farmakodynamiska egenskaper och produktresumén för Engerix-B 20 mikrogram/1 ml).
Primärimmuniseringsscheman
- Personer till och med 15 år:
Två alternativa primärimmuniseringsscheman kan följas:
Ett vaccinationsschema där vaccinationerna ges vid 0, 1 och 6 månader ger optimalt skydd vid månad 7 och producerar höga antikroppskoncentrationer.
Ett accelererat schema, där vaccinationerna ges vid 0, 1 och 2 månader ger ett snabbare skydd och förväntas ge bättre patientföljsamhet. Med detta schema ska en fjärde dos administreras vid 12 månader för att säkerställa långtidsskydd eftersom antikroppskoncentrationerna efter den tredje dosen är lägre än de som uppnås med 0, 1, 6-månadersschemat. Hos spädbarn tillåter detta vaccinationsschema samtidig administrering av hepatit B-vaccin och andra barnvacciner.
Patienter med njurinsufficiens, inklusive patienter som genomgår hemodialys:
Patienter med njurinsufficiens, inklusive patienter som genomgår hemodialys, har nedsatt immunsvar mot hepatit B-vacciner. Antingen kan 0, 1, 2 och 12-månadersshemat eller 0, 1, 6-månadersschemat med Engerix-B 10 mikrogram/0,5 ml användas. Baserat på erfarenheter från vuxna kan vaccinering med en högre dos antigen förbättra immunsvaret. Serologisk provtagning efter vaccineringen ska övervägas. Ytterligare vaccindoser kan behövas för att säkerställa en skyddande anti-HBs-antikroppsnivå som är ≥ 10 IU/l.
Känd eller trolig exponering för HBV:
Under förhållanden där exponering för HBV nyligen har skett (t.ex. nålstick med kontaminerad spruta) kan den första dosen Engerix-B administreras samtidigt med HBIg, men de måste dock ges på skilda injektionsställen (se avsnitt Interaktioner). Schemat med immunisering vid 0, 1, 2 och 12 månader rekommenderas.
Doseringsrekommendation för nyfödda barn till mödrar som är HBV-bärare:
Immunisering med Engerix-B 10 mikrogram/0,5 ml av dessa nyfödda ska påbörjas direkt efter födseln och två alternativa immuniseringsscheman kan följas. Vaccinationsdoserna kan antingen ges enligt 0, 1, 2 och 12-månadersschemat, vilket ger ett snabbare immunsvar, eller enligt 0, 1, och 6-månadersschemat. Om möjligt ska hepatit-B-immunglobulin (HBIg) ges samtidigt med Engerix-B på skilda injektionsställen eftersom detta kan öka den skyddande effekten av vaccinet.
Dessa immuniseringsscheman kan justeras för att överensstämma med lokal immuniseringspraxis när det gäller rekommenderad ålder för administrering av andra barnvacciner.
Boosterdos
Aktuella data ger inget stöd för behovet av boostervaccinering av immunkompetenta individer som har svarat på en full primärimmunisering.
Till patienter med nedsatt immunförsvar (t.ex. patienter med kronisk njursvikt, hemodialyspatienter, hiv-positiva patienter) ska boosterdoser administreras för att säkerställa att anti-HBs-antikroppskoncentrationer som är lika med eller högre än den accepterade skyddande nivån på 10 IU/l upprätthålls. För patienter med nedsatt immunförsvar rekommenderas undersökning av antikroppsnivån var 6:e–12:e månad efter vaccination.
Nationella rekommendationer för boostervaccinering ska beaktas.
Utbytbarhet av hepatit B-vacciner
Se avsnitt Interaktioner.
Administreringssätt
Engerix-B administreras som en intramuskulär injektion i deltoideusregionen hos barn och anterolateralt i låret hos nyfödda, spädbarn och små barn.
I undantagsfall kan vaccinet ges som en subkutan injektion till patienter med trombocytopeni eller blödningsrubbningar.
Kontraindikationer
Engerix-B ska inte ges till personer med känd överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen eller till personer som har visat tecken på överkänslighet efter tidigare administrering av Engerix-B.
I likhet med andra vacciner ska administrering av Engerix-B uppskjutas om patienten lider av akut svår febersjukdom. Lindriga infektioner är dock ingen kontraindikation för immunisering.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Försiktighet vid användning
Synkope (svimning) kan inträffa efter eller till och med före vaccination, framför allt hos ungdomar, som en psykogen reaktion på nålsticket. Detta kan åtföljas av flera neurologiska symtom såsom övergående synrubbning, parestesi och rörelser av tonisk-klonisk typ i extremiteterna under återhämtning. Det är viktigt att rutiner finns på plats för att undvika skador vid svimning.
Engerix-B ska inte ges intraglutealt eller intradermalt eftersom detta kan resultera i ett lägre immunsvar.
Engerix-B får under inga omständigheter ges intravaskulärt.
Som med alla injicerbara vacciner ska lämplig medicinsk behandling alltid finnas i beredskap då sällsynta fall av anafylaktiska reaktioner till följd av administrering av vaccinet kan inträffa.
Skydd På grund av den långa inkubationstiden för hepatit B är det möjligt att en odiagnostiserad hepatit B-infektion kan föreligga vid tidpunkten för immunisering. Det är möjligt att vaccinet inte skyddar mot hepatit B-infektion i sådana fall.
Vaccinet skyddar inte mot infektioner orsakade av andra leverpatogener såsom hepatit A-, hepatit C- och hepatit E-virus.
Som för andra vacciner uppnås inte alltid en skyddande antikroppsnivå hos alla vaccinerade.
Ett antal faktorer har visat sig reducera immunsvaret mot hepatit B-vacciner. Dessa faktorer inkluderar manligt kön, övervikt, rökning, administreringsväg samt vissa kroniska underliggande sjukdomar. Serologisk testning ska övervägas hos de patienter som löper risk att inte uppnå fullgott skydd efter avslutat fullständigt vaccinationsprogram med Engerix-B. Behovet av ytterligare doser ska övervägas för personer som inte svarar eller svarar suboptimalt på vaccinationsprogrammet.
Särskild population
Patienter med kronisk leversjukdom, hiv-infektion eller hepatit C-bärare ska inte undantas från vaccination mot hepatit B. Vaccination kan rekommenderas eftersom hepatit B-infektionen kan vara svår hos dessa patienter. Läkaren ska dock överväga från fall till fall om dessa patienter ska vaccineras mot hepatit B. Hos hiv-infekterade patienter, liksom hos patienter med njurinsufficiens, patienter som genomgår hemodialys och patienter med nedsatt immunförsvar, finns det risk att en adekvat anti-HBs-antikroppskoncentration ej uppnås efter primärimmunisering och dessa patienter kan därför behöva ytterligare vaccindoser.
Prematura spädbarn
Den potentiella risken för apné och behovet av andningsövervakning under 48–72 timmar ska beaktas när den primära vaccinationsserien ges till mycket prematura spädbarn (födda ≤ 28 graviditetsveckor) och särskilt för dem med tidigare känd omogen lungutveckling. Eftersom nyttan med vaccination är hög för denna spädbarnsgrupp ska vaccinationen inte utebli eller skjutas upp.
Natriuminnehåll
Detta vaccin innehåller mindre än 1 mmol (23 mg) natrium, d.v.s. är näst intill ”natriumfritt”.
Interaktioner
Samtidig administrering av Engerix-B och standarddos av HBIg ger inte lägre anti-HBs-antikroppskoncentration förutsatt att administreringen sker på olika injektionsställen.
Engerix-B kan ges samtidigt med Haemophilus influenzae b BCG-, hepatit A-, polio-, mässling-, påssjuke-, röda hund-, difteri-, tetanus- och pertussisvacciner.
Engerix-B kan ges samtidigt med vaccin mot humant papillomvirus (HPV). Samtidig administrering av Engerix-B och Cervarix (HPV-vaccin) visade inte någon kliniskt relevant påverkan på antikroppssvaret mot HPV-antigen. Geometriska medelkoncentrationen för anti-HBs var lägre vid samtidig administrering, men den kliniska signifikansen av detta fynd är inte känd eftersom seroprotektionsfrekvensen inte påverkades. Andelen individer som uppnådde anti-HBs ≥ 10 mIU/ml var 97,9 % vid samtidig vaccination och 100 % då endast Engerix-B administrerades.
Olika injicerbara vacciner ska alltid administreras på olika injektionsställen.
Engerix-B kan användas för att fullfölja primärimmunisering som påbörjats antingen med plasmaderiverat eller annat genetiskt framställt hepatit B-vaccin eller, om så önskas, som boosterdos till individer som tidigare fått primärimmunisering med ett plasmaderiverat eller annat genetiskt framställt hepatit B-vaccin.
Hos patienter som står på immunsuppressiv behandling eller hos patienter med immunbrist, kan kanske inte ett adekvat immunsvar förväntas. (se avsnitt Varningar och försiktighet).
Fertilitet, graviditet och amning
Graviditet
Effekterna av HBsAg på fostrets utveckling har ej fastställts.
Som för alla inaktiverade virala vacciner förväntas inte skador på fostret. Engerix-B ska endast användas under graviditet om absolut nödvändigt och då de förväntade fördelarna överväger de möjliga riskerna för fostret.
Amning
Effekterna på barn som ammas, vars mödrar vaccinerats med Engerix-B har inte utvärderats i kliniska studier eftersom information om utsöndring i bröstmjölk saknas.
Amning är inte en kontraindikation.
Fertilitet
Engerix-B har inte utvärderats i fertilitetsstudier.
Effekter på förmågan att framföra fordon och använda maskiner
Engerix-B har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerhetsprofilen nedan baseras på data från 5 329 patienter i 23 studier.
Nuvarande formulering av Engerix-B innehåller inte tiomersal (en organisk kvicksilverförening). Följande biverkningar har rapporterats efter användning av tidigare formulering med tiomersal och nuvarande tiomersalfria formulering.
I en klinisk studie med den nuvarande tiomersalfria formuleringen var incidensen av smärta, rodnad, svullnad, trötthet, irritabilitet, aptitlöshet och feber jämförbar med den som observerats i kliniska studier som genomförts med tidigare vaccinformulering innehållande tiomersal.
Biverkningstabell
Frekvensen av biverkningar per dos rapporteras enligt följande:
Mycket vanliga: (≥ 1/10)
Vanliga: (≥ 1/100, < 1/10)
Mindre vanliga: (≥ 1/1 000, < 1/100)
Sällsynta: (≥ 1/10 000, < 1/1 000)
Mycket sällsynta: (< 1/10 000)
Organsystem | Frekvens | Biverkning |
Kliniska prövningar | ||
Blodet och lymfsystemet | Sällsynta | Lymfadenopati |
Metabolism och nutrition | Vanliga | Aptitlöshet |
Psykiska störningar | Mycket vanliga | Irritabilitet |
Centrala och perifera nervsystemet | Mycket vanliga | Huvudvärk |
Vanliga | Dåsighet | |
Mindre vanliga | Yrsel | |
Sällsynta | Parestesi | |
Magtarmkanalen | Vanliga | Gastrointestinala symtom (som illamående, kräkningar, diarré, buksmärtor) |
Hud och subkutan vävnad | Sällsynta | Urtikaria, klåda, utslag |
Muskuloskeletala systemet och bindväv | Mindre vanliga | Myalgi |
Sällsynta | Artralgi | |
Allmänna symtom och/eller symtom vid administreringsstället | Mycket vanliga | Smärta och rodnad vid injektionsstället, trötthet |
Vanliga | Feber (≥ 37,5 °C), sjukdomskänsla, svullnad vid injektionsstället, reaktion vid injektionsstället (såsom induration) | |
Mindre vanliga | Influensaliknande sjukdom | |
Data efter marknadsintroduktion | ||
Infektioner och infestationer | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Meningit |
Blodet och lymfsystemet | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Trombocytopeni |
Immunsystemet | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Anafylaxi, allergiska reaktioner inklusive anafylaktoida reaktioner och ett tillstånd som liknar serumsjuka |
Centrala och perifera nervsystemet | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Encefalit, encefalopati, kramper, paralys, neurit (inklusive Guillain-Barrés syndrom, optikusneurit och multipel skleros), neuropati, hypoestesi |
Blodkärl | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Vaskulit, hypotension |
Andningsvägar, bröstkorg och mediastinum | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Apné hos mycket prematura spädbarn (≤ 28 graviditetsveckor) (se avsnitt Varningar och försiktighet). |
Hud och subkutan vävnad | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Erythema multiforme, angioneurotiskt ödem, lichen planus |
Muskuloskeletala systemet och bindväv | Ingen känd frekvens (kan inte beräknas från tillgängliga data) | Artrit, muskelsvaghet |
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-risk förhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Fall av överdosering har rapporterats efter marknadsintroduktion. De biverkningar som rapporterats vid överdosering liknar dem som rapporterats vid rekommenderad dos av vaccinet.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Vaccin mot hepatit B, ATC-kod J07BC01
Verkningsmekanism
Engerix-B inducerar bildandet av specifika humorala antikroppar mot HBsAg (anti-HBs-antikroppar). En anti-HBs-antikroppskoncentration ≥ 10 IU/l skyddar mot HBV-infektion.
Farmakodynamisk effekt
Personer med ökad risk för exponering för HBV:
I fältstudier har en skyddande effekt mellan 95 % och 100 % visats hos nyfödda, barn och vuxna tillhörande riskgrupper.
Hos friska nyfödda till HBeAg positiva mödrar i ett högriskområde har ett 95 % skydd (IgG antikroppstitrar i serum för anti-HBs ≥ 10 mIU/ml) uppnåtts med vaccinering enligt 0, 1, 2 och 12-månaders schemat eller 0, 1 och 6-månaders schemat, då vaccinationsschemat påbörjades vid födseln utan samtidig administrering av hepatit-B-immunglobulin (HBIg). Samtidig administrering av HBIg och vaccin vid födseln ökade den skyddande effekten till 98 %.
Nyfödda barn till mödrar som är bärare av hepatit B virus (HBsAg positiva, med eller utan HBeAg) utan samtidig administrering av HBIg vid födseln fick en påfyllnadsdos av Engerix-B 20 år efter primärvaccinering med 3-dosschemat eller 4-dosschemat.
Graden av serologiskt skydd före och efter en påfyllnadsdos var följande:
Grad av serologiskt skydd | N | n | % | 95 % CI | |
LL | UL | ||||
Innan påfyllnadsdos | 72 | 39 | 54,2 | 42,0 | 66,0 |
Efter påfyllnadsdos | 75 | 74 | 98,7 | 92,8 | 100 |
N = Antal personer för vilka resultat finns tillgängliga
n = Antal personer med en koncentration lika med eller högre än 10 mIU/ml
% = Procentandel personer med en koncentration lika med eller högre än 10 mIU/ml
95 % CI = 95 % konfidensintervall; LL = Lower Limit (lägre gräns), UL = Upper Limit (övre gräns)
Anamnetiska svar har utvärderats med hänsyn tagen till serostatus innan påfyllnadsdosen:
Anamnetiskt svar | |||||
95 % CI | |||||
Innan påfyllnadsdos: | N | n | % | LL | UL |
Personer med < 10 mIU/ml | 33 | 31 | 93,9 | 79,8 | 99,3 |
Personer med ≥ 10 mIU/ml | 39 | 39 | 100 | 91,0 | 100 |
Total respons | 72 | 70 | 97,2 | 90,3 | 99,7 |
Stratifiering baserad på senast tillgängliga tidpunkt före påfyllnadsdosen:
- patienter med < 10 mIU/ml = patienter med antikroppskoncentration < 10 mIU/ml före påfyllnadsdosen
- patienter med ≥ 10 mIU/ml = patienter med antikroppskoncentration ≥ 10 mIU/ml före påfyllnadsdosen
Anamnetiskt svar definieras som:
- anti-HBs-antikroppskoncentration ≥ 10 mIU/ml hos personer som var seronegativa före påfyllnadsdosen, eller
- minst en 4-faldig ökning av anti-HBs-antikroppskoncentrationen hos personer som var seropositiva före påfyllnadsdosen.
N = Antal personer för vilka resultat finns tillgängliga både före och efter vaccination.
n = Antal responders
% = Procentandel responders
95 % CI = exakt 95 % konfidensintervall; LL = lLower Limit (lägre gräns), UL = Upper Limit (övre gräns)
Allmän pediatrisk population:
- Graden av serologiskt skydd hos personer till och med 15 år:
Tabellen nedan sammanfattar graden av serologiskt skydd (d.v.s. procentandel individer med anti-HBs-antikroppskoncentration ≥ 10 IU/l) som uppnåtts i kliniska studier med olika vaccinationsscheman (se avsnitt Dosering).
Population | Vaccinationsschema | Grad av serologiskt skydd |
Friska personer till och med 15 år | 0, 1, 6 månader
0, 1, 2–12 månader | vid månad 7: ≥ 96 %
vid månad 1: 15 % vid månad 3: 89 % vid månad 13: 95,8 % |
Tabellen baseras på data som tagits fram med vaccin som innehåller tiomersal. I två ytterligare kliniska studier som gjorts med den nuvarande tiomersalfria formuleringen på friska barn och vuxna uppnåddes en liknande grad av serologiskt skydd som med tidigare vaccinformulering innehållande tiomersal.
- Immunsvarets varaktighet hos personer från 11 till och med 15 år:
Det långsiktiga immunsvaret bedömdes i en klinisk prövning på personer i åldern 11 till och med 15 år vid tiden för primärvaccinering. Graden av serologiskt skydd (d v s procentandel personer med anti-HBs-antikroppskoncentration ≥10 mIE/ml) som uppnåtts i en jämförande studie för de två olika doserna och schemana utvärderades upp till 66 månader efter den första dosen vid primärvaccinering och visas i tabellen nedan (ATP-kohort avseende effekt):
Antal månader efter första vaccindosen | |||||||
Vaccinationsschema | 2 | 6 | 7 | 30 | 42 | 54 | 66 |
Grad av serologiskt skydd | |||||||
Engerix-B 10 mikrogram/0,5 ml (0, 1, 6 månader) | 55,8 | 87,6 | 98,2* | 96,9 | 92,5 | 94,7 | 91,4 |
Engerix-B 20 mikrogram/1 ml (0, 6 månader) | 11,3 | 26,4 | 96,7* | 87,1 | 83,7 | 84,4 | 79,5 |
* Vid månad 7 utvecklade 97,3 % respektive 88,8 % av personerna i åldrarna 11 till 15 år som vaccinerats med Engerix-B 10 mikrogram/0,5 ml injektionsvätska (0, 1, 6-månadersschema) respektive Engerix-B 20 mikrogram/1 ml injektionsvätska (0, 6-månadersschema) anti-HBs-antikroppskoncentrationer ≥ 100 mIU/ml. Geometriska medelkoncentrationerna (GMC) var 7 238 mIU/ml respektive 2 739 mIU/ml.
Samtliga personer i båda vaccingrupperna (N=74) gavs en påfyllnadsdos 72 till 78 månader efter primärimmunisering. En månad senare sågs, hos samtliga personer, ett anamnestiskt immunsvar med en 108- och 95-faldig ökning av antikroppsnivåerna efter påfyllnadsdosen för 2-dos- respektive 3-dosschemat för primärimmunisering och således uppnåddes seroprotektion. Dessa data tyder på att ett immunologiskt minne inducerats hos samtliga personer som erhållit primärimmunisering, även hos dem som inte uppnådde seroprotektion vid månad 66.
- Immunsvarets varaktighet och påfyllnadsdos hos personer i åldern 15 till 16 år, 14 år efter primärvaccineringen:
Graden av serologiskt skydd före och efter en påfyllnadsdos har utvärderats för personer i åldern 15 till 16 år som vaccinerats med 3 doser Engerix-B under de två första levnadsåren:
Grad av serologiskt skydd | N | n | % | 95 % CI | |
LL | UL | ||||
Innan påfyllnadsdos | 292 | 191 | 65,4 | 59,6 | 70,9 |
Efter påfyllnadsdos | 292 | 286 | 97,9 | 95,6 | 99,2 |
N = antal personer för vilka resultat finns tillgängliga
n = antal personer med en koncentration lika med eller högre än 10 mIE/ml
% = procentandel personer med en koncentration lika med eller högre än 10 mIE/ml
95 % CI = 95 % konfidensintervall; LL = Lower Limit (lägre gräns), UL = Upper Limit (övre gräns)
Efter påfyllnadsdosen = en månad efter påfyllnadsdosen
Anamnetiskt immunsvar har utvärderats med hänsyn tagen till serostat innan påfyllnadsdos för personer i åldern 15 till 16 år som vaccinerats med 3 doser Engerix-B under de två första levnadsåren:
Anamnestiskt svar | |||||
95 % CI | |||||
Innan påfyllnadsdos status | N | n | % | LL | UL |
Personer < 10 mIE/ml | 101 | 95 | 94,1 | 87,5 | 97,8 |
Personer ≥ 10 mIE/ml | 190 | 187 | 98,4 | 95,5 | 99,7 |
Totalt | 291 | 282 | 96,9 | 94,2 | 98,6 |
Stratifiering baserad på senast tillgängliga tidpunkt före boosterdos:
- patienter < 10 mIE/ml = patienter med antikroppskoncentration < 10 mIE/ml före påfyllnadsdosen
- patienter ≥ 10 mIE/ml = patienter med antikroppskoncentration ≥10 mIE/ml före påfyllnadsdosen
Anamnetiskt immunsvar definieras som:
- anti-HBs-antikroppskoncentration ≥ 10 mIE/ml hos personer som var seronegativa före påfyllnadsdosen, eller
- minst en 4-faldig ökning av anti-HBs-antikroppskoncentrationen hos personer som var seropositiva före påfyllnadsdosen.
N = antal personer för vilka resultat finns tillgängliga både före (pre-) och efter (post-) vaccination.
n = antal responders
% = procentandel responders
95 % CI = exakt 95 % konfidensintervall; LL = lower limit (lägre gräns), UL = upper limit(övre gräns)
Studiens primära effektmått, definierat som procentandelen personer med anti-HBs-antikroppskoncentrationer ≥ 100 mIE/mL en månad efter påfyllnadsdosen beräknades till 90,8 % (95 % CI: 86,8; 93,8). GMC för anti-HBs-antikroppar ökade 156-faldigt (från 26,5 till 4134,9 mIE/ml) som svar på påfyllnadsdosen.
Liknande data avseende graden av serologiskt skydd och anamnestiskt svar erhölls hos personer (N=279) i ålder 12 till 13 år.
Minskad incidens av hepatocellulär cancer hos barn:
Ett klart samband har påvisats mellan hepatit B-infektion och förekomsten av hepatocellulär cancer. Förebyggande av hepatit B genom vaccination resulterar i en minskning av incidensen av hepatocellulär cancer, vilket har observerats i Taiwan hos barn i åldrarna 6–14 år.
Farmakokinetiska egenskaper
Ej relevant.
Prekliniska säkerhetsuppgifter
Prekliniska säkerhetsdata uppfyller kraven från WHO.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Natriumklorid
Dinatriumfosfatdihydrat
Natriumdivätefosfat
Vatten för injektionsvätskor
Inkompatibiliteter
Då blandbarhetsstudier saknas ska detta läkemedel inte blandas med andra läkemedel.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C–8 °C).
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Stabilitetsstudier visar att Engerix-B är stabilt i 3 dagar vid en temperatur på högst 37 °C eller i 7 dagar vid högst 25 °C. Denna information är endast avsedd för hälso- och sjukvårdspersonal ifall vaccinet tillfälligt förvaras utanför kylskåp.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ENGERIX-B injektioneste, suspensio, esitäytetty ruisku
10 mikrog/0,5 ml (L:ei) 0,5 ml (36,49 €)
PF-selosteen tieto
0,5 ml suspension i en förfylld spruta (typ I glas) med en kolvring (butylgummi) och ett gummiskyddslock. Förpackningar om 1 eller 10 med eller utan nålar.
0,5 ml suspension i ett injektionsflaska (typ I glas) med ett gummiskyddslock (butylgummi). Förpackningar om 1, 10 eller 100.
Skyddslocket och gummikolvringen på den förfyllda sprutan och skyddslocket på injektionsflaskan är av syntetiskt gummi.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vit, mjölkaktig suspension.
Särskilda anvisningar för destruktion och övrig hantering
Vid förvaring kan en vit bottensats och en klar färglös supernatant observeras. Efter omskakning är vaccinet en nästan genomskinlig vit suspension.
Vaccinet ska inspekteras visuellt för främmande partiklar och/eller onormalt utseende före administrering. I händelse av att antingen observeras ska vaccinet inte administreras.
Vaccinet ska användas omedelbart efter öppnande.
Instruktioner för den förfyllda sprutan
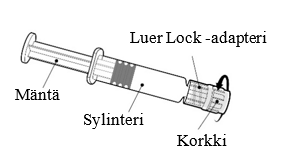 | Håll alltid i sprutcylindern, inte i kolvstången. Skruva av locket på sprutan genom att vrida den motsols. |
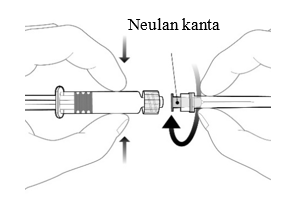 | Fäst nålen på sprutan genom att ansluta den till Luer Lock kopplingen och rotera ett kvarts varv medsols tills du känner att den låser sig. Dra inte ut kolvstången ur sprutcylindern, om detta sker ska vaccinet inte administreras. |
Destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
ENGERIX-B injektioneste, suspensio, esitäytetty ruisku
10 mikrog/0,5 ml 0,5 ml
- Ei korvausta.
Atc-kod
J07BC01
Datum för översyn av produktresumén
15.04.2025
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi
