ORLADEYO kapseli, kova 150 mg
Huomioitavaa
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Jokainen kova kapseli sisältää 150 mg berotralstaattia (dihydrokloridina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kova kapseli (kapseli)
Kliiniset tiedot
Käyttöaiheet
Orladeyo on tarkoitettu perinnöllisen angioödeeman (HAE) toistuvien kohtausten rutiininomaiseen ehkäisemiseen aikuisilla sekä 12-vuotiailla ja sitä vanhemmilla nuorilla potilailla.
Annostus ja antotapa
Annostus
Suositeltu annos aikuisille sekä 12-vuotiaille ja sitä vanhemmille nuorille, joiden paino on ≥ 40 kg, on 150 mg berotralstaattia kerran vuorokaudessa.
Väliin jääneet annokset
Jos berotralstaattiannos on jäänyt väliin, potilaan on otettava unohtunut annos mahdollisimman pian ilman, että vuorokausiannos ylittyy.
Orladeyo-valmistetta ei ole tarkoitettu akuuttien HAE-kohtausten hoitoon (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityispotilasryhmät
Iäkkäät potilaat
Annosta ei ole tarpeen muuttaa yli 65-vuotiailla potilailla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei ole tarpeen muuttaa potilailla, joilla on lievä tai keskivaikea munuaisten vajaatoiminta. Berotralstaatin käyttöä on suositeltavaa välttää potilailla, joilla on vaikea munuaisten vajaatoiminta. Jos hoito on tarpeen, on harkittava asianmukaista seurantaa (esim. EKG) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinistä tietoa berotralstaatin käytöstä hemodialyysiä edellyttävän loppuvaiheen munuaissairauden (ESRD) potilailla ei ole saatavilla. Varotoimena on suositeltavaa välttää berotralstaatin käyttöä ESRD-potilailla (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei ole tarpeen muuttaa potilailla, joilla on lievä maksan vajaatoiminta. Berotralstaatin käyttöä potilailla, joilla on keskivaikea tai vaikea maksan vajaatoiminta (Child-Pugh-luokka B tai C), on vältettävä (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Berotralstaatin turvallisuutta ja tehoa alle 12-vuotiaiden lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Orladeyo otetaan suun kautta. Kapseli voidaan ottaa mihin vuorokauden aikaan tahansa ruoan kanssa (ks. kohta Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Yleistä
Orladeyo-valmistetta ei ole tarkoitettu akuuttien HAE-kohtausten hoitoon, vaan yksilöllinen hoito on aloitettava kohtausten hoitoon hyväksytyllä valmisteella.
Kliinistä tietoa berotralstaatin käytöstä HAE-potilailla, joiden C1-esteraasin estäjän (C1-INH) toiminta on normaalia, ei ole saatavilla.
Tietoa berotralstaatin käytöstä potilailla, joiden paino on alle 40 kg, ei ole saatavilla, ja berotralstaatin käyttöä näillä potilailla on vältettävä.
QT-ajan pidentyminen
QT-ajan pidentymisen kohoamista voidaan mahdollisesti havaita korkeimmilla berotralstaatin pitoisuuksilla (katso kohta Farmakodynamiikka).
Seerumin berotralstaatin pitoisuus potilailla, joilla on keskivaikea tai vaikea maksan vajaatoiminta, voi kohota, mikä on yhdistetty QT-ajan pidentymisen riskiin. Berotralstaatin käyttöä näillä potilailla on vältettävä.
Potilailla, joilla on vakava munuaisten vajaatoiminta, voi olla QT-ajan pidentymisen riski. Berotralstaatin käyttöä näillä potilailla on suositeltavaa välttää. Jos hoito on tarpeen, on harkittava asianmukaista seurantaa (esim. EKG).
Saatavilla ei ole tietoa berotralstaatin käytöstä potilailla, joilla on QT-ajan pidentymisen yksittäisiä riskitekijöitä, kuten elektrolyyttitasapainon häiriöt, jo entuudestaan pidentynyt QT-aika (joko hankittu tai perinnöllinen), ikääntyminen (ks. kohta Annostus ja antotapa) tai muiden sellaisen lääkkeiden samanaikainen käyttö, joiden tiedetään pidentävän QT-aikaa. Berotralstaatin käyttöä näillä potilailla on suositeltavaa välttää. Jos hoito on tarpeen, on harkittava asianmukaista seurantaa (esim. EKG).
Yhteisvaikutukset
Berotralstaatti on P-glykoproteiinin (P-gp) ja rintasyöpäresistenssiproteiinin (BCRP) substraatti.
Muiden lääkevalmisteiden vaikutukset berotralstaattiin
P-gp:n ja BCRP:n estäjät
Siklosporiini, joka on P-gp:n ja BCRP:n estäjä, vähensi yksittäisen berotralstaatin 150 mg:n annoksella mitattua enimmäispitoisuutta (Cmax) 7 prosenttia ja lisäsi berotralstaatin AUC-arvoa 27 prosenttia. Berotralstaattiannosta ei suositella muutettavan, kun P-gp:n ja BCRP:n estäjiä käytetään samanaikaisesti.
P-gp:n ja BCRP:n indusoijat
Berotralstaatti on P-gp:n ja BCRP:n substraatti. P-gp:n ja BCRP:n indusoijat (esim. rifampisiini tai mäkikuisma) voivat vähentää berotralstaatin pitoisuutta plasmassa, mikä johtaa berotralstaatin tehon heikkenemiseen. P-gp:n indusoijien käyttöä ei suositella yhdessä berotralstaatin kanssa.
Berotralstaatin vaikutukset muihin lääkevalmisteisiin
CYP3A4:n substraatit
Berotralstaatti on keskivahva CYP3A4:n estäjä, ja se lisää suun kautta otettavan midatsolaamin Cmax-arvoa 45 prosenttia ja AUC-arvoa 124 prosenttia ja amlodipiinin Cmax-arvoa 45 prosenttia ja AUC-arvoa 77 prosenttia. Samanaikainen antaminen voi lisätä CYP3A4:n substraatteja olevien lääkkeiden pitoisuuksia. Katso valmisteyhteenvedosta samanaikaisesti käytetyt lääkkeet, jotka metaboloituvat pääasiallisesti CYP3A4-entsyymin välityksellä, erityisesti ne, joilla on kapea terapeuttinen indeksi (esim. siklosporiini ja fentanyyli). Näiden lääkkeiden annoksen muuttaminen voi olla tarpeen (ks. kohta Farmakokinetiikka).
CYP2D6:n substraatit
Berotralstaatti on keskivahva CYP2D6:n estäjä, ja se lisää dekstrometorfaanin Cmax-arvoa 196 prosenttia ja AUC-arvoa 177 prosenttia ja desipramiinin Cmax-arvoa 64 prosenttia ja AUC-arvoa 87 prosenttia. Samanaikainen antaminen voi lisätä altistusta CYP2D6:n substraatteja oleville lääkkeille. Katso valmisteyhteenvedosta samanaikaisesti käytetyt lääkkeet, jotka metaboloituvat pääasiallisesti CYP2D6-entsyymin välityksellä, erityisesti ne, joilla on kapea terapeuttinen indeksi (esim. tioridatsiini ja pimotsidi) tai joiden valmisteyhteenvedossa suositellaan vasteen seurantaa (esim. trisykliset masennuslääkkeet). Näiden lääkkeiden annoksen muuttaminen saattaa olla tarpeen (ks. kohta Farmakokinetiikka).
CYP2C9:n substraatit
Berotralstaatti on heikko CYP2C9:n estäjä, ja se lisää tolbutamidin Cmax-arvoa 19 prosenttia ja AUC-arvoa 73 prosenttia. Annoksen muuttamista ei suositella käytettäessä samanaikaisesti lääkkeitä, jotka metaboloituvat pääasiallisesti CYP2C9-entsyymin välityksellä (esim. tolbutamidi) (ks. kohta Farmakokinetiikka).
Berotralstaatilla oli hyvin vähäinen vaikutus desogestreelin konvertoitumiseen etonogestreeliksi (aktiiviseksi metaboliitiksi) CYP2C9-entsyymin välityksellä. Annoksen muuttamista ei suositella käytettäessä samanaikaisesti desogestreeliä.
CYP2C19:n substraatit
Berotralstaatti ei ole CYP2C19:n estäjä, sillä omepratsolin Cmax-arvo kohosi vain 21 prosenttia ja AUC-arvo vain 24 prosenttia. Annoksen muuttamista ei suositella käytettäessä samanaikaisesti lääkkeitä, jotka metaboloituvat pääasiallisesti CYP2C19-entsyymin välityksellä (esim. omepratsoli) (ks. kohta Farmakokinetiikka).
P-gp:n substraatit
Berotralstaatti on heikko P-gp:n estäjä, ja se lisäsi P-gp:n substraatin digoksiinin Cmax-arvoa 58 prosenttia ja AUC-arvoa 48 prosenttia. Katso valmisteyhteenvedosta samanaikaisesti käytetyt lääkkeet, jotka ovat P-gp:n substraatteja, erityisesti ne, joilla on kapea terapeuttinen indeksi (esim. digoksiini) tai joiden valmisteyhteenvedossa suositellaan vasteen seurantaa (esim. dabigatraani). Näiden lääkkeiden annoksen muuttaminen saattaa olla tarpeen (ks. kohta Farmakokinetiikka).
Ehkäisypillerit
Koska berotralstaatti on keskivahva CYP3A4:n estäjä, se voi lisätä CYP3A4-entsyymin välityksellä metaboloituvien ehkäisypillereiden pitoisuuksia. Berotralstaatin antaminen samanaikaisesti desogestreelin kanssa suurensi etonogestreelin (aktiivisen metaboliitin) AUC-arvoa 58 % mutta ei vaikuttanut Cmax-arvoon. Berotralstaatilla oli hyvin vähäinen vaikutus desogestreelin konvertoitumiseen etonogestreeliksi CYP2C9-entsyymin välityksellä. Annoksen muuttamista ei suositella käytettäessä samanaikaisesti desogestreeliä.
Raskaus ja imetys
Naisten, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä berotralstaattihoidon aikana ja vähintään yhden kuukauden ajan hoidon päättymisen jälkeen. Berotralstaattia ei suositella naisille, jotka voivat tulla raskaaksi mutta eivät käytä ehkäisyä.
Raskaus
Berotralstaatin käytöstä raskaana olevilla naisilla ei ole tietoja tai niitä on vain vähän. Eläimillä tehdyistä tutkimusta saadut tiedot eivät riitä lisääntymistoksisuuden selvittämiseen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Berotralstaatin käyttöä ei suositella raskauden aikana.
Imetys
Saatavissa olevat farmakokineettiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet berotralstaatin erittyvän rintamaitoon (ks. kohta Prekliiniset tiedot turvallisuudesta).
Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois.
On päätettävä, lopetetaanko imetys vai pidättäydytäänkö Orladeyo-hoidosta, ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Eläinkokeissa ei havaittu vaikutusta hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Orladeyo-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset ovat vatsakipu (koko vatsan alueella) (ilmoitusten mukaan 21 %:lla potilaista), ripuli (15 %:lla potilaista) ja päänsärky (13 %:lla potilaista). Ruoansulatuselimistöön liittyvistä tapahtumista ilmoitettiin pääasiassa, kun Orladeyo-valmistetta oli käytetty ensimmäiset 1‑3 kuukautta (alkamisen mediaanipäivä vatsakivulle oli päivä 66 ja ripulille päivä 45), ja ne hävisivät ilman lääkehoitoa, kun Orladeyo-hoitoa jatkettiin. Lähes kaikki vatsakiputapahtumat (99 %) olivat lieviä tai keskivaikeita, ja niiden mediaanikesto oli 3,5 päivää (95 %, CI 2–8 päivää). Lähes kaikki ripulitapahtumat (98 %) olivat lieviä tai keskivaikeita, ja niiden mediaanikesto oli 3,2 päivää (95 %, CI 2–8 päivää).
Haittavaikutustaulukko
Orladeyo-valmisteen turvallisuus on arvioitu (sekä kontrolloimattomissa avoimissa että lumekontrolloiduissa sokkoutetuissa) pitkäaikaisissa kliinisissä tutkimuksissa 381 HAE-potilaalla. Kliinisissä tutkimuksissa ja markkinoille tulon jälkeen todetut haittavaikutukset on lueteltu seuraavassa taulukossa MedDRA:n elinluokan ja yleisyyden mukaan. Haittavaikutusten yleisyys määritellään seuraavasti: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000), hyvin harvinaiset (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1: Kliinisissä tutkimuksissa ja markkinoille tulon jälkeen todetut haittavaikutukset
| Elinluokka | Yleisyys | Haittavaikutukset |
| Hermosto | Hyvin yleinen | Päänsärkya |
| Ruoansulatuselimistö | Hyvin yleinen | Vatsakipub, ripulic |
| Yleinen | Oksentelu, gastroesofageaalinen refluksi, ilmavaivat | |
| Tuntematon | Pahoinvointi | |
| Iho ja ihonalainen kudos | Yleinen | Ihottuma |
| Tutkimuksetd | Yleinen | Kohonnut ALT, kohonnut AST |
a Sisältää tapahtumat päänsärky, poskiontelopäänsärky
b Sisältää tapahtumat vatsakipu, vatsavaiva, ylävatsakipu, alavatsakipu, epigastrinen vaiva, vatsan arkuus
c Sisältää tapahtumat ripuli, pehmeä uloste, tiheä ulostustarve
d Maksa-arvojen nousua, joka yleisesti pysähtyi sekä berotralstaatin käytön lopettamisella että jatkamisella, todettiin joillakin potilailla, eritoten niillä, jotka lopettivat androgeenihoidon 14 päivän kuluessa Orladeyo-hoidon aloittamisesta. Androgeenien äkillistä lopettamista heti Orladeyo-hoidon aloittamisen jälkeen on vältettävä.
Pediatriset potilaat
Orladeyo-valmisteen turvallisuutta arvioitiin kliinisissä tutkimuksissa alaryhmässä, jossa oli 28 nuorta potilasta, joiden ikä oli 12–< 18 vuotta ja paino vähintään 40 kg. Turvallisuusprofiili vastasi aikuisissa todettua.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostustapauksista ei ole ilmoitettu kliinisissä tutkimuksissa. Tietoja ei ole saatavilla mahdollisten yliannostuksen merkkien ja oireiden tunnistamiseksi. Jos oireita esiintyy, oireenmukaista hoitoa suositellaan. Vastalääkettä ei ole saatavilla.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: muut hematologiset valmisteet, perinnöllisen angioödeeman hoitoon käytettävät lääkkeet, ATC-koodi: B06AC06
Vaikutusmekanismi
Berotralstaatti on plasmakallikreiinin estäjä. Plasmakallikreiini on seriiniproteaasi, joka pilkkoo korkeamolekyylipainoista kininogeenia (HMWK) vapauttaen bradykiniiniä, joka laajentaa verisuonia voimakkaasti ja lisää verisuonten läpäisevyyttä. C1-INH-entsyymin puuttumisen tai toimintahäiriön vuoksi HAE-potilaiden plasmakallikreiinin normaali sääntely on heikentynyt, mikä johtaa plasmakallikreiinin toiminnan ja bradykiniinin vapautumisen kontrolloimattomaan lisääntymiseen, mikä puolestaan aiheuttaa turvotusta aiheuttavia HAE-kohtauksia (angioödeema).
Sydämen sähköfysiologia
Kun berotralstaatin Cmax-arvo oli vakaassa tilassa kerran vuorokaudessa annetulla 150 mg:n suositellulla annoksella, korjattu QT-ajan keskiarvo kohosi 3,4 ms (90 % CI:n yläraja 6,8 ms), mikä on alle huolestuttavana pidetyn 10 ms:n rajan. Kerran vuorokaudessa annetulla 450 mg:n supraterapeuttisella annoksella vakaassa tilassa mitatut altistukset olivat nelinkertaisesti suurempia kuin suositellulla 150 mg:n annoksella, ja korjattu QT-aika piteni keskimäärin 21,9 ms.
Kliininen teho ja turvallisuus
Berotralstaatin tehoa tutkittiin satunnaistetussa kaksoissokkoutetussa lumekontrolloidussa rinnakkaisryhmillä toteutetussa monikeskustutkimuksessa NCT 03485911.
Tutkimus NCT 03485911
Tutkimukseen osallistui 120 potilasta (114 aikuista ja 6 vähintään 12-vuotiasta lasta), joilla on tyypin I tai II HAE ja joilla oli ollut vähintään kaksi tutkijan vahvistamaa kohtausta aloitusvaiheen ensimmäisten 8 viikon aikana ja jotka saivat vähintään yhden tutkimushoitoannoksen. Potilaista yhdeksän olivat iältään ≥ 65-vuotiaita. Potilaat satunnaistettiin yhteen kolmesta rinnakkaisesta hoitoryhmästä, jotka oli ryhmitelty lähtötilanteen kohtausten lukumäärän mukaan suhteessa 1:1:1 (berotralstaatti 110 mg, berotralstaatti 150 mg tai lumelääke suun kautta kerran vuorokaudessa ruoan kanssa), 24 viikon hoitojakson ajaksi.
Yhteensä 81 potilasta sai vähintään yhden annoksen berotralstaattia 24 viikon hoitojakson aikana. Potilaista 66 % oli naisia ja 93 % valkoihoisia. Potilaiden keski-ikä oli 41,6 vuotta. Potilaista 74 %:lla oli ollut aiemmin kurkunpään angioödeemakohtauksia, ja 75 % ilmoitti käyttäneensä aiemmin pitkäaikaista estolääkitystä. Kohtausmäärien mediaani mahdollisen aloitusvaiheen aikana (lähtötilanteen kohtausten lukumäärä) oli 2,9 kohtausta kuukaudessa. Tutkimukseen osallistuneista potilaista 70 %:lla lähtötilanteen kohtausten lukumäärä oli ≥ 2 kohtausta kuukaudessa.
Potilaat lopettivat muut ennaltaehkäisevät HAE-lääkkeet ennen tutkimukseen osallistumista; kaikki potilaat saivat kuitenkin käyttää kohtauslääkkeitä HAE-läpilyöntikohtausten hoitamiseen.
Berotralstaattia saaneista potilaista 51,4 %:lla läpilyöntikohtauksia hoidettiin C1-INH:lla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). C1-INH:n ja berotralstaatin samanaikainen käyttö ei aiheuttanut tunnistettavia haittavaikutuksia.
Orladeyo 150 mg vähensi HAE-kohtauksia tilastollisesti ja kliinisesti merkittävästi lumelääkkeeseen verrattuna 24 viikon aikana ensisijaisen päätetapahtuman ITT-populaatiossa (intent-to-treat), kuten taulukosta 2 käy ilmi. HAE-kohtausten prosentuaalinen väheneminen oli suurempaa Orladeyo 150 mg -valmisteella lumelääkkeeseen verrattuna huolimatta siitä, miten paljon kohtauksia oli aloitusvaiheen aikana.
Taulukko 2: HAE-kohtausten määrän väheneminen berotralstaatti 150 mg ITT -populaatiossa
| Tulokset | Berotralstaatti 150 mg (n = 40) | Lumelääke (n = 40a) | ||
| Määrä 28 päivän aikana | Prosentuaalinen väheneminen lumelääkkeellä (95 % CI) | p-arvo | Määrä 28 päivän aikana | |
| HAE-kohtausten määrä | 1,31 | 44,2 % (23,0, 59,5) | < 0,001 | 2,35 |
aYksi potilas oli satunnaistettu ITT-analyysissa lumelääkeryhmään, mutta häntä ei hoidettu.
Kohtausmäärät vähenivät 24 viikon ajan, kuten kuvasta 1 käy ilmi.
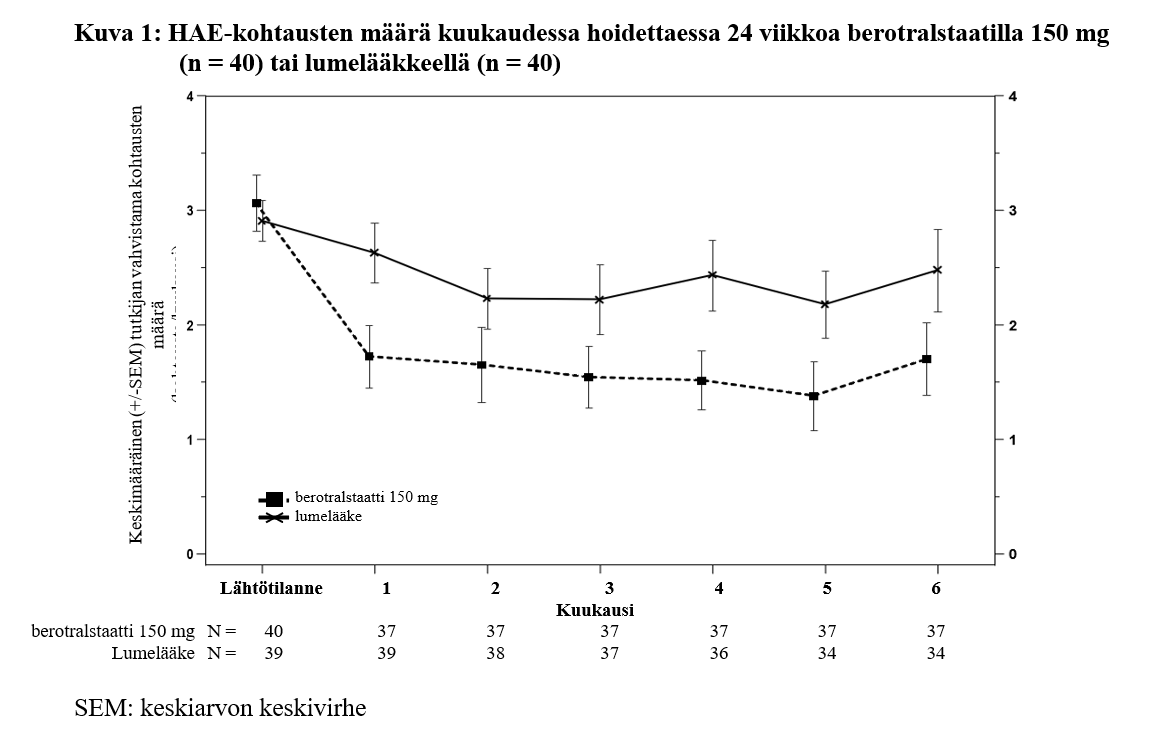
Potilaista, jotka saivat 150 mg berotralstaattia, 58 %:lla HAE-kohtausten määrä väheni ≥ 50 % lähtötilanteeseen verrattuna. Lumelääkettä saaneilla vastaava luku oli 25 %.
Orladeyo 150 mg vähensi sellaisten HAE-kohtausten määrää, jotka vaativat hoitoa tavanomaisilla akuuttien kohtausten hoidoilla, 49,2 % (95 % CI: 25,5 %, 65,4 %) lumelääkkeeseen verrattuna (määrä 28 päivän aikana: 1,04; 2,05).
Terveyteen liittyvä elämänlaatu
Berotralstaattia 150 mg saaneet potilaat kokivat angioödeemaa koskevassa elämänlaatukyselyssä (AE-QoL), että kokonaispistemäärä ja osapistemäärät (toimintakyky, väsymys/mieliala, pelko/häpeä ja ravitsemus) paranivat lumelääkeryhmään verrattuna, kuten taulukosta 3 käy ilmi. Kuuden pisteen vähennys katsotaan kliinisesti merkittäväksi paranemiseksi. Eniten parani toimintakykyä koskeva pistemäärä.
Taulukko 3: Muutos AE-QoL-pisteissä* – berotralstaatti verrattuna lumelääkkeeseen viikolla 24
| LS-keskiarvon muutos (SE) lähtötilanteesta viikolla 24 | LS-keskiarvon muutos lumelääkkeestä (95 % CI) | ||
Berotralstaatti 150 mg | Lumelääke | ||
| AE-QoL-yhteispistemäärä | -14,6 (2,6) | -9,7 (2,6) | -4,90 (‑12,23, 2,43) |
| Toimintakykyä koskeva pistemäärä | -19,5 (3,4) | -10,4 (3,4) | ‑9,10 (‑18,58, 0,38) |
| Väsymystä/mielialaa koskeva pistemäärä | -11,3 (3,2) | -9,2 (3,3) | ‑2,16 (‑11,35, 7,03) |
| Pelkoa/häpeää koskeva pistemäärä | -15,4 (3,2) | -10,5 (3,3) | ‑4,96 (‑14,05, 4,13) |
| Ravitsemusta koskeva pistemäärä | -8,8 (3,0) | -6,1 (3,1) | ‑2,68 (‑11,27, 5,92) |
AE-QoL = angioödeemaa koskeva elämänlaatukysely; CI = luottamusväli; LS = pienin neliösumma; SE = keskivirhe
* Pienet pistemäärät tarkoittavat, että elämänlaatu on parantunut (pienempi häiriö)
Pediatriset potilaat
Orladeyo-valmisteen turvallisuutta ja tehokkuutta arvioitiin kummassakin tutkimuksessa 28 nuorella potilaalla, joiden ikä oli 12 – < 18 vuotta. Turvallisuusprofiili ja kohtausten määrä tutkimuksessa vastasivat aikuisissa todettuja.
Berotralstaatin turvallisuutta ja tehoa alle 12-vuotiailla pediatrisilla potilailla ei ole varmistettu.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Orladeyo-valmisteen käytöstä perinnöllisen angioödeeman hoidossa perinnöllistä angioödeemaan sairastavien potilaiden kohtausten ehkäisemisessä yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Kun berotralstaattia on annettu 150 mg suun kautta kerran vuorokaudessa, Cmax on 158 ng/ml (vaihteluväli: 110–234 ng/ml) ja käyrän alle jäävä alue annosvälin aikana (AUCtau) on 2770 ng*h/ml (vaihteluväli: 1880–3790 ng*h/ml). Berotralstaatin farmakokinetiikka HAE-potilaissa vastaa terveiden henkilöiden farmakokinetiikkaa.
Berotralstaatille altistus (Cmax ja AUC) kasvaa enemmän kuin suhteessa annokseen, ja vakaa tila saavutetaan päivinä 6–12.
Ruoan vaikutus
Berotralstaatin Cmax- ja AUC-arvoissa ei todettu eroja annettaessa runsasrasvaisen aterian yhteydessä. Arvon tmax mediaani viivästyi kuitenkin 3 tuntia, 2 tunnista (paasto) 5 tuntiin (ruoan kanssa, vaihteluväli 1–8 tuntia). Berotralstaatti on annettava ruoan kanssa maha-suolikanavan haittatapahtumien minimoimiseksi.
Jakautuminen
Sitoutuminen plasman proteiineihin on noin 99 %. Yhden radioleimatun 300 mg:n berotralstaattiannoksen jälkeen veren ja plasman suhde oli noin 0,92. Vakaassa tilassa geometrinen keskiarvo (%CV) Vd/F oli 3123 L (40 %) 150 mg:n annoksella berotralstaattia kerran vuorokaudessa.
Biotransformaatio
Berotralstaatti metaboloituu CYP2D6- ja CYP3A4-entsyymien välityksellä hitaasti in vitro. Yhden suun kautta annetun radioleimatun 300 mg:n berotralstaattiannoksen jälkeen berotralstaatin osuus oli 34 % plasman kokonaisradioaktiivisuudesta, ja metaboliitteja oli kahdeksan, joista kunkin osuus kokonaisradioaktiivisuudesta oli 1,8–7,8 %. Näistä kahdeksasta metaboliitista viiden rakenne tiedetään. Ei ole tiedossa, ovatko metaboliitit farmakologisesti aktiivisia.
Berotralstaatti 150 mg annettuna kerran vuorokaudessa on keskivahva CYP2D6:n ja CYP3A4:n estäjä ja heikko CYP2C9:n estäjä. Berotralstaatti ei ole CYP2C19:n estäjä.
Berotralstaatti suositellun annoksen kaksinkertaisella annoksella on heikko P-gp:n estäjä, ja se ei ole BCRP:n estäjä.
Eliminaatio
Yhden 150 mg:n annoksen jälkeen berotralstaatin puoliintumisajan mediaani oli noin 93 tuntia (vaihteluväli: 39–152 tuntia).
Yhden suun kautta annetun radioleimatun 300 mg:n berotralstaattiannoksen jälkeen noin 9 % poistui virtsan mukana (3,4 % muuttumattomana; vaihteluväli 1,8–4,7 %) ja 79 % poistui ulosteen mukana. Lisäanalyysit osoittivat, että noin 50 % ulosteesta löydetystä osuudesta oli muuttumatonta berotralstaattia.
Erityispotilasryhmät
Potilasryhmien farmakokineettiset analyysit osoittivat, että ikä, sukupuoli ja rotu eivät vaikuttaneet merkittävästi berotralstaatin farmakokinetiikkaan. Kehonpaino todettiin kovariaatiksi, joka kuvaa puhdistuman ja jakautumistilavuuden vaihtelua, mikä johtaa suurempaan altistukseen (AUC ja Cmax) potilailla, jotka painavat vähemmän. Eron ei kuitenkaan katsota olevan kliinisesti merkittävä, eikä annoksen muuttamista suositella näiden demografisten tietojen vuoksi.
Pediatriset potilaat
Sellaisten potilasryhmien farmakokineettisten analyysien perusteella, joihin osallistui 12–< 18-vuotiaita ja vähintään 40 kg painavia pediatrisia potilaita, altistus vakaassa tilassa, kun berotralstaattia annettiin suun kautta 150 mg kerran vuorokaudessa, oli hieman suurempi (29 % suurempi) kuin aikuisten altistus, ja arvioitu geometrinen keskiarvo (CV%) AUCtau oli 2515 (38,6) ng*h/ml. Eron ei kuitenkaan katsota olevan kliinisesti merkittävä, eikä annoksen muuttamista suositella 12–< 18-vuotiaille vähintään 40 kg painaville pediatrisille potilaille.
Munuaisten vajaatoiminta
Yhden suun kautta annettavan 200 mg:n berotralstaattiannoksen farmakokinetiikkaa tutkittiin potilailla, joilla on vakava munuaisten vajaatoiminta (eGFR alle 30 ml/min). Kun tätä verrattiin samanaikaiseen kohorttiin, jonka munuaisten toiminta oli normaali (eGFR yli 90 ml/min), Cmax-arvo kohosi 39 %. AUC-arvossa ei todettu eroa. Annosta ei ole tarpeen muuttaa potilailla, joilla on lievä tai keskivaikea munuaisten vajaatoiminta. Potilailla, joilla on vakava munuaisten vajaatoiminta, voi olla QT-ajan pidentymisen riski. Berotralstaatin käyttöä näillä potilailla on suositeltavaa välttää.
Berotralstaatin farmakokinetiikkaa potilailla, joiden munuaissairaus edellyttää hemodialyysiä, ei ole tutkittu. Koska berotralstaatin sitoutuminen plasman proteiineihin on suurta, on epätodennäköistä, että se puhdistuisi hemodialyysillä.
Maksan vajaatoiminta
Yhden suun kautta annettavan 150 mg:n berotralstaattiannoksen farmakokinetiikkaa tutkittiin potilailla, joilla oli lievä, keskivaikea tai vakava maksan vajaatoiminta (Child-Pugh-luokka A, B tai C). Berotralstaatin farmakokinetiikka oli muuttumaton potilailla, joilla oli lievä maksan vajaatoiminta, verrattuna potilaisiin, joilla maksan toiminta oli normaali. Potilailla, joilla oli keskivaikea maksan vajaatoiminta, Cmax-arvo kohosi 77 % ja AUC0-inf-arvo 78 %. Potilailla, joilla oli vaikea maksan vajaatoiminta, Cmax-arvo kohosi 27 % ja AUC0-inf-arvo pieneni 6 %. QTcF-ajan keskiarvon arvioitu piteneminen potilailla, joilla oli keskivaikea tai vaikea maksan vajaatoiminta, oli enintään 8,8 ms (kaksipuolisen 90 %:n suurin arvo 13,1 ms). Berotralstaatin käyttöä potilailla, joilla on keskivaikea tai vaikea maksan vajaatoiminta (Child-Pugh-luokka B tai C), on vältettävä.
Iäkkäät potilaat
Berotralstaattia ei ole tutkittu yli 75-vuotiailla potilailla. Iän ei kuitenkaan odoteta vaikuttavan berotralstaatin altistukseen.
Prekliiniset tiedot turvallisuudesta
Ei-kliinisissä toistuvien annosten kroonisissa toksisuustutkimuksissa rottien maksassa todettiin (elektronimikroskoopin avulla) fosfolipidoosia (vaahtomaisten vakuoleja sisältävien makrofagien esiintymiä), ja niitä epäiltiin esiintyvän rottien ja apinoiden maksassa, ohutsuolessa, keuhkoissa, pernassa ja imukudoksissa kliinisesti merkittävillä altistuksilla. Näiden löydösten kliinistä merkitystä ei tiedetä.
Rotilla tehdyssä kaksivuotisessa (elinikäisessä) tutkimuksessa havaittiin luustolihassyiden rappeumaa/kuoliota. Altistus tasolla, jolla ei ole havaittu haittavaikutuksia (NOAEL), oli näiden löydösten osalta rotilla 4,5-kertainen verrattuna altistukseen, joka saavutettiin (AUC-arvon perusteella) kliinisellä 150 mg:n berotralstaattiannoksella.
Genotoksisuutta koskevien konventionaalisten tutkimusten ei-kliiniset tiedot eivät viittaa erityiseen vaaraan ihmisillä.
Kasvainten määrä ei lisääntynyt Tg rasH2 -transgeenisillä hiirillä tehdyssä kuuden kuukauden tutkimuksessa. Altistus tässä hiirillä tehdyssä karsinogeenisessä tutkimuksessa oli 10-kertainen verrattuna altistukseen, joka saavutettiin (AUC-arvon perusteella) kliinisellä 150 mg:n berotralstaattiannoksella.
Harvinaisia pahanlaatuisia kohdun limakalvon sarkoomia ja ihon erilaistumattomia sarkoomia havaittiin rotilla tehdyssä kaksivuotisessa (elinikäisessä) tutkimuksessa, jossa rotille annettu berotralstaatin altistus oli 4,5-kertainen verrattuna altistukseen, joka saavutettiin (AUC-arvon perusteella) kliinisellä 150 mg:n berotralstaattiannoksella. Nämä löydökset eivät ole vakuuttavia, ja esiintyvyys on hieman suurempi kuin vertailuryhmissä. Näiden löydösten kliinistä merkitystä ei tiedetä.
Berotralstaatti läpäisi veri-istukkaesteen rotilla ja kaneilla. Tiineillä rotilla tehdyssä alkion- ja sikiönkehitystutkimuksessa, jossa annettu berotralstaatin altistus oli 9,7-kertainen verrattuna altistukseen, joka saavutettiin (AUC-arvon perusteella) kliinisellä 150 mg:n berotralstaattiannoksella, ei havaittu haittaa kehittyvälle sikiölle. Toista alkion- ja sikiönkehitystutkimusta muilla kuin jyrsijöillä ei tehty.
Berotralstaattia havaittiin rotanpoikasten plasmassa 14. imetyspäivänä, ja sen pitoisuus oli noin 5 % emon plasman lääkepitoisuudesta.
Berotralstaatilla ei ollut vaikutusta uros- ja naarasrottien paritteluun tai hedelmällisyyteen annoksella, joka oli 2,9-kertainen verrattuna kliiniseen 150 mg:n berotralstaattiannokseen mg/m2-arvon perusteella.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Krospovidoni (tyyppi A)
Magnesiumstearaatti
Kolloidinen vedetön piidioksidi
Esigelatinoitu tärkkelys
Kapselin kuori
Liivate
Titaanidioksidi (E171)
Indigokarmiini (E132)
Musta rautaoksidi (E172)
Punainen rautaoksidi (E172)
Painoväri
Musta rautaoksidi (E172)
Kaliumhydroksidi
Sellakka
Propyleeniglykoli (E1520)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ORLADEYO kapseli, kova
150 mg (L:ei) 28 fol (12529,40 €)
PF-selosteen tieto
PCTFE/PVC-alumiiniläpipainopakkaukset kartonkikotelossa; läpipainopakkauksessa on 7 kapselia
Pakkauskoko: 28 tai 98 kovaa kapselia
Valmisteen kuvaus:
Kapseli (19,4 mm × 6,9 mm) on valkoinen ja läpinäkymätön, ja siihen on painettu merkintä ”150”. Sen korkki on vaaleansininen ja läpinäkymätön, ja siihen on painettu merkintä ”BCX”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ORLADEYO kapseli, kova
150 mg 28 fol
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Berotralsaatti, C1-esteraasin estäjä, ikatibantti, konestaatti alfa ja lanadelumabi: Perinnöllisen angioedeemaan (HAE) hoito erityisin edellytyksin (338).
ATC-koodi
B06AC06
Valmisteyhteenvedon muuttamispäivämäärä
19.09.2024
Yhteystiedot
Block 4, Harcourt Centre, Harcourt Road
D02HW77 Dublin 2
Ireland
+353 1 963 1067
enquiries@biocryst.co.uk
Office hours: 9:00-17:00
