BENEPALI injektioneste, liuos, esitäytetty ruisku 25 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Vaikuttavat aineet ja niiden määrät
Jokaisessa esitäytetyssä ruiskussa on 25 mg etanerseptiä.
Etanersepti on ihmisen tuumorinekroositekijän reseptorin p75 Fc-fuusioproteiini, joka tuotetaan yhdistelmä-DNA-tekniikalla kiinanhamsterin munasarjojen (CHO) nisäkäsekspressiojärjestelmässä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste).
Kliiniset tiedot
Käyttöaiheet
Nivelreuma
Benepali yhdessä metotreksaatin kanssa on tarkoitettu aikuispotilaiden keskivaikean ja vaikean, aktiivisen nivelreuman hoitoon silloin, kun vaste antireumaattisiin lääkkeisiin, mukaan lukien metotreksaatti (ellei vasta-aiheinen), on ollut riittämätön.
Benepali-valmistetta voidaan antaa monoterapiana potilaille, jotka eivät siedä metotreksaattia tai joille metotreksaatin jatkuva käyttö ei muutoin sovellu.
Benepali on tarkoitettu myös vaikean, aktiivisen ja progressiivisen nivelreuman hoitoon aikuisille, joita ei aiemmin ole hoidettu metotreksaatilla.
Benepali-valmisteen käytön yksinään tai yhdistettynä metotreksaattiin on röntgenologisesti osoitettu hidastavan nivelvaurioiden kehittymistä ja parantavan fyysistä toimintakykyä.
Juveniili idipaattinen artriitti
Polyartriitin (reumatekijä positiivinen tai negatiivinen) ja laajenevan oligoartriitin hoito vähintään 2‑vuotiailla lapsilla ja nuorilla, joilla vaste metotreksaatille on ollut riittämätön tai jotka eivät ole sietäneet metotreksaattia.
Psoriaasiartriitin hoito vähintään 12‑vuotiailla nuorilla, joilla vaste metotreksaatille on ollut riittämätön tai jotka eivät ole sietäneet metotreksaattia.
Entesiittiin liittyvän artriitin hoito vähintään 12‑vuotiailla nuorilla, joilla vaste konventionaaliselle hoidolle on ollut riittämätön tai jotka eivät ole sietäneet sitä.
Psoriaasiartriitti
Aktiivisen ja progressiivisen psoriaasiartriitin hoitoon aikuisille silloin, kun vaste aiempiin antireumaattisiin lääkkeisiin on ollut riittämätön. Etanerseptin on osoitettu parantavan psoriartriittia sairastavien potilaiden fyysistä toimintakykyä sekä rajoittavan niiden potilaiden perifeerisen nivelvaurion etenemistä (röntgenkuvauksilla mitattuna), joilla on taudin symmetrinen useita niveliä sairastuttava muoto.
Aksiaalinen spondylartriitti
Selkärankareuma
Vaikean aktiivisen ankyloivan spondyliitin (selkärankareuman) hoitoon aikuisille, joiden vaste tavanomaiseen hoitoon on ollut riittämätön.
Aksiaalinen spondylartriitti ilman radiografista näyttöä selkärankareumasta
Vaikean aksiaalisen spondylartriitin (ilman radiografista näyttöä selkärankareumasta, mutta selvät merkit tulehduksesta magneettikuvissa ja/tai kohonnut CRP) hoitoon aikuisille, joille ei ole kehittynyt riittävää vastetta tulehduskipulääkkeille (NSAID).
Läiskäpsoriaasi
Keskivaikean ja vaikean läiskäpsoriaasin hoitoon aikuisille, kun muille systeemisille hoidoille, mukaan lukien siklosporiini-, metotreksaatti- tai psoraleenihoidolle ja UVA‑valo -hoidolle (PUVA), ei ole saatu hoitovastetta tai nämä hoidot ovat vasta-aiheisia tai potilas ei ole niitä sietänyt (ks. kohta Farmakodynamiikka).
Läiskäpsoriaasi lapsilla
Kroonisen vaikean läiskäpsoriaasin hoitoon lapsilla ja nuorilla (6‑vuotiaasta ylöspäin), joilla hoitovaste on ollut riittämätön tai jotka eivät ole sietäneet muita systeemisiä hoitoja tai valohoitoja.
Ehto
Hoito tulee aloittaa ja sitä tulee seurata nivelreuman, juveniilin idiopaattisen artriitin, psoriaasiartriitin, selkärankareuman, aksiaalisen spondylartriitin (ilman radiografista näyttöä selkärankareumasta), läiskäpsoriaasin tai lapsilla esiintyvän läiskäpsoriaasin diagnosointiin ja hoitoon perehtyneen erikoislääkärin valvonnassa.
Annostus ja antotapa
Benepali-hoito on aloitettava ja sitä on seurattava nivelreuman, juveniilin idiopaattisen artriitin, psoriaasiartriitin, selkärankareuman, aksiaalisen spondylartriitin (ilman radiografista näyttöä selkärankareumasta) tai läiskäpsoriaasin tai lapsilla esiintyvän läiskäpsoriaasin diagnosointiin ja hoitoon perehtyneen erikoislääkärin valvonnassa. Benepali-hoitoa saaville potilaille on annettava potilaskortti.
Benepali on saatavana 25 mg:n ja 50 mg:n vahvuuksina.
Annostus
Nivelreuma
Suositusannos on 25 mg etanerseptiä kahdesti viikossa. Vaihtoehtoisesti kerran viikossa annetun 50 mg:n annoksen on osoitettu olevan turvallinen ja tehoava (ks. kohta Farmakodynamiikka).
Psoriaasiartriitti, selkärankareuma ja aksiaalinen spondylartriitti (ilman radiografista näyttöä selkärankareumasta)
Suositusannos on 25 mg etanerseptiä kahdesti viikossa tai 50 mg kerran viikossa.
Kaikissa edellä mainituissa käyttöaiheissa saatavilla olevat tiedot viittaavat siihen, että kliininen vaste saavutetaan yleensä 12 viikon hoidon aikana. Hoidon jatkamista on harkittava huolellisesti, jos potilas ei saa vastetta tänä aikana.
Läiskäpsoriaasi
Suositusannos on 25 mg etanerseptiä kahdesti viikossa tai 50 mg kerran viikossa. Vaihtoehtoisesti voidaan antaa 50 mg kahdesti viikossa 12 viikkoon asti ja tarvittaessa jatkaa tämän jälkeen annostuksella 25 mg kahdesti viikossa tai annostuksella 50 mg kerran viikossa. Benepali-hoitoa jatketaan, kunnes remissio saavutetaan, aina 24 viikkoon asti. Yli 24 viikkoa kestävä hoito saattaa olla tarpeen joillekin aikuisille (ks. kohta Farmakodynamiikka). Hoito on syytä lopettaa potilailla, joilla ei ilmene vastetta 12 viikon kuluttua. Jos Benepali-hoito aloitetaan uudelleen, on syytä noudattaa samaa ohjetta hoidon kestosta. Annoksen pitää olla 25 mg kahdesti viikossa tai 50 mg kerran viikossa.
Erityispotilasryhmät
Munuaisten ja maksan vajaatoiminta
Annoksen muuttaminen ei ole tarpeen.
Iäkkäät
Annoksen muuttaminen ei ole tarpeen. Annostus ja antotapa ovat samat kuin 18–64-vuotiailla aikuisilla.
Pediatriset potilaat
Benepali on saatavana ainoastaan 25 mg:n esitäytetyssä ruiskussa, 50 mg:n esitäytetyssä ruiskussa ja 50 mg:n esitäytetyssä kynässä.
Benepali-valmistetta ei siten ole mahdollista antaa lapsipotilaille, jotka tarvitsevat vähemmän kuin täyden 25 mg:n tai 50 mg:n annoksen. Lapsipotilaille, jotka tarvitsevat jonkin muun annoksen kuin täyden 25 mg:n tai 50 mg:n annoksen, ei pidä antaa Benepali-valmistetta. Jos tarvitaan vaihtoehtoinen annos, on käytettävä muita etenarseptivalmisteita, joista löytyy sopiva vaihtoehto.
Lapsipotilaiden etanerseptiannos määräytyy potilaan painon mukaan. Alle 62,5 kg painaville potilaille annos määritellään tarkasti milligrammoina kiloa kohti, ja antoon käytetään injektiokuiva-ainetta ja liuotinta liuosta varten tai injektiokuiva-ainetta liuosta varten (katso kutakin käyttöaihetta koskevat annostusohjeet jäljestä). Kiinteäannoksista esitäytettyä ruiskua tai esitäytettyä kynää voidaan käyttää potilaille, jotka painavat 62,5 kg tai enemmän..
Etanerseptille turvallisuutta ja tehoa alle 2 vuoden ikäisille lapsille ei ole varmistettu.
Tietoja ei ole saatavilla.
Juveniili idiopaattinen artriitti
Suositusannos on 0,4 mg/kg (enintään 25 mg/annos) kahdesti viikossa ihonalaisesti 3‑4 päivän välein tai 0,8 mg/kg (enintään 50 mg/annos) kerran viikossa. Hoidon keskeyttämistä on harkittava, jos potilaalla ei ilmene vastetta 4 kuukauden kuluttua.
10 mg injektiopullon vahvuus saattaa sopia paremmin alle 25-kiloisille lapsille, jotka sairastavat juveniilia idiopaattista artriittia.
Varsinaisia kliinisiä tutkimuksia ei ole tehty 2‑3 vuoden ikäisillä lapsilla. Potilasrekisterissä on kuitenkin jonkin verran turvallisuutta koskevia tietoja, joiden mukaan turvallisuusprofiili 2‑3-vuotiailla on samanlainen kuin aikuisilla ja yli 4 vuoden ikäisillä lapsilla annettaessa valmistetta
0,8 mg/kg ihon alle kerran viikossa (ks. kohta Farmakodynamiikka).
Etanerseptille ei ylipäänsä ole soveltuvaa käyttöä alle 2‑vuotiaiden lasten juveniilin idiopaattisen artriitin hoidossa.
Läiskäpsoriaasi lapsilla (6-vuotiaasta ylöspäin)
Suositusannos on 0,8 mg/kg (enintään 50 mg/annos) kerran viikossa 24 viikkoon asti. Hoito tulisi lopettaa potilailla, joille vastetta ei ilmene 12 viikon kuluttua.
Jos Benepali-hoito aloitetaan uudelleen, tulee yllä olevaa ohjetta hoidon kestosta noudattaa. Annos tulee olla 0,8 mg/kg (enintään 50 mg/annos) kerran viikossa.
Etanerseptille ei ylipäänsä ole soveltuvaa käyttöä alle 6‑vuotiaiden lasten läiskäpsoriaasin hoidossa.
Antotapa
Benepali on tarkoitettu ihon alle (ks. kohta Käyttö- ja käsittelyohjeet).
Yksityiskohtaiset ohjeet Benepali-valmisteen antamiseen löytyvät pakkausselosteesta kohdasta 7, ”Käyttöohjeet”.
Tahattomia annostus- ja hoitoaikataulupoikkeamia, mukaan lukien annosten ottamatta jäämistä, koskevat tarkat ohjeet on esitetty pakkausselosteen kohdassa 3.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Sepsis tai sepsisriski.
Benepali-hoitoa ei pidä aloittaa potilaille, joilla on aktiivinen infektio, mukaan lukien krooniset ja paikalliset infektiot.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Infektiot
Potilaiden infektioriskiä on arvioitava ennen Benepali-hoitoa, hoidon aikana ja sen jälkeen, pitäen mielessä, että etanerseptin keskimääräinen eliminaation puoliintumisaika on noin 70 tuntia (vaihteluväli 7–300 h).
Etanerseptin käytön yhteydessä on ilmoitettu vakavia infektiotapauksia, sepsistä, tuberkuloosia ja opportunisti-infektioita, mukaan lukien invasiivisia sieni-infektioita, listerioosia ja legionelloosia (ks. kohta Haittavaikutukset). Infektiot olivat bakteerien, mykobakteerien, sienten, virusten tai parasiittien (kuten alkueläimen) aiheuttamia. Joissakin tapauksissa tiettyjä sieni- tai opportunisti-infektioita ei tunnistettu. Tämä johti hoidon aloituksen viivästymiseen ja joissakin tapauksissa kuolemaan. Kun potilaan infektiostatusta arvioidaan, lääkärin on otettava huomioon myös mahdollisten opportunisti-infektioiden riski (esim. altistus endeemisille mykooseille).
Potilaita, jotka saavat uuden infektion Benepali-hoidon aikana, on seurattava tarkasti. Benepali-valmisteen anto on keskeytettävä, jos potilaalle kehittyy vakava infektio. Etanerseptihoidon turvallisuutta ja tehoa ei ole arvioitu potilailla, joilla on krooninen infektio. Lääkärin on noudatettava erityistä varovaisuutta harkitessaan Benepali-valmisteen käyttöä potilaille, joilla on ollut toistuvia tai kroonisia infektioita tai infektioille altistava perussairaus, kuten pitkälle edennyt tai huonossa hoitotasapainossa oleva diabetes.
Tuberkuloosi
Etanerseptihoitoa saaneilla potilailla on ilmoitettu esiintyneen aktiivista tuberkuloosia, myös miliaarituberkuloosia ja ekstrapulmonaalista tuberkuloosia.
Ennen Benepali-hoidon aloittamista kaikki potilaat on arvioitava sekä aktiivisen että oireettoman (latentin) tuberkuloosin varalta. Arvioinnin yhteydessä on otettava yksityiskohtainen potilasanamneesi, jonka yhteydessä selvitetään potilaan oma tuberkuloosianamneesi, mahdollinen aiempi tuberkuloosialtistus sekä aiempi ja/tai tämänhetkinen immunosuppressiivinen hoito. Kaikille potilaille on tehtävä asianmukaisia seulontatutkimuksia, esim. ihon tuberkuliinitesti ja rintakehän röntgen-kuvaus (mahdollisten paikallisten suositusten mukaisesti). On suositeltavaa merkitä näiden tutkimusten tiedot potilaskorttiin. Väärien negatiivisten tulosten mahdollisuus ihon tuberkuliinitestissä on otettava huomioon, etenkin, jos potilaalla on vaikea sairaus tai hän on immuunipuutteinen.
Jos potilaalla todetaan aktiivinen tuberkuloosi, Benepali-hoitoa ei saa aloittaa. Jos potilaalla todetaan oireeton (latentti) tuberkuloosi, sen hoito tuberkuloosilääkkeillä on aloitettava ennen Benepali-hoidon aloittamista ja paikallisten suositusten mukaisesti. Tällaisissa tapauksissa Benepali-hoidon hyöty-riskisuhdetta on arvioitava hyvin huolellisesti.
Kaikkia potilaita on kehotettava hakeutumaan lääkärin hoitoon, jos heillä ilmenee tuberkuloosiin viittaavia merkkejä tai oireita (esim. pitkittynyt yskä, painon lasku/kuihtuminen, vähäinen lämmönnousu) Benepali-hoidon aikana tai sen jälkeen.
B-hepatiitin uudelleenaktivoituminen
B-hepatiitin uudelleenaktivoitumista on ilmoitettu potilailla, jotka olivat aiemmin saaneet B-hepatiittivirustartunnan ja samanaikaista TNF-salpaajahoitoa, kuten etanerseptihoitoa. Raporttien joukossa oli myös ilmoituksia B-hepatiitin uudelleenaktivoitumisesta potilailla, jotka olivat positiivisia hepatiitti B -viruksen ydinantigeenille (HBcAg), mutta negatiivisia hepatiitti B:n pinta-antigeenille (HBsAg). Potilaat täytyy tutkia B-hepatiitti-infektion varalta ennen Benepali-hoidon aloittamista. Jos potilas todetaan positiiviseksi B-hepatiitti-infektiolle, on suositeltavaa kysyä neuvoa lääkäriltä, jolla on B-hepatiitin hoitoa koskevaa asiantuntemusta. Varovaisuutta on noudatettava, jos Benepali-hoitoa annetaan aiemmin B-hepatiittivirustartunnan saaneille potilaille. Näitä potilaita on seurattava B-hepatiitin aktivoitumisen varalta koko hoidon ajan sekä monen viikon ajan hoidon loppumisen jälkeen. Ei ole olemassa riittävästi tietoja B-hepatiittivirustartunnan saaneiden potilaiden hoidosta samanaikaisella antiviraalisella ja TNF-salpaajahoidolla. B-hepatiitti-infektion kehittävien potilaiden kohdalla täytyy lopettaa Benepali-hoito ja aloittaa tehokas antiviraalinen hoito sekä asianmukainen tukihoito.
C-hepatiitin paheneminen
C-hepatiitin on ilmoitettu pahentuneen etanerseptihoidon aikana. Benepali-valmistetta on käytettävä varoen potilaille, joilla on aikaisemmin ollut C-hepatiittia.
Samanaikainen käyttö anakinran kanssa
Etanerseptin samanaikainen käyttö anakinran kanssa on yhdistetty vakavien infektioiden ja neutropenian lisääntyneeseen riskiin verrattuna pelkän etanerseptin käyttöön. Tämän yhdistelmän käytöllä ei ole havaittu olevan kliinistä lisäetua. Siksi Benepali-valmisteen käyttö yhdessä anakinran kanssa ei ole suositeltavaa (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Samanaikainen käyttö abataseptin kanssa
Kliinisissä tutkimuksissa abataseptin ja etanerseptin samanaikaisen käytön havaittiin lisäävän vakavien haittavaikutusten ilmaantumista. Tämän yhdistelmän käytöllä ei ole havaittu olevan kliinistä lisäetua, joten sen käyttöä ei suositella (ks. kohta Yhteisvaikutukset).
Allergiset reaktiot
Etanerseptin käyttöön liittyvistä allergisista reaktioista on raportoitu yleisesti. Allergisina reaktioina on tavattu angioedeemaa ja urtikariaa; vakavia reaktioita on esiintynyt. Jos potilaalle kehittyy vakava allerginen tai anafylaktinen reaktio, Benepali-hoito on heti keskeytettävä ja asianmukainen hoito aloitettava.
Immunosuppressio
TNF-salpaajahoito, kuten etanerseptihoito, voi vaikuttaa isännän infektioita ja maligniteetteja vastaan suojaaviin puolustusmekanismeihin, koska TNF välittää tulehdusprosesseja ja säätelee soluvälitteistä immuunivastetta. Tutkimuksessa, jossa etanerseptihoitoa annettiin 49 aikuiselle nivelreumapotilaalle, ei havaittu merkkejä viivästyneen yliherkkyyden vähenemisestä, immunoglobuliinipitoisuuksien laskusta eikä efektorisolumäärien muutoksista.
Kahdelle juveniilia idiopaattista artriittia sairastavalle potilaalle kehittyi vesirokkoinfektio ja aseptisen meningiitin merkkejä ja oireita, jotka lievittyivät ilman seurauksia. Jos potilas altistuu merkitsevässä määrin vesirokkovirukselle, Benepali-hoito pitää keskeyttää ja zoster-immunoglobuliiniestohoitoa on harkittava.
Etanerseptihoidon turvallisuutta ja tehoa ei ole arvioitu immuunipuutteisilla potilailla.
Maligniteetit ja lymfoproliferatiiviset sairaudet
Kiinteät kasvaimet ja hematopoeettiset maligniteetit (paitsi ihosyövät)
Markkinoille tulon jälkeen on ilmoitettu erilaisista maligniteeteista (mm. rinta- ja keuhkosyöpä ja lymfooma, ks. kohta Haittavaikutukset).
TNF-antagonisteilla tehtyjen kliinisten tutkimusten kontrolloiduissa osissa on havaittu TNF-antagonistia saaneilla potilailla useampia lymfoomatapauksia kuin kontrollipotilailla. Esiintyvyys oli kuitenkin harvinaista, ja lumelääkettä saaneiden potilaiden seuranta-aika oli lyhyempi kuin TNF-antagonistihoitoa saaneilla potilailla. Markkinoille tulon jälkeen TNF-antagonisteja käyttävillä potilailla on raportoitu leukemiaa. Nivelreumapotilailla, joilla on pitkään kestänyt, hyvin aktiivinen tulehduksellinen sairaus, on suurentunut lymfooma- ja leukemiariski taustansa vuoksi, mikä vaikeuttaa riskinarviointia.
Tämänhetkisten tietojen perusteella ei voida poissulkea TNF-antagonisteilla hoidettavien potilaiden mahdollista riskiä saada lymfooma, leukemia tai muu hematopoeettinen maligniteetti tai kiinteä kasvain. Varovaisuutta on noudatettava, kun harkitaan TNF-antagonistihoidon aloittamista potilaalle, jolla on ollut aikaisemmin jokin maligniteetti, tai hoidon jatkamista potilaalle, jolle on kehittynyt jokin maligniteetti.
Markkinoille tulon jälkeen TNF-antagonisteilla, kuten etanerseptillä, hoidetuilla lapsilla, nuorilla ja nuorilla aikuisilla (korkeintaan 22-vuotiailla) on raportoitu esiintyneen maligniteetteja, joista osa oli kuolemaan johtavia. Näiden potilaiden TNF-hoito oli aloitettu viimeistään 18-vuotiaana. Noin puolet tapauksista oli lymfoomia. Muut tapaukset koostuivat monista erityyppisistä maligniteeteista, joista osa oli harvinaisia immunosuppressioon liitettyjä maligniteetteja. Maligniteetin kehittymisen riskiä TNF-antagonisteilla hoidetuille lapsille ja nuorille ei voida poissulkea.
Ihosyövät
Melanoomaa ja ei-melanoottista ihosyöpää on raportoitu esiintyneen TNF-antagonisteilla (kuten etanerseptillä) hoidetuilla potilailla. Markkinoille tulon jälkeen etanerseptiä käyttävillä potilailla on hyvin harvoin raportoitu esiintyneen merkelinsolukarsinoomaa. Määräaikaisia ihotarkastuksia suositellaan kaikille potilaille, erityisesti niille, joilla on lisääntynyt riski sairastua ihosyöpään.
Yhdistelemällä kontrolloiduista kliinisistä tutkimuksista saatuja tuloksia ei-melanoottisten ihosyöpätapausten todettiin lisääntyneen etanerseptillä hoidetuilla potilailla verrattuna vertailuryhmän potilaisiin. Tämä näkyi varsinkin psoriaasia sairastavien potilaiden ryhmässä.
Rokotteet
Eläviä rokotteita ei pidä antaa samanaikaisesti Benepali-valmisteen kanssa. Tietoja elävien rokotteiden välityksellä saaduista sekundaarisista infektioista etanerseptiä saavilla potilailla ei ole. Psoriaasiartriittipotilailla tehdyssä kaksoissokkoutetussa, lumelääkekontrolloidussa, satunnaistetussa kliinisessä tutkimuksessa 184 aikuispotilasta sai myös multivalentin pneumokokkipolysakkaridirokotteen viikolla 4. Tässä tutkimuksessa useimmat etanerseptiä saaneet psoriaasiartriittipotilaat pystyivät muodostamaan tehokkaan B-soluvasteen pneumokokkipolysakkaridirokotteelle, mutta kokonaisuudessaan titterit olivat lievästi alhaisemmat ja harvoilla potilailla titterit kohosivat kaksinkertaiseksi verrattuna niihin potilaisiin, jotka eivät saaneet etanerseptiä. Tämän tuloksen kliinistä merkitystä ei tunneta.
Autovasta-ainemuodostus
Benepali-hoito voi aiheuttaa autoimmuunivasta-aineiden muodostusta (ks. kohta Haittavaikutukset).
Hematologiset reaktiot
Etanerseptillä hoidetuilla potilailla on raportoitu esiintyneen harvoin pansytopeniaa sekä hyvin harvoin aplastista anemiaa, näistä jotkin kuolemaan johtaneita. Varovaisuutta on noudatettava niiden Benepali-valmisteella hoidettavien potilaiden kohdalla, joilla on aiemmin todettu verenkuvan muutoksia. Kaikkia potilaita ja potilaiden vanhempia/huoltajia tulee neuvoa, että potilaan tulee hakeutua välittömästi lääkärin hoitoon, jos potilaalle kehittyy Benepalin käytön aikana verenkuvan muutoksia tai infektioita muistuttavia merkkejä ja oireita (esimerkiksi toistuvaa kuumeilua, kurkkukipua, mustelmia, verenvuotoa, kalpeutta). Kyseiset potilaat tulee tutkia kiireellisesti, mukaan lukien täydellinen verenkuva; jos verenkuvan muutokset varmistuvat, Benepalin käyttö tulee lopettaa.
Neurologiset häiriöt
Etanerseptillä hoidetuilla potilailla on raportoitu esiintyneen harvoin keskushermoston myeliinikatoa aiheuttavia häiriöitä (ks. kohta Haittavaikutukset). Lisäksi harvoin on raportoitu esiintyneen perifeerisiä demyelinoivia polyneuropatioita (mukaan lukien Guillain-Barrén oireyhtymä, krooninen tulehduksellinen demyelinoiva polyneuropatia, demyelinoiva polyneuropatia ja monipesäkkeinen motorinen neuropatia). Vaikka etanerseptihoitoa ei ole arvioitu multippeliskleroosipotilaille tehdyissä kliinisissä tutkimuksissa, muilla TNF-antagonisteilla tehdyissä kliinisissä tutkimuksissa, joihin osallistui multippeliskleroosipotilaita, havaittiin taudin aktivoitumista. Huolellista riski-/hyöty-arviota, myös neurologista arviota, suositellaan tehtäväksi määrättäessä Benepali-valmistetta potilaille, joilla on jo aiemmin kehittynyt tai tuore myeliinikatoa aiheuttava sairaus tai potilaille, joilla katsotaan olevan suurentunut riski saada myeliinikatoa aiheuttava sairaus.
Yhdistelmähoito
Kun nivelreumapotilaille tehtiin kaksi vuotta kestänyt kontrolloitu kliininen tutkimus, etanerseptin ja metotreksaatin yhdistelmähoidossa ei ilmennyt odottamattomia turvallisuuslöydöksiä. Etanerseptin turvallisuusprofiili annettaessa yhdessä metotreksaatin kanssa oli samankaltainen kuin annettaessa etanerseptiä ja metotreksaattia yksinään. Pitkäaikaistutkimukset yhdistelmähoidon turvallisuudesta ovat meneillään. Etanerseptin turvallisuutta pitkäaikaisessa käytössä muiden tautiprosessia hidastavien reumalääkkeiden (DMARD) kanssa ei ole selvitetty.
Etanerseptin käyttöä psoriaasin hoitoon yhdessä muiden systeemisten hoitojen tai valohoitojen kanssa ei ole tutkittu.
Munuaisen ja maksan vajaatoiminta
Farmakokineettisten tietojen perusteella (ks. kohta Farmakokinetiikka) annosta ei tarvitse muuttaa potilaille, joilla on munuaisen tai maksan vajaatoiminta. Kliiniset kokemukset näillä potilailla ovat rajalliset.
Kongestiivinen sydämen vajaatoiminta
Tarkkaavaisuutta on noudatettava käytettäessä Benepali-valmistetta kongestiivisesta sydämen vajaatoiminnasta kärsivien potilaiden hoitoon. Markkinoille tulon jälkeen etanerseptiä käyttävillä potilailla on raportoitu esiintyneen kongestiivisen sydämen vajaatoiminnan pahenemista. Kaikilla potilailla ei ollut tunnistettavissa olevia taudin etenemistä jouduttavia tekijöitä. Myös harvinaisia (< 0,1 %) raportteja uuden kongestiivisen sydämen vajaatoiminnan alkamisesta on ollut, mukaan lukien potilaat, joilla ei ollut aiemmin todettua sydän- ja verisuonitautia. Jotkut näistä potilaista ovat olleet alle 50-vuotiaita. Kaksi suurta kliinistä tutkimusta, joilla arvioitiin etanerseptin käyttöä kongestiivisen sydämen vajaatoiminnan hoitoon, keskeytettiin tutkimusten alussa tehottomuuden takia. Näistä tutkimuksista toisessa saatu tieto viittaa mahdolliseen kongestiivisen sydämen vajaatoiminnan pahenemistaipumukseen etanerseptiä saaneilla potilailla.
Alkoholisteilla esiintyvä hepatiitti
Vaiheen II satunnaistetussa lumelääkekontrolloidussa tutkimuksessa 48 sairaalahoitoa vaativaa, keskivaikeaa tai vaikeaa hepatiittia sairastavaa alkoholistipotilasta hoidettiin joko etanerseptillä tai lumelääkkeellä. Etanersepti ei tehonnut näihin potilaisiin, ja etanerseptillä hoidettujen potilaiden kuolleisuus oli 6 kuukautta myöhemmin merkittävästi korkeampi. Tästä johtuen Benepali-valmistetta ei pidä käyttää alkoholisteilla esiintyvän hepatiitin hoitoon. Lääkärin on noudatettava varovaisuutta käyttäessään Benepali-valmistetta niiden alkoholistipotilaiden hoitoon, joilla on keskivaikea tai vaikea hepatiitti.
Wegenerin granulomatoosi
Lumelääkekontrolloidussa tutkimuksessa, jossa 89 aikuispotilasta sai etanerseptiä standardihoidon lisänä (mukaan lukien syklofosfamidi tai metotreksaatti ja glukokortikoidit) keskimäärin 25 kuukauden ajan, etanerseptiä ei todettu tehokkaaksi Wegenerin granulomatoosin hoidossa. Erityyppisten pahanlaatuisten, muiden kuin ihokasvainten insidenssi oli merkitsevästi suurempi etanerseptihoitoa saaneilla potilailla kuin verrokkiryhmässä. Benepali-valmistetta ei suositella Wegenerin granulomatoosin hoitoon.
Hypoglykemia diabetekseen hoitoa saavilla potilailla
Diabeteslääkitystä saavien potilaiden keskuudessa on etanerseptihoidon aloittamisen jälkeen todettu hypoglykemiaa, joka on muutamilla potilailla vaatinut diabeteslääkityksen vähentämistä.
Erityispotilasryhmät
Iäkkäät
Etanerseptillä tehdyissä vaiheen 3 tutkimuksissa nivelreuma-, psoriaasiartriitti- ja selkärankareumapotilailla ei todettu eroja haittavaikutusten, vakavien haittavaikutusten tai vakavien infektioiden esiintyvyydessä yli 65-vuotiailla etanerseptiä saaneilla potilailla verrattuna nuorempiin potilaisiin. Varovaisuutta on kuitenkin noudatettava hoidettaessa iäkkäitä potilaita ja erityistä huomiota on kiinnitettävä infektioiden esiintyvyyteen.
Pediatriset potilaat
Rokotteet
Lapsipotilaiden rokotukset on syytä mahdollisuuksien mukaan saattaa rokotussuositusten mukaisesti ajan tasalle ennen etanerseptihoidon aloittamista (ks. Rokotteet, yllä).
Benepali sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 25 mg, eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Samanaikainen käyttö anakinran kanssa
Etanerseptillä ja anakinralla hoidetuilla aikuispotilailla havaittiin korkeampi vakavien infektioiden esiintyvyys, kun lukuja verrattiin pelkkää etanerseptiä tai anakinraa saaneisiin potilaisiin (historiallista tietoa).
Lisäksi metotreksaattia saavilla aikuispotilailla tehdyssä lumelääkekontrolloidussa kaksoissokkotutkimuksessa havaittiin tämän lisäksi, että etanerseptiä ja anakinraa saaneilla potilailla oli useammin vakavia infektioita (7 %) ja neutropeniaa kuin pelkällä etanerseptillä hoidetuilla potilailla (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset). Etanerseptin ja anakinran yhdistelmällä ei ole havaittu olevan kliinistä lisäetua, joten tämän yhdistelmän käyttöä ei suositella.
Samanaikainen käyttö abataseptin kanssa
Kliinisissä tutkimuksissa havaittiin, että abataseptin ja etanerseptin samanaikainen käyttö lisäsi vakavien haittavaikutusten ilmaantumista. Tämän yhdistelmän käytöllä ei ole havaittu olevan kliinistä lisäetua, joten sen käyttöä ei suositella (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Samanaikainen käyttö sulfasalatsiinin kanssa
Kliinisissä tutkimuksissa, joissa ohjeen mukaisen määrän sulfasalatsiinia saaville aikuispotilaille lisättiin myös etanerseptilääkitys, yhdistelmälääkitystä saaneen potilasryhmän veren valkosolujen keskiarvomäärät laskivat tilastollisesti merkitsevästi verrattuna ryhmiin, jotka saivat pelkkää etanerseptiä tai sulfasalatsiinia. Tämän yhteisvaikutuksen kliinistä merkitystä ei tunneta. Lääkärin on noudatettava erityistä varovaisuutta harkitessaan yhdistelmähoitoa sulfasalatsiinin kanssa.
Yhteensopivuus
Kliinisissä tutkimuksissa ei ole havaittu yhteisvaikutuksia annettaessa etanerseptiä glukokortikoidien, salisylaattien (paitsi sulfasalatsiini), ei-steroidisten tulehduskipulääkkeiden (NSAIDien), analgeettien tai metotreksaatin kanssa (ks.. rokotusohjeet kohdasta Varoitukset ja käyttöön liittyvät varotoimet).
Kliinisesti merkittäviä farmakokineettisiä yhteisvaikutuksia ei ole havaittu ihmisillä, joita on hoidettu metotreksaatilla, digoksiinilla tai varfariinilla.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on harkittava tehokkaan ehkäisyn käyttöä estääkseen raskaaksi tulo Benepali-hoidon aikana ja kolme viikkoa hoidon päättymisen jälkeen.
Raskaus
Rotilla ja kaniineilla suoritetuissa lisääntymistoksisuustutkimuksissa ei ole todettu mitään merkkejä etanerseptin sikiölle tai vastasyntyneelle rotalle aiheuttamista haitoista. Etanerseptin vaikutuksia raskauden lopputulokseen on tutkittu kahdessa havainnoivassa kohorttitutkimuksessa. Yhdessä havainnoivassa tutkimuksessa merkittävien synnynnäisten poikkeavuuksien määrä oli suurempi raskauksissa, joissa äiti oli altistunut etanerseptille (n = 370) ensimmäisen raskauskolmanneksen aikana, verrattuna raskauksiin, joissa äiti ei ollut altistunut etanerseptille tai muille TNF-antagonisteille (n = 164) (korjattu vetosuhde 2,4, 95 %:n luottamusväli: 1,0–5,5). Nämä merkittävät synnynnäiset poikkeavuudet olivat samanlaisia kuin yleisimmin normaaliväestössä raportoidut. Mitään säännönmukaisuutta poikkeavuuksissa ei havaittu. Tässä tutkimuksessa ei myöskään havaittu muutoksia spontaanien keskenmenojen, kuolleena syntymisen, ennenaikaisten synnytyksien tai vähäisempien synnynnäisten poikkeavuuksien määrissä. Toisessa, monta maata kattaneessa havainnoivassa rekisteritutkimuksessa verrattiin raskaudelle haitallisten lopputulosten riskiä naisilla, joista osa oli altistunut ensimmäisten 90 raskauspäivän aikana etanerseptille (n = 425) ja osa ei-biologisille lääkevalmisteille (n = 3497). Tässä tutkimuksessa ei havaittu merkittävien synnynnäisten poikkeavuuksien riskin suurenemista (vakioimaton vetosuhde [OR] = 1,22, 95 %:n luottamusväli: 0,79–1,90; (maan, äidin sairauden, synnytyskertojen lukumäärän, äidin iän ja varhaisraskauden aikaisen tupakoinnin suhteen) korjattu OR = 0,96, 95 %:n luottamusväli: 0,58–1,60). Tässä tutkimuksessa ei myöskään osoitettu vähäisille synnynnäisille poikkeavuuksille, ennenaikaiselle synnytykselle, kuolleena syntymiselle tai ensimmäisen elinvuoden aikaisille infektioille riskin suurenemista vauvoilla, joiden äiti oli altistunut etanerseptille raskausaikana. Benepalia saa käyttää raskauden aikana vain, jos hoito on selvästi tarpeen.
Etanersepti läpäisee istukan ja sitä on havaittu sellaisten vauvojen seerumissa, joiden äitejä on hoidettu etanerseptillä raskauden aikana. Tämän kliinistä vaikutusta ei tunneta. Vauvoilla saattaa kuitenkin olla suurentunut infektioriski. Elävien rokotteiden antoa vauvoille ei tavallisesti suositella 16 viikkoon äidin viimeisen Benepali-annoksen jälkeen.
Imetys
Imettäville rotille ihonalaisesti annettu etanersepti erittyi maitoon ja oli havaittavissa poikasten seerumissa. Julkaistusta kirjallisuudesta saadut suppeat tiedot osoittavat, että ihmisen rintamaidossa on havaittu pieniä etanerseptipitoisuuksia. Etanerseptin käyttöä imetyksen aikana voidaan harkita ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Rintaruokitulle imeväiselle aiheutuva systeeminen altistus on oletettavasti vähäinen, koska etanersepti hajoaa suurelta osin maha-suolikanavassa, mutta rintaruokitulle imeväiselle aiheutuvasta systeemisestä altistuksesta on vähän tietoja saatavissa. Sen vuoksi eläviä taudinaiheuttajia sisältävien rokotteiden (esim. BCG-rokotteen) antamista etanerseptihoitoa saavan äidin rintaruokkimalle imeväiselle voidaan harkita 16 viikon kuluttua imetyksen lopettamisesta (tai aiemmin, jos etanerseptipitoisuus imeväisen seerumissa on alle havaitsemisrajan).
Hedelmällisyys
Prekliinisiä tietoja etanerseptin peri- ja postnataalitoksisuudesta ja etanerseptin vaikutuksesta hedelmällisyyteen ja lisääntymiskykyyn ei ole.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Etanerseptillä ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin ilmoitettuja haittavaikutuksia ovat injektiokohdan reaktiot (kuten kipu, turvotus, kutina, punoitus ja verenvuoto pistoskohdassa), infektiot (kuten ylähengitystieinfektiot, keuhkoputkien tulehdukset, rakkoinfektiot ja ihoinfektiot), päänsärky, allergiset reaktiot, autovasta-aineiden muodostuminen, kutina ja kuume.
Etanerseptiin on raportoitu liittyneen myös vakavia haittavaikutuksia. TNF-antagonistit, kuten etanersepti, vaikuttavat immuunijärjestelmään, ja niiden käyttö saattaa vaikuttaa kehon kykyyn puolustautua infektioita ja syöpää vastaan. Vakavia infektioita on todettu harvemmalla kuin yhdellä etanerseptillä hoidetulla potilaalla 100:sta. Raportteihin on sisältynyt kuolemaan johtaneita ja henkeä uhkaavia infektioita ja sepsistä. Etanerseptin käytön yhteydessä on ilmoitettu esiintyneen myös erilaisia pahanlaatuisia kasvaimia, mukaan lukien rinta-, keuhko, iho- ja imusolmukesyöpää (lymfoomaa).
Vakavia hematologisia, neurologisia ja autoimmuunireaktioita on myös ilmoitettu esiintyneen. Ilmoituksiin on sisältynyt harvinaisina tapauksina pansytopeniaa ja hyvin harvinaisina tapauksina aplastista anemiaa. Etanerseptin käytön yhteydessä on havaittu harvinaisina ja hyvin harvinaisina tapauksina sentraalisia ja periferaalisia demyelinoivia tapahtumia. Harvinaisina tapauksina on ilmoitettu lupusta, lupukseen liittyviä tiloja ja vaskuliittia.
Haittavaikutusten yhteenvetotaulukko
Seuraavassa luettelossa on esitetty kliinisissä tutkimuksissa havaitut sekä markkinoille tulon jälkeen ilmoitetut haittavaikutukset.
Haittavaikutukset on listattu elinjärjestelmäkohtaisesti esiintymistiheyden mukaan (oletettavasti reaktion saavien potilaiden määrä) seuraavaa luokitusta käyttäen: hyvin yleinen ( ≥ 1/10); yleinen ( ≥ 1/100, < 1/10); melko harvinainen ( ≥ 1/1 000, < 1/100); harvinainen ( ≥ 1/10 000, < 1/1 000); hyvin harvinainen ( < 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
| Elinjärjestelmä | Hyvin yleinen ≥ 1/10 | Yleinen ≥ 1/100, < 1/10 | Melko harvinainen ≥ 1/1 000, < 1/100 | Harvinainen ≥ 1/10 000, < 1/1 000 | Hyvin harvinainen < 1/10 000 | Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin) |
|---|---|---|---|---|---|---|
| Infektiot | Infektio (mukaan lukien ylempien hengitysteiden infektio, bronkiitti, kystiitti, ihoinfektio) * | Vakavat infektiot (mukaan lukien pneumonia, selluliitti, bakteeriartriitti, sepsis ja parasiitti-infektiot) * | Tuberkuloosi, opportunistiset infektiot (mukaan lukien invasiiviset sieni-, prototsooi-, bakteeri-, atyyppiset mykobakteeri- ja virusperäiset infektiot ja Legionella) * | B-hepatiitin uudelleenaktivoituminen, listeria | ||
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Ei-melanoottiset ihosyövät* (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Pahanlaatuinen melanooma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), lymfooma, leukemia | Merkelinsolukarsinooma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), Kaposin sarkooma | |||
| Veri ja imukudos | Trombosytopenia, anemia, leukopenia, neutropenia | Pansytopenia* | Aplastinen anemia* | Hematofaginen histiosytoosi (makrofagiaktivaatio-oireyhtymä)* | ||
| Immuunijärjestelmä | Allergiset reaktiot (ks. Iho ja ihonalainen kudos), autovasta-aineiden muodostus* | Vaskuliitti (mukaan lukien ANCA-positiivinen vaskuliittti) | Vakavat allergiset/anafylaktiset reaktiot (mukaan lukien angioedeema, bronkospasmi), sarkoidoosi | Dermatomyosiitin oireiden paheneminen | ||
| Hermosto | Päänsärky | Multippeliskleroosia muistuttava keskushermostoon liittyvä myeliinikato tai paikalliseen myeliinikatoon liittyvät tapaukset kuten näköhermon tulehdus sekä transversaalinen myeliitti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), perifeeriset demyelinoivat tapahtumat, mukaan lukien Guillain-Barrén oireyhtymä, krooninen tulehduksellinen demyelinoiva polyneuropatia, demyelinoiva polyneuropatia ja monipesäkkeinen motorinen neuropatia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), kouristus | ||||
| Silmät | Uveiitti, skleriitti | |||||
| Sydän | Kongestiivisen sydämen vajaatoiminnan paheneminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | Uuden kongestiivinen sydämen vajaatoiminnan ilmeneminen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet) | ||||
| Hengityselimet, rintakehä ja välikarsina | Interstitiaali keuhkosairaus (mukaan lukien pneumoniitti ja keuhkofibroosi)* | |||||
Ruoansulatus elimistö | Tulehduksellinen suolistotauti | |||||
| Maksa ja sappi | Kohonneet maksaentsyymiarvot* | Autoimmuunihepatiitti* | ||||
| Iho ja ihonalainen kudos | Kutina, ihottuma | Angioedeema, psoriaasi (myös psoriaasin puhkeaminen tai paheneminen ja pustulaarinen psoriaasi lähinnä kämmenissä ja jalkapohjissa), urtikaria, psoriaasin kaltainen ihottuma | Stevens-Johnsonin oireyhtymä, kutaaninen vaskuliitti (mukaan lukien yliherkkyysvaskuliitti), erythema multiforme, Jäkälää muistuttavat reaktiot | Toksinen epidermaalinen nekrolyysi | ||
| Luusto, lihakset ja sidekudos | Kutaaninen lupus erythematosus, subakuutti kutaaninen lupus erythematosus, lupuksen kaltainen oireisto | |||||
| Munuaiset ja virtsatiet | Munuaiskerästulehdus | |||||
| Yleisoireet ja antopaikassa todettavat haitat | Pistoskohdan reaktiot (mukaan lukien verenvuoto, mustelma, punoitus, kutina, kipu, turvotus)* | Kuume |
*katso Valikoitujen haittavaikutusten kuvaus alla.
Valikoitujen haittavaikutusten kuvaus
Maligniteetit ja lymfoproliferatiiviset sairaudet
Satakaksikymmentäyhdeksän (129) uutta maligniteettia todettiin 4 114 nivelreumapotilaalla, joita hoidettiin kliinisissä tutkimuksissa etanerseptillä enimmillään noin 6 vuotta. Tähän sisältyi myös kaksivuotinen aktiivisella vertailuvalmisteella kontrolloitu tutkimus, jossa 231 potilasta hoidettiin etanerseptin ja metotreksaatin yhdistelmällä. Näissä kliinisissä tutkimuksissa havaitut tiheydet ja ilmaantuvuudet olivat tutkitussa potilasaineistossa odotetun kaltaiset. Yhteensä kaksi maligniteettia raportoitiin noin kaksi vuotta kestäneissä kliinisissä tutkimuksissa, joihin osallistui 240 etanerseptillä hoidettua psoriaasiartriittipotilasta. Yli kaksi vuotta kestäneissä kliinisissä tutkimuksissa, joihin osallistui 351 selkärankareumapotilasta, raportoitiin 6 maligniteettia etanerseptillä hoidetuilla potilailla. Enimmillään 2,5 vuotta kestäneissä avoimissa ja kaksoissokkotutkimuksissa, joissa 2 711:tä läiskäpsoriaasipotilasta hoidettiin etanerseptillä, todettiin 30 maligniteettia ja 43 ei-melanoottista ihosyöpätapausta.
Kliinisissä tutkimuksissa 7 416:lla etanerseptiä saaneella nivelreuma-, psoriaasiartriitti-, selkärankareuma- ja psoriaasipotilaalla raportoitiin ilmenneen 18 lymfoomaa.
Markkinoille tulon jälkeen on myös raportoitu erilaisista maligniteeteista (mukaan lukien rinta- ja keuhkokarsinooma sekä lymfooma, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pistoskohdan reaktiot
Lumelääkkeeseen verrattuna etanerseptihoitoa saaneilla reumaa sairastavilla potilailla oli merkitsevästi enemmän pistoskohdan reaktioita (36 % vs. 9 %). Pistoskohdan reaktioita esiintyi tavallisesti ensimmäisen kuukauden aikana. Niiden keskimääräinen kesto oli noin 3–5 päivää. Suurinta osaa pistoskohdan reaktioista ei etanerseptiryhmissä hoidettu ja hoidetuista potilaista suurin osa sai paikallishoitoa, kuten kortikosteroideja, tai antihistamiinia suun kautta. Lisäksi joillekin potilaille kehittyi aiempien pistoskohtien reaktio samanaikaisesti viimeisen pistoskohdan reaktion kanssa. Nämä reaktiot olivat yleensä ohimeneviä eivätkä uusiutuneet hoidon kuluessa.
Läiskäpsoriaasipotilailla tehdyissä kontrolloiduissa tutkimuksissa ensimmäisten 12 hoitoviikon aikana noin 13,6 %:lle potilaista, joita hoidettiin etanerseptillä, kehittyi pistoskohdan reaktioita, vastaavan luvun ollessa 3,4 % lumelääkkeellä hoidetuilla potilailla.
Vakavat infektiot
Vakavien infektioiden (kuolemaan johtavien, henkeä uhkaavien, sairaalahoitoa tai suonensisäisiä antibiootteja vaativien infektioiden) ilmaantuvuuden ei havaittu lisääntyneen lumelääkekontrolloiduissa tutkimuksissa. Vakavia infektioita havaittiin 6,3 %:lla nivelreumapotilaista, joita hoidettiin etanerseptillä enimmillään 48 kuukautta. Vakaviin infektioihin kuuluivat absessi (eri puolilla vartaloa), bakteremia, bronkiitti, bursiitti, selluliitti, kolekystiitti, ripuli, divertikuliitti, endokardiitti (suspekti), gastroenteriitti, hepatiitti B, herpes zoster, säärihaavauma, suutulehdus, osteomyeliitti, otiitti, peritoniitti, keuhkokuume, pyelonefriitti, sepsis, septinen artriitti, sinuiitti, ihotulehdus, ihon haavauma, virtsatieinfektio, vaskuliitti ja haavainfektio. Kaksi vuotta kestäneessä aktiivisella vertailuvalmisteella kontrolloidussa tutkimuksessa, jossa potilaita hoidettiin joko etanerseptillä tai metotreksaatilla yksinään tai etanerseptin ja metotreksaatin yhdistelmällä, vakavia infektioita esiintyi yhtä usein kaikissa hoitoryhmissä. Kuitenkaan ei voida poissulkea sitä mahdollisuutta, että etanerseptin ja metotreksaatin yhdistelmähoito voisi liittyä infektioiden lisääntyneeseen määrään.
Infektioiden esiintyvyydessä ei havaittu eroa etanerseptillä hoidettujen ja lumelääkettäsaaneiden läiskäpsoriaasipotilaiden välillä enimmillään 24 viikkoa kestäneissä lumelääkekontrolloiduissa tutkimuksissa. Etanerseptihoitoa saaneilla potilailla esiintyneitä vakavia infektioita olivat selluliitti, gastroenteriitti, pneumonia, kolekystiitti, osteomyeliitti, gastriitti, appendisiitti, streptokokkifaskiitti, myosiitti, septinen sokki, divertikuliitti ja absessi. Avoimissa ja kaksoissokkoutetuissa psoriaasiartriittitutkimuksissa yhdellä potilaalla raportoitiin vakava infektio (keuhkokuume).
Vakavia ja kuolemaan johtavia infektioita on raportoitu etanerseptin käytön aikana; raportoituihin patogeeneihin sisältyvät bakteerit, mykobakteerit (mukaan lukien tuberkuloosi), virukset sekä sienet. Osa on ilmaantunut muutaman viikon sisällä etanerseptihoidon aloittamisesta potilaille, joilla on nivelreuman lisäksi jokin muu perussairaus (esim. diabetes, kongestiivinen sydämen vajaatoiminta, aiempi aktiivinen tai krooninen infektio) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Benepali-hoito voi lisätä kuolleisuutta niillä potilailla, joilla on varmennettu sepsis.
Etanerseptin käytön aikana on ilmoitettu opportunistisia infektioita, mukaan lukien invasiivisia sieni-, parasiitti- (kuten prototsooi), virusperäisiä (kuten herpes zoster), bakteeri- (myös Listeria ja Legionella) ja atyyppisiä mykobakteeri-infektioita. Useammasta kliinisestä tutkimuksesta yhdistettyjen tulosten mukaan opportunisti-infektioiden kokonaisesiintyvyys oli 0,09 % 15 402 tutkimuspotilaan joukossa, jotka saivat etanerseptiä. Altistuksen mukaan mukautettu esiintymistiheys oli 0,06 opportunisti-infektiota 100 potilasvuotta kohden. Valmisteen markkinoille tulon jälkeen maailmanlaajuisesti ilmenneistä opportunisti-infektioista suunnilleen puolet on ollut invasiivisia sieni-infektioita. Candida, Pneumocystis, Aspergillus ja Histoplasma ovat olleet yleisimmin raportoitujen invasiivisten sieni-infektioiden aiheuttajia. Kuolemaan johtaneista opportunisti-infektioista yli puolet johtui invasiivisista sieni-infektioista. Kuolemaan johtaneissa tapauksissa suurimmalla osalla potilaista oli joko Pneumocystis-keuhkokuume, epäspesifi systeeminen sieni-infektio tai aspergilloosi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Autovasta-aineet
Aikuispotilaiden seeruminäytteistä määritettiin autovasta-aineet useana ajankohtana. Tumavasta-aineiden (ANA) suhteen testatuista nivelreumapotilaista uudet positiiviset tumavasta-ainetapaukset ( ≥ 1:40) olivat yleisempiä etanerseptihoitoa saavilla potilailla (11 %) kuin lumelääkettä saavilla potilailla (5 %). Uudet positiiviset antinatiivi-DNA-vasta-ainetapaukset olivat myös yleisempiä radioimmunoanalyysissä (15 % etanerseptiryhmässä ja 4 % lumelääkeryhmässä) ja Crithidia luciliae -määrityksessä (3 % etanerseptiryhmässä eikä yhtään lumelääkeryhmässä). Niiden etanerseptiryhmän potilaiden osuus, joille kehittyi kardiolipiinivasta-aineita, oli niinikään suurempi kuin lumelääkeryhmässä. Pitkäaikaisen etanerseptihoidon vaikutusta autoimmuunitautien kehittymiseen ei tiedetä.
Yksittäisiä raportteja on tehty potilaista, joille kehittyi muita autovasta-aineita sellaisen lupuksen kaltaisen oireiston tai ihottumien yhteydessä, joiden kliininen kuva ja biopsia vastasivat subakuuttia kutaanista lupusta tai diskoidia lupusta. Näihin potilaisiin kuului reumatekijäpositiivisia potilaita.
Pansytopenia ja aplastinen anemia
Markkinoille tulon jälkeen on raportoitu esiintyneen pansytopeniaa ja aplastista anemiaa, joista osa oli kuolemaan johtaneita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Interstitiaali keuhkosairaus
Etanerseptin kaikkia käyttöaiheita koskevissa kontrolloiduissa kliinisissä tutkimuksissa haittatapahtuman ”interstitiaali keuhkosairaus” esiintymistiheys (ilmaantuvuusosuus) oli 0,06 % (esiintymistiheys harvinainen) potilailla, jotka saivat etanerseptia ilman samanaikaista metotreksaattiannosta. Niissä kontrolloiduissa kliinisissä tutkimuksissa, joissa voitiin antaa samanaikaisesti etanersepti- ja metotreksaattihoitoa, haittatapahtuman ”interstitiaali keuhkosairaus” esiintymistiheys (ilmaantuvuusosuus) oli 0,47 % (esiintymistiheys melko harvinainen). Markkinoille tulon jälkeen on raportoitu esiintyneen interstitiaalia keuhkosairautta (mukaan lukien pneumoniittia ja keuhkofibroosia), joista osa oli kuolemaan johtaneita.
Samanaikainen käyttö anakinran kanssa
Tutkimuksissa, joissa aikuispotilaita hoidettiin samanaikaisesti etanerseptillä ja anakinralla, vakavien infektioiden esiintyvyys oli suurempi yhdistelmähoidolla kuin pelkällä etanerseptihoidolla. 2 %:lle potilaista (3/139) kehittyi neutropenia (absoluuttinen neutrofiilien määrä < 1 000 / mm3). Yhdelle potilaalle kehittyi neutropenian yhteydessä selluliitti, joka parantui sairaalahoidon jälkeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Kohonneet maksaentsyymiarvot
Etanerseptin kaikkia käyttöaiheita koskevien kontrolloitujen kliinisten tutkimusten kaksoissokkoutettujen vaiheiden aikana haittatapahtuman ”kohonneet maksaentsyymiarvot” esiintymistiheys (ilmaantuvuusosuus) oli 0,54 % (esiintymistiheys melko harvinainen) potilailla, jotka saivat etanerseptia ilman samanaikaista metotreksaattiannosta. Kontrolloitujen kliinisten tutkimusten kaksoissokkoutettujen niiden vaiheiden aikana, jolloin voitiin antaa samanaikaisesti etanersepti- ja metotreksaattihoitoa, haittatapahtuman ”kohonneet maksaentsyymiarvot” esiintymistiheys (ilmaantuvuusosuus) oli 4,18 % (esiintymistiheys yleinen).
Autoimmuunihepatiitti
Etanerseptin kaikkia käyttöaiheita koskevissa kontrolloiduissa kliinisissä tutkimuksissa haittatapahtuman ”autoimmuunihepatiitti” esiintymistiheys (ilmaantuvuusosuus) oli 0,02 % (esiintymistiheys harvinainen) potilailla, jotka saivat etanerseptia ilman samanaikaista metotreksaattiannosta. Niissä kontrolloiduissa kliinisissä tutkimuksissa, joissa voitiin antaa samanaikaisesti etanersepti- ja metotreksaattihoitoa, haittatapahtuman ”autoimmuunihepatiitti” esiintymistiheys (ilmaantuvuusosuus) oli 0,24 % (esiintymistiheys melko harvinainen).
Pediatriset potilaat
Haittavaikutukset juveniilia idiopaattista artriittia sairastavilla lapsilla
Yleisesti juveniilia idiopaattista artriittia sairastavilla lapsipotilailla haittatapahtumat olivat yhtä yleisiä ja samantyyppisiä kuin aikuisilla. Seuraavassa käsitellään eroavuuksia aikuisilla havaittuihin haittoihin nähden sekä muita erityispiirteitä.
Kliinisissä tutkimuksissa juveniilia idiopaattista artriittia sairastavilla potilailla (2–18-vuotiaat) esiintyneet infektiot olivat yleensä lieviä tai keskivaikeita ja samantyyppisiä kuin avohoidossa olevilla lapsipotilailla yleensä. Vakavina haittavaikutuksina todettiin mm. vesirokkoa, johon liittyi aseptisen meningiitin merkkejä ja oireita, jotka hävisivät ilman jälkitauteja (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet), appendisiittia, gastroenteriittiä, masennusta/persoonallisuushäiriöitä, ihohaavaumia, esofagiittia/gastriittia, A-ryhmän streptokokin aiheuttamaa septistä shokkia, tyypin I diabetes mellitusta, pehmytkudosinfektioita sekä postoperatiivisia haavainfektioita.
Eräässä tutkimuksessa 43:lla 69:stä (62 %) juveniilia idiopaattista artriittia sairastavasta lapsesta (4–17 -vuotiaita) esiintyi infektio kolmen kuukauden etanerseptihoidon aikana (osa 1, avoin tutkimus). Infektioiden esiintymistiheys ja vakavuusaste olivat samanlaisia 58 potilaalla, jotka olivat mukana 12 kuukautta kestäneessä avoimessa jatkotutkimuksessa. Juveniilia idiopaattista artriittia sairastavilla lapsipotilailla esiintyneet haittavaikutukset olivat tyypiltään ja esiintyvyydeltään samankaltaiset kuin etanerseptitutkimuksiin osallistuneilla, nivelreumaa sairastavilla aikuispotilailla. Useimmat haittavaikutuksista olivat lieviä. Kolmen kuukauden etanerseptihoidon aikana 69:llä juveniilia idiopaattista artriittia sairastavalla lapsella esiintyi yleisemmin useita haittavaikutuksia kuin 349:llä nivelreumaa sairastavalla aikuispotilaalla. Näitä haittavaikutuksia olivat mm. päänsärky (19 % potilaista, 1,7 tapahtumaa potilasvuotta kohti), pahoinvointi (9 %, 1 tapahtuma potilasvuotta kohti), mahakipu (19 %, 0,74 tapahtumaa potilasvuotta kohti) ja oksentelu (13 %, 0,74 tapahtumaa potilasvuotta kohti).
Juveniilia idiopaattista artriittia koskeneissa kliinisissä tutkimuksissa raportoitiin neljä makrofagiaktivaatio-oireyhtymätapausta.
Haittavaikutukset läiskäpsoriaasia sairastavilla lapsilla
Haittavaikutukset ovat samantyyppisiä läiskäpsoriaasia sairastavilla lapsilla kuin aikaisemmissa tutkimuksissa läiskäpsoriaasia sairastavilla aikuisilla. Tämä todettiin 48 viikon tutkimuksessa, johon osallistui 211 läiskäpsoriaasia sairastavaa 4–17-vuotiasta lasta ja nuorta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Annosta rajoittavaa toksisuutta ei todettu kliinisissä tutkimuksissa nivelreumapotilailla. Suurin arvioitu annostaso on ollut laskimoon annettu kyllästysannos 32 mg/m2 ja sitä seuraava ihonalaisesti annettu 16 mg/m2 kahdesti viikossa. Yksi nivelreumapotilas pisti vahingossa itse virheellisesti 62 mg etanerseptiä ihonalaisesti kahdesti viikossa 3 viikon ajan ilman, että haittavaikutuksia ilmeni. Etanerseptille ei tunneta vastalääkettä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: immunosuppressantit, tuumorinekroositekijä alfan (TNF-α) estäjät, ATC-koodi: L04AB01
Benepali on ns. biosimilaari lääkevalmiste. Yksityiskohtaisempaa tietoa on saatavilla Euroopan lääkeviraston verkkosivulta: https://www.ema.europa.eu.
Tuumorinekroositekijä (TNF) on dominoiva sytokiini nivelreuman tulehdusprosessissa. Kohonneita TNF-tasoja esiintyy myös psoriaasiartriittia sairastavien potilaiden nivelkalvoilla ja psoriaasiläiskissä sekä selkärankareumapotilaiden seerumissa ja synoviaalikudoksessa. Läiskäpsoriaasissa tulehdusta aiheuttavien solujen, mukaan lukien T-solujen, aiheuttama infiltraatio johtaa psoriaasialueilla suurentuneisiin TNF-tasoihin terveiden ihoalueiden tasoihin verrattuna. Etanersepti estää kilpailevasti TNF:n sitoutumista solun pintareseptoreihin ja estää siten TNF:n biologista aktiivisuutta. TNF ja lymfotoksiini ovat proinflammatorisia sytokiineja, jotka sitoutuvat kahteen erilliseen solun pintareseptoriin: 55 kilodaltonin (p55) ja 75 kilodaltonin (p75) tuumorinekroositekijäreseptoreihin (TNFR). Molemmat TNF-reseptorit esiintyvät luontaisesti solukalvoon sitoutuneina ja liukoisina muotoina. Liukoisten TNF-reseptorien oletetaan säätelevän TNF:n biologista aktiivisuutta.
TNF ja lymfotoksiini esiintyvät lähinnä homotrimeereinä, ja niiden biologinen aktiivisuus riippuu solun pinta-TNFR-risteämisestä. Dimeeriset liukoiset reseptorit, kuten etanersepti, hakeutuvat voimakkaammin TNF:ään kuin monomeeriset reseptorit ja ovat huomattavasti potentimpia kilpailevia TNF:n solureseptoreihin sitoutumisen estäjiä. Lisäksi immunoglobuliinin Fc-osan käyttö fuusioelementtinä dimeerisen reseptorin rakentamisessa merkitsee pitempää puoliintumisaikaa.
Vaikutusmekanismi
Nivelreumassa ja selkärankareumassa nivelissä ja läiskäpsoriaasin ihopatologiassa tapahtuvat muutokset välittyvät paljolti TNF:n säätelemän proinflammatoristen molekyylien verkoston kautta. Etanerseptin vaikutusmekanismin ajatellaan perustuvan siihen, että se estää kilpailevasti TNF:n sitoutumisen solun pinnan TNF-reseptoriin, mikä puolestaan estää TNF-välitteisiä soluvasteita tekemällä TNF:n biologisesti inaktiiviseksi. Etanersepti voi myös moduloida muiden TNF:n indusoimien tai säätelemien samaan signaalinvälitysketjuun kuuluvien molekyylien (esim. sytokiinit, adheesiomolekyylit tai proteinaasit) säätelemiä biologisia vasteita.
Kliininen teho ja turvallisuus
Tässä osassa esitetään tuloksia neljästä satunnaistetusta kontrolloidusta aikuispotilailla tehdystä nivelreumatutkimuksesta, yhdestä aikuispotilailla tehdystä psoriaasiartriittitutkimuksesta, yhdestä aikuispotilailla tehdystä selkärankareumatutkimuksesta, kahdesta aikuispotilailla tehdystä aksiaalisen spondylartriitin (ilman radiografista näyttöä selkärankareumasta) tutkimuksesta ja neljästä aikuispotilailla tehdystä läiskäpsoriaasitutkimuksesta, kolmesta juveniilin idiopaattisen artriitin tutkimuksesta ja yhdestä lapsipotilailla tehdystä läiskäpsoriaasitutkimuksesta.
Aikuiset nivelreumapotilaat
Etanerseptin teho arvioitiin satunnaistetussa lumelääkekontrolloidussa kaksoissokkotutkimuksessa. Tutkimuksessa arvioitiin 234 aikuista potilasta, joilla oli aktiivinen nivelreuma ja joilla vähintään yksi mutta enintään neljä antireumaattista lääkettä (DMARD) ei ollut tehonnut. Potilaat saivat 10 mg tai 25 mg etanerseptiä tai lumelääkettä ihonalaisesti kahdesti viikossa 6 kuukauden ajan. Tämän kontrolloidun tutkimuksen tulokset ilmaistiin prosentuaalisena nivelreuman lievittymisenä käyttäen ACR-vastekriteerejä (American College of Rheumatology).
ACR 20 ja ACR 50 -vasteet olivat suuremmat etanerseptihoitoa saaneilla potilailla 3 ja 6 kuukauden kohdalla (ACR 20: etanersepti 62 % ja 59 %, lumelääke 23 % ja 11 % vastaavasti 3 ja 6 kuukauden kohdalla; ACR 50: etanersepti 41 % ja 40 %, lumelääke 8 % ja 5 % vastaavasti 3 ja 6 kuukauden kohdalla; p < 0,01 etanersepti vs lumelääke kaikkina tutkittuina ajankohtina sekä ACR 20 että ACR 50 -vasteiden osalta).
Noin 15 % etanerseptiä saaneista koehenkilöistä saavutti ACR 70 -vasteen 3 ja 6 kuukauden kohdalla, kun vastaava luku lumelääkeryhmässä oli alle 5 %. Etanerseptihoitoa saaneilla potilailla kliininen vaste ilmeni yleensä 1–2 viikon kuluttua, ja lähes aina 3 kuukauden sisällä, hoidon aloittamisesta.. Annosvaste todettiin: 10 mg:n annoksella saatu vaste sijoittui lumelääkkeellä ja 25 mg:n annoksella saadun vasteen väliin. Etanersepti oli merkitsevästi parempi kuin lumelääke kaikkien ACR-kriteerien perusteella, mutta myös ACR-kriteereihin kuulumattomien nivelreuman aktiivisuutta arvioivien mittareiden, kuten aamujäykkyyden, perusteella. Toimintakykyindeksi (HAQ), johon sisältyivät toimintakyvyn heikkeneminen, vitaalisuus, psyykkinen terveys, yleinen terveydentila ja nivelreumaan liittyvät terveydentilan alakohdat, määritettiin 3 kuukauden välein tutkimuksen aikana. Kaikkien toimintakykyindeksin alakohtien tulokset paranivat etanerseptillä saaneilla potilailla vertailupotilaisiin nähden 3 ja 6 kuukauden kohdalla.
Etanerseptihoidon lopettamisen jälkeen nivelreuman oireet palautuivat yleensä kuukaudessa. Avoimista tutkimuksista saatujen tulosten mukaan etanerseptihoidon aloittaminen uudelleen korkeintaan 24 kuukauden tauon jälkeen tuotti potilaille yhtä vahvan vasteen kuin ilman taukoja annettu etanerseptihoito. Pitkäkestoisesti pysyviä vasteita on havaittu aina 10 vuoteen asti avoimissa jatkohoitotutkimuksissa, joissa potilaat saivat etanerseptillä tauotta.
Etanerseptin tehoa verrattiin metotreksaatin tehoon satunnaistetussa, aktiivisella vertailuvalmisteella kontrolloidussa tutkimuksessa, jossa ensisijaisena päätetapahtumana oli sokkoutettu röntgenologinen arviointi. Tutkimuksessa arvioitiin 632 aikuispotilasta, joilla oli aktiivinen nivelreuma (< 3 vuotta kestänyt) ja jotka eivät olleet aiemmin saaneet metotreksaattihoitoa. Etanerseptiä annosteltiin joko 10 mg tai 25 mg ihonalaisesti kahdesti viikossa 24 kuukauden ajan. Metotreksaatin viikkoannoksia nostettiin kahdeksan ensimmäisen tutkimusviikon aikana asteittain 7,5 mg:sta korkeintaan 20 mg:aan, ja hoitoa jatkettiin 24 kuukautta. Kliininen paraneminen, mukaan lukien vaikutuksen alkaminen 2 viikon sisällä, 25 mg etanerseptiä saaneilla potilailla oli samankaltaista kuin aiemmissa tutkimuksissa ja se säilyi 24 kuukauden ajan. Lähtötilanteessa potilaiden toimintakyky oli kohtalaisesti heikentynyt; HAQ-arvojen keskiarvon ollessa 1,4–1,5. Etanerseptihoito 25 mg:n annoksella sai aikaan merkittävää paranemista näissä arvoissa 12 kuukauden kohdalla, jolloin 44 % potilaista saavutti normaalia toimintakykyä kuvaavan HAQ-arvon ( < 0,5). Tämä saavutettu hyöty säilyi edelleen tutkimuksen toisena vuonna.
Tässä tutkimuksessa rakenteelliset nivelvauriot arvioitiin röntgenologisesti ja ilmaistiin Sharpin luokittelun (Total Sharp Score, TSS) sekä sen osien (eroosioaste ja nivelraon kaventuminen, JSN) muutoksina. Käsien/ranteiden ja jalkojen röntgenkuvat katsottiin tutkimuksen alussa ja 6, 12 ja 24 kuukauden kohdalla. 10 mg:n etanersepti annoksella oli säännönmukaisesti heikompi vaikutus rakenteellisiin vaurioihin kuin 25 mg:n etanerseptiannoksella. 12 ja 24 kuukauden kohdalla etanersepti 25 mg oli merkitsevästi metotreksaattia tehokkaampi eroosioasteella mitattuna. Erot TSS- ja JNS-tuloksissa eivät olleet tilastollisesti merkitseviä metotreksaatin ja etanersepti 25 mg:n välillä. Tutkimuksen tulokset on esitetty alla olevassa kuvaajassa.
Röntgenologinen progressio: etanerseptin ja metotreksaatin vertailu potilailla, joilla nivelreuma kestänyt < 3 vuotta
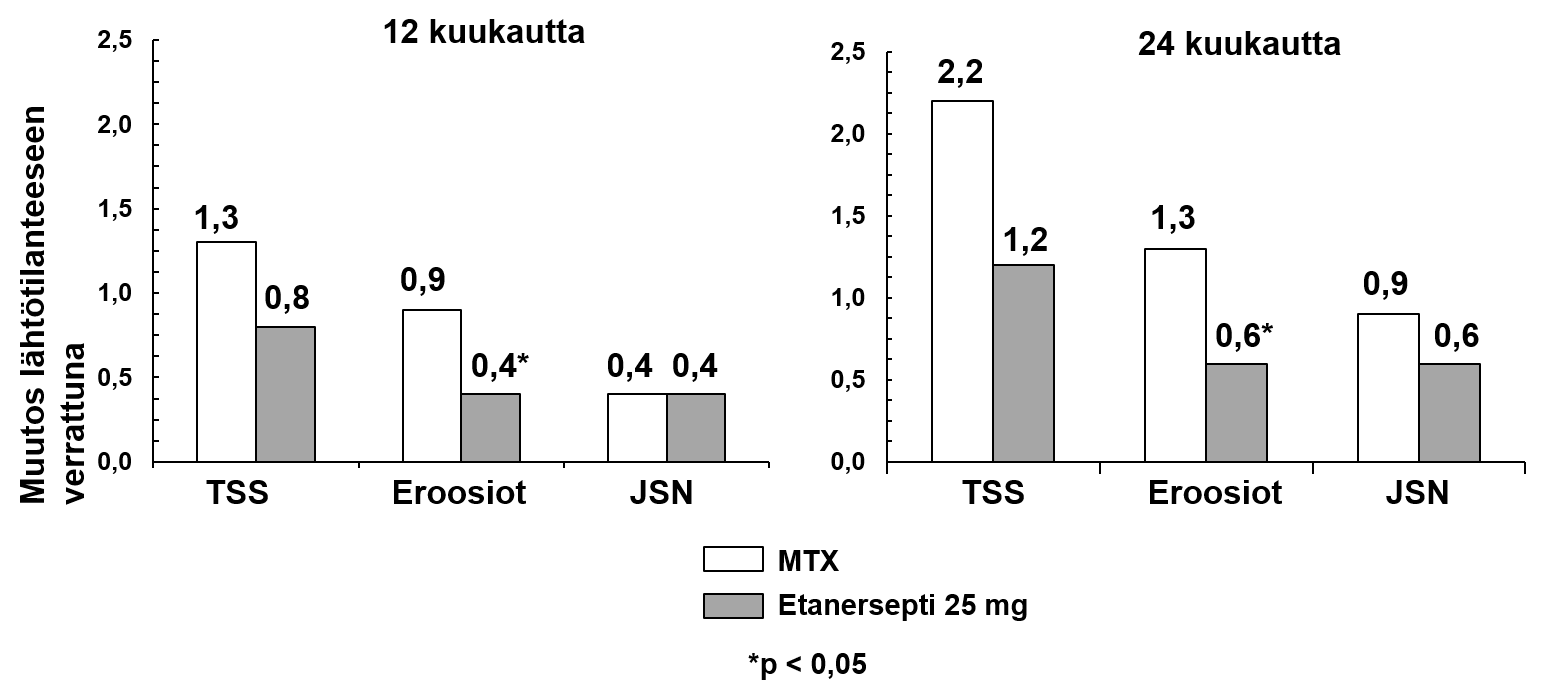
Toisessa aktiivisella vertailuvalmisteella kontrolloidussa, satunnaistetussa kaksoissokkotutkimuksessa arvioitiin kliinistä tehoa, turvallisuutta ja röntgenologista progressiota nivelreumapotilailla, joita hoidettiin vain etanerseptillä (25 mg kahdesti viikossa), vain metotreksaatilla (7,5–20 mg viikossa, mediaaniannos 20 mg) tai etanerseptin ja metotreksaatin yhdistelmähoidolla (lääkkeet aloitettiin yhtä aikaa). Eri hoitoja verrattiin 682 aikuispotilaalla, joilla oli ollut aktiivinen nivelreuma 6 kk:n – 20 vuoden ajan (mediaaniaika 5 vuotta) ja joille ei kehittynyt tyydyttävää vastetta vähintään 1 antireumaattiseen lääkkeeseen (DMARD), joka ei ollut metotreksaatti.
Etanerseptin ja metotreksaatin yhdistelmällä hoidettujen potilaiden ACR 20-, ACR 50- ja ACR 70 -vasteet sekä DAS- ja HAQ-arvot olivat parantuneet 24 ja 52 viikon kohdalla verrattuna potilaisiin, jotka kuuluivat jompaankumpaan yhtä hoitoa saaneeseen ryhmään (tulokset on esitetty alla olevassa taulukossa). Etanerseptin ja metotreksaatin yhdistelmällä saavutettiin 24 kuukauden jälkeen merkittävää hyötyä verrattuna etanerseptin tai metotreksaatin käyttöön yksinään.
Kliininen teho tulokset 12 kuukauden kohdalla: etanersepti vs. metotreksaatti vs. etanerseptin ja metotreksaatin yhdistelmä potilailla, jotka sairastaneet nivelreumaa 6 kuukaudesta 20 vuoteen
| Päätetapahtuma | Metotreksaatti (n = 228) | Etanersepti (n = 223) | Etanersepti + metotreksaatti (n = 231) | |
| ACR-vasteeta | ACR 20 | 58,8 % | 65,5 % | 74,5 %†, Φ |
| ACR 50 | 36,4 % | 43,0 % | 63,2 %†, Φ | |
| ACR 70 | 16,7 % | 22,0 % | 39,8 %†, Φ | |
| DAS | (Pistemääräb) Lähtötasoarvo | 5,5 | 5,7 | 5,5 |
| (Pistemääräb) Viikko 52 | 3,0 | 3,0 | 2,3†, Φ | |
| Remissioc | 14 % | 18 % | 37 %†, Φ | |
| HAQ | Lähtötasoarvo | 1,7 | 1,7 | 1,8 |
| Viikko 52 | 1,1 | 1,0 | 0,8†, Φ | |
a Niiden potilaiden, jotka eivät olleet tutkimuksessa mukana 12 kuukautta kestäneen seurannan loppuun asti, katsottiin jääneen ilman hoitovastetta.
b DAS-arvot ovat keskiarvoja.
c Remissioksi määritelty: DAS < 1,6.
Parittainen vertailu, p-arvot: † = p < 0,05 vertailussa etanersepti + metotreksaatti vs metotreksaatti ja Φ = p < 0,05 vertailussa etanersepti + metotreksaatti vs etanersepti.
Taudin röntgenologinen progressio oli 12 kuukauden kohdalla merkitsevästi vähäisempää etanerseptiryhmässä kuin metotreksaattiryhmässä, kun taas yhdistelmähoito oli merkitsevästi parempi kuin kumpikaan hoito yksinään röntgenologisen progression hidastamisessa (katso alla oleva kuva).
Röntgenologinen progressio: etanersepti vs metotreksaatti vs etanerseptin ja metotreksaatin yhdistelmä potilailla, jotka sairastaneet nivelreumaa 6 kuukaudesta 20 vuoteen (12 kuukauden tulokset)

Parittainen vertailu, p-arvot: * = p < 0,05 vertailussa etanersepti vs metotreksaatti, † = p < 0,05 vertailussa etanersepti + metotreksaatti vs metotreksaatti ja Φ = p < 0,05 vertailussa etanersepti + metotreksaatti vs etanersepti.
Myös 24 kuukautta jatkuneen hoidon jälkeen etanerseptin ja metotreksaatin yhdistelmällä saavutettiin merkittävää hyötyä verrattuna etanerseptin tai metotreksaatin käyttöön yksinään. Samoin etanersepti-monoterapialla saavutettiin merkittävää hyötyä verrattuna metotreksaatin käyttöön yksinään myös 24 kuukauden jälkeen.
Analyysissä, jossa katsottiin kaikkien tutkimuksessa mistä tahansa syystä keskeyttäneiden potilaiden taudin edenneen, niiden potilaiden osuus, joiden tauti ei ollut edennyt (TSS-muutos ≤ 0,5) 24 kuukauden hoidon aikana, oli etanerseptin ja metotreksaatin yhdistelmähoitoa saaneilla potilailla korkeampi (62 %) kuin etanerseptiä yksinään (50 %) tai metotreksaattia yksinään (36 %; p < 0,05) saaneilla potilailla. Ero pelkällä etanerseptillä tai pelkällä metotreksaatilla hoidettujen potilaiden välillä oli myös merkittävä (p < 0,05). Koko 24 kuukauden ajan tutkimuksessa mukana olleista potilaista 78 %:lla etanerseptiä ja metotreksaattia, 70 %:lla etanerseptiä yksinään ja 61 %:lla metotreksaattia yksinään saaneista potilaista tauti ei ollut edennyt.
Etanersepti-hoidon 50 mg (kaksi 25 mg:n ihonalaista injektiota) kerran viikossa tehoa ja turvallisuutta arvioitiin lumelääkekontrolloidussa kaksoissokkotutkimuksessa 420 potilaalla, joilla oli aktiivinen nivelreuma. Tässä tutkimuksessa 53 potilaalle annettiin lumelääkettä, 214 potilaalle 50 mg etanerseptiä kerran viikossa ja 153 potilaalle 25 mg etanerseptiä kahdesti viikossa. Teho- ja turvallisuusprofiilit nivelreuman merkkien ja oireiden hoidossa olivat 8 viikon kohdalla molemmissa etanersepti-hoitohaaroissa keskenään vertailukelpoiset. Tutkimustulokset eivät kuitenkaan olleet 16 viikon kohdalla vertailukelpoisia (ei-inferiorinen) näiden kahden hoitohaaran välillä.
Aikuiset psoriaasiartriittipotilaat
Etanerseptin tehoa tutkittiin satunnaistetussa, lumelääkekontrolloidussa kaksoissokkotutkimuksessa, johon osallistui 205 psoriaasiartriitti-potilasta. Potilaat olivat iältään 18‑70-vuotiaita, ja heillä oli aktiivinen psoriaasiartriitti (≥ 3 turvonnutta niveltä ja ≥ 3 aristavaa niveltä) vähintään yhtenä seuraavista muodoista: (1) DIP-artriitti; (2) polyartriitti (ei reumakyhmyjä, potilaalla myös psoriaasi); (3) mutiloiva artriitti; (4) epäsymmetrinen psoriaasiartriitti; tai (5) spondylartropatia. Potilailla oli lisäksi läiskäpsoriaasi, läiskät läpimitaltaan ≥ 2 cm.
Potilaita oli aiemmin hoidettu tulehduskipulääkkeillä (NSAID, 86 %), antireumaattisilla lääkkeillä (DMARD, 80 %) ja kortikosteroideilla (24 %). Samanaikaista metotreksaattilääkitystä (stabiili ≥ 2 kuukautta) voitiin jatkaa vakiintuneella annoksella ≤ 25 mg metotreksaattia/viikko. Etanersepti 25 mg (annos perustuu nivelreumapotilailla tehtyihin annos-vastetutkimuksiin) tai lumelääke annosteltiin ihonalaisesti kahdesti viikossa kuuden kuukauden ajan. Kaksoissokkotutkimuksen päätyttyä potilaalla oli mahdollisuus siirtyä avoimeen, pitkäaikaiseen, 2 vuotta kestävään jatkotutkimukseen.
Kliiniset vasteet ilmaistiin niiden potilaiden prosentuaalisena osuutena, jotka saavuttivat ACR 20-, ACR 50- ja ACR 70 -vasteen, sekä prosentuaalisena psoriaasiartriitin lievittymisenä käyttäen PsARC-vastekriteerejä (Psoriatic Arthritis Response Criteria). Tulokset on kerätty alla olevaan taulukkoon.
Psoriaasiartriittipotilaiden vasteet lumelääkekontrolloidussa tutkimuksessa
| Psoriaasiartriittivaste | Prosenttia potilaista | ||
Lumelääke n = 104 | Etanerseptia n = 101 | ||
| ACR 20 | Kuukausi 3 | 15 | 59b |
| Kuukausi 6 | 13 | 50b | |
| ACR 50 | Kuukausi 3 | 4 | 38b |
| Kuukausi 6 | 4 | 37b | |
| ACR 70 | Kuukausi 3 | 0 | 11b |
| Kuukausi 6 | 1 | 9c | |
| PsARC | Kuukausi 3 | 31 | 72b |
| Kuukausi 6 | 23 | 70b | |
a 25 mg etanerseptiä ihonalaisesti kahdesti viikossa
b p < 0,001, etanersepti vs lumelääke
c p < 0,01, etanersepti vs lumelääke
Etanerseptiä saaneiden psoriaasiartriittipotilaiden kliininen vaste oli ilmeinen ensimmäisen käynnin (4 viikkoa) yhteydessä, ja se säilyi koko 6 kuukauden hoidon ajan. Etanersepti oli merkittävästi lumelääkettä parempi kaikilla taudin aktiivisuutta määrittävillä mittareilla tarkasteltuna (p < 0,001). ja vasteet olivat samanlaiset sekä samanaikaisen metotreksaattihoidon kanssa että ilman sitä. Psoriaasiartriittipotilaiden elämänlaatua arvioitiin jokaisena seuranta-ajankohtana toimintakykyarviokyselyn (HAQ) toimintakykyindeksin avulla. Toimintakykyindeksin arvo oli merkittävästi parantunut etanerseptillä hoidetuilla psoriaasiartriittipotilailla kaikkina ajankohtina suhteessa lumelääkeryhmään (p < 0,001).
Psoriaasiartriittitutkimuksessa arvioitiin röntgenologisia muutoksia käsissä ja ranteissa tutkimuksen alussa sekä 6, 12 ja 24 kuukauden kuluttua. Modifioitu TSS 12 kuukauden kohdalla on esitetty alla olevassa taulukossa. Analyysissä, jossa tutkimuksen mistä tahansa syystä keskeyttäneiden potilaiden taudin katsottiin edenneen, niiden potilaiden osuus, joilla tauti ei ollut edennyt (TSS muutos ≤ 0,5) 12 kuukauden kohdalla, oli suurempi etanerseptiryhmässä verrattuna lumelääkeryhmään (73 % vs 47 %, p ≤ 0,001). Etanerseptin teho säilyi röntgenologisesti arvioituna potilailla, joiden hoitoa jatkettiin 2 vuoden ajan. Perifeeristen nivelien vaurioitumisen hidastuminen todettiin potilailla, joilla oli taudin symmetrinen, useita niveliä sairastuttava muoto.
Vuosittainen muutos (SE) lähtötilanteeseen verrattuna ”Total Sharp Score” -lukuna
| Aika | Lumelääke (n = 104) | Etanersepti (n = 101) |
| Kuukausi 12 | 1,00 (0,29) | -0,03 (0,09)a |
SE = standard error, keskivirhe
a p = 0,0001
Kaksoissokkovaiheen aikana etanerseptihoito paransi fyysistä toimintakykyä, ja tämä hyöty säilyi pidemmän, yhteensä 2 vuotta kestäneen, altistumisen ajan.
Tutkittujen potilaiden vähäisen määrän vuoksi etanerseptin tehosta ei ole tarpeeksi näyttöä potilailla, jotka sairastavat selkärankareumatyyppistä tai mutiloiva artriitti -tyyppistä psoriaasiartriittia.
Psoriaasiartriittipotilailla ei ole tehty tutkimusta, jossa olisi käytetty annostelua 50 mg kerran viikossa. Näyttö kerran viikossa -annostelun tehosta tässä potilasryhmässä perustuvat selkärankareumapotilailla tehdyistä tutkimuksista saatuun tietoon.
Aikuiset selkärankareumapotilaat
Etanerseptin tehoa selkärankareuman hoidossa tutkittiin kolmessa satunnaistetussa kaksoissokkotutkimuksessa, joissa verrattiin etanersepti 25 mg:n kahdesti viikossa -annostelua lumelääkkeeseen. Tutkimuksiin osallistui 401 potilasta. Näistä potilaista 203 hoidettiin etanerseptillä. Kolmesta tutkimuksesta laajimpaan (n = 277) osallistuneet potilaat olivat iältään 18–70-vuotiaita, ja he sairastivat aktiivista selkärankareumaa, joka määriteltiin VAS-kipumittarin asteikolla arvoksi ≥ 30 mitattaessa keskimääräistä aamujäykkyyden kestoa ja voimakkuutta. Tämän lisäksi potilaalla piti olla ≥ 30 VAS-asteikon pistettä vähintään kahdessa seuraavista kolmesta parametrista: potilaan kokonaisarvio omasta tilastaan; yöllisen selkäkivun ja yleisen selkäkivun VAS-keskiarvo; kymmenestä Bath Ankylosing Spondylits Functional Index (BASFI) -toimintakykyindeksin kysymyksestä saatu keskiarvo. Potilaiden antireumaattista lääkitystä (DMAR), tulehduskipulääkitystä (NSAID) tai kortikosteroidilääkitystä voitiin jatkaa muuttumattomilla annoksilla. Tutkimukseen ei otettu mukaan potilaita, joiden selkäranka oli täysin jäykistynyt. Etanersepti 25 mg (annos perustuu nivelreumapotilailla tehtyihin annos-vastetutkimuksiin) tai lumelääke annosteltiin 138 potilaalle ihonalaisesti kahdesti viikossa kuuden kuukauden ajan.
Tehon primaarimittarina (ASAS 20) pidettiin ≥ 20 %:n paranemaa vähintään kolmessa neljästä Assessment in Ankylosing Spondylitis (ASAS) -kriteeristä (potilaan kokonaisarvio, selkäkipu, BASFI ja tulehdus) ja sitä, että neljännessä kriteerissä ei tapahtunut huononemista. ASAS 50- ja 70-vasteissa käytettiin vastaavia kriteerejä: ASAS 50 -vasteessa vähintään 50 % parantuminen tai ASAS 70 -vasteessa vähintään 70 % parantuminen.
Lumelääkkeeseen verrattuna etanerseptihoidolla saavutettiin merkitsevästi enemmän parantumista ASAS 20-, ASAS 50- ja ASAS 70 -vasteissa niinkin varhaisessa vaiheessa kuin 2 viikon kuluttua hoidon aloituksesta.
Selkärankareumaa sairastavien potilaiden vasteet lumelääkekontrolloidussa tutkimuksessa
| Prosenttia potilaista | ||
|---|---|---|
| Selkärankareumavaste | Lumelääke n = 139 | Etanersepti n = 138 |
| ASAS 20 | ||
| 2 viikkoa | 22 | 46a |
| 3 kuukautta | 27 | 60a |
| 6 kuukautta | 23 | 58a |
| ASAS 50 | ||
| 2 viikkoa | 7 | 24a |
| 3 kuukautta | 13 | 45a |
| 6 kuukautta | 10 | 42a |
| ASAS 70 | ||
| 2 viikkoa | 2 | 12b |
| 3 kuukautta | 7 | 29b |
| 6 kuukautta | 5 | 28b |
a p < 0,001, etanersepti vs lumelääke
b p = 0,002, etanersepti vslumelääke
Osalla etanerseptiä saaneista selkärankareumapotilaista kliininen vaste oli todettavissa ensimmäisen käynnin aikana (2 viikkoa), ja vaste säilyi koko 6 kuukauden hoidon ajan. Vasteet olivat potilailla samanlaiset riippumatta siitä, käytettiinkö lähtötilanteessa muuta samanaikaista lääkitystä.
Samanlaiset tulokset saatiin kahdesta pienemmästä selkärankareumatutkimuksesta.
Neljännessä tutkimuksessa arvioitiin kerran viikossa (kahtena ihonalaisena 25 mg:n injektiona) annetun 50 mg:n etanerseptiannoksen turvallisuutta ja tehoa verrattuna kahdesti viikossa annettuun 25 mg:n etanerseptiannokseen. Tähän kaksoissokkoutettuun, lumelääkekontrolloituun tutkimukseen osallistui 356 selkärankareumapotilasta. Kerran viikossa annetun 50 mg:n etanerseptihoidon turvallisuus- ja tehoprofiilit olivat samanlaiset kuin kahdesti viikossa annetulla 25 mg:n etanerseptillä.
Aikuispotilaat, joilla on aksiaalinen spondylartriitti ilman radiografista näyttöä selkärankareumasta
Tutkimus 1
Etanerseptin tehoa potilailla, jotka sairastivat aktiivista aksiaalista spondylartriittia ilman radiografista näyttöä selkärankareumasta (nr-AxSpa), arvioitiin satunnaistetussa 12 viikon lumelääkekontrolloidussa kaksoissokkotutkimuksessa. Tutkimuksessa seurattiin 215 aikuispotilasta (modifioitu hoitoaikeen mukainen eli intent-to-treat-populaatio), jotka sairastivat aktiivista aksiaalista spondylartriittia ilman radiografista näyttöä selkärankareumasta ja jotka olivat iältään 18–49-vuotiaita. Heidät määriteltiin potilaiksi, jotka täyttivät ASAS:n aksiaalista spondylartriittia koskevat luokittelukriteerit mutteivät selkärankareumaa koskevia modifioituja New York-kriteerejä. Potilailla tuli myös olla riittämätön vaste tai huono sietokyky kahdelle tai useammalle tulehduskipulääkkeelle (NSAID). Kaksoissokkojakson aikana potilaat saivat etanerseptiä 50 mg viikossa tai lumelääkettä 12 viikon ajan. Tehon primaarimittarina (ASAS 40) pidettiin 40 %:n paranemaa vähintään kolmessa neljästä ASAS-kriteeristä ja sitä, että neljännessä kriteerissä ei tapahtunut huononemista. Kaksoissokkojaksoa seurasi avoin jakso, jonka aikana kaikki potilaat saivat etanerseptiä 50 mg viikossa jopa 92 lisäviikon ajan. Risti-suoliluunivelen ja selkärangan magneettikuvaus suoritettiin, jotta voitaisiin arvioida tulehdusta lähtötilanteessa ja viikolla 12 ja 104.
Lumelääkehoitoon verrattuna etanerseptihoidolla saavutettiin tilastollisesti merkitsevästi suuremmat ASAS 40-, ASAS 20- ja ASAS 5/6 -vasteet. Myös osittaisen ASAS-remission ja BASDAI 50 -arvon saavutti merkittävästi suurempi osa näistä potilaista. Viikon 12 tulokset on esitetty seuraavassa taulukossa.
Tehovaste lumelääkekontrolloidussa nr-AxSpa-tutkimuksessa (aksiaalinen spondylartriitti ilman radiografista näyttöä selkärankareumasta): päätetapahtuman saavuttaneiden potilaiden prosenttiosuus
Kaksoissokkoutetut kliiniset vasteet viikolla 12 | Lumelääke n = 106–109* | Etanersepti n = 103–105* |
| ASAS** 40 | 15,7 | 32,4b |
| ASAS 20 | 36,1 | 52,4c |
| ASAS 5/6 | 10,4 | 33,0a |
| ASAS osittainen remissio | 11,9 | 24,8c |
| BASDAI***50 | 23,9 | 43,8b |
*Jotkut potilaat eivät antaneet täydellisiä tietoja kaikista päätetapahtumista.
**ASAS=Assessments in Spondyloarthritis International Society
***Bath Ankylosing Spondylitis Disease Activity Index
a: p < 0,001, b: < 0,01 ja c: < 0,05; p-arvot etanerseptiä ja lumelääkettä verrattaessa.
Etanerseptiä saaneilla potilailla havaittiin viikolla 12 tilastollisesti merkitsevää paranemista magneettikuvauksella mitatussa risti-suoliluunivelen SPARCC-pistemäärässä (SPARCC = Spondyloarthritis Research Consortium of Canada). Vakioitu keskimääräinen muutos lähtötilanteesta oli 3,8 etanerseptillä hoidetuilla potilailla (n = 95) ja 0,8 lumelääkkeellä hoidetuilla potilailla (n = 105) (p < 0,001). Viikolla 104 kaikilla etanerseptillä hoidetuilla potilailla keskimääräinen muutos lähtötilanteesta oli magneettikuvauksella mitatussa risti-suoliluunivelen SPARCC-pistemäärässä 4,64 (n = 153) ja selkärangan SPARCC-pistemäärässä 1,40 (n = 154).
Muutos lähtötilanteesta viikolle 12 oli tilastollisesti merkitsevästi parempi etanerseptillä kuin lumelääkkeellä suurimmassa osassa terveyteen liittyvistä elämänlaatuarvioinneista ja fyysisen toimintakyvyn arvioinneista, mukaan lukien BASFI (Bath Ankylosing Spondylitis Functional Index), EuroQol 5D -kokonaisindeksi ja SF-36-mittarin fyysisen toimintakyvyn komponentti.
Etanerseptiä saaneiden nr-AxSpa-potilaiden kliininen vaste oli havaittavissa ensimmäisen käynnin aikana (viikon 2 kohdalla), ja vaste säilyi 2 hoitovuoden ajan. Terveyteen liittyvän elämänlaadun ja fyysisen toimintakyvyn paraneminen säilyivät myös koko kahden hoitovuoden ajan. Mitään uusia turvallisuuslöydöksiä ei ilmennyt 2 vuoden aikana. Viikolla 104 selkärangan röntgentutkimuksessa 8 potilasta olivat edenneet mukaillun New Yorkin radiologisen luokittelun mukaan pistemäärissä bilateraaliseen luokkaan 2, mikä viittaa aksiaaliseen spondylartriittiin.
Tutkimus 2
Etanerseptihoidon lopettamista ja jatkamista potilailla, jotka sairastivat aktiivista aksiaalista spondylartriittia ilman radiografista näyttöä selkärankareumasta (nr‑AxSpa) ja joiden vaste oli riittämätön (inaktiivinen tauti, joka oli määritelty sairauden aktiivisuutta C-reaktiivisen proteiinin perusteella kuvaavina ASDAS-CRP-pisteinä [Ankylosing Spondylitis Disease Activity Score (ASDAS) C-reactive protein (CRP)] alle 1,3), arvioitiin avoimessa, faasin 4, kolmen jakson monikeskustutkimuksessa 24 hoitoviikon jälkeen.
Tutkimuksessa oli mukana 209 aikuispotilasta, jotka sairastivat aktiivista aksiaalista spondylartriittia ilman radiografista näyttöä selkärankareumasta (ikä 18–49 vuotta). Heidät määriteltiin potilaiksi, jotka täyttivät ASAS:n aksiaalista spondylartriittia koskevat luokittelukriteerit (mutteivät selkärankareumaa koskevia modifioituja New Yorkin kriteerejä), joilla oli magneettikuvauslöydöksiä (magneettikuvauksessa aktiivinen tulehdus, joka viittaa voimakkaasti spondylartriittiin liittyvään sakroiliittiin) ja/tai positiivinen hsCRP (joksi määritelty herkän C-reaktiivisen proteiinin [hsCRP] pitoisuus > 3 mg/l) sekä aktiivisia oireita, joiksi määriteltiin seulontakäynnillä ASDAS CRP ‑pisteet vähintään 2,1. Nämä potilaat saivat ensimmäisessä jaksossa 24 viikon ajan avointa etanerseptihoitoa 50 mg:n annoksina viikoittain sekä vakaata peruslääkitystä tulehduskipulääkkeillä optimaalisesti siedettynä tulehdusta hillitsevänä annostuksena. Potilailla piti olla myös riittämätön vaste kahteen tai useampaan tulehduskipulääkkeeseen tai he eivät sietäneet näitä. Viikon 24 aikapisteessä 119 (57 %) potilaalla oli inaktiivinen sairaus, joten he jatkoivat toiseen jaksoon, joka oli 40 viikkoa kestävä hoidon lopetusvaihe, jossa potilaat lopettivat etanerseptin käytön. Perushoitona käytetty tulehduskipulääkitys kuitenkin jatkui. Tehon primaarimittari oli sairauden paheneminen (määriteltiin sairauden aktiivisuutta laskon [ESR] perusteella kuvaavina ASDAS-ESR-pisteinä vähintään 2,1) Etanerseptihoidon lopettamisen jälkeisten 40 viikon aikana. Potilaat, joiden sairaus paheni, jatkoivat etanerseptihoitoa 50 mg:n annoksina viikoittain 12 viikon ajan (kolmas jakso).
Toisessa jaksossa niiden potilaiden osuus, joilla oli ≥ 1 sairauden paheneminen, lisääntyi 22 %:sta (25/112) viikon 4 aikapisteessä 67 %:iin (77/115) viikon 40 aikapisteessä. Sairaus paheni jossakin aikapisteessä etanerseptihoidon lopettamisen jälkeisten 40 viikon aikana kaikkiaan 75 %:lla (86/115) potilaista.
Tutkimuksen 2 keskeinen toissijainen tavoite oli arvioida sairauden pahenemiseen kuluvaa aikaa etanerseptihoidon lopettamisen jälkeen sekä lisäksi verrata sairauden pahenemiseen kuluvaa aikaa niihin tutkimuksen 1 potilaisiin nähden, jotka täyttivät tutkimuksen 2 hoidon lopettamista koskevaan vaiheeseen mukaan tulon edellytykset ja jatkoivat etanerseptihoitoa.
Sairauden pahenemiseen etanerseptihoidon lopettamisen jälkeen kuluneen ajan mediaani oli 16 viikkoa (95 %:n luottamusväli: 13–24 viikkoa). Alle 25 %:lla tutkimuksen 1 potilaista, joiden hoitoa ei lopetettu, sairaus paheni 40:tä viikkoa vastaavana ajanjaksona, kuten tutkimuksen 2 toisessa jaksossa. Sairauden pahenemiseen kulunut aika oli tilastollisesti merkitsevästi lyhyempi tutkittavilla, jotka lopettivat etanerseptihoidon (tutkimus 2), verrattuna jatkuvaa etanerseptihoitoa saaneisiin tutkittaviin (tutkimus 1), p < 0,0001.
Niistä 87 potilaasta, jotka tulivat mukaan kolmanteen jaksoon ja jatkoivat etanerseptihoitoa 50 mg:n annoksina viikoittain 12 viikon ajan, 62 %:lla (54/87) tauti rauhoittui inaktiiviseksi, ja näistä 50 %:lla taudin rauhoittuminen tapahtui 5 viikon kuluessa (95 %:n luottamusväli: 4‑8 viikkoa
Aikuiset läiskäpsoriaasipotilaat
Etanerseptia suositellaan käytettäväksi kohdan Käyttöaiheet käyttöaiheiden mukaisesti. Kohderyhmän potilaat, joiden ei katsottu saavuttaneen vastetta, eivät joko saavuttaneet riittävää vastetta (PASI < 50 tai PGA vähemmän kuin ”hyvä”) tai heidän tautinsa paheni hoidon aikana. Näille potilaille annettiin systeemistä hoitoa riittävällä annoksella tarpeeksi pitkän ajan, jotta vaste vähintään yhdelle kolmesta mainitusta systeemihoidosta voitiin arvioida.
Etanerseptin tehokkuutta muihin systeemisiin hoitoihin verrattuna ei ole arvioitu tutkimuksissa, joissa verrattaisiin etanerseptiä muihin systeemisesti annettaviin hoitoihin potilailla, joilla on keskivaikea tai vaikea psoriaasi (ja jotka vastaavat muihin systeemisiin hoitoihin). Sen sijaan etanerseptin turvallisuutta ja tehoa on tutkittu neljässä satunnaistetussa lumelääkekontrolloidussa kaksoissokkotutkimuksessa. Ensisijaisena tehoa mittaavana päätetapahtumana kaikissa neljässä tutkimuksessa oli kustakin hoitoryhmästä löytyvä potilasmäärä, joka saavutti 12 viikossa PASI 75 -indeksin (vähintään 75 %:n parannus psoriaasialueen ja -vaikeusasteen indeksin pisteytyksessä lähtötasoon verrattuna).
Tutkimus 1, joka oli vaiheen II-tutkimus, suoritettiin potilailla, jotka olivat vähintään 18-vuotiaita ja joilla oli aktiivinen, mutta kliinisesti vakaa läiskäpsoriaasi ( ≥ 10 % vartalon pinta-alasta). Satakaksitoista (112) potilasta satunnaistettiin saamaan etanerseptiä 25 mg (n = 57) tai lumelääkettä (n = 55) kahdesti viikossa 24 viikon ajan.
Tutkimuksessa 2 seurattiin 652 kroonista läiskäpsoriaasipotilasta ja hyödynnettiin samoja sisäänottokriteerejä kuin ensimmäisessä tutkimuksessa. Tämän lisäksi potilaiden PASI (Psoriaasialue ja –vaikeusaste-indeksi) –pisteiden piti olla tutkimuksen sisäänottovaiheessa vähintään 10. Etanerseptiä annettiin seuraavanlaisin annostuksin: 25 mg kerran viikossa, 25 mg kahdesti viikossa tai 50 mg kahdesti viikossa kuutena peräkkäisenä kuukautena. Potilaat saivat 12 ensimmäisen kaksoissokkotutkimusviikon aikana lumelääkettä tai etanerseptiä yhdellä edellä mainituista kolmesta annostuksista. 12 hoitoviikon jälkeen lumelääkeryhmässä olevat potilaat aloittivat sokkoutetun etanerseptihoidon (25 mg kahdesti viikossa). Potilailla, jotka olivat aktiivihoitoryhmissä, jatkettiin alkuperäistä satunnaistettua annostusta viikkoon 24 asti.
Tutkimuksessa 3 seurattiin 583 potilasta, jotka valittiin tutkimukseen samoilla kriteereillä kuin tutkimuksessa 2. Tutkimuksessa mukana olleet potilaat saivat etanerseptiä joko 25 mg tai 50 mg tai lumelääkettä kahdesti viikossa 12 viikon ajan. Sen jälkeen kaikki potilaat saivat avoimessa kliinisessä tutkimuksessa 25 mg etanerseptiä kahdesti viikossa vielä 24 viikkoa.
Tutkimuksessa 4 seurattiin 142 potilasta, jotka valittiin tutkimukseen samoilla kriteereillä kuin tutkimuksissa 2 ja 3. Tässä tutkimuksessa olevat potilaat saivat 50 mg etanerseptiä tai lumelääkettä kerran viikossa 12 viikon ajan. Sen jälkeen kaikki potilaat saivat avoimessa kliinisessä tutkimuksessa 50 mg etanerseptiä kerran viikossa toiset 12 viikkoa.
Tutkimuksessa 1 etanerseptillä hoidettu ryhmä saavutti merkitsevästi korkeamman PASI 75 -vasteen viikolla 12 (30 %) kuin ryhmä, joka sai lumelääkettä (2 %) (p < 0,0001). Viikolla 24 etanerseptillä hoidetusta ryhmästä 56 % potilaista saavutti PASI 75 -vasteen, kun taas lumelääkeryhmässä vastaava määrä oli 5 %. Tutkimusten 2, 3 ja 4 avaintulokset on esitetty alla.
Psoriaasipotilaiden vasteet tutkimuksissa 2,3 ja 4
Vaste (%) | Tutkimus 2 | Tutkimus 3 | Tutkimus 4 | ||||||||
| Lume-lääke | Etanersepti | Lume-lääke | Etanersepti | Lume-lääke | Etanersepti | ||||||
| 25 mg BIW | 50 mg BIW | 25 mg BIW | 50 mg BIW | 50 mg QW | 50 mg QW | ||||||
n = 166 | n = 162 | n = 162 | n = 164 | n = 164 | n = 193 | n = 196 | n = 196 | n = 46 | n = 96 | n = 90 | |
| vko 12 | vko 12 | vko 24a | vko 12 | vko 24a | vko 12 | vko 12 | vko 12 | vko 12 | vko 12 | vko 24a | |
| PASI 50 | 14 | 58* | 70 | 74* | 77 | 9 | 64* | 77* | 9 | 69* | 83 |
| PASI 75 | 4 | 34* | 44 | 49* | 59 | 3 | 34* | 49* | 2 | 38* | 71 |
DSGAb, puhdas tai melkein puhdas | 5 | 34* | 39 | 49* | 55 | 4 | 39* | 57* | 4 | 39* | 64 |
* p ≤ 0,0001 lumelääkkeeseen verrattuna
a Viikolla 24 tutkimuksissa 2 ja 4 ei tehty tilastollista vertailua lumelääkkeeseen, koska alkuperäinen lumelääkeryhmä sai etanerseptiä 25 mg kahdesti viikossa tai 50 mg kerran viikossa (QW) viikosta 13 viikkoon 24.
b Dermatologist Static Global Assessment. Puhdas tai melkein puhdas määritelmä: 0 tai 1 asteikolla 0–5.
Etanerseptiä saavilla läiskäpsoriaasipotilailla todettiin merkittävä vaste ensikäynnillä (2 viikon kohdalla) lumelääkkeeseen verrattuna, ja vaste säilyi kaikkien 24 hoitoviikon ajan.
Tutkimukseen 2 kuului myös jakso, jossa potilailta, jotka saavuttivat vähintään 50 %:n PASI-indeksiparannuksen viikolla 24, lopetettiin hoito. Potilaita seurattiin hoidottomana aikana mahdollisen rebound-ilmiön varalta (PASI ≥ 150 % lähtötasosta) ja relapsin (vähintään puolet lähtötason ja viikon 24 välillä saavutetusta parantumisesta menetetty) alkuun kuluvan ajan määrittämiseksi. Kyseisen ajanjakson aikana psoriaasin oireet palasivat vähitellen (keskimääräinen aika taudin relapsiin 3 kuukautta). Taudin uudelleen-aktivoitumista tai psoriaasikseen viittaavia vakavia haittavaikutuksia ei ilmennyt. Tutkimuksesta saatiin kohtuullisesti näyttöä sen tueksi, että etanerseptihoito kannattaa aloittaa uudelleen potilaille, jotka alun perin vastasivat hoitoon.
Tutkimuksessa 3 suurimmalla osalla (77 %) potilaista, jotka oli alun perin satunnaistettu saamaan etanerseptiä 50 mg kahdesti viikossa ja joiden annostusta vähennettiin viikolla 12 annokseen 25 mg kahdesti viikossa, säilyi PASI 75 -vaste viikon 36 loppuun asti. Niillä potilailla, jotka saivat etanerseptiä 25 mg kahdesti viikossa koko tutkimuksen ajan, PASI 75 -vaste parani koko ajan viikolta 12 viikolle 36.
Tutkimuksessa 4 suurempi määrä etanerseptiryhmän potilaista (38 %) saavutti PASI 75 -vasteen viikolla 12 lumelääkeryhmään (2 %) verrattuna (p < 0,0001). Tehovaste parani koko ajan niillä potilailla, jotka saivat etanerseptiä 50 mg kerran viikossa koko tutkimuksen ajan. Viikolla 24 PASI 75 -vasteen saavutti 71 % näistä potilaista.
Enimmillään 34 kuukautta kestäneissä pitkäaikaisissa avoimissa tutkimuksissa, joissa etanerseptiä annettiin ilman taukoja, kliiniset vasteet säilyivät ja turvallisuustulokset olivat verrannollisia lyhytaikaisista tutkimuksista saatuihin tuloksiin.
Kliinisen tutkimustiedon analysoinnissa ei ilmennyt sellaisia perussairauden piirteitä, joiden perusteella voitaisiin valita sopiva annostusvaihtoehto (jaksoittainen tai jatkuva). Tästä johtuen jaksoittaisen tai jatkuvan hoitovaihtoehdon valinnan on perustuttava lääkärin harkintaan ja potilaan yksilöllisiin tarpeisiin.
Etanerseptin vasta-aineet
Etanerseptin vasta-aineita on löydetty joidenkin etanerseptillä hoidettujen henkilöiden seerumista. Nämä vasta-aineet ovat yleensä olleet ei-neutralisoivia ja ohimeneviä. Vasta-aineiden muodostuksen ja kliinisen vasteen tai haittavaikutusten välillä ei vaikuta olevan korrelaatiota.
Pediatriset potilaat
Juveniilia idiopaattista artriittia sairastavat lapsipotilaat
Etanerseptin turvallisuutta ja tehoa tutkittiin kaksiosaisessa tutkimuksessa 69:llä taudinkulultaan polyartikulaarista juveniilia idiopaattista artriittia sairastavalla lapsella, joilla oli monentyyppistä taudin puhkeamisvaiheen juveniilia idiopaattista artriittia (polyartriittia, oligoartriittia, yleisoireista artriittia). Tutkimukseen otettiin 4‑17-vuotiaita potilaita, joilla oli kohtalainen tai erittäin aktiivinen taudinkulultaan polyartikulaarinen juveniili idiopaattinen artriitti, johon metotreksaatti ei tehonnut tai jotka eivät sietäneet sitä. Potilaille annosteltiin vakioannos yhtä ei-steroidista tulehduskipulääkettä ja/tai prednisonia (< 0,2 mg/kg päivässä tai enintään 10 mg). Tutkimuksen ensimmäisessä osassa kaikki potilaat saivat etanerseptiä kahdesti viikossa ihonalaisesti 0,4 mg/kg (enintään 25 mg/annos). Tutkimuksen toisessa osassa potilaat, joilla todettiin kliininen vaste 90 päivän kuluttua hoidon alkamisesta, satunnaistettiin jatkamaan etanerseptihoitoa tai saamaan lumelääkettä neljän kuukauden ajan ja taudin pahenemista arvioitiin. Vaste mitattiin ACR Pedi 30:llä, jossa vasteeksi katsotaan 30 % paraneminen vähintään kolmessa kuudesta ja 30 % paheneminen korkeintaan yhdessä kuudesta JRA:n pääkriteeristä, joita ovat mm. aktiivisten nivelten määrä, liikuntarajoitteisuus, lääkärin ja potilaan/vanhempien yleisarviot (PGA), toimintakyvyn arvio sekä lasko. Taudin pahenemiskriteerejä olivat 30 % paheneminen kolmessa kuudesta JRA:n pääkriteeristä ja 30 % paraneminen korkeintaan yhdessä kuudesta JRA:n pääkriteeristä sekä vähintään kaksi aktiivista niveltä.
Tutkimuksen ensimmäisessä osassa 51:llä 69:stä (74 %) potilaasta todettiin kliininen vaste ja nämä siirtyivät tutkimuksen toiseen osaan. Tutkimuksen toisessa osassa tauti paheni 6 potilaalla 25:stä
(24 %) kun taas lumelääkettä saaneilla potilailla tauti paheni 20:lla 26:sta (77 %) (p = 0,007). Mediaaniaika tutkimuksen toisen osan alusta, taudin pahenemiseen oli 116 päivää etanerseptiä saaneilla potilailla ja 28 päivää lumelääkettä saaneilla potilailla. Osa tutkimuksen toiseen osaan siirtyneistä etanerseptiä saaneista potilaista, joilla kliininen vaste oli todettu 90 päivän kuluttua tutkimuksen alkamisesta, parani edelleen kolmannen ja seitsemännen kuukauden välisenä aikana, mutta lumelääkettä saaneet potilaat eivät osoittaneet paranemista.
Edellä mainitun tutkimuksen pediatrisista potilaista 58 osallistui avoimeen, turvallisuutta selvittäneeseen jatkotutkimukseen, jossa he käyttivät etanerseptiä jopa 10 vuotta. Potilaat olivat tutkimuksen aloittaessaan vähintään 4‑vuotiaita. Vakavien haittatapahtumien ja vakavien infektioiden määrät eivät lisääntyneet pitkän altistuksen seurauksena.
Etanersepti-monoterapian (n = 103), etanerseptin ja metotreksaatin yhdistelmän (n = 294) ja metotreksaatti-monoterapian (n = 197) pitkäaikaista turvallisuutta arvioitiin enintään 3 vuoden ajan aineistosta, johon kuului 594 juveniilia idiopaattista artriittia sairastavaa lasta (iältään 2‑18 vuotta), joista 39 oli 2‑3-vuotiaita. Infektioita raportoitiin kaiken kaikkiaan yleisemmin etanerseptiä, kuin pelkkää metotreksaattia saaneilla potilailla (3,8 vs. 2 %), ja etanerseptin käyttöön liittyvät infektiot olivat vaikea-asteisempia.
Toisessa avoimessa, yksihaaraisessa tutkimuksessa potilaat (n = 127), joilla oli joko laajeneva oligoartriitti (yhteensä 60 potilasta: 15 iältään 2–4-vuotiaita, 23 iältään 5–11-vuotiaita ja 22 iältään 12‑17-vuotiaita), entesiittiin liittyvä artriitti (38 potilasta, iältään 12–17-vuotiaita) tai psoriaasiartriitti (29 potilasta, iältään 12–17-vuotiaita), saivat 0,8 mg/kg etanerseptiä (enintään 50 mg/annos) kerran viikossa 12 viikon ajan. Suurin osa juveniilin idiopaattisen artriitin jokaisen alatyypin potilaista saavutti ACR Pedi 30 -vasteen sekä kliinistä paranemista toissijaisten päätemuuttujien, kuten aristavien nivelten määrän sekä lääkärin tekemän yleisarvion, suhteen. Turvallisuusprofiili oli yhdenmukainen muiden juveniilia idiopaattista artriittia koskeneiden tutkimusten kanssa.
Kantatutkimuksen 127 potilaasta 109 potilasta osallistui avoimeen jatkotutkimukseen, ja heitä seurattiin vielä 8 vuoden ajan eli yhteensä enintään 10 vuoden ajan. Jatkotutkimuksen päättyessä 84 potilasta 109 potilaasta (77 %) oli ollut tutkimuksessa mukana sen loppuun saakka; 27 (25 %) käytti etanerseptiä aktiivisesti, seitsemän (6 %) oli lopettanut hoidon sairauden vähäisyyden/inaktiivisuuden vuoksi, viisi (5 %) oli aloittanut etanerseptihoidon uudelleen lopetettuaan sen aiemmin, ja 45 potilasta (41 %) oli lopettanut etanerseptin käytön (mutta pysyi seurannassa); 25 potilasta 109 potilaasta (23 %) oli vetäytynyt tutkimuksesta pysyvästi. Kantatutkimuksessa saavutettu kliinisen tilan paraneminen oli yleensä säilynyt kaikkien tehon päätemuuttujien osalta koko seurantajakson ajan. Etanerseptiä aktiivisesti käyttäneillä potilailla oli mahdollisuus siirtyä valinnaiseen jaksoon, jossa hoito lopetettiin ja aloitettiin uudelleen kerran jatkotutkimuksen aikana tutkijan kliinisestä vasteesta tekemän arvion perusteella. Hoidon lopettamista koskeneeseen jaksoon tuli mukaan 30 potilasta. 17 potilaalla raportoitiin sairauden paheneminen (joksi määriteltiin kuudesta ACR Pedi ‑komponentista vähintään kolmen huononeminen ≥ 30 % ja lopuista komponentista enintään yhden paraneminen ≥ 30 % sekä vähintään kaksi aktiivista niveltä); sairauden pahenemiseen etanerseptihoidon lopettamisen jälkeen kulunut aika (mediaani) oli 190 päivää. 13 potilasta sai hoitoa uudelleen, ja hoidon lopettamisesta sen uudelleen aloittamiseen kuluneen ajan (mediaani) arvioitiin olleen 274 päivää. Koska datapisteitä oli vähän, näitä tuloksia on tulkittava varoen.
Turvallisuusprofiili oli yhdenmukainen kantatutkimuksessa havaitun turvallisuusprofiilin kanssa.
Juveniilia idiopaattista artriittia sairastavilla potilailla ei ole tutkittu, miten edelleen jatkettu etanerseptihoito vaikuttaa niillä potilailla, joilla vastetta ei todettu kolmen kuukauden kuluessa etanerseptihoidon alkamisesta. Tutkimuksia ei myöskään ole tehty etanerseptin suositusannoksen pienentämisen vaikutuksista pitkäaikaisen käytön jälkeen juveniilia idiopaattista artriittia sairastavilla potilailla.
Läiskäpsoriaasia sairastavat lapsipotilaat
Etanerseptin tehoa tutkittiin satunnaistetussa, lumelääkekontrolloidussa kaksoissokkotutkimuksessa 211 lapsipotilaalla, jotka olivat iältään 4–17-vuotiaita ja jotka sairastivat keskivaikeaa tai vaikeaa läiskäpsoriaasia (määritelty sPGA ≥ 3, BSA ≥ 10 % vartalon pinta-alasta ja PASI ≥ 12 –kriteereillä). Tutkimukseen mukaan otetuille potilaille oli aikaisemmin annettu valohoitoa tai systeemistä hoitoa tai vaste paikallishoidoilla oli ollut riittämätön.
Potilaille annettiin 0,8 mg/kg etanerseptiä (enintään 50 mg) tai lumelääkettä kerran viikossa 12 viikon ajan. Viikolla 12 useampi etanerseptihaaraan kuin lumelääkehaaraan satunnaistetuista potilaista, sai suotuisan vasteen (PASI 75).
Läiskäpsoriaasia sairastavien lasten tulokset 12 viikon kohdalla
Etanersepti 0,8 mg/kg kerran viikossa (n = 106) |
Lumelääke (n = 105) | |
| PASI 75, n (%) | 60 (57 %)a | 12 (11 %) |
| PASI 50, n (%) | 79 (75 %)a | 24 (23 %) |
| sPGA ”clear” tai ”minimal”, n (%) | 56 (53 %)a | 14 (13 %) |
Lyhenne: sPGA – static Physician Global Assessment
a p < 0,0001 verrattuna lumelääkkeeseen
12 viikon kaksoissokkoutetun jakson jälkeen kaikille potilaille annettiin 0,8 mg/kg etanerseptiä (enintään 50 mg/annos) kerran viikossa seuraavat 24 viikkoa. Avoimen jakson aikana todetut vasteet olivat samankaltaiset kuin kaksoissokkojakson aikana havaitut.
Satunnaistetun lopetusvaiheen aikana merkitsevästi useampi potilas, joka oli uudelleen satunnaistettu lumelääkkeelle, sai relapsin (PASI 75 vasteen menetys) verrattuna potilaisiin, jotka oli uudelleen satunnaistettu etanerseptille. Jatkohoidossa vasteet säilyivät 48 viikkoon asti.
Kerran viikossa annettavan 0,8 mg/kg etanerseptin (enintään 50 mg/annos) pitkäaikaista tehoa ja turvallisuutta arvioitiin avoimessa jatkotutkimuksessa, jossa oli mukana 181 läiskäpsoriaasia sairastavaa lapsipotilasta, enintään kahden vuoden ajan yllä mainitun 48 viikon lisäksi. Pitkäaikainen kokemus etanerseptistä oli yleisesti verrattavissa alkuperäisestä 48 viikon mittaisesta tutkimuksesta saatuun kokemukseen, eikä uusia turvallisuuslöydöksiä ilmaantunut
Farmakokinetiikka
Etanerseptin seerumiarvoja on tutkittu ELISA-menetelmällä (Enzyme-Linked Immunosorbent Assay), joka saattaa tunnistaa ELISA:lle herkkiä hajoamistuotteita sekä kantayhdisteen.
Imeytyminen
Etanersepti imeytyy hitaasti ihonalaisesta injektiokohdasta, ja huippupitoisuus saavutetaan noin 48 tuntia kerta-annoksen jälkeen. Absoluuttinen hyötyosuus on 76 %. Kahdesti viikossa tapahtuvan annon yhteydessä vakaan tilan pitoisuuksien odotetaan olevan noin kaksinkertaisia kerta-annoksilla saavutettaviin pitoisuuksiin verrattuna. Kun etanerseptiä annettiin kerta-annoksena 25 mg ihon alle, keskimääräiset huippupitoisuudet seerumissa terveillä vapaaehtoisilla olivat 1,65 ± 0,66 mikrog/ml, ja pitoisuuskäyrän alainen alue (AUC) oli 235 ± 96,6 mikrog × h/ml.
Annostuksella 50 mg kerran viikossa nivelreumapotilaiden (n = 21) keskiarvoiset pitoisuusprofiilit seerumissa vakaassa tilassa olivat Cmax 2,4 mg/l, Cmin 1,2 mg/l ja osittainen AUC 297 mg × h/l. Annostuksella 25 mg kahdesti viikossa (n = 16) vastaavat luvut olivat 2,6 mg/l, 1,4 mg/l ja 316 mg × h/l. Avoimessa kahden hoidon vaihtovuoroisessa (crossover) kerta-annostutkimuksessa etanerseptiä annettiin kerta-annoksena terveille vapaaehtoisille. Todettiin, että 50 mg/ml -injektio oli biologisesti samanarvoinen kuin kaksi samanaikaista 25 mg/ml -injektiota.
Selkärankareumapotilailla tehdyissä populaatiofarmakokineettisissä analyyseissä etanerseptin vakaan tilan AUC oli 466 mikrog × h/ml, kun 50 mg:n etanerseptiä annettiin kerran viikossa (n = 154) ja 474 mikrog × h/ml, kun 25 mg etanerseptiä annettiin kahdesti viikossa (n = 148).
Jakautuminen
Etanerseptin pitoisuus-aikakäyrää kuvaamaan tarvitaan bieksponentiaalinen käyrä. Etanerseptin keskeinen jakautumistilavuus on 7,6 l ja vakaan tilan jakautumistilavuus on 10,4 l.
Eliminaatio
Etanersepti poistuu hitaasti elimistöstä. Puoliintumisaika on pitkä, noin 70 tuntia. Puhdistuma on nivelreumapotilailla noin 0,066 l/h, mikä on jonkin verran alhaisempi kuin terveillä vapaaehtoisilla todettu 0,11 l/h. Lisäksi etanerseptin farmakokinetiikka on samanlainen nivelreuma-, selkärankareuma- ja läiskäpsoriaasipotilailla.
Miesten ja naisten välillä ei näytä olevan farmakokineettistä eroa.
Lineaarisuus
Suhdetta annokseen ei ole tutkittu muodollisesti, mutta puhdistuman saturaatiota ei näytä tapahtuvan käytetyllä annosalueella.
Erityispotilasryhmät
Munuaisten vajaatoiminta
Vaikka radioaktiivisuutta todetaan virtsassa annettaessa radioaktiivisesti merkittyä etanerseptiä potilaille ja vapaaehtoisille, etanerseptin pitoisuuksien suurenemista ei todettu potilailla, joilla oli akuutti munuaisten vajaatoiminta. Munuaisten vajaatoiminnassa annostuksen muuttamisen ei pitäisi olla tarpeen.
Maksan vajaatoiminta
Etanerseptin pitoisuuksien suurenemista ei todettu potilailla, joilla oli akuutti maksan vajaatoiminta. Maksan vajaatoiminnassa annostuksen muuttamisen ei pitäisi olla tarpeen.
Iäkkäät henkilöt
Vanhuuden merkitystä tutkittiin seerumin etanerseptipitoisuuksien väestöfarmakokineettisessä analyysissa. Puhdistuman ja jakautumistilavuuden arviot 65–87-vuotiailla potilailla olivat samanlaiset kuin arviot alle 65-vuotiailla.
Pediatriset potilaat
Juveniilia idiopaattista artriittia sairastavat lapsipotilaat
Etanerseptillä tehdyssä tutkimuksessa oli mukana 69 taudinkulultaan polyartikulaarista juveniilia idiopaattista artriittia sairastavaa potilasta (4‑17-vuotiaita), jotka saivat 0,4 mg/kg etanerseptiä kahdesti viikossa kolmen kuukauden ajan. Seerumipitoisuusprofiilit olivat samanlaiset kuin aikuisilla nivelreumapotilailla. Nuorimmilla (4‑vuotiailla) lapsilla puhdistuma oli pienempi (suurempi puhdistuma suhteutettuna painoon) kuin vanhemmilla (12‑vuotiailla) lapsilla ja aikuisilla. Annosta suhteutettaessa vanhemmilla (10‑17-vuotiailla) lapsilla seerumitasot ovat lähes samat kuin aikuisilla. Nuoremmilla lapsilla tasot ovat huomattavasti alhaisemmat.
Läiskäpsoriaasia sairastavat lapsipotilaat
Läiskäpsoriaasia sairastaville lapsipotilaille (4‑17-vuotiaat) annettiin 0,8 mg/kg (korkeintaan 50 mg/annos) etanerseptiä kerran viikossa 48 viikkoon asti. Vakaan tilan keskipitoisuudet seerumissa
olivat 1,6‑2,1 mikrog/ml viikolla 12, 24 ja 48. Nämä keskipitoisuudet läiskäpsoriaasia sairastavilla lapsipotilailla olivat samanlaiset kuin juveniilia idiopaattista artriittia sairastavien lapsipotilaiden, joita oli hoidettu 0,4 mg/kg etanerseptillä kahdesti viikossa, enintään 50 mg:n viikkoannoksella. Nämä keskipitoisuudet olivat samanlaisia kuin aikuisilla läiskäpsoriaasipotilailla, joita oli hoidettu 25 mg etanerseptillä kahdesti viikossa.
Prekliiniset tiedot turvallisuudesta
Etanerseptin toksikologisissa tutkimuksissa ei todettu annosta rajoittavaa eikä kohde-elintoksisuutta. Etanersepti katsottiin ei-genotoksiseksi in vitro- ja in vivo-tutkimussarjoissa. Karsinogeenisyyttä ja lisääntymis- ja kehitystoksisuutta koskevia tavanomaisia tutkimuksia ei ole tehty etanerseptillä, koska sille kehittyy neutraloivia vasta-aineita jyrsijöillä.
Etanersepti ei aiheuttanut kuolleisuutta tai huomattavaa toksisuutta hiirillä tai rotilla, kun 2 000 mg/kg annettiin ihonalaisesti tai 1 000 mg/kg suonensisäisesti. Etanersepti ei aiheuttanut annosta rajoittavaa tai kohde-elintoksisuutta apinoilla, kun niille annettiin ihonalaisesti annos (15 mg/kg) kahdesti viikossa 4 tai 26 viikon ajan. Tällä annoksella pitoisuus seerumissa oli AUC:n perusteella vähintään 27-kertainen ihmisen suositeltuun terapeuttiseen annokseen (25 mg) nähden.
Farmaseuttiset tiedot
Apuaineet
Sakkaroosi
Natriumkloridi
Natriumdivetyfosfaattimonohydraatti
Dinatriumvetyfosfaattiheptahydraatti
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
3 vuotta
Säilytys
Säilytettävä jääkaapissa (2°C – 8°C).
Ei saa jäätyä.
Pidä esitäytetyt ruiskut ulkopakkauksessa valolta suojattuina.
Kun olet ottanut ruiskun jääkaapista, odota noin 30 minuuttia, kunnes ruiskussa oleva Benepali-liuos on lämmennyt huoneenlämpöiseksi. Älä lämmitä sitä millään muulla tavalla. On suositeltavaa, että liuos käytetään välittömästi tämän jälkeen.
Benepali-valmistetta voidaan säilyttää alle 30°C:n lämpötilassa yhden enintään 31 vuorokauden jakson ajan, minkä jälkeen sitä ei enää voi laittaa jääkaappiin. Benepali on hävitettävä, jos sitä ei käytetä 31 vuorokauden kuluessa siitä, kun se on otettu jääkaapista.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BENEPALI injektioneste, liuos, esitäytetty ruisku
25 mg (L:ei) 4 kpl (0,51 ml) (277,41 €)
PF-selosteen tieto
Kirkas lasinen (tyypin 1) esitäytetty ruisku, jossa on neula ruostumattomasta teräksestä, kuminen neulansuojus ja kuminen mäntä ja joka sisältää 0,51 ml liuosta.
Benepali on saatavana 4 esitäytettyä ruiskua sisältävinä pakkauksina, 8 esitäytettyä ruiskua sisältävinä kerrannaispakkauksina (2 pakkausta, joissa kummassakin 4 ruiskua), ja 24 esitäytettyä ruiskua sisältävinä kerrannaispakkauksina (6 pakkausta, joissa kussakin 4 ruiskua). Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkas tai hieman opaalinhohtoinen, väritön tai vaaleankeltainen, ja sen pH on 6,2 ± 0,3. Liuoksen osmolaliteetti on 325 ± 35 mosm/kg.
Käyttö- ja käsittelyohjeet
Kertakäyttöisen esitäytetyn Benepali-ruiskun pitää olla huoneenlämpöinen pistettäessä (pidä huoneenlämmössä noin 30 minuuttia). Neulansuojusta ei saa poistaa esitäytetyn ruiskun lämmetessä huoneenlämpöiseksi. Liuoksen pitää olla kirkas tai hieman opaalinhohtoinen, väritön tai vaaleankeltainen, ja se voi sisältää pieniä läpikuultavia tai valkoisia proteiinihiukkasia.
Yksityiskohtaiset ohjeet lääkevalmisteen antamiseen löytyvät pakkausselosteesta kohdasta 7. ”Käyttöohjeet”.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BENEPALI injektioneste, liuos, esitäytetty ruisku
25 mg 4 kpl
- Alempi erityiskorvaus (65 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli ja tosilitsumabi (tulehdukselliset reumasairaudet): Nivelreuman, juveniilin polyartriitin, psoriaasiin liittyvän niveltulehduksen, selkärankareuman tai edellä mainittuja niveltulehduksia läheisesti muistuttavan niveltulehduksen hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman hoito erityisin edellytyksin (281).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Abatasepti, adalimumabi, bimekitsumabi, etanersepti, golimumabi, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sarilumabi, sekukinumabi, sertolitsumabipegoli, tosilitsumabi ja ustekinumabi (tulehdukselliset reumasairaudet): Eräiden reumasairauksien hoito erityisin edellytyksin / Adalimumabi: Uveiitin hoito erityisin edellytyksin / Tosilitsumabi: Aktiivisen yleisoireisen lastenreuman ja jättisoluarteriitin hoito erityisin edellytyksin (313), Adalimumabi, bimekitsumabi, brodalumabi, etanersepti, guselkumabi, iksekitsumabi, infliksimabi, risankitsumabi, sekukinumabi, sertolitsumabipegoli, tildrakitsumabi ja ustekinumabi (ihopsoriaasi): Vaikean kroonisen ihopsoriaasin hoito erityisin edellytyksin (319).
- Oikeus käyttää samaa biologista lääkettä (sama kauppanimi) 6 kk ajan.
ATC-koodi
L04AB01
Valmisteyhteenvedon muuttamispäivämäärä
01.12.2025
Yhteystiedot
Bertel Jungin aukio 5 C
02600 Espoo
0207 401 200
www.biogen.fi
www.MS-nyt.fi
