RYBELSUS tabletti 3 mg, 7 mg, 14 mg
Vaikuttavat aineet ja niiden määrät
Rybelsus 3 mg tabletit
Yksi tabletti sisältää 3 mg semaglutidia*.
Rybelsus 7 mg tabletit
Yksi tabletti sisältää 7 mg semaglutidia*.
Rybelsus 14 mg tabletit
Yksi tabletti sisältää 14 mg semaglutidia*.
Rybelsus 25 mg tabletit (ei kaupan Suomessa)
Yksi tabletti sisältää 25 mg semaglutidia*.
Rybelsus 50 mg tabletit (ei kaupan Suomessa)
Yksi tabletti sisältää 50 mg semaglutidia*.
* ihmisen glukagoninkaltaisen peptidi 1:n (GLP‑1) analogi, joka on tuotettu yhdistelmä-DNA-tekniikalla Saccharomyces cerevisiae ‑soluissa.
Apuaine, jonka vaikutus tunnetaan
Yksi tabletti sisältää 23 mg natriumia semaglutidin vahvuudesta riippumatta.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti
Kliiniset tiedot
Käyttöaiheet
Rybelsus on tarkoitettu aikuisille riittämättömässä hoitotasapainossa oleville tyypin 2 diabetesta sairastaville potilaille glukoositasapainon parantamiseen ruokavalion ja liikunnan lisänä
- monoterapiana, kun metformiinin käyttöä ei voida pitää tarkoituksenmukaisena
- yhdistelmänä muiden diabeteksen hoitoon käytettävien lääkevalmisteiden kanssa.
Tutkimustulokset eri yhdistelmähoidoista, vaikutuksista glukoositasapainoon ja sydän- ja verisuonitautitapahtumiin sekä tutkimuspopulaatioista ovat luettavissa kohdissa Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakodynamiikka.
Annostus ja antotapa
Annostus
Aloitusannos on 3 mg semaglutidia kerran vuorokaudessa kuukauden ajan. Kuukauden kuluttua annos pitää suurentaa ylläpitoannokseen 7 mg kerran vuorokaudessa. Tarvittaessa annos voidaan suurentaa seuraavalle tasolle, kun edellistä annosta on käytetty vähintään kuukauden ajan. Suositellut päivittäiset kerta-annokset ylläpitoon ovat 7 mg ja 14 mg.
Semaglutidin suurin suositeltu päivittäinen kerta-annos on 50 mg. Rybelsus-valmistetta pitää aina ottaa annostuksella yksi tabletti vuorokaudessa. Suuremman annoksen vaikutuksen saavuttamiseksi ei pidä ottaa enempää kuin yksi tabletti vuorokaudessa.
Siirtyminen ihon alle annettavasta semaglutidihoidosta suun kautta annettavaan semaglutidihoitoon
Vaikutusta, joka aiheutuu siirtymisestä suun kautta annettavasta semaglutidihoidosta ihon alle annettavaan semaglutidihoitoon tai päinvastoin, ei voida helposti ennustaa, koska suun kautta annetun semaglutidin imeytymisessä on enemmän farmakokineettista vaihtelua kuin ihon alle annetun semaglutidin imeytymisessä.
Potilaat, jotka saavat 0,5 mg semaglutidia ihon alle kerran viikossa, voivat siirtyä saamaan 7 mg tai 14 mg suun kautta annettavaa semaglutidia kerran vuorokaudessa.
Potilaat, jotka saavat 1 mg semaglutidia ihon alle kerran viikossa, voivat siirtyä saamaan 14 mg suun kautta annettavaa semaglutidia kerran vuorokaudessa.
Potilaat voivat siirtyä käyttämään suun kautta annettavaa semaglutidia (Rybelsus-valmistetta), kun viimeisen ihon alle annetun semaglutidiannoksen saamisesta on kulunut yksi viikko.
Kun semaglutidia käytetään yhdistelmänä metformiinin ja/tai natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2) estäjän tai tiatsolidiinidionin kanssa, metformiinin ja/tai SGLT2:n estäjän tai tiatsolidiinidionin senhetkistä annosta ei tarvitse muuttaa.
Kun semaglutidia käytetään yhdistelmänä sulfonyyliurean tai insuliinin kanssa, sulfonyyliurea- tai insuliiniannoksen pienentämistä voidaan harkita hypoglykemiariskin pienentämiseksi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Semaglutidiannoksen säätäminen ei vaadi verenglukoosin omaseurantaa. Verenglukoosin omaseuranta on tarpeen sulfonyyliurean ja insuliinin annoksen säätämiseksi, etenkin semaglutidihoitoa aloitettaessa ja insuliiniannosta pienennettäessä. Insuliiniannosta on suositeltavaa pienentää asteittain.
Unohtunut annos
Jos annoksen ottaminen unohtuu, unohtunut annos jätetään väliin ja seuraava annos otetaan seuraavana päivänä.
Iäkkäät
Annosta ei tarvitse säätää iän perusteella.
Munuaisten vajaatoiminta
Annoksen säätäminen ei ole tarpeen, jos potilaalla on lievä, keskivaikea tai vaikea munuaisten vajaatoiminta. Semaglutidihoidosta potilailla, joilla on loppuvaiheen munuaissairaus, on vain vähän kokemusta. Varovaisuutta on noudatettava, kun näitä potilaita hoidetaan suun kautta annettavalla semaglutidilla (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annoksen säätäminen ei ole tarpeen, jos potilaalla on maksan vajaatoiminta. Vaikeaa maksan vajaatoimintaa sairastavien potilaiden semaglutidihoidosta on vain vähän kokemusta. Varovaisuutta on noudatettava, kun näitä potilaita hoidetaan semaglutidilla (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Rybelsus-valmisteen turvallisuutta ja tehoa alle 18 vuoden ikäisten lasten ja nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Rybelsus on tabletti, joka otetaan suun kautta kerran vuorokaudessa.
- Tämä lääkevalmiste pitää ottaa tyhjään mahaan, suositeltavimmin vähintään 8 tunnin pituisen paaston jälkeen (ks. kohta Farmakokinetiikka).
- Se niellään kokonaisena, ja samalla juodaan pieni määrä vettä (enintään puoli lasillista, mikä vastaa noin 120 ml:aa vettä). Tabletteja ei saa jakaa, murskata tai pureskella, sillä ei tiedetä, vaikuttaako se semaglutidin imeytymiseen.
- Potilaan on odotettava vähintään 30 minuuttia ennen syömistä, juomista tai muiden suun kautta otettavien lääkevalmisteiden ottamista. Alle 30 minuutin odotusaika vähentää semaglutidin imeytymistä (ks. kohdat Yhteisvaikutukset ja Farmakokinetiikka).
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yleistä tietoa
Semaglutidia ei saa käyttää tyypin 1 diabetesta sairastaville potilaille eikä diabeettisen ketoasidoosin hoitoon. Diabeettista ketoasidoosia on ilmoitettu insuliinista riippuvaisilla potilailla, joiden insuliinihoito on äkillisesti lopetettu tai joiden insuliiniannosta on äkillisesti pienennetty, kun hoito GLP‑1-reseptoriagonistilla on aloitettu (ks. kohta Annostus ja antotapa).
New York Heart Associationin (NYHA) luokan IV kongestiivista sydämen vajaatoimintaa sairastavien potilaiden hoidosta ei ole kokemusta, ja sen vuoksi semaglutidia ei suositella näille potilaille.
Semaglutidin käytöstä potilaille, joille on tehty lihavuusleikkaus, ei ole kokemusta.
Aspiraatio yleisanestesian tai syvän sedaation yhteydessä
GLP-1 -reseptoriagonisteja yleisanestesiassa tai syvässä sedaatiossa saaneilla potilailla on ilmoitettu aspiraatiopneumoniatapauksista. Siksi on otettava huomioon lisääntynyt riski mahaan jääneestä sisällöstä viivästyneen tyhjentymisen takia (ks. kohta Haittavaikutukset) ennen yleisanestesian tai syvän sedaation aikana suoritettavia toimenpiteitä.
Vaikutukset ruoansulatuselimistöön ja kuivuminen
GLP-1-reseptoriagonistien käyttöön voi liittyä ruoansulatuselimistön haittavaikutuksia. Tämä on otettava huomioon hoidettaessa munuaisten vajaatoimintaa sairastavia potilaita, sillä pahoinvointi, oksentelu ja ripuli voivat aiheuttaa kuivumista, joka voi harvinaisissa tapauksissa johtaa munuaisten toiminnan heikkenemiseen (ks. kohta Haittavaikutukset). Semaglutidia saaville potilaille on kerrottava ruoansulatuselimistön haittavaikutuksiin liittyvästä mahdollisesta kuivumisen riskistä, ja heitä on neuvottava ryhtymään varotoimiin nestevajeen välttämiseksi.
Akuutti haimatulehdus
GLP-1-reseptoriagonistien käytön yhteydessä on todettu akuutteja haimatulehduksia. Potilaille on kerrottava akuutille haimatulehdukselle tyypillisistä oireista. Jos haimatulehdusta epäillään, semaglutidilääkitys on keskeytettävä. Jos akuutti haimatulehdus varmistuu, semaglutidilääkitystä ei pidä aloittaa uudelleen.
Hypoglykemia
Potilailla, jotka saavat semaglutidia yhdistelmänä sulfonyyliurean tai insuliinin kanssa, voi olla suurentunut hypoglykemian riski (ks. kohta Haittavaikutukset). Hypoglykemian riskiä voidaan pienentää sulfonyyliurea- tai insuliiniannosta pienentämällä, kun semaglutidihoito aloitetaan (ks. kohta Annostus ja antotapa).
Diabeettinen retinopatia
Diabeettisen retinopatian komplikaatioiden kehittymisen riskin on todettu suurentuneen diabeettista retinopatiaa sairastavilla potilailla, jotka saavat insuliinia ja ihon alle annettavaa semaglutidia, eikä tätä riskiä voida sulkea pois suun kautta annettavan semaglutidin osalta (ks. kohta Haittavaikutukset). Varovaisuutta on noudatettava, kun semaglutidia käytetään diabeettista retinopatiaa sairastaville potilaille. Näitä potilaita on seurattava huolellisesti ja hoidettava kliinisten suositusten mukaisesti. Verenglukoositasapainon nopeaan paranemiseen on liittynyt diabeettisen retinopatian tilapäistä pahenemista, mutta muita mekanismeja ei voida sulkea pois. Pitkäaikainen glukoositasapainon paraneminen pienentää diabeettisen retinopatian riskiä.
Suun kautta annettavien 25 mg:n tai 50 mg:n semaglutidiannosten käytöstä ei ole kokemusta potilailla, joilla on tyypin 2 diabetes ja huonossa hoitotasapainossa oleva tai mahdollisesti epävakaa diabeettinen retinopatia.
Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION)
Epidemiologisista tutkimuksista saatujen tietojen perusteella non-arteriittisen anteriorisen iskeemisen optikusneuropatian (NAION) riski on suurentunut semaglutidihoidon aikana. Aikaväli, jolla NAION saattaa kehittyä hoidon aloittamisen jälkeen, ei ole tiedossa. Äkillisen näönmenetyksen tapauksessa on tehtävä silmätutkimus, ja jos NAION-diagnoosi varmistuu, semaglutidihoito on lopetettava (ks. kohta Haittavaikutukset).
Potilaat, joilla on gastropareesi
Gastropareesia sairastavat potilaat, joita hoidetaan semaglutidilla, voivat saada vakavampia tai vaikeampia ruoansulatuselimistön haittavaikutuksia. Semaglutidia tulee käyttää varoen näillä potilailla ja sitä ei suositella käytettäväksi, mikäli gastropareesi on vaikea (ks. kohta Haittavaikutukset).
Hoitovaste
Annostusohjelman noudattamista suositellaan semaglutidin parhaan mahdollisen vaikutuksen saavuttamiseksi. Jos vaste semaglutidihoitoon on odotettua heikompi, hoitavan lääkärin on tärkeää tiedostaa, että semaglutidin imeytyminen on hyvin vaihtelevaa ja saattaa olla erittäin vähäistä (2–4 %:lla potilaista ei todeta lainkaan altistusta) ja että semaglutidin absoluuttinen hyötyosuus on pieni.
Natriumpitoisuus
Tämä lääkevalmiste sisältää 23 mg natriumia per tabletti, mikä vastaa 1 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Semaglutidi hidastaa mahalaukun tyhjenemistä, mikä saattaa vaikuttaa muiden suun kautta otettavien lääkevalmisteiden imeytymiseen.
Semaglutidin vaikutukset muihin lääkevalmisteisiin
Tyroksiini
Kokonaisaltistus (AUC) tyroksiinille (korjattu endogeenisten pitoisuuksien suhteen) suureni 33 % levotyroksiinin kerta-annoksen antamisen jälkeen. Enimmäisaltistus (Cmax) ei muuttunut. Kilpirauhasarvojen seurantaa on syytä harkita, jos potilasta hoidetaan samanaikaisesti semaglutidilla ja levotyroksiinilla.
Varfariini ja muut kumariinijohdokset
Semaglutidi ei muuttanut varfariinin kerta-annoksen antamisen jälkeen mitattuja R- ja S-varfariinin AUC- tai Cmax-arvoja, eivätkä INR-arvona (International Normalised Ratio) mitatut varfariinin farmakodynaamiset vaikutukset muuttuneet kliinisesti merkittävästi. Tapauksia, joissa INR-arvo on pienentynyt, on kuitenkin raportoitu käytettäessä asenokumarolia ja semaglutidia samanaikaisesti. On suositeltavaa, että varfariinia tai muita kumariinijohdoksia saavien potilaiden INR-arvoa seurataan tiheästi semaglutidihoitoa aloitettaessa.
Rosuvastatiini
Rosuvastatiinin AUC-arvo suureni 41 % [90 %:n luottamusväli: 24; 60], kun sitä annettiin samanaikaisesti semaglutidin kanssa. Rosuvastatiinin leveän terapeuttisen indeksin perusteella altistuksessa tapahtuvan muutoksen suuruutta ei pidetä kliinisesti merkittävänä.
Digoksiini, ehkäisytabletit, metformiini, furosemidi
Digoksiinin, (etinyyliestradiolia ja levonorgestreelia sisältävien) ehkäisytablettien, metformiinin tai furosemidin AUC- tai Cmax-arvojen ei havaittu muuttuvan kliinisesti merkittävästi, kun niitä annettiin samanaikaisesti semaglutidin kanssa.
Yhteisvaikutuksia muiden sellaisten lääkevalmisteiden kanssa, joilla on hyvin pieni hyötyosuus (1 %), ei ole arvioitu.
Muiden lääkevalmisteiden vaikutukset semaglutidiin
Omepratsoli
Semaglutidin AUC- tai Cmax-arvoissa ei todettu kliinisesti merkittäviä muutoksia, kun sitä annettiin samanaikaisesti omepratsolin kanssa.
Tutkimuksessa, jossa selvitettiin viiden muun tabletin kanssa samanaikaisesti annetun semaglutidin farmakokinetiikkaa, semaglutidin AUC-arvo pieneni 34 % ja Cmax-arvo 32 %. Tämä viittaa siihen, että jos mahalaukussa on useita semaglutidin kanssa samanaikaisesti annettuja tabletteja, semaglutidin imeytyminen muuttuu. Semaglutidin antamisen jälkeen potilaiden on odotettava 30 minuuttia ennen muiden suun kautta otettavien lääkevalmisteiden ottamista (ks. kohta Annostus ja antotapa).
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä semaglutidihoidon aikana.
Raskaus
Eläinkokeissa on havaittu lisääntymistoksisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). On vain vähän tietoja semaglutidin käytöstä raskaana oleville naisille. Siksi semaglutidia ei pidä käyttää raskauden aikana. Jos potilas suunnittelee raskautta tai tulee raskaaksi, semaglutidihoito on lopetettava. Semaglutidin käyttö on lopetettava vähintään 2 kuukautta ennen suunnitellun raskauden alkua pitkän puoliintumisajan vuoksi (ks. kohta Farmakokinetiikka).
Imetys
Imettävien naisten rintamaidossa ei todettu mitattavia pitoisuuksia semaglutidia. Salkaprotsaattinatriumia todettiin rintamaidossa ja joitain sen metaboliitteja erittyi rintamaitoon matalina pitoisuuksina. Imeväiseen kohdistuvia riskejä ei voida poissulkea, joten Rybelsus-valmistetta ei pidä käyttää rintaruokinnan aikana.
Hedelmällisyys
Semaglutidin vaikutusta ihmisen hedelmällisyyteen ei tunneta. Semaglutidi ei vaikuttanut urosrottien hedelmällisyyteen. Naarasrottien kiimojen todettiin pidentyneen ja ovulaatioiden lukumäärän hieman pienentyneen käytettäessä annoksia, joihin liittyi emon painon laskua (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Semaglutidilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Huimausta saattaa kuitenkin ilmetä pääasiassa annoksen suurentamisen yhteydessä. Ajamisessa ja koneiden käyttämisessä on noudatettava varovaisuutta, jos huimausta ilmenee.
Kun sitä käytetään yhdistelmänä sulfonyyliurean tai insuliinin kanssa, potilaita on kehotettava noudattamaan varotoimia ajaessaan ja koneita käyttäessään hypoglykemian välttämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Kymmenessä faasin 3a tutkimuksessa 5 707 potilaalle annettiin semaglutidia joko yksinään tai yhdistelmänä muiden veren glukoosipitoisuutta pienentävien lääkevalmisteiden kanssa. Hoidon kesto vaihteli 26 viikosta 78 viikkoon. Kliinisissä tutkimuksissa yleisimmin raportoituja haittavaikutuksia olivat ruoansulatuskanavan häiriöt, mukaan lukien pahoinvointi (hyvin yleinen), ripuli (hyvin yleinen) ja oksentelu (yleinen).
Haittavaikutustaulukko
Taulukossa 1 on lueteltu haittavaikutukset, joita on todettu faasin 3 tutkimuksissa (kuvattu tarkemmin kohdassa Farmakodynamiikka) tai ilmoitettu myyntiluvan myöntämisen jälkeen tyypin 2 diabetesta sairastavilla potilailla. Haittavaikutusten (lukuun ottamatta diabeettisen retinopatian komplikaatioita ja tuntohäiriöitä, ks. taulukon 1 alaviitteet) esiintymistiheydet perustuvat yhdistettyihin faasin 3a tutkimuksiin sydän- ja verisuonitapahtumatutkimusta lukuun ottamatta.
Haittavaikutukset on lueteltu alla elinjärjestelmäluokan ja absoluuttisen esiintymistiheyden mukaan. Esiintymistiheydet on määritetty seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Jokaisessa esiintymistiheysryhmässä haittavaikutukset on esitetty vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1 Suun kautta annettavaan semaglutidiin liittyvien haittavaikutusten esiintymistiheys
| MedDRA-elinjärjestelmäluokka | Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Hyvin harvinainen | Tuntematon |
| Immuunijärjestelmä | Yliherkkyysc | Anafylaktinen reaktio | ||||
| Aineenvaihdunta ja ravitsemus | Hypoglykemia insuliinin tai sulfonyyliurean kanssa käytettynäa | Hypoglykemia muiden suun kautta otettavien diabeteslääkkeiden kanssa käytettynäa Ruokahalun heikkeneminen | ||||
| Hermosto | Huimaus Tuntohäiriöe Päänsärky | Dysgeusia | ||||
| Silmät | Diabeettisen retinopatian komplikaatiotb | Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION) | ||||
| Sydän | Nopeutunut sydämen syke | |||||
| Ruoansulatuselimistö | Pahoinvointi Ripuli | Oksentelu Vatsakipu Vatsan turvotus Ummetus Dyspepsia Mahatulehdus Ruokatorven refluksitauti Ilmavaivat | Röyhtäily Viivästynyt mahan tyhjeneminen | Akuutti haimatulehdus | Suolitukosd, f | |
| Maksa ja sappi | Sappikivitauti | |||||
| Yleisoireet ja antopaikassa todettavat haitat | Uupumus | |||||
| Tutkimukset | Suurentunut lipaasiarvo Suurentunut amylaasiarvo | Painon lasku |
a) Hypoglykemia määritellään verenglukoosipitoisuudeksi < 3,0 mmol/l tai < 54 mg/dl.
b) Diabeettisen retinopatian komplikaatiot ovat yhdistelmä seuraavista: verkkokalvon fotokoagulaatio, lasiaisensisäinen hoito, lasiaisverenvuoto ja diabetekseen liittyvä sokeus (melko harvinainen). Esiintymistiheys perustuu ihon alle annettavalla semaglutidilla tehtyyn sydän- ja verisuonitapahtumatutkimukseen, mutta ei voida sulkea pois sitä mahdollisuutta, että todettu diabeettisen retinopatian komplikaatioiden riski koskee myös Rybelsus-valmistetta.
c)Ryhmitelty termi, joka kattaa myös yliherkkyyteen liittyvät haittatapahtumat, kuten ihottuma ja urtikaria.
d) Markkinoilletulon jälkeen saaduista raporteista.
e) Esiintymistiheys perustuu PIONEER PLUS ‑tutkimuksen tuloksiin, jotka koskevat 25 mg:n ja 50 mg:n annoksia. Lisätietoa on jäljempänä Tuntohäiriö-alaotsikon alla. Rybelsus 3 mg, 7 mg ja 14 mg -valmisteilla ei ollut eroavaisuuksia tuntohäiriötapauksissa faasi 3a -tutkimuksissa. Tuntohäiriötapauksia on kuitenkin raportoitu markkinoille tulon jälkeen.
f) Ryhmitelty termi, joka kattaa käsitteet ”suolitukos”, ”ileus” ja ”ohutsuolitukos”.
Valittujen haittavaikutusten kuvaus
Hypoglykemia
Vaikeaa hypoglykemiaa todettiin ensisijaisesti silloin, kun semaglutidia käytettiin yhdessä sulfonyyliurean kanssa (< 0,1 %:lla tutkittavista, < 0,001 tapahtumaa/potilasvuosi) tai insuliinin kanssa (1,1 %:lla tutkittavista, 0,013 tapahtumaa/potilasvuosi). Pieni määrä tapauksia (0,1 %:lla tutkittavista, 0,001 tapahtumaa/potilasvuosi) todettiin, kun semaglutidia käytettiin yhdistelmänä muiden suun kautta otettavien diabeteslääkkeiden kuin sulfonyyliurean kanssa.
Ruoansulatuselimistöön liittyvät haittavaikutukset
Pahoinvointia esiintyi 15 %:lla, ripulia 10 %:lla ja oksentelua 7 %:lla semaglutidihoitoa saaneista potilaista. Useimmat tapahtumat olivat lieviä tai keskivaikeita ja lyhytkestoisia. Tapahtumat johtivat hoidon keskeyttämiseen 4 %:lla tutkittavista. Tapahtumia ilmoitettiin useimmiten ensimmäisten hoitokuukausien aikana.
PIONEER PLUS ‑tutkimuksessa pahoinvointia esiintyi 27 %:lla semaglutidia 25 mg:n annoksella ja 27 %:lla semaglutidia 50 mg:n annoksella saaneista, ripulia 13 %:lla semaglutidia 25 mg:n annoksella ja 14 %:lla semaglutidia 50 mg:n annoksella saaneista ja oksentelua 17 %:lla semaglutidia 25 mg:n annoksella ja 18 %:lla semaglutidia 50 mg:n annoksella saaneista. Tapahtumat johtivat hoidon keskeyttämiseen 6 %:lla 25 mg:n annosta saaneista ja 8 %:lla 50 mg:n annosta saaneista potilaista.
Useimmat tapahtumat olivat lieviä tai keskivaikeita ja lyhytkestoisia. Tapahtumia ilmoitettiin useimmiten annoksen suurentamisen yhteydessä ensimmäisten hoitokuukausien aikana.
Gastropareesia sairastavilla potilailla voi esiintyä vakavampia tai vaikeampia ruoansulatuselimistön haittavaikutuksia semaglutidihoidon aikana.
Faasin 3a kliinisissä tutkimuksissa on raportoitu vahvistettua akuuttia haimatulehdusta semaglutidia saaneilla (< 0,1 %:lla tutkittavista) ja vertailuvalmistetta saaneilla (0,2 %:lla tutkittavista). Sydän- ja verisuonitapahtumia koskeneessa PIONEER 6 -tutkimuksessa vahvistetun akuutin haimatulehduksen esiintymistiheys oli 0,1 % semaglutidia saaneilla ja 0,2 % lumelääkettä saaneilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Sydän- ja verisuonitapahtumia koskeneessa faasin 3b SOUL-tutkimuksessa vahvistettun akuutin haimatulehduksen esiintymistiheys oli 0,4 % semaglutidia saaneilla ja 0,4 % lumelääkettä saaneilla potilailla.
Diabeettisen retinopatian komplikaatiot
Kaksi vuotta kestäneessä, ihon alle annettavalla semaglutidilla tehdyssä kliinisessä tutkimuksessa tutkittiin 3 297 tyypin 2 diabetesta sairastavaa potilasta, joilla oli suuri sydän- ja verisuonitapahtumien riski, huonossa hoitotasapainossa oleva verenglukoosi ja jotka olivat sairastaneet diabetesta kauan. Tässä tutkimuksessa vahvistettuja diabeettisen retinopatian komplikaatioita esiintyi useammin ihon alle annettavaa semaglutidihoitoa saaneilla (3,0 %) kuin lumelääkettä saaneilla (1,8 %) potilailla. Tämä havainto tehtiin niiden insuliinihoitoa saaneiden potilaiden kohdalla, joiden tiedettiin sairastavan diabeettista retinopatiaa. Hoitojen välinen ero ilmeni varhain ja säilyi koko tutkimuksen ajan. Järjestelmällinen diabeettisen retinopatian komplikaatioiden arviointi tehtiin vain ihon alle annettavalla semaglutidilla toteutetussa sydän- ja verisuonitapahtumatutkimuksessa. Enintään 18 kuukautta kestäneissä kliinisissä Rybelsus-valmisteella tehdyissä tutkimuksissa, joihin osallistui 6 352 tyypin 2 diabetesta sairastavaa potilasta, diabeettiseen retinopatiaan liittyviä haittatapahtumia raportoitiin suurin piirtein yhtä paljon semaglutidihoitoa saaneilla tutkittavilla (4,2 %) ja vertailuvalmisteita saaneilla tutkittavilla (3,8 %).
Non-arteriittinen anteriorinen iskeeminen optikusneuropatia (NAION)
Useista laajoista epidemiologisista tutkimuksista saadut tulokset viittaavat siihen, että NAION-tilan kehittymisen suhteellinen riski suurenee tyypin 2 diabetesta sairastavilla aikuisilla semaglutidialtistuksen yhteydessä noin kaksinkertaiseksi, mikä vastaa noin yhtä lisätapausta 10 000:ta henkilöhoitovuotta kohti.
Immunogeenisuus
Proteiineja tai peptidejä sisältävillä lääkevalmisteilla saattaa olla immunogeenisiä ominaisuuksia, joten potilaille saattaa kehittyä vasta-aineita semaglutidihoidon jälkeen. Niiden tutkittavien osuus, joilla todettiin semaglutidivasta-aineita milloin tahansa lähtötilanteen jälkeen, oli pieni (0,5 %), eikä yhdelläkään tutkittavalla ollut tutkimuksen päättyessä semaglutidia neutraloivia vasta-aineita tai semaglutidivasta-aineita, joilla olisi endogeenistä GLP-1:tä neutraloiva vaikutus.
Sydämen sykkeen nopeutuminen
GLP-1-reseptoriagonistien käytön yhteydessä on todettu sydämen sykkeen nopeutumista. Faasin 3a tutkimuksissa Rybelsus-valmistetta saaneilla tutkittavilla todettiin keskimääräinen muutos 0–4 lyöntiä/minuutti (bpm) lähtötason syketaajuudesta 69–76 lyöntiä/minuutti.
Tuntohäiriö
Tapahtumia, joiden kliiniseen kuvaan liittyi ihotunnon muutoksia, kuten parestesiaa, ihon kipua, ihon herkistymistä, tuntohäiriöitä ja ihon polttelua, ilmoitettiin 2,1 %:lla semaglutidia 25 mg:n annoksella suun kautta saaneista ja 5,2 %:lla semaglutidia 50 mg:n annoksella suun kautta saaneista potilaista. Tapahtumat olivat lieviä tai keskivaikeita, ja suurin osa potilaista toipui hoidon edelleen jatkuessa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kliinisissä tutkimuksissa havaitut semaglutidin yliannostuksen vaikutukset saattavat liittyä ruoansulatuskanavan häiriöihin. Yliannostustapauksissa on aloitettava asianmukainen tukihoito potilaan kliinisten oireiden perusteella. Semaglutidin pitkän, noin viikon mittaisen puoliintumisajan takia oireiden pitkäkestoinen tarkkailu ja hoito saattaa olla tarpeen (ks. kohta Farmakokinetiikka). Semaglutidin yliannostukseen ei ole mitään spesifistä vastalääkettä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, GLP-1-analogit, ATC-koodi: A10BJ06
Vaikutusmekanismi
Semaglutidi on GLP-1-analogi, jonka aminohappojärjestys on 94-prosenttisesti homologinen ihmisen GLP-1:n kanssa. Semaglutidi toimii GLP-1-reseptoriagonistina, joka sitoutuu selektiivisesti GLP-1-reseptoriin ja aktivoi sen. GLP-1-reseptori on luonnollisen GLP-1:n kohde.
GLP-1 on fysiologinen hormoni, jolla on useita tehtäviä glukoosin ja ruokahalun säätelyssä sekä sydän- ja verisuonijärjestelmässä. Glukoosiin ja ruokahaluun kohdistuvat vaikutukset välittyvät spesifisesti haiman ja aivojen GLP-1-reseptorien kautta.
Semaglutidi pienentää veren glukoosipitoisuutta glukoosista riippuvaisesti stimuloimalla insuliinin eritystä ja vähentämällä glukagonin eritystä, kun veren glukoosipitoisuus on korkea. Mekanismiin, jolla veren glukoosipitoisuus pienenee, liittyy myös lievä mahalaukun tyhjenemisen hidastuminen pian aterian jälkeen. Hypoglykemian aikana semaglutidi vähentää insuliinin eritystä, mutta ei vähennä glukagonin eritystä. Semaglutidin vaikutusmekanismi ei ole riippuvainen antoreitistä.
Semaglutidi alentaa painoa ja vähentää kehon rasvan määrää vähentämällä elimistön energiansaantia mm. heikentämällä yleisesti ruokahalua. Lisäksi semaglutidi vähentää mieltymystä runsaasti rasvaa sisältäviin ruokiin.
GLP-1-reseptorit ilmentyvät sydämessä, verisuonistossa, immuunijärjestelmässä ja munuaisissa. Kliinisissä tutkimuksissa semaglutidilla oli suotuisa vaikutus plasman lipideihin, ja se laski systolista verenpainetta ja vähensi tulehdusta. Eläinkokeissa semaglutidi vähensi ateroskleroosin kehittymistä ehkäisemällä aorttaplakin etenemistä ja vähentämällä plakin tulehdusta.
Semaglutidin vaikutusmekanismi sydän- ja verisuonitapahtumien riskin pienentämisessä on todennäköisesti monitekijäinen ja perustuu osittain HbA1c-arvon pienenemiseen sekä vaikutuksiin, jotka kohdistuvat sydämeen, munuaisiin ja metaboliaan liittyviin tunnettuihin riskitekijöihin. Tällaisia vaikutuksia ovat verenpaineen aleneminen, painon lasku, lipidiprofiilin ja munuaisten toiminnan paraneminen sekä anti-inflammatoriset vaikutukset, jotka ilmenevät hsCRP-arvon pienenemisenä. Sydän- ja verisuonitapahtumien riskin pienenemisen tarkkaa mekanismia ei ole vahvistettu.
Farmakodynaamiset vaikutukset
Jäljempänä kuvatut farmakodynaamiset arvioinnit tehtiin suun kautta annettavalla semaglutidilla 12 viikkoa kestäneen hoidon jälkeen.
Paastoglukoosi ja aterianjälkeinen glukoosi
Semaglutidi pienentää glukoosipitoisuuden paastoarvoja ja aterianjälkeisiä arvoja. Tyypin 2 diabetesta sairastavilla potilailla semaglutidihoidolla saavutettiin seuraavat suhteelliset vähenemät lumelääkkeeseen verrattuna: paastoglukoosi 22 % [13; 30] ja aterianjälkeinen glukoosi 29 % [19; 37].
Glukagonin eritys
Semaglutidi pienentää glukagonipitoisuuden aterianjälkeisiä arvoja. Tyypin 2 diabetesta sairastavilla potilailla semaglutidilla saavutettiin seuraava glukagonin suhteellinen vähenemä lumelääkkeeseen verrattuna: aterianjälkeinen glukagonivaste 29 % [15; 41].
Mahalaukun tyhjeneminen
Semaglutidi hidastaa hieman aterianjälkeistä mahalaukun tyhjenemistä välittömästi aterian jälkeen ja pienentää parasetamolialtistusta ensimmäisen tunnin aikana aterian jälkeen (AUC0-1h) 31 % [13; 46], joten se hidastaa siten glukoosin siirtymistä verenkiertoon aterian jälkeen.
Paasto- ja aterianjälkeiset lipidiarvot
Lumelääkkeeseen verrattuna semaglutidi pienensi triglyseridien paastoarvoja 19 % [8; 28] ja VLDL-kolesterolin paastoarvoja 20 % [5; 33]. Aterianjälkeiset triglyseridivasteet runsaasti rasvaa sisältävään ateriaan pienenivät 24 % [9; 36] ja VLDL-kolesterolivasteet 21 % [7; 32]. ApoB48-pitoisuus pieneni paastotilassa 25 % [2; 42] ja aterianjälkeisessä tilassa 30 % [15; 43].
Kliininen teho ja turvallisuus
Rybelsus-valmisteen tehoa ja turvallisuutta on arvioitu kahdeksassa maailmanlaajuisessa, satunnaistetussa, kontrolloidussa faasin 3a tutkimuksessa. Faasin 3a tutkimukset tehtiin tableteilla, joissa oli 3 mg semaglutidia (biologisesti samanarvoinen kuin 1,5 mg semaglutidia), 7 mg semaglutidia (biologisesti samanarvoinen kuin 4 mg semaglutidia) tai 14 mg semaglutidia (biologisesti samanarvoinen kuin 9 mg semaglutidia). Glykeemisen tehon arviointi oli ensisijainen tavoite seitsemässä tutkimuksessa ja sydän- ja verisuonitapahtumien arviointi yhdessä tutkimuksessa (PIONEER 6).
Tutkimuksiin osallistui 8 842 satunnaistettua potilasta, jotka sairastivat tyypin 2 diabetesta (5 169 potilasta sai semaglutidihoitoa) ja joista 1 165:llä oli keskivaikea munuaisten vajaatoiminta. Potilaiden keskimääräinen ikä oli 61 vuotta (vaihteluväli 18–92 vuotta), ja heistä 40 % oli ≥ 65‑vuotiaita ja 8 % ≥ 75-vuotiaita. Semaglutidin tehoa verrattiin lumelääkkeeseen tai vaikuttaviin vertailuvalmisteisiin (sitagliptiiniin, empagliflotsiiniin ja liraglutidiin).
Kerran vuorokaudessa annettavan 25 mg:n tai 50 mg:n semaglutidiannoksen tehoa ja turvallisuutta arvioitiin faasin 3b tutkimuksessa (PIONEER PLUS), johon osallistui 1 606 satunnaistettua potilasta.
Sydän- ja verisuonitapahtumia koskeneeseen faasin 3b tutkimukseen (SOUL) osallistui 9 650 potilasta. Tavoitteena oli osoittaa, että tavanomaisen hoidon lisänä käytettävä suun kautta otettava semaglutidi pienentää vakavien sydän- ja verisuonitapahtumien (major adverse cardiovascular event, MACE) riskiä verrattuna tavanomaisen hoidon lisänä käytettyyn lumelääkkeeseen potilailla, joilla on tyypin 2 diabetes ja todettu sydän- ja verisuonitauti ja/tai krooninen munuaissairaus.
Seuraavat lähtötilanteen tiedot eivät vaikuttaneet semaglutidin tehoon: ikä, sukupuoli, rotu, etninen tausta, paino, painoindeksi (BMI), diabeteksen kesto, ylemmän ruoansulatuskanavan sairaudet ja munuaisten toiminnan aste.
PIONEER 1 – monoterapia
26 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa 703 tyypin 2 diabetesta sairastavaa potilasta, joiden hoitotasapaino oli riittämätön ruokavaliolla ja liikunnalla, satunnaistettiin saamaan 3 mg semaglutidia, 7 mg semaglutidia, 14 mg semaglutidia tai lumelääkettä kerran vuorokaudessa.
Taulukko 2 Tulokset 26 viikkoa kestäneestä monoterapiatutkimuksesta, jossa semaglutidia verrattiin lumelääkkeeseen (PIONEER 1)
Semaglutidi 7 mg | Semaglutidi 14 mg | Lumelääke | |
| Koko analyysijoukko (N) | 175 | 175 | 178 |
| HbA1c mmol/mol (%) | |||
| Lähtötaso | 64 (8,0) | 64 (8,0) | 63 (7,9) |
| Muutos lähtötasosta1 | -13 (-1,2) | -15 (-1,4) | -3 (‑0,3) |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -9 [-12; -7]* (-0,9 [-1,1; -0,6])* | -12 [-15; -9]* (-1,1 [-1,3; -0,9])* | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 69§ | 77§ | 31 |
| Plasman paastoglukoosi (mmol/l) | |||
| Lähtötaso | 9,0 | 8,8 | 8,9 |
| Muutos lähtötasosta1 | -1,5 | -1,8 | -0,2 |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -1,4 [-1,9; -0,8]§ | -1,6 [-2,1; -1,2]§ | - |
| Paino (kg) | |||
| Lähtötaso | 89,0 | 88,1 | 88,6 |
| Muutos lähtötasosta1 | -2,3 | -3,7 | -1,4 |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -0,9 [-1,9; 0,1] | -2,3 [-3,1; -1,5]* | - |
1 Riippumatta siitä, lopetettiinko hoito tai aloitettiinko varalääkkeen käyttö (pattern mixture -malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen. § p < 0,05, ei kontrolloitu monivertailun suhteen; HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta.
PIONEER 2 – Semaglutidi vs. empagliflotsiini, molemmat yhdistelmänä metformiinin kanssa
52 viikkoa kestäneessä avoimessa tutkimuksessa 822 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin saamaan 14 mg semaglutidia kerran vuorokaudessa tai 25 mg empagliflotsiinia kerran vuorokaudessa. Molempia lääkkeitä käytettiin yhdistelmänä metformiinin kanssa.
Taulukko 3 Tulokset 52 viikkoa kestäneestä tutkimuksesta, jossa semaglutidia verrattiin empagliflotsiiniin (PIONEER 2)
Semaglutidi 14 mg | Empagliflotsiini 25 mg | |
| Koko analyysijoukko (N) | 411 | 410 |
| Viikko 26 | ||
| HbA1c mmol/mol (%) | ||
| Lähtötaso | 65 (8,1) | 65 (8,1) |
| Muutos lähtötasosta1 | -14 (‑1,3) | -9 (‑0,9) |
| Ero empagliflotsiiniin nähden1 [95 %:n luottamusväli] | −5 [−6; −3]* (-0,4 [-0,6; -0,3])* | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 67§ | 40 |
| Plasman paastoglukoosi (mmol/l) | ||
| Lähtötaso | 9,5 | 9,7 |
| Muutos lähtötasosta1 | -2,0 | -2,0 |
| Ero empagliflotsiiniin nähden1 [95 %:n luottamusväli] | 0,0 [-0,2; 0,3] | - |
| Paino (kg) | ||
| Lähtötaso | 91,9 | 91,3 |
| Muutos lähtötasosta1 | -3,8 | -3,7 |
| Ero empagliflotsiiniin nähden1 [95 %:n luottamusväli] | -0,1 [-0,7; 0,5] | - |
| Viikko 52 | ||
| HbA1c mmol/mol (%) | ||
| Muutos lähtötasosta1 | -14 (-1,3) | -10 (-0,9) |
| Ero empagliflotsiiniin nähden1 [95 %:n luottamusväli] | -4 [-6; -3]§ (-0,4 [-0,5; -0,3])§ | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 66§ | 43 |
| Paino (kg) | ||
| Muutos lähtötasosta1 | -3,8 | -3,6 |
| Ero empagliflotsiiniin nähden1 [95 %:n luottamusväli] | -0,2 [-0,9; 0,5] | - |
1 Riippumatta siitä, lopetettiinko hoito tai aloitettiinko varalääkkeen käyttö (pattern mixture -malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen. § p < 0,05, ei kontrolloitu monivertailun suhteen; HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta.
PIONEER 3 – Semaglutidi vs. sitagliptiini, molemmat yhdistelmänä metformiinin tai metformiinin ja sulfonyyliurean kanssa
78 viikkoa kestäneessä kaksoissokkoutetussa kaksoislumetutkimuksessa 1 864 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin saamaan 3 mg semaglutidia, 7 mg semaglutidia, 14 mg semaglutidia tai 100 mg sitagliptiinia kerran vuorokaudessa. Kaikkia näitä käytettiin yhdistelmänä pelkän metformiinin tai metformiinin ja sulfonyyliurean kanssa. HbA1c-arvo ja paino säilyivät pienempinä koko 78 viikkoa kestäneen tutkimuksen ajan.
Taulukko 4 Tulokset 78 viikkoa kestäneestä tutkimuksesta, jossa semaglutidia verrattiin sitagliptiiniin (PIONEER 3)
Semaglutidi 7 mg | Semaglutidi 14 mg | Sitagliptiini 100 mg | |
| Koko analyysijoukko (N) | 465 | 465 | 467 |
| Viikko 26 | |||
| HbA1c mmol/mol (%) | |||
| Lähtötaso | 68 (8,4) | 67 (8,3) | 67 (8,3) |
| Muutos lähtötasosta1 | -11 (-1,0 ) | -14 (-1,3) | -8 (-0,8) |
| Ero sitagliptiiniin nähden1 [95 %:n luottamusväli] | -3 [-4; -2]* (-0,3 [-0,4; -0,1])* | -6 [-7; -4]* (-0,5 [-0,6; -0,4])* | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 44§ | 56§ | 32 |
| Plasman paastoglukoosi (mmol/l) | |||
| Lähtötaso | 9,4 | 9,3 | 9,5 |
| Muutos lähtötasosta1 | -1,2 | -1,7 | -0,9 |
| Ero sitagliptiiniin nähden1 [95 %:n luottamusväli] | -0,3 [-0,6; 0,0]§ | -0,8 [-1,1; -0,5]§ | - |
| Paino (kg) | |||
| Lähtötaso | 91,3 | 91,2 | 90,9 |
| Muutos lähtötasosta1 | -2,2 | -3,1 | -0,6 |
| Ero sitagliptiiniin nähden1 [95 %:n luottamusväli] | -1,6 [-2,0; -1,1]* | -2,5 [-3,0; -2,0]* | - |
| Viikko 78 | |||
| HbA1c mmol/mol (%) | |||
| Muutos lähtötasosta1 | -9 (‑0,8) | -12 (‑1,1) | -7 (‑0,7) |
| Ero sitagliptiiniin nähden1 [95 %:n luottamusväli] | −2 [−3; 0] (-0,1 [-0,3; 0,0]) | −5 [−6; −3]§ (-0,4 [-0,6; -0,3])§ | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 39§ | 45§ | 29 |
| Paino (kg) | |||
| Muutos lähtötasosta1 | -2,7 | -3,2 | -1,0 |
| Ero sitagliptiiniin nähden1 [95 %:n luottamusväli] | -1,7 [-2,3; -1,0]§ | -2,1 [-2,8; -1,5]§ | - |
1 Riippumatta siitä, lopetettiinko hoito tai aloitettiinko varalääkkeen käyttö (pattern mixture -malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen. § p < 0,05, ei kontrolloitu monivertailun suhteen; HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta.
PIONEER 4 – Semaglutidi vs. liraglutidi ja lumelääke, kaikki yhdistelmänä metformiinin tai metformiinin ja SGLT2:n estäjän kanssa
52 viikkoa kestäneessä kaksoissokkoutetussa kaksoislumetutkimuksessa 711 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin saamaan 14 mg semaglutidia, 1,8 mg liraglutidia ihonalaisena injektiona tai lumelääkettä kerran vuorokaudessa. Kaikkia näitä käytettiin yhdistelmänä metformiinin tai metformiinin ja SGLT2:n estäjän kanssa.
Taulukko 5 Tulokset 52 viikkoa kestäneestä tutkimuksesta, jossa semaglutidia verrattiin liraglutidiin ja lumelääkkeeseen (PIONEER 4)
Semaglutidi 14 mg | Liraglutidi 1,8 mg | Lumelääke | |
| Koko analyysijoukko (N) | 285 | 284 | 142 |
| Viikko 26 | |||
| HbA1c mmol/mol (%) | |||
| Lähtötaso | 64 (8,0) | 64 (8,0) | 63 (7,9) |
| Muutos lähtötasosta1 | -13 (-1,2) | -12 (-1,1) | -2 (-0,2) |
| Ero liraglutidiin nähden1 [95 %:n luottamusväli] | -1 [-3; 0] (-0,1 [-0,3; 0,0]) | - | - |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -12 [-13; -10]* (-1,1 [-1,2; -0,9])* | - | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 68§,a | 62 | 14 |
| Plasman paastoglukoosi (mmol/l) | |||
| Lähtötaso | 9,3 | 9,3 | 9,2 |
| Muutos lähtötasosta1 | -2,0 | -1,9 | -0,4 |
| Ero liraglutidiin nähden1 [95 %:n luottamusväli] | -0,1 [-0,4; 0,1] | - | - |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -1,6 [-2,0; -1,3]§ | - | - |
| Paino (kg) | |||
| Lähtötaso | 92,9 | 95,5 | 93,2 |
| Muutos lähtötasosta1 | -4,4 | -3,1 | -0,5 |
| Ero liraglutidiin nähden1 [95 %:n luottamusväli] | -1,2 [-1,9; -0,6]* | - | - |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -3,8 [-4,7; -3,0]* | - | - |
| Viikko 52 | |||
| HbA1c mmol/mol (%) | |||
| Muutos lähtötasosta1 | -13 (-1,2) | -9 (-0,9) | -2 (-0,2) |
| Ero liraglutidiin nähden1 [95 %:n luottamusväli] | -3 [-5; -2]§ (-0,3 [-0,5; -0,1])§ | - | - |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -11 [-13; -8]§ (-1,0 [-1,2; -0,8])§ | - | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 61§,a | 55 | 15 |
| Paino (kg) | |||
| Muutos lähtötasosta1 | -4,3 | -3,0 | -1,0 |
| Ero liraglutidiin nähden1 [95 %:n luottamusväli] | -1,3 [-2,1; -0,5]§ | - | - |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -3,3 [-4,3; -2,4]§ | - | - |
1 Riippumatta siitä, lopetettiinko hoito tai aloitettiinko varalääkkeen käyttö (pattern mixture -malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen. § p < 0,05, ei kontrolloitu monivertailun suhteen; HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta. a vs. lumelääke.
PIONEER 5 – Semaglutidi vs. lumelääke, molemmat yhdistelmänä pelkän perusinsuliinin, metformiinin ja perusinsuliinin tai metformiinin ja/tai sulfonyyliurean kanssa keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla
26 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa 324 tyypin 2 diabetesta ja keskivaikeaa munuaisten vajaatoimintaa (eGFR 30–59 ml/min/1,73 m2) sairastavaa potilasta satunnaistettiin saamaan 14 mg semaglutidia tai lumelääkettä kerran vuorokaudessa. Tutkimusvalmiste lisättiin potilaiden vakiintuneeseen diabeteslääkitykseen, jota he olivat käyttäneet ennen tutkimusta.
Taulukko 6 Tulokset 26 viikkoa kestäneestä tutkimuksesta, jossa semaglutidia verrattiin lumelääkkeeseen tyypin 2 diabetesta ja keskivaikeaa munuaisten vajaatoimintaa sairastavilla potilailla (PIONEER 5)
Semaglutidi 14 mg | Lumelääke | |
| Koko analyysijoukko (N) | 163 | 161 |
| HbA1c mmol/mol (%) | ||
| Lähtötaso | 64 (8,0) | 63 (7,9) |
| Muutos lähtötasosta1 | -11 (-1,0) | -2 (-0,2) |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -9 [-11; -7]* (-0,8 [-1,0; -0,6])* | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 58§ | 23 |
| Plasman paastoglukoosi (mmol/l) | ||
| Lähtötaso | 9,1 | 9,1 |
| Muutos lähtötasosta1 | -1,5 | -0,4 |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -1,2 [-1,7; -0,6]§ | - |
| Paino (kg) | ||
| Lähtötaso | 91,3 | 90,4 |
| Muutos lähtötasosta1 | -3,4 | -0,9 |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -2,5 [-3,2; -1,8]* | - |
1 Riippumatta siitä, lopetettiinko hoito tai aloitettiinko varalääkkeen käyttö (pattern mixture -malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen. § p < 0,05, ei kontrolloitu monivertailun suhteen; HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta.
PIONEER 7 – Semaglutidi vs. sitagliptiini, molemmat yhdistelmänä metformiinin, SGLT2:n estäjien, sulfonyyliurean tai tiatsolidiinidionien kanssa – joustavaa annoksen säätämistä koskeva tutkimus
52 viikkoa kestäneessä avoimessa tutkimuksessa 504 tyypin 2 diabetesta sairastavaa potilasta satunnaistettiin saamaan semaglutidia (annoksia 3 mg, 7 mg ja 14 mg kerran vuorokaudessa voitiin säätää joustavasti) tai 100 mg sitagliptiinia kerran vuorokaudessa. Kaikkia näitä käytettiin yhdistelmänä 1–2:n verenglukoosia alentavan, suun kautta otettavan lääkevalmisteen (metformiinin, SGLT2:n estäjien, sulfonyyliurean tai tiatsolidiinidionien) kanssa. Semaglutidiannosta säädettiin 8 viikon välein potilaan glykeemisen vasteen ja hoidon siedettävyyden perusteella. Sitagliptiinia annettiin 100 mg:n kiinteänä annoksena. Semaglutidin teho ja turvallisuus arvioitiin viikolla 52.
Viikolla 52 noin 10 % potilaista sai 3 mg:n semaglutidiannosta, 30 % sai 7 mg:n semaglutidiannosta ja 60 % sai 14 mg:n semaglutidiannosta.
Taulukko 7 Tulokset 52 viikkoa kestäneestä joustavaa annoksen säätämistä koskevasta tutkimuksesta, jossa semaglutidia verrattiin sitagliptiiniin (PIONEER 7)
Semaglutidi Joustava annos | Sitagliptiini 100 mg | |
| Koko analyysijoukko (N) | 253 | 251 |
| HbA1c mmol/mol (%) | ||
| Lähtötaso | 67 (8,3) | 67 (8,3) |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %)1 | 58* | 25 |
| Paino (kg) | ||
| Lähtötaso | 88,9 | 88,4 |
| Muutos lähtötasosta1 | -2,6 | -0,7 |
| Ero sitagliptiiniin nähden1 [95 %:n luottamusväli] | -1,9 [-2,6; -1,2]* | - |
1 Riippumatta siitä, lopetettiinko hoito (hoidon lopetti 16,6 % potilaista, jotka saivat semaglutidia joustavalla annostuksella, ja 9,2 % potilaista, jotka saivat sitagliptiinia; näistä semaglutidia joustavalla annostuksella saaneista potilaista 8,7 % lopetti hoidon haittatapahtumien vuoksi ja vastaava osuus sitagliptiinia saaneista potilaista oli 4,0 %) tai aloitettiinko varalääkkeen käyttö (pattern mixture -malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen (HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta).
PIONEER 8 – Semaglutidi vs. lumelääke, molemmat yhdistelmänä insuliinin kanssa ja joko metformiinin kanssa tai ilman metformiinia
52 viikkoa kestäneessä kaksoissokkoutetussa tutkimuksessa 731 tyypin 2 diabetesta sairastavaa potilasta, joiden hoitotasapaino oli riittämätön insuliinilla (perusinsuliini, perus-/ateriainsuliini tai sekoiteinsuliini), jota käytettiin metformiinin kanssa tai ilman metformiinia, satunnaistettiin saamaan 3 mg semaglutidia, 7 mg semaglutidia, 14 mg semaglutidia tai lumelääkettä kerran vuorokaudessa.
Taulukko 8 Tulokset 52 viikkoa kestäneestä tutkimuksesta, jossa semaglutidia verrattiin lumelääkkeeseen yhdistelmänä insuliinin kanssa (PIONEER 8)
Semaglutidi 7 mg | Semaglutidi 14 mg | Lumelääke | |
| Koko analyysijoukko (N) | 182 | 181 | 184 |
| Viikko 26 (insuliiniannos enintään sama kuin lähtötasolla) | |||
| HbA1c mmol/mol (%) | |||
| Lähtötaso | 66 (8,2) | 66 (8,2) | 66 (8,2) |
| Muutos lähtötasosta1 | -10 (-0,9) | -14 (-1,3) | -1 (-0,1) |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -10 [-12; -7]* (-0,9 [-1,1; -0,7])* | -13 [-15; -11]* (-1,2 [-1,4; -1,0])* | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 43§ | 58§ | 7 |
| Plasman paastoglukoosi (mmol/l) | |||
| Lähtötaso | 8,5 | 8,3 | 8,3 |
| Muutos lähtötasosta1 | -1,1 | -1,3 | 0,3 |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -1,4 [-1,9; -0,8]§ | -1,6 [-2,2; -1,1]§ | - |
| Paino (kg) | |||
| Lähtötaso | 87,1 | 84,6 | 86,0 |
| Muutos lähtötasosta1 | -2,4 | -3,7 | -0,4 |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -2,0 [-3,0; -1,0]* | -3,3 [-4,2; -2,3]* | - |
| Viikko 52 (insuliiniannosta ei rajoitettu)+ | |||
| HbA1c mmol/mol (%) | |||
| Muutos lähtötasosta1 | -9 (-0,8) | -13 (-1,2) | -3 (-0,2) |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -6 [-8; -4]§ (-0,6 [-0,8; -0,4])§ | -10 [-13; -8]§ (-0,9 [-1,1; -0,7])§ | - |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 7,0 % | 40§ | 54§ | 9 |
| Paino (kg) | |||
| Muutos lähtötasosta1 | -2,0 | -3,7 | 0,5 |
| Ero lumelääkkeeseen nähden1 [95 %:n luottamusväli] | -2,5 [-3,6; -1,4]§ | -4,3 [-5,3; -3,2]§ | - |
1 Riippumatta siitä, lopetettiinko hoito tai aloitettiinko varalääkkeen käyttö (pattern mixture -malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen. § p < 0,05, ei kontrolloitu monivertailun suhteen; HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta. + Insuliinin kokonaisvuorokausiannos oli tilastollisesti merkitsevästi pienempi semaglutidia saaneilla potilailla kuin lumelääkettä saaneilla potilailla viikolla 52.
PIONEER PLUS – Kerran vuorokaudessa annettujen 25 mg:n ja 50 mg:n semaglutidiannosten teho ja turvallisuus 14 mg:n semaglutidiannoksiin verrattuna potilailla, joilla on tyypin 2 diabetes
68 viikkoa kestäneessä kaksoissokkoutetussa kliinisessä tutkimuksessa 1 606 potilasta, joilla oli tyypin 2 diabetes ja jotka käyttivät 1–3 diabeteslääkettä (metformiinia, sulfonyyliureoita, SGLT2:n estäjiä tai DPP‑4:n estäjiä*) suun kautta vakaina annoksina, satunnaistettiin saamaan semaglutidia kerran vuorokaudessa joko 14 mg:n, 25:mg:n tai 50 mg:n ylläpitoannoksella.
*DPP‑4:n estäjien käyttö oli lopetettava satunnaistamisen yhteydessä.
Kerran vuorokaudessa annettu 25 mg:n tai 50 mg:n semaglutidiannos pienensi HbA1c-arvoa ja painoa enemmän kuin 14 mg:n semaglutidiannos (ks. taulukko 9). Viikon 68 kohdalla kerätyt tiedot tukevat käsitystä, että suun kautta annettavilla 14 mg:n, 25 mg:n ja 50 mg:n semaglutidiannoksilla on pitkäkestoinen vaikutus HbA1c-arvoon ja painoon (ks. kuva 1).
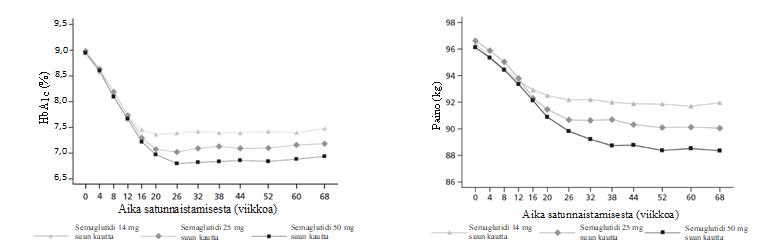
Kuva 1 HbA1c-arvon ja painon keskiarvot lähtötilanteesta viikkoon 68
Taulukko 9 Tulokset 52 viikkoa kestäneestä tutkimuksesta, jossa 25 mg:n ja 50 mg:n semaglutidiannoksia verrattiin 14 mg:n semaglutidiannoksiin (PIONEER PLUS)
Semaglutidi 14 mg2 (biologisesti samanarvoinen kuin 9 mg) | Semaglutidi 25 mg | Semaglutidi 50 mg | |
| Koko analyysijoukko (N) | 536 | 535 | 535 |
| Viikko 52 | |||
| HbA1c mmol/mol (%) | |||
| Lähtötaso | 74 (8,9) | 75 (9,0) | 74 (8,9) |
| Muutos lähtötasosta1 | -16 (-1,5) | -20 (-1,8) | -22 (-2,0) |
| Ero Rybelsus 14 mg ‑valmisteeseen nähden1 [95 %:n luottamusväli] | -3,3 [-5; -2] (-0,27 [-0,42; -0,12])* | -6 [-7; -4] (-0,53 [-0,68; -0,38])* | |
| Potilaat (%), jotka saavuttivat HbA1c-arvon < 53 mmol/mol (7,0 %) | 39,0§ | 50,5§ | 63,0§ |
| Potilaat (%), jotka saavuttivat HbA1c-arvon ≤ 48 mmol/mol (6,5 %) | 25,8§ | 39,6§ | 51,2§ |
| Plasman paastoglukoosi (mmol/l) | |||
| Lähtötaso | 10,8 | 11,0 | 10,8 |
| Muutos lähtötasosta1 | -2,3 | -2,8 | -3,2 |
| Ero Rybelsus 14 mg ‑valmisteeseen nähden1 [95 %:n luottamusväli] | -0,46 [-0,79; -0,13]§ | -0,82 [-1,15; -0,49]§ | |
| Paino (kg) | |||
| Lähtötaso | 96,4 | 96,6 | 96,1 |
| Muutos lähtötasosta1 | -4,4 | -6,7 | -8,0 |
| Ero Rybelsus 14 mg ‑valmisteeseen nähden1 [95 %:n luottamusväli] | -2,32 [-3,11; 1,53]* | -3,63 [‑4,42; ‑2,84]* |
1 Riippumatta siitä, lopetettiinko hoito tai aloitettiinko varalääkkeen käyttö (pattern mixture ‑malli, jossa käytetään moni-imputointia). * p < 0,001 (korjaamaton, kaksisuuntainen) paremmuudelle, kontrolloitu monivertailun suhteen. § p < 0,05, ei kontrolloitu monivertailun suhteen; HbA1c-arvon < 53 mmol/mol (7,0 %) saavuttaneilla potilailla p-arvo kuvaa kerroinsuhdetta. 2 9 mg:n ja 14 mg:n annosten välinen biologinen samanarvoisuus on vahvistettu. Ks. kohta Farmakokinetiikka, Farmakokinetiikka.
Sydän- ja verisuonivaikutukset
SOUL: Sydän- ja verisuonivaikutuksia koskeva tutkimus tyypin 2 diabetesta sairastavilla potilailla
Kaksoissokkoutetussa, lumelääkekontrolloidussa, tapahtumalähtöisessä tutkimuksessa 9 650 potilasta satunnaistettiin saamaan joko 14 mg semaglutidia (biologisesti samanarvoinen kuin 9 mg:n semaglutidi) kerran vuorokaudessa tai lumelääkettä kerran vuorokaudessa tavanomaisen hoidon lisänä. Potilaat olivat vähintään 50-vuotiaita, ja heillä oli tyypin 2 diabetes sekä suuri sydän- ja verisuonitapahtumien riski, joka määritelmän mukaan tarkoitti todettua sydän- ja verisuonitautia ja/tai kroonista munuaissairautta.
Yhteensä 5 468 potilaalla (56,7 %) oli todettu sydän- ja verisuonitauti mutta ei kroonista munuaissairautta, 1 241 potilaalla (12,9 %) oli ainoastaan krooninen munuaissairaus, ja 2 620 potilaalla (27,2 %) oli sekä sydän- ja verisuonitauti että munuaissairaus. Lähtötilanteessa keskimääräinen ikä oli 66,1 vuotta, ja 71,1 % potilaista oli miehiä. Diabeteksen keskimääräinen kesto oli 15,4 vuotta, keskimääräinen HbA1c-arvo oli 8,0 %, keskimääräinen painoindeksi oli 31,1 kg/m2 ja keskimääräinen eGFR oli 73,8 ml/min/1,73 m2. Potilailla oli anamneesissa aivohavereita (15,4 %), sydäninfarkteja (40,0 %) ja ääreisvaltimotautia (15,7 %). Lähtötilanteessa 26,9 % potilaista sai natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2) estäjiä.
Ensisijainen päätetapahtuma oli aika satunnaistamisesta ensimmäiseen vakavaan sydän- ja verisuonitapahtumaan (major adverse cardiovascular event, MACE) eli sydän- ja verisuoniperäiseen kuolemaan, ei-fataaliin sydäninfarktiin tai ei-fataaliin aivohaveriin. Ensisijainen päätetapahtuma, aika ensimmäiseen MACE-tapahtumaan, ilmeni 1 247 potilaalla tutkimukseen osallistuneista 9 650 potilaasta. Semaglutidihoitoa saaneilla 4 825 potilaalla ensimmäisiä MACE-tapahtumia kirjattiin 579 (12,0 %:lla potilaista), kun taas lumelääkettä saaneilla 4 825 potilaalla ensimmäisiä MACE-tapahtumia kirjattiin 668 (13,8 %:lla potilaista).
Semaglutidin paremmuus lumelääkkeeseen verrattuna MACE-tapahtumien suhteen osoitettiin, ja riskisuhde oli 0,86 [0,77; 0,96] [95 %:n luottamusväli], joka vastaa MACE-tapahtumien suhteellisen riskin 14 %:n pienenemistä (ks. kuva 2). MACE-tapahtumien väheneminen semaglutidia saaneilla potilailla oli johdonmukaista ikään, sukupuoleen, rotuun, etniseen taustaan, lähtötilanteessa määritettyyn painoindeksiin ja munuaisten toiminnan heikkenemisen asteeseen perustuvissa alaryhmissä.
Munuaisiin liittyvän yhdistelmätapahtuman (ensimmäinen vahvistava toissijainen päätetapahtuma) analyysin perusteella laskettu riskisuhde oli 0,91 [0,80; 1,05] [95 %:n luottamusväli].
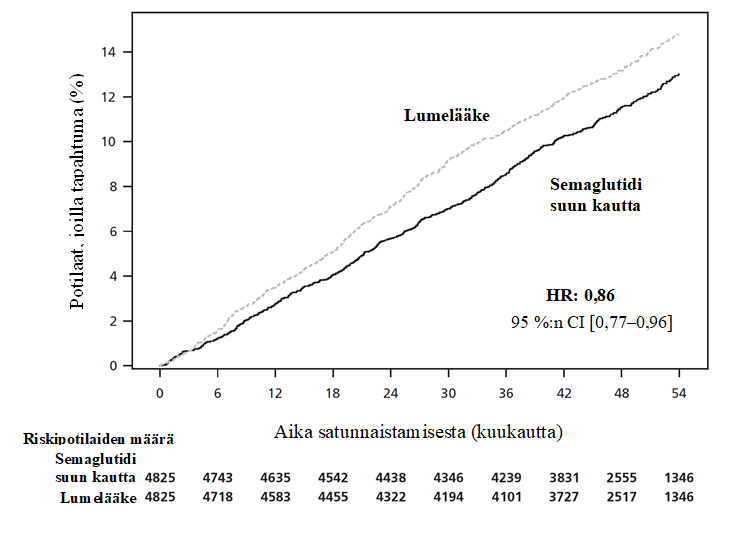
Tiedot ovat tutkimukseen osallistumisen ajalta ja perustuvat koko analyysijoukkoon. Arvioidut kumulatiiviset ilmaantuvuudet perustuvat aikaan satunnaistamisesta ensimmäiseen tapahtumien arviointitoimikunnan vahvistamaan MACE-tapahtumaan siten, että muu kuin sydän- ja verisuoniperäinen kuolema mallinnettiin kilpailevaksi riskiksi käyttäen Aalen–Johansen-estimaattoria. Niiden tutkittavien tiedot, joilla ei ilmennyt kiinnostuksen kohteena olleita tapahtumia, rajattiin pois tutkimukseen osallistumiseen kuuluneen seurannan päättymisen kohdalta. Aika satunnaistamisesta ensimmäiseen MACE-tapahtumaan analysoitiin käyttämällä Coxin suhteellisten riskitiheyksien mallia siten, että kategorisena kiinteänä tekijänä oli hoito. Riskisuhdetta ja luottamusväliä on korjattu ryhmäperäkkäisasetelman suhteen käyttäen uskottavuusosamäärän mukaista järjestystä.
MACE: vakava sydän- ja verisuoniperäinen haittatapahtuma.
Kuva 2: Aika satunnaistamisesta ensimmäiseen MACE-tapahtumaan – kumulatiivisen ilmaantuvuuden funktiota kuvaava käyrä
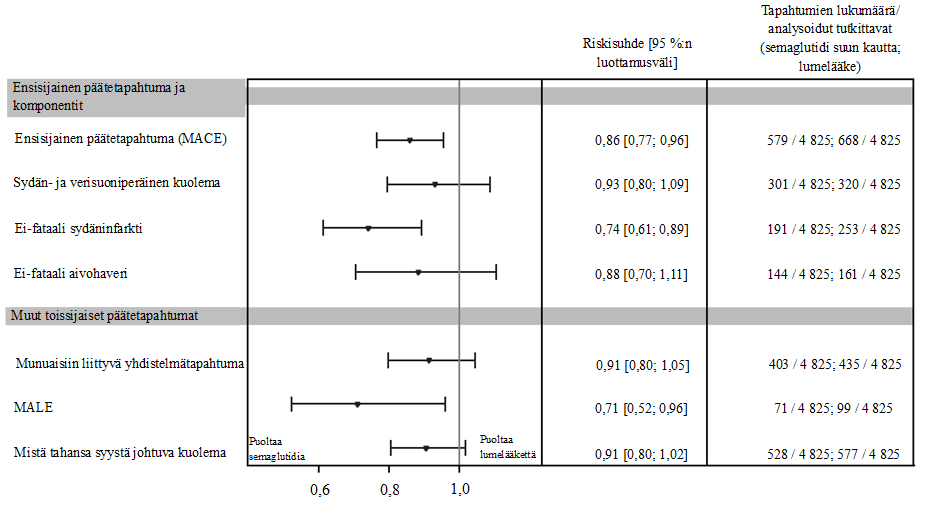
Tiedot ovat tutkimukseen osallistumisen ajalta ja perustuvat koko analyysijoukkoon. Aika satunnaistamisesta kuhunkin päätetapahtumaan analysoitiin käyttämällä Coxin suhteellisten riskitiheyksien mallia siten, että kategorisena kiinteänä tekijänä oli hoito. Niiden tutkittavien tiedot, joilla ei ilmennyt kiinnostuksen kohteena olleita tapahtumia, rajattiin pois tutkimukseen osallistumisen päättymisen kohdalta. Ensisijaisen päätetapahtuman osalta riskisuhdetta ja luottamusväliä on korjattu ryhmäperäkkäisasetelman suhteen käyttäen uskottavuusosamäärän mukaista järjestystä. Sydän- ja verisuoniperäinen kuolema sisältää sekä sydän- ja verisuoniperäisen kuoleman että määrittämättömän kuolinsyyn.
HR: riskisuhde, CI: luottamusväli.
Munuaisiin liittyvä yhdistelmätapahtuma: päätetapahtuma, johon sisältyivät sydän- ja verisuoniperäinen kuolema, munuaisperäinen kuolema, CKD-EPI-kaavalla arvioidun glomerulusten laskennallisen suodatusnopeuden (eGFR, estimated glomerular filtration rate) pysyvä ≥ 50 %:n pieneneminen lähtötilanteeseen verrattuna, CKD-EPI-kaavalla arvioidun eGFR-arvon pysyvä pieneneminen tasolle < 15 m/min/1,73 m2 ja pitkäaikaisen munuaiskorvaushoidon aloittaminen (dialyysihoito tai munuaisensiirto).
MALE: merkittävät raajojen haittatapahtumat; yhdistelmäpäätetapahtuma, johon sisältyi raajan akuutin tai kroonisen iskemian aiheuttama sairaalahoidon tarve.
Kuva 3: Hoidon vaikutus ensisijaiseen päätetapahtumaan, sen komponentteihin ja muihin toissijaisiin päätetapahtumiin (SOUL)
PIONEER 6: Sydän- ja verisuonivaikutuksia koskeva tutkimus tyypin 2 diabetesta sairastavilla potilailla
Kaksoissokkoutetussa tutkimuksessa (PIONEER 6) 3 183 tyypin 2 diabetesta sairastavaa vähintään 50‑vuotiasta potilasta, joilla oli suuri sydän- ja verisuonitapahtumien riski, satunnaistettiin saamaan joko 14 mg semaglutidia kerran vuorokaudessa tai lumelääkettä tavanomaisen hoidon lisänä. Havainnointijakson mediaanikesto oli 16 kuukautta. PIONEER 6 oli ennen myyntiluvan myöntämistä toteutettu sydän- ja verisuonivaikutuksia koskeva tutkimus, jonka tarkoitus oli sydämeen ja verisuoniin liittyvän turvallisuuden varmistaminen.
Ensisijainen päätetapahtuma oli aika satunnaistamisesta ensimmäiseen vakavaan sydän- ja verisuoniperäiseen haittatapahtumaan (major adverse cardiovascular event, MACE) eli sydän- ja verisuoniperäiseen kuolemaan, ei-fataaliin sydäninfarktiin tai ei-fataaliin aivohaveriin.
Ensimmäisten MACE-tapahtumien kokonaismäärä oli 137, joista 61 (3,8 %) ilmeni semaglutidia saaneilla ja 76 (4,8 %) lumelääkettä saaneilla potilailla. Ensimmäiseen MACE-tapahtumaan kuluneen ajan analyysin perusteella riskisuhde oli 0,79 [0,57; 1,11]95 %:n luottamusväli.
Paino
Semaglutidihoidon päättyessä 27–65,7 % potilaista oli saavuttanut ≥ 5 %:n painonlaskun ja 6–34,7 % oli saavuttanut ≥ 10 %:n painonlaskun, kun taas aktiivisia vertailuvalmisteita saaneista potilaista ≥ 5 %:n painonlaskun oli saavuttanut 12–39 % ja ≥ 10 %:n painonlaskun 2–8 %.
Sydän- ja verisuonivaikutuksia koskevassa SOUL-tutkimuksessa havaittiin, että semaglutidia tavanomaisen hoidon lisänä saaneiden potilaiden paino laski 4,22 kg lähtötilanteesta viikon 104 kohdalle, kun taas lumelääkettä tavanomaisen hoidon lisänä saaneiden potilaiden paino laski 1,27 kg.
Verenpaine
Semaglutidihoito oli laskenut systolista verenpainetta 2–7 mmHg.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset Rybelsus-valmisteen käytöstä tyypin 2 diabeteksen hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Semaglutiditabletteja on kahdessa formulaatiossa:
- 1,5 mg, 4 mg ja 9 mg (pyöreät tabletit)
- 3 mg, 7 mg ja 14 mg (soikeat tabletit).
Kummankin formulaation tehon ja turvallisuuden voidaan odottaa olevan samankaltaisia. Seuraavassa taulukossa esitetään kahden formulaation bioekvivalentit annokset.
Taulukko 10: Suun kautta otettavan kahden formulaation annokset, joilla saadaan yhtä suuri vaikutus
| Annos | Yksi pyöreä tabletti | Yksi soikea tabletti | |
| Aloitusannos | 1,5 mg | Yhtä suuri vaikutus kuin | 3 mg |
| Ylläpitoannokset | 4 mg | Yhtä suuri vaikutus kuin | 7 mg |
| 9 mg | Yhtä suuri vaikutus kuin | 14 mg |
Imeytyminen
Suun kautta annetulla semaglutidilla on pieni absoluuttinen hyötyosuus, ja sen imeytyminen vaihtelee. Suositellun annoksen ottaminen päivittäin sekä pitkä puoliintumisaika vähentävät altistuksen päiväkohtaista vaihtelua.
Semaglutidin farmakokinetiikkaa on tutkittu kattavasti terveillä tutkittavilla ja tyypin 2 diabetesta sairastavilla potilailla. Suun kautta annetun semaglutidin huippupitoisuus plasmassa saavutettiin noin 1 tunnin kuluttua annoksen ottamisesta. Vakaan tilan altistus saavutettiin 4–5 viikkoa jatkuneen, kerran vuorokaudessa tapahtuneen annostelun jälkeen. Tyypin 2 diabetesta sairastavien potilaiden keskimääräiset vakaan tilan pitoisuudet olivat suunnilleen seuraavassa kuvatun mukaiset:
7 mg: keskimääräinen pitoisuus oli 7 nmol/l, ja 90 %:lla semaglutidia 7 mg:n annoksella saaneista tutkittavista keskimääräinen pitoisuus oli 2–22 nmol/l.
14 mg: keskimääräinen pitoisuus oli 15 nmol/l, ja 90 %:lla semaglutidia 14 mg:n annoksella saaneista tutkittavista keskimääräinen pitoisuus oli 4–45 nmol/l.
25 mg: keskimääräinen pitoisuus oli 47 nmol/l, ja 90 %:lla semaglutidia 25 mg:n annoksella saaneista tutkittavista keskimääräinen pitoisuus oli 11–142 nmol/l.
50 mg: keskimääräinen pitoisuus oli 92 nmol/l, ja 90 %:lla semaglutidia 50 mg:n annoksella saaneista tutkittavista keskimääräinen pitoisuus oli 23–279 nmol/l.
Systeeminen semaglutidialtistus suureni suhteessa annokseen kunkin formulaation osalta (toisin sanoen 7 mg:n ja 14 mg:n annoksen välillä sekä 25 mg:n ja 50 mg:n annoksen välillä). Hyötyosuus oli suurempi 25 mg:n ja 50 mg:n vahvuuksilla.
In vitro -tietojen perusteella salkaprotsaattinatrium edistää semaglutidin imeytymistä. Semaglutidi imeytyy pääasiassa mahalaukusta.
Suun kautta annetun semaglutidin arvioitu hyötyosuus on 3 mg:n, 7 mg:n ja 14 mg:n vahvuuksilla noin 1 % ja 25 mg:n ja 50 mg:n vahvuuksilla enintään 2 %. Imeytymisessä oli paljon vaihtelua tutkittavien välillä (variaatiokerroin oli noin 100 %). Hyötyosuuden yksilökohtaista vaihtelua koskeva arvio ei ollut luotettava.
Semaglutidin imeytyminen vähenee, jos samanaikaisesti nautitaan ruokaa tai suuria määriä vettä. Erilaisia semaglutidin antoaikatauluja on tutkittu, ja tutkimusten mukaan pidempi paasto ennen annoksen ottamista ja annoksen ottamisen jälkeen lisää imeytymistä (ks. kohta Annostus ja antotapa).
Jakautuminen
Tyypin 2 diabetesta sairastavilla potilailla arvioitu absoluuttinen jakautumistilavuus on noin 8 l. Semaglutidi sitoutuu voimakkaasti (> 99 %) plasman proteiineihin.
Biotransformaatio
Semaglutidi metaboloituu peptidirungon proteolyyttisen pilkkoutumisen ja sitä seuraavan rasvahapposivuketjun beetaoksidaation kautta. Neutraaliendopeptidaasin (NEP-entsyymin) oletetaan osallistuvan semaglutidin metaboliaan.
Eliminaatio
Semaglutidiin liittyvät metaboliitit erittyvät pääasiassa virtsaan ja ulosteeseen. Noin 3 % imeytyneestä annoksesta erittyy virtsaan muuttumattomassa muodossa olevana semaglutidina.
Semaglutidin eliminaation puoliintumisaika on noin 1 viikko, joten sitä on verenkierrossa noin 5 viikon ajan viimeisen annoksen saamisesta. Tyypin 2 diabetesta sairastavilla potilailla semaglutidin puhdistuma on noin 0,04 l/h.
Erityisryhmät
Iäkkäät
Niiden tietojen perusteella, jotka on saatu kliinisistä tutkimuksista, joihin osallistui korkeintaan 92-vuotiaita potilaita, ikä ei vaikuta semaglutidin farmakokinetiikkaan.
Sukupuoli
Sukupuolella ei ollut kliinisesti merkittäviä vaikutuksia semaglutidin farmakokinetiikkaan.
Rotu ja etninen tausta
Rotu (valkoihoinen, mustaihoinen tai afroamerikkalainen, aasialainen) ja etninen tausta (latinalaisamerikkalainen, ei-latinalaisamerikkalainen) eivät vaikuttaneet kliinisesti merkittävällä tavalla semaglutidin farmakokinetiikkaan.
Paino
Painon todettiin vaikuttavan semaglutidialtistukseen. Suurempi paino oli yhteydessä pienempään altistukseen. Kliinisissä tutkimuksissa saavutettiin riittävä systeeminen semaglutidialtistus, kun potilaan paino oli 40–212 kg.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminta ei vaikuttanut semaglutidin farmakokinetiikkaan kliinisesti merkittävästi. Semaglutidin farmakokinetiikkaa arvioitiin tutkimuksessa, jossa lievää, keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastaville potilaille ja loppuvaiheen munuaissairautta sairastaville, dialyysihoitoa saaville potilaille annettiin semaglutidia kerran vuorokaudessa 10 peräkkäisen päivän ajan, ja tuloksia verrattiin tutkittaviin, joiden munuaiset toimivat normaalisti. Sama osoitettiin myös tyypin 2 diabetesta ja munuaisten vajaatoimintaa sairastavien tutkittavien kohdalla faasin 3a tutkimuksista saatujen tietojen perusteella.
Maksan vajaatoiminta
Maksan vajaatoiminta ei vaikuttanut semaglutidin farmakokinetiikkaan kliinisesti merkittävästi. Semaglutidin farmakokinetiikkaa arvioitiin tutkimuksessa, jossa lievää, keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastaville potilaille annettiin semaglutidia kerran vuorokaudessa 10 peräkkäisen päivän ajan, ja tuloksia verrattiin tutkittaviin, joiden maksa toimi normaalisti.
Ylemmän ruoansulatuskanavan sairaudet
Ylemmän ruoansulatuskanavan sairaudet (krooninen gastriitti ja/tai ruokatorven refluksitauti) eivät vaikuttaneet semaglutidin farmakokinetiikkaan kliinisesti merkittävästi. Farmakokinetiikkaa arvioitiin tyypin 2 diabetesta sairastavilla potilailla, joilla oli tai ei ollut ylemmän ruoansulatuskanavan sairauksia. Näille potilaille annettiin semaglutidia kerran vuorokaudessa 10 peräkkäisen päivän ajan. Sama osoitettiin myös tyypin 2 diabetesta ja ylemmän ruoansulatuskanavan sairauksia sairastavien tutkittavien kohdalla faasin 3a tutkimuksista saatujen tietojen perusteella.
Pediatriset potilaat
Semaglutidia ei ole tutkittu pediatristen potilaiden hoidossa.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta tai genotoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Jyrsijöillä todetut ei-letaalit kilpirauhasen C-solukasvaimet ovat GLP-1-reseptoriagonistien luokkavaikutus. Rotilla ja hiirillä tehdyissä, 2 vuotta kestäneissä karsinogeenisuustutkimuksissa kliinisesti merkityksellinen semaglutidialtistus aiheutti kilpirauhasen C-solukasvaimia. Muita hoitoon liittyviä kasvaimia ei havaittu. Jyrsijöiden C-solukasvaimet johtuvat ei-genotoksisesta, spesifisestä GLP-1-reseptorivälitteisestä mekanismista, jolle jyrsijät ovat erityisen herkkiä. Merkityksen ihmiselle katsotaan olevan pieni, mutta sitä ei voida sulkea täysin pois.
Rotilla tehdyissä hedelmällisyystutkimuksissa semaglutidi ei vaikuttanut parittelukäyttäytymiseen tai urosrottien hedelmällisyyteen. Naarasrottien kiimakierron todettiin pidentyneen ja keltarauhasten (ovulaatioiden) lukumäärän hieman pienentyneen käytettäessä annoksia, joihin liittyi emon painon laskua.
Rotilla tehdyissä alkion- ja sikiönkehitystä koskeneissa tutkimuksissa semaglutidi aiheutti alkiotoksisuutta kliinisesti merkityksellistä altistusta pienempinä annoksina. Semaglutidi aiheutti emoille huomattavaa painon laskua ja heikensi alkioiden eloonjäämistä ja kasvua. Sikiöillä todettiin merkittäviä luuston ja sisäelinten epämuodostumia, mukaan lukien pitkiin luihin, kylkiluihin, nikamiin, häntään, verisuoniin ja aivokammioihin kohdistuneita vaikutuksia. Mekanistiset arvioinnit viittasivat siihen, että alkiotoksisuuteen vaikutti GLP-1-reseptorivälitteinen häiriö ravinteiden kulkeutumisessa ruskuaispussin kautta rotan sikiöille. Ruskuaispussin anatomiassa ja toiminnassa on lajikohtaisia eroja, eikä GLP-1-reseptori ilmentynyt kädellisten (muiden kuin ihmisen) ruskuaispussissa, joten pidetään epätodennäköisenä, että tällä mekanismilla olisi merkitystä ihmisille. Semaglutidin suoraa vaikutusta sikiöön ei kuitenkaan voida poissulkea.
Kaneilla ja cynomolgus-apinoilla tehdyissä kehitystoksisuustutkimuksissa kliinisesti merkityksellisen altistuksen todettiin aiheuttavan enemmän keskenmenoja ja sikiöpoikkeavuuksien ilmaantuvuuden lievää nousua. Löydöksiä todettiin emoilla, joilla esiintyi huomattavaa painon laskua (jopa 16 %). Ei ole tiedossa, liittyvätkö nämä vaikutukset emon vähentyneeseen ruoankulutukseen, joka on suora GLP-1-vaikutus.
Syntymänjälkeistä kasvua ja kehitystä arvioitiin cynomolgus-apinoilla. Poikaset olivat syntyessään hieman pienempiä, mutta kasvu tasoittui imetyksen aikana.
Nuorilla rotilla semaglutidi aiheutti sukupuolisen kypsymisen viivästymistä sekä uroksilla että naarailla. Tämä viive ei vaikuttanut kummankaan sukupuolen hedelmällisyyteen tai lisääntymiskykyyn eikä aiheuttanut naarasrotille keskenmenoja.
Farmaseuttiset tiedot
Apuaineet
3 mg, 7 mg ja 14 mg:
Salkaprotsaattinatrium
Povidoni K90
Selluloosa, mikrokiteinen
Magnesiumstearaatti
25 mg ja 50 mg (ei kaupan Suomessa):
Salkaprotsaattinatrium
Magnesiumstearaatti
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 mg: 2 vuotta.
7 mg: 30 kuukautta.
14 mg: 30 kuukautta.
25 mg: 3 vuotta (ei kaupan Suomessa).
50 mg: 3 vuotta (ei kaupan Suomessa).
Säilytys
Säilytä alkuperäisessä läpipainopakkauksessa. Herkkä valolle ja kosteudelle. Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
RYBELSUS tabletti
3 mg (L:ei) 30 fol (114,27 €)
7 mg (L:ei) 30 fol (114,27 €), 90 fol (320,48 €)
14 mg (L:ei) 30 fol (114,27 €), 90 fol (320,48 €)
PF-selosteen tieto
Alu/Alu-läpipainopakkaukset.
Pakkauskoot: 10, 30, 60, 90 ja 100 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Rybelsus 3 mg tabletit
Valkoinen tai vaaleankeltainen, soikea tabletti (7,5 mm x 13,5 mm), johon on kaiverrettu toiselle puolelle "3" ja toiselle "novo".
Rybelsus 7 mg tabletit
Valkoinen tai vaaleankeltainen, soikea tabletti (7,5 mm x 13,5 mm), johon on kaiverrettu toiselle puolelle "7" ja toiselle "novo".
Rybelsus 14 mg tabletit
Valkoinen tai vaaleankeltainen, soikea tabletti (7,5 mm x 13,5 mm), johon on kaiverrettu toiselle puolelle "14" ja toiselle "novo".
Rybelsus 25 mg tabletit (ei kaupan Suomessa)
Valkoinen tai vaaleankeltainen, soikea tabletti (6,8 mm x 12 mm), johon on kaiverrettu toiselle puolelle ”25” ja toiselle ”novo”.
Rybelsus 50 mg tabletit (ei kaupan Suomessa)
Valkoinen tai vaaleankeltainen, soikea tabletti (6,8 mm x 12 mm), johon on kaiverrettu toiselle puolelle ”50” ja toiselle ”novo”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
RYBELSUS tabletti
3 mg 30 fol
7 mg 30 fol, 90 fol
14 mg 30 fol, 90 fol
- Alempi erityiskorvaus (65 %). Dulaglutidi, liraglutidi ja semaglutidi (tyypin 2 diabetes, aikuiset): Vaikeahoitoisen tyypin 2 diabeteksen hoito erityisin edellytyksin (285).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Dulaglutidi, liraglutidi ja semaglutidi (tyypin 2 diabetes, aikuiset): Vaikeahoitoisen tyypin 2 diabeteksen hoito erityisin edellytyksin (346).
ATC-koodi
A10BJ06
Valmisteyhteenvedon muuttamispäivämäärä
27.11.2025
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
