POTELIGEO infuusiokonsentraatti, liuosta varten 4 mg/ml
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo sisältää 20 mg mogamulitsumabia 5 ml:ssa, mikä vastaa 4 mg/ml.
Mogamulitsumabi on tuotettu kiinanhamsterin munasarjasoluissa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusiokonsentraatti, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
POTELIGEO on tarkoitettu aikuispotilaille, joilla on mycosis fungoides (MF) tai Sézaryn oireyhtymä ja jotka ovat saaneet vähintään yhtä aiempaa systeemistä hoitoa.
Ehto
Vain sairaalakäyttöön. Valmistetta tulee käyttää vain syövän hoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Hoidon ja sen aloittamisen tulee tapahtua syövän hoitoon perehtyneiden kokeneiden lääkäreiden valvonnassa, ja hoidon saavat antaa vain terveydenhuollon ammattilaiset sellaisessa ympäristössä, jossa elvytysvälineet ovat saatavana.
Annostus
Suositeltu annos on 1 mg/kg mogamulitsumabia vähintään 60 minuuttia kestävänä infuusiona laskimoon. Valmiste annetaan viikoittain päivinä 1, 8, 15 ja 22 ensimmäisen 28 vuorokauden pituisen hoitosyklin aikana. Sen jälkeen infuusioita annetaan kahden viikon välein päivinä 1 ja 15 jokaisessa seuraavassa 28 vuorokauden syklissä, kunnes sairaus etenee tai potilaalla ilmenevä toksisuus ei ole enää hyväksyttävää.
POTELIGEO pitää antaa 2 vuorokauden kuluessa aikataulun mukaisesta päivästä. Jos annos jää väliin ja on kulunut yli 2 vuorokautta, seuraava annos on annettava mahdollisimman pian. Sen jälkeen annosteluohjelmaa jatketaan niin, että annokset annetaan uuden aikataulun mukaisina päivinä.
Ensimmäisen POTELIGEO-infuusion yhteydessä suositellaan esilääkitystä kuumelääkkeellä ja antihistamiinilla. Jos ilmenee infuusioreaktio, anna esilääkitystä ennen seuraavia POTELIGEO-infuusioita.
Annoksen muuttaminen
Ihoreaktiot
Mogamulitsumabia saaneilla potilailla on ilmennyt lääkeihottumaa (lääkeaineihottuma), joka oli joissakin tapauksissa vaikea-asteinen ja/tai vakava.
- Jos ilmenee lääkkeeseen liittyvä ihottuma, joka on vaikeusasteeltaan 2 tai 3 (keskivaikea tai vaikea), mogamulitsumabihoito on keskeytettävä ja ihottumaa on hoidettava asianmukaisesti, kunnes se lievenee ≤ asteeseen 1 (lievä), jolloin mogamulitsumabihoitoa voidaan jatkaa.
- POTELIGEO on lopetettava pysyvästi, jos ilmenee hengenvaarallinen (asteen 4) ihottuma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Infuusion antoon liittyvät reaktiot
- POTELIGEO-valmisteen annostelu on keskeytettävä tilapäisesti, jos ilmenee lieviä tai vaikeita (asteen 1–3) infuusioon liittyviä reaktioita, ja oireisiin on annettava hoitoa. Infuusion antonopeutta on pienennettävä vähintään 50 %:lla, kun infuusion anto aloitetaan uudelleen oireiden hävittyä. Jos reaktio toistuu, on harkittava infuusion lopettamista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- POTELIGEO-valmisteen anto on lopetettava pysyvästi, jos ilmenee hengenvaarallinen (asteen 4) infuusioon liittyvä reaktio (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityisryhmät
Pediatriset potilaat
POTELIGEO-valmisteen turvallisuutta ja tehoa lasten ja alle 18 vuoden ikäisten nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Iäkkäät potilaat
Annosta ei tarvitse muuttaa hoidettaessa ikääntyneitä potilaita (katso kohta Farmakokinetiikka).
Heikentynyt munuaistoiminta
Populaatiofarmakokineettisen analyysin perusteella mitään muutosta annokseen ei suositella potilaille, joiden munuaistoiminta on heikentynyt lievästi tai vaikeasti (ks. kohta Farmakokinetiikka).
Heikentynyt maksan toiminta
Populaatiofarmakokineettisen analyysin perusteella ei suositella mitään muutosta annokseen potilaille, joiden maksan toiminta on heikentynyt lievästi tai kohtalaisesti. POTELIGEO-valmistetta ei ole tutkittu potilailla, joilla on vaikeasti heikentynyt maksan toiminta (ks. kohta Farmakokinetiikka).
Antotapa
POTELIGEO on tarkoitettu annettavaksi laskimoon. Sen saa antaa ainoastaan vähintään 60 minuuttia kestävänä infuusiona laskimoon. Katso edeltä suositukset infuusion antoon liittyvien reaktioiden varalta.
Ks. Kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen laimentamisesta ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Ihoreaktiot
Mogamulitsumabia saaneilla potilailla on ilmennyt lääkeihottumaa (lääkeaineihottuma), joka oli joissakin tapauksissa vaikea-asteinen ja/tai vakava.
Kun mogamulitsumabia on annettu potilaille, joilla on muu T-solulymfooma kuin MF tai Sézaryn oireyhtymä, alle 1 %:lla kliinisten tutkimusten potilaista on ilmennyt vakavia ihoreaktioita, ml. Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi, ja niitä on ilmennyt myös markkinoille tulon jälkeen. Osan näistä tapauksista raportoitiin johtaneen kuolemaan. Potilaita on tarkkailtava huolellisesti Stevens-Johnsonin oireyhtymään ja toksiseen epidermaaliseen nekrolyysiin viittaavien oireiden ja löydösten varalta. Jos niitä ilmenee, POTELIGEO on keskeytettävä eikä hoitoa saa aloittaa uudelleen, ennen kuin Stevens-Johnsonin oireyhtymä tai toksinen epidermaalinen nekrolyysi on suljettu pois ja ihoreaktio lieventynyt ≤ asteeseen 1. Jos ilmenee Stevens-Johnsonin oireyhtymä tai toksinen epidermaalinen nekrolyysi, on annettava asianmukaista sairaanhoitoa. Ks. lisätietoja annoksen muuttamisesta kohdasta Annostus ja antotapa.
Infuusion antoon liittyvät reaktiot
Akuutteja infuusion antoon liittyvät reaktioita on havaittu potilailla, joita on hoidettu mogamulitsumabilla. Infuusioon liittyvät reaktiot olivat enimmäkseen vaikeusasteeltaan lieviä tai keskivaikeita, mutta myös muutamasta vakavasta reaktiosta (aste 3) on raportoitu. Suurin osa infuusioon liittyvistä reaktioista ilmenee ensimmäisen infuusion aikana tai pian sen jälkeen (kaikki 24 tunnin kuluessa annosta), ja esiintyvyys laskee seuraavien antokertojen myötä.
Potilaita on tarkkailtava huolellisesti infuusion aikana ja sen jälkeen. Jos ilmenee anafylaktinen reaktio, mogamulitsumabin antaminen on keskeytettävä heti ja lopetettava pysyvästi ja on annettava asianmukaista sairaanhoitoa.
Jos ilmenee infuusioon liittyvä reaktio, infuusio on keskeytettävä ja annettava asianmukaista sairaanhoitoa.
Infuusion voi aloittaa uudelleen hitaammalla nopeudella, kun oireet ovat hävinneet. Ks. lisätietoja esilääkityksestä ja annoksen muuttamisesta kohdasta Annostus ja antotapa.
Infektiot
Potilaat, joilla on MF tai Sézaryn oireyhtymä ja joita hoidetaan mogamulitsumabilla, on kohonnut vakavan infektion ja/tai virusinfektion uudelleen aktivoitumisen riski. Mogamulitsumabin antamista yhdessä systeemisten immuunivastetta muuntavien lääkevalmisteiden tai muiden MF:n tai Sézaryn oireyhtymän hoitoon hyväksyttyjen valmisteiden kanssa ei ole tutkittu eikä sitä siksi suositella, erityisesti sen vuoksi, että mogamulitsumabihoitoa saavilla potilailla on riski saada vaikeita infektioita. Paikallisia steroideja tai pieniä annoksia systeemisiä kortikosteroideja voidaan käyttää mogamulitsumabihoidon aikana. Vaikean infektion ja/tai virusinfektion uudelleen aktivoitumisen riski voi kuitenkin olla suurempi, kun samanaikaisesti annetaan systeemisiä immunosuppressiivisia lääkeaineita. Potilaita on tarkkailtava infektion merkkien ja oireiden varalta ja hoitoa on annettava viipymättä.
Potilailta on testattava hepatiitti B -infektio ennen mogamulitsumabihoidon aloittamista. Jos potilas saa positiivisen testituloksen nykyisestä tai aiemmasta hepatiitti B -infektiosta, suositellaan konsultoimaan hepatiitti B:n hoitoon perehtynyttä lääkäriä asianmukaisista toimenpiteistä hepatiitti B:n uudelleen aktivoitumisen ehkäisemiseksi.
Allogeenisen hematopoieettisen kantasolusiirron komplikaatiot mogamulitsumabin jälkeen
Komplikaatioita, ml. vaikea käänteishyljintäreaktio (graft-versus-host-reaktio), on todettu potilailla, joilla on muu T-solulymfooma kuin MF tai Sézaryn oireyhtymä ja joille on tehty allogeeninen hematopoieettinen kantasolusiirto mogamulitsumabihoidon jälkeen.
Suurentuneesta komplikaatioiden riskistä siirron jälkeen on raportoitu tapauksissa, joissa mogamulitsumabia on annettu lyhyen ajan sisällä (noin 50 vrk) ennen hematopoieettista kantasolusiirtoa. Seuraa potilaita huolellisesti siirtoon liittyvien komplikaatioiden varhaisten merkkien varalta.
Mogamulitsumabihoidon turvallisuutta autologisen tai allogeenisen hematopoieettisen kantasolusiirron jälkeen ei ole tutkittu.
Tuumorilyysioireyhtymä
Tuumorilyysioireyhtymää on havaittu potilailla, jotka saavat mogamulitsumabia. Tuumorilyysioireyhtymää havaittiin useimmin hoidon ensimmäisen kuukauden aikana. Potilailla, joilla on nopeasti kasvava kasvain ja suuri kasvaintaakka, on riski saada tuumorilyysioireyhtymä. Potilaita on tarkkailtava huolellisesti asianmukaisilla kliinisillä ja laboratoriokokeilla, joilla arvioidaan elektrolyyttitasapainoa, nestetasapainoa ja munuaistoimintaa, erityisesti hoidon ensimmäisen kuukauden ajan, ja potilaita on hoidettava parhaan hoitokäytännön mukaisesti. Tuumorilyysioireyhtymän hoitoon voi kuulua aggressiivinen nestehoito, elektrolyyttipoikkeamien korjaaminen, hyperurikemian hoito ja tukihoito.
Sydänsairaudet
Yksi akuutti sydäninfarktitapaus on havaittu kliinisen tutkimuksen potilaalla, jolla on MF/Sézaryn oireyhtymä ja joka sai mogamulitsumabia. Kliinisissä tutkimuksissa on raportoitu stressikardiomyopatiaa (takotsubo-oireyhtymä; yksi tapaus) ja akuutti sydäninfarkti (yksi tapaus) potilailla, joilla on muita T-solulymfoomia. Tutkittavien esitiedoissa oli erilaisia riskitekijöitä. Potilaita, joilla on sydänsairauksiin liittyviä riskitekijöitä, on tarkkailtava ja ryhdyttävä asianmukaisiin varotoimiin.
Suurisoluinen transformaatio
Potilaista, joilla on suurisoluinen transformaatio, on vain vähän tietoa.
Muuta
Mogamulitsumabia ei pidä antaa ihon alle tai lihakseen, nopeasti laskimoon tai boluksena laskimoon.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia per annos eli sen voidaan sanoa olevan ”natriumiton”.
Tämä lääkevalmiste sisältää 1 mg polysorbaatti 80:tä per injektiopullo, joka vastaa 0,2 mg/ml. Polysorbaatit voivat aiheuttaa allergisia reaktioita.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi/ehkäisy naisilla
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä POTELIGEO-hoidon aikana ja vähintään 6 kuukauden ajan hoidon päättymisen jälkeen.
Raskaus
Ei ole olemassa tietoja mogamulitsumabin käytöstä raskaana oleville naisille. Vaikka mogamulitsumabi läpäisee jaavanmakakilla veri-istukkaesteen, eläinkokeissa ei ole havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia sikiöön kohdistuvaa farmakologista vaikutusta lukuun ottamatta (ks. kohta Prekliiniset tiedot turvallisuudesta). Varmuuden vuoksi mogamulitsumabin käyttöä on suositeltavaa välttää raskauden aikana.
Imetys
Ei tiedetä, erittyykö mogamulitsumabi ihmisen rintamaitoon. Ihmisen immunoglobuliini G:n tiedetään erittyvän rintamaitoon muutaman ensimmäisen vuorokauden aikana syntymän jälkeen, minkä jälkeen pitoisuudet laskevat pian vähäisiksi. Sen vuoksi lapseen kohdistuvia riskejä ei voida poissulkea tämän lyhyen ajanjakson aikana. Sen jälkeen POTELIGEO-valmistetta voi mahdollisesti käyttää rintaruokinnan aikana, jos kliinisesti tarpeen.
Hedelmällisyys
Kliinistä tietoa mogamulitsumabin vaikutuksesta ihmisen hedelmällisyyteen ei ole saatavana. Mogamulitsumabin vaikutusta hedelmällisyyteen ei ole arvioitu erityisissä eläinkokeissa. Jaavanmakakeilla tehdyissä toistuvan altistuksen aiheuttamaa toksisuutta koskevissa tutkimuksissa ei havaittu urosten ja naaraiden sukupuolielimiin kohdistuvia haittavaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Mogamulitsumabilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Uupumusta voi esiintyä mogamulitsumabin antamisen jälkeen (ks. kohta Haittavaikutukset).
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Useimmin ilmoitetut vakavat haittavaikutukset olivat keuhkokuume, kuume, infuusioon liittyvä reaktio ja selluliitti.
Useimmin ilmoitetut haittavaikutukset olivat infuusioon liittyvä reaktio ja ihottuma (lääkeaineihottuma); suurin osa näistä reaktioista ei ollut vakavia, ja ne olivat vaikeusasteiltaan 1 tai 2.
Vaikeita haittavaikutuksia olivat asteen 4 hengitysvajaus (1,1 %), ja asteen 5 haittavaikutuksia olivat polymyosiitti ja sepsis (kumpikin 0,5 %).
Haittavaikutustaulukko
Haittavaikutukset esitetään niiden elinluokan mukaan, ja yleisyys on luokiteltu seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1: POTELIGEO-valmisteeseen liittyviksi tunnistetut haittavaikutukset
| Elinluokka | Yleisyysluokka | Haittavaikutus |
| Veri ja imukudos | Yleinen | Anemia, neutropenia, leukopenia, trombosytopenia |
| Umpieritys | Yleinen | Hypotyreoosi |
| Ruoansulatuselimistö | Hyvin yleinen | Ummetus, ripuli, pahoinvointi, suutulehdus |
| Yleinen | Oksentelu | |
| Yleinen | Koliitti | |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Uupumus, perifeerinen ödeema, kuume |
| Maksa ja sappi | Melko harvinaiset | Akuutti maksatulehdus, hepatiitti |
| Infektiot | Hyvin yleinen | Infektiota |
| Yleinen | Ylempien hengitysteiden infektio | |
| Vammat, myrkytykset ja hoitokomplikaatiot | Hyvin yleinen | Infuusion antoon liittyvä reaktio |
| Tutkimukset | Yleinen | Kohonnut alaniiniaminotransferaasi, kohonnut aspartaattiaminotransferaasi, kohonnut veren alkalinen fosfataasi, pienentynyt lymfosyyttien määrä |
| Aineenvaihdunta ja ravitsemus | Melko harvinaiset | Tuumorilyysioireyhtymä |
| Hermosto | Hyvin yleinen | Päänsärky |
| Iho ja ihonalainen kudos | Hyvin yleinen | Lääkeihottuma (ml. ihottuma iholla) |
| Tuntematon | Granuloomab |
a Follikuliitti, selluliitti, kandidiaasi, keuhkokuume, sepsis, ihoinfektio, korvakäytävätulehdus, vyöruusu, stafylokokin aiheuttama ihoinfektio, virtsatieinfektio, Herpes simplex -infektio ja sytomegalovirusinfektio.
b Mukaan lukien granuloomatapaukset ihossa (päänahka, periaurikulaarinen alue ja vartalo) ja luussa (rintalasta, kallo, selkäranka, kylkiluut ja lantio).
Valikoitujen haittavaikutusten kuvaus
Ihoreaktiot
POTELIGEO-valmistetta saaneilla potilailla on ilmennyt lääkeihottumaa (lääkeaineihottuma), joka oli joissakin tapauksissa vaikea-asteinen ja/tai vakava. Suurin osa hoitoon liittyvistä ihoreaktioista oli asteeltaan 1 tai 2, ja asteen ≥ 3 lääkeihottumaa esiintyi 4,3 %:lla potilaista. Lääkeihottumien ja ihottumien suhteen ei tunnistettu säännönmukaisuuksia tapahtuman alkamiseen kuluneessa ajassa; sekä varhain että myöhään alkavia tapahtumia esiintyi.
Infuusion antoon liittyvät reaktiot
Infuusion antoon liittyvät reaktioita on havaittu 33 %:lla POTELIGEO-hoitoa saaneista potilaista. Suurin osa hoitoon liittyvistä infuusion antoon liittyvistä reaktioista oli asteeltaan 1 tai 2, ja ne esiintyivät ensimmäisen infuusion aikana tai pian sen jälkeen. Vaikeita reaktioita (aste 3) esiintyi 4 %:lla potilaista.
Infuusioon liittyvien reaktioiden esiintyvyys oli suurimmillaan ensimmäisen infuusion jälkeen (28,8 %:lla tutkittavista), ja kahden tai useamman infuusion jälkeen niitä esiintyi enää ≤ 3,8 %:lla tutkittavista.
Infuusion keskeytyksiä esiintyi noin 6 %:lla potilaista, ja suurin osa niistä (noin 90 %) esiintyi ensimmäisen mogamulitsumabi-hoitosyklin aikana.
Alle 1 % potilaista, jotka saivat hoitoa kliinisessä tutkimuksessa 0761-010, keskeytti hoidon infuusioon liittyvien reaktioiden vuoksi.
Vakavat infektiot
Potilailla, joilla on MF tai Sézaryn oireyhtymä, on kohonnut riski saada vakava infektio ihosairauden aiheuttaman ihon rikkoutumisen vuoksi sekä ihon ulkopuolisen taudin immunosuppressiivisten vaikutusten vuoksi, ja mogamulitsumabihoito voi suurentaa tätä riskiä. Vakavia infektioita, mukaan lukien sepsis, keuhkokuume ja ihoinfektiot, esiintyi 14,3 %:lla tutkittavista, jotka saivat mogamulitsumabia. Tapahtuman alkamiseen kulunut aika ensimmäisen annoksen jälkeen vaihteli huomattavasti. Suurin osa potilaista toipui infektiosta. Kliinisessä tutkimuksessa (0761‑010) raportoitiin 2:sta kuolemaan johtaneesta hengitysvajauksesta potilailla, joilla oli vaikea keuhkokuume, joka ilmeni yli 9 kuukautta mogamulitsumabihoidon aloittamisen jälkeen.
Immunogeenisuus
Kliinisten POTELIGEO-tutkimusten aikana annettujen POTELIGEO-infuusioiden jälkeen noin 14 % potilaista (44 potilasta 313 arvioitavissa olleesta potilaasta), joilla oli aikuisen T-soluleukemia-lymfooma tai ihon T-solulymfooma, sai positiivisen tuloksen hoidonaikaisista mogamulitsumabin vastaisista vasta-aineista. Yhdelläkään potilaalla ei todettu vasteena positiivista neutraloivien vasta-aineiden testitulosta.
Ruoansulatuselimistö
Koliitille oli tyypillistä pääasiassa vetinen ripuli, joka voi olla joissakin tapauksissa runsasta.
Turvallisuus viimeisen annoksen jälkeen
Mogamulitsumabille kliinisessä tutkimuksessa 0761‑010 altistuneista 320 tutkittavasta 21 (6,6 %) sai vähintään yhden vakavan haittavaikutuksen (SADR), joka ilmeni 90 vuorokauden kuluessa viimeisen tutkimuslääkeannoksen antamisesta.
Useammalla kuin yhdellä potilaalla ilmoitetut vakavat haittavaikutukset luokiteltiin elinluokan mukaan seuraavasti: Infektiot (7 potilasta [2,2 %]), Yleisoireet ja antopaikassa todettavat haitat (5 potilasta [1,6 %]), Hengityselimet, rintakehä ja välikarsina (4 potilasta [1,3 %]), Luusto, lihakset ja sidekudos (3 potilasta [0,9 %]), Maksa ja sappi (2 potilasta [0,6 %]) ja Vammat, myrkytykset ja hoitokomplikaatiot (2 potilasta [0,6 %]). Kaikissa muissa elinluokissa raportoitiin vakavasta haittavaikutuksesta yhdellä potilaalla (0,3 %).
Mogamulitsumabin viimeistä annosta seuraavien 90 päivän aikana havaittu turvallisuusprofiili vastaa tutkimuksen hoitovaiheen aikana havaittua turvallisuusprofiilia.
Iäkkäät
Iäkkäiden potilaiden (vähintään 65-vuotiaat) turvallisuusprofiili oli yleisesti ottaen yhdenmukainen aikuispotilaiden turvallisuusprofiilin kanssa lukuun ottamatta ihoreaktioita ja infuusioon liittyviä reaktioita, joita esiintyi useammin iäkkäämmillä tutkittavilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Mogamulitsumabin yliannostuksesta ei ole tietoa saatavilla. Yliannostustapauksessa potilasta, ml. elintoimintoja, on tarkkailtava huolellisesti (vähintään 1 tunnin ajan) ja tukihoitoa on annettava tarvittaessa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Syöpälääkkeet ja immuunivasteen muuntajat, monoklonaaliset vasta‑aineet
ATC-koodi: L01FX09
Vaikutusmekanismi
Mogamulitsumabi on defukosyloitu, humanisoitu IgG1-kappa-immunoglobuliini, joka sitoutuu selektiivisesti CCR4-reseptoriin. CCR4-reseptori on CC-kemokiinien G-proteiinikytkentäinen reseptori, joka osallistuu lymfosyyttien kuljettamiseen eri elimiin, mukaan lukien ihoon. Se johtaa kohdesolujen depleetioon. CCR4 ekspressoituu joidenkin syöpäsolujen pinnalla. Näitä ovat mm. T‑solulymfoomat, kuten MF ja Sézaryn oireyhtymä, joille CCR4:n ekspressio on ominaista.
Kliininen teho ja turvallisuus
Mogamulitsumabin teho mycosis fungoidesia (MF) tai Sézaryn oireyhtymää sairastavien potilaiden hoidossa vahvistettiin faasin 3 avoimessa kliinisessä monikeskustutkimuksessa (0761‑010), jossa 372 aikuispotilasta satunnaistettiin suhteessa 1:1 saamaan hoitoa joko mogamulitsumabilla tai vorinostaatilla. Kumpaankin haaraan otettiin mukaan 186 potilasta. Mogamulitsumabi-infuusio annettiin annostuksella 1 mg/kg kerran viikossa ensimmäisen 28 vuorokauden syklin ajan (päivinä 1, 8, 15 ja 22) ja seuraavien 28 vuorokauden syklien päivinä 1 ja 15. Vorinostaattia annettiin aloitusannoksella 400 mg suun kautta kerran vuorokaudessa alkaen 28 vuorokauden syklien päivästä 1. Niiden vorinostaattia saavien potilaiden, joiden sairaus eteni tai joilla toksisuus ei ollut enää hyväksyttävää, sallittiin siirtyä saamaan mogamulitsumabihoitoa (crossover). Siirtyvät potilaat saivat enintään 46 kuukauden ajan mogamulitsumabihoitoa joulukuun 2016 tietojenkeruun määräaikaan mennessä. Mogamulitsumabihoito jatkui, kunnes sairaus eteni tai toksisuus ei ollut enää hyväksyttävää. Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen autoimmuunisairaus, keskushermoston metastaasi tai sairaus, joka edellyttää systeemisten kortikosteroidien tai muiden immunosuppressiivisten lääkevalmisteiden käyttöä, tai hoitoa edellyttävä aktiivinen infektio, mukaan lukien HIV tai hepatiitti B tai C. Pois suljettiin myös potilaat, joiden ECOG-toimintakykyluokitus oli ≥ 2. Tutkimuksen lähtötilanteessa 38 %:lla oli asteen IB–II sairaus, 10 %:lla asteen III sairaus ja 52 %:lla asteen IV sairaus. Mukaanottoon ei vaikuttanut CCR4-ekspression aste potilaan ihokoepalassa lähtötilanteessa.
Ensisijainen tehon päätetapahtuma oli etenemisvapaa elossaoloaika (PFS) perustuen tutkijan arvioon käyttämällä globaalin yhdistetyn vasteen kriteerejä, joissa huomioitiin kaikki tilamallin mukaiset vaikutuspaikat (iho, veri, imusolmukkeet ja sisäelimet), joihin sairaus oli mahdollisesti voinut levitä. Vastetta arvioitiin ihosta ja verestä 4 viikon välein. Vaste imusolmukkeissa ja sisäelimissä arvioitiin 4 viikon kuluttua ja sen jälkeen 8 viikon välein ensimmäisen vuoden ajan, ja sen jälkeen 16 viikon välein.
Histologisesti vahvistettu mycosis fungoides -diagnoosi oli mogamulitsumabiryhmässä 56,5 %:lla potilaista ja vorinostaattiryhmässä 53,2 %:lla, ja histologisesti vahvistettu Sézaryn oireyhtymän diagnoosi oli mogamulitsumabiryhmässä 43,5 %:lla ja vorinostaattiryhmässä 46,8 %:lla potilaista, ja kaikki potilaat olivat saaneet vähintään yhden aiemman systeemisen hoidon. Yleisimmät Euroopassa sijaitsevilla tutkittavilla käytetyt aiemmat systeemiset hoidot olivat beksaroteeni (70 %), interferoni (59 %), metotreksaatti (49 %), kehonulkoinen fotofereesi (ECP) (31 %) ja gemsitabiini/gemsitabiinia sisältävät hoito-ohjelmat (28 %).
Mogamulitsumabin altistuksen keston mediaani oli 5,6 kuukautta (vaihteluväli: < 1–45,3 kuukautta). 56 % potilaista sai mogamulitsumabia vähintään 6 syklin ajan, ja 25 % potilaista sai mogamulitsumabia vähintään 12 syklin ajan.
Potilaiden mediaani-ikä oli 64 vuotta seulonnan hetkellä (vaihteluväli 25–101 vuotta). Potilaista 49,5 % oli vähintään 65-vuotiaita ja 58,1 % miehiä.
CCR4-ekspressiota arvioitiin retrospektiivisesti hoitoa edeltävistä ihokoepaloista (kiinnitetty formaliinilla ja valettu parafiiniin) immunohistokemiallisella analyysillä. Mogamulitsumabihaarassa lähtötilanteen CCR4-ekspression asteet olivat saatavana 75 %:lla potilaista (N = 140). CCR4-ekspressiota havaittiin 100 %:lla potilaista ≥ 1 %:ssa lymfosyyteistä, ja 96 %:lla potilaista (134/140) CCR4-ekspressiota havaittiin ≥ 10 %:ssa ihon lymfosyyteistä.
Potilaista, jotka oli satunnaistettu saamaan vorinostaattia, 136 (73,1 %) siirtyi saamaan mogamulitsumabia tutkimuksen aikana. Syyt siirtymiselle mogamulitsumabiryhmään olivat sairauden eteneminen (109 potilasta) ja kyvyttömyys sietää hoitoa (27 potilasta). Siirtyneille potilaille oli annettu 1–94 mogamulitsumabi-infuusiota (enintään 46 kuukautta hoitoa) joulukuun 2016 tietojen keruun katkaisuajankohtaan mennessä.
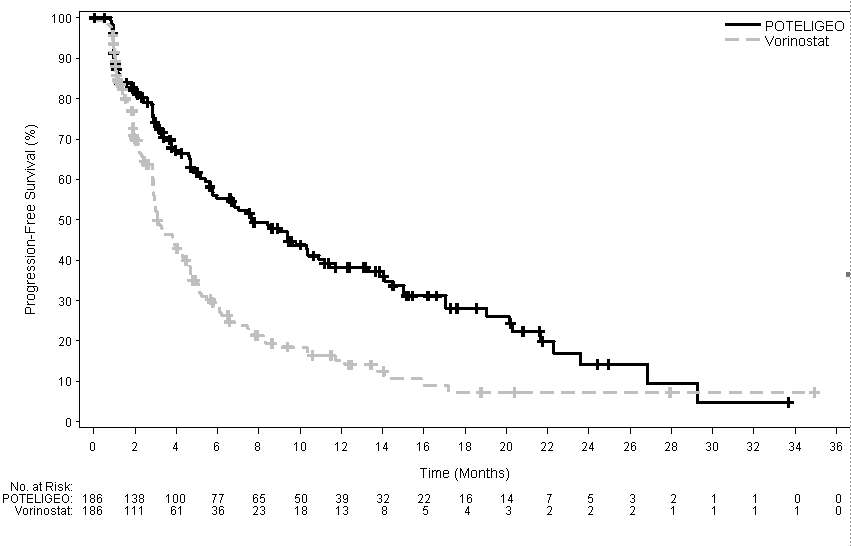
6, 12, 18 ja 24 kuukauden kuluttua satunnaistetun hoidon alkamisen jälkeen niiden potilaiden osuus, jotka olivat elossa eikä sairaus ollut edennyt, oli korkeampi mogamulitsumabiryhmässä (55,3 %, 38,3 %, 28,0 % ja 14,1 %) verrattuna vorinostaattiryhmään (28,8 %, 15,3 %, 7,2 % ja 7,2 %). Mogamulitsumabiryhmässä etenemisvapaan elossaoloajan (PFS) mediaani oli 7,70 kuukautta (95 %:n lv: 5,67; 10,33) ja vorinostaattiryhmässä PFS oli 3,10 kuukautta (95 %:n lv: 2.87, 4.07), jolloin riskisuhde on 0,53 (95 %:n lv: 0,41; 0,69), p < 0,0001 (2-suuntainen ositettu log rank -testi).
Etenemisvapaan elossaolon Kaplan–Meierin käyrä esitetään kuvassa 1.
Kuva 1: Tutkijan arvioimaa etenemisvapaata elossaoloaikaa (PFS) kuvaava Kaplan-Meierin käyrä hoitoaikeen mukaisessa (ITT) populaatiossa
Tärkeät toissijaiset päätetapahtumat olivat kokonaisvasteosuus (ORR), kokonaisvasteosuus hoitoryhmän vaihtamisen jälkeen (crossover), vasteen kesto (DOR) ja muutokset lähtötilanteesta Skindex-29-asteikon Symptoms and Functional Scales -osiossa ja Functional Assessment of Cancer Therapy-General (FACT‑G) -asteikon Physical Well-being- ja Functional Well-being -osioissa.
Kokonaisvaste raportoitiin yhdistettynä pistemääränä jokaisen tilan mittareiden perusteella, ja vaste oli täytynyt olla osoitettavissa kahdessa peräkkäisessä sairauden kokonaisarvioinnissa (vähintään 8 viikon välein ensimmäisen vuoden aikana ja sen jälkeen 16 viikon välein), jotta se voitiin vahvistaa. Potilaat otettiin mukaan tietyn tilan analyysiin, jos sairaus ilmeni kyseisessä tilassa lähtötilanteessa tai missä tahansa lähtötilanteen jälkeisessä, kyseisessä tilassa ilmenevän vasteen arvioinnissa.
Taulukossa 2 esitetään yhteenveto kokonaisvasteosuudesta (ORR) ja vasteen kestosta (DOR) ja vasteesta tilan mukaan. Tutkimus osoitti tilastollisesti merkitseviä parannuksia kokonaisvasteosuudessa ja tilakohtaisissa vasteissa veressä, ihossa ja imusolmukkeissa verrattuna vorinostaattiin. Vastetta sisäelimissä ei voitu arvioida, koska tehosta tutkittavilla, joilla sairaus oli levinnyt sisäelimiin, on vain vähän tietoa; mogamulitsumabin hyöty-haittatasapainoa tutkittavilla, joilla sairaus on levinnyt sisäelimiin, ei voida tietojen puuttumisen vuoksi toistaiseksi määrittää.
Taulukko 2: Vaste satunnaistetun hoitojakson aikana kliinisessä tutkimuksessa 0761-010 (ITT)
Mogamulitsumabi N = 186 | Vorinostaatti N = 186 | |
Kokonaisvasteosuus (vahvistettu CR + PR, %) | 28,0 | 4,8 |
| 95 %:n lv | (21,6; 35,0) | (2,2; 9,0) |
| P-arvoa | < 0,0001 | |
| Vasteen kesto (kk) | ||
| Mediaani (95 %:n lv) | 14,1 (9,4; 19,2) | 9,13 (4,7;-) |
| Vaste tilan mukaan | ||
| Veri | n = 124 | n = 125 |
| Vasteosuus (vahvistettu CR + PR, %) | 66,9 | 18,4 |
| 95 %:n lv | (57,9; 75,1) | (12,0; 26,3) |
| P-arvoa | < 0,0001 | |
| Iho | n = 186 | n = 186 |
| Kokonaisvasteosuus (vahvistettu CR + PR, %) | 41,9 | 15,6 |
| 95 %:n lv | (34,8; 49,4) | (10,7; 21,6) |
| P-arvoa | < 0,0001 | |
| Imusolmukkeet | n = 136 | n = 133 |
| Kokonaisvasteosuus (vahvistettu CR + PR, %) | 15,4 | 3,8 |
| 95 %:n lv | (9,8; 22,6) | (1,2; 8,6) |
| P-arvoa | 0,0008 | |
| Sisäelimet | n = 6 | n = 4 |
| Kokonaisvasteosuus (vahvistettu CR + PR, %) | 0 | 0 |
| 95 %:n lv | (0,0; 45,9) | (0,0; 60,2) |
Huomautus: Kokonaisvasteosuus perustuu yhdistetyn kokonaisvasteen (Global Composite Response) pisteytykseen.
a: P-arvo saatiin sairauden tyypin, asteen ja alueen mukaan korjatun Cochran-Mantel–Haenszelin testin perusteella.
lv = luottamusväli, CR = complete response, täydellinen hoitovaste; PR = partial response, osittainen hoitovaste
Mogamulitsumabihoito johti 8 vahvistettuun täydelliseen hoitovasteeseen (täydellinen puhdistuminen kaikissa vaikutuspaikoissa, joihin sairaus oli levinnyt) verrattuna 0 potilaaseen vorinostaattia saaneista. 4 näistä 8 potilaasta oli satunnaistettu alussa saamaan mogamulitsumabia ja 4 siirtyi saamaan mogamulitsumabia tutkimuksen aikana. Mogamulitsumabiryhmään siirtyneistä 136:sta crossover-potilaasta 41 (30,1 %) sai joko osittaisen tai täydellisen hoitovasteen mogamulitsumabille.
Tehoa koskevat tiedot ovat rajalliset potilaista, joiden CCR4-ekspression aste ihossa on matala (< 10 %). Kliinisessä tutkimuksessa 0761‑010 oli 10 arviointikelpoista potilasta 290:stä potilaasta, joiden CCR4-ekspressio oli alle 10 %. Näistä potilaista 6 oli satunnaistettu saamaan mogamulitsumabia, ja 4 oli satunnaistettu saamaan ensin vorinostaattia ja siirtyi sen jälkeen saamaan mogamulitsumabia. Vahvistettuja vasteita ei havaittu näillä 10 tutkittavalla, joiden CCR4-ekspressio oli vähäistä (alle 10 %). Vaikutuspaikan mukaisia vasteita todettiin 3 tutkittavalla 10 arviointikelpoisesta tutkittavasta, joita hoidettiin mogamulitsumabilla satunnaistetussa tai crossover-vaiheessa.
Potilailla, joilla oli asteen IB/II sairaus ja jotka saivat mogamulitsumabihoitoa, vahvistettu kokonaisvasteosuus oli 17,6 % verrattuna 8,3 %:iin vorinostaattia saaneilla, ja vaikutuspaikan (veri, iho, imusolmukkeet) mukaiset vasteosuudet olivat suurempia kuin vorinostaattihoitoa saaneilla potilailla. (taulukko 3). Yleisesti ottaen vaiheen IB/II sairautta sairastavien mogamulitsumabihoitoa saaneiden tutkittavien etenemisvapaan elossaoloajan mediaanikesto oli 4,7 kuukautta verrattuna 3,9 kuukauteen vorinostaattihoitoa saaneilla (taulukko 4). Vasteen kestosta ei voida tehdä johtopäätöstä tutkittavilla, joilla on asteen IB/II sairaus, koska vasteen saaneiden tutkittavien määrä on rajallinen ja seuranta-aikaa ei ole vielä tarpeeksi.
Vaikutuspaikan vasteeseen kuluva aika asteen IB/II potilailla oli noin 3 kuukautta, mikä vastaa koko ITT-populaation vasteeseen kuluvaa aikaa (noin 3 kuukautta). Jos vaikutuspaikan mukaista vastetta tai kokonaisvastetta ei havaita 3 hoitokuukauden jälkeen, hoidon keskeyttämistä on harkittava.
Taulukko 3: Kokonaisvasteosuus ja vaikutuspaikan mukainen vasteosuus sairauksien varhaisasteissa
| Mogamulitsumabi | Vorinostaatti | Riskien erotus (mogal. vs. vorin.) | |
| Sairauden aste IB/II | N = 68 | N = 72 | |
| Kokonaisvasteosuus (ORR), n (%) | 12 (17,6) | 6 (8,3) | 9,3 |
| Vaikutuspaikka: | |||
| Veri (n) | 17 | 23 | |
| Vasteosuus (n, %) | 8 (47,1) | 4 (17,4) | 29,7 |
| 95 %:n lva | (23,0; 72,2) | (5,0; 38,8) | (-2,2; 57,1) |
| Iho (n) | 68 | 72 | |
| Vasteosuus (n, %) | 19 (27,9) | 14 (19,4) | 8,5 |
| 95 %:n lva | (17,7; 40,1) | (11,1; 38,8) | (-8,3; 24,9) |
| Imusolmukkeet (n) | 41 | 40 | |
| Vasteosuus (n, %) | 4 (9,8) | 1 (2,5) | 7,3 |
| 95 %:n lva | (2,7; 23,1) | (0,1; 13,2) | (-14,3; 28,6) |
mogal. = mogamulitsumabi, vorin. = vorinostaatti
Taulukko 4: Etenemisvapaa elossaoloaika (PFS) hoitoryhmän ja sairauden asteen mukaan (satunnaistettu hoitojakso)
| Mogamulitsu-mabi | Vorinos-taatti | P-arvo | ||
| PFS, kk | ||||
| ITT-populaatio | 7,70 (5,67; 10,33) | 3,10 (2,87; 4,07) | < 0,0001 | |
| IB/II | 4,7 (2,9–7,47) | 3,9 (2,87–4,73) | 0,6790 | |
| III/IV | 10,9 (7,03–15,03) | 3,0 (2,83–3,87) | < 0,0001 | |
ITT = intent to treat (lähtöryhmien mukainen)
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset POTELIGEO-valmisteen käytöstä ihon T-solulymfooman hoidossa (MF ja Sézaryn oireyhtymä ovat T-solulymfooman alatyyppejä) kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Mogamulitsumabin farmakokinetiikkaa arvioitiin T-soluleukemia-lymfoomaa (ATL) tai ihon T-solulymfoomaa sairastavilla aikuispotilailla annostuksella 0,01–1 mg/kg annettuna useina mogamulitsumabiannoksina joka viikko tai joka toinen viikko. Mukana oli suosituksen mukainen 1,0 mg/kg:n annostus ja hoito-ohjelma (ensimmäisen 28 vrk:n syklin päivinä 1, 8, 15 ja 22 ja sitä seuraavien 28 vrk:n syklien päivinä 1 ja 15). Populaatiofarmakokineettisessä analyysissä oli mukana 444 mogamulitsumabia saanutta potilasta kuudesta kliinisestä tutkimuksesta. Mogamulitsumabialtistus kasvoi suhteessa annokseen, kun annosväli oli 0,1–1,0 mg/kg.
Imeytyminen
Mogamulitsumabi annetaan laskimoon ja sen biologinen hyötyosuus on siksi välitön ja täydellinen.
Jakautuminen
Populaatiofarmakokineettisen analyysin perusteella keskustilan jakautumistilavuuden (Vc) geometrinen keskiarvo (variaation %-kerroin [CV-%]) oli 3,57 l (20,1 %).
Biotransformaatio
Mogamulitsumabin metabolista reittiä ei ole karakterisoitu. Mogamulitsumabi oletettavasti hajoaa pieniksi peptideiksi ja aminohapoiksi katabolisia reittejä samaan tapaan kuin endogeeninen immunoglobuliini.
Eliminaatio
Populaatiofarmakokineettisen analyysin perusteella puhdistuman (CL) geometrinen keskiarvo (variaation %-kerroin [CV-%]) on 12,0 ml/t (83,7 %) ja eliminaation puoliintumisajan (t1/2) geometrinen keskiarvo 17 vuorokautta (65,5 %).
Lineaarisuus ja kumulaatio
Mogamulitsumabin farmakokinetiikka on lineaarista annoksesta alkaen annosvälillä 0,01 mg/kg–1 mg/kg. Populaatiofarmakokineettisen analyysin perusteella mogamulitsumabin vakaan tilan pitoisuudet saavutettiin 12 viikon toistuvan annostelun jälkeen, kun valmiste annettiin suositellun hoito-ohjelman mukaisesti, ja systeeminen kertymä oli 1,7-kertainen. Voimamallin analyysissä ei ollut ilmeistä poikkeamaa suhteellisuudessa annokseen.
Heikentynyt munuaistoiminta
Heikentyneen munuaistoiminnan vaikutusta mogamulitsumabin puhdistumaan arvioitiin populaatiofarmakokineettisellä analyysillä potilailla, joilla on lievästi heikentynyt munuaistoiminta (kreatiniinipuhdistuma [CrCL] 60–89 ml/min; n = 157), keskivaikeasti heikentynyt munuaistoiminta (CrCL 59–30 ml/min; n = 80) tai vaikeasti heikentynyt munuaistoiminta (CrCL alle 30 ml/min; n = 2). Kliinisesti merkittäviä eroja mogamulitsumabin puhdistumassa ei löydetty verrattaessa potilaita, joilla oli lievästi tai vaikeasti heikentynyt munuaistoiminta, potilaisiin, joiden munuaistoiminta oli normaali.
Heikentynyt maksan toiminta
Heikentyneen maksan toiminnan vaikutusta mogamulitsumabin puhdistumaan arvioitiin populaatiofarmakokineettisellä analyysillä potilailla, joilla oli lievästi heikentynyt maksan toiminta (kokonaisbilirubiini [TB] alle tai yhtä suuri kuin normaalin yläraja [ULN] ja ASAT suurempi kuin ULN tai TB alle 1–1,5 kertaa ULN ja mikä tahansa ASAT; n = 80) tai keskivaikeasti heikentynyt maksan toiminta (TB suurempi kuin 1,5–3 kertaa ULN ja mikä tahansa ASAT; n = 3). Kliinisesti merkittäviä eroja mogamulitsumabin puhdistumassa ei löydetty verrattaessa potilaita, joiden maksan toiminta oli heikentynyt lievästi tai keskivaikeasti, potilaisiin, joiden maksan toiminta oli normaali. Mogamulitsumabia ei ole tutkittu potilailla, joiden maksan toiminta on vaikeasti heikentynyt (TB suurempi kuin 3 kertaa ULN ja mikä tahansa ASAT).
Muut erityisryhmät
Mogamulitsumabin farmakokinetiikan eri kovariaattien vaikutuksia arvioitiin populaatiofarmakokineettisillä analyyseillä. Seuraavilla tekijöillä ei ollut kliinisesti merkittävää vaikutusta mogamulitsumabin puhdistumaan: ikä (vaihteluväli: 22–101 vuotta), sukupuoli, etninen alkuperä (tiedot muista kuin japanilaisperäisistä populaatioista ovat rajalliset), munuaisten heikentynyt toiminta, lievästi tai keskivaikeasti heikentynyt maksan toiminta, sairauden alatyyppi (mycosis fungoides [MF] tai Sézaryn oireyhtymä), CCR4-ekspression aste tai ECOG-toimintakykyluokitus; on kuitenkin huomattava, että kliinisistä tutkimuksista suljettiin pois potilaat, joiden ECOG-toimintakykyluokitus oli ≥ 2.
Farmakokineettiset/farmakodynaamiset suhteet
Teho
Altistus-vasteanalyysi viittasi siihen, että teho ei ollut korrelaatiossa mogamulitsumabialtistuksen kanssa avaintutkimuksessa. Teho mitattuna etenemisvapaan elossaolon parantumisena tutkijan arvion perusteella ei ollut yhteydessä suurenevaan mogamulitsumabialtistukseen.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Mogamulitsumabilla ei ole tehty karsinogeenisuutta tai genotoksisuutta koskevia tutkimuksia. Mogamulitsumabin vaikutusta hedelmällisyyteen ei ole arvioitu erikseen tutkimuksissa.
Mogamulitsumabiin liittyviä toksisia vaikutuksia uroksen ja naaraan sukuelimiin ei havaittu toistuvan altistuksen toksisuutta koskevissa tutkimuksissa sukukypsillä apinoilla enintään 26 viikon aikana.
Koe-eläimillä tehdyissä lisääntymiskykyä ja sikiökehitystä koskevissa toksisuustutkimuksissa mogamulitsumabin anto tiineinä oleville makakeille organogeneesin alusta lähtien synnytykseen asti ei viitannut mahdolliseen vaikutukseen alkioiden tai sikiöiden kuolleisuuteen, teratogeenisuuteen tai sikiön kasvun hidastumiseen. Yleensä ottaen immunoglobuliinimolekyylien tiedetään läpäisevän veri-istukkaesteen, ja sikiön plasmassa havaittiin mogamulitsumabipitoisuuksia. Mogamulitsumabin farmakologinen aktiivisuus oli ilmeistä sikiöissä CCR4:ää ekspressoivien lymfosyyttien vähentymisen perusteella.
Farmaseuttiset tiedot
Apuaineet
Sitruunahappomonohydraatti
Glysiini
Polysorbaatti 80
Natriumhydroksidi (pH:n säätämiseen)
Kloorivetyhappo (pH:n säätämiseen)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa. Mogamulitsumabia ei pidä antaa infuusiona samanaikaisesti saman laskimoyhteyden kautta muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
3 vuotta.
Avaamisen jälkeen
POTELIGEO ei sisällä säilytysainetta. Avaamisen jälkeen lääkevalmiste on laimennettava ja annettava infuusiona välittömästi (ks. kohta Käyttö- ja käsittelyohjeet).
Infuusion käyttökuntoon saattamisen jälkeen
Valmisteen on osoitettu säilyvän kemiallisesti ja fysikaalisesti stabiilina 24 tunnin ajan huoneenlämmössä (25 ºC) huonevalaistuksessa.
Aikarajat sisältävät infuusioliuoksen säilyttämisen infuusiopussissa infuusion keston ajan. Mikrobiologisista syistä valmiste on käytettävä välittömästi.
Jos valmistetta ei käytetä välittömästi, säilytysaika ja säilytysolosuhteet ennen käyttöä ovat käyttäjän vastuulla eivätkä saa ylittää yhteensä 24 tuntia lämpötilassa 2 ºC – 8 ºC sillä edellytyksellä, että laimennus on tapahtunut kontrolloiduissa ja validoiduissa aseptisissa olosuhteissa.
Säilytys
Säilytä jääkaapissa (2 ºC – 8 ºC).
Ei saa jäätyä.
Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
Laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
POTELIGEO infuusiokonsentraatti, liuosta varten
4 mg/ml (L:ei) 1 kpl (5 ml) (1960,11 €)
PF-selosteen tieto
5 ml liuosta 10 ml:n lasisessa injektiopullossa (tyypin I lasia), jossa on kumitulppa, alumiinikorkki ja polypropeenista valmistettu flip-off-korkki.
1 injektiopullon pakkaus.
Valmisteen kuvaus:
Kirkas tai hiukan opaalinhohtoinen, väritön liuos.
Käyttö- ja käsittelyohjeet
Käyttökuntoon saattaminen
- Tarkasta lääkevalmiste silmämääräisesti hiukkasten ja värin muutosten varalta ennen antoa. POTELIGEO on kirkas tai hiukan opaalinhohtoinen, väritön liuos. Hävitä injektiopullo, jos havaitset sameutta, värin muutoksia tai hiukkasaineksia.
- Laske infuusioliuoksen käyttökuntoon saattamiseen tarvittava POTELIGEO-valmisteen tilavuus 1 mg/kg:n annokselle potilaan painon mukaan (ks. kohta Annostus ja antotapa). Vedä tarvittava määrä POTELIGEO-valmistetta ruiskuun aseptisesti ja siirrä infuusiopussiin, joka sisältää 0,9-prosenttista (9 mg/ml) natriumkloridi-injektionestettä. Sekoita laimennettu liuos kääntelemällä sitä varovasti ylösalaisin. Älä ravista. Lopullisen laimennetun liuoksen pitoisuuden pitäisi olla 0,1 mg/ml – 3,0 mg/ml.
- Yksi injektiopullo on vain yhtä käyttökertaa varten. Hävitä injektiopulloon mahdollisesti ylijäänyt lääkevalmiste paikallisten vaatimusten mukaisesti.
Antaminen
- Laimennettu liuos on yhteensopiva polyvinyylikloridista (PVC) tai polyolefiinista (PO) valmistettujen infuusiopussien kanssa.
- Älä sekoita POTELIGEO-valmistetta tai anna sitä infuusiona yhdessä muiden lääkevalmisteiden kanssa.
- POTELIGEO on tarkoitettu annettavaksi vain laskimoon, eikä sitä saa antaa ihon alle, lihakseen tai bolusannoksena tai nopeasti laskimoon.
- Anna infuusioliuos vähintään 60 minuutin kuluessa sellaisen laskimoyhteyden kautta, jossa on steriili, niukasti proteiinia sitova 0,22 µm:n (tai vastaava) in-line-suodatin.
Korvattavuus
POTELIGEO infuusiokonsentraatti, liuosta varten
4 mg/ml 1 kpl
- Ei korvausta.
ATC-koodi
L01FX09
Valmisteyhteenvedon muuttamispäivämäärä
13.05.2025
Yhteystiedot
Torshamnsgatan 39
164 40 Kista
Sweden
+358-10-2355560
www.kyowa-kirin.com
infofin@kyowakirin.com
Edustaja Suomessa: Kyowa Kirin AB. filial i Finland
