SUBUTEX depotinjektioneste, liuos 100 mg, 300 mg
Vaikuttavat aineet ja niiden määrät
100 mg depotinjektioneste, liuos
Yksi esitäytetty ruisku (0,5 ml) sisältää 100 mg buprenorfiinia.
300 mg depotinjektioneste, liuos
Yksi esitäytetty ruisku (1,5 ml) sisältää 300 mg buprenorfiinia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Depotinjektioneste, liuos.
Kliiniset tiedot
Käyttöaiheet
Opioidiriippuvuuden korvaushoito aikuisille lääketieteellisen, sosiaalisen ja psykologisen hoidon osana.
Käyttörajoitus: Lääkettä voi käyttää vain kuten Sosiaali- ja terveysministeriön asetuksessa “opioidiriippuvaisten henkilöiden vieroitus-, korvaus- ja ylläpitohoidosta eräillä lääkkeillä” on säädetty ja niissä terveydenhuollon yksiköissä, joissa lääkkeen annostelee potilaalle terveydenhuollon henkilökunta. Sitä ei saa määrätä toimitettavaksi apteekista potilaalle.
Subutex-depotinjektio on tarkoitettu aikuisille (vähintään 18‑vuotiaille), jotka ovat suostuneet opioidiriippuvuuden hoitoon.
Ehto
Valmistetta voi käyttää vain sosiaali- ja terveysministeriön asetuksen opioidiriippuvuuden vieroitus- ja korvaushoidosta eräillä lääkkeillä mukaisesti ja niissä terveydenhuollon yksiköissä, joissa lääke luovutetaan käyttöön valvotusti tai yksiköissä, joissa lääkkeen annostelee potilaalle terveydenhuollon henkilökunta. Valmistetta ei saa toimittaa apteekista potilaalle.
Annostus ja antotapa
- Hoidon määrää lääkäri, joka huolehtii opioidiriippuvaisen potilaan kokonaisvaltaisesta hoidosta.
- Vain terveydenhuollon ammattilaiset saavat antaa Subutex-depotinjektion. Potilaat eivät saa viedä valmistetta kotiin tai ottaa sitä itse.
Subutex-depotinjektio on liuos, jonka sisältämä poly(DL-laktidi-koglykolidi)polymeeri muodostaa kehossa buprenorfiinia sisältävän kiinteän depotvalmisteen. Buprenorfiinia vapautuu hitaasti muodostuneesta depotvalmisteesta diffuusion ja polymeerin biologisen hajoamisen kautta.
Annostus
Induktiohoito:
Ensin potilaalle on annettava induktiohoito ja hänen tilansa on vakautettava jollakin buprenorfiinia sisältävällä sublinguaalisella valmisteella vähintään 7 päivän ajan (ks. myös kohta Farmakodynamiikka).
Buprenorfiinia sisältävien valmisteiden annostuksen ja induktiohoidon täytyy perustua niiden valmistetiedoissa annettuihin ohjeisiin.
Hoidon aloittaminen ja ylläpito:
Suositeltu annos induktiohoidon jälkeen on 300 mg:n depotinjektio kahtena ensimmäisenä kuukautena 4 viikon välein, ja sen jälkeen ylläpitoannos on 100 mg kuukaudessa.
300 mg:n annosta voidaan harkita potilaille, jotka sietävät annosta 100 mg kuukaudessa mutta joilla ei ole riittävää kliinistä vastetta itse raportoidun kiellettyjen opioidien käytön tai positiivisten virtsan opioidiseulontojen perusteella. Enimmäisannos on 300 mg kuukaudessa.
Siirtyminen vakiintuneesta ja pitkäkestoisesta sublinguaalisesta buprenorfiinihoidosta depotinjektioon:
Jos potilas on saanut vakiintunutta ja pitkäkestoista hoitoa sublinguaalisella buprenorfiinilla ja sairauden oireet on saatu hallintaan, voidaan siirtyä suoraan Subutex-depotinjektiohoitoon (ks. taulukko 1).
Vakaassa tilassa 100 mg:n ylläpitoannoksella plasman buprenorfiinipitoisuudet saavuttavat sublinguaalisella hoidolla saavutettavat pitoisuudet. Huippupitoisuudet voivat kuitenkin olla pienempiä, ja keskimääräiset sekä pienimmät pitoisuudet suurempia (ks. kohta Farmakokinetiikka kuva 1). Nämä pitoisuudet on otettava huomioon, kun sublinguaalista, vakiintunutta ja pitkäkestoista buprenorfiinihoitoa saanut potilas siirretään Subutex-depotinjektiohoitoon.
Taulukko 1. Sublinguaalista, vakiintunutta ja pitkäkestoista buprenorfiinihoitoa saavien potilaiden siirtäminen, kun sairauden oireet on saatu hallintaan
Sublinguaalisen buprenorfiinin annos | Subutex-depotinjektio | ||
1. injektio | 2. injektio | Ylläpitoannos | |
8–18 mg/vrk | 300 mg | 100 mg* | 100 mg |
20–24 mg/vrk | 300 mg | 300 mg | 100 mg |
* Jos potilaalla esiintyy edelleen opioidien himoa tai vieroitusoireita ensimmäisen 300 mg:n annoksen jälkeen, voidaan toiseksi annokseksi harkita 300 mg:n annosta. | |||
Antotiheys:
Pitkän puoliintumisajan vuoksi Subutex-depotinjektio annetaan kerran kuukaudessa. Annosvälin on oltava vähintään 26 vuorokautta.
Buprenorfiinin lisäannokset hoidon aloitusvaiheessa:
Potilaat eivät yleensä tarvitse ylimääräisiä buprenorfiiniannoksia Subutex-depotinjektiohoidon aloitusvaiheessa. Enintään 8 mg/vrk suuruisia lisäannoksia sublinguaalista buprenorfiinia voidaan kuitenkin määrätä lyhytaikaiseen käyttöön tarvittaessa.
Annoksen jääminen väliin:
Jos potilaalta jää annos väliin, seuraava annos on annettava mahdollisimman pian. Väistämättömien, enintään 2 viikon satunnaisten annosviivästymien ei oleteta vaikuttavan kliinisesti merkittävästi hoidon vaikutuksiin.
Hoidon lopettaminen:
Opioidiriippuvuuden kroonisen luonteen vuoksi lääkehoidon jatkamisen tarve on arvioitava määräajoin uudelleen, potilaan kliininen tila huomioiden. Ylläpitohoidon enimmäiskestosta ei ole suosituksia.
Jos Subutex-depotinjektion käyttö lopetetaan, valmisteen lääkeainetta hitaasti vapauttavat ominaisuudet on otettava huomioon (ks. kohta Farmakokinetiikka). Potilasta on seurattava vieroitusoireiden varalta useiden kuukausien ajan. Kun vakaa tila on saavutettu, Subutex-depotinjektiohoidon lopettavan potilaan plasmassa ja virtsassa voi olla havaittavia buprenorfiinipitoisuuksia kahdentoista kuukauden ajan tai tätäkin pidempään.
Erityisryhmät
Iäkkäät potilaat
Buprenorfiinin turvallisuutta ja tehoa vähintään 65-vuotiaiden potilaiden hoidossa ei ole varmistettu.
Iäkkäillä potilailla voi olla maksan, munuaisten tai sydämen vajaatoimintaa, muita samanaikaisia sairauksia tai muita lääkehoitoja, joten Subutex-depotinjektion määrääminen vähintään 65‑vuotiaille potilaille edellyttää varovaisuutta, ja näitä potilaita on seurattava toksisuuteen tai yliannostukseen viittaavien merkkien ja oireiden varalta.
Potilaat, joilla on maksan vajaatoiminta
Buprenorfiinin pitoisuudet plasmassa suurentuvat keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla terveisiin henkilöihin verrattuna. Subutex-depotinjektiota on käytettävä varoen keskivaikeaa maksan vajaatoimintaa sairastaville potilaille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Potilaita on seurattava suurentuneiden buprenorfiinipitoisuuksien aiheuttaman toksisuuden tai yliannostuksen merkkien ja oireiden varalta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Subutex-depotinjektion käyttö on vasta-aiheista vaikeaa maksan vajaatoimintaa sairastavilla potilailla (ks. kohta Vasta-aiheet).
Potilaat, joilla on munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavien potilaiden buprenorfiiniannosta ei tarvitse muuttaa. Varovaisuutta on syytä noudattaa, kun lääkettä annetaan vaikeaa munuaisten vajaatoimintaa (kreatiniinipuhdistuma < 30 ml/min) sairastaville potilaille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Pediatriset potilaat
Tietoja ei ole saatavilla alle 18 vuoden ikäisistä. Siksi Subutex-depotinjektiota ei pidä käyttää lasten ja nuorten hoitoon.
Antotapa
Vain injektiona ihon alle vatsan alueelle.
Subutex-depotinjektiota ei saa antaa suoneen, lihakseen tai ihon sisään (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Subutex-depotinjektion saavat antaa vain terveydenhuollon ammattilaiset (lääkäri tai sairaanhoitaja).
Ärsytyksen välttämiseksi injektiokohtaa on vaihdeltava vatsan kaikkien neljännesten välillä, mikäli ihonalaiskudosta on riittävästi. Injektion saa antaa vain valmisteen mukana toimitettavalla ruiskulla ja turvaneulalla.
Neulan ja ruiskun lääkejäämät on hävitettävä asianmukaisesti paikallisten vaatimusten mukaisesti.
Yksityiskohtaiset, vaiheittaiset ohjeet Subutex-depotinjektion valmistelusta ja antamisesta, ks. kohta Käyttö- ja käsittelyohjeet ja pakkausselosteesta löytyvä TIETOA TERVEYDENHUOLLON AMMATTILAISILLE.
Depotvalmisteen poistaminen
Jos depotvalmiste on poistettava, se voidaan tehdä kirurgisesti paikallispuudutuksessa. Polymeerin odotetun hajoamisnopeuden vuoksi tämä voidaan tehdä helpoiten noin 14 päivän sisällä injektion antamisesta. Vain viimeksi injektoitu depotvalmiste voidaan poistaa.
Poistettu depotvalmiste sisältää huumausaineeksi luokiteltua buprenorfiinia, ja se on hävitettävä paikallisten vaatimusten mukaisesti. Jos depotvalmiste poistetaan, potilasta on seurattava vieroitusoireiden varalta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Vasta-aiheet
- Yliherkkyys buprenorfiinille tai kohdassa Apuaineet mainituille apuaineille
- Vaikea hengityksen vajaatoiminta
- Vaikea maksan vajaatoiminta
- Akuutti alkoholipäihtymys tai delirium tremens
Varoitukset ja käyttöön liittyvät varotoimet
Potilasta kehotetaan ohjeistamaan läheisiään kertomaan hätätilanteessa terveydenhuoltohenkilöstölle, että potilas on fyysisesti riippuvainen opioideista ja saa hoitoa pitkävaikutteisella Subutex-valmisteella. Tämä ohjeistus on voimassa, kunnes Subutex-depotinjektion käytön lopettamisesta on kulunut 6 kuukautta.
Virheellinen antotapa
Subutex-depotinjektiota ei saa antaa suoneen, lihakseen eikä ihon sisään. Suonensisäiseen injektioon liittyy merkittävä vakavien haittojen ja kuoleman riski, sillä Subutex-depotinjektio muodostaa kiinteän massan joutuessaan kosketuksiin kehon nesteiden kanssa.
Suonensisäinen anto voi aiheuttaa tukoksia, paikallisia kudosvaurioita ja tromboembolisia tapahtumia, kuten henkeä uhkaavan keuhkoembolian.
Vahingossa tapahtuva anto lihakseen tai ihon sisään saattaa lisätä vakavien injektiokohdan reaktioiden todennäköisyyttä. Markkinoille tulon jälkeen on raportoitu joitakin tapauksia, joissa injektiokohdan reaktioina on esiintynyt absesseja, haavaumia ja nekroosia. Osassa tapauksista depotvalmiste oli poistettava kirurgisesti ja injektiokohta oli puhdistettava sekä potilaalle annettava antibiootteja ja Subutex-depotinjektiohoito lopetettava. Vakavat injektiokohdan reaktiot on arvioitava ja hoidettava asianmukaisesti. Oikeaan injektiotekniikkaan on kiinnitettävä huomiota (ks. pakkausselosteen kohta TIETOA TERVEYDENHUOLLON AMMATTILAISILLE).
Väärinkäyttö
Kuten muitakin opioideja, myös buprenorfiinia voidaan käyttää väärin. Väärinkäyttöön liittyviä riskejä ovat esimerkiksi yliannostus, veriteitse leviävät virusinfektiot tai paikalliset infektiot, hengityslama ja maksavaurio. Tämän valmisteen suonensisäinen käyttö on hengenvaarallista myös verisuonitukosriskin vuoksi. Jos joku muu kuin hoidettava potilas käyttää buprenorfiinia, vaarana on lisäksi buprenorfiinista riippuvaisten henkilöiden määrän lisääntyminen. Näin voi käydä, jos lääkettä luovutetaan laittomaan käyttöön tai jos lääkettä ei suojata varkauksilta.
Jos potilaan buprenorfiinihoito on riittämätöntä, hän saattaa jatkaa hallitsemattomien vieroitusoireiden itselääkitsemistä opioideilla, alkoholilla tai muilla sedatiiveilla, kuten bentsodiatsepiineilla (ks.”Hengityslama” sekä kohta Yhteisvaikutukset).
Injektiokohdan kliininen seuranta on tarpeen koko hoidon ajan injektiokohdan vaurioiden tai depotvalmisteen poistoyritysten havaitsemiseksi.
Kivunhoito
Subutex-depotinjektiohoidossa oleva potilas saattaa tarvita akuuttia kivunlievitystä tai anestesiaa (puudutukset mukaan lukien). Subutex-depotinjektion saavia potilaita on hoidettava ensisijaisesti muilla kivunlievitysmenetelmillä kuin opioideilla. Opiaatteja käytettäessä potilaita voidaan hoitaa opioidikipulääkkeillä, jotka ovat suuren affiniteetin puhtaita opiaattiagonisteja. Hoito pitää toteuttaa terveydenhuollon ammattilaisen valvonnassa, ja tällöin on kiinnitettävä erityistä huomiota hengitystoimintaan. Toleranssin vuoksi kivunlievitykseen saatetaan tarvita tavanomaista suurempia opiaattiannoksia. Jos opioidihoitoa käytetään osana anestesiaa, on varauduttava opioidien aiheuttaman hengityslaman hoitoon, etenkin avoimen ilmatien varmistamiseen ja ylläpitoon sekä hengityksen avustamiseen ja ventilaatiohoitoon (ks. kohta Yhteisvaikutukset).
Avohoidossa kivunlievitystä ja opioidiriippuvuuden hoitoa tarvitsevien potilaiden hoito onnistuu todennäköisesti parhaiten, jos siitä huolehtii sekä kivunhoidon että opioidiriippuvuuden hoidon asiantuntijoista koostuva ryhmä.
Unenaikaiset hengityshäiriöt
Opioidit voivat aiheuttaa unenaikaisia hengityshäiriöitä, mukaan lukien sentraalista uniapneaa ja unenaikaista hypoksemiaa. Opioidien käyttö lisää sentraalisen uniapnean riskiä annosriippuvaisesti. Jos potilaalla on sentraalista uniapneaa, opioidien kokonaisannoksen pienentämistä on harkittava.
Hengityslama
Hengityslamasta johtuvia kuolemantapauksia on raportoitu etenkin kun buprenorfiinia on käytetty samanaikaisesti bentsodiatsepiinien kanssa tai kun buprenorfiinia ei ole käytetty lääkemääräyksen mukaisesti. Kuolemantapauksia on raportoitu myös buprenorfiinin ja muiden lamaavien aineiden, kuten alkoholin, gabapentinoidien (kuten pregabaliinin ja gabapentiinin) tai muiden opioidien, samanaikaisen käytön yhteydessä (ks. kohta Yhteisvaikutukset). Jos lapsi saa buprenorfiinia tai sitä ottaa henkilö, joka ei ole opioideista riippuvainen ja jolle ei ole kehittynyt sietokykyä opioidien vaikutuksille, buprenorfiini voi aiheuttaa vaikean ja jopa kuolemaan johtavan hengityslaman.
Buprenorfiinia on käytettävä varoen potilaille, joilla on hengitysvajaus (esim. keuhkoahtaumatauti, keuhkoastma, cor pulmonale, pienentynyt hengityskapasiteetti, hypoksia, hyperkapnia, jo olemassa oleva hengityslama tai kyfoskolioosi).
Keskushermostolama
Buprenorfiini voi aiheuttaa uneliaisuutta etenkin, jos sitä otetaan yhdessä alkoholin tai muiden keskushermostoa lamaavien aineiden (kuten bentsodiatsepiinien, gabapentinoidien, rauhoittavien aineiden, sedatiivien tai unilääkkeiden) kanssa (ks. kohta Yhteisvaikutukset).
Riippuvuus (vieroitusoireet)
Buprenorfiini on osittainen myy-opioidireseptoriagonisti, ja sen pitkäaikainen käyttö aiheuttaa opioidiriippuvuutta. Eläintutkimukset ja kliininen kokemus ovat osoittaneet, että buprenorfiini voi aiheuttaa riippuvuutta, mutta sen riippuvuutta aiheuttava vaikutus on lievempi kuin puhtailla agonisteilla (esim. morfiinilla).
Vieroitusoireita ei todettu Subutex-depotinjektion käytön lopettamista seuraavan kuukauden aikana. Pitkän puoliintumisajan vuoksi mahdolliset vieroitusoireet ilmaantuvat viiveellä.
Potilaita, jotka lopettavat Subutex-depotinjektion käytön, on seurattava useiden kuukausien ajan vieroitusoireiden varalta ja tarvittaessa hoidettava asianmukaisesti.
Opioidivieroitusoireyhtymän provosoituminen
Koska buprenorfiini on osittainen opioidiagonisti, se voi provosoida opioidivieroitusoireita henkilöillä, jotka ovat fyysisesti riippuvaisia puhtaista opioidiagonisteista, kuten heroiinista, morfiinista tai metadonista. Ennen Subutex-depotinjektion ihonalaista antoa on varmistettava, että potilas sietää sublinguaalista buprenorfiinia ja että sen annos on säädetty sopivaksi. Jotta vältetään vieroitusoireiden provosoituminen, alkuhoito sublinguaalisella buprenorfiinilla aloitetaan vasta, kun lieviä tai keskivaikeita vieroitusoireita on objektiivisesti havaittavissa.
QT-ajan pidentyminen
Varovaisuutta pitää noudattaa, kun buprenorfiinia käytetään samaan aikaan muiden lääkkeiden kanssa, jotka saattavat pidentää QT-johtumisaikaa, sekä potilaille, joilla on todettu pidentynyt QT-aika tai pidentyneelle QT-ajalle altistavia riskitekijöitä.
Hepatiitti ja maksatapahtumat
Opioidiriippuvaisilla potilailla on raportoitu akuutteja maksavaurioita kielen alle annettavia buprenorfiinivalmisteita käytettäessä sekä kliinisissä tutkimuksissa että kliinisen käytön yhteydessä. Poikkeavuudet vaihtelevat ohimenevästä, oireettomasta maksan transaminaasiarvojen noususta sytolyyttistä hepatiittia, maksan vajaatoimintaa, maksanekroosia, hepatorenaalista oireyhtymää ja hepaattista enkefalopatiaa koskeviin tapauksiin ja kuolemantapauksiin. Monissa tapauksissa jo olemassa olevalla maksaentsyymiarvojen poikkeavuudella, geneettisellä sairaudella, B‑ tai C-hepatiittivirusinfektiolla, alkoholin väärinkäytöllä, anoreksialla, muiden mahdollisesti maksatoksisten aineiden käytöllä tai huumaavien aineiden suonensisäisellä käytöllä voi olla edesauttava rooli. Nämä taustatekijät on otettava huomioon ennen Subutex-depotinjektion määräämistä sekä hoidon aikana. Maksa-arvot pitää tutkia hoitoa aloitettaessa, ja niiden noustessa hoidon aikana tarkkailla niitä säännöllisesti. Maksavaurioepäilyissä on selvitettävä vaurion etiologia. Löydösten perusteella Subutex-depotinjektion käyttö voidaan joutua keskeyttämään. Keskeytyksen yhteydessä tulee huomioida vieroitusoireiden ja huumeiden käytön uudelleenaloittamisen riski. Jos hoitoa jatketaan, maksan toimintaa on seurattava tarkasti.
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta Subutex-depotinjektion farmakokinetiikkaan ei ole tutkittu.
Maksan vajaatoiminnan vaikutusta kielen alle annettavan buprenorfiinin farmakokinetiikkaan on arvioitu yhdessä kliinisessä tutkimuksessa. Buprenorfiini metaboloituu suuressa määrin maksassa, joten plasman buprenorfiinipitoisuudet suurentuivat keskivaikeaa ja vaikeaa maksan vajaatoimintaa sairastavilla potilailla terveisiin tutkittaviin verrattuna (ks. kohta Farmakokinetiikka). Subutex-depotinjektiota on käytettävä varoen potilaille, joilla on ennestään keskivaikea maksan vajaatoiminta, sillä plasman buprenorfiinipitoisuuksia ei voida pienentää nopeasti.
Keskivaikeaa maksan vajaatoimintaa sairastavia potilaita ja potilaita, joille kehittyy keskivaikea maksan vajaatoiminta Subutex-depotinjektion käytön aikana, on seurattava useiden kuukausien ajan buprenorfiinipitoisuuksien suurenemisen aiheuttaman toksisuuden tai yliannostuksen merkkien ja oireiden varalta. Maksan toimintaa pitää seurata säännöllisesti hoidon aikana (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Subutex- depotinjektion käyttö on vasta-aiheista vaikeaa maksan vajaatoimintaa sairastaville potilaille (ks. kohta Vasta-aiheet).
Munuaisten vajaatoiminta
Munuaisten kautta tapahtuvan eliminaation osuus buprenorfiinin ja sen metaboliittien kokonaispuhdistumassa on suhteellisen pieni (noin 30 %). Siksi annosta ei tarvitse muuttaa munuaistoiminnan perusteella. Buprenorfiinin metaboliittien kertymistä tapahtuu munuaisten vajaatoimintaa sairastavilla potilailla. Varovaisuutta on syytä noudattaa, kun lääkettä annetaan vaikeaa munuaisten vajaatoimintaa (kreatiniinipuhdistuma < 30 ml/min) sairastaville potilaille (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Subutex-depotinjektiolla tehtyihin kliinisiin tutkimuksiin ei osallistunut potilaita, joilla on munuaisten vajaatoiminta.
Serotoniinioireyhtymä
Subutex-depotinjektion ja muiden serotonergisten lääkeaineiden, kuten MAO:n estäjien, selektiivisten serotoniinin takaisinoton estäjien (SSRI-lääkkeiden), serotoniinin ja noradrenaliinin takaisinoton estäjien (SNRI-lääkkeiden) tai trisyklisten masennuslääkkeiden, samanaikainen käyttö voi johtaa serotoniinioireyhtymään, joka voi olla hengenvaarallinen tila (ks. kohta Yhteisvaikutukset).
Jos muiden serotonergisten lääkeaineiden samanaikainen käyttö on kliinisesti tarpeen, potilasta on tarkkailtava huolellisesti etenkin hoitoa aloitettaessa ja annosta suurennettaessa.
Serotoniinioireyhtymän oireita ovat esimerkiksi mielentilan muutokset, autonomisen hermoston epävakaus, neuromuskulaariset poikkeavuudet ja/tai maha-suolikanavan oireet.
Jos potilaalla epäillään serotoniinioireyhtymää, on syytä harkita annoksen pienentämistä tai hoidon keskeyttämistä oireiden vaikeusasteesta riippuen.
Opioidien antoon liittyviä yleisiä varoituksia
Opioidit voivat aiheuttaa ortostaattista hypotensiota (ks. kohta Haittavaikutukset).
Opioidit voivat suurentaa kallonsisäistä painetta, mikä voi aiheuttaa kouristuskohtauksia. Siksi opioideja on käytettävä varoen potilaille, joilla on pään vamma, kallonsisäisiä leesioita tai muita aivo-selkäydinnesteen paineen kohoamista aiheuttavia tiloja, tai joilla on ollut aikaisempia kouristuskohtauksia.
Opioideja on käytettävä varoen potilaille, joilla on matala verenpaine, eturauhasen liikakasvua tai virtsaputken ahtauma.
Opioidien aiheuttama mioosi, tajunnan tason muutokset tai muutokset muun sairauden aiheuttaman kivun aistimisessa saattavat haitata potilaan tilan arviointia tai vaikeuttaa samanaikaisen sairauden diagnosointia ja kliinisen kulun seurantaa.
Opioideja on käytettävä varoen, jos potilaalla on myksedeema, kilpirauhasen vajaatoiminta tai lisämunuaiskuoren vajaatoiminta (esim. Addisonin tauti).
Opioidien on osoitettu suurentavan painetta sappitiehyissä, ja niitä on käytettävä varoen potilaille, joilla on sappiteiden toimintahäiriö.
Varovaisuutta on noudatettava annettaessa opioideja iäkkäille tai heikkokuntoisille potilaille.
Yhteisvaikutukset
Subutex-depotinjektiolla ei ole tehty yhteisvaikutustutkimuksia.
Subutex-depotinjektiota on käytettävä varoen seuraavien aineiden kanssa:
-
Bentsodiatsepiinit lisäävät hengityslaman, syvän sedaation, kooman ja kuoleman riskiä. Potilaita on siksi seurattava tarkasti, ja tätä yhdistelmää pitää välttää, jos väärinkäytön riski on olemassa. Potilaita on varoitettava siitä, että on äärimmäisen vaarallista käyttää bentsodiatsepiineja samanaikaisesti tämän valmisteen kanssa. Potilaita, jotka käyttävät lääkärin määräämiä bentsodiatsepiineja samanaikaisesti tämän valmisteen kanssa, on myös kehotettava käyttämään niitä ainoastaan lääkemääräyksen mukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
-
Gabapentinoidien (mm. pregabaliini ja gabapentiini) samanaikainen käyttö lisää hengityslamasta johtuvaa kuolemanvaaraa. Annosta on seurattava tarkasti, ja tätä yhdistelmää pitää välttää, jos väärinkäytön riski on olemassa. Potilaita on varoitettava siitä, että on äärimmäisen vaarallista käyttää gabapentinoideja samanaikaisesti tämän valmisteen kanssa. Potilaita, jotka käyttävät lääkärin määräämiä gabapentinoideja samanaikaisesti tämän valmisteen kanssa, on myös kehotettava käyttämään niitä ainoastaan lääkemääräyksen mukaisesti (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
-
Muut keskushermostoa lamaavat lääkkeet, muut opioidijohdannaiset (esim. metadoni, kipulääkkeet ja yskänlääkkeet), tietyt masennuslääkkeet, sedatiiviset H1-reseptoriantagonistit, barbituraatit, muut anksiolyytit kuin bentsodiatsepiinit, psykoosilääkkeet sekä klonidiini ja sen sukuiset aineet. Nämä yhdistelmät voimistavat keskushermostolamaa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
-
Serotonergiset lääkevalmisteet, kuten MAO:n estäjät, selektiiviset serotoniinin takaisinoton estäjät (SSRI), serotoniinin ja noradrenaliinin takaisinoton estäjät (SNRI) tai trisykliset masennuslääkkeet; näiden lääkkeiden samanaikainen käyttö suurentaa serotoniinioireyhtymän (joka voi olla hengenvaarallinen tila) riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
-
Subutex-depotinjektiota ei saa ottaa samanaikaisesti alkoholijuomien eikä alkoholia sisältävien lääkkeiden kanssa. Alkoholi voimistaa buprenorfiinin sedatiivista vaikutusta ja suurentaa hengityslaman, syvän sedaation, kooman ja kuoleman riskiä.
-
Opioidikipulääkkeet: Korvaushoidossa olevien potilaiden kipua pitää hoitaa ensisijaisesti muilla keinoilla kuin opioideilla. Riittävän kivunlievityksen saavuttaminen puhtaalla opioidiagonistilla voi olla vaikeaa, jos potilas saa buprenorfiinia. Tällöin voidaan tarvita suurempia annoksia, joihin taas liittyy riski opiaattien yliannostukseen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
-
Naltreksoni, nalmefeeni ja muut opioidiantagonistit: Koska buprenorfiini on osittainen myy-opioidiagonisti, samanaikaisesti annetut opioidiantagonistit, kuten naltreksoni ja nalmefeeni, voivat heikentää Subutex-depotinjektion vaikutuksia tai estää ne täysin. Subutex-depotinjektiota ylläpitohoitona saavilla potilailla voi esiintyä äkillisesti ilmeneviä, pitkäkestoisia ja voimakkaita opioidivieroitusoireita.
-
Monoamiinioksidaasin estäjät (MAO:n estäjät) saattavat lisätä opioidien vaikutusta.
-
CYP3A4:n estäjät: Samanaikaisesti annettujen CYP3A4:n estäjien vaikutuksia Subutex-depotinjektiota saavien henkilöiden buprenorfiinialtistukseen ei ole tutkittu, ja vaikutukset saattavat riippua antoreitistä.
Sublinguaalisella buprenorfiinilla ja ketokonatsolilla (voimakas CYP3A4:n estäjä) tehdyssä yhteisvaikutustutkimuksessa buprenorfiinin Cmax-arvo suureni noin 50 %:lla ja AUC-arvo noin 70 %:lla. Norbuprenorfiinimetaboliitin vastaavat arvot suurenivat vähemmässä määrin. Ensikierron vaikutukset eivät koske Subutex-depotinjektiota; siksi CYP3A4:n estäjien (esim. proteaasinestäjien, kuten ritonaviirin, nelfinaviirin ja indinaviirin; atsolisieni-infektiolääkkeiden, kuten keto-, flu- ja itrakonatsolin; makrolidiantibioottien; tai greippimehun) odotetaan vaikuttavan vähemmän buprenorfiinin metaboliaan, jos niitä käytetään samanaikaisesti Subutex-depotinjektion kanssa verrattuna samanaikaiseen käyttöön kielen alle annettavan buprenorfiinin kanssa. Jatkuvaa hoitoa CYP3A4:n estäjällä saavien potilaiden seuranta voi olla tarpeen siirryttäessä sublinguaalisesta buprenorfiinista Subutex-depotinjektion käyttöön, jotta plasman riittävästä buprenorfiinipitoisuudesta voidaan varmistua. Jos potilasta hoidetaan jo Subutex-depotinjektiolla ja hänelle aloitetaan hoito CYP3A4:n estäjällä, häntä on seurattava yliannostuksen merkkien ja oireiden varalta. Jos potilas saa samanaikaisesti Subutex-depotinjektiota ja CYP3A4:n estäjää, ja lopettaa CYP3A4:n estäjän käytön, häntä on seurattava vieroitusoireiden varalta.
- CYP3A4:n indusorit: Samanaikaisesti annettujen CYP3A4:n indusorien vaikutuksia Subutex-depotinjektiota saavien henkilöiden buprenorfiinialtistukseen ei ole tutkittu. CYP3A4:n indusorit voivat lisätä buprenorfiinin metaboliaa, mikä johtaa buprenorfiinipitoisuuksien laskuun. Koska ensikierron vaikutukset eivät koske Subutex-depotinjektiota, CYP3A4:n indusorien (esim. fenobarbitaali, karbamatsepiini, fenytoiini tai rifampisiini) odotetaan vaikuttavan vähemmän buprenorfiinin metaboliaan, jos niitä käytetään samanaikaisesti Subutex-depotinjektion kanssa verrattuna samanaikaiseen käyttöön kielen alle annettavan buprenorfiinin kanssa. Jatkuvaa hoitoa CYP3A4:n indusorilla saavia potilaita on seurattava siirryttäessä kielen alle annettavasta buprenorfiinista Subutex-depotinjektion käyttöön, jotta plasman riittävästä buprenorfiinipitoisuudesta voidaan varmistua. Jos potilasta hoidetaan jo Subutex-depotinjektiolla ja hänelle aloitetaan hoito CYP3A4:n indusorilla, häntä on seurattava vieroitusoireiden varalta. Jos potilas saa samanaikaisesti Subutex-depotinjektiota ja CYP3A4:n indusoria ja lopettaa CYP3A4:n indusorin käytön, häntä on seurattava yliannostuksen oireiden varalta.
Raskaus ja imetys
Hedelmällisyys
Rotilla ja kaneilla tehdyissä lisääntymistoksisissa tutkimuksissa Subutex-depotinjektiolla ei todettu haitallisia vaikutuksia pariutumiseen tai hedelmällisyyteen.
Raskaus
Subutex-depotinjektiota ei ole tutkittu raskaana olevilla naisilla tehdyissä tutkimuksissa. Korkeat annokset aiheuttivat eläintutkimuksissa lisääntynyttä alkion kiinnittymisen jälkeistä katoa, resorptiota ja sikiön varhaiskuolemia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Buprenorfiinia saa käyttää raskauden aikana vain, jos mahdolliset hyödyt ovat sikiölle aiheutuvia riskejä suuremmat.
Buprenorfiini läpäisee istukan helposti ja voi aiheuttaa vastasyntyneelle hengityslaman. Pitkäkestoinen altistus buprenorfiinille kolmen viimeisen raskauskuukauden aikana saattaa aiheuttaa vastasyntyneelle vieroitusoireyhtymän (esim. hypertoniaa, vastasyntyneen vapinaa, kiihtymystä, myoklonusta tai kouristuksia). Oireyhtymä ilmenee yleensä viiveellä, ja oireita havaitaan vasta useita tunteja tai useita päiviä syntymän jälkeen.
Vastasyntynyttä pitää seurata useita päiviä buprenorfiinin pitkän puoliintumisajan takia, jotta mahdollinen hengityslama tai vieroitusoireyhtymä voidaan välttää.
Imetys
Buprenorfiini ja sen metaboliitit erittyvät ihmisen rintamaitoon.
Varovaisuutta suositellaan, jos Subutex-depotinjektio annetaan imettävälle äidille. Imetyksen myönteisiä vaikutuksia lapsen kehitykselle ja terveydelle on punnittava suhteessa äidin kliiniseen tarpeeseen saada Subutex-depotinjektio, ja kaikki mahdolliset imeväiseen kohdistuvat, lääkkeen tai äidin perussairauden aiheuttamat haittavaikutukset on otettava huomioon.
Buprenorfiinivalmisteita käyttäviä imettäviä äitejä on neuvottava seuraamaan lasta lisääntyneen uneliaisuuden ja hengitysvaikeuksien varalta.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Buprenorfiinilla on kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn, kun sitä annetaan opioidiriippuvaisille potilaille. Buprenorfiini saattaa aiheuttaa uneliaisuutta ja huimausta sekä heikentää kognitiivisia kykyjä, etenkin hoidon alkuvaiheessa ja annosta säädettäessä. Jos valmistetta käytetään yhdessä alkoholin tai keskushermostoa lamaavien aineiden kanssa, vaikutus on todennäköisesti voimakkaampi (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset). Potilaita on kehotettava välttämään autolla ajamista tai vaarallisten koneiden käyttämistä, kunnes he ovat suhteellisen varmoja siitä, ettei buprenorfiinihoito vaikuta haitallisesti heidän kykyynsä suoriutua tällaisista toimista.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimpiä sublinguaalisella Subutex-valmisteella tehdyissä kliinisissä lääketutkimuksissa raportoituja haittavaikutuksia olivat vieroitusoireisiin liittyvät haittavaikutukset (esim. unettomuus, päänsärky, pahoinvointi ja liikahikoilu) sekä kipu. Subutex-depotinjektiolla tehdyissä keskeisissä kliinisissä tutkimuksissa todettujen haittavaikutusten esiintyvyys oli samaa luokkaa sublinguaalisella Subutex-valmisteella ilmoitettujen haittavaikutusten kanssa lukuun ottamatta injektiokohdan reaktioita (esim. punoitus, kovettuma, kipu ja kutina).
Haittavaikutustaulukko
Taulukossa 2 on yhteenveto seuraavista:
- Sublinguaalisella Subutex-valmisteella tehdyissä kliinisissä tutkimuksissa raportoidut haittavaikutukset ja lisäksi Subutex-depotinjektiolla tehdyissä kliinisissä tutkimuksissa todetut haittavaikutukset. Lueteltujen mahdollisten haittavaikutusten esiintyvyydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
- Yleisimmät sublinguaalisen Subutex-valmisteen markkinoilletulon jälkeisessä seurannassa raportoidut haittavaikutukset. Mukaan on otettu tapahtumat, jotka mainittiin vähintään 1 %:ssa terveydenhuollon ammattilaisten tekemistä ilmoituksista. Sellaisten tapahtumien esiintyvyys, joita ei raportoitu kliinisissä lääketutkimuksissa, on ”tuntematon”.
Taulukko 2: Kliinisissä tutkimuksissa ja markkinoilletulon jälkeisessä seurannassa todetut buprenorfiinin haittavaikutukset elinjärjestelmän mukaan lueteltuina
Elinjärjestelmä | Hyvin yleinen (≥ 1/10) | Yleinen (≥ 1/100, < 1/10) | Melko harvinainen (≥ 1/1 000, < 1/100) | Harvinainen (≥ 1/10 000, < 1/1 000) | Tuntematon |
Immuunijärjestelmä | Anafylaktinen sokki | ||||
Infektiot | Infektio Nasofaryngiitti* Ylähengitystieinfektio* | ||||
Aineenvaihdunta ja ravitsemus | Ruokahalun heikentyminen | ||||
Psyykkiset häiriöt | Ahdistuneisuus Masennus Unettomuus | Aistiharhat | |||
Hermosto | Huimaus Päänsärky Letargia* Sedaatio* Uneliaisuus Pyörtyminen | ||||
Sydän | Sydämentykytys | ||||
Verisuonisto | Ortostaattinen hypotensio | ||||
Hengityselimet, rintakehä ja välikarsina | Hengityslama Bronkospasmi | ||||
Ruoansulatuselimistö | Vatsakipu* Ummetus Ripuli Pahoinvointi Oksentelu | ||||
Iho ja ihonalainen kudos | Liikahikoilu Kutina* | Angioedeema | |||
Yleisoireet ja antopaikassa todettavat haitat | Voimattomuus Vieroitusoireyhtymä Väsymys* Injektiokohdan punoitus* Injektiokohdan kovettuma* Injektiokohdan kipu* Injektiokohdan kutina* | Injektiokohdan mustelma* Injektiokohdan selluliitti* Injektiokohdan infektio* Injektiokohdan turvotus* | Vastasyntyneen vieroitusoireyhtymä (ks. kohta Raskaus ja imetys) | ||
Maksa ja sappi | Maksanekroosi Hepatiitti | ||||
Tutkimukset | Maksaentsyymi-arvojen nousu*† |
* Haittavaikutuksia, joita todettiin Subutex-depotinjektiolla tehdyissä kliinisissä tutkimuksissa.
† Maksaentsyymiarvojen nousulla tarkoitetaan ALAT-, ASAT- ja GGT-arvojen nousua sekä alkalisen fosfataasiarvon tai bilirubiiniarvon nousua. Lääkkeen aiheuttamia vaikea-asteisia maksavaurioita ei todettu.
Valikoitujen haittavaikutusten kuvaukset
Yleisimpiä Subutex-depotinjektiolla tehdyissä kliinisissä tutkimuksissa raportoituja injektiokohdan reaktioita olivat injektiokohdan kipu, kutina, punoitus ja kovettuma. Harvemmin raportoituja injektiokohdan reaktioita (< 1 %), joita esiintyi useammalla kuin yhdellä tutkittavalla, olivat injektiokohdan turvotus, mustelma, selluliitti ja infektio.
Depotinjektio oli poistettava kirurgisesti kahdelta tutkittavalta Subutex-depotinjektiolla tehtyjen kliinisten tutkimusten aikana. Kumpikaan tutkittava ei saanut poiston jälkeisiä komplikaatioita.
Seuraavassa on yhteenveto muiden buprenorfiinia sisältävien valmisteiden markkinoilletulon jälkeisen käytön yhteydessä raportoiduista haittatapahtumista, joita pidettiin vakavina tai muutoin huomionarvoisina:
- Suonensisäisen väärinkäytön yhteydessä on raportoitu paikallisia, toisinaan septisiä reaktioita (paise, selluliitti) sekä mahdollisesti vakavaa akuuttia hepatiittia ja muita infektioita, kuten keuhkokuumetta ja endokardiittia (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Voimakkaasti lääkeriippuvaisilla potilailla buprenorfiinin aloitusannos voi aiheuttaa samankaltaisia vierotusoireita kuin naloksoni.
- Transaminaasiarvojen nousua, hepatiittia, akuuttia hepatiittia, sytolyyttistä hepatiittia, keltaisuutta, hepatorenaalista oireyhtymää, hepaattista enkefalopatiaa ja maksanekroosia on esiintynyt (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Oireet
Keskushermostoperäinen hengityslama on tärkein hoitoa vaativa oire yliannostustapauksissa, sillä se voi johtaa hengityksen pysähtymiseen ja kuolemaan. Akuutin yliannostuksen ensioireita voivat myös olla uneliaisuus, mioosi, hypotensio, pahoinvointi, oksentelu ja puheen häiriöt.
Hoito
Yleinen elintoimintoja ylläpitävä hoito, mukaan lukien potilaan hengityksen ja sydämen tilan tarkka seuranta, on aloitettava. Jos potilaan hengitys tai sydämen toiminta ovat lamaantuneet, ensimmäiseksi on huolehdittava hengityksen palauttamisesta riittävälle tasolle varmistamalla hengitysteiden avoimuus sekä avustamalla hengitystä tai aloittamalla ventilaatiohoito. Happihoitoa, laskimonsisäistä nesteytystä, vasopressoreita ja muita tukitoimia on harkittava tarpeen mukaan. Jos potilas oksentaa, oksennuksen joutuminen hengitysteihin on estettävä.
Opioidiantagonistin (esim. naloksonin) antamista suositellaan, vaikka sen teho buprenorfiinin aiheuttamien hengitysoireiden kumoamisessa onkin heikompi verrattuna sen tehoon puhtaiden opioidiagonistien vaikutusten kumoamisessa.
Buprenorfiinin pitkä vaikutusaika ja Subutex-depotinjektion lääkeainetta hitaasti vapauttavat ominaisuudet on otettava huomioon, kun päätetään yliannostuksen aiheuttamien vaikutusten kumoamiseen tarvittavan hoidon ja lääketieteellisen valvonnan kestosta. Naloksoni saattaa poistua elimistöstä buprenorfiinia nopeammin, jolloin aiemmin hallinnassa olleet buprenorfiinin yliannostuksen oireet saattavat palata.
Lääkärin on otettava huomioon buprenorfiinin, muiden opioidien ja muiden keskushermostoa lamaavien aineiden mahdollinen rooli ja myötävaikutus potilaan kliiniseen tilaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä
Opioidiriippuvuuden hoitoon käytettävät lääkeaineet, ATC-koodi: N07BC01
Vaikutusmekanismi
Buprenorfiini on myy-opioidireseptorien osittainen agonisti ja kappa-opioidireseptorien antagonisti. Sen vaikutus opioidiriippuvuuden ylläpitohoidossa perustuu sen hitaasti reversiibeliin sitoutumiseen myy-opioidireseptoreihin, mikä pitkän ajan kuluessa saattaa minimoida opioidiriippuvaisen potilaan opioidien tarpeen.
Kliininen teho ja turvallisuus
Subutex-depotinjektion tehoa ja turvallisuutta opioidiriippuvuuden hoidossa arvioitiin 24 viikon pituisessa keskeisessä vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa, johon osallistui 504 hoitoon hakeutuneita potilaita, joilla oli keskivaikea tai vaikea opioidiriippuvuus. Ennen ensimmäistä injektiota tutkittaville annettiin induktiohoito vakautetulla annoksella buprenorfiini/naloksonia (kalvo kielen alle) 8/2 – 24/6 mg/vrk vähintään 7 vuorokautta. Tutkittavat satunnaistettiin johonkin seuraavista annostusohjelmista: 300 mg kerran kuukaudessa 6 kuukauden ajan (300/300 mg; n=201); 300 mg kerran kuukaudessa 2 kuukauden ajan, jonka jälkeen 100 mg kerran kuukaudessa 4 kuukauden ajan (300/100 mg; n=203); tai volyymiltaan vastaava ihonalainen lumelääkeinjektio kerran kuukaudessa 6 kuukauden ajan (n=100). Kaikki saivat psykososiaalista tukea vähintään kerran viikossa. Satunnaistamisen jälkeen lisähoitoa sublinguaalisella buprenorfiinilla ei sallittu.
Tehon ja turvallisuuden tulosmittareita arvioitiin viikoittaisilla käynneillä. Opioidien käyttämättömyyttä arvioitiin virtsan opioidiseulontojen ja kiellettyjen opioidien käyttöä koskevan tutkittavan omaraportoinnin perusteella. Virtsakokeiden tulosten puuttuminen ja/tai opioidien käytön omaraportoinnin väliin jääminen tulkittiin kiellettyjen opioidien käytöksi. Tutkimuksen suoritti loppuun 64 % (129/201) 300/300 mg -ryhmän tutkittavista, 62 % (125/203) 300/100 mg -ryhmän tutkittavista ja 34 % (34/100) lumeryhmän tutkittavista.
Tutkimuksessa saavutettiin ensisijainen päätetapahtuma eli opioideja käyttämättömien potilaiden prosenttiosuuden paremmuus lumelääkkeeseen verrattuna. Tämä määriteltiin kunkin potilaan negatiivisten sekä virtsanäytteiden että kiellettyjen opioidien käyttöä koskevan omaraportoinnin prosenttiosuudeksi viikkojen 5–24 aikana (taulukko 3). Sellaisten potilaiden osuus, joilla hoito onnistui (tutkittavat, joilla opioidittomia viikkoja oli ≥ 80 %), oli tilastollisesti merkitsevästi suurempi molemmissa Subutex-depotinjektiota saaneiden ryhmissä kuin lumeryhmässä; aktiivilääkettä saaneiden ryhmien välillä ei havaittu kliinisesti merkitseviä eroja. Vieroitusoireet ja opioidien himo lievittyivät tutkimusjakson aikana. Ensisijaisen tehon päätetapahtuman osalta tehtiin myös alaryhmäanalyyseja.
Taulukko 3. Ensisijaiset ja tärkeimmät toissijaiset päätetapahtumat keskeisessä vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa potilailla, joilla oli keskivaikea tai vaikea opioidiriippuvuus
Subutex-depotinjektio 300/100 mg (N = 194) | Subutex-depotinjektio 300/300 mg (N = 196) | Lumelääke (N = 99) | |
Opioidien käyttämättömyys (opioidittomat viikot; %) | |||
Mediaani | 32,5 % | 30,0 % | 0,0 % |
Mediaanien ero lumelääkeryhmään verrattuna (95 % luottamusväli) | 27,5 % (15,0; 40,0 %) | 27,5 % (15,0 %; 40,0 %) | - |
p-arvo | < 0,0001 | < 0,0001 | - |
Opioidien käyttämättömyys ≥ 80 % (opioidittomat viikot; vaste) | |||
Hoidon onnistuminen* | 28,4 % | 29,1 % | 2,0 % |
Hoidon onnistumisen ero lumelääkeryhmään verrattuna (95 % luottamusväli) | 26,3 % (19,4 %; 33,3 %) | 27,1 % (20,1 %; 34,0 %) | - |
p-arvo | < 0,0001 | < 0,0001 | - |
*Hoidon onnistumisen määritelmä oli, että ≥ 80 % tutkittavan virtsanäytteistä oli opioidien osalta negatiivisia ja ≥ 80 % tutkittavan omista raporteista kiellettyjen opioidien käytöstä olivat negatiivisia viikkojen 5–24 aikana. Viikoiksi 1–4 myönnettiin ”lykkäystä”, jotta potilaiden hoito saatiin vakautetuksi.
Subutex-depotinjektion pitkäaikaisturvallisuutta ja -siedettävyyttä arvioitiin avoimessa vaiheen 3 monikeskustutkimuksessa hoitoon hakeutuneilla potilailla.
Tutkimukseen otettiin 669 potilasta, joilla oli keskivaikea tai vaikea opioidiriippuvuus. Tutkittavista 412 ei ollut saanut aiempaa hoitoa Subutex-depotinjektiolla. 257 tutkittavaa jatkoi tähän tutkimukseen aiemmasta 24 viikon tehotutkimuksesta. Kaikki tutkittavat saivat ensin 300 mg:n Subutex-depotinjektion ja sen jälkeen joustavasti joko 100 mg tai 300 mg kuukausittain, kunnes injektioita oli annettu yhteensä 12 (uudet tutkittavat) tai 6 (aiemmasta tutkimuksesta siirtyneet). Kaikkiaan 406 tutkittavaa suoritti tutkimuksen loppuun. Vain muutaman tutkittavan (2,2 %) tutkimushoito lopetettiin haittatapahtuman takia. Teho säilyi 48 viikkoa jatkuneen injektiohoidon aikana. Tehon pysyvyyden prosenttiosuus 12 kuukauden jälkeen oli 50,5 %, ja 69,3 % osallistujista ei käyttänyt opioideja 12 kuukauden hoitojakson lopussa.
Farmakokinetiikka
Imeytyminen
Subutex-depotinjektion antamisen jälkeen todettua ensimmäistä buprenorfiinihuippua edeltävän ajan (Tmax) mediaani oli 24 tuntia. Ensimmäisen buprenorfiinihuipun jälkeen plasman buprenorfiinipitoisuudet pienenivät hitaasti tasannevaiheeseen. Vakaa tila saavutettiin 6 kuukaudessa. Plasman buprenorfiinipitoisuuksien keskimääräiset Cavg-, Cmax- ja Ctrough- arvot vakaassa tilassa on esitetty kuvassa 1 verrattuna sublinguaaliseen buprenorfiiniin.
Kuva 1. Vertailu plasman buprenorfiinialtistuksesta vakaassa tilassa käytettäessä sublinguaalista buprenorfiinia ja Subutex-depotinjektiota: pienimmät pitoisuudet (Ctrough), keskimääräiset pitoisuudet (Cavg) ja huippupitoisuudet (Cmax)
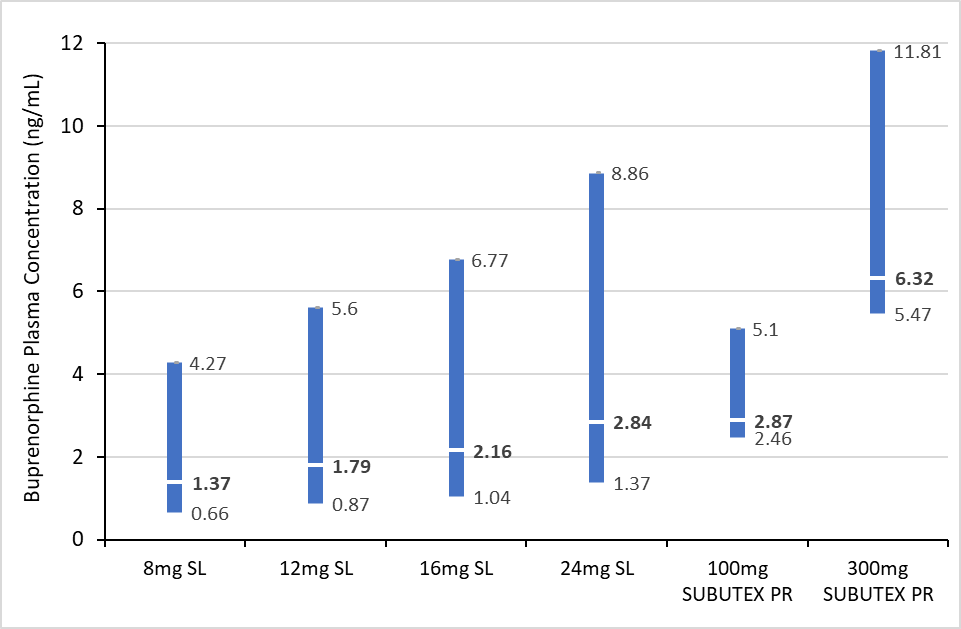
SL: kielen alle annosteltava valmiste; PR: depotvalmiste
Jokaisessa palkissa näkyvät buprenorfiinin pienimmän pitoisuuden (alin), plasman keskimääräisen pitoisuuden (valkoinen merkki) ja plasman huippupitoisuuden (ylin) geometriset keskiarvot.
Pitoisuudet perustuvat populaatiofarmakokineettisen mallin ennustuksiin.
Jakautuminen
Buprenorfiinista noin 96 % sitoutuu proteiineihin, pääasiassa alfa- ja beetaglobuliiniin.
Biotransformaatio
Buprenorfiini metaboloituu päämetaboliitikseen norbuprenorfiiniksi pääasiassa CYP3A4-välitteisesti ja pienemmässä määrin CYP2C8-välitteisesti. Lisäksi norbuprenorfiini voi glukuronidoitua. Norbuprenorfiinin on todettu sitoutuvan opioidireseptoreihin in vitro; sitä ei kuitenkaan ole tutkittu kliinisesti opioidien kaltaisen aktiviteetin osalta.
Buprenorfiini ei käy läpi ensikierron metaboliaa Subutex-depotinjektion ihonalaisen annon jälkeen.
Tämän vuoksi norbuprenorfiinin ja buprenorfiinin AUC-arvojen suhde (0,20–0,40) on paljon pienempi verrattuna kielen alle annettavaan buprenorfiiniin (0,70–2,11).
Eliminaatio
Subutex-depotinjektion ihonalaisen annon jälkeinen buprenorfiinin näennäinen terminaalinen puoliintumisaika plasmassa oli 43–60 vuorokautta buprenorfiinin hitaan ihonalaisesta depotvalmisteesta vapautumisen takia.
Massatasapainotutkimuksessa, jossa buprenorfiinia annettiin ihmisille laskimoinfuusiona, todettiin radiomerkityn lääkeaineen erittyvän virtsaan (30 %) ja ulosteeseen (69 %) enintään 11 päivän kuluessa annostelun jälkeen. Lähes koko annos erittyi buprenorfiinina, norbuprenorfiinina ja kahtena tunnistamattomana buprenorfiinimetaboliittina. Virtsassa suurin osa buprenorfiinista ja norbuprenorfiinista esiintyi konjugoituneessa muodossa (buprenorfiini: 1 % vapaassa ja 8,4 % konjugoituneessa muodossa; norbuprenorfiini: 2,7 % vapaassa ja 8,8 % konjugoituneessa muodossa). Ulosteessa lähes kaikki buprenorfiinista ja norbuprenorfiinista oli vapaassa muodossa (buprenorfiini: 33 % vapaassa ja 4,8 % konjugoituneessa muodossa; norbuprenorfiini: 21 % vapaassa ja 2,1 % konjugoituneessa muodossa).
Tutkimus, jossa arvioitiin buprenorfiinialtistusta 22–38 kuukautta viimeisen Subutex-depotinjektion jälkeen, osoitti, että buprenorfiinia saattaa olla havaittavia määriä plasmassa ja virtsassa tänä ajanjaksona. Havaitut buprenorfiinipitoisuudet olivat pienempiä kuin ne, joiden tiedetään hillitsevän sairausoireita. Pitoisuudet virtsassa vaihtelivat enemmän ja olivat tiettyä testausmenetelmää käytettäessä yleisesti ottaen suurempia kuin pitoisuudet plasmassa. Näin ollen on odotettavissa, että potilaan virtsasta saadaan positiivisia tuloksia pidempään kuin plasmasta.
Erityisryhmät
Populaatiofarmakokineettisissä analyyseissa iällä (keskiarvo [keskihajonta]: 38,8 [11,5], vaihteluväli 19–64), sukupuolella ja rodulla (tummaihoiset tai afroamerikkalaiset vs. muut) ei ollut kliinisesti merkittävää vaikutusta Subutex-depotinjektion farmakokinetiikkaan.
Maksan vajaatoiminta
Kielen alle annettavalla valmisteella tehdyn tutkimuksen perusteella Subutex-depotinjektio voidaan antaa potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta. Buprenorfiinipitoisuuksia ei voida pienentää nopeasti, joten varovaisuutta on noudatettava hoidettaessa Subutex-depotinjektiolla potilaita, joilla on ennestään keskivaikea maksan vajaatoiminta. Subutex-depotinjektiota ei saa antaa potilaille, joilla on ennestään vaikea maksan vajaatoiminta (ks. kohta Vasta-aiheet). Potilaita, joille kehittyy keskivaikea tai vaikea maksan vajaatoiminta Subutex-depotinjektion käytön aikana, on seurattava buprenorfiinipitoisuuksien suurenemisen aiheuttaman toksisuuden tai yliannostuksen merkkien ja oireiden varalta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Subutex-depotinjektiolla tehtyihin kliinisiin tutkimuksiin ei osallistunut tutkittavia, joilla oli vaikea munuaisten vajaatoiminta. Munuaisten kautta tapahtuvan eliminaation osuus buprenorfiinin ja sen metaboliittien kokonaispuhdistumassa on suhteellisen pieni (noin 30 %). Siksi annosta ei tarvitse muuttaa munuaistoiminnan perusteella. Buprenorfiinin metaboliittien kertymistä tapahtuu munuaisten vajaatoimintaa sairastavilla potilailla. Varovaisuutta on noudatettava hoidettaessa vaikeaa munuaisten vajaatoimintaa (kreatiniinipuhdistuma < 30 ml/min) sairastavia potilaita.
Pediatriset potilaat
Kliinisiä tietoja ei ole saatavilla.
Prekliiniset tiedot turvallisuudesta
Paikallista siedettävyyttä, kerta- ja toistetun annostelun aiheuttamaa toksisuutta ja genotoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viitanneet Subutex-depotinjektion osalta erityiseen vaaraan ihmisille, kun buprenorfiinia käytetään kliinisesti asianmukaisina annoksina.
Lisääntymis- ja kehitystoksisuustutkimuksissa ei todettu haittavaikutuksia kliinisesti relevanteilla annostasoilla. Rottatutkimuksissa korkeilla annostasoilla esiintyi lisääntynyttä alkion kiinnittymisen jälkeistä katoa, resorptiota ja kasvanutta sikiökuolleisuutta. Pääosin luustoon kohdistuvia epämuodostumia todettiin korkeilla Subutex-depotinjektio- ja buprenorfiiniannoksilla.
Farmaseuttiset tiedot
Apuaineet
ATRIGEL-polymeeriliuoksen sisältämät aineet ovat
poly(DL-laktidi-koglykolidi) (50:50), N-metyyli-2-pyrrolidoni.
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
100 mg: 21 kuukautta
300 mg: 2 vuotta
Säilytys
Säilytä 2 °C – 8 °C. Ei saa jäätyä.
Ota Subutex-depotinjektio jääkaapista ennen potilaalle antoa. Valmisteen on annettava olla huoneenlämmössä vähintään 15 minuutin ajan. Älä avaa foliopussia, ennen kuin potilas on saapunut paikalle saamaan injektionsa.
Kun valmiste on otettu jääkaapista, sitä voidaan säilyttää alkuperäispakkauksessa huoneenlämmössä (alle 25 °C) enintään 7 vuorokauden ajan ennen antoa. Pakkaukseen pitää merkitä päivämäärä, jolloin pakkaus on otettu huoneenlämpöön.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SUBUTEX depotinjektioneste, liuos
100 mg (L:ei) 1 kpl (turvaneula) (500,41 €)
300 mg (L:ei) 1 kpl (turvaneula) (500,41 €)
PF-selosteen tieto
Subutex 100 mg depotinjektio: toimitetaan steriilissä, syklisestä olefiinikopolymeeristä valmistetussa 1 ml:n ruiskussa, jossa on bromobutyylikumista valmistettu kärkikorkki ja tulppa ja jonka mukana on kertakäyttöpakkauksessa oleva turvaneula (19 G, 16 mm).
Subutex 300 mg depotinjektio: toimitetaan steriilissä, syklisestä olefiinikopolymeeristä valmistetussa 2,25 ml:n ruiskussa, jossa on bromobutyylikumista valmistettu kärkikorkki ja tulppa ja jonka mukana on kertakäyttöpakkauksessa oleva turvaneula (19 G, 16 mm).
Jokainen ruiskuyksikkö, jossa on polypropeenimäntä, toimitetaan alumiinifoliolaminaatista valmistetussa pussissa, joka sisältää happiabsorbenttia. Pussi, steriili turvaneula ja pakkausseloste on pakattu koteloon, jossa on pakkausmerkinnät.
Valmisteen kuvaus:
Kirkas, viskoosi, steriili liuos, joka on väritöntä, keltaista tai kullankeltaista.
Käyttö- ja käsittelyohjeet
Ennen antoa
- Lue ohjeet huolellisesti ennen kuin käsittelet valmistetta.
- Käytä yleisenä varotoimena aina suojakäsineitä.
- Ota Subutex-depotinjektio jääkaapista ennen potilaalle antoa.
- Valmisteen on annettava olla huoneenlämmössä vähintään 15 minuutin ajan. Älä avaa foliopussia, ennen kuin potilas on saapunut paikalle saamaan injektionsa.
- Hävitä Subutex-depotinjektio, jos se on ollut huoneenlämmössä yli 7 vuorokauden ajan.
1. VALMISTAUTUMINEN
Poista foliopussi ja turvaneula kotelosta. Avaa pussi ja ota ruisku esiin. Hävitä happiabsorbenttipakkaus. Sitä ei tarvita.
2. TARKISTA, ETTÄ NESTE ON KIRKASTA
Tarkista silmämääräisesti, että lääkkeessä ei ole epäpuhtauksia eikä hiukkasia. Subutex-depotinjektion väri saattaa vaihdella täysin värittömästä keltaiseen ja kullankeltaiseen. Värin vaihtelu tällä alueella ei vaikuta valmisteen tehoon.
3. KIINNITÄ TURVANEULA
Poista ruiskun korkki ja ota turvaneula sen steriilistä pakkauksesta.
Kierrä neulaa varovasti myötäpäivään, kunnes se on tiiviisti ja tiukasti kiinni.
Jätä muovisuojus neulan päälle.
4. VALMISTELE PISTOSKOHTA VATSAN ALUEELTA
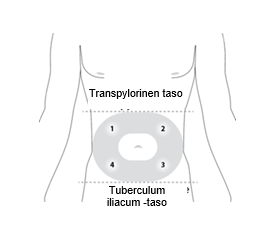
Valitse vatsan alueelta transpylorisen tason ja tuberculum iliacum -tason väliltä pistoskohta, jossa on riittävästi ihonalaiskudosta ja jossa ei ole ihomuutoksia (esim. kyhmyjä, leesioita, liiallista pigmenttiä). On suositeltavaa, että potilas on selinmakuulla.
Älä pistä lääkettä kohtaan, jossa iho on millään tavalla ärtynyt, punoittava, mustelmainen, tulehtunut tai arpeutunut.
Puhdista pistoskohta hyvin alkoholipyyhkeellä.
Ärsytyksen välttämiseksi vaihtele pistoskohtia annosten välillä kuvassa esitettävään tapaan. Kirjaa pistoskohdan sijainti, jotta seuraavalle pistokselle valitaan varmasti eri kohta.
5. POISTA LIIKA ILMA RUISKUSTA
Pitele ruiskua pystysuorassa useiden sekuntien ajan, jotta ilmakuplat nousevat pinnalle. Lääke on jäykkäliikkeistä nestettä, joten kuplat eivät nouse yhtä nopeasti kuin vesiliuoksessa.
Poista neulansuojus ja paina hitaasti mäntää, jotta liika ilma työntyy ulos ruiskusta. Jätä taittuva neulansuojus paikoilleen neulan viereen.
- Lääkkeeseen voi jäädä pieniä kuplia. Suuret ilmataskut voidaan kuitenkin minimoida vetämällä mäntää niin, että ilmakuplat puhkeavat, ja työntämällä ilma hyvin hitaasti ulos. Ilma on poistettava hyvin varovasti, jotta lääkettä ei mene hukkaan.
Jos neulan kärjessä näkyy lääkettä, vedä mäntää hiukan taaksepäin, jotta lääkettä ei valu hukkaan.
6. NIPISTÄ PISTOSKOHTA POIMULLE
Nipistä pistoskohtaa ympäröivä iho poimulle. Varmista, että ihoa on neulan kokoon nähden riittävä määrä. Nosta rasvakudosta koholle alla olevan lihaksen päältä, jotta et pistä vahingossa lihakseen.
7. PISTÄ LÄÄKE
Subutex-depotinjektio on tarkoitettu vain ihon alle injektoitavaksi. Älä koskaan anna valmistetta suoneen tai lihakseen, sillä muodostuva kiinteä depotvalmiste voi aiheuttaa vakavan haitan ja hengenvaaran. Älä anna valmistetta lihakseen tai ihon sisään.
Työnnä neula kokonaan vatsan ihonalaiskudokseen. Pistokulma riippuu ihonalaiskudoksen määrästä. Injektoi lääke hitaasti ja tasaisesti painamalla. Jatka painamista, kunnes koko lääkemäärä on annettu.
8. VEDÄ NEULA ULOS
Vedä neula ulos samassa kulmassa kuin työnsit sen kudokseen ja irrota otteesi ihopoimusta.
Älä hiero pistosaluetta pistoksen jälkeen. Pistoskohdasta saattaa vuotaa pieni määrä verta tai kudosnestettä; pyyhi kohta vanu- tai sideharsotupolla ennen kuin asetat sen päälle harsotaitoksen tai sidoksen. Paina kohtaa mahdollisimman vähän.
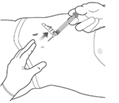
9. LUKITSE NEULANSUOJUS JA HÄVITÄ RUISKU
Lukitse taittuva neulansuojus paikoilleen painamalla sitä kovaa pintaa, kuten pöytää, vasten.
Hävitä kaikki ruiskun osat turvalliseen terävän jätteen säiliöön. Käyttämätön lääkevalmiste tai jäte on hävitettävä soveltuvien ohjeiden mukaisesti.
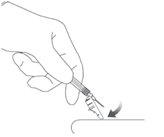
10. NEUVO POTILASTA
Kerro potilaalle, että pistoskohdassa voi olla kyhmy useiden viikkojen ajan mutta se pienenee vähitellen ajan mittaan. Neuvo potilasta olemaan hankaamatta tai hieromatta pistoskohtaa ja asettamaan vyöt tai vaatteiden vyötärönauhat niin, että ne eivät ärsytä pistoskohtaa.
Korvattavuus
SUBUTEX depotinjektioneste, liuos
100 mg 1 kpl
300 mg 1 kpl
- Ei korvausta.
ATC-koodi
N07BC01
Valmisteyhteenvedon muuttamispäivämäärä
01.08.2022
Yhteystiedot
27 Windsor Place
Dublin 2
Irlanti
PatientSafetyRoW@indivior.com
