ATECTURA BREEZHALER inhalaatiojauhe, kapseli, kova 125/127,5 mikrog, 125/260 mikrog
Vaikuttavat aineet ja niiden määrät
Atectura Breezhaler 125 mikrogrammaa/62,5 mikrogrammaa inhalaatiojauhe, kapseli, kova
Yksi kapseli sisältää 150 mikrog indakaterolia (asetaattina) ja 80 mikrog mometasonifuroaattia (indacaterol./mometason. fur.).
Jokainen inhalaattorista saatava annos (annos, joka vapautuu inhalaattorin suukappaleesta) sisältää 125 mikrog indakaterolia (asetaattina) ja 62,5 mikrog mometasonifuroaattia.
Atectura Breezhaler 125 mikrogrammaa/127,5 mikrogrammaa inhalaatiojauhe, kapseli, kova
Yksi kapseli sisältää 150 mikrog indakaterolia (asetaattina) ja 160 mikrog mometasonifuroaattia (indacaterol./mometason. fur.).
Jokainen inhalaattorista saatava annos (annos, joka vapautuu inhalaattorin suukappaleesta) sisältää 125 mikrog indakaterolia (asetaattina) ja 127,5 mikrog mometasonifuroaattia.
Atectura Breezhaler 125 mikrogrammaa/260 mikrogrammaa inhalaatiojauhe, kapseli, kova
Yksi kapseli sisältää 150 mikrog indakaterolia (asetaattina) ja 320 mikrog mometasonifuroaattia (indacaterol./mometason. fur.).
Jokainen inhalaattorista saatava annos (annos, joka vapautuu inhalaattorin suukappaleesta) sisältää 125 mikrog indakaterolia (asetaattina) ja 260 mikrog mometasonifuroaattia.
Apuaine, jonka vaikutus tunnetaan
Yksi kapseli sisältää noin 24 mg laktoosia (monohydraattina).
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Inhalaatiojauhe, kapseli, kova (inhalaatiojauhe)
Kliiniset tiedot
Käyttöaiheet
Atectura Breezhaler on tarkoitettu astman ylläpitohoitoon aikuisille ja 12 vuotta täyttäneille nuorille, joiden oireet eivät ole riittävän hyvin hallinnassa inhaloitavilla kortikosteroideilla ja inhaloitavilla lyhytvaikutteisilla beeta2-agonisteilla.
Annostus ja antotapa
Annostus
Aikuiset ja 12 vuotta täyttäneet nuoret
Suositusannos on yhden kapselin sisältö inhaloituna kerran vuorokaudessa.
Potilaille on määrättävä sellainen vahvuus, jonka sisältämä mometasonifuroaattiannos vastaa heidän tautinsa vaikeusastetta, ja terveydenhuollon ammattilaisen on arvioitava tilanne säännöllisesti uudelleen.
Suurin suositeltu annos on 125 mikrog/260 mikrog kerran vuorokaudessa.
Lääkitys otetaan samaan aikaan päivästä joka päivä. Se voidaan ottaa mihin aikaan päivästä hyvänsä. Jos annos jää väliin, se on otettava mahdollisimman pian. Potilaille on kerrottava, ettei yhden vuorokauden aikana saa ottaa enempää kuin yhden annoksen.
Erityisryhmät
Iäkkäät potilaat
Iäkkäiden potilaiden (65 vuotta täyttäneiden) annosta ei tarvitse muuttaa (ks. kohta Farmakokinetiikka).
Munuaisten vajaatoiminta
Annosta ei tarvitse muuttaa munuaisten vajaatoimintapotilailla (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa, jos potilaalla on lievä tai keskivaikea maksan vajaatoiminta. Tietoja lääkevalmisteen käytöstä vaikeaa maksan vajaatoimintaa sairastavilla potilailla ei ole saatavilla. Tästä syystä näillä potilailla valmistetta voidaan käyttää vain, mikäli odotettavissa oleva hyöty ylittää mahdollisen riskin (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Annostus on 12 vuotta täyttäneille potilaille sama kuin aikuisille.
Turvallisuutta ja tehoa alle 12 vuoden ikäisten lasten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Vain inhalaatioon. Kapseleita ei saa niellä.
Kapselit pitää aina ottaa uuden pakkauksen mukana toimitettavaa inhalaattoria käyttäen (ks. kohta Käyttö- ja käsittelyohjeet).
Potilaita pitää neuvoa lääkevalmisteen oikeasta käyttötavasta. Jos potilaan hengittäminen ei helpotu, häneltä on varmistettava, ettei hän niele lääkevalmistetta inhaloinnin sijaan.
Kapselit saa ottaa repäisypakkauksesta vasta juuri ennen käyttöä.
Inhalaation jälkeen potilaan on huuhdeltava suunsa vedellä nielaisematta vettä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Käyttö- ja käsittelyohjeet).
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen käytöstä ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Taudin paheneminen
Tätä lääkevalmistetta ei saa käyttää akuuttien astmaoireiden hoitoon, mukaan lukien akuutit bronkospasmijaksot. Tässä tapauksessa on käytettävä lyhytvaikutteista bronkodilatoivaa valmistetta. Oireiden lievittämiseen käytettävien lyhytvaikutteisten bronkodilataattorien käytön lisääntyminen viittaa hoitotasapainon huononemiseen, jolloin lääkärin on tutkittava tilanne.
Potilaiden ei pidä lopettaa hoitoa ilman lääkärin valvontaa, sillä oireet voivat uusiutua lopettamisen jälkeen.
Hoitoa tällä lääkevalmisteella ei ole suositeltavaa lopettaa äkillisesti. Jos potilas kokee hoidon tehottomaksi, hoitoa on jatkettava, mutta potilaan on käännyttävä lääkärin puoleen. Oireiden lievittämiseen käytettävien bronkodilataattorien käytön lisääntyminen viittaa perussairauden pahenemiseen, jolloin hoidon uudelleenarviointi on tarpeen. Astmaoireiden äkillinen, etenevä paheneminen voi olla henkeä uhkaavaa, ja lääkärin on arvioitava tilanne pikaisesti.
Yliherkkyys
Tämän lääkevalmisteen annostelun jälkeen on havaittu välittömiä yliherkkyysreaktioita. Jos allergiseen reaktioon viittaavia merkkejä ilmenee, etenkin angioedeemaa (hengitys- tai nielemisvaikeuksia; kielen, huulten tai kasvojen turpoamista), urtikariaa tai ihottumaa, hoito on välittömästi lopetettava ja muu, vaihtoehtoinen lääkitys aloitettava.
Paradoksaalinen bronkospasmi
Kuten muidenkin inhalaatiovalmisteiden anto, myös tämän lääkevalmisteen anto voi johtaa paradoksaaliseen bronkospasmiin, joka voi olla hengenvaarallinen. Tässä tapauksessa hoito on lopetettava heti ja sen sijasta on aloitettava muu hoito.
Beeta-agonistien kardiovaskulaariset vaikutukset
Kuten muutkin beeta2-agonisteja sisältävät valmisteet, myös tämä lääkevalmiste voi aiheuttaa joillekin potilaille kliinisesti merkittäviä kardiovaskulaarivaikutuksia, jotka ilmenevät syketaajuuden tihenemisenä, verenpaineen kohoamisena ja/tai muina oireina. Tällaisessa tilanteessa hoito saatetaan joutua lopettamaan.
Tämän lääkevalmisteen käytössä tulee noudattaa varovaisuutta, jos potilaalla on jokin kardiovaskulaarisairaus (sepelvaltimotauti, akuutti sydäninfarkti, rytmihäiriöitä, hypertensio), kouristuksia aiheuttava sairaus tai tyreotoksikoosi, sekä jos potilas on tavallista herkempi beeta2-agonisteille.
Indakateroli/mometasonifuroaattivalmisteen kliinisen tutkimusohjelman tutkimuksista suljettiin pois potilaat, joilla oli epästabiili iskeeminen sydänsairaus, anamneesissa sydäninfarkti edeltäneiden 12 kk aikana, NYHA-luokituksen (New York Heart Association) luokan III/IV vasemman kammion vajaatoiminta, rytmihäiriö, kontrolloimaton hypertensio, aivoverisuonisairaus tai anamneesissa pitkän QT-ajan oireyhtymä sekä tunnetusti QTc-aikaa pidentäviä lääkevalmisteita käyttäneet potilaat. Näiden potilasryhmien turvallisuustuloksia pidetään tuntemattomina.
Beeta2‑agonistit ovat aiheuttaneet myös EKG-muutoksia kuten T-aallon madaltumista, QT-ajan pitenemistä ja ST-laskua. Havaintojen kliinisestä merkityksestä ei kuitenkaan ole tietoa.
Pitkävaikutteisten beeta2-agonistien (LABA) tai LABA-valmistetta sisältävien yhdistelmävalmisteiden kuten Atectura Breezhalerin käytössä on siis noudatettava varovaisuutta, jos potilaalla on tunnettu tai epäilty QT-välin piteneminen tai jos potilas saa jotakin QT-väliin vaikuttavaa lääkevalmistetta.
Beeta-agonistien käyttöön liittyvä hypokalemia
Joillekin potilaille beeta2-agonistit saattavat aiheuttaa merkittävää hypokalemiaa, joka altistaa kardiovaskulaarihaitoille. Seerumin kaliumpitoisuuksien pieneneminen on yleensä ohimenevää eikä vaadi kaliumlisän käyttöä. Vaikeaa astmaa sairastavilla hypoksia ja samanaikainen hoito saattavat pahentaa hypokalemiaa, mikä voi suurentaa rytmihäiriöherkkyyttä (ks. kohta Yhteisvaikutukset).
Kliinisesti merkittäviä hypokaleemisia vaikutuksia ei ole havaittu suositellulla terapeuttisella indakateroli/mometasonifuroaattiannoksella suoritetuissa kliinisissä tutkimuksissa.
Hyperglykemia
Suurten beeta2-agonistiannosten inhaloiminen saattaa suurentaa plasman glukoosipitoisuuksia. Diabeetikkojen plasman glukoosipitoisuuksia tulee seurata tavanomaista tarkemmin hoidon aloittamisen yhteydessä.
Tätä lääkevalmistetta ei ole tutkittu potilailla, joilla on tyypin I diabetes tai huonossa hoitotasapainossa oleva tyypin II diabetes.
Suu-ja nielutulehdusten ehkäisy
Suun ja nielun hiivasieni-infektioiden riskin vähentämiseksi, tulee potilasta neuvoa huuhtomaan suu tai kurlaamaan vedellä ilman nielemistä tai pesemään hampaat lääkeannoksen inhaloinnin jälkeen.
Kortikosteroidien systeemiset vaikutukset
Inhaloitavat kortikosteroidit voivat aiheuttaa systeemisiä vaikutuksia etenkin, jos niitä käytetään suurina annoksina pitkiä aikoja. Tällaisten vaikutusten todennäköisyys on kuitenkin huomattavasti pienempi kuin peroraalisia kortikosteroideja käytettäessä. Myös potilaskohtaisia ja kortikosteroidivalmistekohtaisia eroja voi esiintyä.
Mahdollisia systeemisiä vaikutuksia voivat olla Cushingin oireyhtymä, Cushingin oireyhtymän kaltaiset piirteet, lisämunuaistoiminnan lamaantuminen, kasvun hidastuminen lapsilla ja nuorilla, luuntiheyden pieneneminen, kaihi, glaukooma ja harvinaisemmissa tapauksissa myös monenlaiset psyykeen/käyttäytymiseen kohdistuvat vaikutukset kuten psykomotorinen yliaktiivisuus, unihäiriöt, ahdistuneisuus, masennus tai aggressiivisuus (erityisesti lapsilla). Tästä syystä on tärkeää titrata inhaloitava kortikosteroidiannos pienimmälle tehokkaalle tasolle, jolla astman hoitotasapaino pysyy hyvänä.
Systeemisten ja paikallisten (ml. intranasaaliset, inhaloitavat ja intraokulaariset) kortikosteroidien käytön yhteydessä voidaan ilmoittaa näköhäiriöitä. Potilailla, joilla on esimerkiksi näön hämärtymistä tai muita näköhäiriöitä, on harkittava lähetettä silmälääkärille näköhäiriöiden mahdollisten aiheuttajien arvioimiseksi. Näitä voivat olla kaihi, glaukooma tai harvinaissairaudet kuten sentraalinen seroosi korioretinopatia (CSCR), joita on ilmoitettu systeemisesti ja paikallisesti käytettävien kortikosteroidien käytön jälkeen.
Tämän lääkevalmisteen käytössä on noudatettava varovaisuutta, jos potilaalla on keuhkotuberkuloosi tai krooninen tai hoitamaton infektio.
Apuaineet
Tämä lääkevalmiste sisältää laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi‑galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Yhteisvaikutukset
Indakateroli/mometasonifuroaattivalmisteella ei ole tehty erityisiä yhteisvaikutustutkimuksia. Tiedot mahdollisista yhteisvaikutuksista perustuvat kunkin vaikuttavan aineen yhteisvaikutuspotentiaalia koskeviin tietoihin.
QTc-aikaa tunnetusti pidentävät lääkevalmisteet
Kuten muitakin beeta2-agonisteja sisältäviä lääkevalmisteita, myös tätä lääkevalmistetta tulee käyttää varoen potilailla, joita hoidetaan monoamiinioksidaasin estäjillä, trisyklisillä masennuslääkkeillä tai tunnetusti QT-aikaa pidentävillä lääkevalmisteilla, sillä niiden mahdollinen vaikutus QT-aikaan voi voimistua. QT-aikaa tunnetusti pidentävien lääkevalmisteiden käyttö voi suurentaa kammioperäisten rytmihäiriöiden riskiä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Hypokaleemisesti vaikuttavat hoidot
Samanaikainen hoito hypokalemiaa aiheuttavilla lääkkeillä (metyyliksantiinijohdokset, steroidit tai kaliumia säästämättömät diureetit) saattaa tehostaa beeta2-agonistien mahdollista hypokaleemista vaikutusta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Beetasalpaajat
Beetasalpaajat saattavat heikentää tai estää beeta2-agonistien vaikutusta. Näin ollen tätä lääkevalmistetta ei pidä käyttää yhdessä beetasalpaajien kanssa, ellei niiden käyttöön ole painavaa syytä. Jos beetasalpaajan käyttö on tarpeen, tulee ensisijaisesti valita kardioselektiivinen beetasalpaaja, mutta niidenkin käytössä on noudatettava varovaisuutta.
Yhteisvaikutukset CYP3A4:n ja P-glykoproteiinin estäjien kanssa
CYP3A4:n ja P-glykoproteiinin (P-gp) esto ei vaikuta hoitoannoksilla käytettävän Atectura Breezhaler valmisteen turvallisuuteen.
Indakaterolipuhdistuman kannalta keskeisten tekijöiden (CYP3A4:n ja P-gp:n) tai mometasonifuroaattipuhdistuman kannalta keskeisten tekijöiden (CYP3A4:n) toiminnan estyminen suurentaa systeemisen indakateroli- tai mometasonifuroaattialtistuksen jopa kaksinkertaiseksi.
Inhaloituna annetun mometasonifuroaatin pitoisuudet plasmassa ovat hyvin pienet, joten kliinisesti merkittävät interaktiot eivät ole todennäköisiä. Systeeminen altistus mometasonifuroaatille saattaa kuitenkin mahdollisesti suurentua, kun samanaikaisesti käytetään voimakkaita CYP3A4:n estäjiä (esim. ketokonatsoli, itrakonatsoli, nelfinaviiri, ritonaviiri, kobisistaatti).
Muut pitkävaikutteiset beeta2-agonistit
Tämän lääkevalmisteen käyttöä muiden pitkävaikutteisia beeta2-agonisteja sisältävien valmisteiden kanssa ei ole tutkittu. Yhteiskäyttöä ei suositella, sillä se voi voimistaa haittavaikutuksia (ks. kohdat Haittavaikutukset ja Yliannostus).
Raskaus ja imetys
Raskaus
Atectura Breezhaler valmisteen tai yksittäisten vaikuttavien aineiden (indakateroli ja mometasonifuroaatti) käytöstä raskauden aikana ei ole riittävästi tietoa mahdollisen riskin määrittämiseksi.
Ihon alle annettu indakateroli ei ollut teratogeeninen rotalla eikä kanilla (ks. kohta Prekliiniset tiedot turvallisuudesta). Eläintutkimuksissa kantavilla hiirillä, rotilla ja kaneilla mometasonifuroaatti suurensi sikiöepämuodostumien esiintyvyyttä ja heikensi sikiöiden eloonjäämistä ja kasvua.
Kuten muutkin beeta2-agonistit, indakateroli saattaa vaikeuttaa synnytystä relaksoimalla kohdun sileää lihasta.
Tätä lääkevalmistetta ei pidä käyttää raskauden aikana, ellei hoidon odotettavissa oleva hyöty potilaalle oikeuta sikiöön mahdollisesti kohdistuvaa riskiä.
Imetys
Indakaterolin tai mometasonifuroaatin esiintymisestä äidinmaidossa ihmisellä, hoidon vaikutuksesta imetettävään lapseen ja hoidon vaikutuksesta maidoneritykseen ei ole tietoa. Muut inhaloitavat kortikosteroidit, jotka ovat samantapaisia kuin mometasonifuroaatti, siirtyvät äidinmaitoon ihmisillä. Imettävien rottien maidossa on havaittu indakaterolia (sekä sen metaboliitteja) ja mometasonifuroaattia.
On päätettävä, lopetetaanko imetys vai pidättäydytäänkö hoidosta ottaen huomioon imetyksen hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Eläimillä tehdyt lisääntymistutkimukset ja muut tiedot eivät viittaa miehen tai naisen hedelmällisyyteen kohdistuviin huolenaiheisiin.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Tällä lääkevalmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Yleisimmät haittavaikutukset 52 viikon aikana olivat astma (pahenemisvaihe) (26,9 %), nenänielun tulehdus (12,9 %), ylähengitystieinfektio (5,9 %) ja päänsärky (5,8 %).
Haittavaikutustaulukko
Haittavaikutukset on lueteltu MedDRA-elinjärjestelmäluokituksen mukaisesti (taulukko 1). Haittavaikutusten yleisyys perustuu PALLADIUM-tutkimukseen. Kunkin elinjärjestelmäluokan haittavaikutukset on järjestetty yleisyysjärjestykseen yleisimmästä alkaen. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Kunkin haittavaikutuksen kohdalla mainittava yleisyysluokka perustuu seuraavaan käytäntöön (CIOMS III): hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000).
Taulukko 1 Haittavaikutukset
| Elinjärjestelmä | Haittavaikutukset | Yleisyysluokka |
| Infektiot | Nenänielun tulehdus | Hyvin yleinen |
| Ylähengitystieinfektiot | Yleinen | |
| Kandidiaasi*1 | Melko harvinainen | |
| Immuunijärjestelmä | Yliherkkyys*2 | Yleinen |
| Angioedeema*3 | Melko harvinainen | |
| Aineenvaihdunta ja ravitsemus | Hyperglykemia*4 | Melko harvinainen |
| Hermosto | Päänsärky*5 | Yleinen |
| Silmät | Näön sumentuminen | Melko harvinainen |
| Kaihi*6 | Melko harvinainen | |
| Sydän | Takykardia*7 | Melko harvinainen |
| Hengityselimet, rintakehä ja välikarsina | Astma (pahenemisvaihe) | Hyvin yleinen |
| Suun ja nielun alueen kipu*8 | Yleinen | |
| Dysfonia | Yleinen | |
| Iho ja ihonalainen kudos | Ihottuma*9 | Melko harvinainen |
| Kutina*10 | Melko harvinainen | |
| Luusto, lihakset ja sidekudos | Tuki- ja liikuntaelimistön kipu*11 | Yleinen |
| Lihasspasmit | Melko harvinainen | |
* Viittaa haittavaikutustermien ryhmittelyyn seuraavasti: 1 Suun kandidiaasi, suun ja nielun kandidiaasi. 2 Lääkeihottuma, lääkeyliherkkyys, yliherkkyys, ihottuma, punoittava ihottuma, kutiava ihottuma, nokkosihottuma. 3 Allerginen turvotus, angioedeema, periorbitaalinen turvotus, silmäluomen turvotus. 4 Veren glukoosipitoisuuden suureneminen, hyperglykemia. 5 Päänsärky, jännityspäänsärky. 6 Kaihi, kaihi, johon liittyy kuorikerroksen samentumia. 7 Syketiheyden suureneminen, takykardia, sinustakykardia, supraventrikulaarinen takykardia. 8 Suun kipu, epämukava tunne suunielussa, suunielun kipu, nielun ärsytys, nielemiskipu. 9 Lääkeihottuma, ihottuma, punoittava ihottuma, kutiava ihottuma. 10 Peräaukon kutina, silmien kutina, nenän kutina, kutina, sukuelinten kutina. 11 Selkäkipu, tuki- ja liikuntaelimistön kipu, lihaskipu, niskakipu, tuki- ja liikuntaelinperäinen rintakipu. | ||
Pediatriset potilaat
Lääkevalmisteen turvallisuusprofiilia arvioitiin faasin III tutkimuksessa nuorilla (12 vuotta täyttäneillä) ja aikuisilla. Haittavaikutusten esiintymistiheys, tyyppi ja vakavuus nuorilla ovat samanlaisia kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostusta epäiltäessä on aloitettava yleiset tukitoimet ja oireenmukainen hoito.
Yliannostus aiheuttaa todennäköisesti yksittäisten vaikuttavien aineiden farmakologisiin vaikutuksiin liittyviä oireita, löydöksiä tai haittavaikutuksia (esim. takykardia, vapina, sydämentykytys, päänsärky, pahoinvointi, oksentelu, uneliaisuus, kammioperäiset rytmihäiriöt, metabolinen asidoosi, hypokalemia, hyperglykemia, hypotalamus-aivolisäke-lisämunuaisakselin toiminnan suppressio).
Kardioselektiivisten beetasalpaajien käyttöä voidaan harkita beeta2-adrenergisten vaikutusten hoitoon, mutta sen tulee aina tapahtua lääkärin valvonnassa ja äärimmäistä varovaisuutta noudattaen, sillä beeta2-salpaajien käyttö voi johtaa bronkospasmiin. Vakavissa tapauksissa potilaat pitää ottaa sairaalahoitoon.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Obstruktiivisten hengitystiesairauksien lääkkeet, adrenergiset lääkeaineet yhd. valmisteina kortikosteroidien tai muiden lääkeaineiden kanssa, ATC-koodi: R03AK14
Vaikutusmekanismi
Tämä lääkevalmiste sisältää yhdistelmänä indakaterolia, joka on pitkävaikutteinen beeta2‑agonisti (LABA), ja mometasonifuroaattia, joka on inhaloitava synteettinen kortikosteroidi (ICS).
Indakateroli
Beeta2‑agonistien (indakateroli mukaan lukien) farmakologiset vaikutukset johtuvat ainakin osittain syklisen 3’, 5’‑adenosiinimonofosfaatin (syklinen AMP) pitoisuuden suurenemisesta, joka johtaa keuhkoputkien sileän lihaksen relaksoitumiseen.
Inhaloidulla indakaterolilla on keuhkoissa paikallinen bronkodilatoiva vaikutus. Indakateroli on ihmisen beeta2‑adrenoreseptorin osittainen agonisti, jonka teho ilmenee jo nanomolaarisilla pitoisuuksilla. Eristetyissä ihmisen keuhkoputkissa indakaterolin vaikutus alkaa nopeasti ja kestää pitkään.
Vaikka beeta2‑adrenergiset reseptorit ovat vallitsevia adrenergisia reseptoreja keuhkoputkien sileässä lihaksessa ja beeta1‑adrenergiset reseptorit sydämessä, on ihmisen sydämessä silti myös beeta2‑adrenergisia reseptoreja, joiden osuus kaikista adrenergisista reseptoreista on 10–50 %.
Mometasonifuroaatti
Mometasonifuroaatti on synteettinen kortikosteroidi, joka sitoutuu suurella affiniteetilla glukokortikoidireseptoreihin ja jolla on paikallisia tulehdusta hillitseviä ominaisuuksia. In vitro mometasonifuroaatti estää leukotrieenien vapautumista allergisten potilaiden leukosyyteistä. Soluviljelmissä mometasonifuroaatti esti hyvin tehokkaasti IL‑1:n, IL‑5:n, IL‑6:n ja TNF‑alfan synteesiä ja vapautumista. Se myös estää tehokkaasti leukotrieenien muodostumista ja IL‑4:n ja IL‑5:n (Th2-tyypin sytokiinien) muodostumista ihmisen CD4+ T‑soluissa.
Farmakodynaamiset vaikutukset
Tämän lääkevalmisteen farmakodynaamista vasteprofiilia luonnehtii nopeasti alkava vaikutus 5 minuutin kuluessa lääkkeenannon jälkeen ja pitkäkestoinen teho koko 24 tunnin annosteluvälin ajan. Tämän osoittaa uloshengityksen sekuntikapasiteetin (FEV1) alhaisimman arvon koheneminen vertailuvalmisteisiin nähden 24 tunnin ajan lääkkeenannon jälkeen.
Tällä lääkevalmisteella ei havaittu viitteitä ajan myötä kehittyvästä takyfylaksiasta keuhkotoiminnan kohenemiseen liittyen.
QTc-aika
Tämän lääkevalmisteen hoidon vaikutusta QTc-aikaan ei ole arvioitu perusteellisessa QT-ajan tutkimuksessa (TQT). Mometasonifuroaatilla ei tiedetä olevan QTc-aikaa pidentäviä vaikutuksia.
Kliininen teho ja turvallisuus
Kahdessa kestoltaan erilaisessa vaiheen III satunnaistetussa, kaksoissokkoutetussa tutkimuksessa (PALLADIUM ja QUARTZ) arvioitiin Atectura Breezhaler valmisteen turvallisuutta ja tehoa aikuisilla ja nuorilla potilailla, joilla oli pitkittynyt astma.
PALLADIUM oli 52 viikon pituinen avaintutkimus, jossa arvioitiin Atectura Breezhaler 125 mikrog/127,5 mikrog x 1 hoitoa (N = 439) verrattuna mometasonifuroaatti 400 mikrog x 1 hoitoon (N = 444) ja Atectura Breezhaler 125 mikrog/260 mikrog x 1 hoitoa (N = 445) verrattuna mometasonifuroaatti 800 mikrog vuorokaudessa hoitoon (annettiin muodossa 400 mikrog kahdesti vuorokaudessa) (N = 442). Kolmannen aktiivisen vertailuhoidon ryhmässä tutkimushenkilöt saivat salmeteroli/flutikasonipropionaattihoitoa 50 mikrog/500 mikrog kahdesti vuorokaudessa (N = 446). Kaikkien tutkimushenkilöiden tuli sairastaa oireista astmaa (ACQ 7 -pistemäärä ≥ 1,5) ja olla käyttänyt astman ylläpitohoitona inhaloitavaa synteettistä kortikosteroidia (ICS) ja mahdollisesti myös pitkävaikutteista beeta2-agonistia (LABA) vähintään 3 kk ajan ennen tutkimukseenottoa. Seulontavaiheessa 31 % potilaista oli sairastanut pahenemisvaiheen edellisenä vuonna. Tutkimukseenottovaiheessa yleisimmin ilmoitettuja astmalääkkeitä olivat keskisuurella annoksella käytetty ICS (20 %) suuriannoksinen ICS (7 %) tai pieniannoksinen ICS yhdistelmänä LABA-valmisteen kanssa (69 %).
Tutkimuksen ensisijainen tavoite oli osoittaa joko Atectura Breezhaler 125 mikrog/127,5mikrog x 1 hoidon paremmuus suhteessa mometasonifuroaatti 400 mikrog x 1 hoitoon tai Atectura Breezhaler 125 mikrog/260 mikrog x 1 hoidon paremmuus suhteessa mometasonifuroaatti 400 mikrog x 2 hoitoon, mitattuna alhaisimmalla FEV1-arvolla viikon 26 kohdalla.
Viikon 26 kohdalla alhaisimman FEV1-arvon ja ACQ‑7-pistemäärän (Asthma Control Questionnaire) osoitettiin kohenevan merkitsevästi Atectura Breezhaler 125 mikrog/127,5 mikrog x 1 hoidolla verrattuna mometasonifuroaatti 400 mikrog x 1 hoitoon ja Atectura Breezhaler 125 mikrog/260 mikrog x 1 hoidolla verrattuna mometasonifuroaatti 400 mikrog x 2 hoitoon (ks. taulukko 2). Viikon 52 kohdalla löydökset olivat yhteneväiset viikon 26 löydöksiin nähden.
Sekä Atectura Breezhaler 125 mikrog/127,5 mikrog x 1 että 125 mikrog/260 mikrog x 1 hoito vähensivät keskivaikeiden tai vaikeiden pahenemisvaiheiden (toissijainen päätetapahtuma) vuotuista määrää kliinisesti merkittävästi verrattuna mometasonifuroaatti 400 mikrog x 1 hoitoon ja x 2 hoitoon (ks. taulukko 2).
Kliinisesti oleellisimpien päätetapahtumien tulokset kuvataan taulukossa 2.
Keuhkotoiminta, oireet ja pahenemisvaiheet
Taulukko 2 Ensi- ja toissijaisten päätetapahtumien tulokset PALLADIUM-tutkimuksessa viikoilla 26 ja 52
| Päätetapahtuma | Ajankohta/ Kesto | Atectura Breezhaler1 vs. MF2 | Atectura Breezhaler1 vs. SAL/FP3 | |
Keskisuuri annos vs. keskisuuri annos | Suuri annos vs. suuri annos | Suuri annos vs. suuri annos | ||
| Keuhkofunktio | ||||
| Alhaisin FEV14 | ||||
Hoitojen ero p-arvo (95 % lv) | Viikko 26 (ensisijainen päätetapahtuma) | 211 ml < 0,001 (167; 255) | 132 ml < 0,001 (88; 176) | 36 ml 0,101 (‑7; 80) |
| Viikko 52 | 209 ml < 0,001 (163; 255) | 136 ml < 0,001 (90; 183) | 48 ml 0,040 (2; 94) | |
| Aamulla mitattu uloshengityksen huippuvirtaus (PEF), keskiarvo* | ||||
Hoitojen ero (95 % lv) | Viikko 52 | 30,2 l/min (24,2; 36,3) | 28,7 l/min (22,7; 34,8) | 13,8 l/min (7,7; 19,8) |
| Illalla mitattu uloshengityksen huippuvirtaus (PEF), keskiarvo* | ||||
Hoitojen ero (95 % lv) | Viikko 52 | 29,1 l/min (23,3; 34,8) | 23,7 l/min (18,0; 29,5) | 9,1 l/min (3,3; 14,9) |
| Oireet | ||||
| ACQ‑7 | ||||
Hoitojen ero p-arvo (95 % lv) | Viikko 26 (tärkein toissijainen päätetapahtuma) | ‑0,248 < 0,001 (‑0,334; ‑0,162) | ‑0,171 < 0,001 (‑0,257; ‑0,086) | ‑0,054 0,214 (‑0,140; 0,031) |
| Viikko 52 | ‑0,266 (‑0,354; ‑0,177) | ‑0,141 (‑0,229; ‑0,053) | 0,010 (‑0,078; 0,098) | |
| ACQ-vasteen saaneet (pienimmän kliinisesti merkittävän muutoksen lähtötilanteesta (MCID) saavuttaneet, ACQ ≥ 0,5) | ||||
| Prosenttiosuus | Viikko 26 | 76 % vs. 67 % | 76 % vs. 72 % | 76 % vs. 76 % |
Vetosuhde (95 % lv) | Viikko 26 | 1,73 (1,26; 2,37) | 1,31 (0,95; 1,81) | 1,06 (0,76; 1,46) |
| Prosenttiosuus | Viikko 52 | 82 % vs. 69 % | 78 % vs. 74 % | 78 % vs. 77 % |
Vetosuhde (95 % lv) | Viikko 52 | 2,24 (1,58; 3,17) | 1,34 (0,96; 1,87) | 1,05 (0,75; 1,49) |
| Kohtauslääkkeettömien päivien prosenttiosuus* | ||||
Hoitojen ero (95 % lv) | Viikko 52 | 8,6 (4,7; 12,6) | 9,6 (5,7; 13,6) | 4,3 (0,3; 8,3) |
| Oireettomien päivien prosenttiosuus* | ||||
Hoitojen ero (95 % lv) | Viikko 52 | 9,1 (4,6; 13,6) | 5,8 (1,3; 10,2) | 3,4 (‑1,1; 7,9) |
| Astman pahenemisvaiheiden vuotuinen määrä | ||||
| Keskivaikeat tai vaikeat pahenemisvaiheet | ||||
| AR | Viikko 52 | 0,27 vs. 0,56 | 0,25 vs. 0,39 | 0,25 vs. 0,27 |
RR (95 % lv) | Viikko 52 | 0,47 (0,35; 0,64) | 0,65 (0,48; 0,89) | 0,93 (0,67; 1,29) |
| Vaikeat pahenemisvaiheet | ||||
| AR | Viikko 52 | 0,13 vs. 0,29 | 0,13 vs. 0,18 | 0,13 vs. 0,14 |
RR (95 % lv) | Viikko 52 | 0,46 (0,31; 0,67) | 0,71 (0,47; 1,08) | 0,89 (0,58; 1,37) |
* Hoidon keston keskiarvo ** Jos RR oli < 1,00, indakateroli/mometasonifuroaatti tuotti paremmat tulokset. 1 Keskisuuri Atectura Breezhaler annos: 125 mikrog/127,5 mikrog x 1; suuri annos: 125 mikrog/260 mikrog x 1. 2 MF: mometasonifuroaatti, keskisuuri annos: 400 mikrog x 1; suuri annos: 400 mikrog x 2 (sisällön määrä). Atectura Breezhaler valmisteen sisältämät 127,5 mikrog ja 260 mikrog mometasonifuroaattiannokset ovat verrattavissa 400 mikrog x 1 ja 800 mikrog vuorokaudessa (annettuna muodossa 400 mikrog x 2) mometasonifuroaattiannoksiin. 3 SAL/FP: salmeteroli/flutikasonipropionaatti; suuri annos: 50 mikrog/500 mikrog x 2 (sisällön määrä). 4 Alhaisin FEV1: 23 h 15 min kuluttua ja 23 h 45 min kuluttua ilta-annoksen jälkeen mitattujen kahden FEV1-arvon keskiarvo. Ensisijainen päätetapahtuma (alhaisin FEV1 viikon 26 kohdalla) ja tärkeä toissijainen päätetapahtuma (ACQ 7 -pistemäärä viikon 26 kohdalla) kuuluivat vahvistavaan tutkimusmenettelyyn, joten päätetapahtumat oli kontrolloitu multiplisiteetin suhteen. Mitkään muut päätetapahtumat eivät kuuluneet vahvistavaan tutkimusmenettelyyn. RR = esiintyvyyssuhde, AR = vuotuinen määrä x 1 = kerran vuorokaudessa, x 2 = kahdesti vuorokaudessa | ||||
Ennalta määritetty yhdistetty analyysi
Atectura Breezhaler 125 mikrog/260 mikrog x 1 hoitoa tutkittiin myös aktiivisina vertailuvalmisteena toisessa vaiheen III tutkimuksessa (IRIDIUM) astmatutkimusohjelmassa, jossa kaikilla tutkimushenkilöillä oli anamneesissa systeemistä kortikosteroidihoitoa vaatinut astman pahenemisvaihe edeltäneenä vuonna. Ennalta määritetyn yhdistetyn IRIDIUM- ja PALLADIUM-tutkimusten analyysin tarkoituksena oli verrata Atectura Breezhaler 125 mikrog/260 mikrog x 1 hoitoa salmeteroli/flutikasoni 50 mikrog/500 mikrog x 2 hoitoon, kun tarkasteltavat päätetapahtumat olivat alhaisin FEV1 ja ACQ‑7-pistemäärä viikon 26 kohdalla sekä pahenemisvaiheiden vuotuinen määrä. Yhdistetyn analyysin mukaan Atectura Breezhaler kohensi alhaisinta FEV1-arvoa 43 ml (95 % lv: 17; 69) ja ACQ‑7-pistemäärää ‑0,091 pisteellä (95 % lv: ‑0,153; ‑0,030) viikon 26 kohdalla ja vähensi astman keskivaikeiden tai vaikeiden pahenemisvaiheiden vuotuista määrää 22 %:lla (RR: 0,78; 95 % lv: 0,66; 0,93) ja vaikeiden pahenemisvaiheiden vuotuista määrää 26 %:lla (RR: 0,74; 95 % lv: 0,61; 0,91) vs. salmeteroli/flutikasoni.
QUARTZ-tutkimus oli 12 viikon pituinen tutkimus, jossa verrattiin Atectura Breezhaler 125 mikrog/62,5 mikrog x 1 hoitoa (N = 398) mometasonifuroaatti 200 mikrog x 1 hoitoon (N = 404). Kaikkien tutkimushenkilöiden piti olla oireisia, ja heidän piti olla käyttänyt astman ylläpitohoitona pieniannoksista ICS-valmistetta ja mahdollisesti myös LABA-valmistetta vähintään 1 kk ajan ennen tutkimukseenottoa. Tutkimukseenottovaiheessa yleisimmin ilmoitettuja astmalääkkeitä olivat pienellä annoksella käytetty ICS (43 %) tai pieniannoksinen ICS yhdistelmänä LABA-valmisteen kanssa (56 %). Tutkimuksen ensisijainen päätetapahtuma oli osoittaa Atectura Breezhaler 125 mikrog/62,5 mikrog x 1 hoidon paremmuus suhteessa mometasonifuroaatti 200 mikrog x 1 hoitoon mitattuna alhaisimmalla FEV1-arvolla viikon 12 kohdalla.
Viikon 12 kohdalla alhaisimman FEV1-arvon ja ACQ‑7-pistemäärän (Asthma Control Questionnaire) osoitettiin kohenevan lähtötilanteesta tilastollisesti merkitsevästi Atectura Breezhaler 125 mikrog/62,5 mikrog x 1 hoidolla verrattuna mometasonifuroaatti 200 mikrog x 1 hoitoon.
Kliinisesti oleellisimpien päätetapahtumien tulokset kuvataan taulukossa 3.
Taulukko 3 Ensi- ja toissijaisten päätetapahtumien tulokset QUARTZ-tutkimuksessa viikon 12 kohdalla
| Päätetapahtumat | Pieni Atectura Breezhaler annos* vs. pieni MF-annos** |
| Keuhkofunktio | |
| Alhaisin FEV1-arvo (ensisijainen päätetapahtuma)*** | |
Hoitojen ero P-arvo (95 % lv) | 182 ml < 0,001 (148; 217) |
| Aamulla mitattu PEF-keskiarvo | |
Hoitojen ero (95 % lv) | 27,2 l/min (22,1; 32,4) |
| Illalla mitattu PEF | |
Hoitojen ero (95 % lv) | 26,1 l/min (21,0; 31,2) |
| Oireet | |
| ACQ‑7 (tärkeä toissijainen päätetapahtuma) | |
Hoitojen ero P-arvo (95 % lv) | ‑0,218 < 0,001 (‑0,293; ‑0,143) |
| Niiden potilaiden osuus, jotka saavuttivat MCID-muutoksen (pienin kliinisesti merkittävä muutos) lähtötilanteesta, ACQ ≥ 0,5 | |
Prosenttiosuus Vetosuhde (95 % lv) | 75 % vs. 65 % 1,69 (1,23; 2,33) |
| Kohtauslääkkeettömien päivien prosenttiosuus | |
Hoitojen ero (95 % lv) | 8,1 (4,3; 11,8) |
| Oireettomien päivien prosenttiosuus | |
Hoitojen ero (95 % lv) | 2,7 (‑1,0; 6,4) |
* Pieni Atectura Breezhaler annos: 125 mikrog/62,5 mikrog x 1. ** MF: mometasonifuroaatti, pieni annos: 200 mikrog x 1 (sisällön määrä). Atectura Breezhaler x 1 hoidon sisältämä mometasonifuroaatti 62,5 mikrog -annos on verrattavissa mometasonifuroaatti 200 mikrog x 1 hoitoon (sisällön määrä). *** Alhaisin FEV1: 23 h 15 min kuluttua ja 23 h 45 min kuluttua ilta-annoksen jälkeen mitattujen kahden FEV1-arvon keskiarvo. x 1 = kerran vuorokaudessa, x 2 = kahdesti vuorokaudessa | |
Pediatriset potilaat
PALLADIUM-tutkimuksessa, johon osallistui 106 nuorta (ikä 12–17 v), alhaisin FEV1-arvo viikon 26 kohdalla koheni 0,173 litraa (95 % lv: ‑0,021; 0,368) Atectura Breezhaler 125 mikrog/260 mikrog x 1 hoidolla vs. mometasonifuroaatti 800 mikrog (eli suuret annokset). Atectura Breezhaler 125 mikrog/127,5 mikrog x 1 hoidolla vs. mometasonifuroaatti 400 mikrog x 1 (eli keskisuuret annokset) arvo koheni 0,397 litraa (95 % lv: 0,195; 0,599).
QUARTZ-tutkimuksessa, johon osallistui 63 nuorta (ikä 12–17 v), hoitojen ero alhaisimman FEV1-arvon pienimmän neliösumman keskiarvon perusteella päivän 85 (viikon 12) kohdalla oli 0,251 litraa (95 % lv: 0,130; 0,371).
Nuorten alaryhmissä keuhkotoiminnan koheneminen, oireiden lievittyminen ja pahenemisvaiheiden vähentyminen vastasivat koko populaation arvoja.
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset indakateroli/mometasonifuroaattivalmisteen käytöstä astman hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Atectura Breezhaler -inhalaation jälkeen mediaaniaika indakaterolihuippupitoisuuden saavuttamiseen plasmassa on noin 15 minuuttia ja mometasonifuroaattihuippupitoisuuden saavuttamiseen noin 1 tunti.
In vitro -tutkimuksista kerättyjen tietojen perusteella kunkin yksittäisen vaikuttavan aineen keuhkoihin jakautuvan annoksen oletetaan olevan indakateroli/mometasonifuroaattiyhdistelmällä samankaltainen kuin kullakin monoterapiana käytetyllä valmisteella. Vakaassa tilassa yhdistelmäinhalaation jälkeen saavutettu indakateroli- ja mometasonifuroaattialtistus plasmassa oli vastaava kuin systeeminen altistus pelkkää indakaterolimaleaattia tai mometasonifuroaattia sisältävän valmisteen inhaloinnin jälkeen.
Yhdistelmän inhaloinnin jälkeen indakaterolin absoluuttisen biologisen hyötyosuuden on arvioitu olevan noin 45 % ja mometasonifuroaatin alle 10 %.
Indakateroli
Indakaterolipitoisuudet suurenivat, kun lääke otettiin toistuvasti kerran vuorokaudessa. Vakaa tila saavutettiin 12–14 päivässä. Kun 60–480 mikrogramman annoksia (inhalaattorista saatava annos) inhaloitiin kerran vuorokaudessa, indakaterolin keskimääräinen kumuloitumissuhde (24 tunnin AUC-arvo päivänä 14 verrattuna päivään 1) oli 2,9–3,8. Systeeminen altistus johtuu sekä keuhkoista että ruoansulatuskanavasta tapahtuvasta imeytymisestä. Noin 75 % systeemisestä altistuksesta oli peräisin keuhkoista tapahtuvasta imeytymisestä ja noin 25 % suolistosta tapahtuvasta imeytymisestä.
Mometasonifuroaatti
Mometasonifuroaattipitoisuudet suurenivat, kun lääke otettiin Breezhaler-inhalaattorilla toistuvasti kerran vuorokaudessa. Vakaa tila saavutettiin 12 päivän kuluttua. Kun 62,5–260 mikrogramman annoksia (indakateroli/mometasoniyhdistelmähoidon osana) inhaloitiin kerran vuorokaudessa, mometasonifuroaatin keskimääräinen kumuloitumissuhde (24 tunnin AUC-arvo päivänä 14 verrattuna päivään 1) oli 1,61–1,71.
Suun kautta annetun mometasonifuroaatin absoluuttinen systeeminen biologinen hyötyosuus arvioitiin hyvin pieneksi (< 2 %).
Jakautuminen
Indakateroli
Laskimoinfuusion jälkeen indakaterolin jakautumistilavuus (Vz) oli 2 361–2 557 litraa, mikä viittaa siihen, että lääkeaine jakautuu voimakkaasti kudoksiin. In vitro kokeissa 94,1–95,3 % sitoutui ihmisen seerumin proteiineihin ja 95,1–96,2 % plasman proteiineihin.
Mometasonifuroaatti
Laskimoon annetun bolusannoksen jälkeen Vd on 332 litraa. Mometasonifuroaatti sitoutuu voimakkaasti proteiineihin in vitro: 5–500 ng/ml pitoisuusalueella sitoutuminen on 98–99-prosenttista.
Biotransformaatio
Indakateroli
Kun radioaktiivisesti leimattua indakaterolia annettiin suun kautta ihmisellä tehdyssä imeytymis-, jakautumis-, metabolia- ja eliminaatiotutkimuksessa, seerumissa tavattiin lähinnä muuttumatonta indakaterolia, joka selitti noin kolmanneksen lääkkeen vuorokausialtistuksesta (24 tunnin AUC). Runsaimmin seerumissa tavattu metaboliitti oli indakaterolin hydroksyloitunut johdannainen. Muita runsaina esiintyneitä metaboliitteja olivat indakaterolin ja hydroksyloituneen indakaterolin fenoli-O-glukuronidit. Lisäksi tavattiin hydroksyloituneen metaboliitin diastereomeeriä, indakaterolin N-glukuronidia ja C- ja N-dealkylaation kautta muodostuneita metaboliitteja.
In vitro tutkimukset viittasivat siihen, että ainoa indakaterolia fenoli-O-glukuronidiksi metaboloiva UGT-isoentsyymi oli UGT1A1. Kun indakaterolia inkuboitiin rekombinanttien CYP1A1-, CYP2D6- ja CYP3A4-entsyymien kanssa, havaittiin oksidaatiotuotteita. CYP3A4:n todettiin olevan tärkein indakaterolia hydroksyloiva isoentsyymi. In vitro tutkimukset viittasivat myös siihen, että indakateroli on P-gp-ulosvirtauspumpun substraatti. Sen P-gp-affiniteetti on kuitenkin pieni.
UGT1A1-isoformi on tärkeä indakaterolin metaboliseen puhdistumaan vaikuttava isoentsyymi in vitro. Kliinisessä tutkimuksessa, johon osallistui eri UGT1A1-genotyyppejä edustavia henkilöitä, UGT1A1-genotyypeillä ei kuitenkaan todettu olevan merkittävää vaikutusta systeemiseen indakaterolialtistukseen.
Mometasonifuroaatti
Se osuus inhaloidusta mometasonifuroaattiannoksesta, joka nielaistaan ja joka imeytyy ruoansulatuskanavasta, käy läpi laajan metabolian useiksi eri metaboliiteiksi. Plasmassa ei havaita päämetaboliitteja. Ihmisen maksan mikrosomeissa mometasonifuroaatti metaboloituu CYP3A4:n välityksellä.
Eliminaatio
Indakateroli
Kliinisissä tutkimuksissa, joissa virtsaa kerättiin talteen, todettiin, että yleensä alle 2 % annoksesta erittyi muuttumattomana indakaterolina virtsaan. Indakaterolin munuaispuhdistuma oli keskimäärin 0,46–1,20 l/h. Kun tätä verrataan indakaterolin puhdistumaan seerumista, joka on 18,8–23,3 l/h, on selvää, että munuaispuhdistumalla on vähäinen merkitys systeemiseen verenkiertoon päässeen indakaterolin eliminaation kannalta (noin 2–6 % systeemisestä puhdistumasta).
Ihmisen imeytymis-, jakautumis-, metabolia- ja eliminaatiotutkimuksessa, jossa indakaterolia annettiin suun kautta, lääkettä erittyi ulosteeseen enemmän kuin virtsaan. Indakateroli erittyi ihmisen ulosteeseen lähinnä muuttumattoman kanta-aineen muodossa (54 % annoksesta) ja vähäisemmässä määrin myös indakaterolin hydroksyloituneina metaboliitteina (23 % annoksesta). Massatasapaino oli täydellinen, ja ≥ 90 % annoksesta erittyi ulosteeseen.
Seerumin indakaterolipitoisuudet pienenivät monivaiheisesti, ja terminaalinen puoliintumisaika oli keskimäärin 45,5–126 tuntia. Toistuvan indakateroliannostelun yhteydessä tapahtuvasta kumuloitumisesta laskettu efektiivinen puoliintumisaika oli 40–52 tuntia. Tämä on yhtäpitävää sen kanssa, että vakaan tilan saavuttamiseen kuluva aika on havaintojen mukaan noin 12–14 vrk.
Mometasonifuroaatti
Laskimoon annetun bolusannoksen jälkeen mometasonifuroaatin terminaalinen eliminaation T½-aika on noin 4,5 tuntia. Radioaktiivisesti merkitty, suun kautta inhaloitu annos erittyy lähinnä ulosteeseen (74 %) ja vähemmässä määrin virtsaan (8 %).
Yhteisvaikutukset
Vakaassa tilassa samanaikainen indakaterolin ja mometasonifuroaatin suun kautta inhalointi ei vaikuttanut kummankaan vaikuttavan aineen farmakokinetiikkaan.
Lineaarisuus/ei‑lineaarisuus
Atectura Breezhaler 125 mikrog/62,5 mikrog hoidolla ja 125 mikrog/260 mikrog hoidolla (sekä kerta-annokset että toistuva annostelu) systeeminen altistus mometasonifuroaatille suureni suhteessa annokseen terveillä henkilöillä. Vakaan tilan systeeminen altistus suureni vähemmän kuin annosriippuvaisesti astmapotilailla annoksilla 125 mikrog/62,5 mikrog ja 125 mikrog/260 mikrog. Annossuhteisuutta ei arvioitu indakaterolin osalta, sillä lääkeainetta käytettiin kaikissa vahvuuksissa vain yhdellä annoksella.
Pediatriset potilaat
Atectura Breezhaler valmistetta voidaan käyttää nuorilla (12 vuotta täyttäneillä) potilailla samalla annostuksella kuin aikuisille.
Erityisryhmät
Indakateroli/mometasonifuroaatti-inhalaation jälkeen astmapotilailta kerättyjen populaatiofarmakokineettisten tietojen analyysissä ei havaittu viitteitä siitä, että ikä, sukupuoli, paino, tupakointistatus, lähtötilanteen glomerulusten laskennallinen suodatusnopeus (eGFR) tai lähtötilanteen FEV1-arvo vaikuttaisivat merkitsevästi systeemiseen indakateroli- tai mometasonifuroaattialtistukseen.
Potilaat, joilla on munuaisten vajaatoiminta
Koska hyvin pieni osa indakaterolista ja mometasonifuroaatista eliminoituu virtsan kautta, munuaisten vajaatoiminnan vaikutusta systeemiseen altistukseen näille lääkeaineille ei ole tutkittu (ks. kohta Annostus ja antotapa).
Potilaat, joilla on maksan vajaatoiminta
Indakateroli/mometasonifuroaattihoidon vaikutuksia ei ole arvioitu maksan vajaatoimintapotilailla. Valmisteen vaikuttavia aineita on kuitenkin tutkittu ainoana lääkkeenä (ks. kohta Annostus ja antotapa).
Indakateroli
Indakaterolin Cmax- ja AUC-arvoissa ei havaittu oleellisia muutoksia lievää tai keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla, eivätkä nämä potilaat eronneet terveistä verrokeista myöskään proteiineihin sitoutumisen suhteen. Vaikeaa maksan vajaatoimintaa sairastavilla ei ole tehty tutkimuksia.
Mometasonifuroaatti
Tutkimuksessa arvioitiin 400 mikrog mometasonifuroaattikerta-annoksen inhalaatiota jauheinhalaattorista tutkimushenkilöille, joilla oli lievä (n = 4), keskivaikea (n = 4) tai vaikea (n = 4) maksan vajaatoiminta. Kussakin näistä ryhmistä mometasonifuroaatin huippupitoisuudet plasmassa olivat havaittavissa (vaihteluväli 50–105 pikogrammaa/ml) vain 1 tai 2 tutkittavalla. Havaitut huippupitoisuudet plasmassa ilmeisesti suurenevat maksan vajaatoiminnan vaikeusasteen myötä. Havaittavia pitoisuuksia kuitenkin todettiin vain harvoin (määrityksen kvantifikaatioalaraja oli 50 pikogrammaa/ml).
Muut erityisryhmät
Systeemisessä kokonaisaltistuksessa (AUC) ei havaittu huomattavia eroja japanilaisten ja valkoihoisten välillä kummankaan vaikuttavan aineen osalta. Muiden etnisten ryhmien osalta ei ole riittävästi farmakokineettistä tietoa saatavilla.
Prekliiniset tiedot turvallisuudesta
Indakaterolin ja mometasonifuroaatin yhdistelmä
13 viikon pituisten inhalaatiotoksisuustutkimusten löydökset johtuivat pääasiassa mometasonifuroaattikomponentista, ja ne olivat glukokortikoidien tyypillisiä farmakologisia vaikutuksia. Indakateroliin liittyvää sykkeen nopeutumista havaittiin koirilla indakateroli/mometasonifuroaatin tai pelkän indakaterolin annon jälkeen.
Indakateroli
Indakaterolin beeta2-agonistisesta vaikutuksesta johtuvia kardiovaskulaarisia vaikutuksia olivat koirilla havaitut takykardia, rytmihäiriöt ja sydänlihasvauriot. Jyrsijöillä todettiin lievää nenäontelon ja kurkunpään ärsytystä.
Geenitoksisuustutkimuksissa ei havaittu mutageenisuutta eikä klastogeenisuutta.
Karsinogeenisuutta arvioitiin kaksivuotisessa tutkimuksessa rotalla ja 6 kk pituisessa tutkimuksessa siirtogeenisellä hiirellä. Rotalla havaittiin munasarjojen hyvänlaatuisten leiomyoomien ja munasarjojen sileän lihaksen paikallisen hyperplasian yleistymistä. Tämä vastasi muilla beeta2-agonisteilla ilmoitettuja samankaltaisia havaintoja. Hiirellä ei todettu viitteitä karsinogeenisuudesta.
Kaikki nämä löydökset havaittiin altistuksilla, jotka olivat riittävästi ihmisen odotettavissa olevaa altistusta suuremmat.
Kun indakaterolia annettiin kaneille ihon alle, tiineyteen ja alkion-/sikiönkehitykseen liittyviä haittavaikutuksia havaittiin vasta yli 500‑kertaisilla annoksilla verrattuna altistuksiin, joita saavutetaan ihmisellä päivittäisen 150 mikrog annoksen inhalaation jälkeen (AUC0–24 h-arvon perusteella).
Vaikka indakateroli ei vaikuttanut rottien tavallisiin lisääntymistoimintoihin rotilla tehdyssä hedelmällisyystutkimuksessa, pieneni tiineeksi tulleiden F1-jälkeläisten osuus tehdyssä peri- ja postnataalisen kehityksen rottatutkimuksessa, jossa altistus oli 14-kertainen verrattuna indakaterolilla hoidettuihin ihmisiin. Indakateroli ei ollut alkiotoksinen eikä teratogeeninen rotalla eikä kanilla.
Mometasonifuroaatti
Kaikki havaitut vaikutukset ovat tyypillisiä glukokortikoidien luokkavaikutuksia, ja ne liittyvät glukokortikoidien farmakologisten vaikutusten korostumiseen.
Mometasonifuroaatilla ei osoitettu geenitoksisia vaikutuksia tavanomaisissa in vitro- ja in vivo kokeissa.
Karsinogeenisuustutkimuksissa hiirellä ja rotalla inhaloidun mometasonifuroaatin ei osoitettu suurentavan kasvainten ilmaantuvuutta tilastollisesti merkitsevästi.
Kuten muutkin glukokortikoidit, mometasonifuroaatti on teratogeeninen jyrsijöillä ja kaneilla. Havaittuja vaikutuksia olivat napatyrä rotalla, suulakihalkio hiirellä sekä sappirakon ageneesi, napatyrä ja etukäpälien koukkuasento kanilla. Rotalla, kanilla ja hiirellä havaittiin myös emon painonnousun hidastumista, vaikutuksia sikiön kasvuun (sikiöiden painon pienenemistä ja/tai luutumisen viivästymistä), ja hiirellä havaittiin poikasten eloonjäämisprosentin pienenemistä. Lisääntymistoimintojen tutkimuksissa ihon alle annettu mometasonifuroaatti annoksella 15 mikrog/kg johti tiineyden pitkittymiseen ja vaikeisiin synnytyksiin sekä poikasten eloonjäämisprosentin ja painon pienenemiseen.
Ympäristöön kohdistuvien riskien arviointi
Ympäristöön kohdistuvia riskejä arvioivissa tutkimuksissa on ilmennyt, että mometasoni voi olla haitallista pintavesille (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Laktoosimonohydraatti
Kapselin kuori
Liivate
Painomuste
Atectura Breezhaler 125 mikrogrammaa/62,5 mikrogrammaa inhalaatiojauhe, kovat kapselit
Sellakka
Briljanttisininen FCF (E133)
Propyleeniglykoli (E1520)
Titaanidioksidi (E171)
Musta rautaoksidi (E172)
Atectura Breezhaler 125 mikrogrammaa/127,5 mikrogrammaa inhalaatiojauhe, kovat kapselit
Sellakka
Titaanidioksidi (E171)
Musta rautaoksidi (E172)
Propyleeniglykoli (E1520)
Keltainen rautaoksidi (E172)
Ammoniumhydroksidi (E527)
Atectura Breezhaler 125 mikrogrammaa/260 mikrogrammaa inhalaatiojauhe, kovat kapselit
Sellakka
Musta rautaoksidi (E172)
Propyleeniglykoli (E1520)
Ammoniumhydroksidi (E527)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Säilytä alle 30 °C.
Säilytä alkuperäispakkauksessa. Herkkä valolle. Herkkä kosteudelle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ATECTURA BREEZHALER inhalaatiojauhe, kapseli, kova
125/127,5 mikrog (L:kyllä) 30 x 1 fol (inhalaattori) (38,16 €)
125/260 mikrog (L:kyllä) 30 x 1 fol (inhalaattori) (45,23 €)
PF-selosteen tieto
Inhalaattorin runko-osa ja suojus on valmistettu akryylinitriilibutadieenistyreenistä (ABS), ja painikkeet on valmistettu metyylimetakrylaatti-ABS:stä. Neulat ja jouset ovat ruostumatonta terästä.
Yksittäispakattu PA/Alu/PVC//Alu-repäisypakkaus. Yksi repäisypakkaus sisältää 10 kovaa kapselia.
Atectura Breezhaler 125 mikrogrammaa/62,5 mikrogrammaa inhalaatiojauhe, kovat kapselit
Yksittäispakkaus sisältää 10 x 1 tai 30 x 1 kovaa kapselia sekä 1 inhalaattorin.
Monipakkaus sisältää 90 (3 pakkausta, joissa 30 x 1) kovaa kapselia ja 3 inhalaattoria.
Monipakkaus sisältää 150 (15 pakkausta, joissa 10 x 1) kovaa kapselia ja 15 inhalaattoria.
Atectura Breezhaler 125 mikrogrammaa/127,5 mikrogrammaa inhalaatiojauhe, kovat kapselit
Yksittäispakkaus sisältää 10 x 1 tai 30 x 1 kovaa kapselia sekä 1 inhalaattorin.
Monipakkaus sisältää 90 (kolme pakkausta, joissa 30 x 1) kovaa kapselia ja 3 inhalaattoria.
Monipakkaus sisältää 150 (15 pakkausta, joissa 10 x 1) kovaa kapselia ja 15 inhalaattoria.
Atectura Breezhaler 125 mikrogrammaa/260 mikrogrammaa inhalaatiojauhe, kovat kapselit
Yksittäispakkaus sisältää 10 x 1 tai 30 x 1 kovaa kapselia sekä 1 inhalaattorin.
Monipakkaus sisältää 90 (3 pakkausta, joissa 30 x 1) kovaa kapselia ja 3 inhalaattoria.
Monipakkaus sisältää 150 (15 pakkausta, joissa 10 x 1) kovaa kapselia ja 15 inhalaattoria.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Atectura Breezhaler 125 mikrogrammaa/62,5 mikrogrammaa inhalaatiojauhe, kapseli, kova
Läpinäkyvä kapseli, joka sisältää valkoista jauhetta. Runko-osaan on sinisellä painettu tuotekoodi ”IM150‑80” sinisen viivan ylle, ja kansiosaan on sinisellä painettu valmisteen logo, jota ympäröi kaksi sinistä viivaa.
Atectura Breezhaler 125 mikrogrammaa/127,5 mikrogrammaa inhalaatiojauhe, kapseli, kova
Läpinäkyvä kapseli, joka sisältää valkoista jauhetta. Runko-osaan on harmaalla painettu tuotekoodi ”IM150‑160” ja kansiosaan on harmaalla painettu valmisteen logo.
Atectura Breezhaler 125 mikrogrammaa/260 mikrogrammaa inhalaatiojauhe, kapseli, kova
Läpinäkyvä kapseli, joka sisältää valkoista jauhetta. Runko-osaan on mustalla painettu tuotekoodi ”IM150‑320” kahden mustan viivan ylle, ja kansiosaan on mustalla painettu valmisteen logo, jota ympäröi kaksi mustaa viivaa.
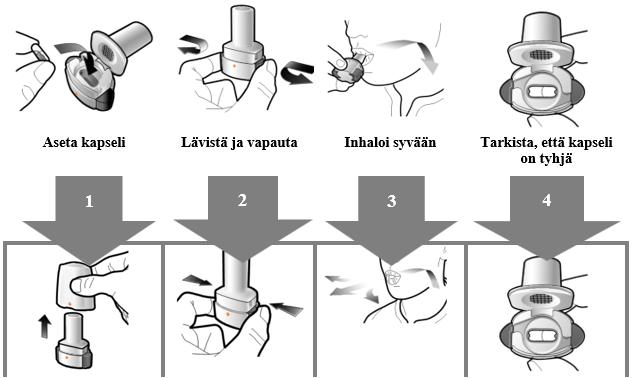
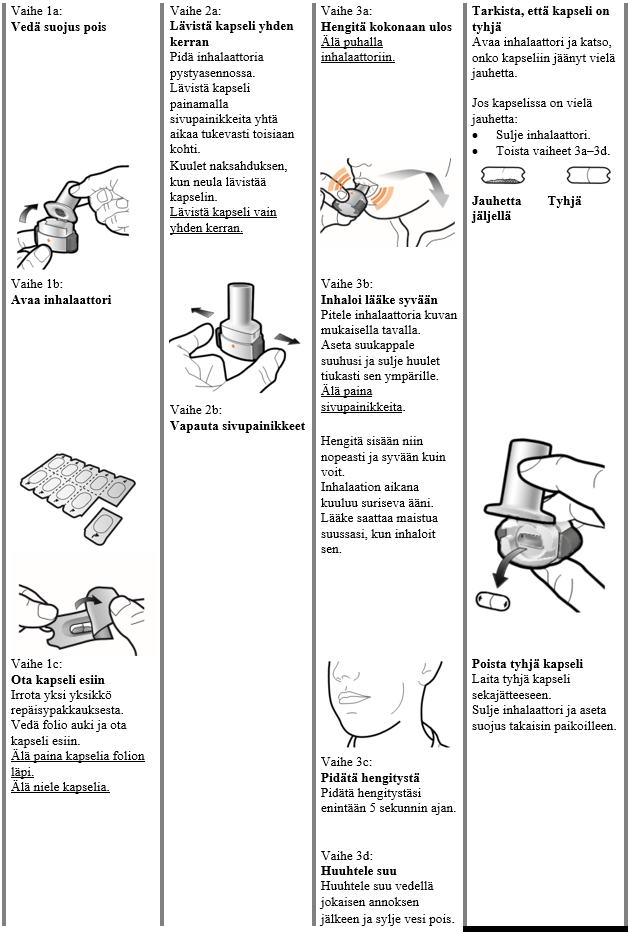
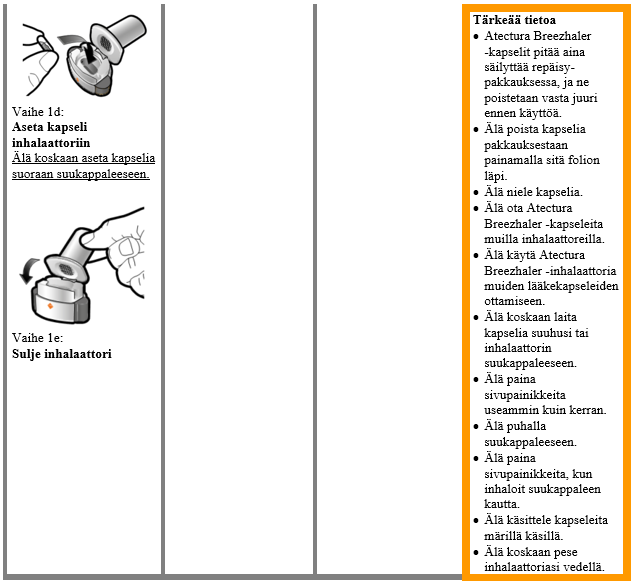
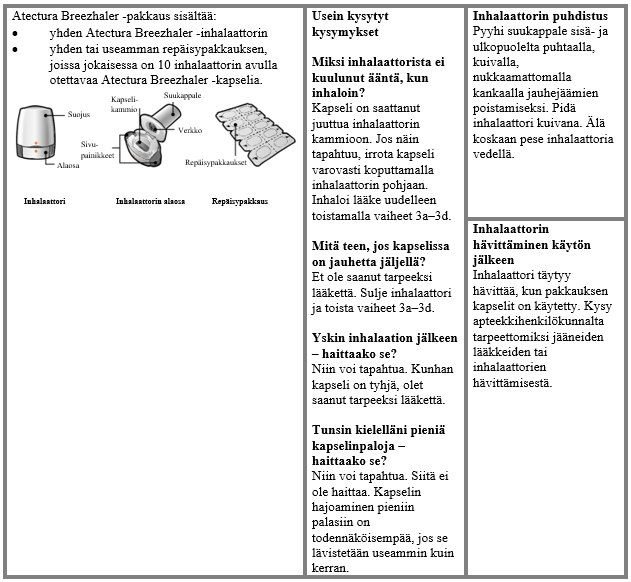
Käyttö- ja käsittelyohjeet
Potilaan tulee käyttää kunkin pakkauksen mukana toimitettavaa inhalaattoria. Jokaisen pakkauksen inhalaattori on hävitettävä, kun kaikki pakkauksen kapselit on käytetty.
Tämä lääkevalmiste voi aiheuttaa riskin ympäristölle (ks. kohta Prekliiniset tiedot turvallisuudesta).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Käsittely- ja käyttöohjeet
Lue Käyttöohjeet kokonaan ennen kuin käytät Atectura Breezhaler -valmistetta.
Korvattavuus
ATECTURA BREEZHALER inhalaatiojauhe, kapseli, kova
125/127,5 mikrog 30 x 1 fol
125/260 mikrog 30 x 1 fol
- Ei korvausta.
ATC-koodi
R03AK14
Valmisteyhteenvedon muuttamispäivämäärä
20.11.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
