GHEMAXAN injektioneste, liuos, esitäytetty ruisku 4000 IU (40 mg)/0,4 ml
Vaikuttavat aineet ja niiden määrät
10 000 IU/ml (100 mg/ml) injektioneste, liuos
Esitäytetyt ruiskut:
4 000 IU (40 mg) / 0,4 ml
Yksi esitäytetty ruisku sisältää enoksapariininatriumia 4 000 IU anti-Xa aktiviteettia (joka vastaa 40 mg:aa) 0,4 ml:ssa injektionesteisiin käytettävässä vedessä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Enoksapariininatrium on biologinen aine, jota saadaan emäksisellä depolymerisaatiolla hepariinin bentsyyliesteristä, joka on peräisin sian suolen limakalvosta.
Lääkemuoto
Injektioneste, liuos
Kirkas, väritön tai vaalean kellertävä liuos.
Kliiniset tiedot
Käyttöaiheet
Ghemaxan on tarkoitettu aikuisille:
- laskimoperäisen tromboembolisen sairauden profylaksia leikkauspotilaille, joiden riski on kohtalainen tai suuri, erityisesti potilaille, joille tehdään ortopedisia tai yleiskirurgisia toimenpiteitä, kuten syöpäleikkaus.
- laskimoperäisen tromboembolisen sairauden profylaksiaan liikuntarajoitteisille sisätautipotilaille, joilla on akuutti sairaus (kuten akuutti sydämen vajaatoiminta, hengitysvajaus, vaikea infektio tai reumatauti) ja suurentunut laskimotromboembolian riski.
- syvän laskimotromboosin ja keuhkoembolian hoitoon, lukuun ottamatta keuhkoemboliaa, jonka hoitaminen todennäköisesti edellyttää liuotushoitoa tai leikkausta.
- syvän laskimotromboosin ja keuhkoembolian pidennettyyn hoitoon ja niiden uusiutumisen ehkäisyyn aktiivista syöpää sairastaville potilaille.
- tromboosien ehkäisyyn elimistön ulkopuolisessa verenkierrossa hemodialyysin aikana.
-
akuutin sepelvaltimo-oireyhtymän yhteydessä:
- epästabiilin angina pectoriksen ja ST-nousuttoman infarktin (NSTEMI) hoitoon yhdessä suun kautta annettavan asetyylisalisyylihapon kanssa.
- akuutin ST-nousuinfarktin hoitoon (STEMI), mukaan lukien potilaat, joita hoidetaan lääkkeellisesti tai joille tehdään myöhemmin perkutaaninen sepelvaltimotoimenpide.
Annostus ja antotapa
Annostus
Laskimoperäisen tromboembolisen sairauden profylaksia leikkauspotilaille, joiden riski on kohtalainen tai suuri
-
Potilaskohtainen tromboemboliariski voidaan arvioida käyttämällä validoitua riskistratifikaatiomallia.
Suositeltu enoksapariininatriumannos on 2 000 IU (20 mg) injektiona ihon alle kerran vuorokaudessa, kun potilaan tromboemboliariski on kohtalainen. Preoperatiivisesti (2 tuntia ennen leikkausta) aloitettu hoito enoksapariininatriumin 2 000 IU:n (20 mg:n) annoksella on osoitettu tehokkaaksi ja turvalliseksi leikkauksissa, joihin liittyy kohtalainen riski.
Enoksapariininatriumhoitoa on jatkettava vähintään 7–10 päivän ajan riippumatta potilaan toipumisasteesta (esim. liikkumisesta), kun riski on kohtalainen. Profylaksiaa on jatkettava niin kauan, kun potilaan liikkumiskyky on merkittävästi alentunut. -
Suositeltu enoksapariininatriumannos on 4 000 IU (40 mg) injektiona ihon alle kerran vuorokaudessa, kun potilaan tromboemboliariski on suuri. Hoito aloitetaan mielellään 12 tuntia ennen leikkausta. Jos enoksapariininatriumhoidon profylaktinen aloittaminen katsotaan aiheelliseksi aiemmin kuin 12 tuntia ennen leikkausta (esim. lykättyä ortopedista leikkausta odottaville potilaille, joilla on suuri riski), viimeinen injektio on annettava viimeistään 12 tuntia ennen leikkausta ja hoitoa jatketaan 12 tunnin kuluttua leikkauksesta.
- Suurten ortopedisten leikkausten yhteydessä potilaille suositellaan pidennettyä tromboosiprofylaksiaa enintään 5 viikon ajan.
- Vatsan tai lantion alueen syöpäleikkauksissa, joissa laskimoperäisen tromboembolian riski on suuri, potilaille suositellaan pidennettyä tromboosiprofylaksiaa enintään 4 viikon ajan.
Laskimotromboembolian profylaksia sisätautipotilaille
Enoksapariininatriumin suositusannos on 4 000 IU (40 mg) injektiona ihon alle kerran vuorokaudessa. Enoksapariininatriumhoito määrätään vähintään 6–14 päiväksi riippumatta potilaan toipumisasteesta (esim. liikkumisesta). Yli 14 päivää kestävän hoidon hyötyä ei ole osoitettu.
Syvän laskimotromboosin ja keuhkoembolian hoito Enoksapariininatrium voidaan antaa injektiona ihon alle joko 150 IU/kg (1,5 mg/kg) kerran vuorokaudessa tai 100 IU/kg (1 mg/kg) kaksi kertaa vuorokaudessa. Lääkäri valitsee enoksapariinihoito-ohjelman yksilöllisen arvioinnin perusteella, johon sisältyy tromboembolia- ja verenvuotoriskin arvio. Hoitoa annoksella 150 IU/kg (1,5 mg/kg) kerran vuorokaudessa voidaan käyttää komplisoitumattomissa tapauksissa potilaille, joiden laskimotromboembolian uusiutumisen riski on pieni. Hoitoa annoksella 100 IU/kg (1 mg/kg) kaksi kertaa vuorokaudessa pitää käyttää kaikille muille potilaille, kuten ylipainoisille potilaille, potilaille, joilla on oireinen keuhkoembolia, syöpä, uusiutuva laskimotromboembolia tai proksimaalinen (lonkkalaskimon) tromboosi.
Enoksapariininatriumhoito määrätään keskimäärin 10 päiväksi. Oraalinen antikoagulanttihoito aloitetaan tarpeen mukaan (ks. kohta Enoksapariinin vaihtaminen oraaliseen antikoagulanttiin ja päinvastoin kohdan Annostus ja antotapa lopussa).
Syvän laskimotromboosin ja keuhkoembolian pidennetyssä hoidossa ja niiden uusiutumisen ehkäisyssä aktiivista syöpää sairastaville potilaille lääkärin on arvioitava huolellisesti potilaskohtainen tromboembolia- ja verenvuotoriski.
Suositeltu annos on 100 IU/kg (1 mg/kg) kaksi kertaa vuorokaudessa injektiona ihon alle 5–10 päivän ajan, minkä jälkeen jatketaan annostuksella 150 IU/kg (1,5 mg/kg) kerran vuorokaudessa injektiona ihon alle enintään 6 kuukauden ajan. Jatkuvan antikoagulanttihoidon hyöty on arvioitava uudelleen 6 hoitokuukauden jälkeen.
Tromboosien ehkäisy hemodialyysin aikana Suositeltu enoksapariininatriumannos on 100 IU/kg (1 mg/kg). Annos on pienennettävä 50 IU/kg:aan (0,5 mg/kg) (kahden verisuonen käyttömahdollisuus) tai 75 IU/kg:aan (0,75 mg/kg) (yhden verisuonen käyttömahdollisuus), kun potilaan verenvuotoriski on suuri.
Hemodialyysin aikana enoksapariininatrium on pistettävä dialyysikierron valtimolinjaan hoitoa aloitettaessa. Tämän annoksen teho on tavallisesti riittävä 4 tunnin hemodialyysissä, mutta jos esimerkiksi normaalia pidemmässä hemodialyysissä muodostuu fibriinirenkaita, voidaan antaa 50–100 IU/kg:n (0,5–1 mg/kg) lisäannos.
Tietoja ei ole saatavilla potilaista, jotka saavat enoksapariininatriumia joko profylaksiana tai hoitona hemodialyysien aikana.
Akuutin sepelvaltimo-oireyhtymän yhteydessä: Epästabiilin angina pectoriksen ja ST-nousuttoman infarktin (NSTEMI) sekä akuutin ST-nousuinfarktin hoito (STEMI)
- Hoidettaessa epästabiilia angina pectorista ja ST-nousutonta infarktia enoksapariininatriumin suositusannos on 100 IU/kg (1 mg/kg) 12 tunnin välein injektiona ihon alle yhdessä verihiutaleiden aggregaatiota estävien lääkkeiden kanssa. Hoitoa annetaan vähintään kahden vuorokauden ajan ja hoitoa jatketaan, kunnes potilaan tila on kliinisesti vakaa. Hoito kestää yleensä 2–8 päivää. Asetyylisalisyylihappoa suositellaan kaikille potilaille, joille se ei ole vasta-aiheista, suun kautta latausannoksella 150–300 mg (potilaille, jotka eivät ole aiemmin saaneet asetyylisalisyylihappoa) ja ylläpitoannoksella 75–325 mg/vrk pitkäkestoisesti hoitostrategiasta riippumatta. Akuutissa ST-nousuinfarktissa suositeltu enoksapariininatriumin annos on 3 000 IU:n (30 mg:n) kerta-annos laskimoboluksena ja lisäksi 100 IU/kg (1 mg/kg) injektiona ihon alle, minkä jälkeen jatketaan annostuksella 100 IU/kg (1 mg/kg) injektiona ihon alle 12 tunnin välein (kumpikin näistä kahdesta ensimmäisestä ihon alle annettavasta annoksesta saa olla enintään 10 000 IU (100 mg)). Samanaikaisesti on annettava verihiutaleiden aggregaatiota estävää hoitoa, kuten suun kautta annettavaa asetyylisalisyylihappoa (75–325 mg kerran vuorokaudessa), jollei se ole vasta-aiheista. Suositeltu hoidon kesto on 8 vuorokautta tai potilaan kotiuttamiseen asti sen mukaan, kumpi näistä tulee ensin. Yhdessä trombolyyttien (fibriinispesifisten tai ei-fibriinispesifisten) kanssa annettaessa enoksapariininatrium on annettava aikaisintaan 15 minuuttia ennen fibrinolyyttisen hoidon aloittamista ja viimeistään 30 minuuttia sen aloittamisen jälkeen.
- Annostus vähintään 75-vuotiaille potilaille, ks. kohta Iäkkäät potilaat.
- Potilaat, joille tehdään perkutaaninen sepelvaltimotoimenpide (PCI): Jos viimeisin ihon alle annettava enoksapariininatriumannos on annettu 8 tunnin sisällä ennen pallolaajennusta, lisäannoksia ei tarvita. Jos viimeisin ihon alle annettava annos on annettu yli 8 tuntia ennen pallolaajennusta, on annettava enoksapariininatriumia laskimoboluksena 30 IU/kg (0,3 mg/kg)
Pediatriset potilaat Enoksapariininatriumin turvallisuutta ja tehoa lasten hoidossa ei ole varmistettu.
Iäkkäät potilaat
Annosta ei ole tarpeen pienentää iäkkäille potilaille missään käyttöaiheessa, ST-nousuinfarktia lukuun ottamatta, ellei potilaalla ole munuaisten vajaatoimintaa (ks. jäljempänä kohta Munuaisten vajaatoiminta ja kohta Varoitukset ja käyttöön liittyvät varotoimet).
Akuutin ST-nousuinfarktin hoidossa vähintään 75-vuotiaille iäkkäille potilaille ei saa käyttää laskimobolusta. Hoito aloitetaan annoksella 75 IU/kg (0,75 mg/kg) ihon alle 12 tunnin välein (kumpikin näistä kahdesta ensimmäisestä ihon alle annettavasta annoksesta saa olla enintään 7 500 IU (75 mg) ja sen jälkeen ihon alle annettavat annokset ovat 75 IU/kg (0,75 mg/kg)). Annostus munuaisten vajaatoimintaa sairastaville iäkkäille potilaille, katso jäljempänä kohta Munuaisten vajaatoiminta ja kohta Varoitukset ja käyttöön liittyvät varotoimet.
Maksan vajaatoiminta
Maksan vajaatoimintaa sairastavista potilaista on saatavilla vähän tietoa (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka), joten varovaisuutta on noudatettava hoidettaessa näitä potilaita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka)
- Vaikea munuaisten vajaatoiminta:
Enoksapariinia ei suositella potilaille, joilla on loppuvaiheen munuaissairaus (kreatiniinipuhdistuma < 15 ml/min), koska tietoja tästä potilasryhmästä ei ole lukuun ottamatta tromboosien muodostumisen ehkäisyä elimistön ulkopuolisessa verenkierrossa hemodialyysin aikana.
Annokset potilaille, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma 15–30 ml/min):
| Käyttöaihe | Annostusohjelma |
| Laskimoperäisen tromboembolisen sairauden profylaksia | 2 000 IU (20 mg) ihon alle kerran vuorokaudessa |
| Syvän laskimotromboosin ja keuhkoembolian hoito | 100 IU/kg (1 mg/kg) ihon alle kerran vuorokaudessa |
| Syvän laskimotromboosin ja keuhkoembolian pidennetty hoito aktiivista syöpää sairastaville potilaille | 100 IU/kg (1 mg/kg) ihon alle kerran vuorokaudessa |
| Epästabiilin angina pectoriksen ja ST-nousuttoman infarktin hoito | 100 IU/kg (1 mg/kg) ihon alle kerran vuorokaudessa |
Akuutin ST-nousuinfarktin hoito (alle 75-vuotiaat potilaat) Akuutin ST-nousuinfarktin hoito (yli 75-vuotiaat potilaat) | 1 × 3 000 IU (30 mg) laskimoboluksena ja 100 IU/kg (1 mg/kg) ihon alle, tämän jälkeen 100 IU/kg (1 mg/kg) ihon alle 24 tunnin välein Aluksi ei laskimobolusta, 100 IU/kg (1 mg/kg) ihon alle, tämän jälkeen 100 IU/kg (1 mg/kg) ihon alle 24 tunnin välein |
Suositellut annosmuutokset eivät koske hemodialyysi-indikaatiota.
- Kohtalainen ja lievä munuaisten vajaatoiminta:
Vaikka annoksen muuttamista ei suositella potilailla, joilla on kohtalainen (kreatiniinipuhdistuma 30–50 ml/min) tai lievä (kreatiniinipuhdistuma 50–80 ml/min) munuaisten vajaatoiminta, tällaisten potilaiden huolellinen kliininen seuranta on suositeltavaa.
Antotapa
Ghemaxania ei saa antaa lihakseen. Enoksapariininatriumia annetaan injektiona ihon alle laskimoperäisen tromboembolisen sairauden profylaksiaan leikkauksen jälkeen sekä syvän laskimotromboosin ja keuhkoembolian hoitoon, syvän laskimotromboosin ja keuhkoembolian pidennettyyn hoitoon aktiivista syöpää sairastaville potilaille sekä, epästabiilin angina pectoriksen ja ST-nousuttoman infarktin hoitoon.
- Akuutin ST-nousuinfarktin hoito aloitetaan laskimobolusinjektiona kerta-annoksella, ja välittömästi sen jälkeen annetaan injektio ihon alle.
- Valmiste annetaan dialyysikierron valtimolinjaan tromboosien ehkäisemiseksi elimistön ulkopuolisessa verenkierrossa hemodialyysin aikana.
Esitäytetty ruisku on välittömästi käyttövalmis.
- Pistostekniikka ihon alle:
Injektio annetaan mieluiten potilaan ollessa makuuasennossa. Enoksapariininatrium annetaan syvänä ihonalaisena injektiona.
Kun käytät esitäytettyjä ruiskuja, älä poista ruiskusta ilmakuplia ennen injektiota, ettei osa lääkeannoksesta mene hukkaan. Jos pistettävän lääkkeen määrä on sovitettava potilaan painon mukaan, käytä mitta-asteikollisia esitäytettyjä ruiskuja, joista poistetaan ylimääräinen lääkeaine ennen injektion antoa niin, että ruiskussa on vaadittu lääkemäärä. Huomaa, että joissakin tapauksissa tarkan annoksen saavuttaminen ei ole mahdollista ruiskun mitta-asteikon vuoksi, ja tällöin lääkkeen määrä on pyöristettävä lähimpään mitta-asteikon viivaan.
Pistoskohtaa vatsanpeitteissä on vaihdeltava antero- tai posterolateraalisesti vasemman ja oikean puolen välillä. Neula työnnetään koko pituudeltaan kohtisuorassa ihopoimuun, jota pidetään kevyesti peukalon ja etusormen välissä. Ihopoimu pidetään koholla niin kauan, että injektio on annettu kokonaan. Pistoskohtaa ei saa hieroa injektion annon jälkeen.
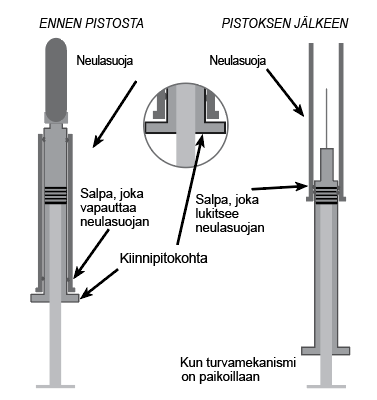
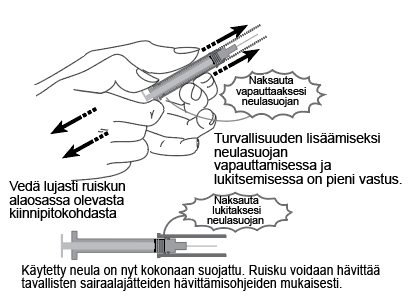
Huomaa: Niissä esitäytetyissä ruiskuissa, joissa on neulasuoja, turvamekanismi aktivoituu pistoksen antamisen jälkeen (katso käyttöohjeet kohdasta Käyttö- ja käsittelyohjeet).
Jos potilas antaa pistoksen itse, häntä on neuvottava noudattamaan tämän lääkkeen mukana tulevan pakkausselosteen ohjeita.
-
Laskimo (bolus)injektio (vain akuutin ST-nousuinfarktin hoidossa):
Akuutin ST-nousuinfarktin hoito aloitetaan laskimobolusinjektiona kerta-annoksena, ja välittömästi sen jälkeen annetaan injektio ihon alle. Kun valmiste annetaan injektiona laskimoon, voidaan käyttää joko moniannosinjektiopulloa tai esitäytettyä ruiskua. Enoksapariininatrium annetaan laskimolinjaan. Sitä ei pidä sekoittaa muihin lääkkeisiin tai antaa samanaikaisesti niiden kanssa. Enoksapariininatriumin ja muiden lääkkeiden mahdollisen sekoittumisen estämiseksi käyttöön valittu laskimolinja on puhdistettava huuhtelemalla riittävällä määrällä keittosuola- tai dekstroosiliuosta ennen enoksapariininatriumin laskimoboluksen antamista ja sen jälkeen portin puhdistamiseksi lääkkeestä. Enoksapariininatrium voidaan antaa turvallisesti fysiologisen keittosuolaliuoksen (0,9 %) tai dekstroosin 5-prosenttisen vesiliuoksen kanssa.- 3 000 IU (30 mg) aloitusbolus
Enoksapariininatriumin 3 000 IU:n (30 mg) aloitusboluksen antamista varten on käytettävä esitäytettyä mitta-asteikollista ruiskua. Ylimääräinen lääkeaine on poistettava, niin että ruiskuun jää vain 3 000 IU (30 mg) eli 0,3 ml. 3 000 IU:n (30 mg) annos voidaan sitten pistää suoraan laskimolinjaa.
- Lisäbolus perkutaanisen sepelvaltimotoimenpiteen yhteydessä, jos viimeisin ihon alle annettu annos on annettu yli 8 tuntia ennen pallolaajennusta.
Kun potilaalle tehdään perkutaaninen sepelvaltimotoimenpide, on annettava lisäksi 30 IU/kg:n (0,3 mg/kg) laskimobolus, jos viimeisin ihon alle annettu annos on annettu yli 8 tuntia ennen pallolaajennusta.
Pistettävän pienen, täsmällisen lääkeannoksen varmistamiseksi suositellaan, että lääke laimennetaan vahvuuteen 300 IU/ml (3 mg/ml).
Jos halutaan saada liuos, jonka vahvuus on 300 IU/ml (3 mg/mĺ), käyttämällä 6 000 IU (60 mg) enoksapariininatriumia sisältävää esitäytettyä ruiskua, on suositeltavaa käyttää 50 ml:n infuusiopussia (eli joko fysiologista suolaliuosta (0,9 %) tai dekstroosin 5-prosenttista vesiliuosta) seuraavasti: Poista ruiskulla 30 ml nestettä infuusiopussista ja heitä se pois. Pistä 6 000 IU (60 mg) enoksapariininatriumia sisältävän esitäytetyn ruiskun koko sisältö pussiin jäljelle jääneeseen 20 ml:aan liuosta. Sekoita pussin sisältö varovasti. Vedä ruiskuun tarvittava määrä laimennettua liuosta laskimolinjaan antamista varten.
Kun laimennettu lääkeliuos on valmis, pistettävä määrä voidaan laskea käyttämällä seuraavaa kaavaa [laimennetun liuoksen määrä (ml) = potilaan paino (kg) x 0,1] tai alla olevaa taulukkoa. Laimennus on suositeltavaa tehdä välittömästi ennen käyttöä.
Laskimolinjaan pistettävä määrä liuosta, joka on laimennettu pitoisuuteen 300 IU (3 mg)/ml.
| Paino | Tarvittava annos 30 IU/kg (0.3 mg/kg) | Pistettävä määrä lopulliseen pitoisuuteen 300 IU (3 mg)/ml laimentamisen jälkeen | |
| [kg] | IU | [mg] | [ml] |
| 45 | 1350 | 13,5 | 4,5 |
| 50 | 1500 | 15 | 5 |
| 55 | 1650 | 16,5 | 5,5 |
| 60 | 1800 | 18 | 6 |
| 65 | 1950 | 19,5 | 6,5 |
| 70 | 2100 | 21 | 7 |
| 75 | 2250 | 22,5 | 7,5 |
| 80 | 2400 | 24 | 8 |
| 85 | 2550 | 25,5 | 8,5 |
| 90 | 2700 | 27 | 9 |
| 95 | 2850 | 28,5 | 9,5 |
| 100 | 3000 | 30 | 10 |
| 105 | 3150 | 31,5 | 10,5 |
| 110 | 3300 | 33 | 11 |
| 115 | 3450 | 34,5 | 11,5 |
| 120 | 3600 | 36 | 12 |
| 125 | 3750 | 37,5 | 12,5 |
| 130 | 3900 | 39 | 13 |
| 135 | 4050 | 40,5 | 13,5 |
| 140 | 4200 | 42 | 14 |
| 145 | 4350 | 43,5 | 14,5 |
| 150 | 4500 | 45 | 15 |
- Valtimolinjan injektio:
Valmiste annetaan dialyysikierron valtimolinjaan tromboosien ehkäisemiseksi elimistön ulkopuolisessa verenkierrossa hemodialyysin aikana.
Siirtyminen enoksapariinista oraalisiin antikoagulantteihin ja päinvastoin
- Siirtyminen enoksapariinista K-vitamiinin antagonisteihin ja päinvastoin
Kliinistä seurantaa ja laboratoriotutkimuksia [INR-arvolla (International Normalized Ratio) ilmaistu protrombiiniaika] on tehostettava K-vitamiinin antagonistin vaikutuksen arvioimiseksi. Koska K-vitamiinin antagonisti saavuttaa huipputehonsa tietyn ajan kuluttua, enoksapariinihoitoa on jatkettava annosta muuttamatta niin kauan kuin on tarpeen, että INR-arvo pysyy käyttöaiheen mukaisella halutulla terapeuttisella alueella kahdessa peräkkäisessä testissä. Siirryttäessä K-vitamiinin antagonistista enoksapariiniin K-vitamiinin antagonistin antaminen lopetetaan ja ensimmäinen enoksapariininatriumannos annetaan, kun INR on laskenut viitealueen alapuolelle.
- Siirtyminen enoksapariinista suoriin oraalisiin antikoagulantteihin ja päinvastoin
Enoksapariinihoitoa saavien potilaiden kohdalla lopetetaan enoksapariininatriumin anto ja aloitetaan suoran oraalisen antikoagulantin anto 0–2 tuntia ennen ajankohtaa, jolloin seuraava enoksapariiniannos normaalisti annetaan ja jatketaan hoitoa suoran oraalisen antikoagulantin tuotetietojen mukaisesti.
Suoraa oraalista antikoagulanttia saavien potilaiden ensimmäinen enoksapariininatriumannos annetaan silloin, kun seuraava suoran oraalisen antikoagulantin annos normaalisti otetaan.
Annostelu spinaali-/epiduraalianestesian tai lannepiston yhteydessä
Jos lääkäri päättää antaa antikoagulanttihoitoa epiduraali- tai spinaalianestesian/analgesian tai lannepiston yhteydessä, suositellaan tarkkaa neurologista seurantaa neuraksiaalisen hematooman riskin vuoksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Profylaksiaan käytetyt annokset
Viimeisen profylaktisen enoksapariininatriumannoksen pistämisen ja neulan tai katetrin paikoilleen asettamisen välillä on pidettävä vähintään 12 tunnin pistosvapaa tauko. Jatkuvassa tekniikassa on pidettävä samanlainen vähintään 12 tunnin aikaväli ennen katetrin poistamista. Potilailla, joiden kreatiniinipuhdistuma on 15–30 ml/min, on harkittava neulan/katetrin paikalleen asettamisen tai poistamisen aikaviiveen kaksinkertaistamista vähintään 24 tuntiin. Enoksapariininatrium 2 000 IU (20 mg) esilääkitystä 2 tuntia ennen toimenpiteen aloitusta ei sovelleta neuraksiaalisessa anestesiassa.
- Hoitoon käytetyt annokset
Viimeisen kuratiivisen enoksapariininatriumannoksen pistämisen ja neulan tai katetrin paikoilleen asettamisen välillä on pidettävä vähintään 24 tunnin pistosvapaa tauko (ks. myös kohta Vasta-aiheet). Jatkuvassa tekniikassa on pidettävä samanlainen vähintään 24 tunnin aikaväli ennen katetrin poistamista. Potilailla, joiden kreatiniinipuhdistuma on 15–30 ml/min, on harkittava neulan/katetrin paikalleen asettamisen tai poistamisen aikaviiveen kaksinkertaistamista vähintään 48 tuntiin. Potilailla, jotka saavat kaksi annosta vuorokaudessa (75 IU/kg (0,75 mg/kg) kaksi kertaa vuorokaudessa tai 100 IU/kg (1 mg/kg) kaksi kertaa vuorokaudessa), toinen enoksapariininatriumannos on jätettävä väliin, jotta saadaan riittävä tauko ennen katetrin paikoilleen asettamista tai poistamista.
Anti-Xa-pitoisuuksia voidaan vielä havaita näinä ajankohtina eivätkä nämä viiveet takaa sitä, että neuraksiaaliselta hematoomalta vältyttäisiin. Niin ikään on harkittava vähintään 4 tunnin taukoa spinaali-/epiduraalipunktion tai katetrin poistamisen jälkeen, jonka aikana enoksapariininatriumia ei anneta. Viiveen pitää perustua hyöty-riskiarvioon, jossa on harkittu tromboosi- ja vuotoriskiä suhteessa toimenpiteeseen ja potilaan riskitekijöihin.
Vasta-aiheet
Enoksapariininatrium on vasta-aiheinen, jos:
- potilas on yliherkkä enoksapariininatriumille, hepariinille tai sen johdoksille sekä muille pienimolekyylisille hepariineille tai kohdassa Apuaineet mainituille apuaineille
- potilaalla on todettu immuunivälitteinen hepariinin aiheuttama trombosytopenia (HIT) viimeksi kuluneiden 100 päivän aikana tai vasta-aineita veressä (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet)
- potilaalla on aktiivinen kliinisesti merkittävä verenvuoto tai tila, johon liittyy suuri verenvuotoriski, kuten äskettäinen aivoverenvuodosta johtuva halvaus, maha-suolikanavan haavauma, pahanlaatuinen kasvain, johon liittyy suuri verenvuotoriski, äskettäinen aivo-, selkäydin- tai silmäleikkaus, todettu tai epäilty ruokatorven suonikohju, arteriovenoosinen epämuodostuma, aneurysma verisuonessa tai merkittävä epämuodostuma selkäydinkanavan tai aivojen verisuonistossa
- potilaalle on annettu spinaali- tai epiduraalianestesia tai paikallinen/alueellinen anestesia viimeksi kuluneiden 24 tunnin sisällä, kun enoksapariinia käytetään hoidolliseen tarkoitukseen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
- Yleistä
Enoksapariininatrium ei ole vaihdettavissa (yksikön vastaavuus yksikköä kohti) muihin pienimolekyylisiin hepariineihin. Nämä lääkevalmisteet poikkeavat toisistaan valmistustavan, molekyylipainojen, spesifisen anti-Xa- ja anti-II -aktiivisuuden, yksikköjen, annostuksen ja kliinisen tehon ja turvallisuuden suhteen. Tämä aiheuttaa eroja farmakokinetiikassa ja biologisessa aktiivisuudessa (esim. antitrombiiniaktiivisuus ja verihiutaleinteraktiot). Kunkin lääkevalmisteen käytössä on otettava huomioon sitä koskevat käyttöohjeet ja noudatettava niitä.
- Potilaalla aiemmin (yli 100 päivää sitten) ilmennyt hepariinin aiheuttama trombosytopenia(HIT)
Enoksapariininatriumin käyttö on vasta-aiheista potilaille, joilla on ollut immuunivälitteinen hepariinin aiheuttama trombosytopenia 100 edeltävän päivän aikana tai joiden veressä todetaan vasta-aineita (ks. kohta Vasta-aiheet). Vasta-aineet voivat säilyä verenkierrossa useita vuosia. Enoksapariininatriumia täytyy käyttää äärimmäistä varovaisuutta noudattaen potilaille, joilla on aikaisemmin (yli 100 päivää sitten) ilmennyt hepariinin aiheuttama trombosytopenia (HIT) ilman vasta-aineita verenkierrossa. Tällaisessa tapauksessa enoksapariininatriumin käyttämistä koskevan päätöksen täytyy perustua huolelliseen hyöty-riskiarviointiin eikä tällaista päätöstä saa tehdä ennen kuin muita hoitovaihtoehtoja (kuten danaparoidinatriumia tai lepirudiinia) on harkittu.
- Verihiutalemäärän seuranta
Syöpää sairastavilla potilailla, joiden verihiutalemäärä on alle 80 E9/l, antikoagulanttihoitoa voidaan harkita vain tapauskohtaisesti, ja huolellista seurantaa suositellaan.
Myös pienimolekyylisiin hepariineihin liittyy hepariinin indusoiman vasta-ainevälitteisen trombosytopenian riski. Jos trombosytopenia kehittyy, se ilmenee tavallisesti 5–21 päivän kuluttua enoksapariininatriumhoidon aloittamisesta. Hepariinin aiheuttaman trombosytopenian riski on suurentunut leikkauksen jälkeen erityisesti sydänleikkausten yhteydessä ja syöpäpotilailla. Siksi suositellaan verihiutalemäärän määrittämistä ennen enoksapariininatriumhoidon aloittamista ja sen jälkeen säännöllisesti hoidon aikana. Verihiutalemäärä on mitattava, jos potilaan kliiniset oireet viittaavat hepariinin aiheuttamaan trombosytopeniaan (uusi valtimo- ja/tai laskimotromboembolia, kivulias ihovaurio pistokohdassa, hoidon aiheuttama allerginen tai anafylaktinen reaktio). Potilaiden on oltava tietoisia tällaisten oireiden mahdollisuudesta, ja niiden mahdollisesti ilmaantuessa heidän on otettava yhteyttä lääkäriin. Enoksapariininatriumhoito täytyy käytännössä välittömästi keskeyttää ja potilas siirtää muuhun, ei-hepariinipohjaiseen antikoagulanttihoitoon, jos verihiutalemäärän todetaan laskeneen merkittävästi (30–50 % lähtöarvosta).
-
Verenvuoto
Kuten muillakin antikoagulanteilla, vuotoa saattaa ilmetä kaikissa kohde-elimissä. Jos vuotoa ilmenee, sen alkuperä on selvitettävä ja on aloitettava asianmukainen hoito. Enoksapariininatriumia, kuten muitakin antikoagulantteja, pitää käyttää varoen sairaustiloissa, joissa vuotomahdollisuus on lisääntynyt. Tällaisia tiloja ovat:- heikentynyt hemostaasi
- aikaisempi peptinen haavauma
- äskettäinen aivoinfarkti
- vaikea kohonnut valtimoverenpaine
- äskettäinen diabeettinen retinopatia
- neurokirurginen tai silmän leikkaus
- samanaikainen käyttö hemostaasiin vaikuttavien lääkkeiden kanssa (ks. kohta Yhteisvaikutukset).
-
Laboratoriokokeet
Laskimotromboembolian ehkäisemiseksi käytettävinä annoksina enoksapariininatrium ei vaikuta vuotoaikaan eikä yleisiin veren hyytymiskokeisiin merkittävästi, eikä se myöskään vaikuta trombosyyttiaggregaatioon eikä fibrinogeenin sitoutumiseen trombosyytteihin. Suurempia annoksia käytettäessä APTT (aktivoitu partiaalinen tromboplastiiniaika) ja ACT (aktivoitu hyytymisaika) voivat pidentyä. APTT:n ja ACT:n pidentyminen ei korreloi lineaarisesti enoksapariininatriumin antitromboottisen vaikutuksen kanssa, eivätkä ne siksi ole sopivia eivätkä luotettavia enoksapariinin aktiivisuuden seurantamittareita.
- Spinaali-/epiduraalianestesia tai lannepisto Spinaali/epiduraalianestesiaa tai lannepistoa ei saa antaa 24 tunnin sisällä terapeuttisella annoksella annetusta enoksapariininatriumista (ks. myös kohta Vasta-aiheet). Joissakin tapauksissa enoksapariininatriumin samanaikaiseen käyttöön epiduraalisen tai spinaalisen anestesian tai lannepiston kanssa liittyi neuraksiaalinen hematooma, joka johti pitkäaikaiseen tai pysyvään halvaukseen. Nämä tapahtumat ovat harvinaisia, kun enoksapariininatriumin annos on korkeintaan 4 000 IU (40 mg) kerran vuorokaudessa. Näiden tapahtumien riski suurenee, kun käytetään leikkauksen jälkeen paikalleen jätettävää epiduraalista katetria, yhteiskäytössä hemostaasiin vaikuttavien lisälääkkeiden, kuten tulehduskipulääkkeiden (NSAID) kanssa, traumaattisen tai toistuvan punktion yhteydessä tai potilailla, joille on tehty selkäleikkaus tai joilla on todettu selkärangan epämuodostuma.
Enoksapariininatriumin farmakokineettinen profiili on otettava huomioon, kun suunnitellaan enoksapariininatriumin käyttöä epiduraali- tai spinaalianestesian/kivunlievityksen tai lannepiston yhteydessä, jotta samanaikaiseen käyttöön liittyvä vuotoriski voidaan minimoida (ks. kohta Farmakokinetiikka). Epiduraalikatetrin asettaminen ja poisto tai lannepisto kannattaa tehdä silloin, kun enoksapariininatriumin antikoagulaatiovaikutus on pieni. Riittävän pienen antikoagulaatiovaikutuksen saavuttamiseen tarvittavaa tarkkaa potilaskohtaista aikaa ei kuitenkaan tunneta. Potilailla, joiden kreatiniinipuhdistuma on 15–30 ml/min, on syytä käyttää erityistä harkintaa, sillä enoksapariininatriumin poistuminen on heillä hitaampaa (ks. kohta Annostus ja antotapa).
Lääkärin päätös antaa antikoagulanttihoitoa epiduraali-/spinaalianestesian tai lannepiston yhteydessä edellyttää tiheää seurantaa, jotta havaitaan neurologisen heikentymisen oireet ja merkit, kuten keskilinjan selkäkipu, tunto- ja liikepuutokset (alaraajojen puutuminen tai heikkous) ja suolen ja/tai rakon toimintahäiriöt. Potilaita on neuvottava ilmoittamaan heti, jos jokin edellä mainituista merkeistä tai oireista ilmaantuu. Jos epäillään spinaalihematooman merkkejä tai oireita, kiireellinen diagnoosi ja hoito, mukaan lukien selkäytimen dekompression harkinta, on välttämätöntä, vaikka näillä toimenpiteillä ei ehkä voida estää tai kumota neurologisia vaurioita.
- Ihonekroosi /ihovaskuliitti
Pienimolekyylisten hepariinien käytön yhteydessä on raportoitu ihonekroosia ja ihovaskuliittia. Hoito on viipymättä keskeytettävä, jos niitä ilmenee
- Perkutaaniset sepelvaltimoiden revaskularisaatiotoimenpiteet
Epästabiilin angina pectoriksen, ST-nousuttoman infarktin ja akuutin ST-nousuinfarktin hoidon aikana tehdyn verisuonitoimenpiteen jälkeen verenvuotoriskin minimoimiseksi enoksapariininatriuminjektioiden annostelussa pitää noudattaa tarkasti suositeltuja annosvälejä. On tärkeää saavuttaa hemostaasi pistoskohdassa perkutaanisen sepelvaltimotoimenpiteen jälkeen. Vaippakatetri voidaan poistaa välittömästi, jos sulkemiseen on käytetty apuvälinettä. Vaippakatetri pitää poistaa 6 tunnin kuluttua viimeisen laskimoon tai ihon alle annetun enoksapariininatriuminjektion jälkeen, kun käytetään manuaalista puristusta. Jos hoitoa enoksapariininatriumilla jatketaan, seuraava aikataulun mukainen annos annetaan vasta 6–8 tunnin kuluttua vaippakatetrin poistamisesta. Toimenpidekohtaa pitää tarkkailla verenvuodon merkkien tai hematooman varalta.
- Akuutti infektioendokardiitti
Aivoverenvuodon riskin vuoksi hepariinin käyttöä ei yleensä suositella potilaille, joilla on akuutti infektioendokardiitti. Hoitopäätös on tehtävä vasta huolellisen yksilöllisen hyöty-riskiarvioinnin jälkeen, jos hepariinin käyttö katsotaan ehdottoman välttämättömäksi.
- Mekaaniset sydämen tekoläpät
Enoksapariininatriumin käyttöä tromboosiprofylaksiaan ei ole riittävästi tutkittu potilailla, joilla on mekaaninen sydämen tekoläppä. Yksittäisiä sydämen tekoläpän trombooseja on raportoitu potilailla, joilla oli mekaaninen sydämen tekoläppä ja jotka saivat tromboosiprofylaksiaan enoksapariininatriumia. Sekoittavat tekijät, kuten perussairaus ja riittämättömät kliiniset tiedot, hankaloittavat näiden tapausten arviointia. Joissakin tapauksissa kyse oli raskaana olevista naisista, joilla tromboosi johti sekä äidin että sikiön kuolemaan.
- Raskaana olevat naiset, joilla on mekaaninen sydämen tekoläppä
Enoksapariininatriumin käyttöä tromboosiprofylaksiaan raskaana oleville naisille, joilla on sydämen mekaaninen tekoläppä, ei ole riittävästi tutkittu. Kliinisessä tutkimuksessa raskaana oleville naisille, joilla oli mekaaninen sydämen tekoläppä, annettiin enoksapariininatriumia (100 IU/kg (1 mg/kg) kaksi kertaa vuorokaudessa) tromboembolian riskin vähentämiseksi. Tutkimuksessa kahdelle naiselle kahdeksasta kehittyi hyytymiä, mikä johti läpän tukkeutumiseen ja äidin ja sikiön kuolemaan. Markkinoille tulon jälkeisessä seurannassa on raportoitu yksittäisiä läpän trombooseja raskaana olevilla naisilla, joilla on mekaaninen sydämen tekoläppä ja jotka saavat tromboosiprofylaksiaan enoksapariininatriumia. Tromboembolian riski saattaa olla suurempi raskaana olevilla naisilla, joilla on mekaaninen sydämen tekoläppä.
- Iäkkäät potilaat
Lisääntynyttä verenvuototaipumusta ei havaittu iäkkäillä potilailla, kun käytettiin profylaktisia annoksia. Iäkkäillä potilailla (erityisesti yli 80-vuotiailla) verenvuotokomplikaatioiden riski saattaa olla suurentunut, kun käytetään terapeuttisia annoksia. Yli 75-vuotiailla ST-nousuinfarktin vuoksi hoidetuilla potilailla suositellaan tarkkaa kliinistä seurantaa ja annoksen pienentämistä voidaan harkita (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
- Munuaisten vajaatoiminta
Enoksapariininatriumaltistus suurenee potilailla, joilla on munuaisten vajaatoimintaa, mikä suurentaa verenvuotoriskiä. Näiden potilaiden huolellista kliinistä seurantaa suositellaan, ja biologista seurantaa anti-Xa-aktiivisuutta mittaamalla voi olla aiheellista harkita (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Enoksapariininatriumia ei suositella potilaille, jolla on loppuvaiheen munuaissairaus (kreatiniinipuhdistuma < 15 ml/min), koska tietoja tästä potilasryhmästä ei ole lukuun ottamatta tromboosien ehkäisyä elimistön ulkopuolisessa verenkierrossa hemodialyysin aikana. Potilaille, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma 15–30 ml/min), suositellaan sekä terapeuttisten että profylaktisten annosten sovittamista, koska enoksapariininatriumaltistus suurenee merkittävästi (ks. kohta Annostus ja antotapa). Annoksen sovittamista ei suositella potilaille, joilla on kohtalainen (kreatiniinipuhdistuma 30–50 ml/min) tai lievä (kreatiniinipuhdistuma 50–80 ml/min) munuaisten vajaatoiminta.
- Maksan vajaatoiminta
Enoksapariininatriumia on käytettävä varoen potilaille, joilla on maksan vajaatoiminta, suurentuneen verenvuodon mahdollisuuden vuoksi. Anti-Xa-aktiivisuuden mittaaminen maksakirroosia sairastavilta potilailta on epäluotettavaa eikä siihen perustuvaa annoksen muuttamista suositella (ks. kohta Farmakokinetiikka).
- Pienipainoiset potilaat
Pienipainoisten naisten (< 45 kg) ja pienipainoisten miesten (< 57 kg) enoksapariininatriumaltistus suureni profylaktisia (ei painon suhteen korjattuja) annoksia käytettäessä, mikä saattaa suurentaa verenvuotoriskiä. Siksi näiden potilaiden huolellista kliinistä seurantaa suositellaan (ks. kohta Farmakokinetiikka).
- Ylipainoiset potilaat
Ylipainoisten potilaiden tromboemboliariski on suurentunut. Profylaktisten annosten turvallisuutta ja tehoa ylipainoisten potilaiden (painoindeksi > 30 kg/m2) hoidossa ei ole täysin selvitetty eikä annoksen säätämistarpeesta ole saavutettu yhteisymmärrystä. Näitä potilaita on seurattava huolellisesti tromboembolian merkkien ja oireiden varalta.
- Hyperkalemia
Hepariinit voivat lamata lisämunuaisten aldosteronin eritystä, mikä johtaa hyperkalemiaan (ks. kohta Haittavaikutukset), erityisesti esimerkiksi potilailla, joilla diabetes, krooninen munuaisten vajaatoiminta tai aiempi metabolinen asidoosi tai jotka käyttävät lääkevalmisteita, joiden tiedetään lisäävän kaliumpitoisuutta (ks. kohta Yhteisvaikutukset). Plasman kaliumpitoisuutta on seurattava säännöllisesti varsinkin potilailla, joilla hyperkalemian riski on suurentunut.
- Jäljitettävyys
Pienimolekyyliset hepariinit ovat biologisia lääkevalmisteita. Pienimolekyylisten hepariininien jäljitettävyyden parantamiseksi suositellaan, että terveydenhuollon ammattilaiset kirjaavat potilaskertomukseen potilaalle annetun valmisteen kauppanimen ja eränumeron.
- Natriumpitoisuus
Tämä valmiste sisältää natriumia vähemmän kuin 1 mmol annosta kohden eli se on käytännössä natriumiton.
- Akuutti yleistynyt eksantematoottinen pustuloosi
Enoksapariinihoidon yhteydessä on ilmoitettu akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP), jonka yleisyys on tuntematon. Valmisteen määräämisen yhteydessä potilaille on kerrottava tämän tilan merkeistä ja oireista, ja heidän vointiaan on seurattava huolellisesti ihoreaktioiden varalta. Jos tällaisiin reaktioihin viittaavia merkkejä ja oireita ilmenee, enoksapariinihoito on keskeytettävä välittömästi ja vaihtoehtoista hoitoa on harkittava (jos se on tarpeen).
Yhteisvaikutukset
Samanaikaista käyttöä ei suositella:
- Hemostaasiin vaikuttavat lääkkeet (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Suositellaan, että joidenkin hemostaasiin vaikuttavien lääkkeiden käyttö lopetetaan ennen enoksapariininatriumhoidon aloittamista, ellei niiden käyttö ole välttämätöntä. Jos yhdistelmähoito on aiheellista, enoksapariininatriumia pitää käyttää varoen, ja potilaan huolellisesta kliinisestä ja laboratorioseurannasta on huolehdittava tarpeen mukaan. Näitä lääkeaineita ovat esimerkiksi:
- systeemiset salisylaatit, asetyylisalisyylihappo anti-inflammatorisina annoksina ja tulehduskipulääkkeet, mukaan lukien ketorolaakki
- muut trombolyytit (esim. alteplaasi, reteplaasi, streptokinaasi, tenekteplaasi, urokinaasi) ja antikoagulantit (ks. kohta Annostus ja antotapa).
Samanaikainen käyttö varovaisuutta noudattaen:
Seuraavia lääkevalmisteita voidaan käyttää varovaisuutta noudattaen samanaikaisesti enoksapariininatriumin kanssa:
-
Muut hemostaasiin vaikuttavat lääkkeet, kuten:
- trombosyyttiaggregaation estäjät, kuten aggregaatiota estävällä annoksella käytetty asetyylisalisyylihappo (sydäntä suojaamaan), klopidogreeli, tiklopidiini ja akuutin sepelvaltimo oireyhtymän hoitoon käytetyt glykoproteiini IIb/IIIa antagonistit niihin liittyvän verenvuotoriskin vuoksi
- Dekstraani 40
- Systeemiset glukokortikoidit
- Veren kaliumpitoisuutta suurentavat lääkevalmisteet:
Veren kaliumpitoisuutta suurentavia lääkevalmisteita voidaan käyttää samanaikaisesti enoksapariininatriumin kanssa, mutta tällöin potilaan huolellinen kliininen ja laboratorioseuranta on tarpeen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Raskaus ja imetys
Raskaus
Ei ole näyttöä siitä, että enoksapariini läpäisee ihmisen istukan toisen ja kolmannen raskauskolmanneksen aikana. Ensimmäistä raskauskolmannesta koskevia tietoja ei ole saatavilla. Eläinkokeet eivät ole osoittaneet fetaalista toksisuutta tai teratogeenisuutta (ks. kohta Prekliiniset tiedot turvallisuudesta). Eläinkokeista saadut tiedot ovat osoittaneet, että enoksapariininatriumin kulkeutuminen istukan läpi sikiöön on erittäin vähäistä. Enoksapariininatriumia voi käyttää raskauden aikana ainoastaan, jos lääkäri on todennut selvän tarpeen.
Enoksapariinia saavia raskaana olevia naisia on seurattava huolellisesti verenvuotojen tai liiallisen antikoagulaation merkkien varalta ja varoitettava verenvuotoriskistä. Kaiken kaikkiaan tällä hetkellä saatavilla olevan tiedon perusteella ei ole näyttöä lisääntyneestä verenvuotojen, trombosytopenian tai osteoporoosin riskistä verrattuna ei-raskaana olevilla naisilla todettuun riskiin, lukuun ottamatta sellaisten raskaana olevien naisten riskiä, joilla on sydämen tekoläppä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Jos epiduraalianestesiaa on suunniteltu, suositellaan enoksapariininatriumhoidon keskeyttämistä sitä ennen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Imetys
Ei tiedetä, erittyykö muuttumaton enoksapariini ihmisen rintamaitoon. Enoksapariinin ja sen metaboliittien kulkeutuminen imettävien rottien maitoon on ollut hyvin vähäistä. Suun kautta otetun enoksapariininatriumin imeytyminen on epätodennäköistä. Ghemaxania voidaan käyttää imetyksen aikana.
Hedelmällisyys
Enoksapariininatriumin vaikutuksista hedelmällisyyteen ei ole kliinistä tietoa. Eläinkokeissa ei ole todettu vaikutuksia hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Enoksapariininatriumilla ei ole haitallista vaikutusta ajokykyyn tai koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Enoksapariininatriumia on tutkittu yli 15 000 potilaalla, jotka saivat enoksapariininatriumia kliinisissä tutkimuksissa, joissa sitä verrattiin vertailuvalmisteeseen. Tutkittavista 1 776 sai sitä syvän laskimotromboosin profylaksiaan ortopedisen tai vatsan alueen kirurgian yhteydessä, kun potilailla on suuri tromboembolisten komplikaatioiden riski. Enoksapariininatriumia annettiin syvän laskimotromboosin profylaksiaan 1 169 sisätautipotilaalle, joilla oli akuutti sairaus, johon liittyi vaikea liikuntarajoitteisuus. Potilaista 559 sai hoitoa syvään laskimotromboosiin, johon saattoi liittyä keuhkoembolia, 1 578 potilasta sai hoitoa epästabiiliin angina pectorikseen ja non-Q-aaltoinfarktiin ja 10 176 potilasta akuuttiin ST-nousuinfarktiin.
Enoksapariininatriumin annostusohjelma vaihteli kliinisissä tutkimuksissa käyttöaiheen mukaan. Enoksapariininatriumannos oli 4 000 IU (40 mg) ihon alle kerran vuorokaudessa, kun kyseessä oli syvän laskimotromboosin profylaksia leikkauksen yhteydessä, tai sisätautipotilailla, joilla oli akuutti sairaus, johon liittyi vaikeaa liikuntarajoitteisuutta. Hoidettaessa syvää laskimotromboosia, johon saattoi liittyä keuhkoembolia, potilaat saivat enoksapariininatriumia joko 100 IU/kg (1 mg/kg) ihon alle 12 tunnin välein tai 150 IU/kg (1,5 mg/kg) ihon alle kerran vuorokaudessa. Kliinisissä tutkimuksissa epästabiilin angina pectoriksen ja non-Q-aaltoinfarktin hoidossa annokset olivat 100 IU/kg (1 mg/kg) ihon alle 12 tunnin välein ja kliinisessä tutkimuksessa, jossa hoidettiin akuuttia ST-nousuinfarktia, enoksapariininatriumin annostus oli laskimoboluksena 3 000 IU (30 mg), ja sen jälkeen 100 IU/kg (1 mg/kg) ihon alle 12 tunnin välein.
Kliinisissä tutkimuksissa yleisimmin raportoituja haittavaikutuksia olivat verenvuodot, trombosytopenia ja trombosytoosi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet ja Valikoitujen haittavaikutusten kuvaus jäljempänä).
Enoksapariinin turvallisuusprofiili syvän laskimotromboosin ja keuhkoembolian pidennetyssä hoidossa aktiivista syöpää sairastaville potilaille on samanlainen kuin sen turvallisuusprofiili syvän laskimotromboosin ja keuhkoembolian hoidossa.
Enoksapariinihoidon yhteydessä on ilmoitettu akuuttia yleistynyttä eksantematoottista pustuloosia (AGEP) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Taulukkomuotoinen yhteenveto haittavaikutuksista
Muita kliinisissä tutkimuksissa havaittuja ja myyntiluvan jälkeisessä käytössä todettuja haittavaikutuksia (* viittaa myyntiluvan myöntämisen jälkeen havaittuihin reaktioihin) on lueteltu seuraavassa taulukossa.
Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin). Haittavaikutukset on esitetty kussakin elinjärjestelmässä haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Veri ja imukudos
- Yleinen: verenvuoto, verenvuodon aiheuttama anemia*, trombosytopenia, trombosytoosi
- Harvinainen: eosinofilia*
- Harvinainen: immunologis-allerginen trombosytopenia, johon liittyy tromboosi. Joissakin tapauksissa tromboosiin liittyi komplikaationa elimen infarkti tai raajan iskemia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Immuunijärjestelmä
- Yleinen: allerginen reaktio
- Harvinainen: anafylaktiset/anafylaktoidit reaktiot, shokki mukaan lukien*
Hermosto
- Yleinen: päänsärky*
Verisuonisto
- Harvinainen: spinaalinen hematooma* (tai neuraksinaalinen hematooma). Nämä haittavaikutukset ovat aiheuttaneet eriasteisia neurologisia vaurioita, kuten pitkäkestoista tai pysyvää halvaantumista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Maksa ja sappi
- Hyvin yleinen: maksaentsyymien määrän lisääntyminen (pääasiassa transaminaasiarvot yli kolminkertaiset viitealueen ylärajaan nähden)
- Melko harvinainen: maksasoluvaurio*
Harvinainen: kolestaattinen maksavaurio*
Iho ja ihonalainen kudos
- Yleinen: urtikaria, kutina, eryteema
- Melko harvinainen: rakkulainen ihottuma
- Harvinainen: alopesia*
- Harvinainen: ihovaskuliitti*, ihonekroosi*, tavallisesti pistoskohdassa (näitä ilmiöitä edeltää tavallisesti purppura tai erytematoottiset infiltroituneet ja kivuliaat paukamat).
Injektiokohdan kyhmyt* (inflammatoriset kyhmyt, jotka eivät ole kystaan koteloitunutta enoksapariinia). Ne häviävät muutaman päivän kuluttua, eikä hoitoa tarvitse niiden vuoksi lopettaa.
- Tuntematon: akuutti yleistynyt eksantematoottinen pustuloosi (AGEP)
Luusto, lihakset ja sidekudos
- Harvinainen: osteoporoosi* pitkäaikaisen (yli 3 kuukauden) käytön jälkeen
Yleisoireet ja antopaikassa todettavat haitat
- Yleinen: pistoskohdan hematooma, pistoskohdan kipu, muu pistoskohdan reaktio (esimerkiksi turvotus, verenvuoto, yliherkkyys, tulehdus, kyhmy, kipu tai muu reaktio)
- Melko harvinainen: paikallinen ärsytys, ihonekroosi pistoskohdassa
Tutkimukset
- Harvinainen: hyperkalemia* (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
Valikoitujen haittavaikutusten kuvaus
Verenvuodot
Näihin sisältyivät merkittävät verenvuodot, joita on raportoitu enimmillään 4,2 %:lla potilaista (leikkauspotilaat). Jotkin näistä tapauksista ovat olleet fataaleja. Leikkauspotilailla verenvuotokomplikaatiot luokiteltiin merkittäviksi verenvuodoiksi: (1) jos verenvuoto aiheutti merkittävän kliinisen tapahtuman, tai (2) jos siihen liittyi hemoglobiinin lasku ≥ 2 g/dl tai kahden tai useamman verivalmisteyksikön siirto. Retroperitoneaalinen tai kallonsisäinen verenvuoto arvioitiin aina merkittäväksi. Kuten muillakin antikoagulanteilla, verenvuotoa voi ilmetä, kun potilaalla on siihen liittyviä riskitekijöitä, joita ovat esimerkiksi elinten vuotoherkät vauriot, invasiiviset toimenpiteet tai hemostaasiin vaikuttavat lääkkeet (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset).
| Elinjärjestelmä | Profylaksia leikkauspotilailla | Profylaksia sisätautipotilailla | Sellaisten potilaiden hoito, joilla on syvä laskimotromboosi ja mahdollisesti keuhkoembolia | Syvän laskimo-tromboosin ja keuhko-embolian pidennetty hoito aktiivista syöpää sairastaville potilaille | Sellaisten potilaiden hoito, joilla on epästabiili angina pectoris ja non-Q-aaltoinfarkti | Sellaisten potilaiden hoito, joilla on akuutti ST-nousuinfarkti |
| Veri ja imukudos | Hyvin yleinen: Verenvuoto a Harvinainen: Retroperitoneaalinen verenvuoto | Yleinen: Verenvuoto a | Hyvin yleinen: Verenvuoto a Melko harvinainen: Kallonsisäinen verenvuoto, retroperitoneaalinen verenvuoto | Yleinenb: verenvuoto | Yleinen: Verenvuoto a Harvinainen: Retroperitoneaalinen verenvuoto | Yleinen: Verenvuoto a Melko harvinainen: Kallonsisäinen verenvuoto, retroperitoneaalinen verenvuoto |
a: esimerkiksi hematooma, mustelma muualla kuin pistoskohdassa, haavahematooma, verivirtsaisuus, nenäverenvuoto ja maha-suolikanavan verenvuoto.
b: esiintymistiheys perustuu 3 526 potilasta käsittäneestä rekisteristä tehtyyn retrospektiiviseen tutkimukseen (ks. kohta Farmakodynamiikka).
Trombosytopenia ja trombosytoosi
| Elinjärjestelmä | Profylaksia leikkauspotilailla | Profylaksia sisätautipotilailla | Sellaisten potilaiden hoito, joilla on syvä laskimotromboosi ja mahdollisesti keuhkoembolia | Syvän laskimo-tromboosin ja keuhko-embolian pidennetty hoito aktiivista syöpää sairastaville potilaille | Sellaisten potilaiden hoito, joilla on epästabiili angina pectoris ja non-Q-aaltoinfarkti | Sellaisten potilaiden hoito, joilla on akuutti ST-nousuinfarkti |
| Veri ja imukudos | Hyvin yleinen: Trombosytoosi* Yleinen: Trombosytopenia | Melko harvinainen: Trombosytopenia | Hyvin yleinen: Trombosytoosi* Yleinen: Trombosytopenia | Tuntematon: Trombo- sytopenia | Melko harvinainen: Trombosytopenia | Yleinen: Trombosytoosi* Trombosytopenia Hyvin harvinainen: Immunoallerginen trombosytopenia |
*: verihiutaleiden määrän lisääntyminen > 400 g/l
Pediatriset potilaat Enoksapariininatriumin turvallisuutta ja tehoa lasten hoidossa ei ole varmistettu (ks. kohta Annostus ja antotapa).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle: www-sivusto: www.fimea.fi Lääkealan turvallisuus -ja kehittämiskeskus Fimea Lääkkeiden haittavaikutusrekisteri PL 55 00034 FIMEA
Yliannostus
Merkkejä ja oireita
Vahingossa tapahtunut laskimoon, elimistön ulkopuoliseen verenkiertoon tai ihon alle annettu enoksapariininatriumyliannostus saattaa johtaa verenvuotokomplikaatioihin. Suurtenkin oraalisten annosten jälkeen on epätodennäköistä, että enoksapariininatriumin imeytymistä tapahtuu.
Hoito
Antikoaguloivat vaikutukset voidaan suurelta osin neutraloida antamalla laskimoon hitaasti protamiinia. Protamiinin annos riippuu injisoidusta enoksapariininatriumin annoksesta: 1 mg protamiinia neutraloi enoksapariininatriumin 100 IU:n (1 mg:n) annoksen aiheuttaman antikoagulanttivaikutuksen, jos enoksapariininatrium on annettu edeltävien 8 tunnin aikana. Protamiinia voidaan antaa infuusiona 0,5 mg / 1 mg enoksapariininatriumia, jos enoksapariininatrium on annettu yli 8 tuntia ennen protamiinin antoa tai jos toisen protamiiniannoksen antaminen arvioidaan tarpeelliseksi. Jos enoksapariininatriuminjektiosta on jo kulunut 12 tuntia, protamiinin anto ei välttämättä ole tarpeen. Suuretkaan protamiiniannokset eivät kuitenkaan pysty koskaan täysin neutraloimaan enoksapariininatriumin anti-Xa-aktiivisuutta (enintään noin 60 %) (ks. protamiinisuolojen valmisteyhteenvedot).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antitromboottiset lääkeaineet, hepariiniryhmä, ATC-koodi: B01AB05
Farmakodynaamiset vaikutukset
Enoksapariini on pienimolekyylinen hepariini, jonka keskimääräinen molekyylipaino on noin 4 500 daltonia ja johon on liitetty tavallisen hepariinin antitromboottisia ja antikoagulanttiaktiivisuuksia. Lääkeaine on natriumsuola.
Puhdistetussa in vitro järjestelmässä enoksapariininatriumilla on voimakas anti-Xa-aktiivisuus (noin 100 IU/mg) ja heikko anti-IIa- tai antitrombiiniaktiivisuus (noin 28 IU/mg) ja niiden välinen suhde on 3,6. Näitä antikoagulanttiaktiivisuuksia välittää antitrombiini III (AT-III) ja ne saavat aikaan antitromboottisia vaikutuksia ihmisellä.
Anti-Xa/IIa-aktiivisuutensa lisäksi enoksapariinilla on todettu antitromboottisia ja anti-inflammatorisia ominaisuuksia terveillä tutkittavilla, potilailla sekä ei-kliinisissä malleissa. Tällaisia ominaisuuksia ovat mm. AT-III-riippuvaisten muiden hyytymistekijöiden (kuten tekijä VIIa:n) inhibitio, endogeenisen kudostekijätien estäjän (TFPI) vapautumisen induktio ja von Willenbrand tekijän (vW-tekijän) vapautumisen väheneminen verisuonen endoteelistä verenkiertoon. Näiden tekijöiden tiedetään osaltaan vaikuttavan enoksapariininatriumin antitromboottiseen kokonaisvaikutukseen. Profylaktisessa käytössä enoksapariininatrium ei vaikuta merkittävästi aktivoituun partiaaliseen tromboplastiiniaikaan (APTT). Kuratiivisessa käytössä APTT voi pidentyä 1,5–2,2-kertaiseksi vertailuaikaan nähden huippuaktiivisuuden kohdalla.
Kliininen teho ja turvallisuus
Laskimoperäisen tromboembolisen sairauden ehkäisy leikkauksen yhteydessä
- Laskimotromboembolian pidennetty profylaksia ortopedisen leikkauksen jälkeen:
Lonkan tekonivelleikkauspotilailla tehdyssä kaksoissokkoutetussa pidennettyä profylaksiaa arvioineessa tutkimuksessa 179 potilasta, joilla ei ollut laskimoperäistä tromboembolista sairautta ja jotka olivat saaneet aluksi sairaalahoitojakson aikana 4 000 IU (40 mg) enoksapariininatriumia ihon alle, satunnaistettiin saamaan kotiuttamisen jälkeen 3 viikon ajan joko enoksapariininatriumia 4 000 IU (40 mg) (n = 90) kerran vuorokaudessa ihon alle tai plaseboa (n = 89). Syvän laskimotromboosin ilmaantuvuus pidennetyn profylaksian aikana oli merkittävästi pienempi enoksapariininatriumia saaneiden ryhmässä verrattuna plaseboa saaneiden ryhmään; yhtään keuhkoemboliatapausta ei ilmoitettu. Suuria verenvuotoja ei ilmennyt.
Tehoa koskevat tulokset on esitetty seuraavassa taulukossa.
Enoksapariininatrium4 000 IU (40 mg) kerran vuorokaudessa ihon alle n (%) | Lumelääke kerran vuorokaudessa ihon alle n (%) | |
| Kaikki pidennettyä profylaksiaa saaneet potilaat | 90 (100) | 89 (100) |
| Laskimotromboembolioiden kokonaismäärä | 6 (6,6) | 18 (20,2) |
| 6 (6,6)* | 18 (20,2) |
| 5 (5,6)# | 7 (8,8) |
*p-arvo lumelääkkeeseen verrattuna = 0,008 #p-arvo lumelääkkeeseen verrattuna = 0,537 | ||
Toisessa kaksoissokkoutetussa tutkimuksessa 262 potilaalle, joilla ei ollut laskimotromboemboliasairautta ja joille tehtiin lonkan tekonivelleikkaus, annettiin aluksi sairaalahoitojakson aikana 4 000 IU (40 mg) enoksapariininatriumia ihon alle. Nämä potilaat satunnaistettiin saamaan kotiuttamisen jälkeen 3 viikon ajan joko enoksapariininatriumia 4 000 IU (40 mg) (n = 131) kerran vuorokaudessa ihon alle tai plaseboa (n = 131). Kuten ensimmäisessä tutkimuksessa, myös tässä laskimotromboembolioiden ilmaantuvuus pidennetyn profylaksian aikana oli merkittävästi pienempi enoksapariininatriumia saaneiden ryhmässä verrattuna lumelääkettä saaneiden ryhmään sekä laskimotromboembolioiden kokonaismäärällä (enoksapariininatrium 21 [16 %] vs. lumelääke 45 [34,4 %]; p = 0,001) että proksimaalisten syvien laskimotromboosien määrällä (enoksapariininatrium 8 [6,1 %] vs. lumelääke 28 [21,4 %]; p = < 0,001) arvioituna. Enoksapariiniryhmän ja lumelääkeryhmän välillä ei todettu eroja merkittävien verenvuotojen määrissä.
- Syvän laskimotromboosin pidennetty profylaksia syöpäleikkauksen jälkeen
Kaksoissokkoutetussa monikeskustutkimuksessa verrattiin neljän ja yhden viikon pituisen enoksapariininatriumprofylaksian tehoa ja turvallisuutta 332 potilaalla, joille tehtiin elektiivinen leikkaus vatsan tai lantion alueella. Potilaat saivat enoksapariininatriumia (4 000 IU (40 mg) ihon alle) kerran vuorokaudessa 6–10 päivän ajan, minkä jälkeen heidät satunnaistettiin saamaan joko enoksapariininatriumia tai plaseboa vielä 21 päivän ajan. Potilaille tehtiin molemminpuolinen venografiatutkimus 25.–31. päivien välisenä aikana, tai aiemmin, jos potilaalle ilmaantui laskimotromboembolian oireita. Potilaita seurattiin kolme kuukautta. Neljän viikon pituinen enoksapariininatriumprofylaksia vatsan tai lantion alueen syöpäleikkauksen jälkeen vähensi merkittävästi venografiatutkimuksella todettujen tromboosien ilmaantuvuutta verrattuna yhden viikon mittaiseen enoksapariininatriumprofylaksiaan. Kaksoissokkoutetun vaiheen jälkeen todettujen laskimotromboembolioiden määrä oli 12,0 % (n = 20) lumelääkeryhmässä ja 4,8 % (n = 8) enoksapariininatriumryhmässä; p = 0,02. Tämä ero säilyi kolme kuukautta [13,8 % vs. 5,5 % (n = 23 vs. 9), p = 0,01]. Verenvuotojen tai muiden komplikaatioiden määrissä ei ollut eroja kaksoissokkoutetun vaiheen tai seurantavaiheen aikana.
Laskimoperäisen tromboembolisen sairauden profylaksia sisätautipotilaille, joiden akuutin sairauden odotetaan aiheuttavan liikuntarajoitteisuutta Kaksoissokkoutetussa, rinnakkaisryhmillä toteutetussa monikeskustutkimuksessa verrattiin kerran vuorokaudessa ihon alle annettua 2 000 IU:n (20 mg) tai 4 000 IU:n (40 mg) enoksapariininatriumannosta lumelääkkeeseen syvän laskimotromboosin profylaksiassa sisätautipotilaille, joiden liikkuminen oli akuutin sairauden aikana erittäin rajoittunutta (määriteltynä alle 10 metrin kävelymatkana ≤ 3 päivän aikana). Tutkimukseen osallistuneilla potilailla oli sydämen vajaatoiminta (NYHA-luokka III tai IV); akuutti hengityksen vajaatoiminta tai komplisoitunut krooninen hengitysvajaus, akuutti infektio tai akuutti reumasairaus, johon liittyi ainakin yksi syvän laskimotromboosin riskitekijä (ikä ≥ 75 vuotta, syöpä, aiempi laskimotromboembolia, lihavuus, suonikohjut, hormonihoito tai krooninen sydämen tai hengityksen vajaatoiminta). Tutkimukseen osallistui yhteensä 1 102 potilasta, ja 1 073 potilasta hoidettiin. Hoito kesti 6–14 päivää (keston mediaani 7 päivää) Kerran vuorokaudessa 4 000 IU:n (40 mg) annoksella ihon alle annettu enoksapariininatrium vähensi merkittävästi laskimotromboembolioiden ilmaantuvuutta lumelääkkeeseen verrattuna. Tehoa koskevat tulokset on esitetty seuraavassa taulukossa.
Enoksapariininatrium 2 000 IU (20 mg) kerran vuorokaudessa ihon alle n (%) | Enoksapariininatrium 4 000 IU (40 mg) kerran vuorokaudessa ihon alle n (%) | Lumelääke n (%) | |
| Kaikki hoidetut sisätautipotilaat sairauden akuuttivaiheen aikana | 287 (100) | 291(100) | 288 (100) |
| Laskimotromboembolioiden kokonaismäärä | 43 (15,0) | 16 (5,5)* | 43 (14,9) |
| 43 (15,0) | 16 (5,5) | 40 (13,9) |
| 13 (4,5) | 5 (1,7) | 14 (4,9) |
Laskimotromboemboliat sisälsivät syvät laskimotromboosit, keuhkoemboliat ja kuolemantapaukset, joiden katsottiin oleva alkuperältään tromboembolisia *p-arvo lumelääkkeeseen verrattuna = 0,0002 | |||
Noin kolmen kuukauden kuluttua tutkimuksen aloittamisesta laskimotromboembolioiden ilmaantuvuus oli edelleen merkittävästi pienempi 4 000 IU:n (40 mg) enoksapariininatriumannoksella hoidettujen ryhmässä verrattuna lumelääkeryhmään. Lumelääkeryhmässä verenvuotojen kokonaisilmaantuvuus oli 8,6 % ja merkittävien verenvuotojen ilmaantuvuus 1,1 %; enoksapariinia 2 000 IU (20 mg) saaneiden ryhmässä vastaavat luvut olivat 11,7 % ja 0,3 % ja enoksapariinia 4 000 IU (40 mg) saaneiden ryhmässä 12,6 % ja 1,7 %.
Syvän laskimotromboosin hoito, kun siihen saattaa liittyä keuhkoembolia
Rinnakkaisryhmillä toteutetussa monikeskustutkimuksessa 900 potilasta, joilla oli todettu akuutti alaraajan syvä laskimotromboosi, johon saattoi liittyä myös keuhkoembolia, satunnaistettiin saamaan sairaalan vuodeosastolla joko (i) enoksapariininatriumia 150 IU/kg (1,5 mg/kg) kerran vuorokaudessa ihon alle, (ii) enoksapariininatriumia 100 IU/kg (1 mg/kg) 12 tunnin välein ihon alle tai (iii) hepariinia laskimoboluksena (5000 IU) ja sen jälkeen jatkuvana infuusiona (annosteltuna siihen asti, että saavutettiin APTT-aika 55–85 sekuntia). Tutkimukseen satunnaistettiin yhteensä 900 potilasta, ja kaikki potilaat saivat hoitoa. Kaikki potilaat saivat myös varfariinia (jonka annos sovitettiin protrombiiniajan mukaan niin, että saavutettu INR-arvo oli 2,0–3,0), jonka antaminen aloitettiin 72 tuntia enoksapariininatriumhoidon tai tavanomaisen hepariinihoidon aloittamisen jälkeen ja jota jatkettiin 90 päivän ajan. Enoksapariininatriumia tai tavanomaista hepariinihoitoa annettiin vähintään 5 päivän ajan ja siihen asti, että varfariininatriumhoidolle asetettu INR:n tavoitearvo oli saavutettu. Molempien enoksapariininatriumhoitojen annostukset vastasivat tavanomaista hepariinihoitoa uusiutuvan laskimotromboembolian (syvä laskimotromboosi ja/tai keuhkoembolia) riskin pienenemisen suhteen. Tehoa koskevat tulokset on esitetty seuraavassa taulukossa.
Enoksapariininatrium 150 IU/kg (1,5 mg/kg) kerran vuorokaudessa ihon alle n (%) | Enoksapariininatrium 100 IU/kg (1 mg/kg) kahdesti vuorokaudessa ihon alle n (%) | Hepariini APTT-ajan mukaan säädetty laskimonsisäinen hoito n (%) | |
| Kaikki hoidetut potilaat, joilla oli syvä laskimotromboosi, johon saattoi liittyä keuhkoembolia | 298 (100) | 312 (100) | 290 (100) |
| Laskimotromboembolioiden kokonaismäärä | 13 (4,4)* | 9 (2,9)* | 12 (4,1) |
| 11 (3,7) | 7 (2,2) | 8 (2,8) |
| 9 (3,0) | 6 (1,9) | 7 (2,4) |
| 2 (0,7) | 2 (0,6) | 4 (1,4) |
Laskimotromboemboliat sisälsivät syvät laskimotromboosit ja/tai keuhkoemboliat *95 %:n luottamusvälit hoitojen välisille eroille laskimotromboembolioiden kokonaismäärän suhteen olivat: - enoksapariini kerran vuorokaudessa verrattuna hepariiniin (3,0 – 3,5) - enoksapariini 12 tunnin välein verrattuna hepariiniin (4,2 – 1,7). | |||
Merkittäviä verenvuotoja ilmeni 1,7 %:lla enoksapariinia150 IU/kg (1,5 mg/kg) kerran vuorokaudessa saaneiden ryhmässä, 1,3 %:lla enoksapariinia 100 IU/kg (1 mg/kg) kaksi kertaa vuorokaudessa saaneiden ryhmässä ja 2,1 %:lla hepariiniryhmässä.
Syvän laskimotromboosin ja keuhkoembolian pidennetty hoito ja niiden uusiutumisen ehkäisy aktiivista syöpää sairastaville potilaille
Kliinisissä tutkimuksissa, joiden potilasmäärä oli pieni, uusiutuneen laskimotromboembolian ilmoitetut osuudet enoksapariinia kerran tai kaksi kertaa vuorokaudessa 3–6 kuukauden ajan saaneilla potilailla vaikuttivat vastaavanlaisilta kuin varfariinia saaneilla.
Vaikuttavuutta todellisessa käytössä arvioitiin laskimotromboemboliaa ja muita tromboottisia tiloja sairastavien potilaiden monikansallisen RIETE-rekisterin kohortissa, jonka 4 451 potilaalla oli oireinen laskimotromboembolia ja aktiivinen syöpä. 3 526 potilasta sai enoksapariinia ihon alle enintään 6 kuukauden ajan, ja 925 potilasta sai tintsapariinia tai daltepariinia ihon alle. Enoksapariinia saaneista 3 526 potilaasta 891 potilasta sai enoksapariinia 1,5 mg/kg kerran vuorokaudessa aloitushoitona ja pidennettynä hoitona enintään 6 kuukauden ajan (aina kerran vuorokaudessa), 1 854 potilasta sai enoksapariinia aluksi 1,0 mg/kg kaksi kertaa vuorokaudessa ja pidennettynä hoitona enintään 6 kuukauden ajan (aina kaksi kertaa vuorokaudessa), ja 687 potilasta sai enoksapariinia 1,0 mg/kg kaksi kertaa vuorokaudessa aloitushoitona ja sen jälkeen 1,5 mg/kg kerran vuorokaudessa (kaksi kertaa vuorokaudessa – kerran vuorokaudessa) pidennettynä hoitona enintään 6 kuukauden ajan.
Ennen hoito-ohjelman vaihtamista hoidon keskimääräinen kesto oli 17 päivää ja hoidon keston mediaani 8 päivää. Näiden kahden hoitoryhmän välillä ei ollut merkitsevää eroa laskimotromboembolian uusiutumisen osuuksissa (ks. taulukko), ja enoksapariini täytti vähintään samanveroisuuden ennalta määritellyn kriteerin, joka oli 1,5 (oleellisten kovariaattien suhteen korjattu riskitiheyksien suhde 0,817, 95 %:n luottamusväli: 0,499–1,336). Näiden kahden hoitoryhmän välillä ei ollut tilastollisesti merkitseviä eroja merkittävien (kuolemaan johtaneiden ja muiden kuin kuolemaan johtaneiden) verenvuotojen ja mistä tahansa syystä johtuvan kuoleman suhteellisissa riskeissä (ks. taulukko).
Taulukko. Tehon ja turvallisuuden mittarit RIETECAT-tutkimuksessa
| Mittari | Enoksapariinin=3526 | Muu pienimolekyylinen hepariini n=925 | Korjatut riskitiheyksien suhteet enoksapariini / muu pienimolekyylinen hepariini [95 %:n luottamusväli] |
| Laskimotromboembolian uusiutuminen | 70 (2,0 %) | 23 (2,5 %) | 0,817, [0,499-1,336] |
| Merkittävä verenvuoto | 111 (3,1 %) | 18 (1,9 %) | 1,522, [0,899-2,577] |
| Muu kuin merkittävä verenvuoto | 87 (2,5 %) | 24 (2,6 %) | 0,881, [0,550-1,410] |
| Mistä tahansa syystä johtuva kuolema | 666 (18,9 %) | 157 (17,0 %) | 0,974, [0,813-1,165] |
Jäljempänä on yleiskuva hoitotuloksista potilailla, jotka jatkoivat hoitoa 6 kuukauteen asti, RIETECAT-tutkimuksessa käytettyjen eri hoito-ohjelmien mukaan:
Taulukko. Hoitotulokset 6 kuukauden kohdalla potilailla, jotka jatkoivat hoitoa 6 kuukauteen asti, hoito-ohjelmittain
Mittari N (%) (95 %:n luottamus-väli) | Enoksa-pariini, kaikki hoito-ohjelmat | Enoksapariini, kaikki hoito-ohjelmat | EU-alueella hyväksytyt pienimole-kyyliset hepariinit | ||||
| Enoksa-pariini kerran vuoro-kaudessa | Enoksa-pariini kaksi kertaa vuoro-kaudessa | Enoksa-pariini kaksi kertaa – kerran vuoro-kaudessa | Enoksa-pariini kerran – kaksi kertaa vuoro-kaudessa | Enoksa-pariini, useampia kuin yksi hoito-ohjelman vaihto | |||
| N=1432 | N=444 | N=529 | N=406 | N=14 | N=39 | N=428 | |
Laskimo- trombo- embolian uusiutuminen | 70 (4,9 %) (3,8 %-6,0 %) | 33 (7,4 %) (5,0 %-9,9 %) | 22 (4,2 %) (2,5 %-5,9 %) | 10 (2,5 %) (0,9 %-4,0 %) | 1 (7,1 %) (0 %-22,6 %) | 4 (10,3 %) (0,3 %-20,2 %) | 23 (5,4 %) (3,2 %-7,5 %) |
Merkittävä verenvuoto (kuolemaan johtanut ja muu kuin kuolemaan johtanut) | 111 (7,8 %) (6,4 %-9,1 %) | 31 (7,0 %) (4,6 %-9,4 %) | 52 (9,8 %) (7,3 %-12,4 %) | 21 (5,2 %) (3,0 %-7,3 %) | 1 (7,1 %) (0 %-22,6 %) | 6 (15,4 %) (3,5 %-27,2 %) | 18 (4,2 %) (2,3 %-6,1 %) |
Muu kuin merkittävä verenvuoto, jolla on kliinistä merkitystä | 87 (6,1 %) (4,8 %-7,3 %) | 26 (5,9 %) (3,7 %-8,0 %) | 33 (6,2 %) (4,2 %-8,3 %) | 23 (5,7 %) (3,4 %-7,9 %) | 1 (7,1 %) (0 %-22,6 %) | 4 (10,3 %) (0,3 %-20,2 %) | 24 (5,6 %) (3,4 %-7,8 %) |
Mistä tahansa syystä johtuva kuolema | 666 (46,5 %) (43,9 %-49,1 %) | 175 (39,4 %) (34,9 %-44,0 %) | 323 (61,1 %) (56,9 %-65,2 %) | 146 (36,0 %) (31,3 %-40,6 %) | 6 (42,9 %) (13,2 %-72,5 %) | 16 (41,0 %) (24,9 %-57,2 %) | 157 (36,7 %) (32,1 %-41,3 %) |
Kuolemaan johtanut keuhko-embolia tai kuolema, jollaoli yhteys kuolemaan johtaneeseen verenvuotoon | 48 (3,4 %) (2,4 %-4,3 %) | 7 (1,6 %) (0,4 %-2,7 %) | 35 (6,6 %) (4,5 %-8,7 %) | 5 (1,2 %) (0,2 %-2,3 %) | 0 (0 %) - | 1 (2,6 %) (0 %-7,8 %) | 11 2,6 %) (1,1 %- 4,1 %) |
| * Kaikkien tietojen kohdalla on mainittu 95 %:n luottamusväli | |||||||
Epästabiilin angina pectoriksen ja ST-nousuttoman infarktin hoito Laajassa monikeskustutkimuksessa, johon otettiin 3 171 epästabiilin angina pectoriksen tai non-Q-aaltoinfarktin akuuttivaiheessa ollutta potilasta, potilaat satunnaistettiin saamaan yhdessä asetyylisalisyylihapon kanssa (100–325 mg x 1) joko enoksapariininatriumia 100 IU/kg (1 mg/kg) 12 tunnin välein ihon alle tai fraktioimatonta hepariinia laskimoon aktivoidun partiaalisen tromboplastiiniajan (APTT) perusteella sovitettuina annoksina. Potilaita piti hoitaa sairaalassa vähintään 2 päivää ja enintään 8 päivää, kunnes heidän kliininen tilansa oli vakaa, heille tehtiin revaskularisaatiotoimenpide tai heidät kotiutettiin. Potilaita piti seurata enintään 30 päivää.
Hepariiniin verrattuna enoksapariininatrium vähensi merkittävästi angina pectoriksen, sydäninfarktia ja kuoleman yhdistettyä ilmaantuvuutta, joka oli pienentynyt 19,8 %:sta 16,6 %:een (suhteellisen riskin vähenemä 16,2 %) päivänä 14. Tämä yhdistetyn ilmaantuvuuden pienenemä oli säilynyt 30 päivän kuluttua (23,3 %:sta 19,8 %:iin; suhteellisen riskin vähenemä 15 %). Tutkimuksessa ei havaittu huomattavia eroja merkittävien verenvuotojen määrässä, tosin verenvuoto ihon alle annettavan injektion pistoskohdasta oli tavallisempaa.
Akuutin ST-nousuinfarktin (STEMI) hoito Laajassa monikeskustutkimuksessa 20 479 STEMI-potilasta, jotka soveltuivat saamaan fibrinolyyttistä hoitoa, satunnaistettiin saamaan joko enoksapariininatriumia 3 000 IU:n (30 mg) kerta-annoksena, joka annettiin laskimoboluksena, sekä 100 IU/kg (1 mg/kg) ihon alle, minkä jälkeen annettiin 100 IU/kg (1 mg/kg) injektiona ihon alle 12 tunnin välein, tai vaihtoehtoisesti fraktioimatonta hepariinia laskimoon annoksilla, jotka sovitettiin aktivoidun partiaalisen tromboplastiiniajan (APTT) perusteella, 48 tunnin ajan. Kaikki potilaat saivat myös asetyylisalisyylihappoa vähintään 30 päivän ajan. Enoksapariininatriumin annostelustrategiaa säädettiin vaikeaa munuaisten vajaatoimintaa sairastavilla ja vähintään 75 vuotiailla potilailla. Enoksapariininatriumia annettiin injektiona ihon alle sairaalasta kotiuttamiseen asti tai korkeintaan 8 päivän ajan (sen mukaan siitä, kumpi tuli ensin). 4 716 potilaalle, jotka saivat antitromboottista tukihoitoa sokkoutetulla tutkimuslääkkeellä, tehtiin perkutaaninen sepelvaltimotoimenpide. Siksi enoksapariininatriumia saaneille potilaille tehtiin perkutaaninen sepelvaltimotoimenpide enoksapariininatriumhoidon aikana (lääkitystä ei vaihdettu) käyttäen aiemmissa tutkimuksissa käytettyä annostelua. Toisin sanoen potilaalle ei annettu enoksapariininatriumin lisäannoksia, jos viimeisestä ihon alle annostelusta oli kulunut alle 8 tuntia ennen pallolaajennusta. Potilaalle annettiin laskimoboluksena 30 IU/kg (0,3 mg/kg) enoksapariininatriumia, jos viimeisestä ihon alle annostelusta ennen pallolaajennusta oli kulunut yli 8 tuntia. Enoksapariininatrium verrattuna fraktioimattomaan hepariiniin vähensi merkittävästi ensisijaisen päätetapahtuman ilmaantuvuutta. Ensisijainen päätetapahtuma oli yhdistelmäpäätemuuttuja, joka sisälsi mistä tahansa syystä johtuvan kuoleman ja sydäninfarktin, joka uusiutui ensimmäisten 30 päivän aikana satunnaistamisesta [9,9 % enoksapariininatriumryhmässä ja 12,0 % fraktioimattoman hepariinin ryhmässä], ja suhteellisen riskin vähenemä oli 17 % (p < 0,001). Enoksapariininatriumhoidon hyödyt olivat ilmeiset useiden tehon mittareiden mukaan: hyödyt tulivat esille 48 tunnin kuluttua, jolloin uusiutuneen sydäninfarktin suhteellisen riskin vähenemä oli 35 % verrattuna fraktioimattomaan (p < 0,001). Enoksapariininatriumin suotuisa vaikutus ensisijaiseen päätetapahtumaan oli yhdenmukainen kaikissa keskeisissä alaryhmissä, jotka oli jaoteltu iän, sukupuolen, infarktin sijainnin, diabetestaustan, aiempien sydäninfarktien, käytetyn fibrinolyytin tyypin ja tutkimuslääkkeen antamiseen kuluneen ajan mukaan. Enoksapariininatriumhoidosta oli merkittävästi hyötyä fraktioimattomaan hepariiniin verrattuna sekä potilaille, joille tehtiin perkutaaninen sepelvaltimotoimenpide 30 päivän kuluessa satunnaistamisesta (suhteellisen riskin vähenemä 23 %) että potilaille, joita hoidettiin lääkkeellisesti (suhteellisen riskin vähenemä 15 %, p = 0,27 yhteisvaikutusten suhteen). Kuoleman, uusiutuneen sydäninfarktin tai kallonsisäisen verenvuodon yhdistelmäpäätemuuttujaa (kliinisen nettohyödyn mittari) esiintyi 30 päivän kohdalla merkittävästi vähemmän (p < 0,0001) enoksapariininatriumryhmässä (10,1 %) kuin hepariiniryhmässä (12,2 %), mikä tarkoitti 17 % suhteellisen riskin vähenemää enoksapariininatriumhoidon eduksi. Merkittävän verenvuodon ilmaantuvuus 30 päivän kohdalla oli merkittävästi suurempi (p <0,0001) enoksapariiniryhmässä (2,1 %) kuin hepariiniryhmässä (1,4 %). Enoksapariiniryhmässä maha-suolikanavan verenvuotojen ilmaantuvuus (0,5 %) oli suurempi kuin hepariiniryhmässä (0,1 %), kun taas kallonsisäisten verenvuotojen ilmaantuvuus oli molemmissa ryhmissä yhtä suuri (0,8 % enoksapariinilla ja 0,7 % hepariinilla).
Enoksapariininatriumin suotuisa vaikutus ensisijaiseen päätetapahtumaan, mikä havaittiin ensimmäisten 30 päivän aikana, säilyi yli 12 kuukauden seurannan ajan.
Maksan vajaatoiminta Kirjallisuuden mukaan enoksapariininatriumin käyttö annoksella 4 000 IU (40 mg) maksakirroosipotilaille (Child-Pugh -luokat B–C) näyttää olevan turvallista ja tehokasta porttilaskimon tromboosin estossa. On huomioitava, että kirjallisuustutkimuksissa voi olla rajoituksia. Maksan vajaatoimintapotilaita on hoidettava varoen, sillä nämä potilaat ovat alttiita verenvuodoille (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), eikä maksakirroosipotilaille (Child-Pugh -luokat A, B ja C) ole tehty muodollisia annosmääritystutkimuksia.
Ghemaxan on biosimilaari lääkevalmiste. Yksityiskohtaisia tietoja on saatavilla Fimean verkkosivustolla (www.Fimea.fi).
Farmakokinetiikka
Yleispiirteet Enoksapariininatriumin farmakokineettisiä parametreja on tutkittu ensisijaisesti muutoksina plasman anti-Xa-aktiivisuudessa ja anti-IIa-aktiivisuudessa ajan suhteen suositelluilla annostuksilla kerta-annosten ja toistettujen annosten ihon alle annon jälkeen sekä laskimonsisäisen kerta-annoksen jälkeen. Anti-Xa:n ja anti-IIa:n farmakokineettinen aktiivisuus määritettiin kvantitatiivisesti validoiduilla amidolyyttisillä menetelmillä.
Imeytyminen Ihon alle injektiona annetun enoksapariininatriumin absoluuttinen hyötyosuus on anti-Xa-aktiivisuuden perusteella lähes 100 %.
Erilaisia annoksia, lääkemuotoja ja annostusohjelmia voidaan käyttää. Keskimääräinen anti-Xa-aktiivisuuden huippu plasmassa todetaan 3–5 tunnin kuluttua ihon alle annetun injektion jälkeen. Ihon alle annettuja kerta-annoksia 2 000 IU (20 mg), 4 000 IU (40 mg), 100 IU/kg (1 mg/kg) ja 150 IU/kg (1,5 mg/kg) vastaavat huippuarvot ovat noin 0,2, 0,4, 1,0 ja 1,3 anti-Xa IU/ml.
Kun annettiin 3 000 IU:n (30 mg) laskimobolus ja välittömästi sen jälkeen 100 IU/kg (1 mg/kg) ihon alle 12 tunnin välein (n = 16), aluksi todettu anti-Xa-aktiivisuuden huippuarvo oli 1,16 IU/ml (n = 16) ja keskimääräinen altistus vastasi 88 % vakaan tilan pitoisuuksista. Vakaa tila saavutettiin toisena hoitopäivänä.
Kun terveillä vapaaehtoisilla oli toteutettu hoito, joka sisälsi toistetun ihon alle annetun annoksen 4 000 IU (40 mg) kerran vuorokaudessa ja 150 IU/kg (1,5 mg/kg) kerran vuorokaudessa, vakaa tila saavutettiin päivänä 2 ja keskimääräinen altistussuhde oli noin 15 % suurempi kuin kerta-annoksen jälkeen. Kun ihon alle annettiin toistettu annos 100 IU/kg (1 mg/kg) kaksi kertaa vuorokaudessa, vakaa tila saavutettiin päivänä 3 tai 4 ja keskimääräinen altistus oli noin 65 % suurempi kuin kerta-annoksen jälkeen ja keskimääräinen anti-Xa-aktiivisuuden huippuarvo oli noin 1,2 IU/ml ja minimiarvo noin 0,52 IU/ml.
Injektion tilavuus ja annoksen vahvuus välillä 100–200 mg/ml eivät vaikuttaneet farmakokineettisiin parametreihin terveillä vapaaehtoisilla. Enoksapariininatriumin farmakokinetiikka näytti olevan lineaarinen suositelluilla annosalueilla. Potilaskohtainen ja potilaiden välinen vaihtelu oli vähäistä. Toistetun ihon alle annon jälkeen ei tapahtunut kumuloitumista.
Plasman anti-IIa-aktiivisuus ihon alle annon jälkeen oli noin 10 kertaa pienempi kuin anti-Xa-aktiivisuus. Keskimääräinen anti-IIa-huippuaktiivisuus havaittiin noin 3–4 tunnin kuluttua ihon alle annetusta injektiosta ja se oli 0,13 IU/ml toistetun kaksi kertaa vuorokaudessa annetun 100 IU/kg:n (1 mg/kg) annoksen jälkeen ja 0,19 IU/ml kerran vuorokaudessa annetun 150 IU/kg:n (1,5 mg/kg) annoksen jälkeen.
Jakautuminen
Enoksapariininatriumin anti-Xa-aktiivisuuden jakautumistilavuus on noin 4,3 litraa ja on lähellä veritilavuutta.
Biotransformaatio
Enoksapariininatrium metaboloituu ensisijaisesti maksassa desulfatoitumalla ja/tai depolymeroitumalla molekyylipainoltaan pienemmiksi osiksi, joiden biologinen voimakkuus on paljon vähäisempi.
Eliminaatio
Enoksapariininatrium on lääke, jonka puhdistuma on pieni; plasman keskimääräinen anti-Xa-puhdistuma on 0,74 litraa/tunti 150 IU/kg:n (1,5 mg/kg) annoksen 6 tuntia kestävän laskimoinfuusion jälkeen. Eliminaatio on yksivaiheinen ja puoliintumisaika on noin 5 tuntia ihon alle annetun kerta-annoksen jälkeen ja noin 7 tuntia toistetun annostuksen jälkeen. Aktiivisten fragmenttien osuus munuaispuhdistumassa on noin 10 % annetusta annoksesta, ja aktiivisten ja ei-aktiivisten fragmenttien kokonaismunuaispuhdistuma on 40 % annoksesta.
Erityisryhmät
Iäkkäät potilaat Populaatiofarmakokineettisen analyysin tulosten perusteella enoksapariininatriumin kineettinen profiili ei poikkea iäkkäillä tutkittavilla nuorempiin verrattuna, kun munuaisten toiminta on normaali. Koska munuaisten toiminta tunnetusti heikkenee iän myötä, enoksapariininatriumin eliminoituminen saattaa kuitenkin vähentyä iäkkäillä potilailla (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksan vajaatoiminta Pitkälle edennyttä kirroosia sairastaneilla potilailla tehdyssä tutkimuksessa havaittiin, että enoksapariininatriumin 4 000 IU:n (40 mg) annos kerran vuorokaudessa heikensi anti-Xa-huippuaktiivisuutta, jolla oli yhteys maksan vajaatoiminnan vaikeusasteeseen (Child-Pugh-luokituksen mukaan arvioituna). Tämä heikkeneminen johtui pääasiassa AT-III-pitoisuuden pienenemisestä, joka puolestaan on seurausta maksan vajaatoimintaa sairastavien potilaiden vähentyneestä AT-III:n synteesistä.
Munuaisten vajaatoiminta Plasman anti-Xa-puhdistuman ja kreatiniinipuhdistuman välillä on havaittu lineaarinen suhde vakaassa tilassa. Tämä viittaa enoksapariininatriumin puhdistuman vähenemiseen potilailla, joilla munuaisten toiminta on heikentynyt. Vakaassa tilassa anti-Xa-altistus on AUC:n perusteella hieman lisääntynyt toistettujen ihon alle kerran vuorokaudessa annettujen 4 000 IU:n (40 mg) annosten jälkeen potilailla, joilla on lievä (kreatiniinipuhdistuma 30–50 ml/min) ja kohtalainen (kreatiniinipuhdistuma 50–80 ml/min) munuaisten vajaatoiminta. Potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma <30 ml/min), vakaan tilan AUC on merkittävästi suurentunut, keskimäärin 65 %, toistettujen ihon alle kerran vuorokaudessa annettujen 4 000 IU:n (40 mg) annosten jälkeen (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Hemodialyysi Laskimoon annetun 25 IU/kg:n, 50 IU/kg:n tai 100 IU/kg:n (0,25, 0,50 tai 1,0 mg/kg) kerta-annoksen jälkeen enoksapariininatriumin farmakokinetiikka vaikutti samankaltaiselta kuin verrokkihenkilöillä; AUC-arvo oli kuitenkin kaksinkertainen kontrollihenkilöihin verrattuna.
Potilaan paino Toistetun ihon alle kerran vuorokaudessa annetun 150 IU/kg:n (1,5 mg/kg) annoksen jälkeen keskimääräinen anti-Xa-aktiivisuuden AUC vakaassa tilassa on hieman suurempi ylipainoisilla terveillä vapaaehtoisilla (painoindeksi 30–48 kg/m2) verrattuna ei-ylipainoisiin verrokkeihin, kun taas plasman anti-Xa-huippuaktiivisuusarvo ei suurene. Ihon alle annon jälkeen ylipainoisten tutkittavien painon suhteen korjattu puhdistuma on pienempi.
Kun käytettiin painon suhteen korjaamatonta annostusta, havaittiin, ihon alle annetun 4000 IU (40 mg) annoksen jälkeen havaittiin, että pienipainoisten naisten (< 45 kg) anti-Xa-altistus oli 52 % suurempi ja pienipainoisten miesten (< 57 kg) 27 % suurempi kuin normaalipainoisilla verrokkihenkilöillä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokineettiset yhteisvaikutukset Farmakokineettisiä yhteisvaikutuksia ei havaittu enoksapariininatriumin ja trombolyyttisten aineiden välillä, kun niitä annettiin samanaikaisesti.
Prekliiniset tiedot turvallisuudesta
Enoksapariininatriumin antikoagulanttivaikutusten lisäksi ei havaittu näyttöä haittavaikutuksista rotilla ja koirilla annoksilla 15 mg/kg/vrk (ihon alle) tehdyissä 13 viikon mittaisissa toksisuustutkimuksissa, eikä rotilla ja apinoilla 10 mg/kg/vrk (ihon alle ja laskimoon) tehdyissä 26 viikon mittaisissa toksisuustutkimuksissa.
Enoksapariininatriumilla ei todettu mutageenista vaikutusta in vitro -tutkimuksissa, joita olivat Ames-testi ja hiiren lymfoomasolujen mutaatiotesti, eikä klastogeenista vaikutusta ihmisen lymfosyyttien kromosomipoikkeavuustestissä in vitro tai rotan luuytimen kromosomipoikkeavuustestissä in vivo.
Raskaana oleville rotille ja kaneille tehdyissä tutkimuksissa ihon alle annettavan enoksapariiniannoksen ollessa enintään 30 mg/kg/vrk ei ilmennyt mitään näyttöä teratogeenisista vaikutuksista tai sikiötoksisuudesta. Enoksapariininatriumin ei todettu vaikuttavan uros- eikä naarasrottien hedelmällisyyteen tai lisääntymiskykyyn ihon alle annetuilla annoksilla, jotka olivat enintään 20 mg/kg/vrk.
Farmaseuttiset tiedot
Apuaineet
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Ihonalainen injektio Ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Laskimo(bolus)injektio (vain akuutissa STEMI käyttöaiheessa) Enoksapariininatrium voidaan antaa fysiologisen keittosuolaliuoksen (0,9 %) tai glukoosin 5‑prosenttisen vesiliuoksen kanssa (ks. kohta Annostus ja antotapa).
Kestoaika
3 vuotta
Säilytys
Ei saa jäätyä.
Tämä lääkevalmiste on tarkoitettu vain kertakäyttöön. Hävitä käyttämättä jäänyt sisältö.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
GHEMAXAN injektioneste, liuos, esitäytetty ruisku
4000 IU (40 mg)/0,4 ml (L:ei) 10 x 0,4 ml (35,41 €)
PF-selosteen tieto
Injektioneste, liuos, 0,5 ml:n tai 1 ml:n esitäytetyssä tyypin I lasista valmistetussa ruiskussa, jossa on neula valmiiksi kiinnitettynä ja neulan suojakorkki (synteettistä polyisopreenikumia) ja jossa on elastomeerinen männän pysäytin (klooributyylikumia) ja männän varsi. Injektionestettä, liuosta, on saatavana kahdenlaisina pakkauksina:
1. Ruiskut, joissa on neulasuoja
Ghemaxan 4 000 IU (40 mg) / 0,4 ml injektioneste, liuos, esitäytetty ruisku:
Pakkaukset: 2, 6 ja 10 esitäytettyä ruiskua. Kerrannaispakkaukset: 12 (2 x 6), 20 (2 x 10), 24 (4 x 6), 30 (3 x 10), 50 (5 x 10) ja 90 (9 x 10) esitäytettyä ruiskua.
2. Ruiskut ilman neulasuojaa
Ghemaxan 4 000 IU (40 mg) / 0,4 ml injektioneste, liuos, esitäytetty ruisku:
Pakkaukset: 2 ja 10 esitäytettyä ruiskua. Kerrannaispakkaus: 30 (3 x 10) esitäytettyä ruiskua.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas, väritön tai vaalean kellertävä liuos.
Käyttö- ja käsittelyohjeet
Esitäytetty ruisku on valmis käytettäväksi välittömästi (ks. kohta Annostus ja antotapa).
Laskimoon annettavaa injektiota varten valmiste voidaan laimentaa fysiologiseen keittosuolaliuokseen (0,9 %) tai glukoosin 5‑prosenttiseen vesiliuokseen. Liuos pitää tarkistaa silmämääräisesti ennen käyttöä. Sitä ei saa käyttää, jos liuoksessa näyttää olevan muutoksia.
Ghemaxan-esitäytetyt ruiskut on tarkoitettu vain kertakäyttöön; hävitä käyttämättä jäänyt valmiste.
Saatavana on kahdenlaisia esitäytettyjä ruiskuja: sellaisia, joissa on neulasuoja, sekä sellaisia, joissa neulasuojaa ei ole. Käyttöohjeet ovat pakkausselosteessa. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
KÄYTTÖOHJEET: ESITÄYTETTY RUISKU
Kuinka annat itsellesi Ghemaxan-pistoksen
Jos voit antaa itsellesi Ghemaxan-pistoksen, lääkäri tai hoitaja näyttää sinulle, kuinka se tehdään. Älä yritä antaa pistosta, jos sinulle ei ole opetettu kuinka se tehdään. Jos et ole varma mitä tehdä, kysy heti lääkäriltä tai hoitajalta.
Ennen kuin annat itsellesi Ghemaxan-pistoksen
- Tarkista lääkkeen viimeinen käyttöpäivä. Älä käytä sitä, jos päivämäärä on ohitettu.
- Tarkista että ruisku on ehjä ja sen sisältämä lääke on kirkas liuos. Jos näin ei ole, ota toinen ruisku.
- Älä käytä lääkettä, jos huomaat sen ulkonäössä jonkin muutoksen.
- Varmista että tiedät kuinka paljon lääkettä sinun pitää pistää.
- Tarkista vatsan seutu nähdäksesi, onko edellinen pistos aiheuttanut punoitusta, muutoksia ihon
- värissä, turvotusta, nesteen tihkumista tai onko pistoskohta edelleen kipeä. Jos näin on, kysy lääkäriltä tai hoitajalta.
- Päätä, mihin kohtaan aiot pistää lääkkeen. Vaihda pistospaikkaa joka kerta vatsan oikean ja vasemman puolen välillä. Ghemaxan täytyy pistää juuri vatsan ihon alle, mutta ei liian lähelle napaa tai mitään arpikudosta (vähintään 5 cm päähän näistä).
Esitäytetty ruisku on tarkoitettu vain yhden henkilön kertakäyttöön. Saatavana on kahdenlaisia ruiskuja:
- esitäytetty ruisku, jossa on neulasuoja
- esitäytetty ruisku ilman neulasuojaa.
Ohjeet kuinka annat itsellesi Ghemaxan-pistoksen
Sinun pitäisi olla makuuasennossa ja pistää Ghemaxan syvälle ihon alle. Pistospaikkaa pitää vaihdella vatsan vasemman ja oikean puolen välillä. Neula pitää pistää koko pituudeltaan ihopoimuun, jota puristetaan peukalon ja etusormen välissä; ihopoimua pitää puristaa koko injektion ajan. Jotta mustelman muodostuminen olisi mahdollisimman vähäistä, älä hiero pistospaikkaa pistoksen antamisen jälkeen.
Ghemaxan-esitäytetyt ruiskut ja mitta-asteikolla varustetut esitäytetyt ruiskut on tarkoitettu yhden henkilön kertakäyttöön. Ruiskuissa voi olla neulasuoja. Tällaisten ruiskujen käyttöohjeet on jäljempänä.
Neulasuojassa on salpa, joka avaa ja lukitsee sen.
Ota esitäytetty ruisku kuplapakkauksesta avaamalla pakkaus ohjeen mukaan nuolen kohdalta. Älä ota ruiskua esiin vetämällä männästä, sillä se voi vahingoittaa ruiskua.
KÄYTTÖOHJEET: TURVAMEKANISMI
Tässä kuplapakkauksessa on esitäytetty Ghemaxan-ruisku. Ruiskussa on neulasuoja. |
|
Ghemaxan-turvamekanismin asettaminen paikoilleen pistoksen jälkeen Pidä ruiskua tukevasti yhdessä kädessä. Ota toisella kädellä kiinni ruiskun alaosassa olevista “siivistä” ja vedä, kunnes kuulet naksahduksen. Nyt käytetty neula on kokonaan suojattu. |
|
Korvattavuus
GHEMAXAN injektioneste, liuos, esitäytetty ruisku
4000 IU (40 mg)/0,4 ml 10 x 0,4 ml
- Rajoitettu ylempi erityiskorvaus reseptimerkinnällä (100 %). Rintasyöpä (115), Eturauhassyöpä (116), Leukemiat, muut pahanlaatuiset veri- ja luuydintaudit sekä pahanlaatuiset imukudostaudit (117), Gynekologiset syövät (128), Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Laskimotukos (E008) Tromboembolia (E007) Keuhkoembolia (E004).
- Peruskorvaus (40 %).
- Oikeus käyttää samaa biologista lääkettä (sama kauppanimi) 6 kk ajan.
ATC-koodi
B01AB05
Valmisteyhteenvedon muuttamispäivämäärä
30.06.2025
Yhteystiedot
Karl Gustavsgatan 1A
SE-411 25 Göteborg
Sweden
+46 3120 5020
www.campuspharma.se
info@campuspharma.se