ERLEADA tabletti, kalvopäällysteinen 60 mg
Vaikuttavat aineet ja niiden määrät
Yksi kalvopäällysteinen tabletti sisältää 60 mg apalutamidia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti).
Kliiniset tiedot
Käyttöaiheet
Erleada on tarkoitettu
- aikuisille miehille etäpesäkkeettömän kastraatioresistentin eturauhassyövän hoitoon, kun potilaalla on korkea etäpesäkkeisen taudin kehittymisen riski (ks. kohta Farmakodynamiikka)
- aikuisille miehille etäpesäkkeisen hormonisensitiivisen eturauhassyövän hoitoon yhdistelmänä androgeenideprivaatiohoidon kanssa (ks. kohta Farmakodynamiikka).
Ehto
Hoito on aloitettava ja toteutettava käyttöaiheissa mainittujen sairauksien diagnosointiin ja hoitoon perehtyneen erikoislääkärin seurannassa.
Annostus ja antotapa
Apalutamidihoito on aloitettava ja toteutettava eturauhassyövän lääkehoitoon perehtyneen erikoislääkärin valvonnassa.
Annostus
Suositeltu annos päivässä on 240 mg (neljä 60 mg:n tablettia) kerta-annoksena.
Lääkkeellistä kastraatiota gonadotropiinin vapauttajahormonin analogilla (GnRHa) on jatkettava hoidon aikana, jos potilaalle ei ole tehty kirurgista kastraatiota.
Jos annos unohtuu, se pitää ottaa mahdollisimman pian samana päivänä. Seuraavana päivänä palataan tavanomaiseen hoitoaikatauluun. Unohtuneen annoksen korvaamiseksi ei saa ottaa ylimääräisiä tabletteja.
Jos potilaalla on ≥ 3. asteen toksisuutta tai ei-siedettävissä olevia haittavaikutuksia, hoitoa ei pidä lopettaa pysyvästi, vaan se pitää mieluummin keskeyttää, kunnes oireet ovat lieventyneet ≤ 1. asteeseen tai alkuperäiseen asteeseen, minkä jälkeen hoitoa pitää jatkaa samalla annoksella tai pienemmällä annoksella (180 mg tai 120 mg), jos se on aiheellista. Yleisimmät haittavaikutukset (ks. kohta Haittavaikutukset).
Erityispotilasryhmät
Iäkkäät
Iäkkäiden potilaiden annosta ei tarvitse muuttaa (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
Munuaisten vajaatoiminta
Lievää tai keskivaikeaa munuaisten vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa.
Vaikea-asteista munuaisten vajaatoimintaa sairastavien potilaiden hoidossa on oltava varovainen, koska apalutamidia ei ole tutkittu tässä potilasjoukossa (ks. kohta Farmakokinetiikka). Jos hoito aloitetaan, potilasta pitää seurata kohdassa Haittavaikutukset mainittujen haittavaikutusten havaitsemiseksi, ja annosta on pienennettävä kohdan Annostus ja antotapa mukaisesti.
Maksan vajaatoiminta
Lievää (Child–Pugh-luokka A) tai keskivaikeaa (Child–Pugh-luokka B) maksan vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa.
Erleada-valmistetta ei suositella vaikeaa maksan vajaatoimintaa sairastaville potilaille, koska tästä potilasjoukosta ei ole tietoja ja apalutamidi eliminoituu pääasiassa maksan kautta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Ei ole asianmukaista käyttää apalutamidia pediatrisille potilaille.
Antotapa
Suun kautta.
Tabletit niellään kokonaisina sen varmistamiseksi, että otetaan täysi aiottu annos. Tabletteja ei saa murskata eikä jakaa. Tabletit voidaan ottaa ruokailun yhteydessä tai tyhjään mahaan.
Erleada-tabletin ottaminen hiilihapottoman juoman tai pehmeän ruoan kanssa
Jos potilas ei kykene nielemään Erleada-tabletteja kokonaisina, tabletit voidaan liuottaa hiilihapottomaan veteen ja sekoittaa sitten seuraavien ohjeiden mukaisesti johonkin seuraavista hiilihapottomista juomista tai pehmeistä ruoista: appelsiinimehu, vihreä tee, omenasose, juotava jogurtti tai lisävesi:
- Laita koko määrätty Erleada-annos mukiin. Älä murskaa tai jaa tabletteja.
- Lisää noin 20 ml (4 teelusikallista) hiilihapotonta vettä, ja varmista, että tabletit ovat kokonaan vedessä.
- Odota 2 minuuttia, kunnes tabletit ovat hajonneet. Sekoita sitten seosta.
- Lisää seokseen 30 ml (6 teelusikallista tai 2 ruokalusikallista) jotakin seuraavista hiilihapottomista juomista tai pehmeistä ruoista: appelsiinimehu, vihreä tee, omenasose, juotava jogurtti tai lisävesi. Sekoita seosta.
- Niele seos välittömästi.
- Huuhtele muki riittävällä vesimäärällä, jotta otat varmasti koko annoksen. Juo vesi heti.
- Älä säästä lääkevalmiste-ruokaseosta myöhempää käyttöä varten.
Anto nenä-mahaletkun kautta
Erleada‑annos voidaan antaa myös nenä-mahaletkun (koko vähintään 8 French [Fr]) kautta seuraavasti:
- Laita koko määrätty Erleada-annos ruiskun säiliöön (käytä vähintään 50 ml:n ruiskua) ja vedä ruiskuun 20 ml hiilihapotonta vettä.
- Odota 10 minuuttia ja ravista sitten voimakkaasti, jotta ruiskun sisältö sekoittuu täysin.
- Anna heti nenä-mahaletkun kautta.
- Täytä ruisku uudelleen hiilihapottomalla vedellä ja anna vesi. Toista, kunnes ruiskussa tai ravitsemusletkussa ei ole enää tabletin jäämiä.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Naiset, jotka ovat raskaana tai saattavat tulla raskaaksi (ks. kohta Raskaus ja imetys).
Varoitukset ja käyttöön liittyvät varotoimet
Kouristuskohtaukset
Erleada-hoitoa ei suositella, jos potilaalla on aiemmin ollut kouristuskohtauksia tai niille altistavia muita tekijöitä, mm. taustalla oleva aivovamma, äskettäinen aivohalvaus (edellisen vuoden aikana), primaari aivokasvain tai etäpesäkkeitä aivoissa. Jos potilaalle ilmaantuu kouristuskohtaus Erleada-hoidon aikana, hoito pitää lopettaa pysyvästi. Kouristuskohtausten riski saattaa olla tavanomaista suurempi, jos potilas käyttää samanaikaisesti kouristuskynnystä alentavia lääkkeitä.
Kouristuskohtauksia ilmaantui kahdessa satunnaistetussa tutkimuksessa (SPARTAN ja TITAN) 0,6 %:lle apalutamidia saaneista potilaista ja 0,2 %:lle lumehoitoa saaneista potilaista. Näistä tutkimuksista oli suljettu pois potilaat, joilla oli aiemmin ollut kouristuskohtauksia tai joilla oli kouristuskohtauksille altistavia tekijöitä.
Erleada-valmisteen antamisesta uudelleen potilaalle, jolle on ilmaantunut kouristuskohtaus, ei ole kliinistä kokemusta.
Kaatumiset ja luunmurtumat
Apalutamidihoitoa saaneilla potilailla esiintyi kaatumisia ja luunmurtumia (ks. kohta Haittavaikutukset). Potilaan kaatumis- ja luunmurtumariski pitää arvioida ennen Erleada-hoidon aloittamista, ja potilaan seurantaa ja hoitoa pitää jatkaa vakiintuneiden hoito-ohjeiden mukaisesti. On harkittava luuhun kohdistuvan lääkehoidon käyttöä.
Iskeeminen sydänsairaus ja iskeemiset aivoverenkiertohäiriöt
Apalutamidihoitoa saaneilla potilailla esiintyi iskeemistä sydänsairautta ja iskeemisiä aivoverenkiertohäiriöitä, myös kuolemaan johtaneita tapahtumia (ks. kohta Haittavaikutukset). Valtaosalla potilaista oli iskeemiseen sydäsairauteen tai aivoverenkiertohäiröön liittyviä riskitekijöitä. Potilaita pitää seurata iskeemisen sydänsairauden ja iskeemisten aivoverenkiertohäiriöiden oireiden ja löydösten havaitsemiseksi. Riskitekijöiden, kuten hypertension, diabeteksen tai dyslipidemian, hoito pitää optimoida tavanomaisesti annettavan hoidon mukaisesti.
Muiden lääkevalmisteiden samanaikainen käyttö
Apalutamidi on voimakas entsyymi-induktori, ja se voi aiheuttaa monien yleisesti käytettävien lääkevalmisteiden tehon häviämistä (ks. kohta Yhteisvaikutukset). Apalutamidihoitoa aloitettaessa pitää sen vuoksi tarkistaa muut samanaikaisesti käytössä olevat lääkevalmisteet. Apalutamidin samanaikaista käyttöä pitää yleensä välttää sellaisten lääkevalmisteiden kanssa, jotka ovat monien metaboloivien entsyymien tai kuljetusproteiinien herkkiä substraatteja (ks. kohta Yhteisvaikutukset), ellei niiden hoitovaikutus ole potilaalle hyvin tärkeä ja jos annosta ei voida tehon seurannan tai plasmassa todettavien pitoisuuksien perusteella helposti säätää.
Varfariinin ja kumariinityyppisten antikoagulanttien samanaikaista käyttöä apalutamidin kanssa pitää välttää. Jos Erleada-valmistetta käytetään yhdessä CYP2C9:n välityksellä metaboloituvan antikoagulantin (esim. varfariinin tai asenokumarolin) kanssa, INR-arvojen (International Normalised Ratio) lisäseuranta on tarpeen (ks. kohta Yhteisvaikutukset).
Äskettäin todettu sydän- tai verisuonisairaus
Kliinisistä tutkimuksista suljettiin pois potilaat, joilla oli edellisten 6 kuukauden aikana ollut kliinisesti merkittävä sydän- tai verisuonisairaus, mukaan lukien vaikea-asteinen tai epästabiili angina pectoris, sydäninfarkti, oireinen kongestiivinen sydämen vajaatoiminta, tromboembolisia valtimo- tai laskimotapahtumia (esim. keuhkoembolia, aivoverisuonitapahtuma, mukaan lukien ohimenevä aivoverenkiertohäiriö) tai kliinisesti merkittäviä kammioperäisiä sydämen rytmihäiriöitä. Apalutamidin turvallisuutta näille potilasryhmille ei ole siksi varmistettu. Jos Erleada-tabletteja määrätään potilaille, joilla on kliinisesti merkittävä sydän- tai verisuonisairaus, potilasta pitää seurata riskitekijöiden, kuten hyperkolesterolemian, hypertriglyseridemian tai muiden kardiometabolisten häiriöiden, havaitsemiseksi (ks. kohta Haittavaikutukset). Potilaan tällaiset sairaudet pitää tarvittaessa hoitaa vakiintuneiden hoito-ohjeiden mukaisesti Erleada-hoidon aloittamisen jälkeen.
Androgeenideprivaatiohoito voi pidentää QT-aikaa
Jos potilaalla on aiemmin todettu QT-ajan pidentymistä tai potilaalla on sen riskitekijöitä ja potilas käyttää samanaikaisesti QT-aikaa mahdollisesti pidentäviä lääkevalmisteita (ks. kohta Yhteisvaikutukset), lääkärin on ennen Erleada-hoidon aloittamista arvioitava hoidon hyöty-riskisuhde, mukaan lukien kääntyvien kärkien takykardian mahdollisuus.
Vaikeat ihoon kohdistuvat haittavaikutukset
Erleada-hoidon yhteydessä on valmisteen markkinoille tulon jälkeen raportoitu vaikeita ihoon kohdistuvia haittavaikutuksia, mukaan lukien lääkkeeseen liittyviä yleisoireisia eosinofiilisia reaktioita (DRESS) ja Stevens–Johnsonin oireyhtymää (SJS) / toksista epidermaalista nekrolyysiä (TEN), jotka voivat olla henkeä uhkaavia tai johtaa kuolemaan (ks. kohta Haittavaikutukset.)
Potilaille pitää kertoa, mitkä ovat lääkkeeseen liittyviin yleisoireisiin eosinofiilisiin reaktioihin tai Stevens–Johnsonin oireyhtymään / toksiseen epidermaaliseen nekrolyysiin viittaavia oireita ja löydöksiä. Jos tällaisia oireita havaitaan, Erleada-hoito pitää lopettaa heti, ja potilaiden on hakeuduttava heti lääkäriin.
Jos potilaalle on ilmaantunut lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio tai Stevens–Johnsonin oireyhtymä / toksinen epidermaalinen nekrolyysi milloin tahansa Erleada-hoidon aikana, Erleada-hoitoa ei saa enää jatkaa, vaan on harkittava vaihtoehtoista hoitoa.
Interstitiaalinen keuhkosairaus
Apalutamidihoitoa saaneilla potilailla on havaittu interstitiaalista keuhkosairautta, mukaan lukien kuolemaan johtaneita tapauksia. Jos keuhko-oireet alkavat akuutisti ja/tai pahenevat selittämättömästi, apalutamidihoito pitää keskeyttää näiden oireiden jatkotutkimusten ajaksi. Jos interstitiaalinen keuhkosairaus todetaan, apalutamidihoito pitää lopettaa ja asianmukainen hoito pitää aloittaa tarpeen mukaan (ks. kohta Haittavaikutukset).
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per 240 mg:n annos (4 tablettia) eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Apalutamidin eliminaatio ja sen aktiivisen metaboliitin, N‑desmetyyliapalutamidin, muodostuminen tapahtuvat vakaassa tilassa yhtä suuressa määrin sekä CYP2C8- että CYP3A4-entsyymin välityksellä. Yhteisvaikutuksista CYP2C8:n tai CYP3A4:n estäjien tai induktorien kanssa ei oletettavasti aiheudu kliinisesti merkittäviä muutoksia niiden kokonaisaltistukseen. Apalutamidi on entsyymien ja kuljetusproteiinien induktori, ja se saattaa lisätä monien yleisesti käytettävien lääkevalmisteiden eliminaatiota.
Muiden lääkevalmisteiden mahdolliset vaikutukset apalutamidialtistukseen
CYP2C8:aa estävät lääkevalmisteet
CYP2C8-entsyymi osallistuu apalutamidin eliminaatioon ja sen aktiivisen metaboliitin muodostumiseen. Lääkkeiden yhteisvaikutustutkimuksessa, jossa 240 mg:n apalutamidikerta-annos annettiin samanaikaisesti gemfibrotsiilin (voimakas CYP2C8:n estäjä) kanssa, apalutamidin Cmax pieneni 21 %, kun taas AUC suureni 68 %. Aktiivisten fraktioiden (apalutamidin ja tehon mukaan säädetyn aktiivisen metaboliitin summa) Cmax-arvo pieneni 21 %, kun taas AUC-arvo suureni 45 %. Kun Erleada-tabletteja käytetään yhdessä voimakkaiden CYP2C8:n estäjien (esim. gemfibrotsiili, klopidogreeli) kanssa, aloitusannosta ei tarvitse muuttaa, mutta Erleada-annoksen pienentämistä pitää kuitenkin harkita siedettävyyden perusteella (ks. kohta Annostus ja antotapa). Heikot tai kohtalaiset CYP2C8:n estäjät eivät oletettavasti vaikuta apalutamidialtistukseen.
CYP3A4:ää estävät lääkevalmisteet
CYP3A4-entsyymi osallistuu apalutamidin eliminaatioon ja sen aktiivisen metaboliitin muodostumiseen. Lääkkeiden yhteisvaikutustutkimuksessa, jossa 240 mg:n apalutamidikerta-annos annettiin samanaikaisesti itrakonatsolin (voimakas CYP3A4:n estäjä) kanssa, apalutamidin Cmax pieneni 22 %, kun taas AUC pysyi ennallaan. Aktiivisten fraktioiden (apalutamidin ja tehon mukaan säädetyn aktiivisen metaboliitin summa) Cmax-arvo pieneni 22 %, kun taas AUC-arvo pysyi jälleen ennallaan. Kun Erleada-tabletteja käytetään yhdessä voimakkaiden CYP3A4:n estäjien (esim. ketokonatsoli, ritonaviiri, klaritromysiini) kanssa, aloitusannosta ei tarvitse muuttaa, mutta Erleada-annoksen pienentämistä pitää harkita siedettävyyden perusteella (ks. kohta Annostus ja antotapa). Heikot tai kohtalaiset CYP3A4:n estäjät eivät oletettavasti vaikuta apalutamidialtistukseen.
CYP3A4:ää tai CYP2C8:aa indusoivat lääkevalmisteet
CYP3A4:n tai CYP2C8:n induktorien vaikutuksia apalutamidin farmakokinetiikkaan ei ole tutkittu in vivo. Voimakkailla CYP3A4:n estäjillä tai voimakkailla CYP2C8:n estäjillä tehtyjen yhteisvaikutustutkimusten tulosten perusteella CYP3A4:n tai CYP2C8:n induktoreilla ei oletettavasti ole kliinisesti oleellisia vaikutuksia apalutamidin ja sen aktiivisten fraktioiden farmakokinetiikkaan. Kun Erleada-tabletteja käytetään yhdessä CYP3A4:n tai CYP2C8:n induktoreiden kanssa, annosta ei näin ollen tarvitse muuttaa.
Apalutamidin mahdolliset vaikutukset muiden lääkevalmisteiden altistukseen
Apalutamidi on voimakas entsyymi-induktori, ja se lisää monien entsyymien ja kuljettajaproteiinien synteesiä. Näin ollen yhteisvaikutuksia oletettavasti esiintyy monien sellaisten yleisesti käytettävien lääkevalmisteiden kanssa, jotka ovat entsyymien tai kuljettajaproteiinien substraatteja. Pitoisuudet plasmassa voivat pienentyä huomattavasti, mistä voi aiheutua kliinisen vaikutuksen häviäminen tai heikkeneminen. Riskinä on myös lisääntynyt aktiivisten metaboliittien muodostuminen.
Lääkeaineita metaboloivat entsyymit
In vitro ‑tutkimukset osoittivat, että apalutamidi ja N‑desmetyyliapalutamidi ovat kohtalaisia tai voimakkaita CYP3A4:n ja CYP2B6:n induktoreita, kohtalaisia CYP2B6:n ja CYP2C8:n estäjiä ja heikkoja CYP2C9:n, CYP2C19:n ja CYP3A4:n estäjiä. Apalutamidin ja N‑desmetyyliapalutamidin terapeuttisesti oleelliset pitoisuudet eivät vaikuta CYP1A2- ja CYP2D6-entsyymeihin. Apalutamidin vaikutusta CYP2B6:n substraatteihin ei ole tutkittu in vivo, ja nettovaikutus on tällä hetkellä tuntematon. Kun Erleada-tablettien kanssa käytetään lääkevalmisteita, jotka ovat CYP2B6:n substraatteja (esim. efavirentsi), haittavaikutuksia on seurattava, substraattien tehon häviämistä on arvioitava, ja substraatin annosta voi olla tarpeen muuttaa, jotta pitoisuudet plasmassa pysyvät optimaalisina.
Apalutamidi on ihmisellä voimakas CYP3A4:n ja CYP2C19:n induktori ja heikko CYP2C9:n induktori. Lääkkeiden yhteisvaikutustutkimuksessa, jossa käytettiin montaa lääkettä samanaikaisesti (cocktail approach), apalutamidin samanaikainen käyttö suun kautta otettavien herkkien CYP:n substraattien kerta-annoksen kanssa pienensi midatsolaamin (CYP3A4:n substraatti) AUC-arvoa 92 %, omepratsolin (CYP2C19:n substraatti) AUC-arvoa 85 % ja S-varfariinin (CYP2C9:n substraatti) AUC-arvoa 46 %. Apalutamidi ei muuttanut altistusta CYP2C8:n subtraatille kliinisesti merkittävästi. Erleada-valmisteen samanaikainen käyttö sellaisten lääkevalmisteiden kanssa, jotka metaboloituvat pääasiassa CYP3A4:n (esim. darunaviiri, felodipiini, midatsolaami, simvastatiini), CYP2C19:n (esim. diatsepaami, omepratsoli) tai CYP2C9:n (esim. varfariini, fenytoiini) välityksellä, voi vähentää altistusta näille lääkevalmisteille. Jos mahdollista, näiden lääkevalmisteiden vaihtamista johonkin toiseen valmisteeseen suositellaan, tai jos lääkevalmisteen käyttöä jatketaan, tehon häviämistä pitää arvioida. Jos varfariinia käytetään Erleada-hoidon aikana, INR-arvoa pitää seurata.
Apalutamidista aiheutuva CYP3A4:n induktio viittaa siihen, että UDP-glukuronosyylitransferaasi (UGT) voi indusoitua myös nukleaarisen pregnaani-X-reseptorin (PXR) aktivaation välityksellä. Erleadan samanaikainen käyttö sellaisten lääkevalmisteiden kanssa, jotka ovat UGT:n substraatteja (esim. levotyroksiini, valproiinihappo), voi vähentää altistusta näille lääkevalmisteille. Kun UGT:n substraatteja käytetään yhdessä Erleada-valmisteen kanssa, substraatin tehon häviämistä on arvioitava, ja substraatin annosta voi olla tarpeen muuttaa, jotta pitoisuudet plasmassa pysyvät optimaalisina.
Lääkkeiden kuljettajaproteiinit
Apalutamidin osoitettiin kliinisesti olevan heikko P-glykoproteiinin (P-gp), rintasyöpäresistenssiproteiinin (BCRP) ja orgaanisen anionin kuljettajapolypeptidin 1B1 (OATP1B1) induktori. Lääkkeiden yhteisvaikutustutkimuksessa, jossa käytettiin montaa lääkettä samanaikaisesti (cocktail approach), apalutamidin samanaikainen käyttö suun kautta otettavien herkkien kuljettajaproteiinien substraattien kerta-annoksen kanssa pienensi feksofenadiinin (P-gp:n substraatti) AUC-arvoa 30 % ja rosuvastatiinin (BCRP:n/OATP1B1:n substraatti) AUC-arvoa 41 %, mutta se ei vaikuttanut Cmax-arvoon. Erleada-valmisteen samanaikainen käyttö sellaisten lääkevalmisteiden kanssa, jotka ovat P‑gp:n (esim. kolkisiini, dabigatraanieteksilaatti, digoksiini), BCRP:n tai OATP1B1:n (esim. lapatinibi, metotreksaatti, rosuvastatiini, repaglinidi) substraatteja, voi vähentää altistusta näille lääkevalmisteille. Kun P-gp:n, BCRP:n tai OATP1B1:n substraatteja käytetään yhdessä Erleada-valmisteen kanssa, substraatin tehon häviämistä on arvioitava, ja substraatin annosta voi olla tarpeen muuttaa, jotta pitoisuudet plasmassa pysyvät optimaalisina.
In vitro ‑tietojen perusteella ei voida sulkea pois sitä, että apalutamidi ja sen N-desmetyylimetaboliitti voivat estää orgaanisen kationin kuljettajaproteiinin 2 (OCT2), orgaanisen anionin kuljettajaproteiinin 3 (OAT3) sekä monilääke- ja toksisten aineiden ekstruusioproteiinien (MATE) toimintaa. Orgaanisen anionin kuljettajaproteiinin 1 (OAT1) estymistä ei havaittu in vitro.
GnRH:n analogit
Apalutamidin samanaikaisella käytöllä leuprolidiasetaatin (GnRH:n analogi) kanssa etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastavien potilaiden hoidossa ei ollut näkyvää vaikutusta vakaan tilan leuprolidialtistukseen.
Lääkevalmisteet, jotka pidentävät QT-aikaa
Androgeenideprivaatiohoito voi pidentää QT-aikaa, joten Erleada-tablettien ja QT-aikaa tunnetusti pidentävien lääkevalmisteiden tai kääntyvien kärkien takykardiaa mahdollisesti aiheuttavien lääkevalmisteiden, kuten IA ryhmän (esim. kinidiini, disopyramidi) tai III ryhmän (esim. amiodaroni, sotaloli, dofetilidi, ibutilidi) rytmihäiriölääkevalmisteiden, metadonin, moksifloksasiinin, psykoosilääkkeiden (esim. haloperidoli) jne., samanaikaista käyttöä pitää arvioida tarkoin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Ehkäisy miehille ja naisille
Ei tiedetä, erittyykö apalutamidia tai sen metaboliitteja siemennesteeseen. Erleada voi olla haitallista kehittyvälle sikiölle. Jos potilas on sukupuoliyhteydessä naiskumppanin kanssa, joka voi tulla raskaaksi, potilaan pitää käyttää kondomia sekä jotakin toista hyvin tehokasta ehkäisymenetelmää hoidon aikana ja 3 kuukauden ajan viimeisen Erleada-annoksen jälkeen.
Raskaus
Erleadan käyttö naisille, jotka ovat raskaana tai voivat tulla raskaaksi, on vasta-aiheista (ks. kohta Vasta-aiheet). Raskaana olevan naisen ottama Erleada voi lisääntymistä koskevien eläinkokeiden ja vaikutusmekanisminsa perusteella vahingoittaa sikiötä ja aiheuttaa keskenmenon. Erleadan käytöstä raskaana oleville naisille ei ole olemassa tietoja.
Imetys
Ei tiedetä, erittyvätkö apalutamidi tai sen metaboliitit ihmisillä äidinmaitoon. Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. Erleada-valmistetta ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Eläinkokeiden perusteella Erleada voi heikentää miesten hedelmällisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Erleada-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Erleada-valmistetta käyttävillä potilailla on kuitenkin raportoitu kouristuskohtauksia. Potilaille on kerrottava tästä ajokykyä ja koneidenkäyttökykyä koskevasta riskistä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmät haittavaikutukset ovat väsymys (26 %), ihottuma (kaikki asteet 26 % ja 3. tai 4. aste 6 %), hypertensio (22 %), kuumat aallot (18 %), nivelsärky (17 %), ripuli (16 %), kaatumiset (13 %) ja painon lasku (13 %). Muita tärkeitä haittavaikutuksia ovat murtumat (11 %), heikentynyt ruokahalu (11 %) ja hypotyreoosi (8 %).
Haittavaikutustaulukko
Jäljempänä luetellaan kliinisissä tutkimuksissa ja/tai valmisteen markkinoille tulon jälkeen havaitut haittavaikutukset yleisyysluokittain. Yleisyysluokat määritellään seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| Taulukko 1. Haittavaikutukset | |
| Elinjärjestelmä | Haittavaikutus ja yleisyys |
| Veri ja imukudos | yleinen: neutropenia |
| tuntematon: agranulosytoosi | |
| Umpieritys | yleinen: hypotyreoosia |
| Aineenvaihdunta ja ravitsemus | hyvin yleinen: heikentynyt ruokahalu |
| yleinen: hyperkolesterolemia, hypertriglyseridemia | |
| Hermosto | yleinen: makuhäiriö, iskeemiset aivoverenkiertohäiriötb |
| melko harvinainen: kouristuskohtausc (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), levottomat jalat ‑oireyhtymä | |
| Sydän | yleinen: iskeeminen sydänsairausd |
| tuntematon: QT-ajan piteneminen (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset) | |
| Verisuonisto | hyvin yleinen: kuumat aallot, hypertensio |
| Hengityselimet, rintakehä ja välikarsina | tuntematon: interstitiaalinen keuhkosairause |
| Ruoansulatuselimistö | hyvin yleinen: ripuli |
| Iho ja ihonalainen kudos | hyvin yleinen: ihottumaf |
| yleinen: kutina, alopesia | |
| melko harvinainen: likenoidi ihottuma | |
| tuntematon: lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio (DRESS)e, Stevens–Johnsonin oireyhtymä (SJS) / toksinen epidermaalinen nekrolyysi (TEN)e | |
| Luusto, lihakset ja sidekudos | hyvin yleinen: murtumag, nivelsärky |
| yleinen: lihasspasmi | |
| Yleisoireet ja antopaikassa todettavat haitat | hyvin yleinen: väsymys |
| Tutkimukset | hyvin yleinen: painon lasku |
| Vammat, myrkytykset ja hoitokomplikaatiot | hyvin yleinen: kaatumiset |
| a Sisältää hypotyreoosin, suurentuneen veren tyreotropiinihormonipitoisuuden (TSH), pienentyneen tyroksiinipitoisuuden, autoimmuunityreoidiitin, pienentyneen vapaan tyroksiinin pitoisuuden, pienentyneen trijodityroniinin pitoisuuden b Sisältää ohimenevän aivoverenkiertohäiriön, aivohaverin, aivoverenkiertohäiriön, iskeemisen aivohalvauksen, kaulavaltimon arterioskleroosin, kaulavaltimon ahtauman, hemipareesin, lakuunainfarktin, lakunaarisen aivohalvauksen, tromboottisen aivoinfarktin, vaskulaarisen enkefalopatian, pikkuaivoinfarktin, aivoinfarktin ja aivoiskemian. c Sisältää kieleen puremisen d Sisältää angina pectoriksen, epästabiilin angina pectoriksen, sydäninfarktin, akuutin sydäninfarktin, sepelvaltimon tukoksen, sepelvaltimon ahtauman, akuutin sepelvaltimo-oireyhtymän, sepelvaltimoiden arterioskleroosin, poikkeavan tuloksen sydämen rasituskokeessa, suurentuneen troponiinipitoisuuden, sydänlihasiskemian e Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet. f Ks. kohta Ihottuma jäljempänä otsikon Valikoitujen haittavaikutusten kuvaus alla g Sisältää kylkiluumurtuman, lannenikamien murtuman, selkärangan kompressiomurtuman, selkärangan murtuman, jalkaterän murtuman, lonkkamurtuman, olkaluun murtuman, rintanikamamurtuman, yläraajamurtuman, ristiluumurtuman, käsimurtuman, häpyluun murtuman, lonkkamaljan murtuman, nilkkamurtuman, kompressiomurtuman, kylkirustomurtuman, kasvoluiden murtuman, alaraajamurtuman, osteoporoottisen murtuman, rannemurtuman, repeämismurtuman, pohjeluun murtuman, häntäluun murtuman, lantion murtuman, värttinäluun murtuman, rintalastan murtuman, rasitusmurtuman, tapaturmaisen murtuman, kaulanikamamurtuman, reisiluunkaulan murtuman, sääriluun murtuman. Ks. jäljempänä. | |
Valikoitujen haittavaikutusten kuvaus
Ihottuma
Apalutamidihoitoon liittynyttä ihottumaa kuvattiin yleisimmin makulaariseksi tai makulopapulaariseksi. Ihottuma sisälsi ihottuman, makulopapulaarisen ihottuman, yleistyneen ihottuman, urtikarian, kutisevan ihottuman, makulaarisen ihottuman, konjunktiviitin, erythema multiformen, papulaarisen ihottuman, ihon hilseilyn, sukupuolielinten ihottuman, erytematoottisen ihottuman, suutulehduksen, lääkeaineihottuman, suun haavaumat, pustulaarisen ihottuman, rakkulat, näppylät, pemfigoidin, ihon eroosion, dermatiitin ja rakkulaisen ihottuman. Ihottumaa raportoitiin haittavaikutuksena 26 %:lla apalutamidihoitoa saaneista potilaista. 3. asteen ihottumaa (määritelty > 30 % kehon pinta-alasta peittäväksi) raportoitiin 6 %:lla apalutamidihoitoa saaneista potilaista.
Ajan mediaani ihottuman ilmaantumiseen oli 83 vuorokautta. Seitsemälläkymmenelläkahdeksalla prosentilla potilaista ihottuma hävisi, ja ihottuman häviämiseen kuluneen ajan mediaani oli 78 vuorokautta. Käytettyjä lääkevalmisteita olivat paikallisesti käytettävät kortikosteroidit, suun kautta otettavat antihistamiinit, ja 19 % potilaista sai systeemisesti käytettäviä kortikosteroideja. Niistä potilaista, joille ilmaantui ihottumaa, 28 % keskeytti hoidon ja 14 %:n annosta pienennettiin (ks. kohta Annostus ja antotapa). Ihottuma uusiutui 59 %:lla niistä potilaista, jotka keskeyttivät hoidon. Ihottuman vuoksi apalutamidihoidon lopetti 7 % niistä potilaista, joille ilmaantui ihottumaa.
Kaatumiset ja murtumat
Tutkimuksessa ARN‑509‑003 murtumia raportoitiin 11,7 %:lla apalutamidihoitoa saaneista potilaista ja 6,5 %:lla lumehoitoa saaneista potilaista. Kummassakin hoitoryhmässä puolet potilaista oli kaatunut murtumaa edeltäneiden 7 päivän aikana. Kaatumisia raportoitiin 15,6 %:lla apalutamidihoitoa saaneista potilaista verrattuna 9,0 %:iin lumehoitoa saaneista potilaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iskeeminen sydänsairaus ja iskeemiset aivoverenkiertohäiriöt
Satunnaistetussa tutkimuksessa (SPARTAN), jossa oli mukana etäpesäkkeetöntä kastraatioresistenttiä eturauhassyöpää sairastavia potilaita, iskeeminen sydänsairaus ilmeni 4 %:lla apalutamidihoitoa saaneista potilaista ja 3 %:lla lumehoitoa saaneista potilaista. Satunnaistetussa tutkimuksessa (TITAN), jossa oli mukana etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastavia potilaita, iskeeminen sydänsairaus ilmeni 4 %:lla apalutamidihoitoa saaneista potilaista ja 2 %:lla lumehoitoa saaneista potilaista. SPARTAN- ja TITAN-tutkimuksissa 6 apalutamidihoitoa saanutta potilasta (0,5 %) ja 2 lumehoitoa saanutta potilasta (0,2 %) kuoli iskeemisen sydänsairauden seurauksena (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
SPARTAN-tutkimuksessa, jossa apalutamidialtistuksen mediaani oli 32,9 kuukautta ja lumealtistuksen mediaani oli 11,5 kuukautta, iskeemisiä aivoverenkiertohäiriöitä esiintyi 4 %:lla apalutamidihoitoa saaneista potilaista ja 1 %:lla lumehoitoa saaneista potilaista (ks. edellä). TITAN-tutkimuksessa iskeemisiä aivoverenkiertohäiriöitä oli samansuuruisella osalla apalutamidia saaneessa (1,5 %) ja lumevalmistetta saaneessa (1,5 %) ryhmässä. SPARTAN- ja TITAN-tutkimuksissa kaksi apalutamidihoitoa saanutta (0,2 %) potilasta kuoli iskeemisen aivoverenkiertohäiriön seurauksena, mutta lumehoitoryhmässä yksikään potilaista ei kuollut tästä syystä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hypotyreoosi
Hypotyreoosia raportoitiin neljän kuukauden välein tehtyjen tyreotropiinihormonin (TSH) pitoisuusmääritysten perusteella 8 %:lla apalutamidihoitoa saaneista potilaista ja 2 %:lla lumehoitoa saaneista potilaista. 3. tai 4. asteen haittatapahtumia ei todettu. Potilaista, jotka saivat jo ennestään kilpirauhasen korvaushoitoa, hypotyreoosia esiintyi apalutamidihoitoryhmässä 30 %:lla ja lumeryhmässä 3 %:lla. Niistä potilaista, jotka eivät saaneet kilpirauhasen korvaushoitoa, hypotyreoosia esiintyi 7 %:lla apalutamidihoitoa saaneista potilaista ja 2 %:lla lumehoitoa saaneista potilaista. Kilpirauhasen korvaushoito on aloitettava tai sen annosta muutettava, kun se on kliinisesti aiheellista (ks. kohta Yhteisvaikutukset).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Apalutamidiyliannostukseen ei tunneta spesifistä vastalääkettä. Yliannostustapauksessa Erleada-hoito pitää lopettaa, ja potilaalle pitää antaa yleistä elintoimintoja tukevaa hoitoa, kunnes kliininen toksisuus on vähentynyt tai hävinnyt. Yliannostusten yhteydessä ei ole vielä havaittu haittavaikutuksia, mutta tällaiset reaktiot ovat oletettavasti kohdassa Haittavaikutukset lueteltujen haittavaikutusten kaltaisia.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Endokrinologiset lääkeaineet, antiandrogeenit, ATC-koodi: L02BB05
Vaikutusmekanismi
Apalutamidi on suun kautta otettava selektiivinen androgeenireseptorin estäjä, joka sitoutuu suoraan androgeenireseptorin ligandia sitovaan domeeniin. Apalutamidi estää androgeenireseptorin nukleaarisen translokaation, estää sitoutumista DNA:han, hillitsee androgeenireseptorivälitteistä transkriptiota, eikä sillä ole androgeenireseptoriagonistista aktiivisuutta. Apalutamidihoito vähentää kasvainsolujen proliferaatiota ja lisää apoptoosia, joten sillä on voimakas kasvaimen kasvua estävä vaikutus. Apalutamidin pääasiallinen metaboliitti, N‑desmetyyliapalutamidi, vastaa kolmasosaa apalutamidin aktiivisuudesta in vitro.
Prostataspesifisen antigeenin (PSA) väheneminen
Etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastaville potilaille (TITAN-tutkimuksessa) annettu 240 mg apalutamidia päivittäin yhdistelmänä androgeenideprivaatiohoidon kanssa pienensi PSA-arvon alle havaitsemisrajan (< 0,2 ng/ml) milloin tahansa tutkimuksen aikana 68 %:lla potilaista verrattuna 32 %:iin potilaista, jotka saivat pelkkää androgeenideprivaatiohoitoa. Mediaaniaika PSA-arvon pienenemiseen alle havaitsemisrajan oli apalutamidin ja androgeenideprivaatiohoidon yhdistelmää saaneilla potilailla 1,9 kuukautta. Apalutamidin ja androgeenideprivaatiohoidon yhdistelmä pienensi PSA-arvoa ≥ 50 % lähtötilanteesta milloin tahansa tutkimuksen aikana 90 %:lla potilaista verrattuna 55 %:iin pelkkää androgeenideprivaatiohoitoa saaneista potilaista.
Etäpesäkkeetöntä kastraatioresistenttiä eturauhassyöpää sairastaville potilaille (SPARTAN-tutkimuksessa) annettu 240 mg apalutamidia päivittäin yhdistelmänä androgeenideprivaatiohoidon kanssa pienensi PSA-arvon alle havaitsemisrajan (< 0,2 ng/ml) milloin tahansa tutkimuksen aikana 38 %:lla potilaista, mutta ei yhdelläkään (0 %) potilaista, jotka saivat pelkkää androgeenideprivaatiohoitoa. Mediaaniaika PSA-arvon pienenemiseen alle havaitsemisrajan oli apalutamidin ja androgeenideprivaatiohoidon yhdistelmää saaneilla potilailla 2,8 kuukautta. Apalutamidin ja androgeenideprivaatiohoidon yhdistelmä pienensi PSA-arvoa ≥ 50 % lähtötilanteesta milloin tahansa tutkimuksen aikana 90 %:lla potilaista verrattuna 2,2 %:iin pelkkää androgeenideprivaatiohoitoa saaneista potilaista.
Sydämen elektrofysiologia
Apalutamidin 240 mg kerran vuorokaudessa annosten vaikutusta QTc-aikaan selvitettiin avoimessa, kontrolloimattomassa yhden hoitoryhmän monikeskustutkimuksessa, jonka tarkoituksena oli tutkia QT-aikaa 45:llä kastraatioresistenttiä eturauhassyöpää sairastavalla potilaalla. Vakaassa tilassa QTcF-ajan suurin keskimääräinen muutos lähtötilanteesta oli 12,4 ms (2-tahoisen 90 %:n luottamusvälin yläraja: 16,0 ms). Altistuksen ja QT-ajan yhteyttä selvittänyt analyysi viittasi siihen, että QTcF-aika pidentyy apalutamidin ja sen aktiivisen metaboliitin vaikutuksesta suhteessa pitoisuuteen.
Kliininen teho ja turvallisuus
Apalutamidin teho ja turvallisuus on osoitettu kahdessa vaiheen 3 satunnaistetussa lumekontrolloidussa tutkimuksessa ARN-509-003 (etäpesäkkeetön kastraatioresistentti eturauhassyöpä) ja 56021927PCR3002 (etäpesäkkeinen hormonisensitiivinen eturauhassyöpä).
TITAN: etäpesäkkeinen hormonisensitiivinen eturauhassyöpä
TITAN oli satunnaistettu, kaksoissokkoutettu, lumekontrolloitu monikansallinen kliininen monikeskustutkimus, jossa 1 052 etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastavaa potilasta satunnaistettiin (1:1) saamaan joko apalutamidia suun kautta annoksina 240 mg kerran päivässä (N = 525) tai lumelääkettä kerran päivässä (N = 527). Kaikilla potilailla piti olla teknetium(99m)-luustokartoituksessa vähintään yksi luuston etäpesäke. Potilaita ei otettu tutkimukseen mukaan, jos etäpesäke rajoittui joko imusolmukkeisiin tai sisäelimiin (esim. maksaan tai keuhkoihin). Kaikki TITAN-tutkimuksen potilaat saivat samanaikaisesti GnRH:n analogihoitoa tai heille oli aiemmin tehty kummankin kiveksen poistoleikkaus. Noin 11 % potilaista oli saanut aiemmin dosetakselihoitoa (enintään 6 hoitosykliä, viimeinen annos ≤ 2 kuukautta ennen satunnaistamista ja vaste oli säilynyt ennen satunnaistamista). Poissulkukriteerejä olivat tiedossa olevat etäpesäkkeet aivoissa, aiempi hoito jollakin seuraavan sukupolven antiandrogeenilla (esim. entsalutamidilla), CYP17:n estäjillä (esim. abirateroniasetaatilla), immuunihoito (esim. sipuleuseeli T:llä), radiofarmaseuttisilla lääkeaineilla tai muilla eturauhassyöpähoidoilla tai anamneesissa kouristuskohtaus tai sairaus, joka voi altistaa kouristuskohtauksille. Potilaat ositettiin diagnoosin yhteydessä määritettyjen Gleason-pisteiden, aiemman dosetakselin käytön ja maantieteellisen alueen perusteella. Sekä matalan että korkean tautivolyymin etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastavat potilaat soveltuivat mukaan tutkimukseen. Korkean volyymin taudiksi määriteltiin joko sisäelinten etäpesäkkeet ja vähintään yksi leesio luustossa tai vähintään neljä leesiota luustossa, joista vähintään yksi leesio muualla kuin selkärangassa tai lantiossa. Matalan volyymin taudiksi määriteltiin luuston leesiot, jotka eivät sopineet korkean volyymin taudin määritelmään.
Potilaiden seuraavat demografiset ja taudin lähtötilanteen ominaisuudet olivat tasapainossa hoitoryhmien kesken. Iän mediaani oli 68 vuotta (vaihteluväli 43–94 vuotta), ja 23 % potilaista oli vähintään 75-vuotiaita. Etninen tausta jakautui seuraavasti: valkoihoisia 68 %, aasialaisia 22 % ja mustaihoisia 2 %. Kuudellakymmenelläkolmella prosentilla (63 %) potilaista oli korkean volyymin tauti, ja 37 %:lla potilaista matalan volyymin tauti. Kuuttatoista prosenttia (16 %) potilaista oli aiemmin hoidettu leikkauksella tai eturauhasen sädehoidolla tai molemmilla. Valtaosalla (92 %) tutkittavista Gleason-pisteet olivat vähintään 7. Kuusikymmentäkahdeksan prosenttia (68 %) potilaista oli saanut etäpesäkkeettömään tautiin aiemmin hoitoa ensimmäisen sukupolven antiandrogeeneilla. Kastraatioresistenssin kriteereitä ei määritelty lähtötilanteessa, mutta 94 %:lla potilaista prostataspesifisen antigeenin (PSA) pitoisuuden todettiin pienentyneen androgeenideprivaatiohoidon (ADT) aloittamisesta ensimmäiseen apalutamidi- tai lumeannokseen mennessä. Yhtä lumeryhmän potilasta lukuun ottamatta kaikkien potilaiden ECOG PS (Eastern Cooperative Oncology Group Performance Status) ‑toimintakykyluokka tutkimukseen tullessa oli 0 tai 1. Kummassakin ryhmässä hoidon lopettaneilla potilailla (lumehoitoa saaneiden N = 271 ja Erleada-hoitoa saaneiden N = 170) yleisin syy tutkimushoidon lopettamiseen oli taudin eteneminen. Tutkimushoidon jälkeen seuraavaa syöpähoitoa sai suurempi osuus (73 %) lumehoitoa saaneista potilaista kuin Erleada-hoitoa saaneista potilaista (54 %).
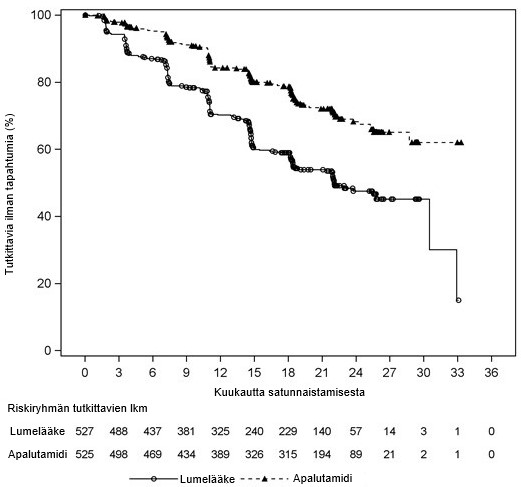
Tutkimuksen tärkeimmät tehon mittarit olivat kokonaiselossaoloaika (overall survival, OS) ja radiologinen etenemisvapaa elossaoloaika (radiographic progression-free survival, rPFS). Yhteenveto TITAN-tutkimuksen tehoa koskevista tuloksista esitetään taulukossa 2 ja kuvissa 1 ja 2.
| Taulukko 2. Yhteenveto tehoa koskevista tuloksista; hoitoaikeen mukainen (ITT) etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastava potilasjoukko (TITAN) | ||
| Päätetapahtuma | Erleada N = 525 | Lumelääke N = 527 |
| Ensisijaisen analyysin kokonaiselossaoloaikaa | ||
| Kuolemia (%) | 83 (16 %) | 117 (22 %) |
| Mediaani, kuukautta (95 %:n luottamusväli) | NE (NE; NE) | NE (NE; NE) |
| Riskitiheyssuhde (95 %:n luottamusväli)b | 0,671 (0,507; 0,890) | |
| p-arvoc | 0,0053 | |
| Päivitetty kokonaiselossaoloaikad | ||
| Kuolemia (%) | 170 (32 %) | 235 (45 %) |
| Mediaani, kuukautta (95 %:n luottamusväli) | NE (NE; NE) | 52 (42; NE) |
| Riskitiheyssuhde (95 %:n luottamusväli)b | 0,651 (0,534; 0,793) | |
| p-arvoc,e | < 0,0001 | |
| Radiologinen etenemisvapaa elossaoloaika | ||
| Todettu taudin eteneminen tai kuolema (%) | 134 (26 %) | 231 (44 %) |
| Mediaani, kuukautta (95 %:n luottamusväli) | NE (NE; NE) | 22,08 (18,46; 32,92) |
| Riskitiheyssuhde (95 %:n luottamusväli)b | 0,484 (0,391; 0,600) | |
| p-arvoc | < 0,0001 | |
a Perustuu ennalta määritettyyn välianalyysiin, jossa seuranta-ajan mediaani oli 22 kuukautta. b Riskitiheyssuhde perustuu ositettuun suhteellisen riskin malliin. Riskitiheyssuhde < 1 suosii hoitoa vaikuttavalla aineella. c p-arvo perustuu diagnoosin yhteydessä määriteltyjen Gleason-pisteiden (≤ 7 vs. > 7), maantieteellisen alueen (Pohjois-Amerikka/EU vs. muut maat) ja aiemman dosetakselin käytön (kyllä vs. ei) perusteella ositettuun log-rank-testiin. d Seuranta-ajan mediaani 44 kuukautta. e Nimellinen p-arvo, ei muodolliseen tilastolliseen testaukseen. NE = ei arvioitavissa (Not Estimable) | ||
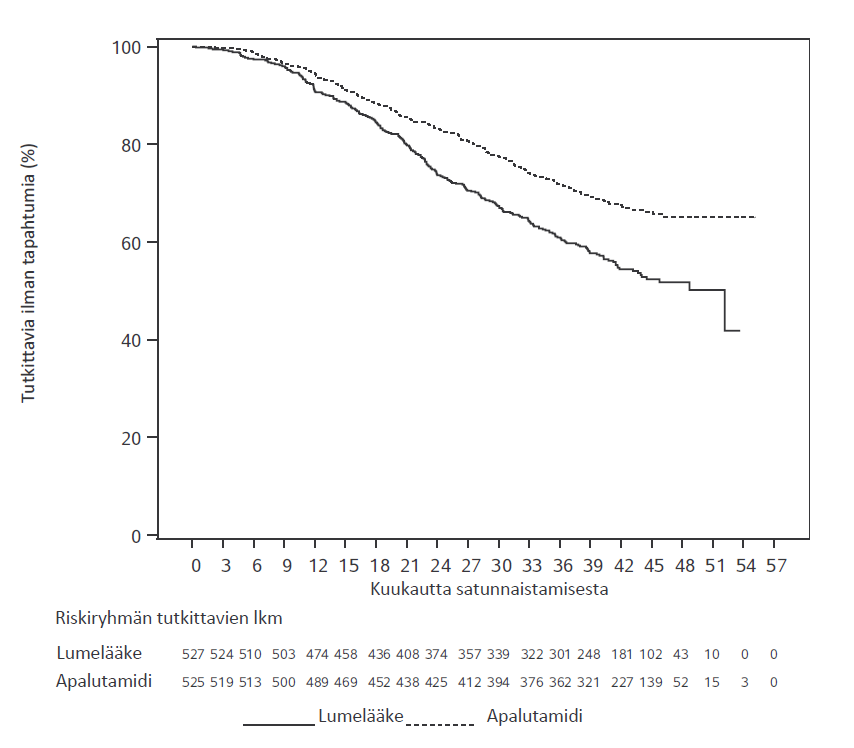
Ensisijaisessa analyysissa kokonaiselossaoloajan ja radiologisen etenemisvapaan elossaoloajan osoitettiin pidentyneen Erleada-hoitoon satunnaistetuilla potilailla tilastollisesti merkitsevästi verrattuna lumehoitoon satunnaistettuihin potilaisiin. Päivitetty kokonaiselossaoloajan analyysi tehtiin tutkimuksen loppuanalyysin yhteydessä, jolloin todettiin 405 kuolemaa ja seuranta-ajan mediaani oli 44kuukautta. Päivitetyn analyysin tulokset olivat yhdenmukaisia ennalta määritetyn välianalyysin tulosten kanssa. Kokonaiselossaoloaika piteni, vaikka 39 % lumeryhmän potilaista siirtyi Erleada-hoitoon. Hoidon keston mediaani Erleada-hoitoon siirryttäessä oli 15 kuukautta.
Radiologisen etenemisvapaan elossaoloajan havaittiin pidentyneen yhdenmukaisesti potilaiden osajoukoissa mukaan lukien korkea tai matala tautivolyymi, diagnoosin yhteydessä määritetty mestastaasivaihe (M0 tai M1), aiempi dosetakselin käyttö (kyllä tai ei), ikä (< 65 vuotta, ≥ 65 vuotta tai ≥ 75 vuotta), PSA-arvo lähtötilanteessa yli mediaanin (kyllä tai ei) ja luissa olevien leesioiden lukumäärä (≤ 10 tai > 10).
Kokonaiselossaoloajan havaittiin pidentyneen yhdenmukaisesti potilaiden osajoukoissa mukaan lukien korkea tai matala tautivolyymi, diagnoosin yhteydessä määritetty mestastaasivaihe (M0 tai M1) ja diagnoosin yhteydessä määritetyt Gleason-pisteet (≤ 7 vs. > 7).
Kuva 1. Päivitetyn kokonaiselossaoloajan Kaplan–Meier-kuvaaja; hoitoaikeen mukainen (ITT) etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastava potilasjoukko (TITAN)
Kuva 2. Radiologisen etenemisvapaan elossaoloajan Kaplan–Meier-kuvaaja; hoitoaikeen mukainen (ITT) etäpesäkkeistä hormonisensitiivistä eturauhassyöpää sairastava potilasjoukko (TITAN)
Erleada-hoito siirsi sytotoksisen solunsalpaajahoidon aloittamista myöhempään ajankohtaan tilastollisesti merkitsevästi (riskitiheyssuhde = 0,391, luottamusväli = 0,274; 0,558; p-arvo < 0,0001), minkä tuloksena hoitoa saaneen ryhmän tutkittavien riski pieneni 61 % lumeryhmään verrattuna.
SPARTAN: etäpesäkkeetön kastraatioresistentti eturauhassyöpä
Kaksoissokkoutetussa kliinisessä monikeskustutkimuksessa (ARN‑509‑003) yhteensä 1 207 tutkittavaa, jotka sairastivat etäpesäkkeetöntä kastraatioresistenttiä eturauhassyöpää, satunnaistettiin suhteessa 2:1 saamaan joko apalutamidia suun kautta annoksina 240 mg kerran vuorokaudessa yhdistelmänä androgeenideprivaatiohoidon kanssa (lääkkeellinen kastraatio tai aiempi kirurginen kastraatio) tai lumelääkettä yhdessä androgeenideprivaatiohoidon kanssa. Tutkimukseen mukaan otettujen tutkittavien PSA-pitoisuuden kahdentumisaika (Prostata Specific Antigen Doubling Time, PSADT) oli ≤ 10 kuukautta, jonka katsottiin osoittavan suurta lähestyvän etäpesäkkeisen taudin ja eturauhassyöpäspesifisen kuoleman riskiä. Kaikki tutkittavat, joille ei ollut tehty kirurgista kastraatiota, saivat jatkuvaa androgeenideprivaatiohoitoa koko tutkimuksen ajan. PSA-tulokset sokkoutettiin eikä niitä käytetty tutkimuksen lopettamiseen. Eri hoitoryhmiin satunnaistetut tutkittavat jatkoivat hoitoa taudin etenemiseen saakka. Taudin eteneminen määriteltiin kuvantamisen sokkoutetun keskitetyn tarkastelun tai uuden hoidon aloituksen perusteella tai sen perusteella, että tutkittavalle ilmaantui toksisuutta, joka ei ollut hyväksyttävissä, tai tutkittava vetäytyi tutkimuksesta.
Potilaiden seuraavat demografiset ja taudin lähtötilanteen ominaisuudet olivat tasapainossa hoitoryhmien kesken. Iän mediaani oli 74 vuotta (vaihteluväli 48–97 vuotta), ja 26 % tutkittavista oli vähintään 80-vuotiaita. Etninen tausta jakautui seuraavasti: valkoihoisia 66 %, mustaihoisia 5,6 %, aasialaisia 12 % ja muita 0,2 %. Kummankin hoitoryhmän tutkittavista 77 %:lle oli tehty eturauhasen leikkaus tai tutkittava oli saanut eturauhaseen sädehoitoa. Valtaosalla (81 %) tutkittavista Gleason-pisteet olivat vähintään 7. Tutkimukseen mukaan tullessa 15 %:lla tutkittavista lantion imusolmukkeiden koko oli < 2 cm. Tutkittavista 73 % oli saanut aiemmin ensimmäisen polven antiandrogeeneja; 69 % tutkittavista oli saanut bikalutamidia ja 10 % tutkittavista oli saanut flutamidia. Kaikkien tutkimukseen mukaan otettujen tutkittavien taudin varmistettiin olevan etäpesäkkeetön. Varmistus tehtiin kuvantamisen keskitetyn ja sokkoutetun tarkastelun perusteella. Tutkittavien ECOG PS (Eastern Cooperative Oncology Group Performance Status) ‑toimintakykyluokka tutkimukseen mukaan tullessa oli 0 tai 1.
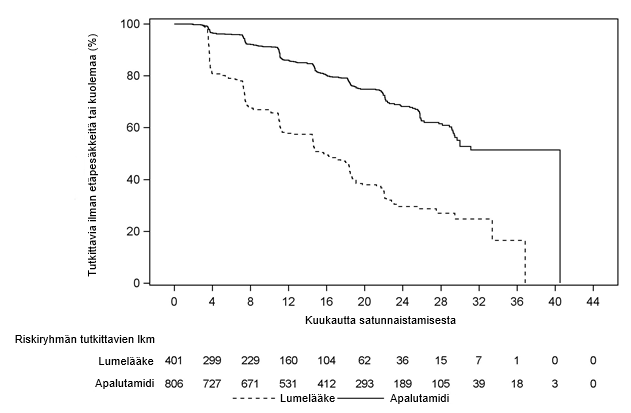
Ensisijainen päätetapahtuma oli metastaasivapaa elossaoloaika (metastasis-free survival, MFS), joka määriteltiin ajaksi satunnaistamisesta ensimmäiseen kuvantamisen keskitetyn ja sokkoutetun tarkastelun varmistamaan näyttöön etäpesäkkeestä luustossa tai kaukoetäpesäkkeenä pehmytkudoksessa tai mistä tahansa syystä aiheutuneeseen kuolemaan, mikä tahansa näistä tapahtui ensin. Erleada-hoito pidensi merkittävästi potilaiden metastaasivapaata elossaoloaikaa. Erleada pienensi etäpesäkkeen tai kuoleman suhteellista riskiä 70 % lumehoitoon verrattuna (riskitiheyssuhde [HR] = 0,30; 95 %:n luottamusväli: 0,24, 0,36; p < 0,0001). Metastaasivapaan elossaoloajan mediaani taudin etenemisessä etäpesäkkeiseksi oli Erleada-hoidossa 41 kuukautta ja lumehoidossa 16 kuukautta (ks. kuva 3). Erleada-hoidon havaittiin parantavan metastaasivapaata elossaoloaikaa yhdenmukaisesti kaikissa ennalta määritellyissä potilasalaryhmissä sisältäen iän, etnisen taustan, maantieteellisen alueen, imusolmukestatuksen, aiempien hormonihoitojen lukumäärän, lähtötilanteen PSA-arvon, PSA-arvon kahdentumisajan, lähtötilanteen ECOG-toimintakykyluokan ja luuta säästävien lääkeaineiden käytön.
Kuva 3. Kaplan‑Meierin käyrä metastaasivapaasta elossaoloajasta tutkimuksessa ARN-509-003
Kaikki tiedot huomioitaessa Erleada- ja androgeenideprivaatiohoitoa saaneilla tutkittavilla todettiin pelkkää androgeenideprivaatiohoitoa saaneisiin tutkittaviin verrattuna huomattavaa paranemista toissijaisissa päätetapahtumissa, joita olivat aika etäpesäkkeeseen (HR = 0,28; 95 %:n luottamusväli: 0,23, 0,34; p < 0,0001), etenemisvapaa elossaoloaika (progression-free survival, PFS) (HR = 0,30; 95 %:n luottamusväli: 0,25, 0,36; p < 0,0001), aika taudin oireiseen etenemiseen (HR = 0,57; 95 %:n luottamusväli: 0,44, 0,73; p < 0,0001), kokonaiselossaoloaika (overall survival, OS) (HR = 0,78; 95 %:n luottamusväli: 0,64, 0,96; p = 0,0161) ja sytotoksisen kemoterapian aloittamiseen kulunut aika (HR = 0,63; 95 %:n luottamusväli: 0,49, 0,81; p = 0,0002).
Ajaksi taudin oireiseen etenemiseen määriteltiin aika satunnaistamisesta luustoon liittyvän tapahtuman tai uuden systeemisen syöpähoidon aloittamista vaativan kivun/oireiden kehittymiseen tai taudin sädehoitoa tai leikkausta vaativaan lokoregionaalisen etenemiseen. Vaikka tapahtumien kokonaismäärä oli pieni, näiden kahden ryhmän välinen ero oli riittävän suuri tilastollisen merkitsevyyden saavuttamiseksi. Erleada-hoito vähensi oireisen etenemisen riskiä 43 % lumehoitoon verrattuna (HR = 0,567; 95 %:n luottamusväli: 0,443, 0,725; p < 0,0001). Ajan mediaania taudin oireiseen etenemiseen ei saavutettu kummassakaan hoitoryhmässä.
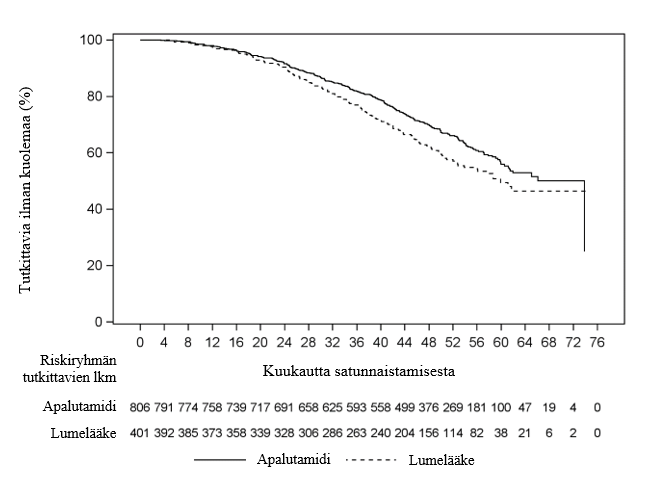
Tulokset osoittivat 52,0 kuukauden (mediaani) seurannan jälkeen, että Erleada-hoito vähensi kuoleman riskiä merkitsevästi (22 %) lumehoitoon verrattuna (HR = 0,784; 95 %:n luottamusväli: 0,643, 0,956; kaksitahoinen p = 0,0161). Kokonaiselossaoloajan mediaani oli Erleada-ryhmässä 73,9 kuukautta ja lumeryhmässä 59,9 kuukautta. Ennalta määritetty alfaraja (p ≤ 0,046) ylitettiin ja tilastollinen merkitsevyys saavutettiin. Hyöty kokonaiselossaoloajassa oli havaittavissa, vaikka 19 % lumeryhmän potilaista saivat Erleada-hoitoa seuraavassa hoitolinjassa.
Kuva 4. Kaplan‑Meierin käyrä kokonaiselossaoloajasta (OS) tutkimuksen ARN-509-003 loppuanalyysissa
Erleada-hoito vähensi merkitsevästi sytotoksisen kemoterapian aloittamisen riskiä 37 % lumehoitoon verrattuna (HR = 0,629; 95 %:n luottamusväli: 0,489, 0,808; p = 0,0002), mikä osoitti tilastollisesti merkitsevän hyödyn Erleada-hoidon ja lumehoidon välillä. Kummassakaan hoitoryhmässä ei saavutettu sytotoksisen kemoterapian aloittamiseen kuluneen ajan mediaania.
Etenemisvapaa elossaoloaika seuraavan hoidon jälkeen (PFS-2, joka määriteltiin ajaksi kuolemaan tai taudin etenemiseen PSA-arvon perusteella, radiologisesti tai oireiseen etenemiseen ensimmäisen tutkimushoitoa seuraavan hoidon aikana tai jälkeen) oli Erleada-hoitoa saaneilla tutkittavilla pidempi kuin lumehoitoa saaneilla tutkittavilla. Tulokset osoittivat PFS-2:n riskin vähentyneen Erleada-hoidossa 44 % lumehoitoon verrattuna (HR = 0,565, 95 %:n luottamusväli: 0,471, 0,677; p < 0,0001).
Erleada-hoidon lisääminen androgeenideprivaatiohoitoon ei vaikuttanut haitallisesti terveyteen liittyvään kokonaiselämänlaatuun, ja analysoitaessa FACT-P (Functional Assessment of Cancer Therapy-Prostate) -kokonaispisteitä ja ala-asteikkoja havaittiin pieni, mutta ei kliinisesti merkittävä muutos lähtötilanteesta Erleada-hoidon eduksi.
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Erleada-valmisteen käytöstä edenneen eturauhassyövän hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Kerran päivässä toistuvan annon jälkeen apalutamidialtistus (Cmax ja pitoisuuskäyrän alla oleva pinta-ala [AUC]) suurenivat suhteessa annokseen 30–480 mg:n annosalueella. Annoksella 240 mg kerran päivässä apalutamidin vakaa tila saavutettiin 4 viikon kuluttua, ja keskimääräinen kumuloitumissuhde oli noin viisinkertainen kerta-annokseen nähden. Vakaassa tilassa apalutamidin Cmax-arvon keskiarvo (variaatiokerroin, CV %) oli 6 mikrog/ml (28 %) ja AUC-arvon keskiarvo (variaatiokerroin, CV %) oli 100 mikrog.h/ml (32 %). Plasman apalutamidipitoisuuksien päivittäisvaihtelut olivat vähäisiä, sillä pienimmän ja suurimman pitoisuuden suhteen keskiarvo oli 1,63. Laskennallisen puhdistuman (CL/F) havaittiin suurenevan toistuvassa annostelussa todennäköisesti apalutamidin oman metabolian induktion seurauksena.
Vakaassa tilassa pääasiallisen metaboliitin, N-desmetyyliapalutamidin, Cmax-arvon keskiarvo (variaatiokerroin, CV %) oli 5,9 mikrog/ml (18 %) ja AUC-arvon keskiarvo (variaatiokerroin, CV %) oli 124 mikrog.h/ml (19 %). N-desmetyyliapalutamidille on vakaassa tilassa kuvaavaa tasainen pitoisuus-aikaprofiili, sillä pienimmän ja suurimman pitoisuuden suhteen keskiarvo oli 1,27. N‑desmetyyliapalutamidin metaboliitti-kanta-ainesuhteen AUC-arvon keskiarvo (variaatiokerroin, CV %) oli toistuvassa annostelussa noin 1,3 (21 %). Systeemisen altistuksen, suhteellisen tehon ja farmakokineettisten ominaisuuksien perusteella N-desmetyyliapalutamidi todennäköisesti osallistuu apalutamidin kliiniseen aktiivisuuteen.
Imeytyminen
Suun kautta annostelun jälkeen ajan mediaani huippupitoisuuden saavuttamiseen plasmassa (tmax) oli 2 tuntia (vaihteluväli: 1–5 tuntia). Absoluuttisen oraalisen biologisen hyötyosuuden keskiarvo on noin 100 %, mikä osoittaa, että suun kautta otettu apalutamidi imeytyy täydellisesti.
Apalutamidin anto paastotilassa ja runsasrasvaisen aterian yhteydessä ei aiheuttanut terveille tutkittaville kliinisesti oleellisia Cmax- ja AUC-arvojen muutoksia. Ruokailun yhteydessä ajan mediaani tmax:n saavuttamiseen viivästyi noin 2 tuntia (ks. kohta Annostus ja antotapa).
Apalutamidi ei ionisoidu oleellisissa fysiologisissa pH-olosuhteissa, joten happoisuutta vähentävät lääkeaineet (esim. protonipumpun estäjät, H2-reseptorin salpaajat, antasidit) eivät oletettavasti vaikuta apalutamidin liukoisuuteen ja biologiseen hyötyosuuteen.
Apalutamidi ja sen N-desmetyylimetaboliitti ovat P-gp:n substraatteja in vitro. Suun kautta otettu apalutamidi imeytyy täydellisesti, joten P-gp ei vähennä apalutamidin imeytymistä eikä P-gp:n estyminen tai induktio siksi oletettavasti vaikuta apalutamidin biologiseen hyötyosuuteen.
Jakautuminen
Apalutamidin keskimääräinen laskennallinen jakautumistilavuus vakaassa tilassa on noin 276 l. Apalutamidin jakautumistilavuus on suurempi kuin elimistön kokonaisnestetilavuus, mikä viittaa sen laajaan ekstravaskulaariseen jakautumisen.
Apalutamidi sitoutuu 96-prosenttisesti ja N-desmetyyliapalutamidi 95‑prosenttisesti plasman proteiineihin, lähinnä seerumin albumiiniin, pitoisuudesta riippumattomasti.
Biotransformaatio
Kun suun kautta annettiin kerta-annoksena 240 mg:n annos 14C‑merkittyä apalutamidia, apalutamidi, apalutamidin aktiivinen metaboliitti N-desmetyyliapalutamidi ja inaktiivinen karboksyylihappometaboliitti vastasivat valtaosaa plasman 14C‑radioaktiivisuudesta, sillä ne käsittivät 45 % (apalutamidi), 44 % (N-desmetyyliapalutamidi) ja 3 % (inaktiivinen karboksyylihappometaboliitti) kokonais-14C‑AUC-arvosta.
Apalutamidin pääasiallinen eliminaatioreitti on metabolia. Se metaboloituu pääasiassa CYP2C8:n ja CYP3A4:n välityksellä, jolloin muodostuu N-desmetyyliapalutamidia. Apalutamidi ja N‑desmetyyliapalutamidi metaboloituvat edelleen ja muodostavat karboksyyliesteraasin välityksellä inaktiivista karboksyylihappometaboliittia. Kerta-annoksen jälkeen CYP2C8:n osuudeksi apalutamidin metaboliassa arvioidaan 58 % ja CYP3A4:n osuudeksi 13 %, mutta vakaassa tilassa osuudet oletettavasti muuttuvat toistuvista apalutamidiannoksista aiheutuvan CYP3A4:n induktion seurauksena.
Eliminaatio
Apalutamidi eliminoituu pääasiassa virtsaan lähinnä metaboliitteina. Suun kautta annetun radioaktiivisella aineella merkityn apalutamidikerta-annoksen seurauksena 89 % radioaktiivisuudesta todettiin 70 vuorokauteen saakka annoksen ottamisesta seuraavasti: 65 % todettiin virtsassa (1,2 % annoksesta muuttumattomana apalutamidina ja 2,7 % N-desmetyyliapalutamidina) ja 24 % todettiin ulosteissa (1,5 % annoksesta muuttumattomana apalutamidina ja 2 % N-desmetyyliapalutamidina).
Kerta-annoksen jälkeen apalutamidin laskennallinen oraalinen puhdistuma (CL/F) on 1,3 l/h, ja kerran vuorokaudessa tapahtuneen annostelun jälkeen se suurenee vakaassa tilassa tasolle 2,0 l/h. Apalutamidin efektiivisen puoliintumisajan keskiarvo vakaassa tilassa on potilailla noin 3 vuorokautta.
In vitro ‑tiedot osoittavat, että apalutamidi ja sen N‑desmetyylimetaboliitti eivät ole BCRP:n, OATP1B1:n tai OATP1B3:n substraatteja.
Erityispotilasryhmät
Munuaisten vajaatoiminnan, maksan vajaatoiminnan, iän, etnisen taustan ja muiden ulkoisten tekijöiden vaikutukset apalutamidin farmakokinetiikkaan on tiivistetty jäljempänä.
Munuaisten vajaatoiminta
Apalutamidilla ei ole tehty varsinaisia munuaisten vajaatoimintaa koskevia tutkimuksia. Kastraatioresistenttiä eturauhassyöpää sairastavilla ja terveillä tutkittavilla tehdyistä kliinisistä tutkimuksista saatujen tietojen populaatiofarmakokineettisen analyysin perusteella systeemisessä apalutamidialtistuksessa ei havaittu merkittäviä eroja tutkittavilla, joilla oli ennestään lievää tai keskivaikeaa munuaisten vajaatoimintaa (laskennallinen glomerulusten suodatusnopeus [eGFR] 30–89 ml/min/1,73 m2; N = 585), verrattuna tutkittaviin, joiden munuaisten toiminta oli lähtötilanteessa normaali (eGFR ≥ 90 ml/min/1,73 m2; N = 372). Vaikea-asteisen munuaisten vajaatoiminnan tai loppuvaiheen munuaissairauden (eGFR ≤ 29 ml/min/1,73 m2) mahdollista vaikutusta ei ole varmistettu, koska tietoja ei ole riittävästi.
Maksan vajaatoiminta
Maksan vajaatoimintaa koskeneessa tutkimuksessa selvitettiin apalutamidin ja N‑desmetyyliapalutamidin systeemistä altistusta tutkittavilla, joilla oli lähtötilanteessa lievää maksan vajaatoimintaa (N = 8, Child–Pugh-luokka A, pisteiden keskiarvo = 5,3) tai keskivaikeaa maksan vajaatoimintaa (N = 8, Child–Pugh-luokka B, pisteiden keskiarvo = 7,6), verrattuna terveisiin verrokkeihin, joiden maksan toiminta oli normaali (N = 8). Suun kautta otetun 240 mg:n apalutamidikerta-annoksen jälkeen todettiin, että lievää maksan vajaatoimintaa sairastavilla apalutamidin AUC-arvon geometrisen keskiarvon suhde oli 95 % ja Cmax-arvon geometrinen keskiarvo oli 102 % ja että keskivaikeaa maksan vajaatoimintaa sairastavilla apalutamidin AUC-arvon geometrisen keskiarvon suhde oli 113 % ja Cmax-arvon geometrinen keskiarvo oli 104 % verrattuna terveisiin verrokkeihin. Vaikeaa maksan vajaatoimintaa (Child‑Pugh-luokka C) sairastavista potilaista ei ole apalutamidia koskevia kliinisiä ja farmakokineettisiä tietoja saatavana.
Etninen tausta
Apalutamidin farmakokinetiikassa ei populaatiofarmakokineettisen analyysin perusteella ollut kliinisesti oleellisia eroja valkoihoisten (valkoihoiset tai latinalaisamerikkalaiset, N = 761), mustaihoisten (afrikkalaista syntyperää olevat tai afroamerikkalaiset; N = 71), aasialaisten (muiden kuin japanilaisten; N = 58) ja japanilaisten (N = 58) välillä.
Ikä
Populaatiofarmakokineettiset analyysit osoittivat, että iällä (vaihteluväli: 18–94 vuotta) ei ole kliinisesti merkittävää vaikutusta apalutamidin farmakokinetiikkaan.
Prekliiniset tiedot turvallisuudesta
Apalutamidi todettiin geenitoksisuuden suhteen negatiiviseksi tavanomaisessa in vitro- ja in vivo ‑testisarjassa. Apalutamidi ei ollut karsinogeeninen 6 kuukautta kestäneessä tutkimuksessa siirtogeenisillä (Tg.rasH2) uroshiirillä annoksiin 30 mg/kg/vrk saakka, josta aiheutuu 1,2‑kertainen apalutamidin ja 0,5‑kertainen N‑desmetyyliapalutamidin altistus (AUC) suositellun kliinisen annoksen 240 mg/vrk käyttöön nähden.
Apalutamidia annettiin kaksivuotisessa karsinogeenisuustutkimuksessa Sprague‑Dawley -urosrotille suun kautta letkuruokintana annoksina 5, 15 ja 50 mg/kg/vrk. Potilaiden AUC‑arvoihin (altistus käytettäessä suositusannosta 240 mg) nähden rottien altistus oli 0,2‑kertainen (5 mg/kg/vrk), 0,7‑kertainen (15 mg/kg/vrk) ja 2,5‑kertainen (50 mg/kg/vrk). Kasvaimien ilmaantuvuuden havaittiin lisääntyneen, mukaan lukien kivesten välisolujen (Leydigin solujen) adenoomat ja karsinoomat 5 mg/kg/vrk tai sitä suuremmilla annoksilla, rintarauhasen adenokarsinooma ja fibroadenooma annoksilla 15 mg/kg/vrk tai 50 mg/kg/vrk sekä kilpirauhasen follikulaarinen adenooma annoksella 50 mg/kg/vrk. Näiden havaintojen katsottiin olleen rotalle spesifisiä, joten niiden merkitys ihmisen kannalta on vähäinen.
Toistuvan altistuksen toksisuutta selvittäneiden tutkimusten havaintojen perusteella apalutamidihoito todennäköisesti heikentää miesten hedelmällisyyttä, mikä on yhdenmukaista apalutamidin farmakologiseen aktiivisuuteen nähden. Toistuvan altistuksen aiheuttamaa toksisuutta koskevissa tutkimuksissa urosrottien ja ‑koirien lisääntymiselimissä havaittiin atrofiaa, aspermiaa tai hypospermiaa, rappeumaa ja/tai hyperplasiaa tai hypertrofiaa annoksilla, jotka vastaavat AUC-arvon perusteella suunnilleen ihmisellä todettavaa altistusta.
Urosrotilla tehdyssä hedelmällisyyttä koskeneessa tutkimuksessa havaittiin siittiöiden määrän ja liikkuvuuden, parittelun ja tiineyslukujen (hoitamattomien naaraiden kanssa paritellessa) vähenemistä sekä toissijaisten sukupuolirauhasten ja lisäkivesten painon laskua 4 viikon annostelun jälkeen, kun annokset vastasivat AUC-arvon perusteella suunnilleen ihmisellä todettavaa altistusta. Vaikutukset urosrottiin olivat korjautuneet 8 viikon kuluttua viimeisen apalutamidiannoksen jälkeen.
Apalutamidi aiheutti rotilla tehdyssä alustavassa alkion ja sikiön kehitystoksisuustutkimuksessa kehitykseen kohdistuvaa toksisuutta, kun sitä annettiin koko organogeneesijakson ajan (gestaatiopäivät 6–20) suun kautta annoksina 25, 50 tai 100 mg/kg/vrk. Näistä annoksista vastaavasti aiheutunut systeeminen altistus oli AUC:n perusteella noin 2-, 4- ja 6-kertainen verrattuna ihmisen altistukseen annosta 240 mg/vrk käytettäessä. Havainnot sisälsivät annosten 100 mg/kg/vrk yhteydessä tiineyden keskeytymisen, annosten ≥ 50 mg/kg/vrk yhteydessäalkio- ja sikiökuolleisuuden (resorptiot) ja annosten ≥ 25 mg/kg/vrk yhteydessä sikiön anogenitaalimitan lyhenemisen ja aivolisäkkeen epämuotoisuuden (pyöreämpi muoto). Annosten ≥ 25 mg/kg/vrk yhteydessä havaittiin myös luuston poikkeamia (varvasluiden luutumattomuus, ylimääräiset rinta-lannerangan lyhyet kylkiluut ja/tai kieliluun poikkeavuudet), mutta näistä annoksista ei aiheutunut vaikutuksia sikiöiden keskimääräiseen painoon.
Farmaseuttiset tiedot
Apuaineet
Tablettiydin
Kolloidinen vedetön piidioksidi
Kroskarmelloosinatrium
Hypromelloosiasetaattisuksinaatti
Magnesiumstearaatti
Mikrokiteinen selluloosa
Mikrokiteinen selluloosa (silisifioitu)
Kalvopäällyste
Rautaoksidi, musta (E172)
Rautaoksidi, keltainen (E172)
Makrogoli
Polyvinyylialkoholi (osittain hydrolysoitu)
Talkki
Titaanidioksidi (E171)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä kosteudelle. Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ERLEADA tabletti, kalvopäällysteinen
60 mg (L:ei) 112 fol (kalenteripakkaus) (2958,22 €)
PF-selosteen tieto
Valkoinen, läpinäkymätön suurtiheyspolyeteenipurkki (HDPE), jossa polypropeeninen (PP) lapsiturvallinen suljin. Yksi purkki sisältää 120 kalvopäällysteistä tablettia ja yhteensä 6 g silikageelikuivausainetta.
PVC-PCTFE-folioläpipainopakkaus, jossa alumiininen läpipainofolio ja joka on pakattu lapsiturvalliseen taskupakkaukseen.
- Yksi 28 päivän kartonkikotelo sisältää 112 kalvopäällysteistä tablettia 4 kartonkisessa taskupakkauksessa, joista jokainen sisältää 28 kalvopäällysteistä tablettia.
- Yksi 30 päivän kartonkikotelo sisältää 120 kalvopäällysteistä tablettia 5 kartonkisessa taskupakkauksessa, joista jokainen sisältää 24 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Hieman kellertävä tai harmahtavan vihreä, pitkänomainen, kalvopäällysteinen tabletti (pituus 17 mm x leveys 9 mm), jonka toiselle puolelle on kaiverrettu ”AR 60”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ERLEADA tabletti, kalvopäällysteinen
60 mg 112 fol
- Ylempi erityiskorvaus (100 %). Apalutamidi: Eturauhassyövän hoito erityisin edellytyksin (1528).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Apalutamidi: Eturauhassyövän hoito aikuispotilailla erityisin edellytyksin (3031).
ATC-koodi
L02BB05
Valmisteyhteenvedon muuttamispäivämäärä
15.01.2026
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com
