DOLERIN tabletti, kalvopäällysteinen 500/150 mg
Vaikuttavat aineet ja niiden määrät
Yksi tabletti sisältää 500 mg parasetamolia ja 150 mg ibuprofeenia.
Apuaine, jonka vaikutus tunnetaan: laktoosimonohydraatti 3,81 mg
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti (tabletti)
Kliiniset tiedot
Käyttöaiheet
Dolerin on tarkoitettu akuutin kivun tilapäiseen lievitykseen mukaan lukien päänsärky (ei migreenipäänsärky), selkäkipu, hammassärky, lihaskipu ja kurkkukipu.
Dolerin on tarkoitettu kuumeen hoitoon.
Annostus ja antotapa
Annostus
Suun kautta ja vain lyhytaikaiseen käyttöön.
Oireiden lievittämiseen on käytettävä pienintä tehokasta annosta lyhyimmän mahdollisen ajan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Potilaan tulee ottaa yhteyttä lääkäriin jos oireet jatkuvat enemmän kuin 3 päivää tai pahenevat, tai valmistetta tarvitaan pidempään kuin 3 päivää.
Aikuiset:
Tavallinen annos on 1 - 2 tablettia kuuden tunnin välein tarpeen mukaan. Enimmäisvuorokausiannos on kahdeksan tablettia.
Alle 18-vuotiaat lapset ja nuoret
Lääkevalmistetta ei suositella alle 18-vuotiaille lapsille ja nuorille.
Iäkkäät potilaa
Erityinen annoksen muuttaminen ei ole tarpeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iäkkäillä potilailla on kohonnut riski saada vakavia seurauksia haittavaikutuksista. Jos tulehduskipulääkkeen (NSAID) käytön katsotaan olevan välttämätöntä, oireiden hoitoon on käytettävä pienintä mahdollista annosta ja lyhyintä mahdollista hoidon kestoa. NSAID-hoidon aikana potilasta on seurattava säännöllisesti ruoansulatuskanavan verenvuodon varalta.
Munuaisten vajaatoiminta
Varovaisuutta ibuprofeeniannoksen suhteen on noudatettava potilailla, joilla on munuaisten vajaatoiminta. Annostus on arvioitava yksilöllisesti. Annos on pidettävä mahdollisimman pienenä ja munuaisten toimintaa on seurattava (ks. kohdat Vasta-aiheet, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Parasetamoliannosta on pienennettävä munuaisten vajaatoiminnasta kärsivien potilaiden kohdalla:
Glomerulusten suodattumisnopeus | Annostus |
10 - 50 ml/min | 500 mg joka 6. tunti |
< 10 ml/min | 500 mg joka 8. tunti |
Maksan vajaatoiminta
Varovaisuutta ibuprofeeniannoksen suhteen on noudatettava potilailla, joilla on maksan vajaatoiminta. Annostus on arvioitava yksilöllisesti ja annos on pidettävä mahdollisimman pienenä (ks. kohdat Vasta-aiheet, Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Parasetamoliannosta on pienennettävä tai annosväliä pidennettävä maksan vajaatoiminnasta tai Gilbertin oireyhtymästä kärsivien potilaiden kohdalla.
Antotapa
Lääkevalmiste voidaan ottaa joko aterian yhteydessä tai sellaisenaan, valmiste otetaan vesilasillisen kanssa. Sivuvaikutusten minimoimiseksi suositellaan kuitenkin, että Dolerin otetaan aterian yhteydessä.
Vasta-aiheet
Tämän lääkevalmisteen käyttö on vasta-aiheista seuraavissa tapauksissa:
- Yliherkkyys parasetamolille, ibuprofeenille, muille tulehduskipulääkkeille tai kohdassa Apuaineet mainituille apuaineille
- Alkoholismi, sillä jatkuva liiallinen alkoholin käyttö voi altistaa potilaat maksatoksisuudelle (parasetamolikomponentin vuoksi).
- Astmakohtaus, urtikaria tai allerginen reaktio asetyylisalisyylihapon tai muiden NSAID-lääkkeiden käytön jälkeen.
- Aiempi tai nykyinen ruoansulatuskanavan verenvuoto tai peptinen haava.
- Raskauden viimeinen kolmannes (ks. kohta Raskaus ja imetys).
- Vaikea-asteinen maksan vajaatoiminta tai vaikea-asteinen munuaisten vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
- Serebrovaskulaarinen tai muu aktiivinen verenvuoto.
- Veren hyytymishäiriö tai tila, johon liittyy lisääntynyt verenvuototaipumus.
- Vaikea sydämen vajaatoiminta (NYHA-luokitus IV)
Varoitukset ja käyttöön liittyvät varotoimet
Dolerin‑valmisteen samanaikaista käyttöä NSAID-lääkkeiden kanssa, mukaan lukien syklo-oksigenaasi-2:n selektiiviset estäjät ja asetyylisalisyylihappoannokset, jotka ylittävät 75 mg/vrk, on vältettävä, sillä tähän liittyy kohonnut ruoansulatuskanavan vaikea-asteisten haittavaikutusten riski.
Dolerin‑valmisteen samanaikaista käyttöä muiden parasetamolia sisältävien lääkevalmisteiden kanssa on vältettävä, sillä tähän liittyy kohonnut vaikea-asteisten maksavaurioiden riski.
Haittavaikutuksia voidaan minimoida käyttämällä pienintä mahdollista tehokasta annosta ja lyhyintä mahdollista hoidon kestoa oireiden hoitamiseksi (ks. kohta Annostus ja antotapa ja alla mainitut Gastrointestinaaliset ja Kardiovaskulaaris-tromboottiset tapahtumat). Potilaiden, joita hoidetaan pitkäkestoisesti NSAID-lääkkeillä, tulisi käydä säännöllisissä lääkärintarkastuksissa ja heitä tulisi seurata haittavaikutusten varalta.
Maksan vajaatoiminta
Suositeltua suurempien parasetamoliannosten käyttö voi johtaa maksatoksisuuteen ja jopa maksan vajaatoimintaan ja kuolemaan. Jos potilaan maksan toiminta on heikentynyt tai potilaalla on ollut maksasairaus, tai hän saa pitkäkestoista ibuprofeeni- tai parasetamolihoitoa, hänen maksan toimintaansa on seurattava säännöllisesti, sillä ibuprofeenin on raportoitu vaikuttavan vähäisessä määrin ja ohimenevästi maksaentsyymeihin.
Vaikea-asteisia maksareaktioita, mukaan lukien keltaisuus ja kuolemaan johtava hepatiitti (vaikkakin harvinainen) on raportoitu sekä ibuprofeenin että muiden NSAID-lääkkeiden käytön yhteydessä. Jos maksakokeiden tuloksissa havaitaan jatkuvasti poikkeavuutta, testitulokset huononevat, kehittyy maksasairauteen viittaavia kliinisiä merkkejä ja oireita tai systeemisiä ilmentymiä (esim. eosinofiliaa, ihottumaa jne.), ibuprofeenin käyttö on lopetettava. Molempien vaikuttavien aineiden on raportoitu aiheuttavan maksatoksisuutta ja jopa maksan vajaatoimintaa, mikä koskee erityisesti parasetamolia.
Potilaille on kerrottava, että he eivät saa käyttää samanaikaisesti muita parasetamolia tai ibuprofeenia sisältäviä lääkevalmisteita.
Munuaisten vajaatoiminta
Parasetamolin annossa potilaille, joilla on kohtalainen tai vaikea-asteinen munuaisten vajaatoiminta, on noudatettava varovaisuutta. Lääkevalmisteen ibuprofeenikomponentti: varovaisuutta on noudatettava aloitettaessa ibuprofeenihoitoa potilaalle, joka kärsii kuivumisesta tai munuaisten vajaatoiminnasta. Ibuprofeenin kaksi tärkeintä metaboliittia erittyvät pääasiassa virtsaan ja heikentynyt munuaistoiminta voi johtaa niiden kertymiseen. Tämän merkitsevyyttä ei tunneta. Tulehduskipulääkkeiden (NSAID) käyttö voi johtaa munuaisten toiminnan heikkenemiseen. Annos on pidettävä mahdollisimman pienenä ja munuaisten toiminta on arvioitava ennen hoidon aloittamista ja säännöllisesti sen jälkeen.
ACE:n estäjien tai angiotensiinireseptorien antagonistien, tulehduskipulääkkeiden ja tiatsididiureettien samanaikainen käyttö
ACE:n estäjän (ACE:n estäjä tai angiotensiinireseptorin antagonisti), tulehduskipulääkkeen (NSAID tai COX-2:n estäjä) ja tiatsididiureetin samanaikainen käyttö lisää munuaisten vajaatoiminnan riskiä. Tämä sisältää sellaisten yhdistelmälääkkeiden käytön, jotka sisältävät enemmän kuin yhden lääkeryhmän vaikuttavaa ainetta. Jos näitä lääkevalmisteita käytetään samanaikaisesti, seerumin kreatiniiniarvoa on seurattava useammin, etenkin yhdistelmähoidon alkuvaiheessa. Näiden kolmen lääkeryhmän yhteiskäytössä on noudatettava varovaisuutta etenkin iäkkäiden potilaiden kohdalla tai jos potilaalla on jo ennen hoitoa munuaisten vajaatoimintaa.
Iäkkäät potilaat
Suositeltuun annostukseen ei ole tarpeen tehdä muutoksia iäkkäiden parasetamolihoitoa tarvitsevien potilaiden kohdalla. Potilaiden, jotka tarvitsevat hoitoa pidempään kuin kolmen päivän ajan, on otettava yhteys lääkäriin tilan seurannan sopimiseksi; suositellun annoksen pienentäminen ei kuitenkaan ole tarpeen. Ibuprofeenin käytössä on kuitenkin noudatettava varovaisuutta, sillä yli 65-vuotiaiden ei tulisi käyttää sitä ilman, että muiden sairauksien ja samanaikaisen lääkityksen vaikutuksia on arvioitu, koska tähän liittyy lisääntyneiden haittavaikutusten, etenkin sydämen vajaatoiminnan, ruoansulatuskanavan haavaumien ja munuaisten vajaatoiminnan riski.
Hematologiset vaikutukset
Veren dyskrasiaa on raportoitu harvinaisissa tapauksissa. Pitkäkestoista ibuprofeenihoitoa saaville on toteutettava säännöllinen hematologinen seuranta.
Puutteet veren hyytymisessä
Kuten muutkin NSAID-lääkkeet, ibuprofeeni voi estää verihiutaleaggregaatiota. Ibuprofeenin on osoitettu pidentävän vuotoaikaa (kuitenkin normaalin rajoissa) terveillä koehenkilöillä. Vuodon pidentymistaipumus voi kuitenkin voimistua potilailla, joilla on taustalla jokin hemostaattinen häiriö. Siksi ibuprofeenia sisältäviä lääkevalmisteita on käytettävä varoen potilaille, joilla on veren hyytymishäiriöitä tai jotka saavat verenohennuslääkkeitä.
Gastrointestinaaliset tapahtumat
Ruoansulatuskanavan yläosien haavaumista, vakavasta verenvuodosta tai perforaatioista on raportoitu NSAID-hoidon yhteydessä. Riskit kasvavat annostuksen noustessa ja hoidon keston pidetessä ja ovat yleisempiä yli 65-vuotiailla potilailla. Joillakin potilailla esiintyy dyspepsiaa, närästystä, pahoinvointia, vatsakipua tai ripulia.
Ibuprofeenikomponentin vuoksi lääkevalmistetta on annettava varoen potilaille, joilla on ollut jokin ruoansulatuskanavan sairaus (haavainen koliitti, Crohnin tauti) samoin kuin potilaille, joilla on porfyria tai vesirokko.
Tämän lääkevalmisteen käyttö on lopetettava, jos ruoansulatuskanavan verenvuotoon viittaavia merkkejä ilmenee.
Kardiovaskulaaris-tromboottiset tapahtumat
Kliiniset tutkimukset viittaavat siihen, että ibuprofeenin käytöllä etenkin suurina annoksina (2 400 mg vuorokaudessa) saattaa olla yhteyttä hieman kohonneeseen valtimoveritulppatapahtumien riskiin (esimerkiksi sydäninfarkti tai aivohalvaus). Kaiken kaikkiaan epidemiologiset tutkimukset eivät viittaa siihen, että ibuprofeeni pieninä annoksina (esimerkiksi enintään 1 200 mg vuorokaudessa) liittyisi kohonneeseen valtimoveritulppatapahtumien riskiin.
Jos potilaalla on hoitamaton kohonnut verenpaine, kongestiivinen sydämen vajaatoiminta (NYHA-luokitus II tai III), todettu iskeeminen sydänsairaus, ääreisverisuonten sairaus ja/tai aivoverisuonten sairaus, ibuprofeenin käyttöä hoidossa on harkittava huolellisesti ja suuria annoksia (2 400 mg vuorokaudessa) vältettävä.
Samoin on harkittava huolellisesti pitkäaikaisen hoidon aloittamista potilailla, joilla on sydän- ja verisuonitapahtumien riskitekijöitä (kuten kohonnut verenpaine, hyperlipidemia, diabetes mellitus tai tupakointi), etenkin jos hoito edellyttää suuria ibuprofeeniannoksia (2 400 mg vuorokaudessa).
Kohonnut verenpaine:
NSAID-lääkkeiden käyttö saattaa johtaa kohonneen verenpaineen ilmenemiseen tai aiemmin koholla olleen verenpaineen kohoamiseen entisestään. Verenpainelääkkeitä NSAID-lääkkeiden kanssa samanaikaisesti käyttävillä potilailla verenpainetta laskeva vaste voi olla heikentynyt. Varovaisuutta on noudatettava määrättäessä NSAID-lääkkeitä potilaille, joilla on kohonnut verenpaine. Verenpainetta on seurattava tiiviisti NSAID-hoitoa aloitettaessa ja säännöllisesti sen jälkeen.
Sydämen vajaatoiminta
Nesteen kertymistä ja edeemaa on havaittu joillain NSAID-lääkkeitä käyttävillä potilailla. Siksi on noudatettava varovaisuutta niiden potilaiden kohdalla, jotka kärsivät nesteen kertymisestä tai sydämen vajaatoiminnasta.
Vaikeat ihoreaktiot
Vaikeita ihoreaktioita, myös kuolemaan johtaneita, kuten hilseilevä ihotulehdus, Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi, on raportoitu harvoissa tapauksissa steroideihin kuulumattomien tulehduskipulääkkeiden käytön yhteydessä (ks. kohta Haittavaikutukset). Näiden reaktioiden riski on suurimmillaan hoidon alkuvaiheessa; useimmissa tapauksissa reaktio ilmaantuu hoidon ensimmäisen kuukauden aikana. Akuutista yleistyneestä eksantematoottisesta pustuloosista (AGEP) on ilmoitettu ibuprofeenia sisältävien tuotteiden yhteydessä. Ibuprofeenin käyttö on lopetettava heti, jos potilaalla ilmenee vaikean ihoreaktion oireita, kuten ihottumaa, limakalvovaurioita tai muita merkkejä yliherkkyydestä.
Olemassa oleva astma
Ibuprofeenia sisältäviä lääkevalmisteita ei saa antaa potilaille, joilla on asetyylisalisyylihappoon reagoiva astma ja niitä on käytettävä varoen potilaille, joilla on olemassa oleva astma.
Oftalmologiset vaikutukset
Oftalmologisia haittavaikutuksia on havaittu NSAID-lääkkeiden käytön yhteydessä. Siksi potilaat, joille kehittyy ibuprofeenia sisältävien lääkevalmisteiden käytön aikana näköhäiriöitä, on ohjattava näöntutkimukseen.
Hengityselinhäiriöt
Potilailla, joilla on tai ollut keuhkoastma tai allerginen sairaus, NSAID-lääkkeiden on raportoitu nopeuttavan bronkospasmien esiintymistä.
Systeeminen lupus erythematosus ja sekamuotoinen sidekudostauti
Potilailla, joilla on systeeminen lupus erythematosus ja sekamuotoinen sidekudostauti, voi olla suurempi riski saada aseptinen meningiitti (ks. kohta Haittavaikutukset).
Aseptinen meningiitti
Aseptista meningiittiä on havaittu harvoissa tapauksissa potilailla jotka käyttävät ibuprofeenia. Vaikkakin esiintyvyys on todennäköisempää potilailla, joilla on systeeminen lupus erythematosus ja sidekudostauti, on tätä myös raportoitu potilailla joilla ei ole kroonista perussairautta.
Naisten hedelmällisyyden heikentyminen
Tämän lääkevalmisteen käyttö saattaa heikentää naisen hedelmällisyyttä eikä sitä suositella raskautta yrittäville naisille. Naisten, joilla on vaikeuksia tulla raskaaksi tai jotka ovat parhaillaan hedelmällisyystutkimuksissa, tulisi harkita lääkevalmisteen käytön lopettamista.
Mahdolliset vaikutukset laboratoriokokeiden tuloksiin
Parasetamoli ei vaikuta laboratoriotutkimusten tuloksiin käytettäessä nykyaikaisia analyyttisiä järjestelmiä. On kuitenkin olemassa joitain menetelmiä, joiden kohdalla voi esiintyä vaikutuksia laboratoriokokeiden tuloksiin, kuten on kuvattu alla:
Virtsakokeet:
Hoitoannoksina annettu parasetamoli voi vaikuttaa 5-hydroksi-indolietikkahapon (5HIAA) määritykseen ja aiheuttaa virheellisesti positiivisia tuloksia. Virheelliset määritykset voidaan välttää välttämällä parasetamolin käyttöä useita tunteja ennen virtsanäytteen antoa ja näytteenoton aikana.
Taustalla olevien infektioiden oireiden peittyminen
Ibuprofeeni voi peittää infektion oireita, jolloin asianmukaisen hoidon aloittaminen voi viivästyä, mikä pahentaa infektion seurauksia. Näin on havaittu tapahtuvan bakteeriperäisen sairaalan ulkopuolella saadun keuhkokuumeen ja vesirokon bakteeriperäisten komplikaatioiden yhteydessä. Kun ibuprofeeni-valmistetta käytetään infektioon liittyvän kuumeen tai kivun lievittämiseen, infektiota on seurattava tiiviisti. Avohoidossa olevan potilaan on otettava yhteyttä lääkäriin, jos oireet jatkuvat tai pahenevat.
Erityiset varotoimet
Jos analgeettihoito on pitkäkestoista (> 3 kuukautta) ja lääkettä otetaan joka toinen päivä tai useammin, päänsärkyä voi kehittyä tai se voi pahentua. Analgeettien liiallisesta käytöstä aiheutunutta päänsärkyä (MOH-päänsärkyä) ei saa hoitaa annosta lisäämällä. Tällaisissa tapauksissa analgeettien käyttö on lopetettava lääkärin antamien ohjeiden mukaisesti.
Jotta vältetään sairauden paheneminen tai lisämunuaisen vajaatoiminta, pitkään kortikosteroidihoitoa saaneiden potilaiden hoitoannosta on pienennettävä asteittain hoidon äkillisen lopettamisen sijaan silloin, kun ibuprofeenia sisältäviä lääkevalmisteita lisätään hoito-ohjelmaan.
Yksi kalvopäällysteinen tabletti sisältää 3,81 mg laktoosia, mikä vastaa 30,48 mg:aa laktoosia suositellussa enimmäisvuorokausiannoksessa. Lääkettä ei saa käyttää, jos potilaalla on harvinainen perinnöllinen galaktoosi-intoleranssi, saamelaisilla esiintyvä laktaasinpuutos (Lapp-laktaasinpuutos) tai glukoosi-galaktoosi-imeytymishäiriö.
Yhteisvaikutukset
Tätä lääkevalmistetta (kuten mitään muutakaan parasetamolia ja/tai ibuprofeenia sisältävää valmistetta) ei saa ottaa samanaikaisesti muiden parasetamolia ja/tai ibuprofeenia sisältävien valmisteiden kanssa lisääntyneen vaikea-asteisten haittavaikutusten riskin vuoksi.
Ibuprofeeni:
Kuten muidenkin ibuprofeenia sisältävien lääkevalmisteiden kohdalla, seuraavien samanaikaista käyttöä Dolerin-valmisteen kanssa on vältettävä:
Dikumaroliryhmä: NSAID-lääkkeet voivat voimistaa antikoagulanttien, kuten varfariinin tehoa. Kokeelliset tutkimukset osoittavat, että ibuprofeeni vahvistaa varfariinin vaikutuksia vuotoaikaan. NSAID-lääkkeet ja dikumaroliryhmä metaboloituvat saman entsyymin, CYP2C9:n vaikutuksesta.
Veren hyytymistä estävät lääkkeet: NSAID-lääkkeitä ei pidä käyttää veren hyytymistä estävien lääkkeiden, kuten tiklopidiinin kanssa, sillä tällä voi olla additiivinen vaikutus verihiukkasten toiminnan estämisessä (ks. alla).
Metotreksaatti: NSAID-lääkkeet heikentävät metotreksaatin tubulaarista erittymistä ja tällöin voi tapahtua metabolista interaktiota, joka johtaa metotreksaattipuhdistuman pienenemiseen. Siksi tilanteissa, joissa potilas saa korkeita metotreksaattiannoksia, NSAID-lääkkeiden määräämistä on aina pyrittävä välttämään (ks. alla).
Asetyylisalisyylihappo: Ibuprofeenin ja asetyylisalisyylihapon samanaikaista käyttöä ei yleisesti ottaen suositella, sillä se saattaa lisätä haittavaikutuksia.
Kokeelliset tiedot viittaavat siihen, että ibuprofeeni saattaa inhiboida pienen asetyylisalisyylihappoannoksen vaikutuksen verihiutaleiden aggregaatioon, kun valmisteita otetaan samanaikaisesti. On epävarmaa, voidaanko näitä tietoja ekstrapoloida kliiniseen tilanteeseen, mutta ei voida kuitenkaan sulkea pois mahdollisuutta, että ibuprofeenin säännöllinen, pitkäaikainen käyttö saattaa heikentää pieniannoksisen asetyylisalisyylihapon sydäntä suojaavaa vaikutusta. Ei ole todennäköistä, että satunnaisella ibuprofeenin käytöllä olisi kliinisesti merkityksellisiä vaikutuksia (ks. kohta Farmakodynamiikka).
Sydänglykosidit: NSAID-lääkkeet voivat pahentaa sydämen vajaatoimintaa, vähentää glomerulussuodosta ja lisätä sydänglykosidien (esim. digoksiinin) plasmapitoisuuksia.
Mifepristoni: NSAID-lääkkeiden, asetyylisalisyylihappo mukaan lukien, prostaglandiineja estävien ominaisuuksien vuoksi on teoriassa mahdollista, että lääkevalmisteen teho laskee. Rajallinen määrä tietoja viittaa siihen, että NSAID-lääkkeiden anto samana päivänä prostaglandiinien annon kanssa ei vaikuta haitallisesti mifepristonin tehoon tai kohdunkaulan kypsymiseen tai supistuksiin käytettyyn prostaglandiiniin eikä se pienennä lääkehoidolla toteutetun raskaudenkeskeytyksen kliinistä tehoa.
Sulfonyyliurea: Harvinaisissa tapauksissa sulfonyyliureahoitoa ja ibuprofeenia saavilla potilailla on raportoitu hypoglykemiaa.
Tsidovudiini: On näyttöä hemartroosien ja hematoomien suurentuneesta riskistä HIV-positiivisilla hemofiliapotilailla, jotka ovat saaneet samanaikaisesti tsidovudiinia ja ibuprofeenia.
Kinoloniantibiootit: Eläintutkimuksista saadut tiedot osoittavat, että NSAID-lääkkeet voivat lisätä kinoloniantibiootteihin liittyvien kouristusten riskiä. Kouristusten riski potilailla, jotka käyttävät samanaikaisesti NSAID-lääkkeitä ja kinolonia, voi kohota.
Seuraavat Dolerin-valmisteen kanssa käytettävät yhdisteet voivat edellyttää annoksen muuttamista:
NSAID-lääkkeet voivat heikentää diureettien ja muiden verenpainetta alentavien lääkkeiden vaikutusta.
NSAID-lääkkeet voivat heikentää aminoglykosidien erittymistä.
Lapset: Varovaisuutta on noudatettava annettaessa samanaikaisesti ibuprofeenia ja aminoglykosideja.
Litium: Ibuprofeeni heikentää litiumin munuaispuhdistumaa, minkä seurauksena seerumin litiumpitoisuus voi nousta. Tätä lääkeyhdistelmää on vältettävä, ellei seerumin litiumpitoisuutta pystytä määrittämään säännöllisesti ja litiumannosta tämän perusteella mahdollisesti vähentämään.
ACE:n estäjät ja angiotensiini II -antagonistit:
Munuaisten toimintahäiriöistä kärsivillä potilailla (esim. kuivumisesta kärsivillä ja/tai iäkkäillä potilailla) on kohonnut yleensä palautuvan akuutin munuaisten vajaatoiminnan riski, jos hoitoa ACE:n estäjillä tai angiotensiini II -antagonisteilla annetaan samanaikaisesti NSAID-lääkkeiden, mukaan lukien selektiivisten syklo-oksigenaasi-2-estäjien kanssa. Yhdistelmää on määrättävä varoen potilaille, joilla on munuaisten toimintahäiriöitä, etenkin iäkkäät potilaat huomioon ottaen. Potilaita on nesteytettävä riittävästi ja munuaistoiminnan tarkastusta on harkittava yhdistelmähoidon aloittamisen jälkeen ja säännöllisin väliajoin hoidon aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Beetasalpaajat: NSAID-lääkkeet kumoavat beeta-adrenoseptoreita salpaavien lääkkeiden verenpainetta laskevan vaikutuksen.
Selektiiviset serotoniinin takaisinoton estäjät (SSRI-lääkkeet):
Sekä SSRI- että NSAID-lääkkeiden käyttöön liittyy lisääntynyt vuotoriski, esim. ruoansulatuskanavasta. Yhdistelmähoito kasvattaa tätä riskiä. Mekanismi saattaa liittyä serotoniinin oton heikkenemiseen verihiutaleissa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Siklosporiini: NSAID-lääkkeiden ja siklosporiinin samanaikaisen käytön uskotaan pystyvän lisäämään nefrotoksisuuden riskiä munuaisten prostasykliinin synteesin heikkenemisen vuoksi. Jos yhdistelmähoito toteutetaan, munuaisten toimintaa on seurattava tarkoin.
Kaptopriili: Kokeelliset tutkimukset viittaavat siihen, että ibuprofeeni vähentää kaptopriilin vaikutusta natriumin erityksessä.
Kolestyramiini: Ibuprofeenin ja kolestyramiinin samanaikainen anto viivästää ja heikentää (25 %:lla) ibuprofeenin imeytymistä. Näiden kahden lääkkeen annon välillä on odotettava ainakin kaksi tuntia.
Tiatsidit, tiatsidinsukuiset valmisteet ja loop-diureetit: NSAIDit voivat heikentää furosemidin ja bumetanidin diureettisia vaikutuksia mahdollisesti prostaglandiinisynteesiä estämällä. Ne voivat heikentää myös tiatsidien verenpainetta laskevaa vaikutusta.
Takrolimuusi: NSAID-lääkkeiden ja takrolimuusin samanaikaisen käytön uskotaan pystyvän lisäämään nefrotoksisuuden riskiä munuaisten prostasykliinin synteesin heikkenemisen vuoksi. Jos yhdistelmähoito toteutetaan, munuaisten toimintaa on seurattava tarkoin.
Metotreksaatti: NSAID-lääkkeiden ja metotreksaatin mahdolliset yhteisvaikutukset on myös huomioitava pieniannoksisen metotreksaattihoidon yhteydessä, erityisesti niiden potilaiden kohdalla, joilla on munuaisten vajaatoiminta. Yhdistelmähoidossa munuaisten toimintaa on tarkkailtava. Varovaisuutta on noudatettava, jos sekä NSAID-lääkkeitä että metotreksaattia annetaan 24 tunnin kuluessa toisistaan, sillä metotreksaatin pitoisuus plasmassa voi nousta, mikä johtaa lisääntyneeseen toksisuuteen (ks. yllä).
Kortikosteroidit: Samanaikainen hoito voi johtaa ruoansulatuskanavan haavaumien tai verenvuodon riskin kasvamiseen.
Veren hyytymistä estävät lääkkeet: Ruoansulatuskanavan verenvuodon kohonnut riski (ks. yllä).
CYP2C9:n estäjät: Ibuprofeenin ja CYP2C9:n estäjien samanaikainen anto voi lisätä ibuprofeenille altistumista (CYP2C9:n substraatti). Vorikonatsolilla ja flukonatsolilla (CYP2C9:n estäjiä) toteutetussa tutkimuksessa ilmeni noin 80 - 100 % lisääntynyt S(+)-ibuprofeenialtistus. Ibuprofeeniannoksen pienentämistä on harkittava, kun voimakkaita CYP2C9:n estäjiä annetaan samanaikaisesti erityisesti silloin, kun korkeita ibuprofeeniannoksia annetaan joko vorikonatsolin tai flukonatsolin kanssa.
Parasetamoli:
Probenesidi estää parasetamolin sitoutumisen glukuronihappoon ja näin vähentää parasetamolipuhdistuman lähes puoleen. Parasetamoliannosta on pienennettävä, jos potilas käyttää samanaikaisesti probenesidiä.
Entsyymi-induktorit, kuten tietyt epilepsialääkkeet (fenytoiini, fenobarbitaali, karbamatsepiini), pienensivät parasetamolin plasman AUC-arvoa noin 60 %:iin farmakokineettisissä tutkimuksissa. Muut aineet, joilla on samankaltaisia entsyymi-induktorin ominaisuuksia (esim. rifampisiini, mäkikuisma (Hypericum)) voivat myös johtaa parasetamolipitoisuuden pienenemiseen. Lisäksi maksavaurioiden riski hoidettaessa suositellulla parasetamolin enimmäisannoksella on todennäköisesti korkeampi potilailla, jotka saavat entsyymi-induktoreja.
Tsidovudiini voi vaikuttaa parasetamolin metaboliaan ja päinvastoin, mikä voi lisätä molempien toksisuutta.
Jos parasetamolin käyttöä jatketaan toistuvasti yli viikon ajan, tämä voimistaa verenohennuslääkkeiden, erityisesti varfariinin, tehoa. Siksi parasetamolin pitkäkestoinen käyttö potilaille, joita hoidetaan verenohennuslääkkeillä, on sallittua vain, jos potilaan vointia seurataan. Vaikutuksia voi esiintyä jo 5 - 7 päivän ajan otettujen 1,5 - 2 g:n päiväannosten jälkeen. Jos parasetamolia otetaan päivässä > 2 g, INR-arvoa on seurattava. Epäsäännöllisellä parasetamolin käytöllä ei ole merkitseviä vaikutuksia vuototaipumukseen.
Suoliston peristaltiikkaa kiihdyttävien lääkevalmisteiden, kuten metoklopramidin ja domperidonin samanaikainen käyttö kiihdyttää parasetamolin imeytymistä ja vaikutusten ilmenemistä.
Kolestyramiini voi heikentää parasetamolin imeytymistä eikä sitä siksi saa määrätä otettavaksi tunnin kuluessa parasetamolin annosta. Isoniatsidi voi vaikuttaa parasetamolin farmokokinetiikkaan ja mahdollisesti voimistaa maksatoksisuutta.
Suoliston peristaltiikkaa hidastavien lääkevalmisteiden samanaikainen käyttö voi viivyttää parasetamolin imeytymistä ja vaikutusten ilmenemistä.
Parasetamoli voi vaikuttaa kloramfenikolin farmakokinetiikkaan. Kloramfenikolin plasmapitoisuuden seurantaa suositellaan, jos parasetamolihoito yhdistetään kloramfenikoli-injektioihin.
Etyylialkoholi voimistaa parasetamolin toksisuutta, mahdollisesti indusoimalla parasetamolista johdettujen maksatoksisten tuotteiden syntyä maksassa.
Vaikutukset laboratoriokokeisiin
Parasetamoli saattaa vaikuttaa fosfovolframihapolla tehtävän seerumin virtsahappokokeen ja glukoosioksidaasi-peroksidaasimenetelmällä tehtävän verensokerikokeen tuloksiin.
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Raskaus
Ibuprofeeni:
Prostaglandiinisynteesin inhibitiolla voi olla haitallisia vaikutuksia raskauteen ja/tai sikiön kehitykseen. Epidemiologisista tutkimuksista saadut tiedot osoittavat, että prostaglandiinisynteesin inhibitio raskauden alkuvaiheessa kasvattaa keskenmenon, sydämen epämuodostumien ja gastroskiisin riskiä. Kardiovaskulaaristen epämuodostumien absoluuttinen riski kasvoi vähemmästä kuin yhdestä prosentista keskimäärin 1,5 %:iin. Riskin uskotaan kasvavan annoksen ja hoidon keston myötä. Eläimillä prostaglandiinisynteesin inhibition on todettu johtavan lisääntyneeseen alkion menetykseen ennen ja jälkeen kiinnittymistä ja alkion/sikiön kuolleisuuteen. Lisäksi eläinkokeiden perusteella erilaisten (mm. sydän-ja verenkiertoelimistön) epämuodostumien ilmaantuvuuden on raportoitu lisääntyvän, kun prostaglandiinisynteesi-inhibiittoria on annettu organogeneesin aikana. Raskauden ensimmäisen ja toisen kolmanneksen aikana ibuprofeenia ei pidä käyttää, ellei se ole ehdottoman välttämätöntä. Jos raskautta yrittävä tai ensimmäisellä/toisella raskauskolmanneksella oleva nainen käyttää ibuprofeenia, on käytettävä mahdollisimman pientä annosta ja mahdollisimman lyhytkestoisesti.
Prostaglandiinisynteesi-inhibiittorin käyttö viimeisen raskauskolmanneksen aikana voi altistaa sikiön seuraaville:
- sydän- ja keuhkotoksisuus (ennenaikainen ductus arteriosuksen sulkeutuminen ja keuhkojen yliherkkyys)
- munuaisten toimintahäiriölle, joka voi johtaa munuaisten vajaatoimintaan ja lapsiveden määrän vähenemiseen.
Raskauden lopussa äiti ja vastasyntynyt lapsi voivat altistua seuraaville:
- verihiutaleaggregaation estoon ja mahdolliseen vuotoajan pitenemiseen, mikä voi liittyä pieniinkin annoksiin.
- supistusten estyminen, mikä voi viivästää tai pidentää synnytystä.
Tämän vuoksi ibuprofeeni on vasta-aiheista raskauden viimeisen kolmanneksen aikana.
Parasetamoli:
Epidemiologiset tutkimukset parasetamolille kohdussa altistuneiden lasten neurologisesta kehityksestä eivät ole antaneet ratkaisevia tuloksia. Raskaana olevista naisista olemassa oleva laaja tietomäärä ei osoita epämuodostumien esiintymistä eikä sikiöön tai vastasyntyneeseen kohdistuvaa toksisuutta. Parasetamolia voi käyttää raskauden aikana, jos se on kliinisesti tarpeen. Hoidossa on kuitenkin käytettävä pienintä tehokasta annosta mahdollisimman lyhytkestoisesti ja mahdollisimman harvoin.
Imetys
Parasetamoli erittyy äidinmaitoon, mutta määrät eivät ole kliinisesti merkitseviä. Saatavilla olevien julkaistujen tietojen perusteella imetys ei ole vasta-aiheista.
Ibuprofeeni ja sen metaboliitit voivat hyvin pieninä määrinä kulkeutua äidinmaitoon. Haitallisia lapseen kohdistuvia vaikutuksia ei tunneta.
Yllä esitettyjen tietojen valossa imetystä ei ole tarpeen keskeyttää käytettäessä lyhytkestoisessa hoidossa tämän valmisteen suositeltua annosta.
Hedelmällisyys
Tämän lääkevalmisteen käyttö saattaa heikentää naisen hedelmällisyyttä eikä sitä suositella raskautta yrittäville naisille. Naisten, joilla on vaikeuksia tulla raskaaksi tai jotka ovat parhaillaan hedelmällisyystutkimuksissa, tulisi harkita lääkevalmisteen käytön lopettamista.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Yleisesti ottaen ibuprofeenilla ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn. Korkeita annoksia käytettäessä voi kuitenkin esiintyä haittavaikutuksia, kuten väsymystä, huimausta (raportoitu yleiseksi) ja näköhäiriöitä (raportoitu melko harvinaiseksi), ja tämän perusteella joidenkin potilaiden ajokyky ja koneiden käyttökyky voi heikentyä.
Haittavaikutukset
Dolerin-valmisteen kliinisissä tutkimuksissa ei ole tullut ilmi muita haittavaikutuksia kuin parasetamoliin tai ibuprofeeniin yksistään liittyvät haittavaikutukset.
Haittavaikutukset on listattu MedDRA:n suosittelemiin elinjärjestelmän ryhmiin ja esiintyvyystiheyteen.
Hyvin yleinen (≥ 1/10);
Yleinen (≥ 1/100, < 1/10);
Melko harvinainen (≥ 1/1 000, < 1/100);
Harvinainen (≥1/10 000, <1/1 000);
Hyvin harvinainen (<1/10 000)
Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Hyvin harvinaisissa tapauksissa on raportoitu vaikea-asteisista ihoreaktioista.
Kliiniset tutkimukset viittaavat siihen, että ibuprofeenin käytöllä etenkin suurina annoksina (2 400 mg vuorokaudessa) saattaa olla yhteyttä hieman kohonneeseen valtimoveritulppatapahtumien riskiin (esimerkiksi sydäninfarkti tai aivohalvaus) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Veri ja imukudos | Melko harvinaiset: Neutropenia, agranulosytoosi, aplastinen anemia, hemolyyttinen anemia (joskus Coombs-positiivinen), trombosytopenia, johon liittyy tai ei liity purppura, leukopenia, pansytopenia, eosinofilia ja hemoglobiinin ja hematokriitin lasku, epistaksia, menorragia. |
Immuunijärjestelmä | Melko harvinaiset: Allergiset reaktiot: Oireyhtymä, johon liittyy vatsakipua, kuumetta, vilunväristyksiä, pahoinvointia ja oksentelua, anafylaksia, bronkospasmi. Seerumitauti, lupus erythematosus -oireyhtymä, Henoch-Schönleinin purppura, angioedeema. Hyvin harvinaiset: Yliherkkyysreaktiot, ihottuma ja ristiherkistyminen sympatomimeeteille. |
Aineenvaihdunta ja ravitsemus | Hyvin harvinaiset: Metabolinen asidoosi, hypokalemia. Melko harvinaiset: Gynekomastia, hypoglykeeminen reaktio |
Psyykkiset häiriöt | Hyvin harvinaiset: Sekavuus, masennus, unihäiriöt, ärtyneisyys, ahdistuneisuus, levottomuus, herkkyys. |
Hermosto | Yleiset: Huimaus, päänsärky, hermostuneisuus, heitehuimaus, väsymys, levottomuus, ärtyisyys Melko harvinaiset: Masennus, unettomuus, sekavuus, emotionaalinen epävakaus, uneliaisuus Harvinaiset: Parestesiat, hallusinaatiot, epänormaalit unet Hyvin harvinaiset: Paradoksikaalinen stimulaatio, optinen neuriitti, psykomotoriset häiriöt, ekstrapyramidaaliset oireet, vapina ja kouristukset. Tuntematon: aseptinen meningiitti |
Silmät | Melko harvinaiset: Amblyopia (hämärtynyt ja/tai heikentynyt näkö, sokea piste ja/tai värinäön muutokset), palautuu yleensä hoidon lopettamisen jälkeen. |
Kuulo ja tasapainoelin | Yleiset: Tinnitus |
Sydän | Yleiset: Edeema, nesteen kertyminen (häviää yleensä hoidon loputtua). Melko harvinaiset: Rytmihäiriöt (sinustakykardia, sinusbradykardia) Hyvin harvinaiset: Sydämentykytykset, takykardia, rytmihäiriö ja muut sydänperäiset dysrytmiat. Hypertensio ja sydämen vajaatoiminta, hypotensio. |
Hengityselimet, rintakehä ja välikarsina | Melko harvinaiset: Hengitysteiden eritteen paksuuntuminen Hyvin harvinaiset: Astma, astman paheneminen, bronkospasmi ja dyspnea. |
Ruoansulatuselimistö | Yleiset: Vatsakipu, ripuli, dyspepsia, pahoinvointi, epämukavuuden tunne vatsassa. Oksentelu, ummetus, vatsakrampit tai -kipu, kylläisyyden tunne ruoansulatuskanavassa (turvotus ja ilmavaivat) Melko harvinaiset: Peptinen haava, perforaatio tai ruoansulatuskanavan verenvuoto, meleena, hematemeesi, joka voi joskus olla hengenvaarallista, etenkin iäkkäillä. Haavainen stomatiitti ja haavaisen koliitin ja Crohnin taudin paheneminen. Gastriitti, pankreatiitti. |
Maksa ja sappi | Hyvin harvinaiset: Epänormaali maksan toiminta, hepatiitti ja keltaisuus. Maksan vajaatoiminta, maksanekroosi ja maksavaurio. |
Iho ja ihonalainen kudos | Yleiset: Ihottuma (mukaan lukien makulopapulaarinen tyyppi), kutina, angioedeema ja kasvojen turpoaminen. Melko harvinaiset: Rakkulaihotauti, urtikaria, erythema multiforme, hiustenlähtö, valoallergiset ihoreaktiot Hyvin harvinaiset: Voimakas hikoilu. eksfoliatiivinen dermatoosi, nekrotisoiva faskiitti. Rakkulaiset reaktiot, mukaan lukien erythema multiforme, Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi. Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin): Yleisoireinen eosinofiilinen oireyhtymä (DRESS-oireyhtymä). Akuutti yleistynyt eksantematoottinen pustuloosi (AGEP). |
Munuaiset ja virtsatiet | Melko harvinaiset: Virtsaumpi, edeema, nefroottinen oireyhtymä, interstitiaalinefriitti. Hyvin harvinaiset: Nefrotoksisuus ja akuutti ja krooninen munuaisten vajaatoiminta. Akuutti tubulaarinekroosi |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin harvinaiset: Väsymys ja pahoinvointi. |
Tutkimukset | Yleiset: Suurentunut alaniiniaminotransferaasi, suurentunut gamma-glutamyylitransferaasi ja epänormaalit maksan toimintakokeiden tulokset. Suurentunut veren kreatiinipitoisuus ja veren urea-arvo. Melko harvinaiset: Suurentunut aspartaattiaminotransferaasi, suurentunut veren alkalinen fosfataasi, suurentunut veren kreatiinifosfokinaasi, madaltunut hemoglobiini ja suurentunut verihiutalemäärä. |
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
FI-00034 Fimea
Yliannostus
Parasetamoli
Oireet
Usein parasetamolin yliannostustapauksissa aikaisia merkkejä ei ole. Parasetamolin yliannostuksen varhaisia merkkejä ovat kalpeus, pahoinvointi, oksentelu, anoreksia ja vatsakipu. Maksavaurio voi ilmetä 12 - 48 tunnin kuluessa lääkkeenotosta. Glukoosimetabolian poikkeamia ja metabolista asidoosia voi ilmetä. Vaikeassa myrkytystapauksessa maksan vajaatoiminta voi edetä enkelofalopatiaan, verenvuotoon, hypoglykemiaan, aivojen turvotukseen ja kuolemaan. Akuutti munuaisten vajaatoiminta ja akuutti tubulaarinen nekroosi, jonka voimakkaita oireita ovat lanteen alueen kipu, hematuria ja proteinuria saattaa kehittyä jopa ilman vaikeaa maksavauriota. Sydämen rytmihäiriöitä ja haimatulehdusta on raportoitu.
Hoito
Koska parasetamoliyliannostuksen hoito-ohjeissa on eroja jäsenvaltioiden välillä ja hoitosuosituksia päivitetään jatkuvasti, parasetamolin yliannostustapauksissa on otettava yhteys kansalliseen myrkytystietokeskukseen, josta saa ajantasaisimmat hoitosuositukset.
Parasetamolin yliannostustapauksessa välitön hoito on tärkeätä. Välitön sairaalahoito on tarpeen yliannostustapauksissa, vaikka havaittavissa ei olisi merkittäviä varhaisia oireita.
Jos akuuttia parasetamoliyliannostusta tai usean parasetamoliannoksen ottamista >1 tunnin aikana (”staggered overdose”) epäillään, N-asetyylikysteiinihoito on aloitettava välittömästi.
Lääkehiilen käyttöä on harkittava, jos yliannostus on otettu korkeintaan tunti sitten.
N-asetyylikysteiini annostellaan painoon perustuvien annostaulukoiden mukaan aikuisille ja lapsille. Taulukot ovat N-asetyylikysteiinin valmisteyhteenvedossa tai kansallisissa hoitosuosituksissa.
N-asetyylikysteiinihoidon kesto määräytyy maksavaurion vakavuuden mukaan ja sen on oltava linjassa kansallisten hoitosuositusten kanssa.
Maksapoliklinikalle on otettava yhteys seuraavissa tapauksissa:
- Potilaassa on merkkejä hepatosellulaarisista vaurioista (kohonnut ALAT) ja hyytymisparametrit ovat kriittisesti muuttuneet (INR > 1,6).
- Potilaalla todetaan munuaisten toimintahäiriö ja/tai metabolinen asidoosi, jota ei voida korjata nesteillä.
- Potilaalla todetaan enkefalopatia.
Ibuprofeeni
Lapsilla yli 400 mg/kg:n annos voi aiheuttaa oireita. Aikuisille annosvasteen vaikutus ei ole näin selkeä. Puoliintumisaika yliannostuksessa on 1,5 - 3 tuntia.
Oireet
Useimmille kliinisesti merkityksellisen tulehduskipulääkemäärän nielleille potilaille ilmaantuu vain pahoinvointia, oksentelua, ylävatsakipua tai harvemmin ripulia. Tinnitus, päänsärky ja ruuansulatuskanavan verenvuoto ovat myös mahdollisia. Vakavammissa myrkytystapauksissa on havaittu keskushermostotoksisuutta, joka ilmaantuu uneliaisuutena, toisinaan kiihtyneisyytenä ja desorientaationa tai koomana. Satunnaisesti potilaat kärsivät kouristuksista. Vaikea-asteisissa myrkytystiloissa voi ilmetä metabolista asidoosia ja protrombiiniajan/INR-ajan pitenemistä, joka saattaa johtua verenkierrossa olevien hyytymistekijöiden häiriöistä. Akuuttia munuaisten vajaatoimintaa ja maksavaurioita voi esiintyä. Astmaatikoilla astma saattaa pahentua.
Hoito
Hoidon on oltava oireenmukaista ja elintoimintoja tukevaa. Siihen on kuuluttava hengitysteiden pitäminen avoimina sekä sydämen toiminnan ja tärkeiden elintoimintojen seuraaminen, kunnes ne saadaan vakaiksi. Lääkehiilen antamista suun kautta on harkittava, jos potilas tulee hoitoon 1 tunnin kuluessa mahdollisesti toksisen lääkemäärän nielemisestä. Jos kouristukset ovat toistuvia tai pitkittyneitä, niitä tulee hoitaa suonensisäisellä diatsepamilla tai loratsepaamilla. Astman hoitoon annetaan keuhkoputkia laajentavia lääkkeitä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Parasetamoli, yhdistelmävalmisteet. ATC-koodi: N02BE51
Vaikutusmekanismi
Vaikka parasetamolin analgeettisen vaikutuksen tarkkaa paikkaa ja mekanismia ei ole selkeästi määritetty, näyttää siltä, että se saa aikaan kipua lievittävän vaikutuksen nostamalla kipukynnystä. Mahdolliseen mekanismiin voi liittyä useiden eri hermosolujen välittäjäainereseptorien, kuten N-metyyli-D-aspartaatin ja substanssi P:n välittämä typpioksidireitin estäminen.
Ibuprofeeni on propionihappojohdos, jolla on kipua ja tulehdusta lievittäviä ja kuumetta alentavia vaikutuksia. Lääkkeen terapeuttinen vaikutus NSAID-lääkkeenä perustuu entsyymin syklo-oksigenaasin estoon, joka johtaa prostaglandiinin synteesin hidastumiseen.
Ibuprofeenin tarkan toimintamekanismin oletetaan perustuvan syklo-oksigenaasien perifeeriseen estoon ja tästä seuraavaan prostaglandiinin synteesin estoon.
Kliininen teho ja turvallisuus
Yhdistelmälääkettä käytettiin satunnaistetuissa, kaksoissokkoutetuissa tutkimuksissa, joissa hoidettiin akuuttia hammassärkyä postoperatiivisesti. Tutkimuksissa ilmeni seuraavaa:
- 48 tunnin aikana tämän lääkevalmisteen vaikutus oli nopeampi kuin sen kahden vaikuttavan aineen erikseen ja se tarjosi paremman kivunlievityksen kuin sama päiväannos parasetamolia (levossa: p=0,007, 90 % CI [mm]: -20,04, -4,10, jalkeilla, p=0,006, 90 % CI [mm]: -21,54, -4,58) ja ibuprofeenia (levossa p=0,003, 90 % CI [mm]: -21,54, -4,58, jalkeilla, p=0,007, 90 % CI [mm]:-22,09, 4,56).
Kiputaulukon arvot ‒ Arvot kuvaavat tilannetta neljän tunnin välein leikkauksen jälkeen
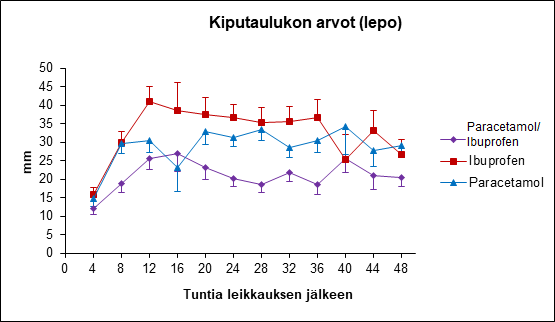
- Kaikki kolme arvioitua annosta (puoli tablettia, yksi tabletti tai kaksi tablettia) olivat tehokkaita lumelääkkeeseen verrattuna (kaksi tablettia: p=0,004, 95 % CI [mm/hr]:-23,32, -4,66; yksi tabletti: p=0,002, 90 % CI [mm/hr]:-20,78, -4,84; puoli tablettia: p=0,002, 95 % CI [mm/hr]:-20,73, -4,51) ja suurimman annoksen kohdalla [kaksi tablettia] mitattiin paras vasteprosentti (50 %, p=0,003), matalin maksimaalinen kiputaulukon VAS-arvo (p=0,009, 95 % CI [mm]: -17,73, -2,41), pisin aika ennen varalääkkeen tarvetta (p=0,001, 95 % CI [h]: 2,27, 12,41) ja matalin %-osuus potilaita, jotka tarvitsivat varalääkkeen (53,3 %, p=0,007). Kaikki mittaukset erosivat merkitsevästi lumelääkkeestä (p<0,05).
Erot kivun voimakkuudessa hoitoryhmittäin ensimmäisten kuuden tunnin kuluessa ensimmäisestä annoksesta
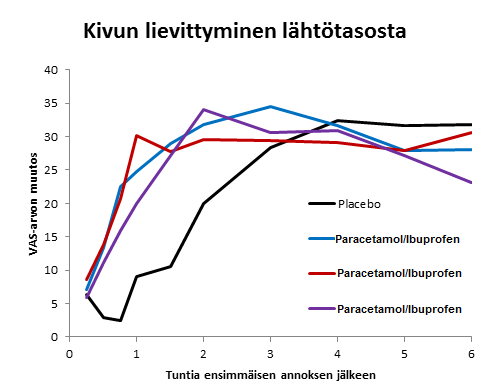
Kokeelliset tiedot viittaavat siihen, että ibuprofeeni saattaa inhiboida pienen asetyylisalisyyli-happoannoksen vaikutuksen verihiutaleiden aggregaatioon, kun valmisteita otetaan samanaikaisesti. Joissakin farmakodynaamisissa tutkimuksissa asetyylisalisyylihapolla on havaittu heikentynyttä vaikutusta tromboksaanin muodostumiseen ja verihiutaleiden aggregaatioon, kun ibuprofeenia on otettu yksittäisenä 400 mg:n annoksena joko 8 tuntia ennen kuin henkilö on saanut lääkeainetta välittömästi vapauttavan asetyylisalisyylihappoannoksen (81 mg) tai 30 minuuttia sen jälkeen. On epävarmaa, voidaanko näitä tietoja ekstrapoloida kliiniseen tilanteeseen, mutta ei voida kuitenkaan sulkea pois mahdollisuutta, että ibuprofeenin säännöllinen, pitkäaikainen käyttö saattaa heikentää pieniannoksisen asetyylisalisyylihapon sydäntä suojaavaa vaikutusta. Ei ole todennäköistä, että satunnaisella ibuprofeenin käytöllä olisi kliinisesti merkityksellisiä vaikutuksia (ks. kohta Yhteisvaikutukset).
Farmakokinetiikka
Imeytyminen
Sekä parasetamoli että ibuprofeeni imeytyvät nopeasti ruoansulatuskanavasta ja plasman huippupitoisuudet saavutetaan 10 - 60 minuuttia lääkkeen suun kautta oton jälkeen.
Jakautuminen
Kuten muidenkin parasetamolia sisältävien valmisteiden kohdalla, valmiste jakautuu useimpiin kehon kudoksiin.
Biotransformaatio
Parasetamoli metaboloituu laaja-alaisesti maksassa ja erittyy virtsaan pääosin inaktiivisena glukoronidina ja sulfaattikonjugaatteina. Alle 5 % lääkevalmisteesta erittyy muuttumattomana. Parasetamolin metaboliitteihin kuuluu vähäinen hydrolysoitunut välittäjä, jolla on maksatoksisia vaikutuksia. Tämä aktiivinen välittäjä detoksifioituu glutationikonjugaation seurauksena, mutta sitä voi kertyä parasetamolin yliannostuksessa. Hoitamattomana se voi mahdollisesti aiheuttaa vaikea-asteisia ja jopa pysyviä maksavaurioita.
Parasetamolin metabolia on erilainen keskosilla, vastasyntyneillä ja alle 12-vuotiailla lapsilla kuin aikuisilla konjugoitumisen sulfaatin kanssa ollessa parasetamolin pääasiallinen eliminaatioreitti.
Ibuprofeeni sitoutuu voimakkaasti (90 - 99 %:sti) plasman proteiineihin ja metaboloituu laajamittaisesti inaktiivisiksi komponenteiksi maksassa, pääosin glukuronidaation kautta.
Parasetamolin ja ibuprofeenin metaboliareitit ovat erilaiset eikä sellaisia yhteisvaikutuksia odoteta, joissa toisen aineen metabolia vaikuttaisi toiseen. Virallisessa tutkimuksessa, jossa käytettiin ihmisen maksaentsyymejä tällaisen mahdollisuuden tutkimiseen, ei löydetty mahdollisia lääkkeiden yhteisvaikutuksia metaboliareiteillä.
Toisessa tutkimuksessa arvioitiin ibuprofeenin vaikutusta parasetamolin oksidatiiviseen metaboliaan terveillä vapaaehtoisilla paaston aikana. Tutkimustulokset osoittivat, että ibuprofeeni ei muuttanut oksidatiivisesti metaboloituvan parasetamolin määrää, sillä parasetamolin ja sen metaboliittien (glutationi-, merkaptaani-, kysteiini-, glukoronidi- ja sulfaatti-parasetamolin) määrä oli sama riippumatta siitä, annettiinko se yksinään parasetamolina tai yhdessä ibuprofeenin kanssa (kiinteänä yhdisteenä Dolerin-valmisteessa). Tämä tutkimus sulkee pois mahdolliset muut maksatoksisen metaboliitin (NAPQI) aiheuttamat riskit parasetamoliin liittyen, jos sitä annetaan yhdessä ibuprofeenin kanssa.
Eliminaatio
Parasetamolin eliminaation puoliintumisaika vaihtelee noin yhdestä kolmeen tuntiin.
Sekä inaktiiviset metaboliitit että pieni määrä muuttumattomassa muodossa olevaa ibuprofeenia erittyy nopeasti ja täydellisesti munuaisten kautta ja 95 % otetusta annoksesta eliminoituu virtsaan neljän tunnin kuluessa lääkkeenotosta. Ibuprofeenin eliminaation puoliintumisaika on 1,9 - 2,2 tuntia.
Farmakokineettiset/farmakodynaamiset suhteet
Tutkimuksessa, jossa selvitettiin parasetamolin mahdollisia vaikutuksia ibuprofeenin plasmapuhdistumaan ja päinvastoin, ei tunnistettu lääkkeiden yhteisvaikutuksia.
Prekliiniset tiedot turvallisuudesta
Tavanomaisia tutkimuksia, joissa käytetään nykyisin hyväksyttyjä standardeja lisääntymis- ja kehitystoksisuuden arviointiin ei ole saatavissa. Ibuprofeenin ja parasetamolin toksikologinen turvallisuusprofiili on määritetty eläinkokeissa ja potilaskäytöstä saadun runsaan kliinisen kokemuksen perusteella. Ei ole mitään sellaista uutta käyttäjälle merkityksellistä prekliinistä tietoa turvallisuudesta, jota ei ole jo käsitelty valmisteyhteenvedon muissa osissa.
Farmaseuttiset tiedot
Apuaineet
Esigelatinoitu maissitärkkelys
Maissitärkkelys
Mikrokiteinen selluloosa
Kroskarmelloosinatrium
Magnesiumstearaatti
Tabletin päällyste: HPMC 2910/hypromelloosi 15cP (E464), laktoosimonohydraatti, titaanidioksidi (E171), makrogoli/PEG-4000, natriumsitraattidihydraatti (E331)
Talkki
Yhteensopimattomuudet
Ei sovellettavissa
Kestoaika
3 vuotta.
Säilytys
Säilytä alle 30 °C.
Säilytä alkuperäisessä pakkauksessa valolta suojaamiseksi.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
DOLERIN tabletti, kalvopäällysteinen
500/150 mg 30 fol (5,78 €), 50 fol (8,44 €)
PF-selosteen tieto
Pakkauskoot:
PVC/alumiiniläpipainopakkaukset, jotka sisältävät 8, 10, 12, 16, 20, 24, 30, 32, 50 tai 100 kalvopäällysteistä tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoisia, kapselinmuotoisia kalvopäällysteisiä tabletteja, joiden pituus on 19 mm. Tablettien toisella puolella on jakouurre ja toinen puoli on sileä.
Jakouurre on tarkoitettu vain nielemisen helpottamiseksi eikä jakamiseksi yhtä suuriin annoksiin.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia hävittämisen suhteen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
DOLERIN tabletti, kalvopäällysteinen
500/150 mg 30 fol, 50 fol
- Ei korvausta.
ATC-koodi
N02BE51
Valmisteyhteenvedon muuttamispäivämäärä
28.08.2021
Yhteystiedot
Box 16184
103 24 Stockholm
Sweden
+46 10 330 23 10
www.karopharma.se
info@karopharma.se
