BEXSERO injektioneste, suspensio, esitäytetty ruisku
Vaikuttavat aineet ja niiden määrät
Yksi annos (0,5 ml) sisältää:
Rekombinanttia B‑ryhmän Neisseria meningitidis ‑bakteerin NHBA‑fuusioproteiinia 1, 2, 3 | 50 mikrogrammaa |
Rekombinanttia B‑ryhmän Neisseria meningitidis ‑bakteerin NadA‑proteiinia 1, 2, 3 | 50 mikrogrammaa |
Rekombinanttia B‑ryhmän Neisseria meningitidis ‑bakteerin fHbp‑fuusioproteiinia 1, 2, 3 | 50 mikrogrammaa |
B‑ryhmän Neisseria meningitidis ‑kannan NZ98/254 ulkokalvovesikkeleitä (OMV) PorA P1.4:ää sisältävänä kokonaisproteiinimääränä mitattuna2 | 25 mikrogrammaa |
1 tuotettu E. coli ‑soluissa yhdistelmä‑DNA‑tekniikalla
2 adsorboitu alumiinihydroksidiin (0,5 mg Al³+)
3 NHBA (Neisserial Heparin Binding Antigen), NadA (Neisseria adhesin A), fHbp (factor H binding protein)
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, suspensio.
Kliiniset tiedot
Käyttöaiheet
Bexsero on tarkoitettu 2 kuukauden iästä lähtien aktiiviseen immunisaatioon B‑ryhmän Neisseria meningitidis ‑bakteerin aiheuttamaa invasiivista meningokokkisairautta vastaan.
Invasiivisen sairauden vaikutus eri ikäryhmiin sekä antigeeniepidemiologian vaihtelevuus B‑ryhmän kantojen osalta eri maantieteellisillä alueilla on otettava huomioon rokotetta annettaessa. Ks. kohdasta Farmakodynamiikka lisätietoja suojasta tiettyjä B‑ryhmän kantoja vastaan.
Tätä rokotetta on käytettävä virallisten suositusten mukaisesti.
Annostus ja antotapa
Annostus
Taulukko 1. Yhteenveto annostuksesta
Ikä ensimmäisen annoksen antohetkellä | Perusimmunisaatio | Perusrokotusannosten antoväli | Tehoste |
2–5 kuukauden ikäiset vauvat a | Kolme 0,5 ml:n annosta | Ei alle 1 kuukausi | Kyllä, 1 annos 12−15 kuukauden iässä siten, että perusrokotussarjan ja tehosteannoksen antoväli on vähintään 6 kuukautta b, c |
Kaksi 0,5 ml:n annosta | Ei alle 2 kuukautta | ||
6−11 kuukauden ikäiset vauvat | Kaksi 0,5 ml:n annosta | Ei alle 2 kuukautta | Kyllä, 1 annos 2. elinvuotena siten, että perusrokotussarjan ja tehosteannoksen antoväli on vähintään 2 kuukautta c |
12−23 kuukauden ikäiset lapset | Kaksi 0,5 ml:n annosta | Ei alle 2 kuukautta | Kyllä, 1 annos siten, että perusrokotussarjan ja tehosteannoksen antoväli on 12−23 kuukauttac |
2–10 vuoden ikäiset lapset | Kaksi 0,5 ml:n annosta | Ei alle 1 kuukausi | Tehosteannosta tulisi harkita henkilöillä, joilla on virallisiin suosituksiin perustuen jatkuva altistumisriski meningokokki-infektiolled |
Nuoret (≥ 11‑vuotiaat) ja aikuiset* |
a Ensimmäinen annos annetaan aikaisintaan 2 kuukauden iässä. Bexsero‑valmisteen turvallisuutta ja tehoa alle 8 viikon ikäisten lasten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
b Jos rokotuksen anto viivästyy, tehosterokotusta ei saa antaa 24 kuukauden iän jälkeen.
c Ks. kohta Farmakodynamiikka. Lisäksi annettavien tehosteannosten tarvetta ja ajankohtaa ei ole vielä varmistettu.
d Ks. kohta Farmakodynamiikka.
* Yli 50‑vuotiaista aikuisista ei ole tietoja.
Antotapa
Rokote annetaan syvänä injektiona lihakseen, mieluiten vauvan reiden etu‑sivuosaan tai vanhempien potilaiden hartialihaksen alueelle.
Jos samaan aikaan annetaan useampi kuin yksi rokote, ne on annettava eri kohtiin.
Rokotetta ei saa injisoida laskimoon, ihon alle eikä ihon sisään eikä sitä saa sekoittaa samaan ruiskuun muiden rokotteiden kanssa.
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet rokotteen käsittelystä ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Bexsero‑rokotteen antamista on muiden rokotteiden tavoin lykättävä, jos rokotettavalla on akuutti vaikea kuumesairaus. Lievä infektio, kuten vilustuminen, ei kuitenkaan ole aihe rokotuksen lykkäämiselle.
Ei saa injisoida suoneen.
Kuten kaikkien injisoitavien rokotteiden kohdalla, asianmukaisen lääkärinhoidon ja valvonnan on oltava viipymättä saatavilla siltä varalta, että rokotteen antamisen jälkeen ilmaantuu anafylaktinen reaktio.
Ahdistuneisuuteen liittyviä reaktioita, kuten vasovagaalisia reaktioita (pyörtyminen), hyperventilaatiota tai stressiin liittyviä reaktioita voi ilmetä rokottamisen yhteydessä psykogeenisena reaktiona neulanpistoon (ks. kohta Haittavaikutukset). On tärkeää toimia siten, että vältetään pyörtymisen seurauksena aiheutuvat vammat.
Tätä rokotetta ei saa antaa henkilöille, joilla on trombosytopenia tai jokin lihakseen annettavalle injektiolle vasta‑aiheen muodostava hyytymishäiriö, ellei mahdollinen hyöty ole selvästi antoon liittyvää riskiä suurempi.
Kuten muutkaan rokotteet, Bexsero ei välttämättä anna suojaa kaikille rokotetuille.
Bexsero‑rokotteen ei odoteta antavan suojaa kaikkia leviäviä B‑ryhmän meningokokkikantoja vastaan (ks. kohta Farmakodynamiikka).
Terveydenhuollon ammattilaisten on oltava tietoisia siitä, että vauvoilla ja lapsilla (alle 2‑vuotiailla) voi ilmetä rokottamisen jälkeen lämmönnousua, kuten monien rokotteiden kohdalla. Kuumelääkkeiden antaminen ennaltaehkäisynä rokotuksen yhteydessä ja pian sen jälkeen voi vähentää rokotuksen jälkeisten kuumereaktioiden ilmaantuvuutta ja voimakkuutta. Vauvoille ja lapsille (alle 2‑vuotiaille) on aloitettava kuumelääkitys paikallisten suositusten mukaisesti.
Vasta-ainevaste aktiivisessa immunisaatiossa saattaa olla heikentynyt henkilöillä, joiden immuunivaste on alentunut joko immunosuppressiivisen hoidon, geneettisen tekijän tai jonkin muun syyn vuoksi. Immunogeenisuutta koskevat tiedot ovat saatavilla henkilöille, joilla on komplementtipuutos, asplenia tai jokin muu pernan toimintahäiriö (ks. kohta Farmakodynamiikka).
Riski ryhmän B Neisseria meningitidiksen aiheuttamaan invasiiviseen sairauteen on suurentunut henkilöillä, joilla on perinnöllinen komplementtipuutos (esimerkiksi C3 tai C5 puutos) ja henkilöillä, jotka saavat komplementin terminaalisen osan aktivaatiota estävää hoitoa (esimerkiksi ekulitsumabi). Riski on suurentunut, vaikka Bexsero rokotuksen jälkeen muodostuisi vasta-aineita.
Bexseron käytöstä yli 50‑vuotiaille potilaille ei ole tietoja ja kroonisia sairauksia sairastaville potilaille tietoja on vain vähän.
Jos perusimmunisaatiosarja annetaan hyvin varhain keskosena syntyneille vauvoille (syntyneet ≤ 28. raskausviikolla) ja erityisesti sellaisille, joilla on aiemmin ollut hengityselinten kehittymättömyyttä, on otettava huomioon mahdollinen apneariski ja että hengitystä on seurattava 48−72 tuntia. Koska rokottamisen hyöty tälle vauvaryhmälle on suuri, rokotusta ei pidä lykätä tai jättää antamatta.
Kanamysiiniä käytetään valmistusprosessin alkuvaiheessa ja se poistetaan valmistuksen myöhemmissä vaiheissa. Jos valmisteessa on kanamysiiniä, sen pitoisuus lopullisessa rokotteessa on alle 0,01 mikrogrammaa/annos.
Bexseron käytön turvallisuutta kanamysiinille herkille henkilöille ei ole varmistettu.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Käyttö muiden rokotteiden kanssa
Bexsero voidaan antaa samanaikaisesti seuraavien rokoteantigeenien kanssa joko monovalenttina tai yhdistelmärokotteena: kurkkumätä, jäykkäkouristus, soluton hinkuyskä, Haemophilus influenzae tyyppi b, inaktivoitu poliomyeliitti, hepatiitti B, heptavalentti pneumokokkikonjugaatti, tuhkarokko, sikotauti, vihurirokko, vesirokko ja meningokokki A,C, W, Y -ryhmien konjugaatti.
Kliinisissä tutkimuksissa osoitettiin, että Bexseron anto ei vaikuttanut samanaikaisesti annettujen tavanomaisten rokotteiden immuunivasteisiin. Tämä perustuu yhdenvertaisiin vasta‑ainevastemääriin verrattuna tavanomaisten rokotteiden antoon yksinään. Tutkimuksissa havaittiin epäjohdonmukaisia tuloksia vasteessa inaktivoituun poliovirustyyppiin 2 ja pneumokokkikonjugaatin serotyyppiin 6B sekä pienempiä vasta‑ainetittereitä hinkuyskän pertaktiiniantigeeniin, mutta nämä tiedot eivät viittaa kliinisesti merkittävään yhteisvaikutukseen.
Koska kuumeen, antopaikan aristuksen, ruokailutottumusten muutosten ja ärtyisyyden esiintyvyys on suurempi annettaessa Bexsero yhdessä edellä mainittujen rokotteiden kanssa, rokotteiden antamista erikseen on harkittava silloin, kun se on mahdollista. Estohoitona käytetty parasetamoli vähentää kuumeen ilmaantuvuutta ja vaikeusastetta vaikuttamatta Bexseron tai tavanomaisesti käytettävien rokotteiden immunogeenisuuteen. Muiden kuumelääkkeiden kuin parasetamolin vaikutusta immuunivasteeseen ei ole tutkittu.
Bexseron antamista samanaikaisesti muiden kuin edellä mainittujen rokotteiden kanssa ei ole tutkittu.
Kun Bexsero annetaan samanaikaisesti muiden rokotteiden kanssa, se on annettava eri kohtaan (ks. kohta Annostus ja antotapa).
Raskaus ja imetys
Raskaus
Raskauden aikaisesta käytöstä ei ole saatavissa riittävästi kliinisiä tietoja.
Mahdollista riskiä raskaana olevalle naiselle ei tunneta. Siitä huolimatta rokotetta ei pidä olla antamatta, kun on olemassa selvä meningokokki‑infektiolle altistumisen riski.
Emoon tai sikiöön kohdistuvasta toksisuudesta tai vaikutuksista raskauteen, emon käyttäytymiseen, naaraan hedelmällisyyteen tai postnataaliseen kehitykseen ei saatu näyttöä tutkimuksessa, jossa naaraskaniinit saivat Bexseroa noin 10 kertaa ihmisen annosta vastaavan määrän (painon perusteella).
Imetys
Rokotteen imetyksenaikaisesta turvallisuudesta naisille ja heidän lapsilleen ei ole saatavissa tietoja. Hyöty‑riskisuhde on tutkittava, ennen kuin tehdään päätös rokotuksen antamisesta imetyksen aikana.
Rokotetuilla emokaniineilla tai niiden poikasilla ei ilmennyt haittavaikutuksia 29. imetyspäivään mennessä. Bexsero oli immunogeeninen emoilla, jotka rokotettiin ennen imetystä, ja poikasissa havaittiin vasta‑aineita, mutta maidon vasta‑ainepitoisuuksia ei määritetty.
Hedelmällisyys
Ihmisestä ei ole hedelmällisyystietoja saatavilla.
Eläinkokeissa ei havaittu vaikutuksia naaraiden hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Bexserolla ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn. Jotkut kohdassa Haittavaikutukset mainituista vaikutuksista saattavat kuitenkin vaikuttaa tilapäisesti ajokykyyn tai koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Bexseron turvallisuutta arvioitiin 17 tutkimuksessa, joista 10 oli satunnaistettuja kontrolloituja kliinisiä tutkimuksia. Näihin tutkimuksiin osallistui 10 565 tutkittavaa (≥ 2 kuukauden ikäisiä), jotka saivat vähintään yhden Bexsero‑annoksen. Bexseroa saaneista 6 837 oli vauvoja ja lapsia (alle 2‑vuotiaita), 1 051 oli lapsia (2–10‑vuotiaita) ja 2 677 oli nuoria ja aikuisia. Niistä tutkittavista, jotka saivat vauvoille tarkoitetun Bexsero‑perusrokotussarjan, 3 285 sai tehosteannoksen toisena elinvuotena.
Kliinisissä tutkimuksissa vauvoilla ja lapsilla (alle 2‑vuotiailla) yleisimmin havaittuja paikallisia ja systeemisiä haittavaikutuksia olivat aristus ja eryteema antopaikassa, kuume ja ärtyisyys.
2., 4. ja 6. ikäkuukautena rokotettuja vauvoja koskeneissa kliinisissä tutkimuksissa kuumetta (≥ 38 °C) ilmeni 69–79 %:lla tutkittavista, kun Bexsero annettiin samanaikaisesti tavanomaisten rokotteiden kanssa (jotka sisälsivät seuraavia antigeenejä: pneumokokin 7‑valenttista konjugaattia, kurkkumätää, jäykkäkouristusta, solutonta hinkuyskää, hepatiitti B:tä, inaktivoitua poliomyeliittiä ja Haemophilus influenzae tyyppi b:tä) verrattuna 44–59 %:iin tutkittavista, jotka saivat pelkästään tavanomaiset rokotukset. Kuumelääkkeiden käyttöä ilmoitettiin useammin myös vauvoilla, jotka saivat Bexseroa ja tavanomaisia rokotteita. Kun Bexsero annettiin yksinään, kuumeen esiintymistiheys oli samankaltainen kuin tavanomaisia vauvoille tarkoitettuja rokotteita koskevissa kliinisissä tutkimuksissa. Kun kuumetta ilmeni, se noudatti yleensä ennakoitavissa olevaa kaavaa. Useimmissa kuumetapauksissa kuume laski rokotusta seuraavana päivänä.
Nuorilla ja aikuisilla yleisimmin havaittuja paikallisia ja systeemisiä haittavaikutuksia olivat kipu antopaikassa, huonovointisuus ja päänsärky.
Haittavaikutusten ilmaantuvuuden tai vaikeusasteen lisääntymistä ei havaittu rokotussarjan seuraavien annosten yhteydessä.
Haittavaikutustaulukko
Haittavaikutukset (perusimmunisaation tai tehosteannoksen jälkeen), joiden katsottiin ainakin mahdollisesti liittyvän rokottamiseen, on luokiteltu esiintymistiheyden mukaan.
Esiintymistiheydet ovat seuraavat:
Hyvin yleinen: (≥ 1/10)
Yleinen: (≥ 1/100, < 1/10)
Melko harvinainen: (≥ 1/1 000, < 1/100)
Harvinainen: (≥ 1/10 000, < 1/1 000)
Hyvin harvinainen: (< 1/10 000)
Tuntematon: (koska saatavissa oleva tieto ei riitä arviointiin)
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Kliinisissä lääketutkimuksissa raportoidut haitat sekä Bexseron markkinoille tulon jälkeisessä maailmanlaajuisessa spontaaniraportoinnissa ilmoitetut haittavaikutukset on lueteltu seuraavassa. Koska ilmoitukset reaktiot on todettu populaatiossa, jonka kokoa ei tiedetä, niiden esiintyvyyttä ei aina voida arvioida luotettavasti. Tästä syystä niiden yleisyydeksi on merkitty tuntematon.
Vauvat ja lapset (enintään 10‑vuotiaat)
Veri ja imukudos
Tuntematon: lymfadenopatia
Immuunijärjestelmä
Tuntematon: allergiset reaktiot (mukaan lukien anafylaktiset reaktiot)
Aineenvaihdunta ja ravitsemus
Hyvin yleinen: syömishäiriöt
Hermosto
Hyvin yleinen: uneliaisuus, epätavallinen itkeminen, päänsärky
Melko harvinainen: kouristuskohtaukset (mukaan lukien kuumekouristukset)
Tuntematon: hypotonis-hyporesponsiivinen episodi, aivokalvoärsytys (merkkejä aivokalvoärsytyksestä kuten niskan jäykkyyttä tai valonarkuutta on satunnaisesti raportoitu pian rokotuksen jälkeen. Nämä oireet ovat olleet lieviä ja ohimeneviä)
Verisuonisto
Melko harvinainen: kalpeus (harvinaista tehosterokotuksen jälkeen)
Harvinainen: Kawasakin tauti
Ruoansulatuselimistö
Hyvin yleinen: ripuli, oksentelu (melko harvinainen tehosterokotuksen jälkeen)
Iho ja ihonalainen kudos
Hyvin yleinen: ihottuma (12–23 kuukauden ikäiset lapset) (melko harvinainen tehosterokotuksen jälkeen)
Yleinen: ihottuma (2–10‑vuotiaat lapset)
Melko harvinainen: ekseema
Harvinainen: urtikaria
Luusto, lihakset ja sidekudos
Hyvin yleinen: nivelkipu
Yleisoireet ja antopaikassa todettavat haitat
Hyvin yleinen: kuume (≥ 38 °C), antopaikan aristus (mukaan lukien vaikea antopaikan aristus, joksi määriteltiin itku kyseistä raajaa liikutettaessa), antopaikan eryteema, antopaikan turvotus, antopaikan induraatio, ärtyisyys
Melko harvinainen: kuume (≥ 40 °C)
Tuntematon: injektiokohdan reaktiot (mukaan lukien rokotetun raajan laaja turpoaminen), rakkulat antopaikassa tai sen ympärillä ja injektiokohdassa oleva kyhmy, joka voi pysyä yli kuukauden ajan)
Nuoret (vähintään 11‑vuotiaat) ja aikuiset
Veri ja imukudos
Tuntematon: lymfadenopatia
Immuunijärjestelmä
Tuntematon: allergiset reaktiot (mukaan lukien analyfylaktiset reaktiot)
Hermosto
Hyvin yleinen: päänsärky
Tuntematon: pyörtyminen tai vasovagaalinen reaktio antoon, aivokalvoärsytys (merkkejä aivokalvoärsytyksestä kuten niskan jäykkyyttä tai valonarkuutta on satunnaisesti raportoitu pian rokotuksen jälkeen. Nämä oireet ovat olleet lieviä ja ohimeneviä)
Ruoansulatuselimistö
Hyvin yleinen: pahoinvointi
Iho ja ihonalainen kudos
Tuntematon: ihottuma
Luusto, lihakset ja sidekudos
Hyvin yleinen: lihaskipu, nivelkipu
Yleisoireet ja antopaikassa todettavat haitat
Hyvin yleinen: antopaikan kipu (mukaan lukien vaikea antopaikan kipu, joksi määriteltiin kyvyttömyys suoriutua normaaleista päivittäisistä toimista), antopaikan turvotus, antopaikan induraatio, antopaikan eryteema, huonovointisuus
Tuntematon: kuume, injektiokohdan reaktiot (mukaan lukien rokotetun raajan laaja turpoaminen), rakkulat antopaikassa tai sen ympärillä ja injektiokohdassa oleva kyhmy, joka voi pysyä yli kuukauden ajan)
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kokemukset yliannostuksista ovat niukkoja. Yliannostustapauksissa suositellaan elintoimintojen seurantaa ja mahdollista oireenmukaista hoitoa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: meningokokkirokotteet, ATC‑koodi: J07AH09
Vaikutusmekanismi
Immunisaatio Bexserolla on tarkoitettu stimuloimaan sellaisten bakteerivasta‑aineiden tuotantoa, jotka tunnistavat NHBA‑, NadA‑, fHbp‑ ja PorA P1.4 ‑rokoteantigeenit (PorA P1.4 on immunodominantti antigeeni, jota esiintyy ulkokalvovesikkelikomponentissa) ja jotka oletettavasti suojaavat invasiiviselta meningokokkisairaudelta (IMD). Koska nämä antigeenit ilmentyvät vaihtelevasti eri kannoissa, rokotteen tuottamat vasta‑aineet tappavat herkästi meningokokkibakteerit, jotka ilmentävät näitä antigeenejä riittävinä pitoisuuksina. Meningokokkien antigeenien tyypitysjärjestelmä (Meningococcal Antigen Typing System, MATS) kehitettiin liittämään meningokokkiryhmän B eri bakteerikantojen antigeeniprofiilit kantojen tappamiseen ihmisen komplementilla (hSBA) tehtävässä seerumin bakterisidianalyysissä. Vuosina 2007–2008 viidessä Euroopan maassa kerätyn noin 1 000 erilaisen invasiivisen meningokokkiryhmän B isolaatin tarkastelu osoitti, että alkuperämaan mukaan 73‑87 %:ssa meningokokkiryhmän B isolaateista oli sopiva rokotteen kattama MATS‑antigeeniprofiili. Noin tuhannesta kannasta yhteensä 78 % (95 %:n luottamusväli: 63–90) oli mahdollisesti herkkiä rokotteen indusoimille vasta‑aineille.
Kliininen teho
Bexseron tehoa ei ole arvioitu kliinisissä tutkimuksissa. Rokotteen teho on päätelty osoittamalla seerumin bakterisidisen vasta‑ainevasteen induktio kuhunkin rokoteantigeeniin (ks. kohta Immunogeenisuus). Rokotteen vaikuttavuus ja vaikutus on osoitettu tosielämän olosuhteissa.
Rokotuksen vaikutus sairauden ilmaantuvuuteen
Syyskuussa 2015 Bexsero tuli osaksi kansallista rokotusohjelmaa (NIP) Isossa‑Britanniassa. Rokotusohjelmassa vauvoille annetaan kaksi rokoteannosta (2 ja 4 kuukauden iässä) ja tehosteannos (12 kuukauden iässä). Samassa yhteydessä Englannin terveysviranomainen PHE teki 3 vuotta kestäneen havainnointitutkimuksen, joka käsitti kansallisella tasolla koko syntymäkohortin.
Kolme vuotta rokotusohjelman alkamisesta MenB IMD -tapausten ilmaantuvuuden havaittiin vähentyneen tilastollisesti merkitsevästi 75 % (ilmaantuvuuden suhdeluku 0,25 [95 %:n luottamusväli 0,19–0,36]) rokotusohjelman piiriin kuuluneilla vauvoilla. Tulos oli riippumaton vauvojen rokotusstatuksesta tai rokotesuojan ennustetusta kattavuudesta ryhmän B meningokokkikantoja vastaan.
Etelä‑Australiassa yli 30 000 16–19-vuotiasta oppilasta (91 %:sta high school ‑oppilaitoksia) sai kaksi Bexsero‑annosta 1–3 kk:n välein. Keskeytetyn aikasarjan analyysissa havaittiin MenB IMD ‑tapausten vähentyneen tilastollisesti merkitsevästi 71 % (95 %:n luottamusväli 15–90) kaksivuotisen seurannan (heinäkuu 2017 – kesäkuu 2019) aikana.
Immunogeenisuus
Seerumin bakterisidiset vasta‑ainevasteet rokotteen kuhunkin antigeeniin NadA, fHbp, NHBA ja PorA P1.4 arvioitiin käyttämällä neljän meningokokkiryhmän B viitekantajoukkoa. Bakterisidiset vasta‑aineet näitä kantoja vastaan mitattiin seerumin bakterisidimäärityksellä käyttämällä ihmisen seerumia komplementin lähteenä (hSBA). Kaikista rokotusohjelmista, joissa käytettiin NHBA:n viitekantaa, ei ole tietoja.
Useimmat primaarisista immunogeenisuustutkimuksista toteutettiin satunnaistettuina, kontrolloituina, kliinisinä monikeskustutkimuksina. Immunogeenisuus arvioitiin vauvoilla, lapsilla, nuorilla ja aikuisilla.
Immunogeenisuus vauvoilla ja lapsilla
Vauvoja koskevissa tutkimuksissa osallistujat saivat kolme Bexsero‑annosta joko 2, 4 ja 6 tai 2, 3 ja 4 kuukauden ikäisenä sekä tehosteannoksen toisena elinvuotena heti 12 kuukauden ikäisenä. Seeruminäytteet otettiin ennen rokotusta, yksi kuukausi kolmannen rokotuksen jälkeen (ks. taulukko 2) ja yksi kuukausi tehosterokotuksen jälkeen (ks. taulukko 3). Jatkotutkimuksessa arvioitiin immuunivasteen säilymistä yksi vuosi tehosteannoksen jälkeen (ks. taulukko 3). Toisessa kliinisessä tutkimuksessa arvioitiin immunogeenisuus kahden tai kolmen annoksen ja näiden jälkeen annettavan tehosteannoksen jälkeen 2‑5 kuukauden ikäisillä vauvoilla. Kahden annoksen jälkeinen immunogeenisuus on dokumentoitu myös toisessa tutkimuksessa vauvoilla, jotka olivat tutkimukseen tullessaan 6−8 kuukauden ikäisiä (ks. taulukko 4).
Aiemmin rokottamattomat lapset saivat myös kaksi annosta toisena elinvuotena, ja vasta aineiden säilyminen mitattiin yksi vuosi toisen annoksen jälkeen (ks. taulukko 4).
Immunogeenisuus 2–5 kuukauden ikäisillä vauvoilla
Kolmen annoksen perusrokotussarja, jonka jälkeen annettiin tehosteannos
Immunogeenisuustulokset yhden kuukauden kuluttua kolmen Bexsero‑annoksen jälkeen, kun annokset annettiin 2, 3, 4 ja 2, 4, 6 kuukauden ikäisille vauvoille, on esitetty taulukossa 2. Bakterisidiset vasta‑ainevasteet meningokokkiviitekantoja vastaan yksi kuukausi kolmannen rokotteen jälkeen olivat korkeat fHbp‑, NadA‑ ja PorA P1.4 ‑antigeenejä vastaan molemmissa Bexseron rokotusohjelmissa. Bakterisidiset vasteet myös NHBA‑antigeeniä vastaan olivat korkeita vauvoilla, joille annettiin rokotus 2., 4., 6. kuukauden aikataulun mukaan, mutta tämä antigeeni vaikutti olevan heikommin immunogeeninen 2., 3., 4. kuukauden aikataululla. NHBA‑antigeenin tämän rokotusohjelman yhteydessä havaitun heikomman immunogeenisuuden kliiniset seuraukset eivät ole tiedossa.
Taulukko 2. Seerumin bakterisidiset vasta‑ainevasteet 1 kuukausi 2., 3., 4. tai 2., 4., 6. ikäkuukautena annetun kolmannen Bexsero‑annoksen jälkeen
Antigeeni | Tutkimus V72P13 2, 4, 6 kuukautta | Tutkimus V72P12 2, 3, 4 kuukautta | Tutkimus V72P16 2, 3, 4 kuukautta | |
fHbp | % seropositiivisia* (95 %:n luottamusväli) | N = 1149 100 % (99–100) | N = 273 99 % (97–100) | N = 170 100 % (98–100) |
hSBA GMT** (95 %:n luottamusväli) | 91 (87–95) | 82 (75–91) | 101 (90–113) | |
NadA | % seropositiivisia (95 %:n luottamusväli) | N = 1152 100 % (99–100) | N = 275 100 % (99–100) | N = 165 99 % (97–100) |
hSBA GMT (95 %:n luottamusväli) | 635 (606–665) | 325 (292–362) | 396 (348–450) | |
PorA P1.4 | % seropositiivisia (95 %:n luottamusväli) | N = 1152 84 % (82–86) | N = 274 81 % (76–86) | N = 171 78 % (71–84) |
hSBA GMT (95 %:n luottamusväli) | 14 (13–15) | 11 (9,14–12) | 10 (8,59–12) | |
NHBA | % seropositiivisia (95 %:n luottamusväli) | N = 100 84 % (75–91) | N = 112 37 % (28–46) | N = 35 43 % (26–61) |
hSBA GMT (95 %:n luottamusväli) | 16 (13–21) | 3,24 (2,49–4,21) | 3,29 (1,85–5,83) |
* % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA‑titterin ≥ 1:5.
** GMT = titterin geometrinen keskiarvo.
Tiedot bakterisidisten vasta‑aineiden säilymisestä 8 kuukautta 2., 3. ja 4. ikäkuukautena annetun Bexsero‑rokotuksen jälkeen ja 6 kuukautta 2., 4. ja 6. ikäkuukautena annetun Bexsero‑rokotuksen jälkeen (tehosteannosta edeltävä ajankohta) sekä tehostetiedot 12. ikäkuukautena annetun neljännen Bexsero‑annoksen jälkeen on esitetty taulukossa 3. Immuunivasteen säilyminen yksi vuosi tehosteannoksen jälkeen on esitetty myös taulukossa 3.
Taulukko 3. Seerumin bakterisidiset vasta‑ainevasteet, kun tehosteannos annettiin 12 kuukauden iässä 2., 3. ja 4. tai 2., 4. ja 6. ikäkuukautena annetun perusrokotussarjan jälkeen, sekä bakterisidisen vasta‑aineen säilyminen yksi vuosi tehosteannoksen jälkeen
Antigeeni | 2, 3, 4, 12 kuukautta | 2, 4, 6, 12 kuukautta | |
fHbp | ennen tehostetta* % seropositiivisia** (95 %:n luottamusväli) hSBA GMT*** (95 %:n luottamusväli) | N = 81 58 % (47–69) 5,79 (4,54–7,39) | N = 426 82 % (78–85) 10 (9,55–12) |
1 kuukausi tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | N = 83 100 % (96–100) 135 (108–170) | N = 422 100 % (99–100) 128 (118–139) | |
12 kuukautta tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | ‑ | N = 299 62 % (56–67) 6,5 (5,63–7,5) | |
NadA | ennen tehostetta % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | N = 79 97 % (91–100) 63 (49–83) | N = 423 99 % (97–100) 81 (74–89) |
1 kuukausi tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | N = 84 100 % (96–100) 1558 (1262–1923) | N = 421 100 % (99–100) 1465 (1350–1590) | |
12 kuukautta tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | ‑ | N = 298 97 % (95–99) 81 (71–94) | |
PorA P1.4 | ennen tehostetta % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | N = 83 19 % (11–29) 1,61 (1,32–1,96) | N = 426 22 % (18–26) 2,14 (1,94–2,36) |
1 kuukausi tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | N = 86 97 % (90–99) 47 (36–62) | N = 424 95 % (93–97) 35 (31–39) | |
12 kuukautta tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | ‑ | N = 300 17 % (13–22) 1,91 (1,7–2,15) | |
NHBA | ennen tehostetta % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | N = 69 25 % (15–36) 2,36 (1,75–3,18) | N = 100 61 % (51–71) 8,4 (6,4–11) |
1 kuukausi tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | N = 67 76 % (64–86) 12 (8,52–17) | N = 100 98 % (93–100) 42 (36–50) | |
12 kuukautta tehosterokotuksen jälkeen % seropositiivisia (95 %:n luottamusväli) hSBA GMT (95 %:n luottamusväli) | ‑ | N = 291 36 % (31–42) 3,35 (2,88–3,9) |
* tehosterokotusta edeltävä ajankohta edustaa bakterisidisten vasta‑aineiden säilymistä 8 kuukautta 2., 3. ja 4. ikäkuukautena annetun Bexsero‑rokotuksen jälkeen ja 6 kuukautta 2., 4. ja 6. ikäkuukautena annetun Bexsero‑rokotuksen jälkeen.
** % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA‑titterin > 1:5.
*** GMT = titterin geometrinen keskiarvo.
Lisätutkimuksessa, johon osallistui vauvoina täydellisen perusrokotus‑ ja tehosteohjelman mukaisesti rokotettuja 4 vuoden ikäisiä lapsia, havaittiin PorA P1.4‑ ja fHbp‑antigeenien vasta‑ainetitterien laskua (9–10 % ja 12–20 % tutkittavista, joiden hSBA‑titteri oli ≥ 1:5). Samassa tutkimuksessa vaste lisäannokseen viittasi immunologiseen muistiin, koska 81–95 % tutkittavista saavutti hSBA‑titterin ≥ 1:5 PorA P1.4 ‑antigeeneille ja 97–100 % fHbp‑antigeeneille lisärokotuksen jälkeen. Tämän havainnon kliinistä merkitystä tai lisätehosteannoksen tarvetta suojaavan immuniteetin säilymiseksi pidempään ei ole varmistettu.
Kahden annoksen perusrokotussarja, jonka jälkeen annettiin tehosteannos
Bexsero-valmisteen immunogeenisuutta kahden annoksen perusrokotussarjan (annokset 3,5 kuukauden ja 5 kuukauden iässä) tai kolmen annoksen perusrokotussarjan (annokset 2,5 kuukauden, 3,5 kuukauden ja 5 kuukauden iässä) ja tämän jälkeen annetun tehosteannoksen jälkeen arvioitiin lisäksi faasin 3 kliinisessä tutkimuksessa, jossa vauvojen rokotukset aloitettiin 2‑5 kuukauden iässä. Seropositiivisten tutkittavien (eli tutkittavien, joiden hSBA-arvo oli vähintään 1:4) prosenttiosuus vaihteli välillä 44–100 % yhden kuukauden kuluttua toisesta annoksesta ja välillä 55‑100 % yhden kuukauden kuluttua kolmannesta annoksesta. Yhden kuukauden kuluttua tehosteannoksesta, joka annettiin 6 kuukautta viimeisen annoksen jälkeen, seropositiivisten tutkittavien prosenttiosuudet vaihtelivat välillä 87–100 % kahden annoksen rokotussarjan jälkeen ja välillä 83–100 % kolmen annoksen rokotussarjan jälkeen.
Vasta-aineiden säilyminen arvioitiin jatkotutkimuksessa 3–4 vuoden ikäisillä lapsilla. Seropositiivisten tutkittavien prosenttiosuudet olivat 2–3 vuoden kuluttua aiemmista rokotuksista samaa luokkaa sekä ryhmässä, jossa annettiin kaksi Bexsero-annosta ja tehosteannos (vaihteluväli 35–91 %), että ryhmässä, jossa annettiin kolme annosta ja tehosteannos (vaihteluväli 36–84 %). Samassa tutkimuksessa 2–3 vuotta tehosteannoksen jälkeen annetun lisäannoksen tuottama vaste viittasi immunologiseen muistiin, sillä 81–100 %:lla ja 70–99 %:lla tutkittavista todettiin vahva vasta-ainevaste kaikkia Bexsero-rokotteen antigeeneja vastaan. Nämä havainnot vastaavat käsitystä, että sekä kahden annoksen perusrokotussarja että kolmen annoksen perusrokotussarja tuottavat riittävän perussuojan, kun ne annetaan imeväisiässä ja niiden jälkeen annetaan Bexsero-tehosteannos.
Immunogeenisuus 6–11 kuukauden ikäisillä vauvoilla ja 12–23 kuukauden ikäisillä lapsilla
Kahden annoksen jälkeinen immunogeenisuus, kun annokset annettiin 6–23 kuukauden ikäisille lapsille kahden kuukauden välein, on dokumentoitu kahdessa tutkimuksessa, joiden tuloksista on esitetty yhteenveto taulukossa 4. Serovasteluvut ja hSBA GMT ‑arvot olivat korkeita jokaista rokoteantigeeniä vastaan ja samankaltaisia kahden annoksen sarjan jälkeen 6–8 kuukauden ikäisillä vauvoilla sekä 13–15 kuukauden ikäisillä lapsilla. Myös tiedot vasta‑aineen säilymisestä yksi vuosi 13 ja 15 kuukauden ikäisille lapsille annettujen kahden annoksen jälkeen on koottu taulukkoon 4.
Taulukko 4. Seerumin bakterisidiset vasta‑ainevasteet, kun Baxsero‑rokotus annettiin 6 ja 8 kuukauden iässä tai 13 ja 15 kuukauden iässä sekä bakterisidisen vasta‑aineen säilyminen yksi vuosi 13 ja 15 kuukauden iässä annettujen kahden annoksen jälkeen
Antigeeni | Ikäryhmä | ||
6–11 kuukautta | 12–23 kuukautta | ||
Rokotusikä | |||
6, 8 kuukautta | 13, 15 kuukautta | ||
fHbp | 1 kuukausi toisen annoksen jälkeen | N = 23 | N = 163 |
% seropositiivisia* (95 %:n luottamusväli) | 100 % (85–100) | 100 % (98–100) | |
hSBA GMT** (95 %:n luottamusväli) | 250 (173–361) | 271 (237–310) | |
12 kuukautta toisen annoksen jälkeen | N = 68 | ||
% seropositiivisia (95 %:n luottamusväli) | ‑ | 74 % (61–83) | |
hSBA GMT (95 %:n luottamusväli) | 14 (9,4–20) | ||
NadA | 1 kuukausi toisen annoksen jälkeen | N = 23 | N = 164 |
% seropositiivisia (95 %:n luottamusväli) | 100 % (85–100) | 100 % (98–100) | |
hSBA GMT (95 %:n luottamusväli) | 534 (395–721) | 599 (520–690) | |
12 kuukautta toisen annoksen jälkeen | N = 68 | ||
% seropositiivisia (95 %:n luottamusväli) | ‑ | 97 % (90–100) | |
hSBA GMT (95 %:n luottamusväli) | 70 (47–104) | ||
PorA P1.4 | 1 kuukausi toisen annoksen jälkeen | N = 22 | N = 164 |
% seropositiivisia (95 %:n luottamusväli) | 95 % (77–100) | 100 % (98–100) | |
hSBA GMT (95 %:n luottamusväli) | 27 (21–36) | 43 (38–49) | |
12 kuukautta toisen annoksen jälkeen | N = 68 | ||
% seropositiivisia (95 %:n luottamusväli) | ‑ | 18 % (9–29) | |
hSBA GMT (95 %:n luottamusväli) | 1,65 (1,2–2,28) | ||
NHBA | 1 kuukausi toisen annoksen jälkeen | N = 46 | |
% seropositiivisia (95 %:n luottamusväli) | ‑ | 63 % (48–77) | |
hSBA GMT (95 %:n luottamusväli) | 11 (7,07–16) | ||
12 kuukautta toisen annoksen jälkeen | N = 65 | ||
% seropositiivisia (95 %:n luottamusväli) | ‑ | 38 % (27–51) | |
hSBA GMT (95 %:n luottamusväli) | 3,7 (2,15–6,35) | ||
* % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA‑titterin ≥ 1:4 (iän vaihteluväli 6–11 kuukautta) ja hSBA‑titterin ≥ 1:5 (iän vaihteluväli 12–23 kuukautta).
** GMT = titterin geometrinen keskiarvo.
Immunogeenisuus 2–10 vuoden ikäisillä lapsilla
Kahden, joko yhden tai kahden kuukauden välein annetun Bexsero-annoksen immunogeenisuutta 2–10 vuoden ikäisillä lapsilla on arvioitu faasin 3 kliinisessä tutkimuksessa sekä sen jatkotutkimuksessa. Ensimmäisessä tutkimuksessa tutkittavat saivat kaksi Bexsero-annosta kahden kuukauden välein. Tulosten yhteenveto esitetään taulukossa 5. Kahden annoksen rokotussarjan jälkeen lapsilla todettiin suuret serologiset vasteprosentit ja hSBA GMT -arvot kutakin rokoteantigeenia vastaan (taulukko 5).
Taulukko 5. Seerumin bakterisidiset vasta-ainevasteet 1 kuukauden kuluttua toisesta Bexsero-annoksesta 2–10-vuotiailla lapsilla, jotka saivat rokoteannokset 0 kuukauden ja 2 kuukauden kohdalla
Antigeeni | 2–5-vuotiaat | 6–10-vuotiaat | |
fHbp | % seropositiivisia* (95 %:n luottamusväli) | N = 99 100 % (96–100) | N = 287 99 % (96–100) |
hSBA GMT** (95 %:n luottamusväli) | 140 (112–175) | 112 (96–130) | |
NadA | % seropositiivisia (95 %:n luottamusväli) | N = 99 99 % (95–100) | N = 291 100 % (98–100) |
hSBA GMT (95 %:n luottamusväli) | 584 (466–733) | 457 (392–531) | |
PorA P1.4 | % seropositiivisia (95 %:n luottamusväli) | N = 100 98 % (93–100) | N = 289 99 % (98–100) |
hSBA GMT (95 %:n luottamusväli) | 42 (33–55) | 40 (34–48) | |
NHBA | % seropositiivisia (95 %:n luottamusväli) | N = 95 91 % (83–96) | N = 275 95 % (92–97) |
hSBA GMT (95 %:n luottamusväli) | 23 (18–30) | 35 (29–41) |
* % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA-titterin ≥ 1:4 (fHbp-, NadA-, PorA P1.4 -antigeenien viitekantoja vastaan) ja hSBA-titterin ≥ 1:5 (NHBA-antigeenin viitekantaa vastaan).
** GMT = titterin geometrinen keskiarvo.
Jatkotutkimuksessa, jossa rokottamattomille lapsille annettiin kaksi Bexsero-annosta yhden kuukauden välein, suuri prosenttiosuus tutkittavista oli seropositiivisia yhden kuukauden jälkeen toisesta annoksesta. Myös ensimmäisen annoksen tuottamaa varhaista immuunivastetta arvioitiin. Eri kantojen suhteen seropositiivisten tutkittavien (eli tutkittavien, joiden hSBA-arvo oli vähintään 1:4) prosenttiosuus vaihteli välillä 46–95 % yhden kuukauden kuluttua ensimmäisestä annoksesta ja välillä 69–100 % yhden kuukauden kuluttua toisesta annoksesta (taulukko 6).
Taulukko 6. Seerumin bakterisidiset vasta-ainevasteet 1 kuukauden kuluttua toisesta Bexsero-annoksesta 2–10-vuotiailla lapsilla, jotka saivat rokoteannokset 0 kuukauden ja 1 kuukauden kohdalla
Antigeeni | 35–47 kuukauden ikäiset | 4–7-vuotiaat | 8–10-vuotiaat | |
fHbp | % seropositiivisia* (95 %:n luottamusväli) | N = 98 100 % (96,3–100) | N = 54 98 % (90,1–99,95) | N = 34 100 % (89,7–100) |
hSBA GMT** (95 %:n luottamusväli) | 107 (84–135) | 76,62 (54–108) | 52,32 (34–81) | |
NadA | % seropositiivisia (95 %:n luottamusväli) | N = 98 100 % (96,3–100) | N = 54 100 % (93,4–100) | N = 34 100 % (89,7–100) |
hSBA GMT (95 %:n luottamusväli) | 631 (503–792) | 370,41 (264–519) | 350,49 (228–540) | |
PorA P1.4 | % seropositiivisia (95 %:n luottamusväli) | N = 98 100 % (96,3–100) | N = 54 100 % (93,4–100) | N = 33 100 % (89,4–100) |
hSBA GMT (95 %:n luottamusväli) | 34 (27–42) | 30,99 (28–49) | 30,75 (20–47) | |
NHBA | % seropositiivisia (95 %:n luottamusväli) | N = 91 75 % (64,5–83,3) | N = 52 69 % (54,9–81,3) | N = 34 76 % (58,8–89,3) |
hSBA GMT (95 %:n luottamusväli) | 12 (7,57–18) | 9,33 (5,71–15) | 12,35 (6,61–23) |
* % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA-titterin ≥ 1:4 (fHbp-, NadA-, PorA P1.4 -antigeenien viitekantoja vastaan) ja hSBA-titterin ≥ 1:5 (NHBA-antigeenin viitekantaa vastaan).
** GMT = titterin geometrinen keskiarvo.
Jatkotutkimuksessa arvioitiin myös vasta-aineen pysyvyyttä ja vastetta tehosteannokselle lapsilla, jotka saivat kahden annoksen perusrokotussarjan 2–5 tai 6–10 vuoden iässä. 24–36 kuukauden jälkeen seropositiivisten tutkittavien (eli hSBA vähintään 1:4) prosenttiosuudet laskivat, vaihdellen kantojen välillä 21–74 % 4–7-vuotiailla lapsilla ja 47–86 % 8–12-vuotiailla lapsilla. 24–36 kuukautta perusrokotussarjan jälkeen annetulla tehosteannoksella saatu vaste viittasi immunologiseen muistiin, koska seropositiivisten tutkittavien prosenttiosuudet vaihtelivat kantojen välillä 93–100 % 4–7-vuotiailla ja 96–100 % 8–12-vuotiailla lapsilla.
Immunogeenisuus nuorilla (≥ 11‑vuotiaat) ja aikuisilla
Nuoret saivat kaksi Bexsero‑annosta yhden, kahden tai kuuden kuukauden välein. Näistä tiedoista on esitetty yhteenveto taulukoissa 7 ja 8.
Aikuisilla tehdyissä tutkimuksissa tietoja kerättiin kahden Bexsero‑annoksen jälkeen, kun annosväli oli yksi tai kaksi kuukautta (ks. taulukko 9).
Yhden tai kahden kuukauden välein annettujen kahden annoksen rokotusohjelman yhteydessä havaittiin samankaltaisia immuunivasteita sekä aikuisilla että nuorilla. Samankaltaisia vasteita havaittiin myös nuorilla, joille annettiin kaksi Bexsero‑annosta kuuden kuukauden välein.
Taulukko 7. Seerumin bakterisidiset vasta‑ainevasteet nuorilla yksi kuukausi kahden Bexsero‑annoksen jälkeen, kun annokset annettiin kahden erilaisen antoaikataulun mukaan, sekä bakterisidisten vasta‑aineiden säilyminen 18–23 kuukautta toisen annoksen jälkeen
Antigeeni | 0, 1 kuukautta | 0, 2 kuukautta | 0, 6 kuukautta | |
fHbp | 1 kuukausi toisen annoksen jälkeen | N = 638 | N = 319 | N = 86 |
% seropositiivisia* (95 %:n luottamusväli) | 100 % (99−100) | 100 % (99−100) | 100 % (99−100) | |
hSBA GMT** (95 %:n luottamusväli) | 210 (193–229) | 234 (209–263) | 218 (157–302) | |
18–23 kuukautta toisen annoksen jälkeen | N = 102 | N = 106 | N = 49 | |
% seropositiivisia (95 %:n luottamusväli) | 82 % (74–89) | 81 % (72–88) | 84 % (70–93) | |
hSBA GMT (95 %:n luottamusväli) | 29 (20–42) | 34 (24–49) | 27 (16–45) | |
NadA | 1 kuukausi toisen annoksen jälkeen | N = 639 | N = 320 | N = 86 |
% seropositiivisia (95 %:n luottamusväli) | 100 % (99−100) | 99 % (98−100) | 99 % (94−100) | |
hSBA GMT (95 %:n luottamusväli) | 490 (455–528) | 734 (653–825) | 880 (675–1147) | |
18–23 kuukautta toisen annoksen jälkeen | N = 102 | N = 106 | N = 49 | |
% seropositiivisia (95 %:n luottamusväli) | 93 % (86–97) | 95 % (89–98) | 94 % (83–99) | |
hSBA GMT (95 %:n luottamusväli) | 40 (30–54) | 43 (33–58) | 65 (43–98) | |
PorA P1.4 | 1 kuukausi toisen annoksen jälkeen | N = 639 | N = 319 | N = 86 |
% seropositiivisia (95 %:n luottamusväli) | 100 % (99−100) | 100 % (99−100) | 100 % (96−100) | |
hSBA GMT (95 %:n luottamusväli) | 92 (84–102) | 123 (107–142) | 140 (101–195) | |
18–23 kuukautta toisen annoksen jälkeen | N = 102 | N = 106 | N = 49 | |
% seropositiivisia (95 %:n luottamusväli) | 75 % (65–83) | 75 % (66–83) | 86 % (73–94) | |
hSBA GMT (95 %:n luottamusväli) | 17 (12–24) | 19 (14–27) | 27 (17–43) | |
NHBA | 1 kuukausi toisen annoksen jälkeen | N = 46 | N = 46 | ‑ |
% seropositiivisia (95 %:n luottamusväli) | 100 % (92−100) | 100 % (92−100) | ‑ | |
hSBA GMT (95 %:n luottamusväli) | 99 (76–129) | 107 (82–140) | ‑ |
* % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA‑titterin ≥ 1:4.
** GMT = titterin geometrinen keskiarvo.
Nuorilla tehdyssä tutkimuksessa bakterisidiset vasteet kahden Bexsero‑annoksen jälkeen ryhmiteltiin lähtötilanteen hSBA‑titterin < 1:4 tai ≥ 1:4 mukaan. Yhteenveto serovasteluvuista ja niiden tutkittavien prosenttiosuudesta, joiden hSBA‑titteri suureni vähintään nelinkertaiseksi verrattuna lähtötilanteeseen yksi kuukausi toisen Bexsero‑annoksen jälkeen, on esitetty taulukossa 8. Bexsero‑rokotuksen jälkeen suuri prosenttiosuus tutkittavista oli seropositiivisia ja saavutti hSBA‑titterin suurenemisen nelinkertaiseksi rokotusta edeltäneestä tilanteesta riippumatta.
Taulukko 8. Niiden nuorten prosenttiosuus, joilla oli serovaste ja bakterisidinen titteri suureni vähintään nelinkertaiseksi yksi kuukausi kahden Bexsero‑annoksen jälkeen, kun rokotteet annettiin erilaisten kahden annoksen rokotusohjelmien mukaisesti – ositettuna rokotusta edeltäneiden tittereiden mukaisesti.
Antigeeni | 0, 1 kuukautta | 0, 2 kuukautta | 0, 6 kuukautta | ||
fHbp | % seropositiivisia* toisen annoksen jälkeen (95 %:n luottamusväli) | Rokotusta edeltävä titteri < 1:4 | N = 369 100 % (98−100) | N = 179 100 % (98−100) | N = 55 100 % (94−100) |
rokotusta edeltävä titteri ≥ 1:4 | N = 269 100 % (99−100) | N = 140 100 % (97−100) | N = 31 100 % (89−100) | ||
niiden tutkittavien osuus (%), joiden titteri nelinkertaistui toisen annoksen jälkeen (95 %:n luottamusväli) | rokotusta edeltävä titteri < 1:4 | N = 369 100 % (98−100) | N = 179 100 % (98−100) | N = 55 100 % (94−100) | |
rokotusta edeltävä titteri ≥ 1:4 | N = 268 90 % (86−93) | N = 140 86 % (80−92) | N = 31 90 % (74−98) | ||
NadA | % seropositiivisia toisen annoksen jälkeen (95 %:n luottamusväli) | rokotusta edeltävä titteri < 1:4 | N = 427 100 % (99−100) | N = 211 99 % (97−100) | N = 64 98 % (92−100) |
rokotusta edeltävä titteri ≥ 1:4 | N = 212 100 % (98−100) | N = 109 100 % (97−100) | N = 22 100 % (85−100) | ||
niiden tutkittavien osuus (%), joiden titteri nelinkertaistui toisen annoksen jälkeen (95 %:n luottamusväli) | rokotusta edeltävä titteri < 1:4 | N = 426 99 % (98−100) | N = 211 99 % (97−100) | N = 64 98 % (92−100) | |
rokotusta edeltävä titteri ≥ 1:4 | N = 212 96 % (93−98) | N = 109 95 % (90−98) | N = 22 95 % (77−100) | ||
PorA P1.4 | % seropositiivisia toisen annoksen jälkeen (95 %:n luottamusväli) | rokotusta edeltävä titteri < 1:4 | N = 427 100 % (98−100) | N = 208 100 % (98−100) | N = 64 100 % (94−100) |
rokotusta edeltävä titteri ≥ 1:4 | N = 212 100 % (98−100) | N = 111 100 % (97−100) | N = 22 100 % (85−100) | ||
niiden tutkittavien osuus (%), joiden titteri nelinkertaistui toisen annoksen jälkeen (95 %:n luottamusväli) | rokotusta edeltävä titteri < 1:4 | N = 426 99 % (98−100) | N = 208 100 % (98−100) | N = 64 100 % (94−100) | |
rokotusta edeltävä titteri ≥ 1:4 | N = 211 81 % (75−86) | N = 111 77 % (68−84) | N = 22 82 % (60−95) | ||
NHBA | % seropositiivisia toisen annoksen jälkeen (95 %:n luottamusväli) | rokotusta edeltävä titteri < 1:4 | N = 2 100 % (16−100) | N = 9 100 % (66−100) | ‑ |
rokotusta edeltävä titteri ≥ 1:4 | N = 44 100 % (92−100) | N = 37 100 % (91−100) | ‑ | ||
niiden tutkittavien osuus (%), joiden titteri nelinkertaistui toisen annoksen jälkeen (95 %:n luottamusväli) | rokotusta edeltävä titteri < 1:4 | N = 2 100 % (16−100) | N = 9 89 % (52−100) | ‑ | |
rokotusta edeltävä titteri ≥ 1:4 | N = 44 30 % (17−45) | N = 37 19 % (8−35) | ‑ |
* % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA‑titterin ≥ 1:4.
Tiedot vasta-aineen pysyvyydestä nuorilla saatiin faasin 3 tutkimuksen jatkotutkimuksesta. Noin 7,5
vuotta kahden annoksen perusrokotussarjan jälkeen niiden tutkittavien, joilla hSBA:n ≥ 1:4,
prosenttiosuus laski, vaihdellen kantojen välillä 29–84 %. 7,5 vuotta perusrokotussarjan jälkeen
annostellulla tehosteannoksella saatu vaste viittasi immunologiseen muistiin, sillä niiden tutkittavien
prosenttiosuus, joilla hSBA ≥ 1:4, vaihteli kantojen välillä 93–100 %.
Samassa jatkotutkimuksessa arvioitiin vasta-aineen pysyvyyttä myös toiseen faasin 3 tutkimukseen
osallistuneilla nuorilla. Noin neljän vuoden kuluttua kahden annoksen perusrokotussarjasta, niiden
tutkittavien prosenttiosuus, joilla hSBA ≥ 1:5, yleisesti laski toisen annoksen jälkeisestä kantojen
välillä vaihdelleesta 68–100 %:sta tasolle 9–84 %. 4 vuotta perusrokotussarjan jälkeen annostellulla
tehosteannoksella saatu vaste viittasi immunologiseen muistiin, sillä niiden tutkittavien prosenttiosuus,
joilla hSBA ≥ 1:5, vaihteli kantojen välillä 92–100 %.
Taulukko 9. Aikuisten seerumin bakterisidiset vasta‑ainevasteet kahden Bexsero‑annoksen jälkeen, kun annokset annettiin kahden erilaisen antoaikataulun mukaan
Antigeeni | 0, 1 kuukautta | 0, 2 kuukautta | |
fHbp | 1 kuukausi toisen annoksen jälkeen | N = 28 | N = 46 |
% seropositiivisia* (95 %:n luottamusväli) | 100 % (88–100) | 100 % (92–100) | |
hSBA GMT** (95 %:n luottamusväli) | 100 (75–133) | 93 (71–121) | |
NadA | 1 kuukausi toisen annoksen jälkeen | N = 28 | N = 46 |
% seropositiivisia (95 %:n luottamusväli) | 100 % (88–100) | 100 % (92–100) | |
hSBA GMT (95 %:n luottamusväli) | 566 (338–948) | 144 (108–193) | |
PorA P1.4 | 1 kuukausi toisen annoksen jälkeen | N = 28 | N = 46 |
% seropositiivisia (95 %:n luottamusväli) | 96 % (82–100) | 91 % (79–98) | |
hSBA GMT (95 %:n luottamusväli) | 47 (30–75) | 32 (21–48) |
* % seropositiivisia = niiden tutkittavien prosenttiosuus, jotka saavuttivat hSBA‑titterin ≥ 1:4.
** GMT = titterin geometrinen keskiarvo.
Seerumin bakterisidista vastetta NHBA‑antigeeneille ei ole arvioitu.
Immunogeenisuus erityispotilailla
Lapset ja nuoret, joilla on komplementtipuutos, asplenia tai muu pernan toimintahäiriö
Faasin 3 kliinisessä tutkimuksessa tutkittaville annosteltiin kaksi annosta Bexseroa kahden kuukauden välein. Tutkittavat olivat 2–17-vuotiaita komplementtipuutosta (40), aspleniaa tai muuta pernan toimintahäiriötä (107) sairastavia lapsia ja nuoria sekä iän suhteen vakioituja terveitä verrokkeja (85).
Kuukauden kuluttua kahden annoksen rokotesarjan jälkeen, komplementtipuutosta sairastavilla potilailla ja potilailla, joilla oli asplenia tai pernan toimintahäiriö prosenttiosuus tutkittavista, joilla hSBA ≥ 1:5 oli vastaavasti 87 % ja 97 % fHbp antigeenille, 95 % ja 100 % NadA antigeenille, 68 % ja 86 % PorA PI.4 antigeenille ja 73 % ja 94 % NHBA antigeenille. Tulokset osoittivat immuunivasteen muodostumisen immuunipuutteisilla henkilöillä. Terveillä tutkittavilla prosenttiosuus tutkittavista, joilla hSBA ≥ 1:5 oli 98 % fHbp antigeenille, 99 % NadA antigeenille, 83 % PorA PI.4. antigeenille ja 99 % NHBA antigeenille.
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Toistuvan altistuksen aiheuttamaa toksisuutta sekä lisääntymis‑ ja kehitystoksisuutta koskevien tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Natriumkloridi
Histidiini
Sakkaroosi
Injektionesteisiin käytettävä vesi
Katso adsorbentin tiedot kohdasta Vaikuttavat aineet ja niiden määrät.
Yhteensopimattomuudet
Koska yhteensopimattomuustutkimuksia ei ole tehty, lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
4 vuotta
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
BEXSERO injektioneste, suspensio, esitäytetty ruisku
0,5 ml (neula) (129,30 €)
PF-selosteen tieto
0,5 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa männän tulppa (butyylikumia) ja kuminen kärkikorkki.
Esitäytetyn ruiskun kärkikorkki ja kuminen männän tulppa ovat valmistettu synteettisestä kumista.
Pakkauskoot 1 ja 10 ruiskua, neuloilla tai ilman.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen opalisoiva nestemäinen suspensio.
Käyttö- ja käsittelyohjeet
Suspension sisältävään esitäytettyyn ruiskuun on havaittu muodostuneen säilytyksen aikana hienojakoista luonnonvalkoista sakkaa.
Ravista esitäytettyä ruiskua hyvin ennen käyttöä, jotta muodostuu homogeeninen suspensio.
Rokote on tarkastettava silmämääräisesti hiukkasten ja värimuutosten havaitsemiseksi ennen antoa. Jos vierashiukkasia ja/tai fysikaalisia muutoksia havaitaan, rokotetta ei saa antaa. Jos pakkauksessa toimitetaan kaksi eripituista neulaa, niistä on valittava asianmukainen neula, jolla varmistetaan rokotteen anto lihakseen.
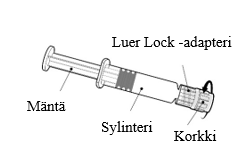
Esitäytetyn ruiskun käyttöohje
| Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
| Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun.
Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
BEXSERO injektioneste, suspensio, esitäytetty ruisku
0,5 ml
- Ei korvausta.
ATC-koodi
J07AH09
Valmisteyhteenvedon muuttamispäivämäärä
09.05.2024
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi