VAXIGRIPTETRA injektioneste, suspensio, esitäytetty ruisku 15 mikrog HA/0,5 ml
Vaikuttavat aineet ja niiden määrät
Influenssavirus, (inaktivoitu, fragmentoitu) seuraavista kannoista*:
Kannan A/Victoria/4897/2022 (H1N1)pdm09 kaltainen virus (A/Victoria/4897/2022 , IVR-238) 15 mikrogrammaa HA**
Kannan A/Croatia/10136RV/2023 (H3N2) kaltainen virus (A/Croatia/10136RV/2023, X-425A) 15 mikrogrammaa HA**
Kannan B/Austria/1359417/2021 kaltainen virus (B/Michigan/01/2021, villityyppi) 15 mikrogrammaa HA**
Kannan B/Phuket/3073/2013 kaltainen virus (B/Phuket/3073/2013, villityyppi) 15 mikrogrammaa HA**
0,5 ml:n annoksessa
* kasvatettu terveiden kanojen hedelmöitetyissä kananmunissa
** hemagglutiniini
Rokote on WHO:n suositusten (pohjoinen pallonpuolisko) ja EU:n päätöksen mukainen kaudelle 2025-2026.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
VaxigripTetra saattaa sisältää häviävän pieniä määriä kananmunaa, esim. ovalbumiinia, sekä neomysiiniä, formaldehydiä ja oktoksinoli-9:ä, joita on käytetty valmistusprosessissa (ks. kohta Vasta-aiheet).
Lääkemuoto
Injektioneste, suspensio, esitäytetty ruisku.
Kliiniset tiedot
Käyttöaiheet
VaxigripTetra on tarkoitettu influenssataudin ennaltaehkäisemiseksi, minkä aiheuttajina ovat rokotteen sisältämät kaksi influenssa A ‑viruksen alatyyppiä ja kaksi influenssa B ‑virustyyppiä:
- aikuisten, mukaan lukien raskaana olevat naiset, ja vähintään 6 kuukauden ikäisten lasten aktiiviseen immunisaatioon
- vastasyntyneiden ja alle 6 kuukauden ikäisten lasten passiiviseen suojaamiseen raskaana olevien naisten rokottamisella (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Raskaus ja imetys ja Farmakodynamiikka).
VaxigripTetra-rokotteen käytön pitää perustua mahdollisiin virallisiin suosituksiin.
Annostus ja antotapa
Annostus
Kolmivalenttista rokotetta koskevan kliinisen kokemuksen perusteella vuosittainen influenssarokotteen uudelleen ottaminen on suositeltavaa, huomioiden rokotteen tarjoaman immuniteetin kesto ja se, että influenssaviruksen kiertävät kannat saattavat muuttua vuodesta toiseen.
Aikuiset: yksi 0,5 ml:n annos.
Pediatriset potilaat
- 6 kuukauden ikäiset – 17-vuotiaat lapset: yksi 0,5 ml:n annos.
Alle 9-vuotiaille lapsille, joita ei ole rokotettu aiemmin, on annettava toinen 0,5 ml:n annos aikaisintaan neljän viikon kuluttua ensimmäisestä annoksesta. - Alle 6 kuukauden ikäiset lapset: VaxigripTetra-rokotuksen (aktiivisen immunisaation) turvallisuutta ja tehoa ei ole varmistettu. Tietoja ei ole saatavilla.
Raskaana oleville naisille annettu yksi 0,5 ml annos voi antaa passiivisen suojan vastasyntyneille ja alle 6 kuukauden ikäisille lapsille, mutta kaikki nämä lapset eivät kuitenkaan saa suojaa (ks. kohta Farmakodynamiikka).
Antotapa
Rokote annetaan injektiona lihakseen tai ihon alle.
Suositeltavat lihakseen annettavan injektion pistoskohdat ovat reiden ulkosyrjän etuosa (tai hartialihas, jos lihasmassa on riittävä) 6–35 kuukauden ikäisille lapsille, tai hartialihas vähintään 36 kuukauden ikäisille lapsille ja aikuisille.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille, kohdassa Apuaineet mainituille valmisteen apuaineille tai jollekin aineelle, josta rokotteessa saattaa olla jäämiä, kuten kananmuna (ovalbumiini, kanan proteiinit), neomysiini, formaldehydi ja oktoksinoli-9.
Rokotusta pitää lykätä potilailla, joilla on lievä tai vakava kuumesairaus tai akuutti sairaus.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Kuten aina injektoitavia rokotteita annettaessa, pitää asianmukaisen hoidon ja valvonnan olla helposti saatavilla rokotuksen jälkeen mahdollisesti esiintyvän anafylaktisen tapahtuman varalta.
VaxigripTetra-rokotetta ei saa missään tapauksessa antaa suoneen.
Kuten muita lihakseen injektoitavia rokotteita annettaessa, varovaisuutta on noudatettava rokotettaessa trombosytopeniaa tai verenvuotohäiriötä sairastavia henkilöitä, koska näillä henkilöillä saattaa esiintyä verenvuotoa lihasinjektioiden jälkeen.
Pyörtymistä voi ilmetä rokottamisen aikana tai jopa sitä ennen psyykkisperäisenä reaktiona neulainjektioon. Pyörtymisestä johtuvat vammat on estettävä ja tajunnan menetykseen liittyviin reaktioihin on varauduttava varotoimenpiteillä.
VaxigripTetra on tarkoitettu antamaan suoja niitä influenssaviruksen kantoja vastaan, joista rokote on valmistettu.
Kaikkien muiden rokotteiden tavoin VaxigripTetra ei välttämättä suojaa kaikkia rokotettuja.
Kaikki alle 6 kuukauden ikäiset lapset, joiden äidit ovat saaneet rokotuksen raskauden aikana, eivät saa passiivista suojaa (ks. kohta Farmakodynamiikka).
Vasta-ainetuotanto saattaa olla riittämätön henkilöillä, joilla on sisäsyntyinen tai hoidosta johtuva heikentynyt immuunivaste.
Vaikutus serologisiin kokeisiin
Ks. kohta Yhteisvaikutukset.
VaxigripTetra sisältää kaliumia ja natriumia
Tämä lääkevalmiste sisältää kaliumia alle 1 mmol (39 mg) ja natriumia alle 1 mmol (23 mg) per annos, eli sen voidaan sanoa olevan ”kaliumiton” ja ”natriumiton”.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty VaxigripTetra-rokotteella.
VaxigripTetra voidaan antaa samanaikaisesti muiden rokotteiden kanssa Vaxigrip-rokotteen kliinisen käyttökokemuksen perusteella. Eri injektiokohtia ja erillisiä ruiskuja on käytettävä annettaessa samanaikaisesti useita rokotteita.
Immuunivaste saattaa heikentyä, jos potilas saa immunosuppressiivista lääkitystä.
Influenssarokotuksen jälkeen on esiintynyt vääriä positiivisia tuloksia serologisissa testeissä, joissa on käytetty ELISA-menetelmää HIV1-, hepatiitti C- ja varsinkin HTLV1-vasta-aineiden määrittämiseksi. Nämä väärät ELISA-menetelmällä saadut positiiviset testitulokset voidaan tarkistaa Western Blot ‑menetelmällä. Tilapäiset väärät positiiviset reaktiot saattavat johtua IgM-vasteesta rokotteelle.
Raskaus ja imetys
Raskaus
Raskaana olevilla naisilla on suuri riski influenssan komplikaatioille mukaan lukien ennenaikainen synnytyksen käynnistyminen, ennenaikainen synnytys, sairaalahoitoon joutuminen ja kuolema. Raskaana olevien naisten tulee saada influenssarokote.
VaxigripTetra-rokotetta voidaan käyttää raskauden kaikissa vaiheissa. Raskauden toiselle ja kolmannelle kolmannekselle on olemassa laajemmat turvallisuustiedot inaktivoiduista influenssarokotteista kuin ensimmäiselle kolmannekselle. Maailmanlaajuiset tiedot inaktivoitujen influenssarokotteiden, VaxigripTetra ja Vaxigrip (kolmivalenttinen inaktivoitu influenssarokote) mukaan lukien, käytöstä eivät kuitenkaan viittaa mihinkään rokotteen aiheuttamiin haittatapahtumiin sikiöllä tai äidillä. Tämä vastaa tuloksia, jotka saatiin yhdessä kliinisessä tutkimuksessa, jossa VaxigripTetra- ja Vaxigrip rokotteet annettiin raskaana oleville naisille toisen tai kolmannen raskauskolmanneksen aikana (VaxigripTetra: 230 raskaudenaikaista altistusta ja 231 elävänä syntynyttä lasta, Vaxigrip: 116 raskaudenaikaista altistusta ja 119 elävänä syntynyttä lasta).
Tiedot neljästä kliinisestä tutkimuksesta kolmivalenttisella inaktivoidulla influenssarokotteella (Vaxigrip-valmisteella, joka ei sisällä tiomersaalia), joka annettiin raskaana oleville naisille toisen tai kolmannen raskauskolmanneksen aikana (yli 5 000 raskaudenaikaisen altistusta ja yli 5 000 elävänä syntynyttä lasta, joita seurattiin noin 6 kuukautta syntymän jälkeen), eivät viittaa mihinkään rokotteen aiheuttamiin haittatapahtumiin sikiöllä, vastasyntyneellä, imeväisellä tai äidillä.
Etelä-Afrikassa ja Nepalissa tehdyissä kliinisissä tutkimuksissa ei todettu Vaxigrip- ja lumeryhmien välillä merkittäviä eroja sikiöitä, vastasyntyneitä, imeväisiä tai äitejä koskevissa päätetapahtumissa (kuten keskenmenot, kuolleena syntyneet lapset, ennenaikaiset synnytykset tai alhainen syntymäpaino).
Malissa tehdyssä tutkimuksessa ei todettu Vaxigrip-rokotteen tai vertailurokotteen (tetravalentin meningokokkikonjugaattirokotteen) saaneiden välillä merkittäviä eroja ennenaikaisten synnytysten osuudessa, kuolleina syntyneiden osuudessa tai pienessä syntymäpainossa / raskauden kestoon nähden pienipainoisten osuudessa.
Lisätietoa kohdissa Haittavaikutukset ja Farmakodynamiikka.
Yhdessä VaxigripTetra-rokotteen eläinkokeessa ei havaittu suoria tai epäsuoria haitallisia vaikutuksia raskauteen, alkion/sikiön kehitykseen tai varhaiseen postnataaliseen kehitykseen.
Imetys
VaxigripTetra-rokotetta voidaan käyttää imetyksen aikana.
Hedelmällisyys
Ihmisiä koskevia hedelmällisyystietoja ei ole saatavilla. Yhdessä VaxigripTetra-rokotteen eläinkokeessa ei havaittu haitallisia vaikutuksia naisten hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
VaxigripTetra-rokotteella ei ole vaikutusta ajokykyyn ja koneiden käyttökykyyn, tai vaikutus on merkityksettömän vähäinen.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
VaxigripTetra-rokotteen turvallisuutta arvioitiin kuudessa kliinisessä tutkimuksessa, joissa 3 040 18–60-vuotiasta aikuista, 1 392 yli 60-vuotiasta iäkästä henkilöä ja 429 9–17-vuotiasta lasta sai vähintään yhden annoksen VaxigripTetra-rokotetta, 884 3–8-vuotiasta lasta sai yhden tai kaksi annosta VaxigripTetra-rokotetta riippuen siitä, olivatko he saaneet aiemmin influenssarokotuksia, ja 1 614 6–35 kuukauden ikäistä lasta sai kaksi annosta (0,5 ml) VaxigripTetra-rokotetta.
Useimmat reaktiot ilmenivät yleensä ensimmäisten kolmen vuorokauden sisällä rokotuksen jälkeen ja hävisivät spontaanisti 1–3 vuorokauden sisällä niiden alkamisesta. Nämä reaktiot olivat voimakkuudeltaan lieviä.
Yleisimmin ilmoitettu haittavaikutus rokotuksen jälkeen oli kaikissa potilasryhmissä, 6–35 kuukauden ikäisten lasten koko ryhmä mukaan lukien, kipu injektiokohdassa (52,8 % – 56,5 % 3–17 -vuotiailla lapsilla ja aikuisilla, 26,8 % 6–35 kuukauden ikäisillä lapsilla ja 25,8 % iäkkäillä). Alle 24 kuukauden ikäisten lasten alaryhmässä ärtyneisyys (32,3 %) oli yleisimmin ilmoitettu haittavaikutus.
24–35 kuukauden ikäisten lasten alaryhmässä huonovointisuus (26,8 %) oli yleisimmin ilmoitettu haittavaikutus.
Muita yleisimmin ilmoitettuja haittavaikutuksia rokotuksen jälkeen olivat:
- aikuisilla: päänsärky (27,8 %), lihaskipu (23 %) ja huonovointisuus (19,2 %)
- iäkkäillä henkilöillä: päänsärky (15,6 %) ja lihaskipu (13,9 %)
- 9–17-vuotiailla lapsilla: lihaskipu (29,1 %), päänsärky (24,7 %), huonovointisuus (20,3 %) ja turvotus injektiokohdassa (10,7 %)
- 3–8-vuotiailla lapsilla: huonovointisuus (30,7 %), lihaskipu (28,5 %), päänsärky (25,7 %), turvotus injektiokohdassa (20,5 %), injektiokohdan punoitus (20,4 %), kovettuma injektiokohdassa (16,4 %) ja vilunväristykset (11,2 %)
- 6–35 kuukauden ikäisillä lapsilla: kuume (20,4 %) ja injektiokohdan punoitus (17,2 %),
- alle 24 kuukauden ikäisillä lapsilla: ruokahaluttomuus (28,9 %), epätavallinen itku (27,1 %), oksentelu (16,1 %) ja uneliaisuus (13,9 %)
- 24–35 kuukauden ikäisillä lapsilla: päänsärky (11,9 %) ja lihaskipu (11,6 %).
Haittavaikutuksia esiintyi yleisesti ottaen vähemmän iäkkäillä kuin aikuisilla ja lapsilla.
Haittavaikutusten taulukoitu yhteenveto
Alla olevat tiedot ovat yhteenveto kliinisissä tutkimuksissa ja maailmanlaajuisessa markkinoilletulon jälkeisessä seurannassa kirjattujen haittavaikutusten ilmenemistiheydestä VaxigripTetra-rokotuksen jälkeen.
Haittavaikutukset on luokiteltu seuraavien esiintymistiheyksien mukaan:
Hyvin yleinen (≥1/10);
Yleinen (≥1/100, <1/10);
Melko harvinainen (≥1/1 000, <1/100);
Harvinainen (≥1/10 000, <1/1 000);
Hyvin harvinainen (<1/10 000);
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin): raportoidut haittavaikutukset perustuvat spontaaneihin ilmoituksiin VaxigripTetra-rokotteen markkinoilletulon jälkeen. Koska nämä reaktiot on ilmoitettu vapaaehtoisesti potilasryhmissä, joiden koosta ei ole varmaa tietoa, reaktioiden esiintymistiheyttä ei ole mahdollista arvioida luotettavasti.
Haittavaikutukset on esitetty kussakin yleisyysluokassa vakavuuden mukaan alenevassa järjestyksessä.
Aikuiset ja iäkkäät henkilöt
Alla esitetty turvallisuusprofiili perustuu:
- 3 040 18–60-vuotiaasta aikuisesta ja 1 392 yli 60‑vuotiaasta iäkkäästä henkilöstä kerättyihin tietoihin
- maailmanlaajuisesta markkinoilletulon jälkeisestä seurannasta saatuihin tietoihin (*).
| HAITTAVAIKUTUKSET | ESIINTYMISTIHEYS |
| Veri ja imukudos | |
| Lymfadenopatia (1) | Melko harvinainen |
| Immuunijärjestelmä | |
| Yliherkkyys (1), allergiset reaktiot kuten angioedeema (1), allerginen dermatiitti (1), yleistynyt kutina (1), urtikaria (1), kutina (2), punoitus | Harvinainen |
| Anafylaktiset reaktiot | Tuntematon* |
| Hermosto | |
| Päänsärky | Hyvin yleinen |
| Heitehuimaus (3) | Melko harvinainen |
| Parestesia, uneliaisuus | Harvinainen |
| Verisuonisto | |
| Kuumat aallot (4) | Melko harvinainen |
| Hengityselimet, rintakehä ja välikarsina | |
| Hengenahdistus (1) | Harvinainen |
| Ruoansulatuselimistö | |
| Ripuli, pahoinvointi (5) | Melko harvinainen |
| Iho ja ihonalainen kudos | |
| Voimakas hikoilu | Harvinainen |
| Luusto, lihakset ja sidekudos | |
| Lihaskipu | Hyvin yleinen |
| Nivelkipu (1) | Harvinainen |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Huonovointisuus (6) Kipu injektiokohdassa | Hyvin yleinen |
| Vilunväristykset, kuume (2) Injektiokohdan punoitus, turvotus injektiokohdassa, kovettuma injektiokohdassa | Yleinen |
| Väsymys Mustelma injektiokohdassa, injektiokohdan kutina, injektiokohdan lämpö | Melko harvinainen |
| Astenia, flunssan kaltainen sairaus Epämukava tunne injektiokohdassa (1) | Harvinainen |
(1) Aikuisilla (2) Melko harvinainen iäkkäillä henkilöillä (3) Harvinainen aikuisilla (4) Iäkkäillä henkilöillä (5) Harvinainen iäkkäillä henkilöillä (6) Yleinen iäkkäillä henkilöillä
Pediatriset potilaat
Alla esitetty turvallisuusprofiili perustuu:
- tietoihin 429 9–17-vuotiaasta lapsesta, jotka saivat yhden annoksen VaxigripTetra-rokotetta ja 884 3–8-vuotiaasta lapsesta, jotka saivat yhden tai kaksi annosta VaxigripTetra-rokotetta riippuen siitä, olivatko he saaneet aiemmin influenssarokotuksia
- maailmanlaajuisesta markkinoilletulon jälkeisestä seurannasta saatuihin tietoihin (*).
| HAITTAVAIKUTUKSET | ESIINTYMISTIHEYS |
| Veri ja imukudos | |
| Trombosytopenia (1) | Melko harvinainen |
| Immuunijärjestelmä | |
| Allergiset reaktiot, mukaan lukien anafylaktiset reaktiot | Tuntematon* |
| Psyykkiset häiriöt | |
| Vaikertaminen (2), levottomuus (2) | Melko harvinainen |
| Hermosto | |
| Päänsärky | Hyvin yleinen |
| Heitehuimaus (2) | Melko harvinainen |
| Ruoansulatuselimistö | |
| Ripuli, oksentelu (2), ylävatsan kipu (2) | Melko harvinainen |
| Luusto, lihakset ja sidekudos | |
| Lihaskipu | Hyvin yleinen |
| Nivelkipu (2) | Melko harvinainen |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Huonovointisuus, vilunväristykset (3) Kipu injektiokohdassa, turvotus injektiokohdassa, injektiokohdan punoitus (3), kovettuma injektiokohdassa (3) | Hyvin yleinen |
| Kuume Mustelma injektiokohdassa | Yleinen |
| Väsymys (2), Injektiokohdan lämpö (2), injektiokohdan kutina (4) | Melko harvinainen |
(1) Ilmoitettu yhdellä 3-vuotiaalla lapsella (2) Ilmoitettu 3–8-vuotiailla lapsilla
(3) Yleinen 9–17-vuotiailla lapsilla (4) Ilmoitettu 9–17-vuotiailla lapsilla
Alla esitetty turvallisuusprofiili perustuu:
- tietoihin 1 614:stä 6–35 kuukauden ikäisestä lapsesta, jotka saivat kaksi annosta VaxigripTetra-rokotetta
- maailmanlaajuisesta markkinoilletulon jälkeisestä seurannasta saatuihin tietoihin (*).
| HAITTAVAIKUTUKSET | ESIINTYMISTIHEYS |
| Immuunijärjestelmä | |
| Yliherkkyys | Melko harvinainen |
| Allergiset reaktiot kuten yleistynyt kutina, papulaarinen ihottuma | Harvinainen |
| Anafylaktiset reaktiot | Tuntematon* |
| Hermosto | |
| Päänsärky (1) | Hyvin yleinen |
| Ruoansulatuselimistö | |
| Oksentelu (2) | Hyvin yleinen |
| Ripuli | Melko harvinainen |
| Luusto, lihakset ja sidekudos | |
| Lihaskipu (3) | Hyvin yleinen |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Ärtyneisyys (4), ruokahaluttomuus (4), epätavallinen itku (5), huonovointisuus (3), kuume, uneliaisuus (5), kipu/arkuus injektiokohdassa, injektiokohdan punoitus | Hyvin yleinen |
| Vilunväristykset (1) Kovettuma injektiokohdassa, turvotus injektiokohdassa, mustelma injektiokohdassa | Yleinen |
| Influenssan kaltainen sairaus Injektiokohdan ihottuma, injektiokohdan kutina | Harvinainen |
(1) Ilmoitettu vähintään 24 kuukauden ikäisillä lapsilla (2) Melko harvinainen vähintään 24 kuukauden ikäisillä lapsilla
(3) Harvinainen alle 24 kuukauden ikäisillä lapsilla (4) Harvinainen vähintään 24 kuukauden ikäisillä lapsilla
(5) Ilmoitettu alle 24 kuukauden ikäisillä lapsilla
VaxigripTetra-rokotteen turvallisuusprofiili oli 6 kuukauden – 8-vuoden ikäisillä lapsilla samanlainen ensimmäisen ja toisen injektion jälkeen ja 6–35 kuukauden ikäisten lasten kohdalla todettiin, että toisen injektion jälkeen haittavaikutuksia näyttää ilmenevän vähemmän kuin ensimmäisen injektion jälkeen.
Haittavaikutukset
Seuraavia haittatapahtumia on ilmoitettu Vaxigrip-rokotteen markkinoilletulon jälkeen. Syy-yhteyttä VaxigripTetra-rokotteeseen ei ole kuitenkaan osoitettu.
- Veri ja imukudos
Ohimenevä trombosytopenia (1), lymfadenopatia (1)
- Hermosto
Parestesia (1), Guillain-Barrén oireyhtymä (GBS), neuriitti, neuralgia, kouristuskohtaukset, enkefalomyeliitti
- Verisuonisto
Vaskuliitti, kuten Henoch-Schonleinin purppura, joihin liittyy joissakin tapauksissa ohimeneviä munuaisoireita
(1) Näitä haittatapahtumia ilmoitettiin kliinisissä tutkimuksissa vain tietyissä ikäryhmissä (ks. Haittavaikutusten taulukoitu yhteenveto).
Muut erityisryhmät
Rajallisella määrällä tutkittavia, joilla oli muita samanaikaisia sairauksia ja jotka tulivat mukaan kliinisiin tutkimuksiin, VaxigripTetra-rokotteen havaittu turvallisuusprofiili ei eronnut yleispopulaatiossa havaitusta turvallisuusprofiilista. Lisäksi Vaxigrip-rokotteesta munuaissiirrännäispotilailla ja astmapotilailla tehdyissä tutkimuksissa ei havaittu merkittäviä eroja Vaxigrip-rokotteen turvallisuusprofiilissa näissä potilasryhmissä.
Raskaana olevat naiset
Etelä-Afrikassa ja Malissa tehdyissä kliinisissä tutkimuksissa raskaana olevilla naisilla, jotka saivat Vaxigrip rokotteen (ks. kohdat Raskaus ja imetys ja Farmakodynamiikka), 7 päivän kuluessa rokotteen antamisesta ilmoitettujen, tutkimussuunnitelman mukaisesti arvioitujen paikallisten ja systeemisten reaktioiden esiintymistiheydet vastasivat esiintymistiheyksiä, joita ilmoitettiin aikuisilla tutkittavilla Vaxigrip-rokotteen kliinisten tutkimusten aikana. Eteläafrikkalaisessa tutkimuksessa paikalliset reaktiot olivat yleisempiä Vaxigrip-ryhmässä kuin lumevalmistetta saaneiden ryhmässä sekä HIV-negatiivisessa että HIV-positiivisessa kohortissa. Kummassakaan kohortissa ei todettu merkittäviä eroja tutkimussuunnitelman mukaisesti arvioiduissa reaktioissa Vaxigrip- ja lumeryhmien välillä.
Yhdessä Suomessa VaxigripTetra-rokotteella tehdyssä kliinisessä tutkimuksessa, johon osallistui raskaana olevia naisia (ks. kohdat Raskaus ja imetys ja Farmakodynamiikka), 7 vuorokauden kuluessa VaxigripTetra-rokotteen antamisesta ilmoitettujen, tutkimussuunnitelman mukaisesti arvioitujen paikallisten ja systeemisten reaktioiden esiintymistiheydet vastasivat esiintymistiheyksiä, joita oli ilmoitettu VaxigripTetra-rokotetta koskevien kliinisten tutkimusten aikana aikuisilla tutkittavilla, jotka eivät olleet raskaana, vaikka joitakin haittavaikutuksia ilmeni enemmän (kipu injektiokohdassa, huonovointisuus, vilunväristykset, päänsärky, lihaskipu).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haitta-tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
VaxigripTetra-rokotetta käytettäessä on ilmoitettu tapauksista, joissa sitä on annettu suositeltua annosta enemmän (yliannostus). Kun haittavaikutuksista ilmoitettiin, tiedot olivat VaxigripTetra-rokotteen kohdassa Haittavaikutukset kuvatun tiedossa olevan turvallisuusprofiilin mukaisia.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Influenssarokotteet ATC-koodi: J07BB02
Vaikutusmekanismi
VaxigripTetra tarjoaa aktiivisen immunisaation neljää rokotteen sisältämää influenssaviruskantaa (kahta A-alatyyppiä ja kahta B-tyyppiä) vastaan.
VaxigripTetra saa aikaan humoraalisia vasta-aineita hemagglutiniineja vastaan 2–3 viikon sisällä. Nämä vasta-aineet neutralisoivat influenssavirukset.
Tietyt hemagglutinaation inhibition (HAI) vasta-ainetittereiden pitoisuudet inaktivoitujen influenssavirusten rokotuksen jälkeen eivät ole korreloineet influenssataudilta suojaamisen kanssa, mutta HAI-vasta-ainetittereitä on käytetty rokotteen aktiivisuuden mittarina. Joissakin ihmisille tehdyissä altistustutkimuksissa tasolla ≥ 1:40 olevat HAI-vasta-ainetitterit ovat olleet yhteydessä influenssataudilta suojaamisen kanssa maksimissaan 50 %:lla tutkittavista.
Koska influenssavirukset kehittyvät jatkuvasti, WHO tarkastaa vuosittain rokotteeseen valitut viruskannat.
Vuosittaista VaxigripTetra-rokotuksen uudelleen ottamista ei ole tutkittu. Kolmivalenttista rokotetta koskevan kliinisen kokemuksen perusteella vuosittainen influenssarokotteen uudelleen ottaminen on kuitenkin suositeltavaa, huomioiden rokotteen tarjoaman immuniteetin kesto ja se, että influenssaviruksen kiertävät kannat saattavat muuttua vuodesta toiseen.
VaxigripTetra-rokotteen teho
Pediatriset potilaat
- 6–35 kuukauden ikäiset lapset (aktiivinen immunisaatio):
VaxigripTetra -rokotteen tehoa laboratoriovarmennetun influenssan kaltaisen sairauden ehkäisyssä, jonka aiheutti mikä tahansa A ja/tai B kanta sekä rokotteen kanssa samankaltainen kanta (määritettiin sekvensoinnilla), arvioitiin satunnaistetussa, lumekontrolloidussa tutkimuksessa, joka tehtiin neljällä alueella (Afrikassa, Aasiassa, Latinalaisessa Amerikassa ja Euroopassa) neljän influenssakauden aikana. Tutkimukseen osallistui yli 5 400 6–35 kuukauden ikäistä lasta, jotka saivat kaksi annosta (0,5 ml) VaxigripTetra-rokotetta (N = 2 722) tai lumelääkettä (N = 2 717) 28 vuorokauden välein.
Laboratoriovarmennetuksi influenssaksi määritettiin influenssan kaltainen sairaus (influenza-like illness, ILI) (vähintään 38 °C:n kuume (joka kestää vähintään 24 tuntia) ja samanaikaisesti vähintään yksi seuraavista oireista: yskä, nenän tukkoisuus, voimakas nuha, nielutulehdus, korvatulehdus, oksentelu tai ripuli), joka varmistettiin laboratoriokokein käänteiskopiointipolymeraasiketjureaktiolla (RT-PCR) ja/tai virusviljelyllä.
Taulukko 1: Influenssan ilmaantumisosuus ja VaxigripTetra-rokotteen teho laboratoriovarmennettua influenssatautia vastaan 6–35 kuukauden ikäisillä lapsilla
VaxigripTetra (N = 2 584) | Lumelääke (N = 2 591) | Teho | |||
| n | Influenssan ilmaantumisosuus (%) | n | Influenssan ilmaantumisosuus (%) | % (kaksipuolinen 95 %:n CI) | |
| Laboratoriovarmennetun influenssataudin aiheuttajat: | |||||
| 122 | 4,72 | 255 | 9,84 | 52,03 (40,24; 61,66) |
| 26 | 1,01 | 85 | 3,28 | 69,33 (51,93; 81,03) |
N = analysoitujen lasten lukumäärä (koko joukko)
n = taulukossa mainitun kohdan mukaisten tutkittavien lukumäärä
CI = luottamusväli
Lisäksi ennalta määritelty täydentävä analyysi osoitti, että VaxigripTetra -rokote esti 56,6 % (95 %:n luottamusväli 37,0; 70,5) vaikeista minkä tahansa kannan aiheuttamista laboratoriovarmennetuista influenssataudeista ja 71,7 % (95 %:n luottamusväli 43,7; 86,9) vaikeista rokotteen kanssa samankaltaisten kantojen aiheuttamista laboratoriovarmennetuista influenssataudeista. Tämän lisäksi VaxigripTetra -rokotetta saaneilla tutkittavilla oli 59,2 % (95 %:n luottamusväli 44,4; 70,4) pienempi todennäköisyys saada hoitoa edellyttävä influenssatauti kuin lumelääkettä saaneilla tutkittavilla.
Vaikeaksi laboratoriovarmennetuksi influenssataudiksi määriteltiin laboratoriokokein käänteiskopiointipolymeraasiketjureaktiolla (RT-PCR) ja/tai virusviljelyllä varmistettu influenssan kaltainen sairaus (ILI), johon liittyi vähintään yksi seuraavista:
- yli 39,5 °C:n kuume alle 24 kuukauden ikäisillä tutkittavilla tai vähintään 39,0 °C:n kuume vähintään 24 kuukauden ikäisillä tutkittavilla
- ja/tai vähintään yksi merkittävä influenssan kaltaisen sairauden (ILI) oire, joka estää päivittäisiä toimia (yskä, nenän tukkoisuus, voimakas nuha, nielutulehdus, korvatulehdus, oksentelu, ripuli)
- ja/tai yksi seuraavista tapahtumista: akuutti välikorvan tulehdus, akuutti alempien hengitysteiden infektio (keuhkokuume, bronkioliitti, keuhkoputkitulehdus, kuristustauti), sairaalahoito.
- 3–8-vuotiaat lapset (aktiivinen immunisaatio):
3–8-vuotiailla lapsilla havaittujen immuunivasteiden perusteella VaxigripTetra -rokotteen tehon odotetaan olevan tässä populaatiossa vähintään samanlainen kuin 6–35 kuukauden ikäisillä lapsilla havaitun rokotteen tehon (ks. kohta ”6–35 kuukauden ikäiset lapset” edellä ja ”VaxigripTetra -rokotteen immunogeenisuus” jäljempänä).
- Raskauden aikana rokotetuille naisille syntyneet alle 6 kuukauden ikäiset lapset (passiivinen suoja):
Alle 6 kuukauden ikäisillä lapsilla on suuri riski sairastua influenssaan, joka vaatii usein sairaalahoitoa. Influenssarokotteita ei kuitenkaan ole tarkoitettu aktiiviseen immunisaatioon tässä ikäryhmässä.
Tehoa ei ole tutkittu toisen tai kolmannen raskauskolmanneksen aikana yhden 0,5 ml VaxigripTetra-annoksen saaneiden naisten lapsilla, mutta teho on osoitettu kliinisissä tutkimuksissa toisen tai kolmannen raskauskolmanneksen aikana yhden 0,5 ml annoksen kolmivalenttista inaktivoitua influenssarokotetta (Vaxigrip) saaneiden naisten lapsilla, ja tulokset voidaan ekstrapoloida VaxigripTetra-valmisteelle.
Kolmivalentin inaktivoidun influenssarokotteen (Vaxigrip) tehoa ensimmäisen raskauskolmanneksen aikana rokotettujen naisten lapsilla ei ole tutkittu näissä tutkimuksissa. Ensimmäisen raskauskolmanneksen aikana tarvittavaa influenssarokotusta ei pidä lykätä (ks. kohta Raskaus ja imetys).
Malissa, Nepalissa ja Etelä-Afrikassa tehdyissä satunnaistetuissa, kontrolloiduissa vaiheen IV kliinisissä tutkimuksissa noin 5 000 raskaana olevaa naista sai Vaxigrip-rokotteen (kolmivalenttinen influenssarokote, joka ei sisällä tiomersaalia) ja noin 5 000 raskaana olevaa naista sai lumevalmistetta tai vertailurokotteen (tetravalentin meningokokkikonjugaattirokotteen) toisen tai kolmannen raskauskolmanneksen aikana. Näissä kolmessa tutkimuksessa rokotteen tehoa raskaana olevilla naisilla laboratoriovarmennetun influenssan ennaltaehkäisyssä arvioitiin toissijaisena päätetapahtumana.
Malissa ja Etelä-Afrikassa tehdyt tutkimukset osoittivat Vaxigrip-rokotteen tehon influenssan ennaltaehkäisyssä näiden raskauskolmannesten aikana rokotteen saaneilla naisilla (ks. taulukko 2). Nepalissa tehdyssä tutkimuksessa Vaxigrip-rokotteen tehoa influenssan ennaltaehkäisyssä näiden raskauskolmannesten aikana rokotteen saaneilla naisilla ei osoitettu.
Taulukko 2: Influenssan ilmaantumisosuus ja Vaxigrip-rokotteen teho laboratoriovarmennettua influenssaa vastaan raskaana olevilla naisilla
Influenssan ilmaantumisosuus (mikä tahansa A- tai B-tyypin influenssa), % (n/N) | Vaxigrip-rokotteen teho, % (95 %:n CI) | |||
| Kolmivalenttinen influenssarokote | Vertailurokote* | |||
| Mali | 0,5 (11 / 2 108) | 1,9 (40 / 2085) | 70,3 (42,2–85,8) | |
| Kolmivalenttinen influenssarokote | Lumevalmiste | |||
| Etelä-Afrikka | 1,8 (19 / 1 062) | 3,6 (38 / 1 054) | 50,4 (14,5–71,2) | |
* Meningokokkirokote
N: analysoitujen raskaana olevien naisten lukumäärä
n: niiden tutkittavien lukumäärä, joilla oli laboratoriovarmennettu influenssa
CI: luottamusväli
Samoissa Malissa, Nepalissa ja Etelä-Afrikassa tehdyissä satunnaistetuissa, kontrolloiduissa vaiheen IV kliinisissä tutkimuksissa seurattiin noin 6 kuukauden ikään saakka 4 530 lasta 4 898 lapsesta (92 %), joiden äidit olivat saaneet Vaxigrip-rokotteen (kolmivalenttisen influenssarokotteen, joka ei sisältänyt tiomersaalia) ja 4 532 lasta 4 868 lapsesta (93 %), joiden äidit olivat saaneet lumevalmistetta tai vertailurokotteen (tetravalentin meningokokkikonjugaattirokotteen) (ks. taulukko 3) toisen tai kolmannen raskauskolmanneksen aikana.
Tutkimuksissa varmistettiin Vaxigrip-rokotteen teho influenssan ennaltaehkäisyssä näiden raskauskolmannesten aikana rokotteen saaneiden naisten lapsilla syntymästä noin 6 kuukauden ikään saakka. Näihin tutkimuksiin ei otettu mukaan ensimmäisellä raskauskolmanneksella olevia naisia; Vaxigrip-rokotteen tehoa lapsilla, joiden äidit olivat saaneet rokotteen ensimmäisen raskauskolmanneksen aikana, ei siten voitu arvioida.
Taulukko 3: Influenssan ilmaantumisosuus ja Vaxigrip-rokotteen teho laboratoriovarmennettua influenssaa vastaan raskauden aikana rokotteen saaneiden naisten lapsilla
Influenssan ilmaantumisosuus (mikä tahansa A- tai B-tyypin influenssa), % (n/N) | Vaxigrip-rokotteen teho, % (95 %:n CI) | |||
| Kolmivalenttinen influenssarokote | Vertailurokote* | |||
| Mali | 2,4 (45 / 1 866) | 3,8 (71 / 1 869) | 37,3 (7,6–57,8) | |
| Kolmivalenttinen influenssarokote | Lumevalmiste | |||
| Nepal | 4,1 (74 / 1 820) | 5,8 (105 / 1 826) | 30,0 (5–48) | |
| Etelä-Afrikka | 1,9 (19 / 1 026) | 3,6 (37 / 1 023) | 48,8 (11,6–70,4) | |
* Meningokokkirokote
N: analysoitujen lasten lukumäärä
n: niiden tutkittavien lukumäärä, joilla oli laboratoriovarmennettu influenssa
CI: luottamusväli
Tehoa koskevat tiedot viittaavat siihen, että rokotteen saaneiden äitien lapsilla suoja heikkenee ajan kuluessa syntymän jälkeen.
Etelä-Afrikassa tehdyssä tutkimuksessa rokotteen teho oli suurin 8 viikon ikäisillä tai sitä nuoremmilla lapsilla (85,8 % [95 %:n luottamusväli 38,8–98,4]) ja se heikkeni ajan myötä; rokotteen teho oli 25,5 % (95 %:n luottamusväli -67,9–67,8) 8-16 viikon ikäisillä lapsilla ja 30,4 % (95 %:n luottamusväli -154,9–82,6) 8-24 viikon ikäisillä lapsilla.
Myös Malissa tehdyssä tutkimuksessa kolmivalenttisen inaktivoidun influenssarokotteen teho oli yleensä suurempi lapsilla ensimmäisten neljän kuukauden aikana syntymän jälkeen, ja viidennen seurantakuukauden aikana teho oli pienempi ja kuudennen kuukauden aikana teho oli heikentynyt selvästi, eikä suojaa ollut enää havaittavissa.
Influenssatautia ennaltaehkäisevää vaikutusta voidaan odottaa vain silloin, kun lapsi altistuu kannoille jotka sisältyivät äidille annettuun rokotteeseen.
VaxigripTetra-rokotteen immunogeenisuus
18–60-vuotiailla aikuisilla, yli 60-vuotiailla iäkkäillä henkilöillä, 3–8-vuotiailla ja 6–35 kuukauden ikäisillä lapsilla tehdyissä kliinisissä tutkimuksissa arvioitiin VaxigripTetra-rokotteen immuunivastetta HAI:n keskimääräisen geometrisen vasta-ainetitterin (GMT) osalta päivänä 21 (aikuisilla) ja päivänä 28 (lapsilla), HAI-serokonversiosuhteen osalta (nelinkertainen kohoaminen keskinäisessä titterissä tai muutos havaitsemattomissa olevalta tasolta [< 10] ≥ 40:n keskinäiseen titteriin), ja HAI:n GMT-suhde (titteri rokotuksen jälkeen/ennen rokotusta).
Yhdessä kliinisessä tutkimuksessa, joka tehtiin 18–60-vuotiaille aikuisille ja 9–17-vuotiaille lapsille, kuvattiin VaxigripTetra-rokotteen immuunivastetta HAI:n keskimääräisen geometrisen vasta-ainetitterin (GMT) osalta päivänä 21. Toisessa 9–17-vuotiaille lapsille tehdyssä kliinisessä tutkimuksessa kuvattiin VaxigripTetra-rokotteen immuunivastetta.
Yhdessä raskaana olevilla naisilla tehdyssä kliinisessä tutkimuksessa kuvattiin VaxigripTetra-rokotteen aikaansaamaa immuunivastetta HAI:n GMT:n osalta päivänä 21, HAI-serokonversion osalta ja HAI:n GMT-suhteen (GMTR) osalta yhden annoksen jälkeen annettuna toisen tai kolmannen raskauskolmanneksen aikana. Tässä tutkimuksessa arvioitiin kulkeutumista istukan läpi käyttämällä äidin veren ja napaveren HAI:n GMT-arvoja sekä napaveren ja äidin veren HAI:n GMT-arvojen välistä suhdetta synnytyksen yhteydessä.
VaxigripTetra sai aikaan merkittävän immuunivasteen neljälle rokotteen sisältämälle influenssakannalle.
Aikuiset ja iäkkäät
Yhteensä 832 18–60-vuotiaalta aikuiselta ja 831 yli 60-vuotiaalta iäkkäältä määritettiin immuunivaste yhden VaxigripTetra-rokoteannoksen jälkeen.
Immunogeenisuustulokset on esitetty alla olevassa taulukossa:
Taulukko 4: Immunogeenisuustulokset 18–60-vuotiailla aikuisilla ja yli 60-vuotiailla iäkkäillä
| Antigeenikanta | 18–60-vuotiaat N = 832 | Yli 60-vuotiaat N = 831 |
| GMT-arvo (95 %:n CI) | ||
| A (H1N1) (a)(b) | 608 (563; 657) | 219 (199; 241) |
| A (H3N2) | 498 (459; 541) | 359 (329; 391) |
| B (Victoria) | 708 (661; 760) | 287 (265; 311) |
| B (Yamagata) | 1715 (1607; 1830) | 655 (611; 701) |
| SC % (95 %:n CI) (c) | ||
| A (H1N1)(a)(b) | 64,1 (60,7; 67,4) | 45,6 (42,1; 49,0) |
| A (H3N2) | 66,2 (62,9; 69,4) | 47,5 (44,1; 51,0) |
| B (Victoria) | 70,9 (67,7; 74,0) | 45,2 (41,8; 48,7) |
| B (Yamagata) | 63,7 (60,3; 67,0) | 42,7 (39,3; 46,2) |
| GMTR-arvo (95 %:n CI) (d) | ||
| A (H1N1)(a)(b) | 9,77 (8,69; 11,0) | 4,94 (4,46; 5,47) |
| A (H3N2) | 10,3 (9,15; 11,5) | 5,60 (5,02; 6,24) |
| B (Victoria) | 11,6 (10,4; 12,9) | 4,61 (4,18; 5,09) |
| B (Yamagata) | 7,35 (6,66; 8,12) | 4,11 (3,73; 4,52) |
N = tutkittavien lukumäärä, joista oli käytettävissä tiedot tutkittavan päätetapahtuman osalta
GMT-arvo: geometrinen keskiarvotitteri (Geometric Mean Titer); CI: luottamusväli;
(a) N = 833 18–60-vuotiaiden ryhmän osalta
(b) N = 832 yli 60-vuotiaiden ryhmän osalta
(c) SC: serokonversio tai merkittävä kohoaminen: niiden tutkittavien osalta, joilla rokotusta edeltävä titteri < 10 (1/dil), niiden tutkittavien suhteellinen osuus, joiden rokotuksen jälkeinen titteri ≥ 40 (1/dil) ja niiden tutkittavien osalta, joilla rokotusta edeltävä titteri ≥ 10 (1/dil), niiden tutkittavien suhteellinen osuus, joilla oli vähintään nelinkertainen lisäys rokotusta edeltävästä titteristä rokotuksen jälkeiseen titteriin
(d)GMTR: Yksittäisten geometristen keskiarvotittereiden suhde (rokotuksen jälkeiset/rokotusta edeltävät titterit)
Raskaana olevat naiset ja transplasentaalinen kulkeutuminen
Yhteensä 230 raskaana olevaa naista sai VaxigripTetra-rokotteen toisen tai kolmannen raskauskolmanneksen aikana (raskausviikoilla 20–32).
Taulukossa 5 on esitetty HAI-menetelmällä arvioidut immunogeenisuustulokset raskaana olevilla naisilla 21 vuorokautta VaxigripTetra-rokotuksen jälkeen.
Taulukko 5: HAI-menetelmällä arvioidut immunogeenisuustulokset raskaana olevilla naisilla 21 vuorokautta VaxigripTetra-rokotuksen jälkeen
| Antigeenikanta | Nelivalenttinen influenssarokote N = 216 |
| GMT-arvo (95 %:n CI) | |
| A (H1N1)* | 525 (466; 592) |
| A (H3N2)* | 341 (286; 407) |
| B1 (Victoria)* | 568 (496; 651) |
| B2 (Yamagata)* | 993 (870; 1 134) |
| ≥ 4-kertainen nousu, n (%) (a) | |
| A (H1N1)* | 38,0 (31,5; 44,8) |
| A (H3N2)* | 59,3 (52,4; 65,9) |
| B1 (Victoria)* | 61,1 (54,3; 67,7) |
| B2 (Yamagata)* | 59,7 (52,9; 66,3) |
| GMTR-arvo (95 %:n CI) (b) | |
| A (H1N1)* | 3,81 (3,11; 4,66) |
| A (H3N2)* | 8,63 (6,85; 10,9) |
| B1 (Victoria)* | 8,48 (6,81; 10,6) |
| B2 (Yamagata)* | 6,26 (5,12; 7,65) |
*A/H1N1: kannan A/Michigan/45/2015 (H1N1) pdm09 kaltainen virus; A/H3N2: kannan A/Hong Kong/4801/2014 (H3N2) kaltainen virus;
B1: kannan B/Brisbane/60/2008 kaltainen virus (B/Victoria-haara);
B2: kannan B/Phuket/3073/2013 kaltainen virus (B/Yamagata-haara)
N: tutkittavien lukumäärä, joista oli käytettävissä tiedot tutkittavan päätetapahtuman osalta
GMT-arvo: geometrinen keskiarvotitteri; CI: luottamusväli
(a) SC: serokonversio tai merkittävä nousu: tutkittavilla, joilla rokotusta edeltävä titteri oli < 10 (1/dil), luvut kuvaavat niiden tutkittavien osuutta, joilla rokotuksen jälkeinen titteri oli ≥ 40 (1/dil), ja tutkittavilla, joilla rokotusta edeltävä titteri oli ≥ 10 (1/dil), luvut kuvaavat niiden tutkittavien osuutta, joilla rokotuksen jälkeinen titteri oli vähintään nelinkertainen verrattuna rokotusta edeltävään titteriin
(b) GMTR-arvo: yksittäisten geometristen keskiarvotitterien suhde (rokotuksen jälkeiset/rokotusta edeltävät titterit)
Taulukossa 6 on esitetty immunogeenisuutta kuvaava arviointi, joka on tehty HAI-menetelmällä synnytyksen yhteydessä otetusta äidin verinäytteestä (BL03M), napaverinäytteestä (BL03B) sekä istukan läpi kulkeutumisesta (BL03B/BL03M).
Taulukko 6: Synnytyksen yhteydessä HAI-menetelmällä tehty VaxigripTetra-valmisteen immunogeenisuutta kuvaava arviointi
| Antigeenikanta | Nelivalenttinen influenssarokote N = 178 |
| BL03M (äidin veri)† GMT-arvo (95 %:n CI) | |
| A (H1N1)* | 304 (265; 349) |
| A (H3N2)* | 178 (146; 218) |
| B1 (Victoria)* | 290 (247; 341) |
| B2 (Yamagata)* | 547 (463; 646) |
| BL03B (napaveri)** GMT-arvo (95 %:n CI) | |
| A (H1N1)* | 576 (492; 675) |
| A (H3N2)* | 305 (246; 379) |
| B1 (Victoria)* | 444 (372; 530) |
| B2 (Yamagata)* | 921 (772; 1 099) |
| Kulkeutuminen istukan läpi BL03B/BL03M§ GMT-arvo (95 %:n CI) | |
| A (H1N1)* | 1,89 (1,72; 2,08) |
| A (H3N2)* | 1,71 (1,56; 1,87) |
| B1 (Victoria)* | 1,53 (1,37; 1,71) |
| B2 (Yamagata)* | 1,69 (1,54; 1,85) |
N: tutkittavien lukumäärä, joista oli käytettävissä tiedot tutkittavan päätetapahtuman osalta: naiset, jotka saivat nelivalenttisen influenssarokotteen ja synnyttivät vähintään 2 viikon kuluttua injektion saamisesta ja joilta oli saatavilla synnytyksen yhteydessä otetut näytteet napaverestä ja äidin verestä.
*A/H1N1: kannan A/Michigan/45/2015 (H1N1) pdm09 kaltainen virus; A/H3N2: kannan A/Hong Kong/4801/2014 (H3N2) kaltainen virus;
B1: kannan B/Brisbane/60/2008 kaltainen virus (B/Victoria-haara)
B2: kannan B/Phuket/3073/2013 kaltainen virus (B/Yamagata-haara)
§ Jos äiti synnyttää X lasta, hänen titteriarvonsa lasketaan X kertaa
Synnytyksen yhteydessä otetussa napaverinäytteessä vasta-aineiden määrä oli korkeampi äidin verinäytteeseen verrattuna, mikä vastaa sitä, että vasta-aineet kulkeutuvat istukan läpi äidistä vastasyntyneeseen, kun nainen on saanut VaxigripTetra-rokotteen toisen tai kolmannen raskauskolmanneksen aikana.
Nämä tiedot ovat yhdenmukaisia sen kanssa, että Malissa, Nepalissa ja Etelä-Afrikassa tehdyissä tutkimuksissa on osoitettu lasten saaneen syntymästä noin 6 kuukauden ikään asti kestävän passiivisen suojan, kun naiset saivat Vaxigrip-rokotteen toisen tai kolmannen raskauskolmanneksen aikana (ks. alakohta "VaxigripTetra-rokotteen teho").
Pediatriset potilaat
- 9–17-vuotiaat lapset:
Yhteensä 429 9–17-vuotiaalla lapsella, jotka saivat yhden annoksen VaxigripTetra-rokotetta, immuunivaste neljää rokotteen sisältämää kantaa vastaan oli samanlainen kuin 18–60-vuotiailla aikuisilla aikaansaatu immuunivaste.
- 6 kuukauden – 8-vuoden ikäiset lapset:
Yhteensä 863 3–8-vuotiasta lasta sai joko yhden tai kaksi annosta VaxigripTetra- tai Vaxigrip-rokotetta riippuen siitä, olivatko he saaneet aiemmin influenssarokotuksia.
Lapsilla, jotka saivat yhden tai kaksi annosta VaxigripTetra-rokotetta, ilmeni samanlainen immuunivaste viimeisen annosaikataulun annoksen jälkeen.
VaxigripTetra-rokotteen tehon lisäksi VaxigripTetra-rokotteen kahden 0,5 ml annoksen immunogeenisuutta arvioitiin HAI‑menetelmällä 28 vuorokauden kuluttua viimeisestä VaxigripTetra‑injektiosta 341:llä 6–35 kuukauden ikäisellä lapsella.
Immunogeenisuustulokset on esitetty alla olevassa taulukossa:
Taulukko 7: Immunogeenisuustulokset 6 kuukauden – 8-vuotiailla lapsilla
| Antigeenikanta | 6–35 kuukauden ikäiset N = 341 | 3–8-vuotiaat N = 863 |
| GMT-arvo (95 %:n CI) | ||
| A (H1N1) | 641 (547; 752) | 971 (896; 1 052) |
| A (H3N2) | 1 071 (925; 1 241) | 1 568 (1 451; 1 695) |
| B (Victoria) | 623 (550; 706) | 1 050 (956; 1 154) |
| B (Yamagata)(a) | 1 010 (885; 1 153) | 1 173 (1 078; 1 276) |
| SC % (95 %:n CI) (b) | ||
| A (H1N1) | 90,3 (86,7; 93,2) | 65,7 (62,4; 68,9) |
| A (H3N2) | 90,3 (86,7; 93,2) | 64,8 (61,5; 68,0) |
| B (Victoria) | 98,8 (97,0; 99,7) | 84,8 (82,3; 87,2) |
| B (Yamagata)(a) | 96,8 (94,3; 98,4) | 88,5 (86,2; 90,6) |
| GMTR-arvo (95 %:n CI) (c) | ||
| A (H1N1) | 36,6 (30,8; 43,6) | 6,86 (6,24; 7,53) |
| A (H3N2) | 42,6 (35,1; 51,7) | 7,49 (6,72; 8,35) |
| B (Victoria) | 100 (88,9; 114) | 17,1 (15,5; 18,8) |
| B (Yamagata)(a) | 93,9 (79,5; 111) | 25,3 (22,8; 28,2) |
N=tutkittavien lukumäärä, joista oli käytettävissä tiedot tutkitun päätetapahtuman osalta
GMT-arvo: geometrinen keskiarvotitteri (Geometric Mean Titer); CI: luottamusväli
(a) N = 862 3–8-vuotiaiden ryhmän osalta
(b) SC: serokonversio tai merkittävä kohoaminen: niiden tutkittavien osalta, joilla rokotusta edeltävä titteri < 10 (1/dil), niiden tutkittavien suhteellinen osuus, joiden rokotuksen jälkeinen titteri ≥ 40 (1/dil) ja niiden tutkittavien osalta, joilla rokotusta edeltävä titteri ≥ 10 (1/dil), niiden tutkittavien suhteellinen osuus, joilla oli vähintään nelinkertainen lisäys rokotusta edeltävästä titteristä rokotuksen jälkeiseen titteriin
(c) GMTR: Yksittäisten geometristen keskiarvotittereiden suhde (rokotuksen jälkeiset/rokotusta edeltävät titterit)
Nämä immunogeenisuustulokset tukevat tästä populaatiosta saatavilla olevia rokotteen tehoa koskevia tietoja (ks. kohta VaxigripTetra-rokotteen teho).
Farmakokinetiikka
Ei oleellinen.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa ja paikallista toksisuutta sekä lisääntymis- ja kehitystoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Puskuriliuos:
- Natriumkloridi
- Kaliumkloridi
- Dinatriumfosfaattidihydraatti
- Kaliumdihydrogeenifosfaatti
- Injektioihin käytettävä vesi.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
1 vuosi.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä. Säilytä ruisku ulkopakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VAXIGRIPTETRA injektioneste, suspensio, esitäytetty ruisku
15 mikrog HA/0,5 ml (L:ei) 0,5 ml (15,05 €), 10 x 0,5 ml (122,87 €), 10 x 0,5 ml (ilman neulaa) (-)
PF-selosteen tieto
0,5 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), jossa kiinteä neula, männän pysäytin (elastomeeri klorobutyyliä tai bromobutyyliä) – pakkauskoot: 1, 10 tai 20.
0,5 ml suspensiota esitäytetyssä ruiskussa (tyypin I lasia), männän pysäytin (elastomeeri bromobutyyliä) ja kärkisuojus.
- Pakkauskoot: 1, 10 tai 20 esitäytettyä ruiskua, joissa ei ole neuloja.
- Pakkauskoot: 1 tai 10 esitäytettyä ruiskua, joissa on erilliset neulat (ruostumatonta terästä) ja niiden turvasuojukset (polykarbonaattia).
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kevyen ravistamisen jälkeen suspensio on väritön ja opalisoiva.
Käyttö- ja käsittelyohjeet
Rokotteen pitää antaa lämmetä huoneenlämpöiseksi ennen injisointia.
Ravistettava ennen käyttöä.
Valmistelut ennen antamista
Injektionestettä (suspensio) sisältävä ruisku on tarkastettava silmämääräisesti ennen antamista. Jos injektionesteessä on vierashiukkasia, ruisku vuotaa, mäntä on aktivoitunut ennenaikaisesti tai kärkisuojus on viallinen, esitäytetty ruisku on hävitettävä.
Ruisku on tarkoitettu vain yhtä käyttökertaa varten, eikä sitä saa käyttää uudelleen.
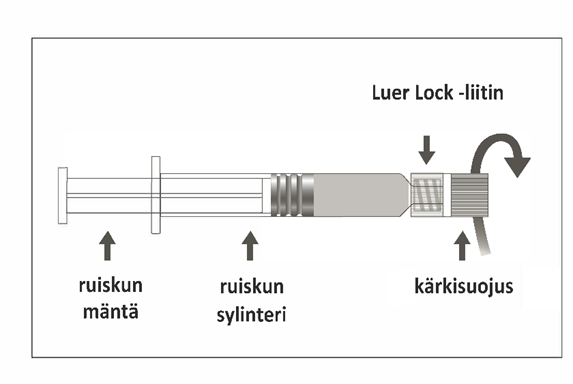
Esitäytetyn Luer Lock ‑ruiskun käyttöohjeet:
Kuva A: Luer Lock ‑ruisku, jossa on jäykkä kärkisuojus
| Vaihe 1: Pidä toisella kädellä kiinni Luer Lock ‑liittimestä (älä pidä kiinni ruiskun männästä tai sylinteristä) ja poista kärkisuojus kiertämällä sitä. | 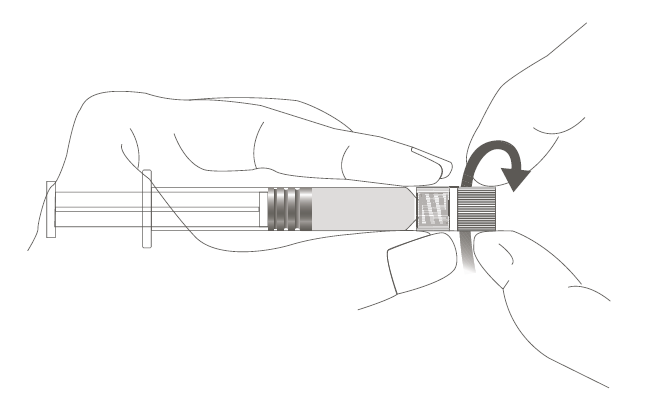 |
| Vaihe 2: Kiinnitä neula ruiskuun kiertämällä neulaa varovasti ruiskun Luer Lock ‑liittimeen, kunnes tunnet vähäisen vastuksen. | 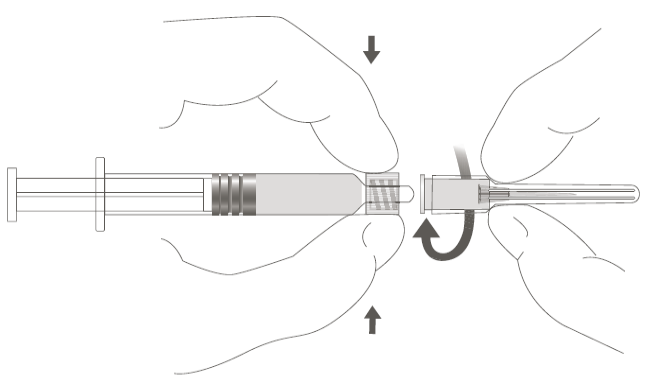 |
<Ohjeet turvaneulan käytölle esitäytetyn Luer Lock ‑ruiskun kanssa:
Valmistele Luer Lock ‑ruisku ja neula kiinnittämistä varten noudattaen edellä esitettyjä vaiheita 1 ja 2.
| Kuva B: Turvaneula (kotelossa) | Kuva C: Turvaneulan osat (valmisteltuna käyttöä varten) |
|
|
| Vaihe 3: Poista turvaneulan kotelo vetämällä kohtisuoraan. Neula on turvasuojuksen ja suojaosan sisällä. | |
Vaihe 4: A: Käännä turvasuojusta poispäin neulasta, kohti ruiskun sylinteriä kuvassa esitettyyn asentoon. B: Poista suojaosa vetämällä kohtisuoraan. | 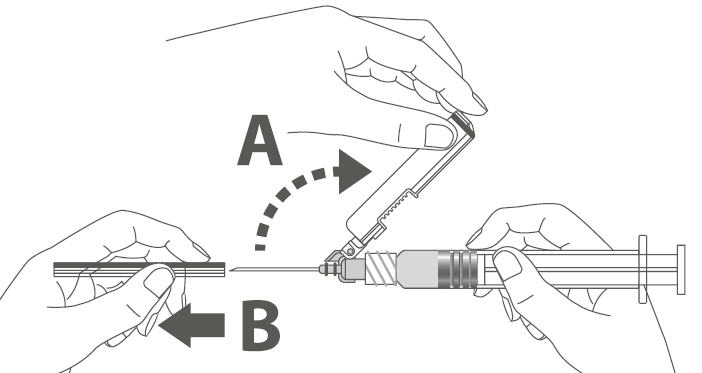 |
Vaihe 5: Kun pistos on annettu, lukitse (aktivoi) turvasuojus käyttämällä jotakin kolmesta (3) yhden käden tekniikasta, jotka on esitetty kuvassa, eli aktivoinnilla pintaa vasten, peukalolla tai sormella. Huomaa: Aktivointi on onnistunut, kun kuulet ja/tai tunnet naksahduksen. | 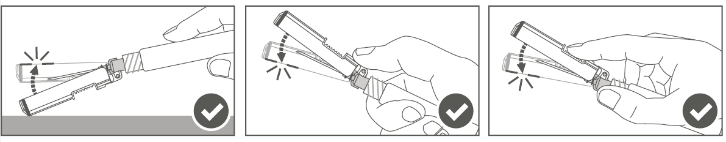 |
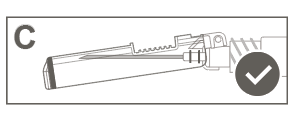
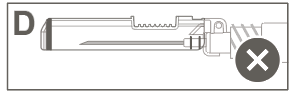
Vaihe 6: Tarkasta turvasuojuksen aktivoituminen silmämääräisesti. Turvasuojuksen on oltava täysin lukkiutunut (aktivoitunut), kuten kuvassa C on esitetty.
Kuvassa D on turvasuojus, joka EI ole täysin lukkiutunut (ei ole aktivoitunut).
|
|
| Varoitus: Älä yritä poistaa turvalaitteen lukitusta (peruuttaa turvalaitteen aktivointia) ottamalla neula väkisin pois turvasuojuksesta.> | |
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
VAXIGRIPTETRA injektioneste, suspensio, esitäytetty ruisku
15 mikrog HA/0,5 ml 0,5 ml, 10 x 0,5 ml, 10 x 0,5 ml
- Ei korvausta.
ATC-koodi
J07BB02
Valmisteyhteenvedon muuttamispäivämäärä
27.05.2025
Yhteystiedot
 SANOFI OY
SANOFI OY Revontulenkuja 1
02100 Espoo
0201 200 300
www.sanofi.fi