EPIDUO geeli 0,3 %/2,5 %
Vaikuttavat aineet ja niiden määrät
Yksi gramma geeliä sisältää:
adapaleeni 3 mg (0,3 % w/w)
bentsoyyliperoksidi, vesipitoinen; määrä vastaa 25 mg:aa (2,5 % w/w) vedetöntä bentsoyyliperoksidia.
Apuaine, jonka vaikutus tunnetaan: propyleeniglykoli (E1520) 40 mg/g (4,0 %). Polysorbaatti 80 (E433) ≤4 mg/g.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Geeli.
Kliiniset tiedot
Käyttöaiheet
Epiduo 0,3% / 2,5% geeli on tarkoitettu acne vulgariksen paikallishoitoon silloin, kun siihen liittyy komedoita, useita papuloita ja pustuloita (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Epiduo 0,3% / 2,5% geeli on tarkoitettu käytettäväksi aikuisille ja 12-vuotiaille tai sitä vanhemmille nuorille.
Annostus ja antotapa
Annostus
Epiduo 0,3% / 2,5% geeliä levitetään kerran päivässä illalla koko kasvojen ja vartalon aknealueelle puhtaalle ja kuivalle iholle.
Lääkäri päättää hoidon keston kliinisen tilan ja hoitovasteen perusteella. Kliinisen paranemisen ensimmäiset merkit alkavat yleensä näkyä 1-4 viikon kuluttua hoidon aloittamisesta. Jos 4-8 viikon hoidon jälkeen ei havaita paranemista, jatkohoidon hyödyllisyyttä pitää harkita uudelleen.
Epiduosta on olemassa pienempi vahvuus (Epiduo 0,1% / 2,5% geeli), jota pitää harkita käytettäväksi keskivaikeaa acne vulgarista sairastaville potilaille (ks. kohta Farmakodynamiikka).
Koko kasvojen alueella esiintyvien lukuisten papulopustuloiden hoidossa saavutettiin parempi teho Epiduo 0,3% / 2,5% geelillä hoidetuilla henkilöillä kuin vertailuvalmisteella (Epiduo 0,1% / 2,5% geeli) hoidetuilla. Lääkäri voi valita potilaan kliinisen tilan ja sairauden vaikeusasteen mukaan kumpaa pitoisuutta käytetään.
Erityisryhmät
Iäkkäät
Epiduo 0,3% / 2,5% geelin turvallisuutta ja tehoa ei ole varmistettu iäkkäillä potilailla, jotka ovat 65-vuotiaita tai sitä vanhempia.
Munuaisten ja maksan vajaatoiminta
Epiduo 0,3% / 2,5% geeliä ei ole tutkittu munuaisten tai maksan vajaatoimintaa sairastavilla potilailla.
Pediatriset potilaat
Epiduo 0,3% / 2,5% geelin turvallisuutta ja tehoa ei ole tutkittu alle 12-vuotiailla lapsilla.
Antotapa
Vain iholle.
Levitä ohut kerros Epiduo 0,3% / 2,5% geeliä kasvojen ja/tai vartalon aknealueelle kerran päivässä peseytymisen jälkeen. Käytä herneen kokoinen määrä kasvojen kullekin alueelle (esim. otsa, leuka, kumpikin poski) välttäen silmiä ja huulia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Potilaita pitää neuvoa pesemään kätensä lääkevalmisteen levittämisen jälkeen.
Kosmeettisia tuotteita voi käyttää, kun lääkevalmiste on kuivunut.
Jos ärsytystä ilmenee, potilasta tulee neuvoa käyttämään ei-komedogeenisia kosteusvoiteita tarpeen mukaan, käyttämään lääkettä harvemmin (esim. joka toinen päivä), keskeyttämään hoito väliaikaisesti tai lopettamaaan hoito kokonaan.
Vasta-aiheet
- Raskaus (ks. kohta Raskaus ja imetys)
- Raskautta suunnittelevat naiset (ks. kohta Raskaus ja imetys)
- Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Epiduo 0,3% / 2,5% geeliä ei tule levittää vaurioituneelle iholle, joka on joko rikkoutunut (haavat tai hiertymät), palanut auringossa tai jossa on ihottumaa.
Lääkettä ei saa joutua silmiin, huuliin, suuhun, sieraimiin tai limakalvoille. Jos valmistetta joutuu silmään, silmä on pestävä välittömästi lämpimällä vedellä.
Jos ilmenee reaktio, joka viittaa herkkyyteen mille tahansa valmisteen aineelle, Epiduo 0,3% / 2,5% geelin käyttö pitää lopettaa.
Liiallista altistumista auringonvalolle tai UV-säteilylle pitää välttää.
Epiduo 0,3% / 2,5% geeli ei saa joutua kosketuksiin värillisten materiaalien kanssa, kuten esimerkiksi hiusten tai värjättyjen kankaiden kanssa, koska se saattaa vaalentaa tai värjätä niitä.
Tämä lääkevalmiste sisältää 40 mg propyleeniglykolia (E1520) per gramma, joka vastaa 4 % w/w.
Tämä lääkevalmiste sisältää polysorbaatti 80 (E433), joka voi aiheuttaa allergisia reaktioita.
Epiduo 0,3% / 2,5% geelin tehoa ja turvallisuutta ei ole tutkittu potilailla, joilla on vaikea nodulaarinen tai syvä nodulokystinen akne. Koska vaikeaa nodulaarista/nodulokystistä aknea sairastavilla potilailla on suurentunut riski arpeutua pysyvästi aknevaurioiden vuoksi, näille potilaille ei suositella käytettäväksi Epiduo 0,3% / 2,5% geeliä, koska terapeuttinen vaste voi olla riittämätön.
Yhteisvaikutukset
Epiduo 0,3% / 2,5% geelillä ei ole tehty yhteisvaikutustutkimuksia.
Aikaisemman kokemuksen mukaan adapaleenilla tai bentsoyyliperoksidilla ei ole tunnettuja yhteisvaikutuksia muiden, mahdollisesti iholle annettavien ja samanaikaisesti Epiduo 0,3% / 2,5% geelin kanssa käytettävien lääkevalmisteiden kanssa. Kuitenkaan muita retinoideja tai bentsoyyliperoksidia tai näiden kanssa samalla tavoin vaikuttavia lääkevalmisteita ei pidä käyttää samanaikaisesti. Varovaisuutta tulee noudattaa, jos käytetään kuorivia, ärsyttäviä tai kuivattavia kosmeettisia aineita, sillä ne voivat lisätä ärsytystä lääkevalmisteen kanssa käytettyinä.
Adapaleenin imeytyminen ihmisen ihon läpi on vähäistä (ks. kohta Farmakokinetiikka), minkä takia yhteisvaikutukset systeemisesti käytettävien lääkevalmisteiden kanssa ovat epätodennäköisiä.
Bentsoyyliperoksidin penetraatio ihon läpi on vähäistä ja lääkeaine metaboloituu kokonaan bentsoehapoksi, joka eliminoituu nopeasti. Tämän vuoksi bentsoehapon yhteisvaikutukset systeemisten lääkevalmisteiden kanssa ovat epätodennäköisiä.
Raskaus ja imetys
Suun kautta otettavat retinoidit on yhdistetty synnynnäisiin epämuodostumiin. Kun paikallisesti käytettäviä retinoideja käytetään valmistetietojen mukaisesti, niiden systeemisen altistuksen oletetaan olevan vähäinen, sillä imeytyminen ihon kautta on minimaalista. Yksittäiset tekijät (kuten vaurioitunut iho tai valmisteen liikakäyttö) voivat kuitenkin suurentaa systeemistä altistusta.
Raskaus
Epiduo 0,3% / 2,5% geeli on vasta-aiheinen raskauden aikana ja raskautta suunnitellessa (ks. kohta Vasta-aiheet).
Ei ole olemassa tietoja tai on vain vähän tietoja adapaleenin paikallisesta käytöstä raskaana oleville naisille.
Eläinkokeissa on havaittu lisääntymistoksisuutta suurilla systeemisillä altistuksilla suun kautta annon jälkeen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Kliiniset kokemukset adapaleenin ja bentsoyyliperoksidin paikallisesta annosta raskauden aikana ovat rajalliset.
Jos potilas käyttää valmistetta raskauden aikana tai tulee raskaaksi hoidon aikana, hoito on lopetettava.
Imetys
Tutkimuksia Epiduo 0,3% / 2,5% geelin kulkeutumisesta eläimen tai ihmisen maitoon iholle annon jälkeen ei ole tehty. Saatavilla oleva farmakokineettinen aineisto on osoittanut, että rotilla suun kautta tai suoneen annettu adapaleeni imeytyy maitoon.
Imeväiseen kohdistuvia riskejä ei voida poissulkea.
On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Epiduo 0,3% / 2,5% geelihoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Jotta lapsi ei joutuisi kosketuksiin geelin kanssa, Epiduo 0,3% / 2,5% geelin levittämistä rintakehän alueelle pitää välttää, jos sitä käytetään imetysaikana.
Hedelmällisyys
Epiduo 0,3% / 2,5% geelillä ei ole tehty ihmisen hedelmällisyystutkimuksia.
Rotilla tehdyissä lisääntymistutkimuksissa ei kuitenkaan ole havaittu adapaleenin tai bentsoyyliperoksidin vaikutuksia hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Epiduo 0,3% / 2,5% geelillä ei ole haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Noin 10 %:lla potilaista voidaan odottaa esiintyvän haitallisia ihoreaktioita.
Epiduo 0,3% / 2,5% geelihoitoon tyypillisesti liittyvät haittavaikutukset ovat lieviä tai kohtalaisia antopaikan reaktioita, kuten ihoärsytys, jonka oireita ovat pääasiassa hilseily, kuivuus, punoitus ja polttelu/pistely. Suositus on käyttää kosteusvoidetta, vähentää lääkkeen käyttötiheyttä tilapäisesti joka toiseen päivään, tai keskeyttää hoito tilapäisesti kunnes voidaan palata kerran päivässä annosteluun.
Näitä reaktioita esiintyy tavallisesti hoidon alussa ja ne yleensä lievittyvät ajan myötä.
Haittavaikutusten yhteenvetotaulukko
Epiduo 0,3% / 2,5% geelin vehikkelikontrolloiduissa faasi 3:n kliinisissä tutkimuksissa ilmoitetut haittavaikutukset on luokiteltu elinjärjestelmittäin ja esiintyvyyden mukaan seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, <1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000), tuntematon (koska saatavissa oleva tieto ei riitä arviointiin) (ks. taulukko 1):
Taulukko 1. Haittavaikutukset
| Elinjärjestelmä | Yleisyys | Haittavaikutukset |
| Silmät | Melko harvinainen | Silmäluomien eryteema |
| Tuntematon* | Silmäluomien turvotus | |
| Immuunijärjestelmä | Tuntematon* | Anafylaktinen reaktio |
| Hermosto | Melko harvinainen | Parestesia (kihelmöinti antopaikassa) |
| Hengityselimet, rintakehä ja välikarsina | Tuntematon* | Ahtauden tunne kurkussa, hengenahdistus |
| Iho ja ihonalainen kudos | Yleinen | Atooppinen ihottuma, ekseema, polttelu, ihoärsytys, ihon punoitus, ihon kesiminen (hilseily) |
| Melko harvinainen | Kuiva iho, kutina, ihottuma | |
| Tuntematon* | Allerginen kosketusihottuma, kasvojen turvotus, ihokipu (pistävä kipu) ja rakkulat, ihon värimuutokset (hyperpigmentaatio ja hypopigmentaatio), urtikaria, antokohdan palovamma** |
* Markkinoille tulon jälkeinen turvallisuusseuranta sen jälkeen, kun Epiduo 0,1% / 2,5% geeli tuli markkinoille maailmanlaajuisesti, tuntemattoman suuruisesta käyttäjäjoukosta
** Useimmat ”antokohdan palovammat” olivat pinnallisia palovammoja, mutta on ilmoitettu tapauksia, joissa on ollut reaktiona toisen asteen palovamma tai vaikea palovamma.
Epiduo 0,3% / 2,5% geeli aiheutti ihoon liittyviä haittavaikutuksia useammin kuin Epiduo geeli (adapaleeni 0,1% / bentsoyyliperoksidi 2,5%) vehikkeliin verrattuna. Pivotaalitutkimuksessa (ks. kohta Farmakodynamiikka), yhdistetyn tutkimusaineiston Epiduo 0,3% / 2,5% geelillä hoidetuista henkilöistä 9,2%:lla oli ihoon liittyviä haittavaikutuksia, Epiduo geelillä hoidetuista 3,7%:lla ja vehikkeliryhmässä 2,9%:lla.
Joidenkin yllä mainittujen lisäksi muita haittavaikutuksia on ilmoitettu aikaisemmin hyväksytyn adapaleenin ja bentsoyyliperoksidin yhdistelmävalmisteen, Epiduo geelin (adapaleeni 0,1% / bentsoyyliperoksidi 2,5%) käytön yhteydessä:
-
Kliiniset tutkimukset:
Muita Epiduo geelin kliinisissä tutkimuksissa ilmoitettuja haittavaikutuksia ovat ärtynyt kosketusihottuma (yleinen) ja auringonpolttama (melko harvinainen).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Epiduo 0,3% / 2,5% geeli on tarkoitettu käytettäväksi vain kerran päivässä iholle. Epiduo 0,3% / 2,5% geelin liiallinen käyttö voi aiheuttaa vaikeaa ärsytystä. Tässä tapauksessa keskeytä hoito ja odota, että iho on toipunut.
Jos valmistetta niellään vahingossa, asianmukaista oireenmukaista hoitoa on annettava.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Ulkoisesti käytettävät aknelääkkeet, ATC-koodi: D10AD53.
Vaikutusmekanismi ja farmakodynaamiset vaikutukset
Epiduo 0,3% / 2,5% geelissä on kaksi vaikuttavaa ainetta, joilla on erilaiset, mutta toisiaan täydentävät, vaikutusmekanismit.
- Adapaleeni: Adapaleeni on kemiallisesti stabiili naftoehapon johdannainen, jolla on retinoidien kaltainen vaikutus. Biokemialliset ja farmakologiset tutkimukset ovat osoittaneet, että adapaleeni vaikuttaa acne vulgariksen patogeneesiin: se moduloi voimakkaasti solujen erilaistumista ja keratinisaatiota, ja sillä on anti-inflammatorisia ominaisuuksia. Adapaleeni sitoutuu spesifisiin retinoiinihappotumareseptoreihin. Tämänhetkiset tiedot viittaavat siihen, että iholle käytetty adapaleeni normalisoi follikkeliepiteelisolujen erilaistumista, mikä vähentää mikrokomedoiden muodostumista. Adapaleeni estää ihmisen liuskatumaisten leukosyyttien kemotaktisia ja kemokineettisiä vasteita in vitro -tutkimusmalleissa. Se estää myös arakidonihapon metaboloitumista tulehduksen välittäjäaineiksi. In vitro -tutkimukset ovat osoittaneet, että adapaleeni estää AP-1-tekijöitä ja Tollin kaltaisten reseptoreiden 2 ilmentymistä. Tämä viittaa siihen, että adapaleeni vähentää aknen soluvälitteistä tulehduksellista komponenttia.
- Bentsoyyliperoksidi:Bentsoyyliperoksidin on osoitettu olevan antimikrobinen, ja akneihon hiusfollikkeleissa epätavallisen runsaasti esiintyvä Cutibacterium acnes on sille erityisen herkkä. Bentsoyyliperoksidin vaikutusmekanismin on selitetty liittyvän sen suureen lipofiilisyyteen, minkä ansiosta se pääsee orvaskeden läpi hiusfollikkelin bakteerien ja keratinosyyttien solumembraaneihin. Bentsoyyliperoksidi on hyvin tehokas laajaspektrinen antibakteerinen aine acne vulgariksen hoidossa. Sen on osoitettu vaikuttavan bakteriosidisesti tuottamalla vapaita radikaaleja, jotka hapettavat proteiineja ja muita bakteerien seinämän solujen olennaisia osia. Bentsoyyliperoksidin pienin inhibitorinen pitoisuus on bakteriosidinen ja sen on osoitettu tehoavan antibioottiherkkiin ja antibiooteille resistentteihin C. acnes -kantoihin. Lisäksi bentsoyyliperoksidilla on havaittu eksfoliatiivisia ja keratolyyttisiä ominaisuuksia.
Kliininen teho ja turvallisuus
Kerran päivässä annostellun Epiduo 0,3% / 2,5% geelin turvallisuus ja tehokkuus acne vulgariksen hoidossa arvioitiin 12 viikon kliinisessä satunnaistetussa, kaksoissokkoutetussa, kontrolloidussa monikeskustutkimuksessa, jossa Epiduo 0,3% / 2,5% geeliä verrattiin geelin vehikkeliin 503 aknepotilaalla. Tutkimuksessa hoidettiin 217 potilasta Epiduo 0,3% / 2,5% geelillä, 217 potilasta adapaleeni 0,1% / bentsoyyliperoksidi 2,5% geelillä ja 69 potilasta vehikkeligeelillä.
Tehokkuuskriteerit olivat:
- Onnistumisprosentti, joka määritettiin niiden potilaiden prosenttiosuudeksi, jotka luokiteltiin viikolla 12 ’Parantuneiksi’ tai ’Lähes parantuneiksi’ IGA (Investigators’s Global Assessment) -asteikossa nähtyyn kahden portaan paranemiseen perustuen. IGA:n arvio ’Parantunut’ vastasi tilannetta, missä iho on terve ilman tulehduksellisia tai ei-tulehduksellisia leesioita. IGA:n ’Lähes parantunut’ vastasi tilannetta, jossa oli vähän erillisiä komedoita ja harvoja pieniä papuloita.
- Absoluuttisen muutoksen keskiarvo lähtötasosta viikolla 12 sekä tulehduksellisten leesioiden että ei-tulehduksellisten leesioiden määrissä.
Lähtötasolla 50%:lla tutkimukseen otetuista potilaista akne oli arvioitu ”keskivaikeaksi” (IGA=3) ja 50%:lla “vaikeaksi” (IGA=4). Koko tutkimuspopulaation osalta sallittujen nodulusten määrä oli korkeintaan kaksi. Henkilöillä oli keskimäärin 98 leesiota (vaihteluväli: 51-226), joista tulehduksellisten leesioiden määrän keskiarvo oli 38 (vaihteluväli: 20-99) ja ei-tulehduksellisten leesioiden määrän keskiarvo oli 60 (vaihteluväli: 30-149). Potilaiden ikä oli 12-57 vuotta (keskiarvo: 19,6 vuotta), ja potilaista 273 (54,3%) oli 12-17 -vuotiaita. Miehiä (47,7%) ja naisia (52,3%) otettiin tutkimukseen yhtä paljon.
Tässä pivotaalitutkimuksessa 55,2 %:lla vaikeaa aknea sairastavista potilaista oli aknea vartalolla. Potilaat hoitivat kasvoja ja muita aknealueita vartalolla tarpeen mukaan kerran päivässä iltaisin.
Tilastollisia analyysejä tehtiin asteittain tutkimuksen tulosten vertaamiseksi ja tulkitsemiseksi:
- Epiduo 0,3% / 2,5% geeli vs. vehikkeligeeli koko potilasaineistossa, jossa oli keskivaikeaa ja vaikeaa aknea sairastavia potilaita (IGA=3 ja IGA=4).
- Epiduo 0,3% / 2,5% geeli vs. vehikkeligeeli vaikeaa aknea sairastavien potilaiden (IGA=4) alaryhmässä.
Taulukossa 2 esitetään tulokset tehosta koko aineistossa, sekä keskivaikeaa että vaikeaa aknea sairastavien potilaiden hoidossa.
Taulukko 2: Kliininen teho koko aineistossa: potilaat, joilla oli kohtalainen ja vaikea acne vulgaris viikolla 12 (yhdistetty IGA = 3 ja 4, MI, ITT populaatio)
| Tehon mittarit | Epiduo 0,3 % / 2,5 % geeli (N = 217) | Adapaleeni 0,1 % / bentsoyyliperoksidi 2,5 % geeli (N = 217)a | Vehikkeligeeli (N = 69) |
| Onnistuminen (vähintään 2 asteen paraneminen ja IGA “parantunut” tai “lähes parantunut”) | 33,7 %b | 27,3 % | 11,0 % |
| Tulehduksellisten leesioiden muutos, vähenemisen keskiarvo (prosenttia) | 27,8b (68,7 %) | 26,5 (69,3 %) | 13,2 (39,2 %) |
| Ei-tulehduksellisten leesioiden muutos, vähenemisen keskiarvo (prosenttia) | 40,5b (68,3 %) | 40,0 (68,0 %) | 19,7 (37,4 %) |
MI = moninkertainen imputointi; ITT = Intent-to-treat
a) Tätä tutkimusta ja sen voimaa ei ollut suunniteltu vertaamaan virallisesti Epiduo 0,3% / 2,5%:n ja miedomman adapaleeni 0,1% / bentsoyyliperoksidi 2,5%:n tehoa, eikä miedomman adapaleeni 0,1% / bentsoyyliperoksidi 2,5%:n ja vehikkeligeelin tehoa
b) p < 0,001 vs. vehikkeli
Ensisijaisen tehoanalyysin tulokset vaikeaa aknea sairastavilla on esitetty taulukossa 3.
Taulukko 3: Kliininen teho potilailla, joilla oli vaikea acne vulgaris (IGA = 4, MI, ITT populaatio)
| Tehon mittarit | Epiduo 0,3 % / 2,5 % geeli (N = 106) | Adapaleeni 0,1 % / bentsoyyliperoksidi 2,5% geeli (N = 112) | Vehikkeligeeli (N = 34) |
| Onnistuminen (vähintään 2 asteen paraneminen ja IGA “parantunut” tai “lähes parantunut”) | 31,9 %a | 20,5 % | 11,8 % |
| Tulehduksellisten leesioiden muutos, vähenemisen keskiarvo (prosenttia) | 37,3b (74,4 %) | 30,2 (68 %) | 14,3 (33,0 %) |
| Ei-tulehduksellisten leesioiden muutos, vähenemisen keskiarvo (prosenttia) | 46,3b (72,1 %) | 43,9 (68,4 %) | 17,8 (30,8 %) |
MI = moninkertainen imputointi; ITT= Intent-to-treat
a) p = 0,029 vs. vehikkeli
b) p < 0,001 vs. vehikkeli
Adapaleeni 0,1% / bentsoyyliperoksidi 2,5% geeli oli tässä tutkimuksessa vertailuhoitona. Henkilöillä, joilla akne oli arvioitu ”keskivaikeaksi” (IGA aste 3), Epiduo 0,3% / 2,5% geeli ei ollut vertailuhoitoa tehokkaampi. ”Vaikeaa” aknea (IGA aste 4) sairastavien ryhmän analyysissä Epiduo 0,3% / 2,5% geeli oli tehokkaampi kuin vehikkeli, hoitoeron ollessa 20,1% (31,9% vs. 11,8%; 95% CI: [6,0%, 34,2%)], p = 0,029), kun taas vertailuhoito ei eronnut vehikkelistä (hoitoero vehikkeliin verrattuna 8,8%).
Epiduo 0,3 % / 2,5 % geelin tehoa aknearpien hoidossa selvitettiin OSCAR-tutkimuksessa. Kyseessä oli satunnaistettu, tutkijan suhteen sokkoutettu, vehikkelikontrolloitu tutkimus, jossa vertailtiin tutkittavan kasvojen oikean ja vasemman puoliskon eroa. Tutkittavat olivat 16–35-vuotiaita miehiä ja naisia (n = 67), joilla oli keskivaikea tai vaikea kasvojen acne vulgaris. Akneleesioiden lukumäärä oli keskimäärin 40 (18 tulehduksellista leesiota, 22 ei-tulehduksellista leesiota) kummallakin kasvopuoliskolla. Tutkittavien merkittävällä enemmistöllä (93 %) akne arvioitiin keskivaikeaksi (IGA). Akneleesioita oli tasaisesti molemmilla kasvopuoliskoilla, kummallakin puoliskolla 12 arpea, joiden pituus oli valtaosin 2–4 mm. Enemmistöllä tutkittavista arvet olivat IGA-arvion mukaan lieviä (63 %), ja noin 30 %:lla ne olivat keskivaikeita.
Tutkimukseen otettiin mukaan 16–35-vuotiaita miehiä ja naisia, joiden ihon fototyyppi oli Fitzpatrickin asteikolla I–IV.
Suurin osa tutkimukseen mukaan otetuista henkilöistä oli naisia (65,7 %) ja rodultaan pääasiassa valkoisia (86,6 %) ja loput aasialaisia (13.4%), etnistä taustaa ei dokumentoitu. Yleisimmät ihon fototyypit olivat II (47,8 %) ja III (34,3 %). Loput olivat fototyyppiä IV (13,4 %) ja I (4,5 %).
Kaikki tutkimukseen soveltuneet henkilöt satunnaistettiin saamaan kerran vuorokaudessa yöksi 24 viikon ajan Epiduo 0,3 % / 2,5 % geeliä kasvojen toiselle puoliskolle ja vehikkeligeeliä toiselle. Ensisijainen päätetapahtuma oli atrofisten aknearpien lukumäärä per kasvopuolisko viikolla 24.
Ensisijaisen päätetapahtuman analyysi osoitti, että lääkehoito vähensi aknearpien lukumäärää (ks. taulukko 4).
Taulukko 4: Aknearpien lukumäärä (hoitoaikeen mukaan [ITT] / puuttuvat arvot korvattu potilaan viimeisimmällä arvolla [LOCF])
| Aknearpien lukumäärä (ITT/LOCF) | Epiduo 0,3 % / 2,5 % geeli | Vehikkeligeeli | Hoitojen ero | Tilastollinen merkitsevyys |
keskiarvo ± keskihajonta mediaani (Q1, Q3) (min, max) | 9,5 ± 5,5 8,0 (6,0; 12,0) (0, 27) | 13,3 ± 7,4 13,0 (8,0; 19,0) (0, 36) | -3,7 ± 4,4 -3,0 (-7,0; 0,0) (-16, 3) | p < 0,0001 |
Epiduo 0,3 % / 2,5 % geeli vähensi ensisijaisesti 2–4 mm:n arpia (Epiduo 0,3 % / 2,5 % geelin keskiarvo: 9,0 ± 5,4; vehikkeligeelin keskiarvo: 12,1 ± 7,0; keskimääräinen ero hoidon ja vehikkelin välillä: -3,1 ± 4,1), kun taas > 4 mm:n arpien väheneminen oli vähäisempää (Epiduo 0,3 % / 2,5 % geelin keskiarvo: 0,6 ± 0,8; vehikkeligeelin keskiarvo: 1,2 ± 1,9; keskimääräinen ero hoidon ja vehikkelin välillä: -0,6 ± 1,5).
Kuva 1 osoittaa käynneittäin atrofisten aknearpien lukumäärän muutoksen Epiduo 0,3 % / 2,5 % geelillä ja vehikkeligeelillä hoidetuilla kasvopuoliskoilla.
Kuva 1
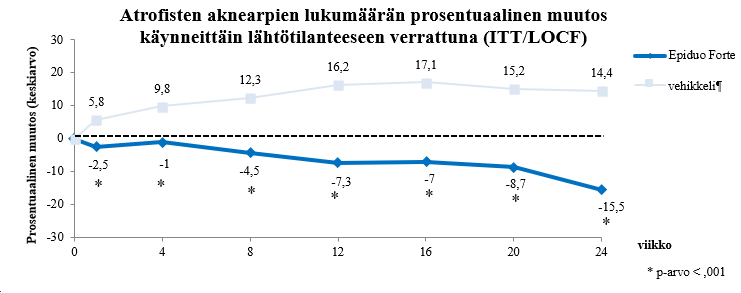
* nimellinen p-arvo, ei mukautettu toistettuihin analyyseihin
Farmakokinetiikka
Imeytyminen
Epiduo 0,3% / 2,5% geelillä tehtiin farmakokineettinen tutkimus 26:lla nuorella ja aikuisella (12-33 vuotiaita), joilla oli vaikea acne vulgaris. Tutkittavia hoidettiin levittämällä geeliä kaikille mahdollisesti sairastuneille alueille kerran päivässä 4 viikon ajan. Epiduo 0,3% / 2,5% geeliä levitettiin keskimäärin 2,3 g/päivä (vaihteluväli 1,6-3,1 g/päivä) ohut kerros kasvoille, hartioille, rintakehän ja selän yläosaan. Neljän viikon hoidon jälkeen 16 henkilöllä (62%) oli mitattavia adapaleenin plasmapitoisuuksia, jotka ylittivät määritysrajan (LOQ 0,1 ng/ml) ja joiden Cmax-arvojen keskiarvo oli 0,16 ± 0,08 ng/ml ja AUC0-24h-arvojen keskiarvo oli 2,49 ± 1,21 ng.h/ml. Eniten altistuneella henkilöllä adapaleenin Cmax-arvo oli 0,35 ng/ml ja AUC0-24h-arvo 6,41 ng.h/ml.
Epiduo-geelillä ja Epiduo 0,3% / 2,5% geelillä tehdyt farmakokineettiset tutkimukset ovat osoittaneet, että bentsoyyliperoksidi ei vaikuta adapaleenin imeytymiseen ihon läpi.
Bentsoyyliperoksidin penetraatio ihon läpi on vähäistä; iholle levitettynä se muuttuu kokonaan nopeasti eliminoituvaksi bentsoehapoksi.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, geenitoksisuutta, fototoksisuutta sekä karsinogeenisuutta koskevien prekliinisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Adapaleenin reproduktiotoksisuutta koskevat tutkimukset on tehty rotalla ja kanilla suun ja ihon kautta. Teratogeenisuus on osoitettu suurilla systeemisillä altistuksilla (suun kautta vähintään 25 mg/kg/vrk). Pienemmillä altistuksilla (annos iholle 6 mg/kg/vrk) ilmeni muutoksia kylkiluiden ja nikamien määrässä.
Korkeintaan 13 viikkoa kestäneet Epiduon ja Epiduo 0,3% / 2,5% geelin paikallista sietokykyä koskevat tutkimukset ja toistuvan iholle annon toksisuustutkimukset tehtiin rotalla, koiralla ja/tai minisialla, ja ne osoittivat paikallista ärsytystä ja herkistymismahdollisuutta, kuten bentsoyyliperoksidia sisältävältä yhdistelmävalmisteelta voidaan odottaa. Systeeminen altistus adapaleenille yhdistelmävalmisteen toistuvan iholle annon jälkeen on eläimillä hyvin pieni, yhdenmukaisesti kliinisen farmakokineettisen tiedon kanssa. Bentsoyyliperoksidi muuttuu iholla nopeasti ja kokonaan bentsoehapoksi ja imeytymisen jälkeen se eliminoituu virtsaan ja aiheuttaa vain vähäisen systeemisen altistuksen.
Adapaleenin reproduktiotoksisuutta hedelmällisyyden suhteen tutkittiin rotalla suun kautta annettaessa.
Lisääntymiseen ja hedelmällisyyteen, F1-sukupolven poikasten selviytymiseen, kasvuun ja kehitykseen vieroitukseen asti ja myöhempään lisääntymiskykyyn kohdistuvia haittavaikutuksia ei havaittu adapaleenihoidon jälkeen, kun suun kautta annettava annos oli enintään 20 mg/kg/vrk.
Rotalla tehdyissä reproduktio- ja kehitystoksisuutta selvittävissä tutkimuksissa ryhmät altistettiin saamaan bentsoyyliperoksidia suun kautta enintään 1 000 mg/kg/vrk (5 ml/kg). Tutkimuksissa bentsoyyliperoksidi ei ollut teratogeeninen eikä vaikuttanut lisääntymiskykyyn, kun annos oli enintään 500 mg/kg/vrk.
Ympäristöön kohdistuvien riskien arviointi
Ympäristöön kohdistuvia riskejä arvioivat tutkimukset ovat osoittaneet, että adapaleeni voi olla hyvin hitaasti hajoavaa ja myrkyllistä ympäristölle (ks. kohta Käyttö- ja käsittelyohjeet).
Ympäristöön kohdistuvia riskejä arvioivat tutkimukset ovat osoittaneet, että adapaleenista voi aiheutua riski vesistöille.
Farmaseuttiset tiedot
Apuaineet
Dinatriumedetaatti
Dokusaattinatrium
Glyseroli
Poloksameeri
Propyleeniglykoli (E1520)
Simulgel 600PHA (akryyliamidin ja natriumakryloyylidimetyylitauraatin kopolymeeri, isoheksadekaani, polysorbaatti 80 (E433), sorbitaanioleaatti)
Puhdistettu vesi
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
2 vuotta.
Pumppu:
Ensimmäisen avaamisen jälkeen: 6 kuukautta.
Tuubi:
Ensimmäisen avaamisen jälkeen: 7 päivää.
Säilytys
Säilytä alle 25 °C.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
EPIDUO geeli
0,3 %/2,5 % (L:ei) 30 g (42,04 €), 60 g (54,93 €)
PF-selosteen tieto
Epiduo 0,3% / 2,5% geeli on saatavilla kahden eri pakkaustyypin pakkauksissa:
Tuubi:
2 g:n ja 5 g:n muovituubit, joilla HD-polyeteenirakenne ja HD-polyeteenistä valmistettu pää, joka on suljettu polypropeenisella kierrekorkilla.
Moniannospakkaus, ilmattomalla pumpulla varustettu:
15 g:n, 30 g:n, 45 g:n ja 60 g:n polypropeenistä ja HD-polyeteenistä tai polypropeenistä, HD-polyeteenistä ja VLD-polyeteenistä tehdyt moniannospakkaukset, joissa on ilmaton pumppu ja napsautettava korkki.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai hyvin haalean keltainen läpinäkymätön geeli.
Käyttö- ja käsittelyohjeet
Tästä lääkevalmisteesta voi aiheutua riski ympäristölle (ks. kohta Prekliiniset tiedot turvallisuudesta).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
EPIDUO geeli
0,3 %/2,5 % 30 g, 60 g
- Ei korvausta.
ATC-koodi
D10AD53
Valmisteyhteenvedon muuttamispäivämäärä
07.07.2025
Yhteystiedot
Seminariegatan 21
SE-752 28 Uppsala
Sverige
+46 18 444 0330
www.galdermanordic.com
nordic@galderma.com
