TRECONDI infuusiokuiva-aine, liuosta varten 1 g, 5 g
Vaikuttavat aineet ja niiden määrät
Trecondi 1 g infuusiokuiva-aine, liuosta varten
Yksi injektiopullo kuiva-ainetta sisältää 1 g treosulfaania.
Trecondi 5 g infuusiokuiva-aine, liuosta varten
Yksi injektiopullo kuiva-ainetta sisältää 5 g treosulfaania.
1 ml kohdan Käyttö- ja käsittelyohjeet mukaisesti käyttökuntoon saatettua infuusioliuosta sisältää 50 mg treosulfaania.
Lääkemuoto
Infuusiokuiva-aine, liuosta varten.
Kliiniset tiedot
Käyttöaiheet
Treosulfaani on tarkoitettu esihoidoksi yhdessä fludarabiinin kanssa ennen allogeenista hematopoieettisten kantasolujen siirtoa aikuispotilaille ja yli yhden kuukauden ikäisille pediatrisille potilaille, joilla on pahanlaatuinen tai hyvänlaatuinen sairaus.
Ehto
Valmistetta saa antaa vain allogeeniseen hematopoieettisten kantasolujen siirtoon ja sitä edeltävään esihoitoon perehtyneen lääkärin valvonnassa.
Annostus ja antotapa
Treosulfaania saa antaa vain allogeeniseen hematopoieettisten kantasolujen siirtoon ja sitä edeltävään esihoitoon perehtyneen lääkärin valvonnassa.
Annostus
Aikuiset, joilla on pahanlaatuinen sairaus
Treosulfaania annetaan yhdessä fludarabiinin kanssa.
Suositeltu annos ja annosaikataulu:
- Treosulfaani: 10 g kehon pinta-alan neliömetriä kohden vuorokaudessa 2 tunnin kestoisena infuusiona laskimoon kolmena peräkkäisenä päivänä (päivät ‑4, ‑3, ‑2) ennen kantasolujen infusointia (päivä 0). Treosulfaanin kokonaisannos on 30 g/m².
- Fludarabiini: 30 mg kehon pinta-alan neliömetriä kohden vuorokaudessa 0,5 tunnin kestoisena infuusiona laskimoon viitenä peräkkäisenä päivänä (päivät ‑6, ‑5, ‑4, ‑3, ‑2) ennen kantasolujen infusointia (päivä 0). Fludarabiinin kokonaisannos on 150 mg/m².
- Treosulfaani tulee antaa ennen fludarabiinia päivinä ‑4, ‑3, ‑2 (FT10-hoito-ohjelma).
Aikuiset, joilla on hyvänlaatuinen sairaus
Treosulfaania annetaan yhdessä fludarabiinin kanssa joko tiotepan kanssa tai ilman tiotepaa.
Suositeltu annos ja annosaikataulu:
- Treosulfaani: 14 g kehon pinta-alan neliömetriä kohden vuorokaudessa 2 tunnin kestoisena infuusiona laskimoon kolmena peräkkäisenä päivänä (päivät ‑6, ‑5, ‑4) ennen kantasolujen infusointia (päivä 0). Treosulfaanin kokonaisannos on 42 g/m².
- Fludarabiini: 30 mg kehon pinta-alan neliömetriä kohden vuorokaudessa 0,5 tunnin kestoisena infuusiona laskimoon viitenä peräkkäisenä päivänä (päivät ‑7, ‑6, ‑5, ‑4, ‑3) ennen kantasolujen infusointia (päivä 0). Fludarabiinin kokonaisannos on 150 mg/m².
- Treosulfaani tulee antaa ennen fludarabiinia päivinä ‑6, ‑5, ‑4 (FT14-hoito-ohjelma).
- Tiotepa: 5 mg painokiloa kohden kaksi kertaa vuorokaudessa, kahtena 2–4 tunnin kestoisena infuusiona laskimoon päivänä ‑2 ennen kantasolujen infusointia (päivä 0).
Erityisryhmät
Yli 1 kuukauden ikäiset pediatriset potilaat
Treosulfaania annetaan yhdessä fludarabiinin kanssa, joko tiotepan kanssa (tehostettu hoito-ohjelma; FT10‑14TT-hoito-ohjelma) tai ilman tiotepaa (FT10‑14-hoito-ohjelma).
Suositeltu annos ja annosaikataulu:
- Treosulfaani: 10–14 g kehon pinta-alan neliömetriä kohden vuorokaudessa 2 tunnin kestoisena infuusiona laskimoon kolmena peräkkäisenä päivänä (päivät ‑6, ‑5, ‑4) ennen kantasolujen infusointia (päivä 0). Treosulfaanin kokonaisannos on 30–42 g/m².
Treosulfaaniannos tulee mukauttaa potilaan kehon pinta-alaan seuraavasti (ks. kohta Farmakokinetiikka):
Kehon pinta-ala (m²) | Treosulfaaniannos (g/m²) |
< 0,4 | 10,0 |
≥ 0,4 – < 0,9 | 12,0 |
≥ 0,9 | 14,0 |
- Fludarabiini: 30 mg kehon pinta-alan neliömetriä kohden vuorokaudessa 0,5 tunnin kestoisena infuusiona laskimoon viitenä peräkkäisenä päivänä (päivät ‑7, ‑6, ‑5, ‑4, ‑3) ennen kantasolujen infusointia (päivä 0). Fludarabiinin kokonaisannos on 150 mg/m².
- Treosulfaani tulee antaa ennen fludarabiinia.
- Tiotepa (tehostettu hoito-ohjelma, 5 mg painokiloa kohden) kaksi kertaa vuorokaudessa, kahtena 2–4 tunnin kestoisena infuusiona laskimoon päivänä ‑2 ennen kantasolujen infusointia (päivä 0).
Treosulfaanin turvallisuutta ja tehoa alle 1 kuukauden ikäisten lasten hoidossa ei ole vielä varmistettu.
Iäkkäät potilaat
Annosta ei tarvitse säätää millekään iäkkäiden potilaiden alaryhmälle.
Munuaisten ja maksan ja vajaatoiminta
Annosta ei tarvitse säätää lievän tai keskivaikean vajaatoiminnan vuoksi, mutta treosulfaani on vasta-aiheinen vaikeaa vajaatoimintaa sairastaville potilaille (ks. kohta Vasta-aiheet).
Antotapa
Treosulfaani annetaan laskimoon kahden tunnin kestoisena infuusiona.
Ennen lääkkeen käsittelyä tai antoa huomioon otettavat varotoimet
Treosulfaanin käsittelyn aikana on vältettävä sisään hengittämistä sekä iho- ja limakalvokontaktia. Raskaana olevan henkilöstön ei pidä käsitellä sytotoksisia aineita.
Laskimoon annossa on käytettävä turvallista tekniikkaa ekstravasaation välttämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Ks. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen saattamisesta käyttökuntoon ennen lääkkeen antoa.
Vasta-aiheet
- Yliherkkyys vaikuttavalle aineelle
- Aktiivinen kontrolloimaton infektiotauti
- Samanaikainen vaikea sydämen, keuhkojen, maksan tai munuaisten vajaatoiminta
- Fanconin anemia tai muu DNA-katkosten korjaukseen liittyvä häiriö
- Raskaus (ks. kohta Raskaus ja imetys)
- Elävän rokotteen anto
Varoitukset ja käyttöön liittyvät varotoimet
Myelosuppressio
Treosulfaania sisältävän esihoidon toivottu hoitovaikutus on perusteellinen myelosuppressio ja pansytopenia, ja nämä vaikutukset esiintyvät kaikilla potilailla. Siksi on suositeltavaa seurata verisolumääriä tiheästi, kunnes hematopoieettinen järjestelmä on toipunut.
Vaikean neutropenian aikana infektioriski on tavallista suurempi (neutropeenisen jakson mediaanipituus on aikuisilla 14–17,5 vuorokautta ja pediatrisilla potilailla 20–22 vuorokautta). Profylaktisen tai empiirisen infektiolääkityksen (bakteeri-, virus- ja sieni-infektioihin) käyttöä on siksi harkittava. Kasvutekijöitä (G‑CSF, GM‑CSF), verihiutalesiirtoja ja/tai punasolusiirtoja on annettava tarpeen mukaan.
Sekundaariset maligniteetit
Sekundaariset maligniteetit ovat hyvin dokumentoituja pitkän aikavälin komplikaatioita allogeenisen hematopoieettisten kantasolujen siirron saaneilla potilailla. Treosulfaanin osuutta niiden esiintymiseen ei tunneta. Potilaalle tulee kertoa sekundaarisen maligniteetin mahdollisesta riskistä. Kansainvälinen syöpätutkimusjärjestö (IARC) on ihmisiä koskevien tietojen perusteella luokitellut treosulfaanin karsinogeeniksi ihmiselle.
Limakalvotulehdus
Suun limakalvon tulehdus (mukaan lukien vaikea tulehdus) on hyvin yleinen treosulfaania sisältävän esihoidon ja sen jälkeisen allogeenisen hematopoieettisten kantasolujen siirron haittavaikutus (ks. kohta Haittavaikutukset). Limakalvotulehdusta ehkäiseviä toimenpiteitä suositellaan (esim. paikallisesti käytettävät mikrobilääkkeet, limakalvoa suojaavat valmisteet, jää ja riittävä suuhygienia).
Rokotteet
Elävien, heikennettyjä taudinaiheuttajia sisältävien rokotteiden samanaikaista käyttöä ei suositella.
Hedelmällisyys
Treosulfaani voi heikentää hedelmällisyyttä. Siksi treosulfaanihoitoa saavia miehiä on neuvottava olemaan siittämättä lasta hoidon aikana ja hoidon päättymisen jälkeisten 6 kuukauden aikana sekä hakeutumaan neuvontaan koskien sperman pakastamista ennen hoitoa treosulfaanihoidon aiheuttaman pysyvän hedelmättömyyden riskin vuoksi.
Munasarjojen suppressio, kuukautisten poisjääminen ja vaihdevuosioireet ovat yleisiä naispotilailla, jotka eivät vielä ole vaihdevuosi-iässä (ks. kohta Raskaus ja imetys).
Pediatriset potilaat
Kouristuskohtaukset
Kouristuskohtauksia on yksittäisissä tapauksissa raportoitu (≤4 kuukauden ikäisillä) vauvoilla, joilla oli primaarinen immuunipuutos treosulfaanin ja fludarabiinin tai treosulfaanin ja syklofosfamidin yhdistelmällä annetun esihoidon jälkeen. Siksi ≤4 kuukauden ikäisiä vauvoja on seurattava neurologisten haittavaikutusten merkkien varalta. Vaikka syy-yhteydestä treosulfaaniin ei ole varmuutta, profylaktista hoitoa klonatsepaamilla voidaan harkita alle 1‑vuotiaille lapsille.
Hengityselimet, rintakehä ja välikarsina
Iän ja hengityselintoksisuuden välillä havaittiin merkitsevä yhteys pediatrisilla potilailla, jotka saivat treosulfaania sisältävää esihoitoa.
Alle yhden vuoden ikäisillä lapsilla (joilla oli pääasiassa hyvänlaatuisia sairauksia, etenkin immuunipuutos) esiintyi muita enemmän asteen III/IV hengityselintoksisuutta, mahdollisesti jo ennen esihoidon aloittamista saatujen keuhkoinfektioiden vuoksi.
Vaippaihottuma
Treosulfaanin virtsaan erittymisen vuoksi pienillä lapsilla saattaa esiintyä vaippaihottumaa. Vaippaa tulee tämän takia vaihtaa tiheään treosulfaani-infuusion jälkeisten 6–8 tunnin aikana.
Ekstravasaatio
Treosulfaanin katsotaan olevan ärsyttävä aine. Laskimoon annossa on käytettävä turvallista tekniikkaa. Ekstravasaatiota epäiltäessä on ryhdyttävä yleisiin turvallisuustoimenpiteisiin. Mitään erityistä toimenpidettä ei voida todistettavasti suositella.
Yhteisvaikutukset
Treosulfaanin ei havaittu aiheuttavan yhteisvaikutuksia suuriannoksisessa solunsalpaajahoidossa.
Yksityiskohtaiset in vitro -tutkimukset eivät täysin poissulkeneet mahdollisia yhteisvaikutuksia treosulfaanin ja CYP3A4:n, CYP2C19:n tai P-glykoproteiinin (P-gp:n) substraattien välillä silloin, kun pitoisuudet plasmassa ovat suuria. Fysiologiaan perustuva farmakokineettinen mallinnus ennusti heikon (AUC-suhde ≥ 1,25 ja < 2) tai kohtalaisen (AUC-suhde ≥ 2 ja < 5) yhteisvaikutuksen CYP3A4:n kanssa, heikon yhteisvaikutuksen CYP2C19:n kanssa ja hyvin heikon (AUC-suhde < 1,25) yhteisvaikutuksen P-gp:n kanssa. Siksi terapeuttiselta indeksiltään kapeita lääkevalmisteita, jotka ovat CYP3A4:n tai CYP2C19:n substraatteja (esim. takrolimuusi), ei pidä antaa treosulfaanihoidon aikana.
Ottaen huomioon hoitojen yleisen ajoituksen ja samanaikaisesti käytettyjen lääkevalmisteiden farmakokineettiset ominaisuudet (esim. puoliintumisajan), yhteisvaikutusten mahdollisuus voidaan pienentää tasolle ”ei yhteisvaikutuksia” (AUC-suhde < 1,25), jos kaikki samanaikaisesti käytetyt lääkevalmisteet annetaan joko 2 tuntia ennen laskimoon annettavaa treosulfaani-infuusiota tai 8 tuntia tämän 2 tuntia kestävän infuusion jälkeen.
Treosulfaanin vaikutusta fludarabiinin farmakokinetiikkaan ei tunneta.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / ehkäisy miehillä ja naisilla
Sekä seksuaalisesti aktiivisten miesten että naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 6 kuukautta hoidon päättymisen jälkeen.
Raskaus
Ei ole olemassa tietoja treosulfaanin käytöstä raskaana oleville naisille. Ei ole tehty riittäviä eläinkokeita lisääntymistoksisuuden selvittämiseksi (ks. kohta Prekliiniset tiedot turvallisuudesta). Treosulfaani on vasta-aiheista raskauden aikana (ks. kohta Vasta-aiheet).
Imetys
Ei tiedetä, erittyykö treosulfaani ihmisen rintamaitoon. Rintaruokinta on lopetettava treosulfaanihoidon ajaksi.
Hedelmällisyys
Treosulfaani saattaa heikentää miesten ja naisten hedelmällisyyttä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Miesten tulee hakeutua neuvontaan koskien sperman pakastamista ennen hoitoa treosulfaanihoidon aiheuttaman pysyvän hedelmättömyyden riskin vuoksi.
Muiden esihoitoon käytettävien alkyloivien lääkeaineiden tavoin treosulfaani voi aiheuttaa munasarjojen suppressiota, kuukautisten poisjäämistä ja vaihdevuosioireita naisille, jotka eivät vielä ole vaihdevuosi-iässä.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Treosulfaanilla on kohtalainen vaikutus ajokykyyn ja koneiden käyttökykyyn. On todennäköistä, että tietyt treosulfaanin haittavaikutukset, kuten pahoinvointi, oksentelu tai huimaus, saattavat vaikuttaa ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Esihoidon toivottu hoitovaikutus on perusteellinen myelosuppressio ja pansytopenia, ja nämä vaikutukset esiintyvät kaikilla potilailla. Verisolumäärät palautuvat yleensä normaaleiksi hematopoieettisten kantasolujen siirron jälkeen.
Yleisimmin todetut haittavaikutukset (aikuiset potilaat / pediatriset potilaat) treosulfaania sisältävän esihoidon ja sen jälkeisen allogeenisen hematopoieettisten kantasolujen siirron jälkeen ovat infektiot yleensä (10,1 % / 11,6 %), maha-suolikanavan häiriöt (pahoinvointi [38,0 % / 26,4 %], suutulehdus [36,4 % / 66,1 %], oksentelu [22,5 % / 42,1 %], ripuli [14,4 % / 33,1 %], vatsakipu [9,6 % / 17,4 %]), väsymys (14,4 % / 1,7 %), maksatoksisuus (0,3 % / 26,4 %), kuumeinen neutropenia (10,1 % / 1,7 %), ruokahalun heikentyminen (8,0 % / 0,8 %), makulopapulaarinen ihottuma (5,2 % / 7,4 %), kutina (2,8 % / 10,7 %), hiustenlähtö (1,5 % / 9,9 %), kuume (4,1 % / 13,2 %),turvotus (6,2 % / 0,8 %), ihottuma (0,7 % / 5,8 %) sekä seuraavien maksa-arvojen kohoaminen: alaniiniaminotransaminaasi (ALAT [4,9 % / 10,7 %]), aspartaattiaminotransaminaasi (ASAT [4,1 % / 6,6 %]) ja bilirubiini (17,1 % / 6,6 %).
Aikuiset
Haittavaikutusten taulukkomuotoinen luettelo
Alla olevassa taulukossa ilmoitettujen haittavaikutusten yleisyydet perustuvat viiteen kliiniseen tutkimukseen (yhteensä 613 potilasta), joissa treosulfaanin ja fludarabiinin yhdistelmää tutkittiin esihoitona ennen aikuispotilaille tehtävää allogeenista hematopoieettisten kantasolujen siirtoa. Treosulfaania annettiin 10–14 g:n annoksena kehon pinta-alan neliömetriä kohden kolmena peräkkäisenä päivänä.
Haittavaikutukset on lueteltu alla elinjärjestelmän ja seuraavien yleisyyksien mukaan luokiteltuina: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on kussakin yleisyysluokassa esitetty vakavuuden mukaan alenevassa järjestyksessä.
| Elinjärjestelmä (SOC-termistö) | Kaikkien haittavaikutusten yleisyydet | Asteen 3–4 haittavaikutusten yleisyydet |
| Infektiot* | Yleinen Infektiot (bakteeri-, virus- ja sieni-infektiot), sepsisa Tuntematon Septinen sokkic | Yleinen Infektiot (bakteeri-, virus- ja sieni-infektiot), sepsisa Tuntematon Septinen sokkic |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit)* | Tuntematon Hoitoon liittyvä sekundaarinen maligniteetti | Tuntematon Hoitoon liittyvä sekundaarinen maligniteetti |
| Veri ja imukudos* | Hyvin yleinen Myelosuppressio, pansytopenia, kuumeinen neutropenia | Hyvin yleinen Myelosuppressio, pansytopenia, kuumeinen neutropenia |
| Immuunijärjestelmä | Yleinen Yliherkkyys | |
| Aineenvaihdunta ja ravitsemus | Yleinen Ruokahalun heikentyminen Melko harvinainen Glukoosinsiedon heikentyminen, mukaan lukien hyperglykemia ja hypoglykemia Tuntematon Asidoosib | Yleinen Ruokahalun heikentyminen Melko harvinainen Glukoosinsiedon heikentyminen, mukaan lukien hyperglykemia ja hypoglykemia Tuntematon Asidoosib |
| Psyykkiset häiriöt | Yleinen Unettomuus Melko harvinainen Sekavuus | Tuntematon Sekavuus |
| Hermosto | Yleinen Päänsärky, huimaus Melko harvinainen Kallonsisäinen verenvuoto, perifeerinen sensorinen neuropatia Tuntematon Enkefalopatia, ekstrapyramidaalihäiriö, pyörtyminen, parestesia | Melko harvinainen Päänsärky Tuntematon Enkefalopatia, kallonsisäinen verenvuoto, pyörtyminen, perifeerinen sensorinen neuropatia |
| Silmät | Tuntematon Kuivasilmäisyys | |
| Kuulo ja tasapainoelin | Melko harvinainen Kiertohuimaus | |
| Sydän* | Yleinen Sydämen rytmihäiriöt (esim. eteisvärinä, sinusarytmia) Tuntematon Sydämenpysähdys, sydämen vajaatoiminta, sydäninfarkti, sydänpussin nestekertymä | Melko harvinainen Sydämen rytmihäiriöt (esim. eteisvärinä, sinusarytmia) Tuntematon Sydämenpysähdys, sydäninfarkti |
| Verisuonisto | Yleinen Hypertensio, hypotensio, kasvojen punoitus Melko harvinainen Verenpurkauma Tuntematon Embolismi | Melko harvinainen Hypertensio Tuntematon Embolismi |
| Hengityselimet, rintakehä ja välikarsina | Yleinen Hengenahdistus, nenäverenvuoto Melko harvinainen Keuhkotulehdus, keuhkopussin nestekertymä, nielun tai kurkunpään tulehdus, suunielun kipu, hikka Tuntematon Kurkunpään kipu, yskä, dysfonia | Melko harvinainen Hengenahdistus Tuntematon Keuhkotulehdus, keuhkopussin nestekertymä, nielun tulehdus, nenäverenvuoto |
| Ruoansulatuselimistö* | Hyvin yleinen Suutulehdus/limakalvotulehdus, ripuli, pahoinvointi, oksentelu Yleinen Suukipu, mahatulehdus, ruoansulatushäiriö, ummetus, nielemishäiriö, vatsakipu, ruokatorven tai maha-suolikanavan kipu Melko harvinainen Suun verenvuoto, vatsan turvotus, suun kuivuminen Tuntematon Mahan verenvuoto, neutropeeninen koliitti, ruokatorvitulehdus, peräaukon tulehdus | Yleinen Suutulehdus/limakalvotulehdus, ripuli, pahoinvointi, vatsakipu Melko harvinainen Oksentelu, suukipu, nielemishäiriö, ruokatorven tai maha-suolikanavan kipu Tuntematon Mahan tai suun verenvuoto, neutropeeninen koliitti |
| Maksa ja sappi* | Melko harvinainen Maksan veno-okklusiivinen tauti Tuntematon Maksatoksisuus, maksan suurentuma | Tuntematon Maksan veno-okklusiivinen tauti, maksatoksisuus |
| Iho ja ihonalainen kudos | Yleinen Makulopapulaarinen ihottuma, purppura, punoitus, käsi-jalkaoireyhtymä, kutina, hiustenlähtö Melko harvinainen Monimuotoinen punavihoittuma, aknetyyppinen ihottuma, ihottuma, kuiva iho Tuntematon Ihonekroosi tai ‑haavauma, ihotulehdus, ihon hyperpigmentaatiod | Melko harvinainen Makulopapulaarinen ihottuma Tuntematon Ihonekroosi, purppura, punoitus |
| Luusto, lihakset ja sidekudos | Yleinen Raajakipu, selkäkipu, luukipu, nivelkipu Melko harvinainen Lihaskipu | Tuntematon Raajakipu, luukipu |
| Munuaiset ja virtsatiet | Yleinen Akuutti munuaisvaurio, verivirtsaisuus Melko harvinainen Virtsateiden kipu Tuntematon Munuaisten vajaatoiminta, hemorraginen virtsarakkotulehdusc, dysuria | Melko harvinainen Akuutti munuaisvaurio Tuntematon Verivirtsaisuus |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen Asteeniset tilat (väsymys, voimattomuus, letargia) Yleinen Turvotus, kuumee, vilunväristykset Melko harvinainen Ei-sydänperäinen rintakipu, kipu | Yleinen Väsymys Tuntematon Ei-sydänperäinen rintakipu, kuumee |
| Tutkimukset | Hyvin yleinen Veren bilirubiinin kohoaminen Yleinen Transaminaasien (ALAT/ASAT) kohoaminen, GGT:n kohoaminen, C‑reaktiivisen proteiinin kohoaminen, painon lasku, painon nousu Melko harvinainen Veren alkalisen fosfataasin kohoaminen Tuntematon Veren laktaattidehydrogenaasin kohoaminen | Yleinen Veren bilirubiinin kohoaminen, transaminaasien (ALAT/ASAT) kohoaminen, GGT:n kohoaminen Melko harvinainen C‑reaktiivisen proteiinin kohoaminen Tuntematon Veren alkalisen fosfataasin kohoaminen |
* Ks. tarkemmat kuvaukset alla
a Kliinisesti tai mikrobiologisesti vahvistettu infektio, johon liittyi asteen 3 tai 4 neutropenia (absoluuttinen neutrofiilimäärä <1,0 x 109/l) ja sepsis
b Asidoosi saattaa olla seuraus metaanisulfonihapon vapautumisesta treosulfaanin aktivoituessa/pilkkoutuessa plasmassa
c Raportit treosulfaania sisältävän esihoidon jälkeisistä tapauksista (>2) saatu muista lähteistä
d Pronssinsävyinen pigmentaatio
e Kuume ilman neutropeniaa, kun neutropenian määritelmä on absoluuttinen neutrofiilimäärä <1,0 x 109/l
Valittujen haittavaikutusten kuvaus
Infektiot yleensä
Infektioita esiintyi 10,1 %:lla potilaista (62/613). Tähän sisältyvät bakteeri-, virus- ja sieni-infektioiden ilmaantuvuus (50/613; 8,1 %) ja sepsiksen ilmaantuvuus yleensä (12/613; 2 %). Yleisin infektiotyyppi oli keuhkoinfektio (10/62 [16,1 %]). Infektioiden aiheuttajia olivat bakteerit (esim. Staphylococcus, Enterococcus, Corynebacterium), virukset (esim. sytomegalovirus [CMV], Epstein-Barrin virus [EBV]) ja sienet (esim. candida). Sepsikseen yleensä sisältyvät sepsis (9/613; 1,5 %), stafylokokin aiheuttama sepsis (2/613; 0,3 %) ja enterokokin aiheuttama sepsis (1/613; 0,2 %). Infektioita esiintyi vähiten potilailla, jotka saivat treosulfaania 10 g/m² vuorokaudessa päivästä ‑4 päivään ‑2 (8,1 %).
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit)
Yhdelle 613:sta aikuispotilaasta (0,2 %) kehittyi sekundaarinen maligniteetti (rintasyöpä). Lisäksi muut tutkijat ovat raportoineet muutamia sekundaarisen maligniteetin tapauksia treosulfaania sisältävän esihoidon jälkeen. Pitkäaikaisen hoidon jälkeen, jossa potilaille, joilla oli kiinteitä kasvaimia, annettiin tavanomaisia suun kautta annettavia treosulfaaniannoksia, 1,4 %:lla 553:sta potilaasta todettiin akuutti myelooinen leukemia.
Veri ja imukudos
Hematologisia haittavaikutuksia todettiin 62:lla 613:sta aikuispotilaasta (10,1 %). Yleisin niistä oli kuumeinen neutropenia (10,1 %). Hematologisia haittavaikutuksia esiintyi vähiten potilailla, jotka saivat treosulfaania 10 g/m² vuorokaudessa päivästä ‑4 päivään ‑2 (4,4 %).
Neutropenian mediaanikesto (25. ja 75. persentiili) oli 14 (12, 20) vuorokautta 10 g/m²:n treosulfaaniannoksella ja 17,5 (14, 21) vuorokautta 14 g/m²:n treosulfaaniannoksella.
Sydän
Sydämeen liittyviä haittavaikutuksia todettiin 21:llä potilaalla (3,4 %). Yleisimpiä niistä olivat sydämen rytmihäiriöt, kuten eteisvärinä (1,0 %), sinustakykardia (0,8 %), supraventrikulaarinen takykardia (0,3 %) ja kammiolisälyönti (0,3 %). Sydämenpysähdyksiä, sydämen vajaatoimintaa ja sydäninfarkteja esiintyi yksittäisinä tapauksina. Sydämeen liittyviä haittavaikutuksia esiintyi vähiten potilailla, jotka saivat treosulfaania 10 g/m² vuorokaudessa päivästä ‑4 päivään ‑2 (2,6 %).
Ruoansulatuselimistö
Ruoansulatuselimistöön liittyviä haittavaikutuksia todettiin 379:llä potilaalla (61,8 %). Yleisimmin raportoidut haittavaikutukset olivat pahoinvointi (38,0 %), suutulehdus (36,4 %), oksentelu (22,5 %), ripuli (14,4 %) ja vatsakipu (9,6 %). Näitä haittavaikutuksia esiintyi vähiten potilailla, jotka saivat treosulfaania 10 g/m² vuorokaudessa päivästä ‑4 päivään ‑2 (pahoinvointi 21,5 %, suutulehdus 32,2 %, oksentelu 14,8 %, ripuli 5,9 % ja vatsakipu 6,7 %).
Maksa ja sappi
Maksan veno-okklusiivista tautia esiintyi 0,8 %:lla potilaista (5/613). Tautia esiintyi ainoastaan potilailla, jotka saivat treosulfaania 14 g/m² vuorokaudessa. Mikään tapauksista ei johtanut kuolemaan tai ollut henkeä uhkaava.
Pediatriset potilaat
Haittavaikutusten taulukkomuotoinen luettelo
Alla olevassa taulukossa ilmoitettujen haittavaikutusten yleisyydet perustuvat kahteen kliiniseen tutkimukseen (yhteensä 121 potilasta; mediaani-ikä 7 vuotta [vaihteluväli 0–17 vuotta]), joissa treosulfaanin ja fludarabiinin yhdistelmää (ja useimmiten myös tiotepaa) annettiin esihoitona ennen allogeenista hematopoieettisten kantasolujen siirtoa pediatrisille potilaille, joilla oli pahanlaatuinen tai hyvänlaatuinen sairaus. Treosulfaania annettiin 10–14 g:n annoksena kehon pinta-alan neliömetriä kohden kolmena peräkkäisenä päivänä.
Haittavaikutukset on lueteltu alla elinjärjestelmän ja seuraavien yleisyyksien mukaan luokiteltuina: hyvin yleinen (≥1/10), yleinen (≥1/100, <1/10), melko harvinainen (≥1/1 000, <1/100), harvinainen (≥1/10 000, <1/1 000), hyvin harvinainen (<1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on kussakin yleisyysluokassa esitetty vakavuuden mukaan alenevassa järjestyksessä.
| Elinjärjestelmä (SOC-termistö) | Kaikkien haittavaikutusten yleisyydet | Asteen 3–4 haittavaikutusten yleisyydet |
| Infektiot* | Hyvin yleinen Infektiot (bakteeri-, virus- ja sieni-infektiot) | Yleinen Infektiot (bakteeri-, virus- ja sieni-infektiot) |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit)* | Tuntematon Hoitoon liittyvä sekundaarinen maligniteettia | Tuntematon Hoitoon liittyvä sekundaarinen maligniteettia |
| Veri ja imukudos* | Hyvin yleinen Myelosuppressio, pansytopenia Tuntematon Kuumeinen neutropenia | Hyvin yleinen Myelosuppressio, pansytopenia Tuntematon Kuumeinen neutropenia |
| Aineenvaihdunta ja ravitsemus | Tuntematon Alkaloosi, elektrolyyttien epätasapaino, hypomagnesemia, ruokahalun heikentyminen | Tuntematon Alkaloosi |
| Hermosto* | Yleinen Päänsärky Tuntematon Kouristuskohtaus, parestesia | Tuntematon Parestesia |
| Silmät | Tuntematon Sidekalvon verenvuoto, kuivasilmäisyys | |
| Verisuonisto | Tuntematon Hiussuonivuoto-oireyhtymä, hypertensio, hypotensio | Tuntematon Hiussuonivuoto-oireyhtymä, hypertensio, hypotensio |
| Hengityselimet, rintakehä ja välikarsina | Yleinen Suunielun kipu, nenäverenvuoto Tuntematon Hypoksia, yskä | Tuntematon Hypoksia |
| Ruoansulatuselimistö | Hyvin yleinen Suutulehdus/limakalvotulehdus, ripuli, pahoinvointi, oksentelu, vatsakipu Yleinen Nielemisvaikeudet, peräaukon tulehdus, suukipu Tuntematon Neutropeeninen koliitti, ruoansulatushäiriö, peräsuolitulehdus, ienkipu, ruokatorven kipu, ummetus | Hyvin yleinen Suutulehdus/limakalvotulehdus Yleinen Nielemishäiriö, ripuli, pahoinvointi, oksentelu Tuntematon Neutropeeninen koliitti, vatsakipu, ruokatorven kipu |
| Maksa ja sappi | Hyvin yleinen Maksatoksisuus Tuntematon Maksan veno-okklusiivinen tauti, maksan suurentuma | |
| Iho ja ihonalainen kudos | Hyvin yleinen Kutina, hiustenlähtö Yleinen Hilseilevä ihottuma, makulopapulaarinen ihottuma, ihottuma, punoitus, nokkosihottuma, ihokipu, ihon hyperpigmentaatiob Tuntematon Ihohaavauma, monimuotoinen punavihoittuma, rakkulainen ihottuma, aknetyyppinen ihottuma, käsi-jalkaoireyhtymä, vaippaihottumaa | Yleinen Hilseilevä ihottuma, makulopapulaarinen ihottuma Tuntematon Punoitus |
| Luusto, lihakset ja sidekudos | Tuntematon Raajakipu | |
| Munuaiset ja virtsatiet | Tuntematon Akuutti munuaisvaurio, munuaisten vajaatoiminta, ei-infektiivinen virtsarakkotulehdus, verivirtsaisuus | Tuntematon Akuutti munuaisvaurio, munuaisten vajaatoiminta, ei-infektiivinen virtsarakkotulehdus |
| Sukupuolielimet ja rinnat | Tuntematon Kivespussin punoitus, peniskipu | |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen Kuumec Yleinen Vilunväristykset Tuntematon Kasvojen turvotus, väsymys, kipu | |
| Tutkimukset | Hyvin yleinen ALAT-arvon kohoaminen Yleinen ASAT-arvon kohoaminen, veren bilirubiinin kohoaminen, C-reaktiivisen proteiinin kohoaminen Tuntematon GGT:n kohoaminen | Yleinen ALAT-arvon kohoaminen, veren bilirubiinin kohoaminen Tuntematon ASAT-arvon kohoaminen, GGT:n kohoaminen, C‑reaktiivisen proteiinin kohoaminen |
* Ks. tarkemmat kuvaukset alla
a Raportit treosulfaania sisältävän esihoidon jälkeisistä tapauksista (>1) saatu muista lähteistä
b Pronssinsävyinen pigmentaatio
c Kuume ilman neutropeniaa, kun neutropenian määritelmä on absoluuttinen neutrofiilimäärä <1,0 x 109/l
Valittujen haittavaikutusten kuvaus
Infektiot
Infektioita esiintyi 11,6 %:lla 121:stä pediatrisesta potilaasta (14/121), mikä vastaa ilmaantuvuutta aikuisilla. Ilmaantuvuus oli suurempi 12–17‑vuotiailla pediatrisilla potilailla (6/39 [15,4 %]) kuin nuoremmilla lapsilla (7/59 [11,9 %]).
Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit)
Yksi sekundaarisen maligniteetin tapaus (myelodysplastinen oireyhtymä) raportoitiin sirppisoluanemiaa sairastavalla lapsella noin 12 kuukautta treosulfaania sisältävän esihoidon jälkeen.
Muut tutkijat ovat raportoineet kuusi sekundaarisen maligniteetin tapausta treosulfaania sisältävän esihoidon jälkeen. Viisi potilasta sai allogeenisen hematopoieettisten kantasolujen siirron primaarisen immuunipuutoksen vuoksi, eli sairauteen, johon itsessään liittyy suurentunut neoplasiariski. Heille kehittyneitä sairauksia olivat myelodysplastinen oireyhtymä, akuutti lymfoblastinen leukemia ja Ewingin sarkooma. Yhdelle hemofagosyyttistä lymfohistiosytoosia sairastavalle potilaalle kehittyi sekundaarinen krooninen juveniili myelooinen leukemia.
Veri ja imukudos
Neutropenian mediaanikesto (25. ja 75. persentiili) oli 22 (17, 26) vuorokautta pahanlaatuista tautia sairastavilla pediatrisilla potilailla ja 20 (15, 25) vuorokautta hyvänlaatuista tautia sairastavilla potilailla.
Hermosto
Enkefaliitin yhteydessä esiintynyt kouristuskohtaus raportoitiin yhdellä 121:stä pediatrisesta potilaasta. Tutkijalähtöisessä, primaarista immuunipuutosta sairastavilla lapsilla tehdyssä tutkimuksessa raportoitiin viisi muiden treosulfaania sisältävien esihoitojen jälkeen esiintynyttä kouristuskohtaustapausta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto:www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Treosulfaanin pääasiallinen toksinen vaikutus on perusteellinen myeloablaatio ja pansytopenia. Lisäksi saattaa esiintyä asidoosia, ihotoksisuutta, pahoinvointia, oksentelua ja mahatulehdusta. Suositeltu treosulfaaniannos ilman hematopoieettisten kantasolujen siirtoa johtaa yliannostukseen. Treosulfaanin yliannostukseen ei ole saatavilla erityistä vastalääkettä. Yliannostustapauksessa potilaan hematologista statusta on tarkkailtava tiiviisti ja tarvittavaa elintoimintoja tukevaa hoitoa annettava ripeästi.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Solunsalpaajat, alkyloivat lääkeaineet, ATC-koodi: L01AB02
Vaikutusmekanismi
Treosulfaani on esimuoto kaksivaikutteiselle alkyloivalle lääkeaineelle, jolla on sytotoksinen vaikutus hematopoieettisiin esiastesoluihin. Treosulfaanin vaikutus perustuu spontaaniin muuntumiseen monoepoksidiväliyhdisteeksi ja L-diepoksibutaaniksi (ks. kohta Farmakokinetiikka).
Muodostuneet epoksidit alkyloivat deoksiribonukleiinihapon (DNA) nukleofiilisia keskuksia ja kykenevät aikaansaamaan DNA:han ristisidoksia, joiden katsotaan aiheuttavan kantasolujen poistumisen ja antineoplastiset vaikutukset.
Farmakodynaamiset vaikutukset
Treosulfaanilla on laaja antineoplastinen ja antileukeeminen vaikutus. Tämä osoitettiin hiiriin ja rottiin siirretyissä lymfoomissa, leukemioissa, sarkoomissa ja hepatoomissa sekä ihmisen kasvainksenografteissa, kasvainbiopsioissa ja solulinjoissa.
Treosulfaanin immunosuppressiiviset vaikutukset perustuvat sen myrkyllisyyteen primitiivisille, erilaistumiskyvyltään rajoitetuimmille progenitorisoluille sekä T- ja NK-soluille, sen primaaristen ja sekundaaristen lymfaattisten elinten solukkuutta pienentävään vaikutukseen ja sen käänteishyljinnän (GvHD) kehittymistä edeltävää ja veno-okklusiivisen taudin patogeneesiin osallistuvaa sytokiinimyrskyä estävään vaikutukseen.
Kliininen teho ja turvallisuus
Faasin III pivotaalitutkimuksessa aikuispotilailla, joilla oli akuutti myelooinen leukemia (AML) tai myelodysplastinen oireyhtymä (MDS) ja joille tavanomaiset esihoidot olivat liian riskialttiita potilaiden iän (≥50 vuotta) tai komorbiditeettien (hematopoieettisten kantasolujen siirron komorbiditeetti-indeksin [HCT‑CI] pistemäärä >2) vuoksi, potilaat satunnaistettiin saamaan esihoitoa joko treosulfaanin (3 × 10 g/m²) ja fludarabiinin yhdistelmällä (FT10-hoito-ohjelma; n = 268) tai laskimoon annettavan busulfaanin (kokonaisannos 6,4 mg/kg) ja fludarabiinin yhdistelmällä (FB2-hoito-ohjelma; n = 283) ennen allogeenista hematopoieettisten kantasolujen siirtoa. 64 %:lla potilaista oli AML ja 36 %:lla MDS. Potilaiden mediaani-ikä oli 60 vuotta (vaihteluväli 31–70 vuotta), ja 25 % potilaista oli yli 65‑vuotiaita.
Tutkimuksen ensisijainen päätetapahtuma oli tapahtumavapaa elossaolo-osuus 2 vuoden jälkeen. Tapahtumiksi määriteltiin taudin uusiutuminen, siirteen menetys tai kuolema (näistä ensimmäisenä esiintynyt noteerattiin). FT10-hoito-ohjelman vertailukelpoisuus (non-inferiority) FB2-verrokkihoito-ohjelman kanssa osoitettiin tilastollisesti. P‑arvo 0,0005787 osoittaa treosulfaanin paremmuuden busulfaaniin nähden (kuva 1).
Kuva 1: Kaplan‑Meier-arviot tapahtumavapaasta elossaolo-osuudesta (koko analyysijoukko)
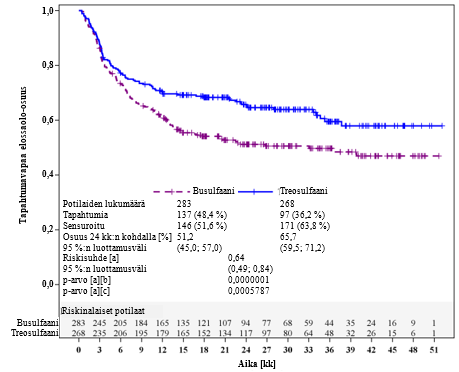
a Korjattu luovuttajatyypin mukaan faktorina sekä riskiryhmän ja keskuksen mukaan ositteina Coxin regressiomallin avulla.
b Treosulfaanin vertailukelpoisuuden testaukselle busulfaaniin nähden.
c Treosulfaanin paremmuuden testaukselle busulfaaniin nähden.
Analysoitaessa tapahtumavapaata elossaolo-osuutta 2 vuoden kohdalla eri etukäteen määritellyille alaryhmille (luovuttajatyyppi, riskiryhmä, sairaus, ikäryhmä, HCT‑CI-indeksin pistemäärä, remissiostatus tutkimukseen otettaessa ja näiden muuttujien eri yhdistelmät) tulokset olivat treosulfaania sisältävän hoito-ohjelman eduksi (FT10-hoito-ohjelman riskisuhde vs. FB2-hoito-ohjelma <1) yhtä poikkeusta lukuun ottamatta (sopivan sukulaisluovuttajan [MRD] saaneiden potilaiden riskiryhmä II; riskisuhde 1,18 [95 %:n luottamusväli 0,61, 2,26]).
Lisää tuloksia on esitetty taulukossa 1.
Taulukko 1: Hoitotulokset 24 kuukauden kohdalla (koko analyysijoukko)
| Muuttuja | Treosulfaani | Busulfaani | Riskisuhdeb (95 %:n luottamusväli) | P-arvob |
| Potilaiden lukumäärä | 268 | 283 | ||
| Kokonaiselossaolo-osuusa, % (95 %:n luottamusväli) | 72,7 (66,8; 77,8) | 60,2 (54,0; 65,8) | 0,64 (0,48; 0,87) | 0,0037 |
| Uusiutumisen/etenemisen kumulatiivinen ilmaantuvuus, % (95 %:n luottamusväli) | 22,0 (16,9; 27,1) | 25,2 (20,0; 30,3) | 0,82 (0,59; 1,16) | 0,2631 |
| Siirtoon liittyvän kuolleisuuden kumulatiivinen ilmaantuvuus, % (95 %:n luottamusväli) | 12,8 (9,2; 17,7) | 24,1 (19,1; 30,2) | 0,52 (0,34; 0,82) | 0,0043 |
| a Perustuu Kaplan-Meier-arvioihin; b Korjattu luovuttajatyypin, riskiryhmän ja keskuksen mukaan Coxin regressiomallin avulla | ||||
Käänteishyljintää koskevat tulokset on esitetty taulukossa 2.
Taulukko 2: Käänteishyljinnän kumulatiivinen ilmaantuvuus (koko analyysijoukko)
| Muuttuja | Treosulfaani | Busulfaani | P-arvo |
| Potilaiden lukumäärä | 268 | 283 | |
| Akuutti käänteishyljintä, kaikki asteet, % (95 %:n luottamusväli) | 52,8 (46,8; 58,8) | 57,2 (51,5; 63,0) | 0,2038 |
| Akuutti käänteishyljintä, asteet III ja IV, % (95 %:n luottamusväli) | 6,4 (3,4; 9,3) | 8,1 (4,9; 11,3) | 0,4267 |
| Krooninen käänteishyljintäa, % (95 %:n luottamusväli) | 61,7 (55,1; 68,3 | 60,3 (53,8; 66,7) | 0,9964 |
| Laaja krooninen käänteishyljintäa, % (95 %:n luottamusväli) | 19,8 (14,5; 25,1) | 28,6 (22,5; 34,7) | 0,0750 |
| a Enintään 2 vuoden jälkeen allogeenisestahematopoieettisten kantasolujen siirrosta | |||
Treosulfaania sisältävästä esihoidosta (FT14-hoito-ohjelma ± tiotepa; ks. kohta Annostus ja antotapa) hyvänlaatuista tautia sairastaville aikuisille on niukasti tietoa saatavissa. Pääasialliset käyttöaiheet hyvänlaatuista tautia sairastavien aikuisten allogeeniselle hematopoieettisten kantasolujen siirrolle ja treosulfaania sisältävälle esihoidolle ovat hemoglobinopatiat (esim. sirppisolutauti, talassemia major), primaarinen immuunipuutos, hemofagosyyttinen oireyhtymä, IPEX-oireyhtymä ja luuytimen vajaatoiminta.
Eräässä tutkimuksessa 31:lle hyvänlaatuista tautia sairastavalle potilaalle annettiin FT14-hoito-ohjelman mukaista hoitoa ja antitymosyyttiglobuliinia. Potilaiden ikä vaihteli välillä 0,4–30,5 vuotta, ja 29 %:lla potilaista HCT‑CI-indeksin pistemäärä oli >2. Kaikkien potilaiden solusiirto onnistui. Mediaaniaika neutrofiilien toiminnan käynnistymiseen (engraftment) oli 21 vuorokautta (vaihteluväli 12–46 vuorokautta), ja 2 vuoden ennustettu kokonaiselossaolo-osuus oli 90 %. Täydellinen vaste kliinisten oireiden ja laboratorioanalyysien perusteella todettiin 28 potilaalla (90 %) (Burroughs LM et al., Biology of Blood and Marrow Transplantation 2014; 20(12):1996-2003).
Italialainen tutkimusryhmä antoi 60:lle talassemia major -potilaalle (ikävaihtelu 1–37 vuotta, 12 aikuispotilasta) FT14-hoito-ohjelman mukaista hoitoa ja tiotepaa. Solusiirto onnistui kaikilla paitsi yhdellä potilaalla, joka kuoli päivänä +11. Mediaaniaika neutrofiilien ja verihiutaleiden toiminnan käynnistymiseen oli 20 vuorokautta. Seuranta-aikana, jonka mediaanikesto oli 36 kuukautta (vaihteluväli 4–73 kuukautta), 5 vuoden ennustettu kokonaiselossaolo-osuus oli 93 % (95 %:n vaihteluväli 83–97 %). Hoitotuloksessa ei havaittu eroa lasten ja aikuisten välillä (Bernardo ME et al.; Blood 2012; 120(2):473-6).
Aikuispotilaille annetun treosulfaania sisältävän esihoidon (n = 16) ja busulfaania sisältävän esihoidon (n = 81) retrospektiivisessä vertailussa elossaolo-osuudet olivat melko samankaltaiset (70,3 ± 15,1 % vs. 69,3 ± 5,5 %), mutta akuutin käänteishyljinnän riski oli pienempi treosulfaaniryhmässä (kerroinsuhde 0,28; 95 %:n luottamusväli 0,12–0,67; p = 0,004) (Caocci G et al.; American Journal of Hematology 2017; 92(12):1303-1310).
Pediatriset potilaat
Treosulfaania sisältävän esihoidon tehoa ja turvallisuutta arvioitiin 70 potilaalla, joilla oli akuutti lymfoblastinen leukemia (ALL), AML, MDS tai juveniili myelomonosyyttileukemia (JMML). Potilaat saivat esihoitoa treosulfaanin ja fludarabiinin yhdistelmällä joko tiotepan kanssa (n = 65) tai ilman tiotepaa (n = 5). Treosulfaanin annos mukautettiin potilaan kehon pinta-alaan, ja annos 10, 12 tai 14 g/m² vuorokaudessa annettiin kaksi tuntia kestävänä laskimoinfuusiona päivinä -6, -5 ja -4 ennen kantasoluinfuusiota (päivä 0). Potilaista 37 (52,9 %) oli alle 12‑vuotiaita.
Kellään potilaista ei todettu primaarista siirteen menetystä, mutta yhdellä ALL-potilaalla todettiin sekundaarinen siirteen menetys. Täydellisen luovuttajan kimerismin ilmaantuvuus oli päivän +28 käynnillä 94,2 % (90 %:n luottamusväli 87,2–98,0 %), päivän +100 käynnillä 91,3 % (90 %:n luottamusväli 83,6–96,1 %) ja 12 kuukauden käynnillä 91,2 % (90 %:n luottamusväli 82,4–96,5 %).
Kokonaiselossaolo-osuus 24 kuukauden kohdalla oli 85,7 % (90 %:n luottamusväli 77,1–91,2 %). 70 potilaasta 12 (17,1 %) kuoli; 8 potilasta taudin uusiutumisen/etenemisen vuoksi ja 4 potilasta siirteeseen liittyvistä syistä. Vapaus siirtoon liittyvästä kuolleisuudesta allogeenisen hematopoieettisten kantasolujen siirron jälkeiseen päivään +100 asti (ensisijainen päätetapahtuma) oli 98,6 % (90 %:n luottamusväli 93,4–99,9 %). Yksi siirtoon/hoitoon liittyvä kuolema todettiin päivään +100 mennessä. Siirtoon liittyvä kuolleisuus 24 kuukauden kohdalla oli 4,6 % (90 %:n luottamusväli 1,8–11,4 %). Kuudentoista potilaan tauti uusiutui tai eteni. Uusiutumisen/etenemisen kumulatiivinen ilmaantuvuus kuukauden +24 kohdalla oli 23,0 % (90 %:n luottamusväli 14,7–31,3 %).
Treosulfaania/fludarabiinia ± tiotepaa sisältävän esihoidon tehoa ja turvallisuutta arvioitiin tarkemmin 51 potilaalla, joilla oli hyvänlaatuisia sairauksia (primaarinen immuunipuutos, hemoglobinopatia, synnynnäinen aineenvaihduntahäiriö ja luuytimen vajaatoiminta). Treosulfaanin annos mukautettiin potilaan kehon pinta-alaan, ja annos 10, 12 tai 14 g/m² vuorokaudessa annettiin kaksi tuntia kestävänä laskimoinfuusiona päivinä -6, -5 ja -4 ennen kantasoluinfuusiota (päivä 0). Anto-ohjelmaa mukautettiin tutkimuksen aikana eri annoksiin sovellettavien kehon pinta-alaluokkien osalta, minkä seurauksena 2 potilasta sai suurempaa annosta kuin alkuperäisessä anto-ohjelmassa. Aktiivinen verrokkiryhmä koostui viidestäkymmenestä arviointikelpoisesta potilaasta, jotka saivat kontrollina toimivaa, busulfaania/fludarabiinia ± tiotepaa sisältävää esihoitoa. Busulfaanin annos mukautettiin potilaan painoon, ja annos 3,2–4,8 mg/kg/vrk annettiin päivinä -7, -6, -5 ja -4. Useimmat tutkittavat (84 % kummassakin ryhmässä) saivat tiotepaa sisältävää tehostettua hoitoa, joka annettiin kahtena 5 mg/kg kerta-annoksena päivänä ‑2. Useimpien potilaiden ikä oli 28 päivää – 11 vuotta (88,2 % treosulfaaniryhmässä ja 80 % busulfaaniryhmässä). Tässä tutkimuksessa alfaa ei kontrolloitu monitestauksen osalta. Vapaus siirtoon (hoitoon) liittyvästä kuolleisuudesta päivään +100 asti (ensisijainen päätetapahtuma) oli 100,0 % (90 %:n luottamusväli 94,3–100,0 %) treosulfaaniryhmässä ja 90,0 % (90 %:n luottamusväli 80,1–96,0 %) busulfaaniryhmässä. Kokonaiselossaolo-osuus 1 vuoden kohdalla oli 96,1 % (90 %:n luottamusväli 88,0–98,8 %) treosulfaanin kohdalla ja 88,0 % (90 %:n luottamusväli 77,9–93,7 %) busulfaanin kohdalla.
Yhteensä 2 potilaalla (3,9 %) treosulfaaniryhmässä ja 2 potilaalla (4,0 %) busulfaaniryhmässä todettiin primaarinen siirteen menetys, ja toissijaisia siirteen menetyksiä raportoitiin 9 potilaalla (18,4 %), jotka saivat treosulfaania sisältävää esihoitoa. Täydellisen luovuttajan kimerismin ilmaantuvuus oli molemmissa ryhmissä samankaltainen.
Farmakokinetiikka
Treosulfaani on aihiolääke, joka fysiologisissa olosuhteissa (pH 7,4; 37 °C) muuntuu spontaanisti monoepoksidiväliyhdisteeksi ja L-diepoksibutaaniksi ja jonka puoliintumisaika on 2,2 tuntia.
Imeytyminen
Laskimoon annettaessa huippupitoisuus plasmassa saavutetaan infuusioajan lopussa. Huippupitoisuus plasmassa (keskiarvo ± SD) aikuispotilaille annettujen 2 tunnin kestoisten infuusioiden jälkeen oli 10 g/m²:n annoksella 306 ± 94 µg/ml, 12 g/m²:n annoksella 461 ± 102 µg/ml ja 14 g/m²:n annoksella 494 ± 126 µg/ml.
Jakautuminen
Treosulfaani jakautuu elimistöön nopeasti; sen veri-aivoesteen läpäisy on kuitenkin melko vähäistä (ks. kohta Prekliiniset tiedot turvallisuudesta). Jakaantumistilavuus aikuisilla on noin 20–30 litraa. Annoksen kumuloitumista ei havaittu suositellulla, kolmena peräkkäisenä päivänä annettavalla vuorokausiannoksella.
Treosulfaani ei sitoudu plasman proteiineihin.
Biotransformaatio
Fysiologisissa olosuhteissa (pH 7,4; 37 °C) farmakologisesti inaktiivinen treosulfaani muuntuu spontaanisti (ei-entsymaattisesti) aktiiviseksi monoepoksidiväliyhdisteeksi (S,S-EBDM = (2S,3S)-1,2-epoksibutaani-3,4-dioli-4-metaanisulfonaatti) ja lopulta L-diepoksibutaaniksi (S,S-DEB = (2S,3S)-1,2:3,4-diepoksibutaani).
Treosulfaani ei estä CYP1A2-, CYP2B6-, CYP2C8-, CYP2C9-, CYP2D6- ja CYP3A4-entsyymejä, joiden substraattina on testosteroni. Treosulfaani kuitenkin esti CYP2C19:n ja CYP3A4:n toimintaa palautuvasti, jos substraattina oli midatsolaami. Treosulfaani ei estä substraattien kuljetusta eri kuljettajaproteiinien toimesta, lukuun ottamatta P-gp:tä ja MATE2:ta hyvin suurina pitoisuuksina.
Eliminaatio
Treosulfaanin pitoisuus plasmassa laskee eksponentiaalisesti, ja se on parhaiten kuvattavissa ensimmäisen asteen eliminaatioprosessina kaksitilamallilla.
Laskimoon annetun treosulfaanin (enintään 47 g/m²) terminaalinen puoliintumisaika (T1/2ß) on noin 2 tuntia. Noin 25–40 % treosulfaaniannoksesta erittyy muuttumattomana virtsaan 24 tunnin kuluessa, ja lähes 90 % tästä erittymisestä tapahtuu 6 tunnin kuluessa annosta.
Lineaarisuus/ei-lineaarisuus
AUC-arvon (AUC0-∞) ja treosulfaaniannoksen regressioanalyysi osoitti niiden korreloivan lineaarisesti keskenään.
Munuaisten ja maksan ja vajaatoiminta
Treosulfaanin farmakokinetiikkaa ei tutkittu vaikeaa munuaisten tai maksan vajaatoimintaa sairastavilla potilailla, sillä tällaisille potilaille ei yleensä tehdä allogeenista hematopoieettisten kantasolujen siirtoa. Noin 25–40 % treosulfaaniannoksesta erittyy virtsaan, mutta munuaisten toiminnan vaikutusta treosulfaanin munuaispuhdistumaan ei havaittu.
Pediatriset potilaat
Tavanomainen, pelkästään kehon pinta-alaan perustuva annoksen laskenta johtaa pienillä lapsilla ja vauvoilla, joiden kehon pinta-ala on pieni, huomattavasti suurempaan altistukseen (AUC) kuin nuorilla ja aikuisilla. Siksi treosulfaanin annostus pediatrisille potilaille pitää mukauttaa potilaan kehon pinta-alaan (ks. kohta Annostus ja antotapa), jolloin kaikkiin ikäryhmiin kuuluvilla lapsilla saavutetaan samankaltainen treosulfaanialtistus, joka vastaa aikuisten altistusta 3 x 14 g/m².
Treosulfaanin keskimääräinen näennäinen terminaalinen puoliintumisaika oli samankaltainen eri ikäryhmien välillä, ja se vaihteli välillä 1,3–1,6 tuntia.
Farmakokineettinen/farmakodynaaminen arviointi ei osoittanut merkitseviä muutoksia neutrofiilien toiminnan käynnistymiseen (engraftment) kuluvassa ajassa AUC:n funktiona.
Prekliiniset tiedot turvallisuudesta
Rotilla neljä viikkoa kestänyt, laskimoon annettu subkrooninen hoito sai aikaan hematologisia muutoksia, jotka ilmenivät leukosyyttien ja neutrofiilisten granulosyyttien määrän pienenemisenä, pernan ja kateenkorvan suhteellisen painon laskuna imukudoksen atrofian yhteydessä sekä luuydinlamana. Lymfohistiosyyttistä infiltraatiota luustolihaksiin ja virtsarakon histopatologisia muutoksia todettiin. Hematurian merkkejä havaittiin lähinnä uroksilla.
Alkyloivan vaikutusmekanisminsa vuoksi treosulfaania pidetään genotoksisena ja karsinogeenisena yhdisteenä. Treosulfaanilla ei tehty erityisiä lisääntymis- ja kehitystoksisuutta koskevia eläinkokeita. Kroonista toksisuutta koskevissa testeissä rotilla havaittiin kuitenkin huomattavia vaikutuksia spermatogeneesiin ja munasarjojen toimintaan. Julkaistussa kirjallisuudessa treosulfaanin on raportoitu aiheuttaneen sukupuolirauhasten toksisuutta esipubertaalisilla ja pubertaalisilla uros- ja naarashiirillä.
Lisäksi julkaistuissa tuloksissa, jotka koskivat hiirien ja rottien hoitoa L-diepoksibutaanilla (treosulfaanin alkyloivalla muuntumistuotteella), raportoitiin hedelmällisyyttä heikentävistä ja kohdun, munasarjojen ja siittiöiden kehitystä haittaavista vaikutuksista.
Tutkimukset nuorilla eläimillä
Nuorilla rotilla tehdyissä toksisuustutkimuksissa treosulfaani aiheutti lievää fyysisen kehityksen hidastumista sekä naarailla lievää emättimen avautumisen viivästymistä. Treosulfaanin havaittiin läpäisevän rottien veri-aivoesteen hyvin vähäisessä määrin. Treosulfaanin pitoisuus aivokudoksessa oli 95–98 % pienempi kuin plasmassa. Altistuksen nuorten rottien aivokudoksessa havaittiin kuitenkin olevan noin kolme kertaa suurempi kuin nuorilla täysikasvuisilla rotilla.
Farmaseuttiset tiedot
Apuaineet
Ei ole.
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
Avaamaton injektiopullo
5 vuotta
Käyttökuntoon saatettu infuusioliuos
0,45-prosenttisella (4,5 mg/ml) natriumkloridiliuoksella käyttökuntoon saatetun valmisteen kemialliseksi ja fysikaaliseksi säilyvyydeksi on osoitettu 3 vuorokautta 25 °C:een lämpötilassa.
Mikrobiologisesta näkökulmasta valmiste tulee käyttää välittömästi, ellei käyttökuntoon saattamiseen käytettävä menetelmä poissulje mikrobiologisen kontaminaation riskiä. Jos valmistetta ei käytetä heti, säilytysaika ja säilytysolosuhteet ennen käyttöä ovat käyttäjän vastuulla.
Älä säilytä jääkaapissa (2–8 °C), sillä valmiste saattaa saostua.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Käyttökuntoon saatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TRECONDI infuusiokuiva-aine, liuosta varten
1 g (L:ei) 5 x 1 g (716,14 €)
5 g (L:ei) 5 x 5 g (3027,18 €)
PF-selosteen tieto
Trecondi 1 g infuusiokuiva-aine, liuosta varten
Väritön, tyypin I lasista valmistettu injektiopullo, jossa on kumitulppa ja alumiinikorkki. Injektiopullo sisältää 1 g treosulfaania.
Trecondi 5 g infuusiokuiva-aine, liuosta varten
Väritön, tyypin I lasista valmistettu injektiopullo, jossa on kumitulppa ja alumiinikorkki. Injektiopullo sisältää 5 g treosulfaania.
Trecondi on saatavana 1 tai 5 injektiopulloa sisältävissä pakkauksissa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen kiteinen jauhe.
Käyttö- ja käsittelyohjeet
Kuten muiden sytotoksisten aineiden käsittelyssä, myös treosulfaanin käsittelyssä tulee noudattaa asianmukaisia varotoimia.
Vain asianmukaisen koulutuksen saanut henkilöstö saa saattaa lääkevalmisteen käyttökuntoon. Treosulfaanin käsittelyn aikana on vältettävä sen hengittämistä sekä iho- ja limakalvokontaktia (riittävästi suojaavien kertakäyttökäsineiden, suojalasien, suojatakin ja hengityssuojaimen käyttö on suositeltavaa). Altistuneet ihoalueet on pestävä huolellisesti vedellä ja saippualla ja altistuneet silmät huuhdeltava 0,9-prosenttisella (9 mg/ml) natriumkloridiliuoksella. Jos mahdollista, käyttökuntoon saattaminen on suositeltavaa tehdä turvapöydällä, joka on varustettu laminaarivirtauksella ja päällystetty nestettä läpäisemättömällä imukykyisellä kertakäyttökalvolla. Sytotoksisten lääkevalmisteiden käyttökuntoon saattamiseen käytettyjen välineiden (kuten ruiskujen ja neulojen) hävittämisessä on noudatettava asianmukaista huolellisuutta ja asianmukaisia varotoimia. Käytä Luer-liitoksia kaikissa ruiskuissa ja infuusiosarjoissa. Halkaisijaltaan suurien neulojen käyttö on suositeltavaa paineen ja mahdollisen aerosolimuodostuksen minimoimiseksi. Jälkimmäistä voidaan vähentää myös käyttämällä sivuaukollista neulaa.
Raskaana olevan henkilöstön ei pidä käsitellä sytotoksisia aineita.
Ohjeet treosulfaanin käyttökuntoon saattamiseen:
1. Treosulfaani saatetaan käyttökuntoon alkuperäisessä lasipakkauksessaan. Käyttökuntoon saatetut treosulfaaniliuokset voidaan yhdistää suurempaan lasiseen injektiopulloon tai PVC- tai PE-pussiin.
2. Liukenemisongelmien välttämiseksi lämmitä liuotin eli 0,45-prosenttinen (4,5 mg/ml) natriumkloridiliuos 25–30 °C:een lämpöiseksi (ei lämpimämmäksi) esimerkiksi vesihauteen avulla.
3. Irrota injektiopullon sisäpintaan tarttunut treosulfaanijauhe ravistamalla huolellisesti. Tämä toimenpide on erittäin tärkeä, sillä pintaan tarttuneen jauheen kostuminen johtaa paakkuuntumiseen. Jos näin tapahtuu, liuota paakkuuntunut jauhe uudelleen ravistamalla injektiopulloa voimakkaasti.
4. Saata kukin 1 g treosulfaania sisältävä Trecondi-injektiopullo käyttökuntoon 20 ml:lla esilämmitettyä (enintään 30 °C:een lämpöistä) 0,45-prosenttista (4,5 mg/ml) natriumkloridiliuosta. Liuota ravistamalla.
Saata kukin 5 g treosulfaania sisältävä Trecondi-injektiopullo käyttökuntoon 100 ml:lla esilämmitettyä (enintään 30 °C:een lämpöistä) 0,45-prosenttista (4,5 mg/ml) natriumkloridiliuosta. Liuota ravistamalla.
0,45-prosenttinen (4,5 mg/ml) natriumkloridiliuos voidaan valmistaa sekoittamalla yhtä suuret määrät 0,9-prosenttista (9 mg/ml) natriumkloridiliuosta ja injektionesteisiin käytettävää vettä.
Käyttökuntoon saatettu liuos sisältää 50 mg treosulfaania ml:aa kohden, ja se on kirkasta ja väritöntä. Liuosta, jossa on merkkejä saostumisesta, ei saa käyttää.
Treosulfaani on mutageeninen ja karsinogeeninen. Jäljelle jäänyt lääkevalmiste ja kaikki käyttökuntoon saattamiseen ja antoon käytetyt välineet ja materiaalit on tuhottava antineoplastisiin aineisiin sovellettavien tavanomaisten käytäntöjen sekä voimassa olevien vaarallisen jätteen hävittämistä koskevien lakien mukaisesti.
Korvattavuus
TRECONDI infuusiokuiva-aine, liuosta varten
1 g 5 x 1 g
5 g 5 x 5 g
- Ei korvausta.
ATC-koodi
L01AB02
Valmisteyhteenvedon muuttamispäivämäärä
01.01.2026
Yhteystiedot
Spektri Business Park, Metsänneidonkuja 4
02130 Espoo
010 420 4000
www.medac.fi
info@medac.fi
