SOLIFENACIN ORION tabletti, kalvopäällysteinen 5 mg, 10 mg
Vaikuttavat aineet ja niiden määrät
Solifenacin Orion 5 mg kalvopäällysteiset tabletit:
Yksi kalvopäällysteinen tabletti sisältää 5 mg solifenasiinisuksinaattia, mikä vastaa 3,8 mg:aa solifenasiinia.
Apuaine, jonka vaikutus tunnetaan: laktoosimonohydraatti 132,9 mg.
Solifenacin Orion 10 mg kalvopäällysteiset tabletit:
Yksi kalvopäällysteinen tabletti sisältää 10 mg solifenasiinisuksinaattia, mikä vastaa 7,5 mg:aa solifenasiinia.
Apuaine, jonka vaikutus tunnetaan: laktoosimonohydraatti 127,9 mg.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti, kalvopäällysteinen (tabletti)
Kliiniset tiedot
Käyttöaiheet
Yliaktiivisesta virtsarakosta johtuvan pakkoinkontinenssin ja/tai tihentyneen virtsaamistarpeen ja virtsapakon oireenmukainen hoito.
Annostus ja antotapa
Annostus
Aikuiset, myös vanhukset
Suositusannos on 5 mg solifenasiinisuksinaattia kerran päivässä. Annosta voidaan suurentaa tarvittaessa 10 mg:aan solifenasiinisuksinaattia kerran päivässä.
Munuaisten vajaatoimintapotilaat
Annoksen muuttaminen ei ole tarpeen, jos potilaalla on lievä tai kohtalainen munuaisten vajaatoiminta (kreatiniinipuhdistuma > 30 ml/min). Potilaita, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ≤ 30 ml/min), tulee hoitaa varoen, ja maksimiannos on 5 mg kerran päivässä (ks. kohta Farmakokinetiikka).
Maksan vajaatoimintapotilaat
Annoksen muuttaminen ei ole tarpeen potilaille, joilla on lievä maksan vajaatoiminta. Potilaita, joilla on kohtalainen maksan vajaatoiminta (Child-Pugh-pisteet 7–9), tulee hoitaa varoen, ja maksimiannos on 5 mg kerran päivässä (ks. kohta Farmakokinetiikka).
Potilaat, joita hoidetaan potenteilla CYP450 3A4‑estäjillä
Solifenacin Orion ‑valmisteen enimmäisannos on 5 mg annettaessa samanaikaisesti ketokonatsolia tai terapeuttisin annoksin muita potentteja CYP3A4‑estäjiä, esim. ritonaviiria, nelfinaviiria, itrakonatsolia (ks. kohta Yhteisvaikutukset).
Pediatriset potilaat
Solifenacin Orion ‑valmisteen turvallisuutta ja tehoa lasten ja alle 18 vuoden ikäisten nuorten hoidossa ei ole vielä varmistettu. Siksi Solifenacin Orion ‑valmistetta ei pidä käyttää lapsille ja nuorille.
Antotapa
Solifenacin Orion otetaan suun kautta. Tabletit tulee niellä kokonaisina nesteen kanssa. Lääke voidaan ottaa ruuan kanssa tai ilman.
Vasta-aiheet
- yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille
- solifenasiini on vasta-aiheinen potilaille, joilla on virtsaumpi, vaikea gastrointestinaalinen sairaus (mukaan lukien toksinen megakoolon), myasthenia gravis tai ahdaskulmaglaukooma tai joilla on näiden tilojen riski
- hemodialyysipotilaat (ks. kohta Farmakokinetiikka)
- vaikeaa maksan vajaatoimintaa sairastavat potilaat (ks. kohta Farmakokinetiikka)
- samanaikainen potentin CYP3A4‑estäjän, esim. ketokonatsolin, käyttö potilailla, joilla on vaikea munuaisten vajaatoiminta tai kohtalainen maksan vajaatoiminta (ks. kohta Yhteisvaikutukset).
Varoitukset ja käyttöön liittyvät varotoimet
Muut tihentyneen virtsaamistarpeen aiheuttavat syyt (sydämen vajaatoiminta tai munuaissairaus) tulee selvittää ennen Solifenacin Orion ‑hoidon aloittamista. Mahdolliseen virtsatieinfektioon on aloitettava asianmukainen bakteerilääkitys.
Solifenacin Orion ‑valmistetta tulee käyttää varoen seuraavissa tapauksissa:
- kliinisesti merkittävä virtsarakon ulosvirtauseste, joka aiheuttaa virtsaummen riskin
- gastrointestinaaliset obstruktiiviset häiriöt
- maha-suolikanavan motiliteetin vähenemisriski
- vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ≤ 30 ml/min; ks. kohdat Annostus ja antotapa ja Farmakokinetiikka), ja näillä potilailla maksimiannos on 5 mg
- kohtalainen maksan vajaatoiminta (Child-Pugh-pisteet 7–9, ks. kohdat Annostus ja antotapa ja Farmakokinetiikka), ja näillä potilailla maksimiannos on 5 mg
- samanaikainen potentin CYP3A4‑estäjän, esim. ketokonatsolin, käyttö (ks. kohdat Annostus ja antotapa ja Yhteisvaikutukset)
- hiatushernia/gastroesofageaalinen refluksi ja/tai esofagiittia mahdollisesti aiheuttavien tai pahentavien lääkevalmisteiden (kuten bisfosfonaattien) samanaikainen käyttö
- autonominen neuropatia.
QT-ajan pitenemistä ja kääntyvien kärkien kammiotakykardiaa (torsades de pointes) on havaittu potilailla, joilla on riskitekijöitä, kuten aiemmin todettu pitkä QT ‑oireyhtymä sekä hypokalemia.
Turvallisuutta ja tehoa ei ole vielä varmistettu potilailla, joilla detrusor-lihaksen yliaktiivisuuteen on neurogeeninen syy.
Joillakin solifenasiinia käyttäneillä potilailla on todettu angioedeemaa ja siihen liittyvää hengitysteiden ahtautumista. Jos angioedeemaa ilmenee, solifenasiinin käyttö tulee lopettaa ja aloittaa asianmukainen hoito ja/tai toimenpiteet.
Joillakin solifenasiinilla hoidetuilla potilailla on raportoitu anafylaktinen reaktio. Anafylaktisia reaktioita saavilla potilailla solifenasiinin käyttö tulee lopettaa ja aloittaa asianmukainen hoito ja/tai toimenpiteet.
Solifenacin Orion ‑valmisteen enimmäisteho voidaan todeta aikaisintaan 4 viikon kuluttua.
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, saamelaisilla esiintyvä laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä valmistetta.
Yhteisvaikutukset
Farmakodynaamiset yhteisvaikutukset
Muiden antikolinergisiä ominaisuuksia omaavien lääkkeiden samanaikainen käyttö saattaa voimistaa terapeuttisia vaikutuksia ja haittavaikutuksia. Solifenacin Orion ‑hoidon lopettamisen jälkeen tulee pitää noin viikon tauko ennen muun antikolinergisen hoidon aloittamista. Kolinergisten reseptoriagonistien samanaikainen käyttö saattaa heikentää solifenasiinin terapeuttista vaikutusta.
Solifenasiini saattaa heikentää maha-suolikanavan motiliteettia stimuloivien lääkkeiden, kuten metoklopramidin ja sisapridin, vaikutusta.
Farmakokineettiset yhteisvaikutukset
In vitro ‑tutkimukset ovat osoittaneet, että terapeuttisina pitoisuuksina solifenasiini ei estä ihmisen maksan mikrosomaalisia entsyymejä, kuten CYP1A1/2, 2C9, 2C19, 2D6 tai 3A4. Siksi on epätodennäköistä, että solifenasiini vaikuttaisi näiden CYP‑entsyymien vaikutuksesta metaboloituvien lääkkeiden puhdistumaan.
Muiden lääkeaineiden vaikutukset solifenasiinin farmakokinetiikkaan
Solifenasiini metaboloituu CYP3A4:n vaikutuksesta. Potentin CYP3A4‑estäjän, ketokonatsolin (200 mg/vrk), samanaikainen käyttö kaksinkertaisti solifenasiinin AUC‑arvon. Annettaessa samanaikaisesti ketokonatsolia 400 mg/vrk solifenasiinin AUC‑arvo kolminkertaistui. Siksi Solifenacin Orion ‑valmisteen enimmäisannos on 5 mg annettaessa samanaikaisesti ketokonatsolia tai terapeuttisin annoksin muita potentteja CYP3A4‑estäjiä (esim. ritonaviiri, nelfinaviiri, itrakonatsoli)(ks. kohta Annostus ja antotapa).
Solifenasiinin ja potentin CYP3A4‑estäjän samanaikainen käyttö on vasta-aiheinen potilailla, joilla on vaikea munuaisten vajaatoiminta tai keskivaikea maksan vajaatoiminta.
Entsyymi-induktion vaikutuksia solifenasiinin ja sen metaboliittien farmakokinetiikkaan eikä myöskään suuren affiniteetin CYP3A4‑substraattien vaikutusta solifenasiinin käytön yhteydessä ole tutkittu. Koska solifenasiini metaboloituu CYP3A4:n vaikutuksesta, farmakokineettiset yhteisvaikutukset muiden suuren affiniteetin CYP3A4‑substraattien (esim. verapamiili, diltiatseemi) ja CYP3A4‑entsyymiä indusoivien lääkkeiden (esim. rifampisiini, fenytoiini, karbamatsepiini) kanssa ovat mahdollisia.
Solifenasiinin vaikutus muiden lääkeaineiden farmakokinetiikkaan
Ehkäisytabletit
Solifenasiinin käytön yhteydessä solifenasiinin ja yhdistelmäehkäisytablettien (etinyyliestradioli/levonorgestreeli) välillä ei ole osoitettu farmakokineettistä yhteisvaikutusta.
Varfariini
Solifenasiinin ottaminen ei muuttanut R‑varfariinin eikä S‑varfariinin farmakokinetiikkaa eikä niiden vaikutusta protrombiiniaikaan.
Digoksiini
Solifenasiinin ottamisen ei osoitettu vaikuttavan digoksiinin farmakokinetiikkaan.
Raskaus ja imetys
Raskaus
Solifenasiinihoidon aikana raskaaksi tulleista naisista ei ole saatavissa kliinisiä tutkimustietoja. Eläinkokeissa ei ole havaittu suoria haitallisia vaikutuksia hedelmällisyyteen, alkion/sikiön kehitykseen tai synnytykseen (ks. kohta Prekliiniset tiedot turvallisuudesta). Ihmiseen mahdollisesti kohdistuvia riskejä ei tunneta. Valmistetta tulee määrätä varoen raskaana oleville naisille.
Imetys
Ei ole tietoa solifenasiinin erittymisestä ihmisen rintamaitoon. Hiirillä solifenasiini ja/tai sen metaboliitit erittyivät maitoon ja aiheuttivat vastasyntyneille poikasille annoksesta riippuen painon ja kasvun jälkeenjääneisyyttä (ks. kohta Prekliiniset tiedot turvallisuudesta). Siksi Solifenacin Orion ‑valmisteen käyttöä tulee välttää rintaruokinnan aikana.
Hedelmällisyys
Hedelmällisyyttä koskevia tietoja ei ole saatavilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Koska solifenasiini voi muiden antikolinergisten aineiden tavoin aiheuttaa näön hämärtymistä, heitehuimausta, uneliaisuutta ja väsymystä (ks. kohta Haittavaikutukset), ajokyky ja koneiden käyttökyky voi heikentyä.
Haittavaikutukset
Yhteenveto haittavaikutusprofiilista
Solifenasiinin farmakologisen vaikutuksen vuoksi Solifenacin Orion saattaa aiheuttaa antikolinergisiä haittavaikutuksia, jotka ovat (yleensä) lieviä tai kohtalaisia. Antikolinergisten haittavaikutusten esiintymistiheys on annosriippuvainen.
Solifenasiinin käytön yhteydessä useimmin ilmoitettu haittavaikutus oli suun kuivuminen. Sitä esiintyi 11 %:lla potilaista, jotka saivat 5 mg kerran päivässä, 22 %:lla potilaista, jotka saivat 10 mg kerran päivässä, ja 4 %:lla potilaista, jotka saivat plaseboa. Suun kuivuminen oli yleensä lievää ja johti vain satunnaisesti hoidon keskeyttämiseen. Yleisesti ottaen hoitomyöntyvyys oli erittäin hyvä (noin 99 %), ja noin 90 % potilaista, jotka saivat solifenasiinihoitoa, jatkoi 12 viikkoa kestäneessä tutkimuksessa loppuun asti.
Taulukkoyhteenveto haittavaikutuksista
MedDRA-elinjärjestelmän luokka | Hyvin yleiset ≥ 1/10 | Yleiset ≥ 1/100, < 1/10 | Melko harvinaiset ≥ 1/1 000, < 1/100 | Harvinaiset ≥ 1/10 000, < 1/1 000 | Hyvin harvinaiset < 1/10 000 | Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin) |
Infektiot | Virtsatieinfektio, kystiitti | |||||
Immuunijärjestelmä | Anafylaktinen reaktio* | |||||
Aineenvaihdunta ja ravitsemus | Vähentynyt ruokahalu*, hyperkalemia* | |||||
Psyykkiset häiriöt | Hallusinaatiot*, sekavuus* | Delirium* | ||||
Hermosto | Uneliaisuus, makuhäiriöt | Heitehuimaus,* päänsärky* | ||||
Silmät | Näön hämärtyminen | Silmien kuivuminen | Glaukooma* | |||
Sydän | Torsades de pointes*, pidentynyt QT-aika EKG:ssa*, eteisvärinä*, sydämentykytys*, takykardia* | |||||
Hengityselimet, rintakehä ja välikarsina | Nenän kuivuminen | Dysfonia* | ||||
Ruoansulatuselimistö | Suun kuivuminen | Ummetus, pahoinvointi, ruuansulatushäiriöt, vatsakipu | Gastroesofageaalinen refluksitauti, kurkun kuivuminen | Paksusuolen obstruktio, ulosteen pakkautuminen peräsuoleen, oksentelu* | Suolen tukkeuma*, vatsavaivat* | |
Maksa ja sappi | Maksan toimintahäiriö*, poikkeavat maksan toimintakokeiden tulokset* | |||||
Iho ja ihonalainen kudos | Ihon kuivuminen | Kutina*, ihottuma* | Monimuotoinen punavihoittuma*, urtikaria*, angioedeema* | Hilseilevä ihotulehdus* | ||
Luusto, lihakset ja sidekudos | Lihasheikkous* | |||||
Munuaiset ja virtsatiet | Virtsaamisvaikeudet | Virtsaumpi | Munuaistoiminnan heikkeneminen* | |||
Yleisoireet ja antopaikassa todettavat haitat | Väsymys, perifeerinen turvotus |
*todettu markkinoilletulon jälkeen
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty–haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Solifenasiinin yliannostus saattaa aiheuttaa vaikeita antikolinergisiä vaikutuksia. Suurin yksittäiselle potilaalle vahingossa annettu solifenasiiniannos oli 280 mg annettuna viiden tunnin aikana. Tästä aiheutui mielentilamuutoksia, jotka eivät vaatineet sairaalahoitoa.
Hoito
Solifenasiinin yliannostustapauksessa potilaalle on annettava lääkehiiltä. Mahahuuhtelusta on hyötyä, jos se tehdään tunnin kuluessa, mutta potilasta ei tule oksennuttaa.
Kuten muidenkin antikolinergisten aineiden kohdalla, oireita voidaan hoitaa seuraavasti:
- vaikeat sentraaliset antikolinergiset vaikutukset, kuten hallusinaatiot tai voimakas kiihottuneisuus: hoidetaan fysostigmiinilla tai karbakolilla.
- kouristukset tai voimakas kiihottuneisuus: hoidetaan bentsodiatsepiineilla.
- hengitysvajaus: hoidetaan avustamalla hengitystä.
- takykardia: hoidetaan beetasalpaajalla.
- virtsaumpi: hoidetaan katetroimalla.
- mydriaasi: hoidetaan pilokarpiinisilmätipoilla ja/tai siirtämällä potilas pimeään huoneeseen.
Kuten muidenkin muskariinireseptorien antagonistien kohdalla, yliannostustapauksessa on kiinnitettävä erityistä huomiota potilaisiin, joilla tiedetään olevan QT-ajan pidentymisriski (esim. hypokalemia, bradykardia, QT-aikaa tunnetusti pidentävien lääkevalmisteiden samanaikainen anto) ja joilla on entuudestaan jokin merkityksellinen sydänsairaus (eli sydänlihaksen hapenpuute, rytmihäiriöt, kongestiivinen sydämen vajaatoiminta).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Virtsaelinten sairauksien lääkkeet, tihentyneen virtsaamistarpeen ja inkontinenssin hoitoon tarkoitetut lääkkeet, ATC-koodi: G04BD08.
Vaikutusmekanismi
Solifenasiini on kilpaileva, spesifinen kolinergisten reseptorien antagonisti.
Farmakodynaamiset vaikutukset
Virtsarakon hermotus tapahtuu parasympaattisten kolinergisten hermojen kautta. Asetyylikoliini supistaa detrusorin sileälihasta muskariinireseptorien kautta, joista tärkeimpänä M3‑alatyyppi. Farmakologiset tutkimukset in vitro ja in vivo osoittavat, että solifenasiini on muskariini-M3‑alatyypin reseptorin kilpaileva estäjä. Lisäksi solifenasiinin todettiin olevan spesifinen muskariinireseptorien antagonisti, jolla on vähän tai ei lainkaan affiniteettia erilaisiin muihin tutkittuihin reseptoreihin ja ionikanaviin.
Kliininen teho ja turvallisuus
Solifenasiinihoitoa vuorokausiannoksilla 5 mg ja 10 mg tutkittiin useissa kaksoissokkoutetuissa, satunnaistetuissa, kontrolloiduissa kliinisissä tutkimuksissa miehillä ja naisilla, joilla oli yliaktiivinen rakko. Kuten alla olevasta taulukosta nähdään, sekä 5 mg että 10 mg solifenasiiniannoksilla saatiin aikaan tilastollisesti merkitsevä paraneminen ensisijaisissa ja toissijaisissa päätetapahtumissa plaseboon verrattuna. Valmisteen teho havaittiin viikon sisällä hoidon aloittamisesta ja stabilisoitui 12 viikon aikana. Avoimessa pitkäaikaistutkimuksessa osoitettiin, että valmisteen teho pysyi samana vähintään 12 kuukauden ajan. 12 viikon hoidon jälkeen oireet olivat hävinneet noin 50 %:lla potilaista, joilla oli ollut inkontinenssi ennen hoidon aloittamista, ja lisäksi 35 %:lla potilaista virtsaamistiheys väheni alle 8 virtsaamiskertaan päivässä. Yliaktiivisen rakon oireiden hoito vaikuttaa myönteisesti myös useisiin elämänlaadun mittareihin, kuten koettuun yleiseen terveydentilaan, inkontinenssin vaikutukseen, roolirajoituksiin, fyysisiin ja sosiaalisiin rajoituksiin, tunnetiloihin, oireiden vaikeusasteeseen, vaikeusasteiden mittareihin ja uneen/energisyyteen.
Tulokset (yhdistetyt tiedot) neljästä kontrolloidusta vaiheen 3 tutkimuksesta, joissa hoito kesti 12 viikkoa
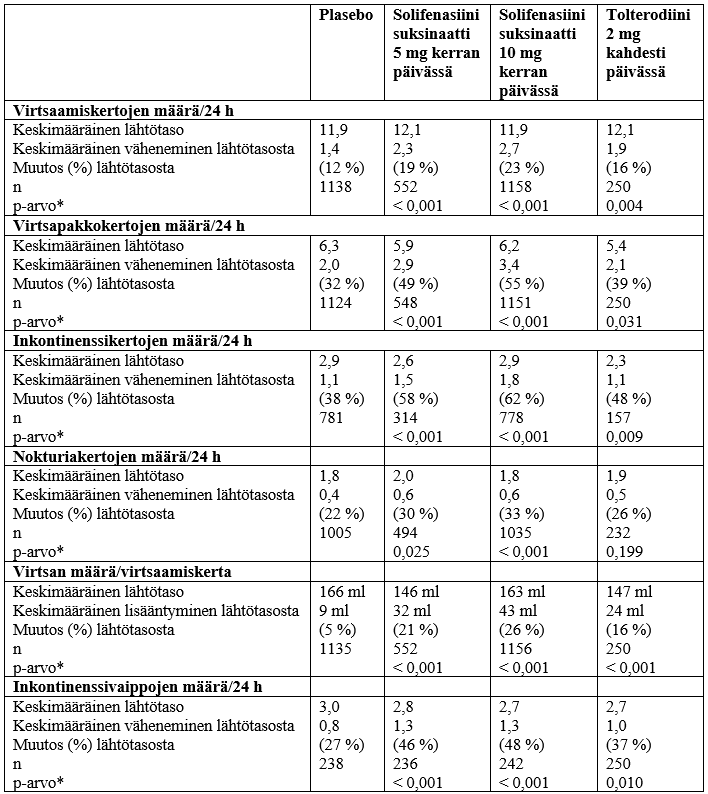
Huom.: Neljässä tutkimuksessa käytettiin 10 mg:n solifenasiinisuksinaattiannosta sekä plaseboa. Kahdessa tutkimuksessa neljästä käytettiin myös 5 mg:n solifenasiinisuksinaattiannosta ja yhdessä näistä tutkimuksista annettiin tolterodiinia 2 mg kahdesti päivässä.
Kaikissa tutkimuksissa ei arvioitu kaikkia parametrejä ja hoitoryhmiä. Siksi esitetyissä potilasmäärissä voi olla eroja parametrien ja hoitoryhmien välillä.
* p‑arvo plaseboon verrattuna
Farmakokinetiikka
Imeytyminen
Solifenasiinin oton jälkeen solifenasiinin huippupitoisuudet plasmassa (Cmax) saavutetaan 3–8 tunnissa. Tmax ei riipu annoksesta. Cmax ja AUC‑arvo suurenevat suhteessa annokseen, kun annos on 5–40 mg. Absoluuttinen biologinen hyötyosuus on noin 90 %. Ruoan nauttiminen ei vaikuta solifenasiinin Cmax‑arvoon eikä AUC‑arvoon.
Jakautuminen
Laskimonsisäisen annon jälkeen solifenasiinin näennäinen jakautumistilavuus on noin 600 l. Solifenasiini sitoutuu suuressa määrin (noin 98 %) plasman proteiineihin, pääasiassa happamaan α1‑glykoproteiiniin.
Biotransformaatio
Solifenasiini metaboloituu suuressa määrin maksassa, ensisijaisesti sytokromi P450 3A4:n (CYP3A4) vaikutuksesta. On myös vaihtoehtoisia metaboliareittejä, jotka saattavat osallistua solifenasiinin metaboliaan. Solifenasiinin systeeminen puhdistuma on noin 9,5 l/h ja terminaalinen puoliintumisaika 45–68 tuntia. Suun kautta tapahtuvan annon jälkeen plasmassa on tunnistettu solifenasiinin lisäksi yksi farmakologisesti aktiivinen metaboliitti (4R‑hydroksisolifenasiini) ja kolme ei-aktiivista metaboliittia (N‑glukuronidi‑, N‑oksidi‑ ja 4R‑hydroksi‑N‑oksidimetaboliitit).
Eliminaatio
Kun suun kautta annettiin kerta-annoksena 10 mg 14C‑merkittyä solifenasiinia, noin 70 % radioaktiivisuudesta mitattiin virtsasta ja 23 % ulosteesta 26 vuorokauden aikana. Noin 11 % radioaktiivisesti merkitystä lääkeaineesta erittyi virtsaan muuttumattomana vaikuttavana aineena, noin 18 % N‑oksidimetaboliittina, 9 % 4R‑hydroksi‑N‑oksidimetaboliittina ja 8 % 4R‑hydroksimetaboliittina (aktiivinen metaboliitti).
Lineaarisuus/ei-lineaarisuus
Farmakokinetiikka on lineaarinen terapeuttisella annosalueella.
Muut erityisryhmät
Vanhukset
Annostuksen muuttaminen potilaan iän perusteella ei ole tarpeen. Vanhuksilla tehdyt tutkimukset ovat osoittaneet, että altistus solifenasiinille (AUC‑arvo) solifenasiinisuksinaatin annon jälkeen (5 mg ja 10 mg kerran päivässä) oli samankaltainen terveillä vanhuksilla (65–80‑vuotiailla) ja terveillä nuorilla tutkittavilla (alle 55‑vuotiailla). Keskimääräinen imeytymisnopeus (tmax) oli vanhuksilla hieman hitaampi, ja terminaalinen puoliintumisaika oli vanhuksilla noin 20 % pidempi. Näitä vähäisiä eroja ei pidetty kliinisesti merkittävinä.
Solifenasiinin farmakokinetiikkaa lapsilla tai nuorilla ei ole varmistettu.
Sukupuoli
Sukupuoli ei vaikuta solifenasiinin farmakokinetiikkaan.
Rotu
Rotu ei vaikuta solifenasiinin farmakokinetiikkaan.
Munuaisten vajaatoiminta
Solifenasiinin AUC-arvo ja Cmax eivät olleet merkitsevästi erilaisia potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta, ja terveillä vapaaehtoisilla. Potilailla, joilla oli vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ≤ 30 ml/min) solifenasiinialtistus oli merkitsevästi suurempi kuin verrokeilla (Cmax noin 30 %, AUC‑arvo yli 100 % ja t½ yli 60 % suurempi). Kreatiniinipuhdistuman ja solifenasiinipuhdistuman välillä havaittiin tilastollisesti merkitsevä suhde.
Farmakokinetiikkaa ei ole tutkittu hemodialyysihoitoa saavilla potilailla.
Maksan vajaatoiminta
Potilailla, joilla on kohtalainen maksan vajaatoiminta (Child-Pugh-pisteet 7–9), Cmax ei muutu, AUC‑arvo suurenee 60 %:lla ja t½ kaksinkertaistuu. Solifenasiinin farmakokinetiikkaa ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta.
Prekliiniset tiedot turvallisuudesta
Farmakologista turvallisuutta, toistuvan altistuksen aiheuttamaa toksisuutta, hedelmällisyyttä, alkion/sikiön kehitystä, geenitoksisuutta ja karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Hiirillä tehdyissä pre- ja postnataalista kehitystä selvittävissä tutkimuksissa emon solifenasiinihoito imetyksen aikana vähensi – annoksesta riippuen – poikasten syntymänjälkeistä eloonjääneisyyttä, alensi poikasten painoa ja hidasti fyysistä kehitystä kliinisesti merkityksellisesti. Annoksesta riippuvaa lisääntynyttä kuolleisuutta – ilman edeltäviä kliinisiä merkkejä – todettiin nuorilla hiirillä, joita hoidettiin 10. tai 21. päivästä syntymän jälkeen käyttäen annoksia, joilla saavutettiin farmakologinen teho. Molemmissa ryhmissä kuolleisuus oli suurempi kuin täysikasvuisilla hiirillä. Nuorilla hiirillä, joita hoidettiin postnataalisesti 10. päivästä alkaen, plasman lääkeainealtistus oli suurempi kuin täysikasvuisilla hiirillä. Postnataalisesta päivästä 21 lähtien systeeminen altistus oli samaa luokkaa kuin täysikasvuisilla hiirillä. Nuorten hiirten lisääntyneen kuolleisuuden aiheuttamia kliinisiä seuraamuksia ei tunneta.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin:
Laktoosimonohydraatti
Maissitärkkelys
Hypromelloosi
Magnesiumstearaatti
Piidioksidi, kolloidinen, vedetön
Kalvopäällyste:
Hypromelloosi
Makrogoli 4000
Titaanidioksidi
Talkki
5 mg: Rautaoksidi, keltainen
10 mg: Rautaoksidi, punainen
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
SOLIFENACIN ORION tabletti, kalvopäällysteinen
5 mg (L:kyllä) 30 fol (7,00 €), 90 fol (44,14 €)
10 mg (L:kyllä) 30 fol (7,32 €), 90 fol (28,11 €)
PF-selosteen tieto
PVC-alumiinifolio-läpipainopakkaus: 3, 5, 10, 20, 30, 50, 60, 90, 100 tai 200 tablettia.
HDPE-purkki ja polypropeenisuljin, jossa on kuumasaumattu sinetti: 100 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
5 mg: Vaaleankeltainen, pyöreä, kaksoiskupera kalvopäällysteinen tabletti, jonka toiselle puolelle on kaiverrettu ”CC” ja toiselle puolelle ”31”. Tabletin halkaisija on 7,6 mm.
10 mg: Vaaleanpunertava, pyöreä, kaksoiskupera kalvopäällysteinen tabletti, jonka toiselle puolelle on kaiverrettu ”CC” ja toiselle puolelle ”32”. Tabletin halkaisija on 7,6 mm.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
SOLIFENACIN ORION tabletti, kalvopäällysteinen
5 mg 30 fol, 90 fol
10 mg 30 fol, 90 fol
- Peruskorvaus (40 %).
ATC-koodi
G04BD08
Valmisteyhteenvedon muuttamispäivämäärä
11.07.2019
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com
