KYLEENA depotlääkevalmiste, kohtuun 19,5 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Terveydenhuollon ammattilainen
Tietoa terveydenhuollon ammattilaisille kohdunulkoisen raskauden riskistä ja Bayerin hormonikierukoiden eroista
Vaikuttavat aineet ja niiden määrät
Yksi depotlääkevalmiste sisältää 19,5 mg levonorgestreelia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet
Lisätietoja vapautumisnopeudesta, ks. kohta Farmakokinetiikka.
Lääkemuoto
Depotlääkevalmiste, kohtuun
Kliiniset tiedot
Käyttöaiheet
Raskauden ehkäisy 5 vuoden ajan
Annostus ja antotapa
Annostus
Kyleena asetetaan kohtuonteloon ja sen teho säilyy enintään viisi vuotta.
Asetus
On suositeltavaa, että Kyleena-valmisteen asettaa aina terveydenhuollon ammattilainen, jolla on kokemusta hormonikierukan asetuksista ja/tai joka on saanut koulutuksen Kyleena-valmisteen asettamiseen.
Potilas on tutkittava huolellisesti ennen asettamista mahdollisten hormonikierukan käytön vasta-aiheiden tunnistamiseksi. Raskaus on poissuljettava ennen asettamista. Huomioi ovulaation ja hedelmöittymisen mahdollisuus ennen tämän valmisteen käyttöä. Kyleena ei sovellu käytettäväksi jälkiehkäisyyn (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet kohdasta ”Lääketieteellinen tutkimus/konsultaatio”).
Taulukko 1: Kyleena-valmisteen asetusajankohta hedelmällisessä iässä oleville naisille
| Kyleena-valmisteen käytön aloittaminen |
|
| Asetus synnytyksen jälkeen | Yllä olevien ohjeiden (Kyleena-valmisteen käytön aloittaminen) lisäksi: Synnytyksen jälkeen tapahtuvaa asetusta tulisi siirtää, kunnes kohtu on täysin supistunut, eikä asetusta pidä tehdä ennen kuin synnytyksestä on kulunut vähintään 6 viikkoa. Jos kohdun supistuminen viivästyy merkittävästi, voi olla hyvä odottaa, kunnes synnytyksestä on kulunut 12 viikkoa. |
| Asetus ensimmäisellä raskauskolmanneksella tehdyn keskeytyksen jälkeen | Kyleena voidaan asettaa välittömästi ensimmäisellä raskauskolmanneksella tehdyn keskeytyksen jälkeen. Tällöin ei tarvita lisäehkäisyä. |
| Kyleena-valmisteen vaihtaminen | Kyleena voidaan vaihtaa uuteen hormonikierukkaan missä tahansa kuukautiskierron vaiheessa. Tällöin ei tarvita lisäehkäisyä. |
| Toisesta ehkäisymenetelmästä (esim. yhdistelmäehkäisyvalmisteet, ehkäisykapseli) vaihtaminen |
|
Huomioitavia asioita asetuksen aikana tai sen jälkeen
Jos asetus on vaikea ja/tai asetuksen aikana tai sen jälkeen ilmenee epätavallisen paljon kipua tai vuotoa, kohdun seinämän puhkeamisen mahdollisuus on otettava huomioon ja suoritettava asianmukaiset toimenpiteet, kuten esimerkiksi gynekologinen tutkimus ja ultraäänitutkimus.
Naisille on tehtävä jälkitarkastus 4–6 viikkoa asetuksen jälkeen poistolankojen tarkistamiseksi ja oikean sijainnin varmistamiseksi. Gynekologinen tutkimus yksinään (mukaan lukien poistolankojen tarkastus) ei välttämättä ole riittävä sulkemaan pois kohdun seinämän osittaista puhkeamista, ja ultraäänitutkimuksen tekemistä voidaan harkita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kyleena-valmisteen erottaa muista hormonikierukoista sekä ultraäänitutkimuksessa näkyvä hopearengas että valmisteen siniset poistolangat. Kyleena-valmisteen T-runko sisältää bariumsulfaattia, jonka ansiosta Kyleena näkyy röntgentutkimuksissa.
Poisto/vaihto
Kyleena poistetaan vetämällä pihdeillä varovasti langoista. Liiallisen voiman tai terävien instrumenttien käyttö poiston aikana voi aiheuttaa hormonikierukan rikkoutumisen. Kyleena-valmisteen poistamisen jälkeen on tarkistettava, että hormonikierukka on ehjä ja että se on poistettu kokonaan. Jos langat eivät ole näkyvissä, hormonikierukan sijainti on määritettävä ultraäänellä tai jollakin muulla menetelmällä. Jos hormonikierukka on ultraäänitutkimuksen perusteella kohtuontelossa, se voidaan poistaa kapeiden pihtien avulla. Tämä saattaa vaatia kohdunkaulan kanavan laajentamista tai muuta kirurgista toimenpidettä.
Hormonikierukka on poistettava viimeistään viiden vuoden kuluttua sen asetuksesta.
Jatkoehkäisy poiston jälkeen
- Jos nainen haluaa jatkaa saman menetelmän käyttöä, uusi hormonikierukka voidaan asettaa välittömästi poistetun hormonikierukan tilalle.
Jos nainen ei halua jatkaa saman ehkäisymenetelmän käyttöä mutta raskautta ei toivota, hormonikierukka tulee poistaa viimeistään seitsemäntenä päivänä vuodon alkamisesta edellyttäen, että naisella on säännöllinen kuukautiskierto. Jos hormonikierukka poistetaan kierron muussa vaiheessa tai naisella ei ole säännöllisiä kuukautisia ja nainen on ollut sukupuoliyhteydessä poistoa edeltävän viikon aikana, on raskauden riski olemassa. Jatkuvan ehkäisyn varmistamiseksi estemenetelmän (esim. kondomien) käyttö on aloitettava viimeistään seitsemän päivää ennen poistoa. Poistamisen jälkeen uuden ehkäisymenetelmän käyttö on aloitettava välittömästi (noudata uuden ehkäisymenetelmän käyttöohjeita)
Iäkkäät potilaat
Kyleena-valmiste ei ole tarkoitettu postmenopausaalisille naisille.
Heikentynyt maksan toiminta
Kyleena-valmistetta ei ole tutkittu potilailla, joilla on heikentynyt maksan toiminta. Kyleena on vasta-aiheinen naisilla, joilla on akuutti maksasairaus tai maksakasvain (ks. kohta Vasta-aiheet).
Heikentynyt munuaisten toiminta
Kyleena-valmistetta ei ole tutkittu potilailla, joilla on heikentynyt munuaisten toiminta.
Pediatriset potilaat
Valmistetta ei ole tarkoitettu käytettäväksi ennen kuukautisten alkamista. Tiedot valmisteen turvallisuudesta ja tehosta nuorilla, katso kohta Farmakodynamiikka.
Antotapa
Hormonikierukan asettaa terveydenhuollon ammattilainen aseptisia työtapoja noudattaen.
Kyleena toimitetaan steriilissä pakkauksessa. Valmisteeseen on yhdistetty asetin, joka mahdollistaa asetuksen yhdellä kädellä. Pakkaus tulee avata vasta juuri ennen sen asettamista. Ei saa steriloida uudelleen. Kyleena on kertakäyttöinen. Älä käytä valmistetta, jos sisäpakkaus on vahingoittunut tai auennut. Älä aseta hormonikierukkaa viimeisen käyttöpäivämäärän (EXP) jälkeen, joka lukee ulkopakkauksessa ja sisäpakkauksessa.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Kyleena-valmisteen ulkopakkauksessa on muistutuskortti potilaalle. Täytä potilaan muistutuskortti ja anna se asetuksen jälkeen potilaalle.
Asetuksen valmistelu
- Tee gynekologinen tutkimus Kyleena-valmisteen vasta-aiheiden havaitsemiseksi (ks. kohdat Vasta-aiheet ja Varoitukset ja käyttöön liittyvät varotoimet kohdasta ”Lääketieteellinen tutkimus/konsultaatio”)
- Vie tähystin emättimeen niin, että kohdunkaula tulee näkyviin ja puhdista kohdunnapukka sekä emätin huolellisesti sopivalla antiseptisella liuoksella.
- Käytä tarvittaessa avustajaa.
- Tartu kohtupihdeillä tai muilla pihdeillä kohdunnapukan etureunaan kohdun suoristamiseksi. Jos kohtu on kallistunut taaksepäin, voi olla parempi ottaa kiinni kohdunkaulan takareunasta. Tarvittaessa oikaise kohdunkaulan kanava vetämällä kevyesti pihdeistä. Jätä pihdit paikoilleen ja vedä niistä kevyesti koko asetustoimenpiteen ajan.
- Työnnä sondi kohdunkaulan kanavan läpi kohdunpohjaan asti sen syvyyden mittaamiseksi ja kohtuontelon suunnan määrittämiseksi ja sulkeaksesi pois sekä kohdun poikkeavuudet (esim. väliseinä, limakalvonalaiset myoomat) että aiemmin asetetun kohdunsisäisen ehkäisimen, jota ei ole poistettu. Jos asetuksen aikana ilmenee ongelmia, kohdunkaulakanavan laajentaminen voi olla tarpeen. Jos kohdunkaulan kanavaa on laajennettava, harkitse kipua lieventävän lääkkeen tai paraservikaalipuudutuksen käyttöä.
Asetus
| 1. Avaa ensin steriili pakkaus kokonaan (kuva 1). Käytä sen jälkeen aseptista tekniikkaa ja steriilejä käsineitä. | |
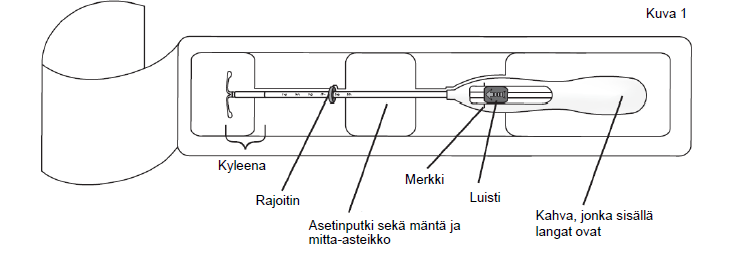 | |
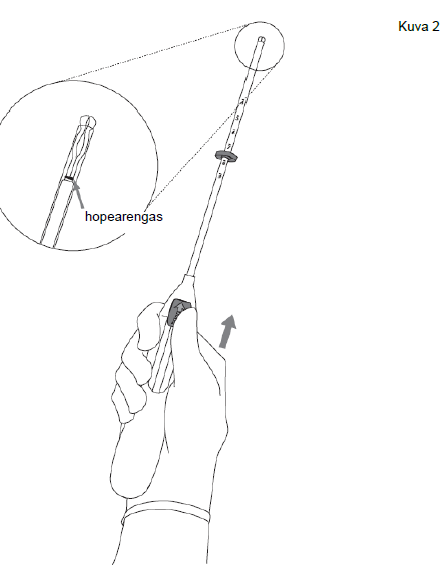
| 2. Työnnä luistia eteenpäin nuolen suuntaan ääriasentoon, jolloin Kyleena latautuu asetinputkeen (kuva 2). |
Kuva 2 |
| TÄRKEÄÄ! Älä vedä luistia alaspäin, koska silloin voit vahingossa vapauttaa Kyleena-valmisteen liian aikaisin. Kun Kyleena vapautuu asetinputkesta, sitä ei voi ladata uudelleen. | |
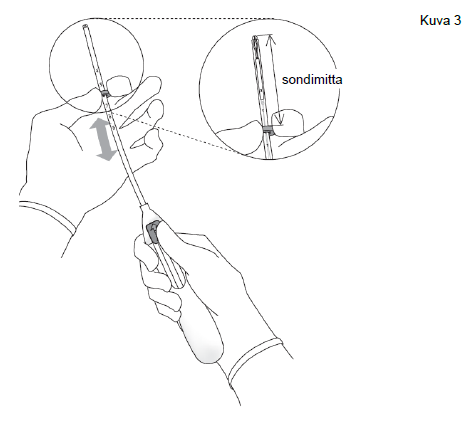
| 3. Pidä luistia ääriasennossa ja aseta rajoittimen yläreuna vastaamaan kohtuontelon sondimittaa (kuva 3). |
Kuva 3 |
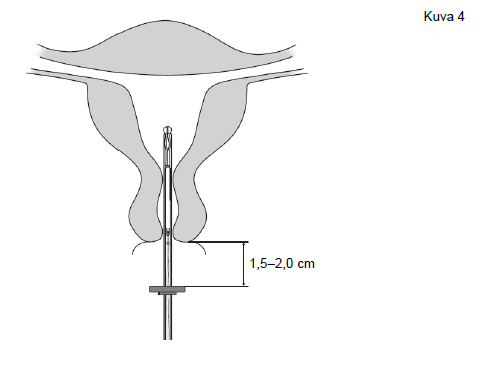
| 4. Pidä luistia ääriasennossa ja vie asetin samalla kohdunkaulan läpi, kunnes rajoitin on noin 1,5–2,0 cm:n päässä kohdunnapukasta (kuva 4). |
Kuva 4 |
| TÄRKEÄÄ! Älä käytä liikaa voimaa työntäessäsi asetinta. Laajenna kohdunkaulan kanavaa tarvittaessa. | |
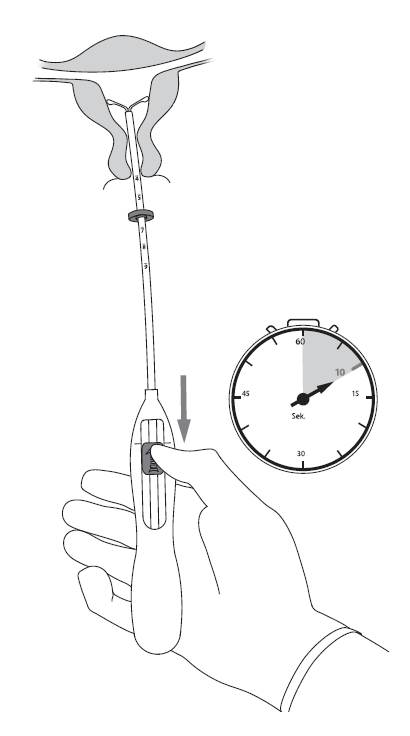
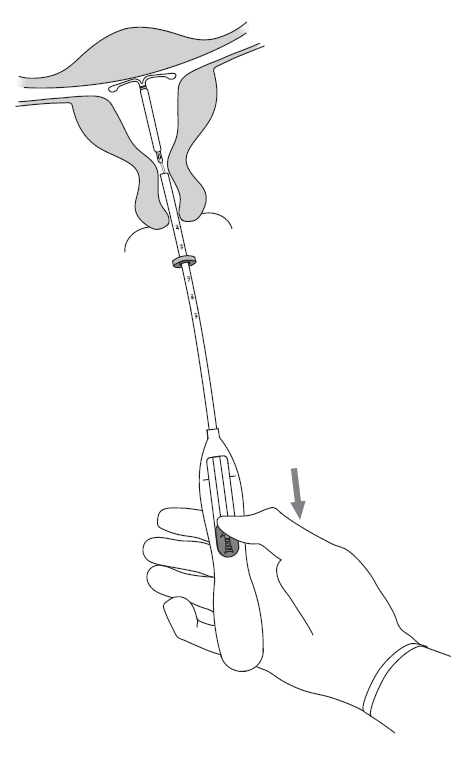
| 5. Pidä asetinta hyvin paikallaan ja avaa Kyleena-valmisteen vaakasakarat vetämällä luistia merkkiin saakka (kuva 5). Odota 5‑10 sekuntia, jotta vaakasakarat aukeavat täysin. |
Kuva 5 |
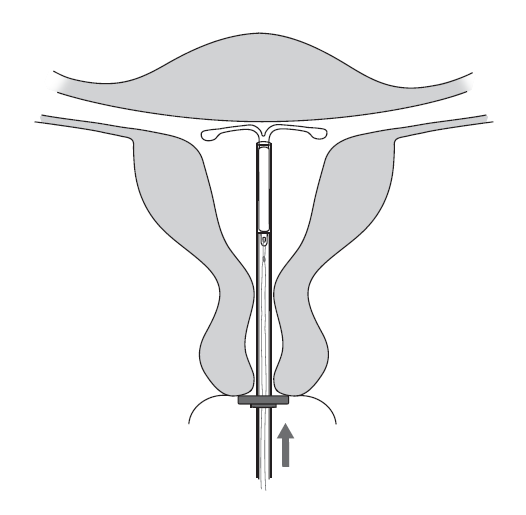
| 6. Työnnä asetinta kevyesti kohti kohdun pohjaa, kunnes rajoitin koskettaa kohdunnapukkaa. Kyleena on nyt kohdun pohjassa (kuva 6). |
Kuva 6 |
| 7. Pidä asetin paikallaan ja vapauta Kyleena vetämällä luisti uloimpaan asentoonsa (kuva 7). Pidä luistia aivan alas saakka vedettynä ja poista asetin vetämällä se ulos. Leikkaa langat niin, että niistä jää noin 2‑3 cm näkyviin kohdunkaulan ulkopuolelle. |
Kuva 7 |
TÄRKEÄÄ! Jos epäilet, että Kyleena ei ole oikein paikoillaan, tarkista sen sijainti (esim. ultraäänitutkimuksella). Poista hormonikierukka, jos se ei ole täysin paikoillaan kohtuontelossa. Poistettua kierukkaa ei saa asettaa uudelleen. | |
Poisto/vaihto
Katso lisätietoja valmisteen poistosta/vaihdosta uuteen kohdasta Annostus ja antotapa Asetus ja poisto/vaihto
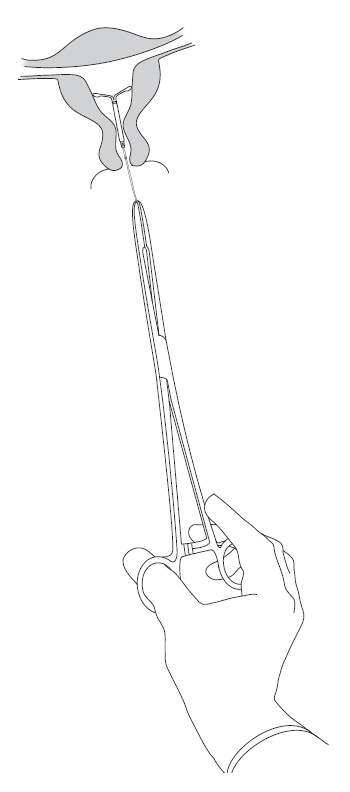
| Kyleena poistetaan vetämällä pihdeillä varovasti langoista (kuva 8). Uusi Kyleena voidaan asettaa välittömästi poiston jälkeen. Kyleena-valmisteen poistamisen jälkeen on tarkistettava, että hormonikierukka on ehjä ja että se on poistettu kokonaan. |
Kuva 8 |
Vasta-aiheet
- raskaus (ks. kohta Raskaus ja imetys)
- akuutti tai toistuva sisäsynnytintulehdus tai tila, joka lisää sisäsynnytintulehdusten riskiä
- akuutti kohdunkaulan tulehdus tai emätintulehdus
- synnytyksen jälkeinen kohtutulehdus tai tulehduksellinen keskenmeno viimeisen kolmen kuukauden kuluessa
- hoitamaton kohdunkaulan epiteelisoluatypia
- pahanlaatuinen kohdun tai kohdunkaulan kasvain
- progestiiniriippuvaiset kasvaimet, kuten rintasyöpä
- epänormaali kohtuverenvuoto, jonka syytä ei ole selvitetty
- synnynnäinen tai hankittu kohdun anomalia, mukaan lukien myoomat, jotka voivat haitata hormonikierukan asetusta ja/tai paikallaan pysymistä (muuttamalla kohtuontelon muotoa)
- akuutti maksasairaus tai maksakasvain
- yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Kyleena-valmisteen käyttöä voidaan jatkaa varovaisuutta noudattaen erikoislääkärikonsultaation perusteella, tai sen poistoa on harkittava, jos potilaalla ilmenee ensimmäistä kertaa jokin seuraavista tiloista:
- migreeni, aurallinen migreeni, johon liittyy epäsymmetristä näön menetystä, tai muita ohimenevään aivoverenkiertohäiriöön viittaavia oireita
- poikkeuksellisen voimakas päänsärky
- keltaisuus
- voimakas verenpaineen nousu
- vakava valtimoperäinen sairaus, kuten aivohalvaus tai sydäninfarkti.
Matala-annoksinen levonorgestreeli saattaa muuttaa glukoositoleranssia, joten diabeetikoiden sokeritasapainoa tulee seurata Kyleena-valmisteen käytön aikana. Yleensä ei kuitenkaan ole tarvetta muuttaa hormonikierukkaa käyttävien diabeetikkojen hoitoa.
Lääketieteellinen tutkimus/konsultaatio
Ennen hormonikierukan asetusta potilaalle tulee kertoa Kyleena-valmisteen eduista sekä riskeistä, mukaan lukien kohdun seinämän puhkeamisen merkit ja oireet sekä kohdunulkoisen raskauden riskistä. Ennen asetusta tulee tehdä gynekologinen tutkimus ja tutkia rinnat. Kohdunkaulan irtosolunäyte tulee ottaa tarvittaessa terveydenhuollon ammattilaisen arvioon perustuen. Raskauden ja sukupuolitautien mahdollisuus tulee sulkea pois. Genitaali-infektiot tulee hoitaa ennen asetusta. Kohdun asento ja kohtuontelon koko tulee selvittää. Kyleena-valmisteen tehon varmistamiseksi ja sen poistumisen riskin pienentämiseksi on tärkeää, että se asetetaan kohdun pohjukkaan. Asetusohjeiden huolellinen noudattaminen on tärkeää.
Asetustekniikan harjoitteluun on kiinnitettävä huomiota.
Asetukseen ja poistoon voi liittyä hieman kipua ja vuotoa. Toimenpide saattaa laukaista vasovagaalisen reaktion (esim. pyörtymisen tai kohtauksen epilepsiapotilaalle).
Poistolangat sekä hormonikierukan oikea asento tulisi tarkastaa 4‑6 viikon kuluttua asetuksesta. Emättimen kautta tehtävää ultraäänitutkimusta voidaan harkita kierukan oikean sijainnin varmistamiseksi. Jos Kyleena-valmistetta ei voida paikallistaa kohtuontelossa, ekspulsion tai täydellisen perforaation mahdollisuus on otettava huomioon (ks. kohta ”Perforaatio” jäljempänä) ja röntgentutkimus voidaan tehdä. Tämän jälkeen potilaan tulee käydä kontrollikäynnillä kerran vuodessa tai useammin, mikäli siihen on kliininen syy.
Kyleena ei sovi käytettäväksi jälkiehkäisyyn.
Kyleena-valmisteen käyttöä runsaiden kuukautisten hoitoon tai estrogeenikorvaushoidon aikaiseen paikalliseen progestiinihoitoon ei ole tutkittu, eikä sitä siksi suositella käytettäväksi näiden hoitoon.
Perforaatio
Kyleena saattaa, useimmiten asetuksen yhteydessä, puhkaista kohtuontelon tai kohdunkaulan, eikä sitä mahdollisesti havaita kuin vasta myöhemmässä vaiheessa. Tämä voi heikentää valmisteen tehoa. Jos asetus on vaikea ja/tai asetuksen aikana tai sen jälkeen ilmenee epätavallisen paljon kipua tai vuotoa, kohdun seinämän puhkeaminen on poissuljettava suorittamalla heti esimerkiksi gynekologinen ja ultraäänitutkimus. Joissakin tapauksissa kierukka saattaa löytyä kohtuontelon ulkopuolelta. Jos puhkeama todetaan, hormonikierukka on poistettava. Kirurginen toimenpide voi olla tarpeen.
Kohdunsisäistä ehkäisintä käyttävillä naisilla (n = 61 448 naista) tehdyssä laajassa prospektiivisessa non-interventionaalisessa seurantatutkimuksessa yhden vuoden seuranta-aikana käyttäjillä perforaation esiintymistiheys oli 1,3 (95 % CI: 1,1 – 1,6) tuhatta asetusta kohden koko tutkimusaineistossa, 1,4 (95 % CI: 1,1 – 1,8) tuhatta asetusta kohden levonorgestreelikierukkaa käyttävien ryhmässä ja 1,1 (95 % CI: 0,7 – 1,6) tuhatta asetusta kohden kuparikierukkaa käyttävien ryhmässä.
Tutkimus osoitti, että asetukseen liittyi suurentunut perforaatioriski sekä imetyksen aikana että synnytyksen jälkeisten 36 viikon aikana (ks. taulukko 2). Molemmat riskitekijät olivat riippumattomia asetettavan kohdunsisäisen ehkäisimen tyypistä.
Taulukko 2: Perforaation esiintyvyys tuhatta asetusta kohden koko tutkimusaineistossa vuoden seuranta-aikana, ryhmiteltynä imetyksen ja synnytyksestä asetusajankohtaan kuluneen ajan mukaan
| Nainen imettää asetusajankohtana | Ei imetystä asetusajankohtana | |
| Asetus ≤ 36 viikkoa synnytyksen jälkeen | 5,6 (95 % CI 3,9–7,9; n = 6 047 asetusta) | 1,7 (95 % CI 0,8–3,1; n = 5 927 asetusta) |
| Asetus > 36 viikkoa synnytyksen jälkeen | 1,6 (95 % CI 0,0–9,1; n = 608 asetusta) | 0,7 (95 % CI 0,5–1,1; n = 41 910 asetusta) |
Kun tämän tutkimuksen alaryhmässä seuranta-aikaa jatkettiin 5 vuoteen (n = 39 009 naista, joille asetettiin joko levonorgestreelikierukka tai kupariehkäisin, 73 prosentilla näistä naisista koko seuranta-ajan tiedot olivat saatavilla), perforaation esiintymistiheys minä tahansa ajankohtana 5 vuoden seurantajakson aikana oli 2,0 (95 % CI: 1,6–2,5) tuhatta asetusta kohden. Asetus imetyksen aikana sekä synnytyksen jälkeisten 36 viikon aikana vahvistuivat riskitekijöiksi myös alaryhmässä, jota seurattiin 5 vuoden ajan.
Perforaation riski voi kasvaa naisilla, joilla on huonosti liikkuva taaksepäin kallistunut kohtu.
Asetuksen jälkeinen uusintatutkimus tehdään, kuten otsikon ”Lääketieteellinen tutkimus/konsultaatio” alla ohjeistetaan, mukaan lukien mahdollinen emättimen kautta tehtävä ultraäänitutkimus kierukan oikean asennon varmistamiseksi 4–6 viikon kuluttua asettamisesta. Ohjeita voidaan mukauttaa kliinisen tarpeen mukaan naisille, joilla on perforaation riskitekijöitä.
Kadonneet langat
Jos hormonikierukan langat eivät näy kohdunkaulan kanavasta kontrollikäynneillä, huomaamatta jääneen poistumisen ja raskauden mahdollisuus on poissuljettava. On mahdollista, että langat ovat vetäytyneet ylöspäin kohtuun tai kohdunkaulan kanavan sisälle, josta ne saattavat tulla uudelleen esille seuraavan kuukautisvuodon aikana. Kun raskauden mahdollisuus on poissuljettu, langat saadaan useimmiten esiin kohdunkaulan kanavasta sopivan instrumentin avulla. Jos lankoja ei löydy, ekspulsion tai perforaation mahdollisuus on otettava huomioon. Emättimen kautta tehtävää ultraäänitutkimusta voidaan käyttää hormonikierukan paikallistamiseksi. Jos ultraäänilaitetta ei ole käytettävissä tai jos paikallistaminen ei onnistu ultraäänitutkimuksella, Kyleena-valmisteen paikallistamiseen voidaan käyttää röntgentutkimusta.
Rintasyöpä
Meta-analyysi 54 epidemiologisesta tutkimuksesta osoitti, että rintasyövän diagnoosin suhteellinen riski on hieman suurentunut (RR=1,24) niillä naisilla, jotka käyttävät parhaillaan yhdistelmäehkäisytabletteja, etupäässä estrogeeni-progestiinivalmisteita. Suurentunut riski palaa vähitellen normaaliksi 10 vuoden aikana yhdistelmäehkäisytablettien käytön loputtua. Koska rintasyöpä on harvinainen alle 40-vuotiailla naisilla, rintasyöpädiagnoosien lisääntynyt määrä tällä hetkellä ja viime aikoina yhdistelmäehkäisytabletteja käyttäneiden joukossa on pieni verrattuna rintasyövän kokonaisriskiin. Pelkkää progestiinia sisältäviä ehkäisytabletteja käyttävien rintasyöpädiagnoosin riski on mahdollisesti samanlainen kuin yhdistelmäehkäisytablettien käyttäjien riski. Useissa havainnointitutkimuksissa on selvitetty rintasyöpädiagnoosin riskiä levonorgestreelia sisältävän kierukan käyttäjillä, ja vertailukohtana on useimmiten käytetty riskiä henkilöillä, jotka eivät käyttäneet hormonaalista ehkäisyä tai jotka eivät käyttäneet levonorgestreelia sisältävää kierukkaa. Jotkin näistä tutkimuksista ovat viitanneet hieman suurentuneeseen suhteelliseen riskiin levonorgestreelia sisältävän kierukan käyttäjillä, mutta toiset eivät ole, ja saatavilla oleva näyttö ei yleisesti ottaen ole yhtä selkeää kuin yhdistelmäehkäisytablettien kohdalla.
Kohdunulkoinen raskaus
Kliinisissä tutkimuksissa kohdunulkoisten raskauksien määrä Kyleena-valmisteen käyttäjillä oli noin 0,20 sataa naisvuotta kohti. Noin puolet Kyleena-valmisteen käytön aikana alkaneista raskauksista on todennäköisesti kohdunulkoisia.
Naisille, jotka harkitsevat Kyleena-valmisteen käyttöä, tulee kertoa kohdunulkoisen raskauden merkeistä, oireista ja riskeistä. Jos nainen tulee raskaaksi Kyleena-valmistetta käyttäessään, kohdunulkoisen raskauden mahdollisuus täytyy ottaa huomioon ja poissulkea.
Kohdunulkoisen raskauden riski on suurempi naisilla, joilla on aikaisemmin ollut kohdunulkoinen raskaus, munanjohtimien leikkaus tai lantion alueen tulehdus. Kohdunulkoisen raskauden mahdollisuus on otettava huomioon alavatsakipujen yhteydessä, erityisesti jos kuukautiset jäävät tulematta tai jos amenorreapotilaalla alkaa esiintyä vuotoa.
Kohdunulkoinen raskaus saattaa vaikuttaa naisen myöhempään hedelmällisyyteen, ja tämän vuoksi Kyleena-valmisteen riskit ja hyödyt tulee arvioida huolellisesti yksilöllisesti.
Vaikutus kuukautisvuotoon
Useimmilla käyttäjillä Kyleena vaikuttaa vuotoihin. Muutokset johtuvat siitä, että levonorgestreeli vaikuttaa suoraan endometriumiin eivätkä ne välttämättä korreloi munasarjojen toiminnan kanssa.
Epäsäännöllistä vuotoa ja tiputtelua esiintyy varsin yleisesti ensimmäisten käyttökuukausien aikana. Tämän jälkeen kuukautisten kesto lyhenee ja vuodon määrä vähenee voimakkaan endometriumsuppression vuoksi. Niukka vuoto muuttuu usein oligomenorreaksi tai amenorreaksi.
Kliinisissä tutkimuksissa harvat kuukautiset ja/tai amenorrea kehittyivät vähitellen. Viidennen käyttövuoden loppuun mennessä noin 26,4 %:lla käyttäjistä oli harvat kuukautiset ja 22,6 %:lla amenorrea. Jos kuukautisvuotoa ei ole tullut kuuden viikon kuluessa edellisen vuodon alkamisesta, tulee raskauden mahdollisuus ottaa huomioon. Raskaustestin toistaminen ei ole tarpeen potilailla, joilla ei ole kuukautisvuotoa, ellei muita raskauden merkkejä ilmaannu.
Jos vuoto muuttuu myöhemmin runsaammaksi ja/tai epäsäännöllisemmäksi, potilas on tutkittava huolellisesti, sillä verenvuoto voi olla myös kohdun limakalvon polyypin, kohdun limakalvon liikakasvun tai syövän oire ja runsaat kuukautiset voivat olla merkki kierukan huomaamatta jääneestä poistumisesta.
Lantion alueen infektiot
Lantion alueen infektioita on raportoitu kaikkien kierukoiden käytön yhteydessä. Kyleena ja sen asetin ovat steriilejä, mutta ne saattavat joutua asetuksen aikana kosketuksiin bakteerien kanssa ja näin ollen kuljettaa mikrobeja sisäsynnyttimiin. Kliinisissä tutkimuksissa sisäsynnytintulehduksia (PID) havaittiin useammin Kyleena-valmisteen käytön alkuaikana, mikä vastaa kuparikierukoiden käytöstä julkaistuja tietoja, joiden mukaan tulehdusriski on suurimmillaan asetusta seuraavien 3 viikon aikana. Sen jälkeen tulehdusten esiintyminen vähenee.
Ennen Kyleena-valmisteen käytön aloittamista, potilaan lantion alueen tulehduksiin liittyvät riskit tulee arvioida huolellisesti (esim. useat seksipartnerit, seksitaudit, aiemmat sisäsynnytintulehdukset). Lantion alueen tulehduksella, kuten sisäsynnytintulehduksella, voi olla vakavat seuraukset, ja se saattaa heikentää hedelmällisyyttä ja lisätä kohdunulkoisen raskauden riskiä.
Kuten muidenkin gynekologisten tai kirurgisten toimenpiteiden yhteydessä, vaikea tulehdus tai sepsis (mukaan lukien A-ryhmän streptokokkisepsis) saattaa esiintyä kierukan asetuksen jälkeen. Tämä on kuitenkin erittäin harvinaista.
Kyleena on poistettava, jos naisella on toistuvia kohdun limakalvon tulehduksia tai sisäsynnytintulehduksia tai jos akuutti tulehdus on vaikea tai se ei reagoi hoitoon.
Tulehdusnäytteiden otto on indisoitu ja monitorointia suositellaan, vaikka tulehdukseen viittaavat oireet olisivat lieviä.
Ekspulsio
Kyleena-valmisteella tehdyissä kliinisissä tutkimuksissahormonikierukan poistuminen oli harvinaista (< 4 % asetuksista) ja luvut vastasivat muista kierukoista raportoituja lukuja.
Kyleena-valmisteen osittaisen tai täydellisen poistumisen mahdollisia oireita voivat olla vuoto tai kipu. Hormonikierukka voi kuitenkin luisua pois kohdusta naisen huomaamatta, mikä johtaa ehkäisysuojan häviämiseen. Normaalisti Kyleena-valmiste vähentää kuukautisvuodon määrää, joten vuodon määrän lisääntyminen saattaa olla merkki hormonikierukan poistumisesta.
Ekspulsion riski on suurentunut
- Naisilla, joilla on aiemmin ollut runsas kuukautisvuoto
- Naisilla, joilla on asetustilanteessa normaalia korkeampi BMI; tämä riski kasvaa asteittain BMI:n noustessa.
Naisia tulisi neuvoa hormonikierukan poistumiseen mahdollisesti liittyvien oireiden varalta ja miten Kyleena-valmisteen lankoja tunnustellaan sekä kehottaa ottamaan yhteyttä terveydenhuollon ammattilaiseen, mikäli lankoja ei tunnu. Estemenetelmää (kuten kondomia) tulee käyttää siihen asti, kunnes Kyleena-valmisteen sijainti on varmistettu.
Osittainen paikoiltaan poistuminen voi heikentää Kyleena-valmisteen tehoa.
Osittain paikoiltaan poistunut Kyleena-valmiste on poistettava. Uusi hormonikierukka voidaan asettaa poiston yhteydessä edellyttäen, että raskauden mahdollisuus on poissuljettu.
Munasarjakystat / laajentuneet munarakkulat
Koska Kyleena-valmisteen ehkäisyteho perustuu pääasiassa paikalliseen vaikutukseen kohdun sisällä, se ei tavallisesti muuta hedelmällisessä iässä olevien naisten ovulointia, johon kuuluvat säännöllinen munarakkuloiden kehitys, munasolujen vapautuminen ja munarakkuloiden atresia. Joskus kuitenkin munarakkuloiden atresia voi viivästyä ja munarakkuloiden kehittyminen jatkua. Näitä laajentuneita munarakkuloita ei voi kliinisesti erottaa munasarjakystista ja niitä, mukaan luettuna munasarjakystat, hemorragiset munasarjakystat ja revenneet munasarjakystat, on raportoitu kliinisissä tutkimuksissa haittavaikutuksena noin 22,2 %:lla Kyleena-valmisteen käyttäjistä. Suurin osa kystistä on oireettomia, mutta jotkut niistä saattavat aiheuttaa alavatsakipua tai yhdyntäkipuja.
Suurimmalla osalla naisista laajentuneet munarakkulat häviävät spontaanisti 2‑3 kuukauden aikana. Ellei näin tapahdu, suositellaan ultraäänitutkimusta tai muuta tutkimusta ja löydösten mukaista hoitoa. Kirurgista hoitoa tarvitaan harvoin.
Psyykkiset häiriöt
Masentunut mieliala ja masennus ovat tunnettuja hormonaalisten ehkäisyvalmisteiden käyttöön liittyviä haittavaikutuksia (ks. kohta Haittavaikutukset). Masennus voi olla vakavaa, ja se on itsetuhoisen käyttäytymisen ja itsemurhan tunnettu riskitekijä. Naisia on kehotettava ottamaan yhteyttä terveydenhuollon ammatilaiseen, jos heillä esiintyy mielialan muutoksia ja masennuksen oireita, myös pian hoidon aloittamisen jälkeen
Varotoimenpiteet poiston yhteydessä
Liiallisen voiman tai terävien instrumenttien käyttö poiston aikana voi aiheuttaa hormonikierukan rikkoutumisen (ks. kohta Annostus ja antotapa). Kyleena-valmisteen poistamisen jälkeen tulee tarkistaa, että hormonikierukka on ehjä ja että se on poistettu kokonaan.
Yhteisvaikutukset
Huomioitavaa: mahdollisten yhteisvaikutusten varalta tulee tutustua kaikkien samanaikaisesti käytettävien lääkkeiden valmisteyhteenvetoihin.
Muiden lääkevalmisteiden vaikutus Kyleena-valmisteeseen
Yhteisvaikutuksia voi esiintyä käytettäessä maksaentsyymejä indusoivia lääkevalmisteita, mikä voi johtaa sukupuolihormonien lisääntyneeseen puhdistumaan.
Lääkeaineet, jotka lisäävät levonorgestreelin puhdistumaa, esimerkiksi:
Fenytoiini, barbituraatit, primidoni, karbamatsepiini sekä mahdollisesti myös okskarbatsepiini, topiramaatti, felbamaatti, griseofulviini ja mäkikuismauutetta (Hypericum perforatum) sisältävät rohdosvalmisteet.
Näiden lääkevalmisteiden vaikutusta Kyleena-valmisteen ehkäisytehoon ei tiedetä, mutta vaikutuksen ei uskota olevan merkittävä, koska Kyleena-valmisteen toimintamekanismi on paikallinen.
Lääkeaineet, joilla on vaihteleva vaikutus levonorgestreelin puhdistumaan, esimerkiksi:
Useat HIV-proteaasin estäjät ja ei-nukleosidisten käänteiskopioijaentsyymin estäjät voivat suurentaa tai pienentää progestiinin plasmakonsentraatiota käytettäessä samanaikaisesti sukupuolihormoneita.
Aineet, jotka vähentävät levonorgestreelin puhdistumaa (entsyymi-inhibiittorit):
Voimakkaiden ja kohtalaisten CYP3A4-inhibiittoreiden kuten atsolisienilääkkeiden (esim. flukonatsoli, itrakonatsoli, ketokonatsoli, vorikonatsoli), verapamiilin, makrolidiantibioottien (esim. klartiromysiini, erytromysiini), diltiatseemin ja greippimehun käyttö voi nostaa plasman progestiinin pitoisuutta.
Magneettikuvaus (MRI)
Ei-kliinisissä testeissä, joissa käytettiin toista levonorgestreelikierukkaa (samankokoinen hopearengas ja T-runko), on osoitettu, että magneettikuvauksen suorittaminen Kyleena-valmisteen asetuksen jälkeen (MR:n suorittaminen ehdollista) on turvallista seuraavien ehtojen täyttyessä:
- staattinen magneettikenttä on enintään 3 teslaa
- spatiaalinen gradienttikenttä on korkeintaan 36 000 gaussia/cm (360 T/m) tai vähemmän
- koko kehon keskimääräinen spesifinen absorptioarvo (SAR) korkeintaan 4 W/kg ensimmäisen tason kontrolloidussa vaiheessa, 15 minuutin jatkuvan kuvantamisen aikana.
Ei-kliinisissä kokeissa edellä mainittu levonorgestreelikierukka tuotti 15 minuutin MR-kuvantamisen aikana 1,8 °C tai pienemmän lämpötilan nousun, kehon keskimääräisen spesifisen absorptioarvon (SAR) ollessa 2,9 W/kg. Kuvantaminen suoritettiin 3 teslan voimakkuudella, käyttäen lähetys-/ vastaanottopääkelaa.
Magneettikuvan laatu voi heikentyä hieman, jos tutkimuksen kohde on samassa kohdassa kuin Kyleena-valmisteen sijaintikohta tai suhteellisen lähellä sitä.
Raskaus ja imetys
Hedelmällisyys
Levonorgestreelia sisältävän hormonikierukan käyttö ei vaikuta myöhempään hedelmällisyyteen. Hormonikierukan poiston jälkeen hedelmällisyys palautuu normaaliksi (ks. kohta Farmakodynamiikka).
Raskaus
Kyleena-valmistetta ei saa käyttää raskauden aikana, katso kohta Vasta-aiheet
Jos nainen tulee raskaaksi Kyleena-valmisteen käytön aikana, hormonikierukka on poistettava niin pian kuin mahdollista, sillä raskauden aikana kohdussa oleva kierukka saattaa lisätä keskenmenon tai ennenaikaisen synnytyksen riskiä. Kyleena-valmisteen poisto voi myös laukaista keskenmenon. Kohdunulkoinen raskaus on poissuljettava.
Jos nainen kuitenkin haluaa jatkaa raskautta ja hormonikierukan poisto ei onnistu, hänelle tulisi kertoa riskeistä sekä ennenaikaisen synnytyksen lapselle aiheuttamista seuraamuksista. Tällaisen raskauden kulkua on seurattava tarkasti. Naista tulee kehottaa ilmoittamaan kaikista raskauden komplikaatioihin viittaavista oireista, kuten kouristavista vatsakivuista, joihin liittyy kuumetta.
Lisäksi, levonorgestreelin kohdunsisäisestä altistuksesta johtuvaa virilisaation riskin lisääntymistä tyttösikiölle ei voida poissulkea. Tyttösikiön ulkoisten sukupuolielinten maskulinisaatiosta on ollut yksittäisiä tapauksia paikallisen levonorgestreelialtistuksen seurauksena hormonikierukan ollessa paikallaan raskauden aikana.
Imetys
Yleisesti ottaen kuusi viikkoa synnytyksen jälkeen aloitettavalla, pelkkää progestiinia sisältävällä valmisteella ei ole todettu olevan haitallisia vaikutuksia lapsen kasvuun tai kehitykseen. Levonorgestreelia vapauttava hormonikierukka ei vaikuta äidinmaidon määrään tai laatuun. Pieniä määriä progestiinia (noin 0,1 % levonorgestreeliannoksesta) siirtyy imettävien äitien rintamaitoon.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Kyleena-valmisteella ei ole tunnettua haitallista vaikutusta ajokykyyn ja koneiden käyttökykyyn.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Useimmilla naisilla ilmenee Kyleena-valmisteen asettamisen jälkeen muutoksia kuukautisvuodossa. Ajan myötä amenorrean ja harvojen kuukautisten yleisyys nousee, kun taas pitkittyneen ja epäsäännöllisen vuodon ja tiheiden kuukautisten yleisyys laskee. Kliinisissä tutkimuksissa havaittiin vuotoprofiileista seuraavaa:
Taulukko 3: Kyleena-valmisteen kliinisissä tutkimuksissa raportoidut vuotoprofiilit
| Kyleena | Ensimmäiset 90 päivää | Seuraavat 90 päivää | Vuoden 1 lopussa | Vuoden 3 lopussa | Vuoden 5 lopussa |
| Amenorrea | < 1 % | 5 % | 12 % | 20 % | 23 % |
| Harvat kuukautiset | 10 % | 20 % | 26 % | 26 % | 26 % |
| Tiheät kuukautiset | 25 % | 10 % | 4 % | 2 % | 2 % |
| Pitkittynyt vuoto* | 57 % | 14 % | 6 % | 2 % | 1 % |
| Epäsäännöllinen vuoto | 43 % | 25 % | 17 % | 10 % | 9 % |
*Tutkimushenkilöt, joilla on pitkittynyttä vuotoa, saattavat kuulua myös johonkin muuhun ryhmään (paitsi amenorrea)
Haittavaikutustaulukko
Kyleena-valmisteen käytön yhteydessä raportoitujen haittavaikutuksien yleisyys on esitetty seuraavassa taulukossa. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Esiintyvyydet on määritelty seuraavasti:
hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvin harvinainen (< 1/10 000).
| Elinjärjestelmä | |
| Psyykkiset häiriöt | |
| Yleinen | Masentunut mieliala / masennus, libidon väheneminen |
| Hermosto | |
| Hyvin yleinen | Päänsärky |
| Yleinen | Migreeni |
| Verisuonisto | |
| Yleinen | Huimaus |
| Ruoansulatuselimistö | |
| Hyvin yleinen | Vatsakipu / lantion alueen kipu |
| Yleinen | Pahoinvointi |
| Iho ja ihonalainen kudos | |
| Hyvin yleinen | Akne / seborrea |
| Yleinen | Alopesia |
| Melko harvinainen | Hirsutismi |
| Sukupuolielimet ja rinnat | |
| Hyvin yleinen | Vuodon muutokset, mukaan lukien kuukautisvuodon määrän lisääntyminen ja vähentyminen, tiputteluvuoto, harvat kuukautiset ja amenorrea, munasarjakysta*, vulvovaginiitti |
| Yleinen | Sisäsynnytintulehdus, dysmenorrea, rintojen kipu/arkuus, hormonikierukan poistuminen (täydellinen ja osittainen), valkovuoto |
| Melko harvinainen | Kohdun seinämän puhkeaminen** |
| Tutkimukset | |
| Yleinen | Painonnousu |
* Kliinisissä tutkimuksissa munasarjojen kystat tuli raportoida haittavaikutuksina, jos ne olivat epänormaaleja, ei-funktionaalisia kystoja ja/tai niiden läpimitta oli ultraäänitutkimuksessa > 3 cm.
** Yleisyys perustuu laajaan prospektiiviseen non-interventionaaliseen seurantatutkimukseen, jossa osoitettiin, että asetus imetyksen aikana sekä asetus synnytyksen jälkeisenä 36 viikon aikana ovat toisistaan riippumattomia perforaation riskitekijöitä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Perforaation yleisyys oli "harvinainen" Kyleena-valmistetta koskevissa kliinisissä tutkimuksissa, joissa ei ollut mukana imettäviä naisia.
Valittujen haittavaikutusten kuvaus
Levonorgestreelikierukan käytön yhteydessä on raportoitu yliherkkyystapauksia, joihin on liittynyt ihottumaa, urtikariaa ja angioedeemaa.
Jos nainen tulee raskaaksi käyttäessään Kyleena-valmistetta, kohdunulkoisen raskauden suhteellinen riski on tavallista suurempi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet Kohdunulkoinen raskaus).
Kumppani saattaa tuntea hormonikierukan langat yhdynnän aikana.
Seuraavia haittavaikutuksia on raportoitu liittyen Kyleena-valmisteen asetukseen tai poistoon:
Toimenpiteen aiheuttama kipu tai verenvuoto, asetuksen laukaisema vasovagaalinen reaktio, johon liittyy huimaus tai pyörtyminen. Toimenpide saattaa epilepsiaa sairastavalla laukaista epileptisen kohtauksen.
Sepsis-tapauksia (mukaan lukien A-ryhmän streptokokkisepsis) on raportoitu kohdunsisäisen ehkäisimen asetuksen jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Kyleena-valmisteen turvallisuusprofiili on oletettavasti sama alle 18-vuotialla käyttäjillä kuin yli 18-vuotiailla. Turvallisuustiedot nuorilla, ks. kohta Farmakodynamiikka.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haitta- tasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Ei sovellettavissa.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Progestiinia sisältävä muovikierukka, ATC-koodi: G02BA03
Farmakodynaamiset vaikutukset
Kyleena vaikuttaa pääosin paikallisena progestiinina kohtuontelossa.
Kohdun limakalvon suuri levonorgestreelipitoisuus ehkäisee limakalvon estrogeeni- ja progestiinireseptorien synteesiä. Kohdun limakalvo reagoi suhteellisen vähän estradiolin vaihteluihin, jolloin ilmenee voimakas antiproliferatiivinen vaikutus. Käytön aikana kohdun limakalvolla ilmenee sekä morfologisia muutoksia että heikko paikallinen vierasainereaktio. Kohdunkaulan liman paksuuntuminen estää siittiöiden kulkua kanavan läpi. Kohdun ja munanjohtimien paikalliset olosuhteet ehkäisevät siittiöiden liikkuvuutta ja toimintakykyä, jolloin myös hedelmöityminen estyy. Kyleena-valmisteella suoritetuissa kliinisissä tutkimuksissa ovulaatiota havainnoitiin suurimmalla osalla tutkimusjoukon naisista. Ensimmäisen vuoden aikana ovulaatio havaittiin 23 naisella 26 naisesta, toisena vuonna 19 naisella 20 naisesta ja kolmantena vuonna kaikilla 16 naisella. Neljäntenä vuonna ovulaatio havaittiin yhdellä vielä tutkimusjoukossa mukana olevalla naisella. Viidentenä vuonna ei naisia enää ollut tässä tutkimusjoukossa.
Kliininen teho ja turvallisuus
Kyleena-valmisteen ehkäisytehoa on tutkittu kliinisessä tutkimuksessa, johon osallistui 1 452 naista. Tutkimushenkilöt olivat 18–35-vuotiaita ja heistä 39,5 % (574) oli synnyttämättömiä naisia. Synnyttämättömistä naisista 84 % (482) ei ollut koskaan ollut raskaana.
Yhden vuoden Pearlin indeksi oli 0,16 (95 % luottamusväli 0,02–0,58) ja viiden vuoden Pearlin indeksi 0,29 (95 % luottamusväli 0,16–0,50). Ehkäisy petti noin 0,2 %:lla ensimmäisenä vuonna ja kumulatiivisesti noin 1,4 %:lla viiden vuoden aikana. Tähän lukuun sisältyvät myös havaitsemattomien ekspulsioiden ja perforaatioiden aiheuttamat raskaudet. Hormonikierukan käyttö ei vaikuta tulevaan hedelmällisyyteen. Viisi vuotta kestäneessä Kyleena-valmistetta koskevassa tutkimuksessa 116 naista tuli raskaaksi 12 kuukauden seurantajaksolla niistä 163 naisesta, jotka halusivat tulla raskaaksi ja keskeyttivät valmisteen käytön.
Toisen matala-annoksisen levonorgestreelikierukan turvallisuusprofiili on 304 nuorella tehdyn tutkimuksen perusteella yhtenäinen aikuisväestön kanssa. Tehon odotetaan olevan sama sekä alle 18-vuotiailla että sitä vanhemmilla käyttäjillä.
Kuukautiskiertoon vaikuttaa levonorgestreelin suora vaikutus kohdun limakalvoon eikä sitä säätele munasarjojen toiminta. Munarakkuloiden kehittymisessä, ovulaatiossa tai estradioli- ja progesteronituotannossa ei ole selvää eroa naisilla, joiden vuotoprofiilit ovat erilaiset. Kohdun limakalvon proliferaation estoon liittyvässä prosessissa saattaa aluksi olla tiputtelun lisääntymistä ensimmäisten käyttökuukausien aikana. Tämän jälkeen kohdun limakalvon voimakkaan suppression tuloksena kuukautisvuodon kesto ja määrä pienenevät Kyleena-valmisteen käytön aikana. Niukka vuoto muuttuu usein oligomenorreaksi tai amenorreaksi. Munasarjojen toiminta on normaalia ja estradiolipitoisuudet säilyvät ennallaan jopa silloin, kun Kyleena-valmisteen käyttäjällä on amenorrea.
Farmakokinetiikka
Levonorgestreeli vapautuu paikallisesti kohtuonteloon. In vivo -vapautumiskäyrälle on tunnusomaista alun jyrkkä lasku, joka progressiivisesti hidastuu ja jossa ensimmäisen vuoden jälkeen on vain pieni muutos aiotun 5 vuoden käytön loppuun saakka. Arvioidut in vivo -vapautumisnopeudet eri ajankohtina näkyvät taulukossa 4.
Taulukko 4: Arvioidut in vivo -vapautumisnopeudet, jotka perustuvat ex vivo -jäämätietoihin.
| Aika | Arvioitu in vivo -vapautumisnopeus [mikrogrammaa/24 tuntia] |
| 24 päivää asetuksen jälkeen | 17,5 |
| 60 päivää asetuksen jälkeen | 15,3 |
| 1 vuosi asetuksen jälkeen | 9,8 |
| 3 vuotta asetuksen jälkeen | 7,9 |
| 5 vuotta asetuksen jälkeen | 7,4 |
| Keskimäärin 1 vuoden aikana | 12,6 |
| Keskimäärin 5 vuoden aikana | 9,0 |
Imeytyminen
Hormonikierukan asetuksen jälkeen levonorgestreelin vapautuminen kohtuonteloon alkaa heti. Yli 90 % vapautuneesta levonorgestreelista on systeemisesti saatavilla. Levonorgestreelin maksimipitoisuudet seerumissa saavutetaan kahden viikon kuluessa Kyleena-valmisteen asetuksesta. Seitsemän päivän kuluttua asetuksesta levonorgestreelin keskimääräinen pitoisuus on 162 pg/ml (5. -95. persintiilit; 81 pg/ml - 308 pg/ml). Tämän jälkeen levonorgestreelin pitoisuus laskee vähitellen ja kolmen vuoden kuluttua keskimääräinen pitoisuus on 91 pg/ml (5. - 95 persintiilit; 47 - 170 pg/ml) ja viiden vuoden kuluttua 83 pg/ml (5. -95. persintiilit; 45 - 153 pg/ml). Levonorgestreelia vapauttavan hormonikierukan käytöstä aiheutuva kohtuontelon suuri paikallinen lääkealtistus saa aikaan voimakkaan pitoisuusgradientin kohdun limakalvolta kohtulihakseen (gradientti kohdun limakalvosta kohtulihakseen > 100-kertainen) ja pienen levonorgestreelipitoisuuden seerumissa (gradientti kohdun limakalvosta seerumiin > 1 000-kertainen).
Jakautuminen
Levonorgestreeli sitoutuu ei-spesifisesti seerumin albumiiniin ja spesifisesti sukupuolihormoneja sitovaan globuliiniin (SHBG). Alle 2 % seerumin kokonaislääkepitoisuudesta on vapaana steroidina. Levonorgestreeli sitoutuu korkealla affiniteetilla SHBG:iin. Näin ollen SHBG-pitoisuuden vaihtelut seerumissa johtavat levonorgestreelin kokonaispitoisuuden nousuun (korkeilla SHBG-pitoisuuksilla) tai laskuun (alhaisilla SHBG-pitoisuuksilla) seerumissa. Ensimmäisen kolmen kuukauden kuluessa Kyleena-valmisteen asetuksesta SHBG-pitoisuus laskee keskimäärin noin 30 % ja pitoisuus pysyy suhteellisen tasaisena 5 käyttövuoden aikana. Levonorgestreelin keskimääräinen näennäinen jakautumistilavuus on noin 106 litraa.
Biotransformaatio
Levonorgestreelin metaboloituminen on laajaa. Tärkeimmät metaboliareitit ovat Δ4-3-okso-ryhmän reduktio ja hydroksylaatio paikoilla 2α, 1β ja 16β, mitä seuraa konjugoituminen. CYP3A4 toimii levonorgestreelin oksidatiivisen metabolian pääasiallisena entsyyminä. In vitro -tutkimusten perusteella tämä CYP-välitteinen metaboliareitti on kuitenkin vähemmän keskeinen kuin reduktio ja konjugaatio.
Eliminaatio
Levonorgestreelin kokonaispuhdistuma plasmasta on noin 1,0 ml/min/kg. Vain hyvin pieniä määriä levonorgestreelia erittyy muuttumattomassa muodossa. Metaboliitit erittyvät ulosteeseen ja virtsaan noin suhteessa 1. Puoliintumisaika on noin 1 vuorokausi.
Lineaarisuus/ei-lineaarisuus
Levonorgestreelin farmakokinetiikka riippuu SHBG-pitoisuudesta, johon puolestaan vaikuttavat estrogeenit ja androgeenit. SHBG-pitoisuuden lasku johtaa levonorgestreelin kokonaispitoisuuden laskuun seerumissa osoittaen levonorgestreelin farmakokinetiikan olevan ei-lineaarinen ajan suhteen. Tämä ei oletettavasti vaikuta Kyleena-valmisteen tehoon, koska valmisteen vaikutus on lähinnä paikallinen.
Pediatriset potilaat
Nuorilla naisilla, joiden kuukautiset olivat alkaneet (keski-ikä 16,2, vaihteluväli 12–18 vuotta), toisella matala-annoksisella levonorgestreelikierukalla tehdyssä vuoden mittaisessa faasi III -tutkimuksessa, 283 nuoren farmakokineettinen analyysi osoitti, että levonorgestreelin arvioitu pitoisuus seerumissa oli nuorilla hieman suurempi (noin 10 %) kuin aikuisilla. Tämä tulos korreloi nuorten keskimääräisesti alhaisemman kehonpainon kanssa. Nuorten arvioitu vaihteluväli asettuu kuitenkin aikuisten arvioidun vaihteluvälin sisälle, osoittaen arvojen suurta samankaltaisuutta.
Kyleena-valmisteen farmakokinetiikassa ei oleteta olevan eroa nuorten ja aikuisten välillä.
Etniset erot
Toisella matala-annoksisella levonorgestreelikierukalla on Aasian ja Tyynen valtameren alueella tehty kolmen vuoden mittainen faasi III -tutkimus (93 % aasialaisa naisia ja 7 % muihin etnisiin ryhmiin kuuluvia naisia). Vertailtaessa levonorgestreelin tästä tutkimuksesta aasialaiselta väestöltä saatuja farmakokineettisia parametreja toisen faasi III -tutkimuksen kaukasialaisen väestön tunnuslukuihin, ei havaittu kliinisesti merkitsevää eroa systeemisessä altistuksessa ja muissa farmakokineettisissä parametreissa. Lisäksi päivittäinen vapautumisnopeus levonorgestreelia sisältävästä hormonikierukasta oli sama molemmissa väestöryhmissä.
Kyleena-valmisteen farmakokinetiikassa ei ole oleteta olevan eroa eri etnisissä ryhmissä.
Prekliiniset tiedot turvallisuudesta
Levonorgestreelin farmakologista turvallisuutta, farmakokinetiikkaa ja toksisuutta, mukaan lukien genotoksisuutta ja karsinogeenisuutta, koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille. Apinoilla tehdyt tutkimukset, joissa levonorgestreelia annettiin kohdun sisään 9‑12 kuukauden ajan, vahvistivat farmakologisen vaikutuksen paikallisuuden ja hyvän paikallisen toleranssin eikä paljastanut merkkejä systeemisestä toksisuudesta. Kaniineilla ei havaittu sikiötoksisuutta annettaessa levonorgestreelia kohtuun.
Hormoniytimen elastomeeriosien, tuotteen polyeteeni- ja polypropeenimateriaalien kuten myös hopearenkaan sekä elastomeerin ja levonorgestreelin yhdistelmän turvallisuustutkimuksissa, jotka perustuivat geneettisen toksikologian arviointiin in vitro- ja in vivo -tutkimusjärjestelmissä sekä bioyhteensopivuustutkimuksiin hiirillä, rotilla, marsuilla, kaniineilla ja in vitro -tutkimusjärjestelmissä, ei ole paljastanut bioyhteensopimattomuutta.
Ympäristöön kohdistuvien riskien arviointi
Ympäristöön kohdistuvien riskien arviointitutkimuksissa on osoitettu, että levonorgestreeli voi aiheuttaa haittaa vesistöille (ks. kohta Käyttö- ja käsittelyohjeet).
Farmaseuttiset tiedot
Apuaineet
Polydimetyylisiloksaanielastomeeri
Piidioksidi, kolloidinen, vedetön
Polyeteeni
Bariumsulfaatti
Polypropeeni
Kupariftalosyaniini
Hopea
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
KYLEENA depotlääkevalmiste, kohtuun
19,5 mg (L:ei) 1 kpl (152,73 €)
PF-selosteen tieto
Tuote on pakattu yksittäin lämpömuovattuun läpipainopakkaukseen (PETG), jossa on repäisykansi (PE).
Pakkauskoot: 1 x 1 ja 5 x 1.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Tuote koostuu valkoisesta tai mekein valoisesta läpikuultavan kalvon peittämästä lääkeytimestä, joka on kiinnitetty T-rungon pystysakaraan. Pystysakara sisältää lisäksi hopealenkin, joka sijaitsee lähellä vaakasakaroita. Valkoisen T-rungon toisessa päässä on lenkki ja toisessa päässä kaksi vaakasakaraa. Lenkkiin on kiinnitetty kaksi sinistä poistolankaa. Depotlääkevalmisteen pystysakara on asetusputken sisällä asettimen kärjessä. Asetin koostuu kahvasta ja luistista, joihin on yhdistetty rajoitin, lukko, esitaivutettu asetinputki sekä mäntä. Poistolangat sijaitsevat asetinputken ja kahvan sisällä.
Kyleena-hormonikierukan mitat: 28 x 30 x 1,55 mm
Käyttö- ja käsittelyohjeet
Valmiste on steriilipakkauksessa, joka tulee avata vasta juuri ennen hormonikierukan asettamista. Valmistetta käsiteltäessä on noudatettava aseptisia työtapoja. Jos steriilipakkauksen sauman havaitaan olevan auki, valmiste on hävitettävä riskijätteen hävittämisestä annettujen paikallisten vaatimusten mukaisesti. Tämä koskee myös käytetyn Kyleena-valmisteen ja asettimen hävittämistä.
Hormonikierukan asettaa terveydenhuollon ammattilainen aseptisia työtapoja noudattaen (ks. kohta Annostus ja antotapa).
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. Tämä lääkevalmiste voi olla haitallinen ympäristölle (ks. kohta Prekliiniset tiedot turvallisuudesta).
Korvattavuus
KYLEENA depotlääkevalmiste, kohtuun
19,5 mg 1 kpl
- Ei korvausta.
ATC-koodi
G02BA03
Valmisteyhteenvedon muuttamispäivämäärä
18.11.2025
Yhteystiedot
 BAYER OY
BAYER OY Tuulikuja 2, PL 73
02151 Espoo
020 785 21
www.bayer.fi