OZALIN oral lösning i endosbehållare 2 mg/ml
Kvalitativ och kvantitativ sammansättning
Varje ml OZALIN innehåller 2 mg midazolam.
Varje 5 ml ampull med OZALIN innehåller 10 mg midazolam.
Hjälpämnen med kända effekter: etanol (mindre än 100 mg per ampull), natrium (mindre än 1 mmol (23 mg) per ampull), gammadex (400 mg per ampull och mindre än tillåten daglig exponering på 20 mg/kg/dag vid den rekommenderade dosen).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Oral lösning i endosbehållare.
Kliniska uppgifter
Terapeutiska indikationer
OZALIN är avsett för spädbarn, barn och ungdomar (från 6 månader till 17 år), för måttlig sedering före ett terapeutiskt eller diagnostiskt ingrepp för att lindra ångest, obehag och oro inför ingreppet, eller som förmedicinering inför anestesi.
Dosering och administreringssätt
OZALIN oral lösning ska endast administreras av sjukvårdspersonal.
Allmänna riktlinjer för fasta ska iakttas före sedering.
Dosering
Dosen måste anpassas till patientens vikt.
OZALIN ska administreras oralt med en enkeldos på 0,25 mg/kg till barn från 6 månaders ålder. En ytterligare direkt efterföljande dos rekommenderas inte.
Maxdosen ska inte överstiga 20 mg midazolam (motsvarande 2 ampuller), även till barn oder ungdomar som väger över 80 kg.
Ozalin är indikerat för att administreras som enkeldos och det finns ingen information om upprepad administrering av Ozalin.
Dosering till överviktiga barn och ungdomar ska beräknas utifrån faktisk kroppsvikt, upp till maxgränsen på 20 mg.
Dosen måste anpassas till patientens vikt. Den orala applikatorn är graderad i kg, från 3 kg till 40 kgkroppsvikt (se avsnitt Särskilda anvisningar för destruktion och övrig hantering, nr. 6), med tre typer av graderingsmarkeringar:
- En liten markering som motsvarar 1 kg, dvs.: 0,25 mg midazolam,
- En mellanstor markering som motsvarar 5 kg, dvs.: 1,25 mg midazolam,
- En stor markering som motsvarar 10 kg, dvs.: 2,5 mg midazolam
För patienter som väger över 40 kg krävs 2 ampuller. Den minsta dosen som kan dras upp från en ampull, är en dos för 3 kg. För patienter som väger 41 eller 42 kg och behöver mer än en ampull: använd en mindre dos från den första ampullen och komplettera dosen med en andra ampull, se exempel nedan:
- För en patient som väger 41 kg rekommenderas det att använda en dos för 30 kg från den första ampullen och en dos för 11 kg från den andra
- För en patient som väger 42 kg: använd en dos för 30 kg från den första ampullen och en dos för 12 kg från den andra.
Särskilda populationer
Nedsatt njurfunktion
OZALIN ska användas med försiktighet hos patienter med kronisk njursvikt, eftersom eliminering av midazolam kan fördröjas och dess effekter förlängas.
Nedsatt leverfunktion
Nedsatt leverfunktion minskar clearance av midazolam, vilket ökar den terminala halveringstiden (för eliminering) liksom biotillgänglighet. Noggrann övervakning av dessa effekter och av vitala tecken är nödvändig efter administrering av midazolam hos dessa patienter (se avsnitt Varningar och försiktighet).
Pediatrisk population
Säkerheten och effekten av OZALIN hos barn under 6 månaders ålder har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
OZALIN är endast avsett för oral användning och ska administreras med dess specifika orala applikator som graderats i kg.
OZALIN ska administreras ungefär 30 minuter före ingreppet eller anestesin.
Den orala applikatorn och filterröret är engångsartiklar för fyllning och administrering.
Efter användning, ska ampullen, den orala applikatorn och filterröret kasseras.
Fullständiga anvisningar finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Hos patienter med:
- överkänslighet mot den aktiva substansen, mot bensodiazepiner eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen,
- myastenia gravis
- akut andningsinsufficiens
- en anatomisk abnormitet i andningsorganen eller lungsjukdom
- sömnapnésyndrom
- svår leverinsufficiens
Varningar och försiktighet
Midazolam ska endast administreras av sjukvårdspersonal i en miljö som är fullt utrustad för att övervaka och stödja andnings- och hjärtfunktion, och av personer som har utbildats i identifiering och hantering av förväntade biverkningar, inklusive andnings- och hjärt-lungräddning. Allvarliga kardiorespiratoriska biverkningar har rapporterats. Dessa har inkluderat andningsdepression, sömnapné, andningsstillestånd och/eller hjärtstillestånd. Det är större sannolikhet för att sådana livshotande händelser inträffar när en hög dosering ges.
Administrering till högriskpatienter
Midazolam bör användas med försiktighet hos patienter med kronisk andningssvikt, eftersom det kan förvärra andningsdepression.
Midazolam ska användas med försiktighet hos patienter med lindrigt eller måttligt nedsatt leverfunktion, hjärtsvikt eller kronisk njursvikt. Midazolam eller dess metabolit kan ackumuleras hos patienter med kronisk njursvikt eller med leversvikt, och clearance av midazolam kan minskas hos patienter med hjärtsvikt.
Oral midazolam ska användas med försiktighet hos patienter med dålig allmänhälsa, eftersom de är mer känsliga för effekterna av bensodiazepiner på det centrala nervsystemet.
Modifiering av midazolameliminering
Oralt midazolam ska användas med försiktighet hos patienter som behandlats med läkemedel som är kända för att hämma eller inducera CYP3A4 (se avsnitt Interaktioner).
Samtidig användning av alkohol/lugnande medel för centrala nervsystemet
Kombinerad användning av midazolam och alkohol och/eller lugnande medel för centrala nervsystemet ska undvikas. En sådan kombination kommer sannolikt att öka de kliniska effekterna av midazolam, vilket kan orsaka djup sedering eller kliniskt signifikant andningsdepression (se avsnitt Interaktioner).
Anamnes på alkoholism och narkotikamissbruk
Liksom andra bensodiazepiner, ska midazolam undvikas hos patienter med en anamnes på alkoholism och narkotikamissbruk.
Amnesi
Midazolam orsakar anterograd amnesi.
Villkor för utskrivning
Patienter som har fått midazolam ska åtföljas av en vuxen vid utskrivning, och endast lämna behandlingsrummet och sjukhuset när helt återställd av sedering och efter att ha fått tillstånd från läkaren.
Hjälpämnen:
Vid den rekommenderade, enstaka dosen på 0,25 mg/kg (med en maximal enstaka dos på 20 mg), är mängden gammadex 10 mg/kg (med en maximal enstaka dos på 800 mg). Denna mängd gammadex ligger under den tillåtna dagliga exponeringen (200 mg/kg/dygn, och 20 mg/kg/dygn för barn som är under 2 år). Därför skulle mängden av gammadex inte överstiga den tillåtna dagliga exponeringen, även om OZALIN oavsiktligt skulle användas med 0,5 mg/kg-dosen.
Läkemedlet innehåller mindre än 1 mmol (23 mg) natrium per ampull, vilket innebär att det i princip är ”natriumfritt”.
Detta läkemedel innehåller maximalt 17,4 mg alkohol (etanol, komponent av apelsinsmaken) per ampull om 5 ml, motsvarande 3,5 mg/ml (etanol/lösning) eller 0,32 % vikt/volym.
Mängden i 1 ampull om 5 ml av detta läkemedel (17,4 mg) motsvarar 0,2 ml vin. Mängden etanol i 2 ampuller om 5 ml av detta läkemedel (34,8 mg) motsvarar 0,4 ml vin, vid den maximala doseringen 20 mg midazolam.
Den låga mängden alkohol i detta läkemedel ger inga märkbara effekter.
Interaktioner
Farmakokinetiska läkemedelsinteraktioner
Eftersom midazolam huvudsakligen metaboliseras via CYP3A4-enzym, kan CYP3A4-hämmare respektive -inducerare öka eller minska plasmakoncentrationer och därmed kan de kliniska effekterna av midazolam öka eller minska och dess verkningstid förlängas eller förkortas. Noggrann övervakning av kliniska effekter och patientens vitala tecken rekommenderas därför efter administrering av midazolam med CYP3A4-hämmare, även efter en enda dos.
I händelse av CYP3A4-inhibition eller irreversibel inhibition, kan effekten på farmakokinetiken hos midazolam kvarstå i flera dagar till flera veckor efter administrering av CYP3A4-modulatorn (t.ex. claritromycin, erytromycin, HIV-proteashämmare, verapamil, diliazem, atorvastatin, aprepitan).
Under samtidig administrering med etinylestradiol och norgestrel, använt som ett p-piller, ändras inte exponering för midazolam påtagligt.
CYP3A4-hämmare:
- Azolantimykotika: ketokonazol, itrakonazol, vorikonazol, flukonazol och posakonazol)
- HIV-proteashämmare: sakvinavir och andra proteashämmare, inklusive kombinationer som innehåller ritonavir.
- Makrolidantibiotika: claritromycin, erytromycin, telitromycin, roxitromycin. Roxitromycin ökar den terminala halveringstiden för midazolam, som administreras oralt i tablettform, med 30 %.
- Kalciumkanalblockerare: diliazem, verapamil. Verapamil och diliazem multiplicerar plasmakoncentrationer av oralt midazolam med 3 respektive 4 och ökar dess terminala halveringstid med 41 % respektive 49 %.
- Substans P-antagonister: aprepitant. Aprepitant orsakar en dosberoende ökning av plasmakoncentrationerna av oralt midazolam. Plasmakoncentrationen multipliceras med 3,3 efter 80 mg/dag av aprepitant och dess terminala halveringstid med ca 2.
- H2-receptorantagonister: cimetidin, ranitidin.
- Selektiva serotoninåterupptagshämmare: fluvoxamin.
- Antikolinerga läkemedel: propiverin.
- Andra läkemedel (atorvastatin, nefazodon, aprepitant, ivacaftor).
- Växtprodukter: grapefruktjuice, Echinacea purpurea, gurkmeja rhizom.
CYP3A4-inducerare:
- Rifamycinantibiotika: rifampicin. Rifampicin minskar plasmakoncentrationen av oralt midazolam med 96 % hos friska försökspersoner, där midazolams psykomotoriska effekter nästan försvinner helt.
- Antiepileptiska läkemedel: karbamazepin, fenytoin. Upprepad administrering av karbamazepin eller fenytoin minskar plasmahalten av oralt midazolam med så mycket som 90 %, och minskar den terminala halveringstiden med 60 %.
- Omvända transkriptashämmare: efavirenz, förhållandet α-hydroxymidazolam (metabolit som genereras av CYP3A4) ökar med en faktor av fem jämfört med midazolam vilket bekräftar induktionseffekten av efavirenz på CYP3A4.
- Johannesört (Hypericum perforatum)
Midazolam är inte känt att ändra farmakokinetiken hos andra läkemedel.
Farmakodynamiska läkemedelsinteraktioner
Samtidig administrering av midazolam och andra lugnande/hypnotiska medel och lugnande medel för centrala nervsystemet ökar sannolikt sedering och andningsdepression.
Sådana lugnande/hypnotiska medel inkluderar alkohol (inklusive läkemedel som innehåller alkohol), opiater/opioider (när de används som smärtstillande medel, hostdämpande medel eller substitutionsbehandlingar), antipsykotika, andra bensodiazepiner som används som anxiolytika eller hypnotiska medel, barbiturater, propofol, ketamin, etomidat, sedativa antidepressiva medel, antihistaminer, antiepileptika och centralt verkande antihypertensiva medel. Midazolam minskar den minsta alveolära koncentrationen (MAC) för inhalationsanestesimedel.
Den kombinerade effekten av alkohol och midazolam ska undvikas utan undantag, och alkoholkonsumtion ska undvikas utan undantag vid administreringen av midazolam (se avsnitt Varningar och försiktighet och avsnitt Överdosering).
Fertilitet, graviditet och amning
Graviditet
Det finns otillräcklig information angående midazolam för att avgöra dess säkerhet under graviditeten. Djurstudier tyder inte på någon teratogenisk effekt, men toxikologiska effekter observerades så som med andra bensodiazepiner. Det finns ingen information om exponering under graviditetens två första trimester.
Administrering av höga doser av midazolam under graviditetens sista trimester vid förlossningen eller vid inducering av anestesi för kejsarsnitt har rapporterats att orsaka sidoeffekter hos modern eller fostret (inhalationsrisk i modern, oregelbundna hjärtslag i fostret, hypotoni, svagt sugande, hypotermi samt andningsdepression hos den nyfödde).
Dessutom kan nyfödda barn vars mödrar har fått bensodiazepiner kroniskt under den sista tiden av graviditeten ha utvecklat fysisk beroende och kan vara i risk att få abstinensbesvär under den postnatala perioden.
Följaktligen kan midazolam användas under graviditeten om det är utan tvekan nödvändigt men man bör undvika användning av det för kejsarsnitt. Risken för nyfödda bör beaktas vid administrering av midazolam för ett kirurgiskt ingrepp vid sen graviditet.
Amning
Midazolam utsöndras i små mängder i bröstmjölk. Ammande mödrar bör rådas att
avbryta amning i 1 dygn efter administrering av midazolam.
Fertilitet
Djurstudier har inte visat någon minskning av fertiliteten (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
OZALIN kan ha påtaglig effekt på förmågan att framföra fordon och använda maskiner.
Sedering, anterograd amnesi, nedsatt uppmärksamhet och nedsatt muskelfunktion kan tillfälligt påverka förmågan att framföra fordon eller använda maskiner. Innan OZALIN administreras, måste patienten varnas att inte köra bil eller använda maskiner innan hen återhämtat sig helt. Läkaren måste besluta när dessa aktiviteter kan återupptas. Det rekommenderas att patienten har sällskap av en vuxen person när hen går hem efter utskrivningen.
Biverkningar
Under administreringen av midazolam har följande biverkningar rapporterats med en okänd frekvens, som inte kan uppskattas från tillgängliga data:
Organsystem | Biverkningar –frekvens okänd |
Hjärtat | Takykardi, bradykardi. Kounis syndrom* |
Psykiska störningar | Paradoxala reaktioner (agitation, excitation, hallucinationer, aggressivitet, disinhibition, dysfori, negativt beteende, ångest), sömnstörningar, ofrivilliga rörelser, akatisi, gånginstabilitet, tremor. |
Centrala och perifera nervsystemet | Långvarig/överdriven sedering, trötthet, dåsighet, yrsel, ataxi, vertigo, dysartri, muntorrhet, salivering, enures, huvudvärk, anterograd amnesi. |
Ögon | (I allmänhet lindriga) dimsyn, dubbelseende |
Andningsvägar, bröstkorg och mediastinum | Hypoxemi, övergående desaturation, laryngospasm, andningsdepression, luftvägsobstruktion, ronki/väsande andning, hicka, dyspné. |
Magtarmkanalen | Kräkningar, illamående. |
Hud och subkutan vävnad | Klåda, urtikariareaktion, hudutslag. |
Muskuloskeletala systemet och bindväv | Nedsatt muskelkontroll. |
Allmänna symtom och/eller symtom vid administreringsstället | Ovanlig trötthet, känsla av svaghet. |
Immunsystemet | Överkänslighet, angioödem. |
*speciellt efter parenteral administrering
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via det nationella rapporteringssystemet.
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Symptom
Liksom med alla bensodiazepiner, orsakar midazolam vanligen trötthet, ataxi, dysartri och nystagmus. En överdos av Midazolam är sällan livshotande om enbart produkten tas, men en överdos kan orsaka areflexi, apné, hypotoni, kardiorespiratorisk depression och i sällsynta fall koma. Andningsdepressionseffekterna av bensodiazepiner är allvarligare hos patienter med andnings- eller hjärtsjukdom eller om läkemedlet kombineras med andra lugnande medel för det centrala nervsystemet, inklusive alkohol.
Behandling
I de flesta fall krävs övervakning av vitala tecken.
Vid fall av överdosering ska särskild uppmärksamhet ägnas åt andnings- och kardiovaskulära funktioner i intensivvård.
Vid överdos ska kräkning framkallas (så snabbt som möjligt och högst inom en timme efter oral administrering av midazolam) om patienten är vid medvetande. Om patienten inte är vid medvetande ska ventrikelsköljning utföras samtidigt som man skyddar luftvägarna. Om ventrikelsköljning inte ger effekt ska aktivt kol administreras för att minska upptagningen av läkemedlet.
Flumazenil, en antagonist till bensodiazepiner, är indikerat vid svår förgiftning i samband med andningsdepression eller koma. Denna behandling ska endast administreras under noggrann övervakning. Halveringstiden för flumazenil är kort (ca en timme), vilket betyder att övervakning krävs efter att effekten av denna produkt har avklingat. Extrem försiktighet krävs vid användning av flumazenil vid överdos efter samtidig administrering av olika läkemedel hos en patient och hos patienter med epilepsi som redan behandlas med bensodiazepiner. Flumazenil ska endast användas med extrem försiktighet hos patienter som behandlats med tricykliska antidepressiva medel eller epileptogena läkemedel, och hos patienter med EKG-avvikelser (QRS eller QT-förlängning).
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: bensodiazepiner, ATC-kod: N05CD08
Verkningsmekanism
Midazolam är ett derivat från imidazobenzodiazepingruppen. De farmakologiska effekterna av bensodiazepiner är resultatet av reversibla interaktioner med γ-aminosmörsyra- (GABA) receptorn för bensodiazepiner i centrala nervsystemet, den viktigaste hämmande neurotransmittorn i centrala nervsystemet.
Farmakodynamisk effekt
De farmakodynamiska egenskaperna hos midazolam och dess metaboliter, som liknar andra bensodiazepiner, inkluderar lugnande, ångestdämpande, amnetiska (anterograd amnesi), hypnotiska, muskelrelaxerande och antikonvulsiva effekter.
Den farmakologiska verkan av midazolam kännetecknas av en kort varaktighet på grund av en snabb metabolisk omvandling. Verkan av midazolam kan lätt reverseras av receptorantagonisten för bensodiazepin: flumazenil.
Klinisk effekt och säkerhet
Data från publicerade rapporter om studier av pediatriska patienter visar tydligt att oralt midazolam fungerar som ett lugnande medel och ett ångestdämpande medel före ett kirurgiskt ingrepp som kräver anestesi, såväl som andra medicinska procedurer som kräver sedering utan anestesi.
Flera studier har genomförts, som involverar hundratals barn som krävde måttlig sedering före anestetisk premedicinering eller medicinskt ingrepp. Dessa barn fick en enda dos av oralt midazolam (utan samtidig administrering av några andra lugnande medel för centrala nervsystemet). Maximal sedering uppnåddes i allmänhet inom 30 till 45 minuter efter administrering av midazolam för en dos midazolam mellan 0,25 och 1,0 mg/kg. Liknande data erhölls för den anxiolytiska effekten. De lugnande effekterna erhölls för midazolamkoncentrationer i plasma mellan 30 och 160 ng/ml och ett EG50 som sträckte sig mellan 18 och 171 ng/ml, beroende på den metod som användes för att utvärdera sederingen (data från barn och vuxna).
En studie av OZALIN har genomförts hos pediatriska patienter i åldern mellan 6 månader och 17 år, som behövde anestetisk premedicinering. Resultaten från denna studie är förenliga med resultaten i litteraturen. Lugnande och ångestdämpande effekter observerades inom 30 minuter efter oral administrering av en engångsdos av OZALIN på 0,269 mg/kg i genomsnitt, och en midazolamkoncentration i plasma på mellan 15 och 65 ng/ml. Ett EC50 på 53,82 ng/ml observerades efter oral administrering av OZALIN vid en dos på 15 mg (0,245 mg/kg i genomsnitt) hos friska, vuxna försökspersoner. Det finns ingen data för icke-fastande barn och ungdomar från 6 månader till 17 år, som fått en enda oral dos av OZALIN.
Farmakokinetiska egenskaper
Absorption
Midazolam absorberas snabbt och fullständigt efter oral administrering.
Data från litteraturen
Maximal plasmakoncentration (Cmax) uppnås inom 30 till 60 minuter (Tmax) efter oral administrering av midazolam. Ett Cmax mellan 70 och 154 ng/ml har rapporterats efter administrering av en dos på 15 mg hos friska, vuxna försökspersoner. Ett Cmax som sträcker sig från 30 till 200 ng/ml, har rapporterats enligt den administrerade dosen (från 0,25 till 1,0 mg/kg) och barnets ålder (från 6 månader till 17 år).
Biotillgängligheten varierar mellan 30 och 50 %, beroende på studie och den orala läkemedelsform som använts.
Uppgifter om OZALIN
Efter administrering av en engångsdos av OZALIN oralt, uppnåddes Cmax på 35 till 45 minuter (median Tmax) hos vuxna respektive tonårspatienter. Från analysen av populationsfarmakokinetik (Pop-PK), inklusive vuxna och pediatriska data, absorberas mest midazolam inom 30 minuter efter administrering av OZALIN.
Efter en 15 mg (0,245 mg/kg i genomsnitt) oral dos av OZALIN, erhölls Cmax 113 ng/ml hos friska, vuxna försökspersoner. Med en OZALIN-dos på 0,12 till 0,30 mg/kg, uppnåddes ett genomsnittligt Cmax på 40,8 ng/ml hos barn.
Den absoluta biotillgängligheten av oralt administrerat midazolam är 39,4 % hos vuxna, som fått en 15 mg-dos av OZALIN.
Distribution
Vävnadsfördelning av oralt midazolam är mycket snabb, och i de flesta fall är distributionsfasen inte uppenbar eller slutförs väsentligen inom 1 till 2 timmar efter oral administrering. Midazolam är mycket lipofil och distribueras omfattande. Midazolam binds starkt till plasmaproteiner (omkring 96–98 %), och i första hand till albumin.
Passage av midazolam in i cerebrospinalvätska är långsam och obetydlig. Hos människor passerar midazolam placentabarriären och kommer långsamt in i fostercirkulationen. Små mängder av midazolam har påträffats i bröstmjölk.
Data från litteraturen
Distributionsvolymen vid steady-state är mellan 1,0 och 2,5 l/kg och upp till 6,6 l/kg.
Uppgifter om OZALIN
Distributionsvolymen av midazolam är 4,7 l/kg hos friska, vuxna försökspersoner.
Från Pop PK-analysen, uppskattades den centrala distributionsvolymen och den perifera distributionsvolymen vara 27,9 l respektive 413 l, för en typisk patient på 34 kg.
Metabolism
Midazolam elimineras nästan helt genom biotransformation. Midazolam hydroxyleras av CYP3A4-enzymet och den huvudsakliga metaboliten i urin och plasma är α-hydroxymidazolam. Plasmakoncentrationer av α-hydroxymidazolam är 30 till 50 % av plasmakoncentrationerna hos modersmolekylen. Alfa-hydroxymidazolam är farmakologiskt aktiv och bidrar signifikant (ca 34 %) till effekterna av oralt midazolam.
Data från litteraturen
Efter oral administrering, uppskattas förstapassagemetabolism i levern till ca 30 till 60 %.
Efter oral administrering hos barn, varierar förhållandet av området under kurvan (AUC) för α-hydroxymidazolam jämfört med midazolam från 0,38 till 0,75.
Uppgifter om OZALIN
Ca 40 % av α-hydroxymidazolamexponering beror på förstapassageeffekt i levern.
Det metaboliska förhållandet är 0,504, 0,364 och 0,313 hos barn, ungdomar respektive vuxna.
Eliminering
Hos friska vuxna försökspersoner, är plasmaclearance mellan 300 och 500 ml/min (eller mellan 4 och 13 ml/min/kg). Midazolam elimineras främst genom renal utsöndring, 60 till 80 % av den administrerade dosen utsöndras inom 1 dygn från administreringen, och återvinns i form av glukuronid-α-hydroxymidazolam. Mindre än 1 % av den administrerade dosen återvinns oförändrad i urinen. Eliminieringshalveringstiden för midazolam är ca 3 timmar, och för α-hydroxymidazolam ca 2 timmar.
Data från litteraturen
Hos barn kan halveringstiden variera kraftigt, från 0,5 till 7 timmar beroende på studien, oavsett barnets ålder och dosen av midazolam. Plasmaclearance har uppskattats till mellan 1,5 och 3,6 l/h/kg.
Uppgifter om OZALIN
Halveringstiden har uppskattats till 3,6 timmar hos ungdomar. Från Pop-PK-analys, har midazolam-clearance uppskattats till 34,7 l/tim och α-hydroxymidazolam-clearance till 40,6 l/tim för en typisk patient på 34 kg.
Farmakokinetiska egenskaper i särskilda populationer
Nyfödda och spädbarn
OZALIN har inte studerats hos pediatriska patienter under 6 månaders ålder.
Överviktiga patienter
Den genomsnittliga halveringstiden för midazolam är högre hos överviktiga patienter än hos patienter som inte är överviktiga (5,9 timmar jämfört med 2,3 timmar). Detta beror på en ökning med ca 50 % av distributionsvolymen, korrigerad för total kroppsvikt. Det förekommer ingen betydande skillnad i plasmaclearance mellan överviktiga och icke överviktiga patienter. Längre övervakning av överviktiga patienter efter proceduren kan krävas.
Patienter med nedsatt leverfunktion
Hos patienter med levercirros, kan halveringstiden för eliminering vara längre och clearance lägre än vad som observerats hos friska försökspersoner, p.g.a. risken för ackumulering av α-hydroxymidazolam (se avsnitt Dosering och administreringssätt och Kontraindikationer).
Patienter med nedsatt njurfunktion
Halveringstiden fòr eliminering hos patienter med kronisk njursvikt liknar halveringstiden hos friska försökspersoner. Oralt midazolam ska dock användas med försiktighet hos patienter med nedsatt njurfunktion.
Patienter med hjärtsvikt
Halveringstiden för eliminering är längre hos patienter med hjärtsvikt än hos friska försökspersoner (se avsnitt Varningar och försiktighet).
Prekliniska säkerhetsuppgifter
I en fertilitetsstudie av råttor, där djuren fick upp till tio gånger den kliniska dosen, observerades inga negativa effekter på fertiliteten.
Det finns inga relevanta, prekliniska data för förskrivare, förutom vad som redan inkluderas i andra avsnitt i produktresumén.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Citronsyramonohydrat, gammadex, sukralos, apelsinsmakämne (innehåller bl.a. 70–80 % etanol), natriumhydroxid (för pH-justering), vatten för injektionsvätska.
Inkompatibiliteter
Då blandbarhetsstudier saknas ska detta läkemedel inte blandas med andra läkemedel.
Hållbarhet
Före öppnande: 36 månader.
Efter öppnande: produkten ska användas omedelbart efter att den har öppnats och sedan kasseras.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C
Förvaras i skydd mot kyla eller får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
OZALIN oraaliliuos, kerta-annospakkaus
2 mg/ml (L:ei) 10 x 5 ml (suodattimella varustettu pilli, oraaliannostelija) (285,36 €)
PF-selosteen tieto
En ampull i brunt glas (typ I-glas) på 5 ml, ett filterrör och en oral applikator förpackade tillsammans i en enskild blisterförpackning.
Låda med 1 ampull, 1 filterrör och 1 oral applikator.
Låda med 5 ampuller, 5 filterrören och 5 orala applikatorer.
Låda med 10 ampuller, 10 filterrören och 10 orala applikatorer.
De orala applikatorerna och filterrören är enbart avsedda för engångsbruk. Orala applikatorer levereras med markering i kg kroppsvikt: från 3 kg till 40 kg, i steg om ett kg.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Klar till något opalskimrande lösning, blekgul till något brun, med ett pH mellan 3,6 och 4,2.
Särskilda anvisningar för destruktion och övrig hantering
Användning i den pediatriska populationen
OZALIN är endast avsett för oral användning.
Instruktioner för säker användning av OZALIN-ampull, oral applikator och filterör, som tillhandahålls i blisterförpackningen. OZALIN ska endast administreras med dess ändamålsenliga orala applikator som är graderad i kg:
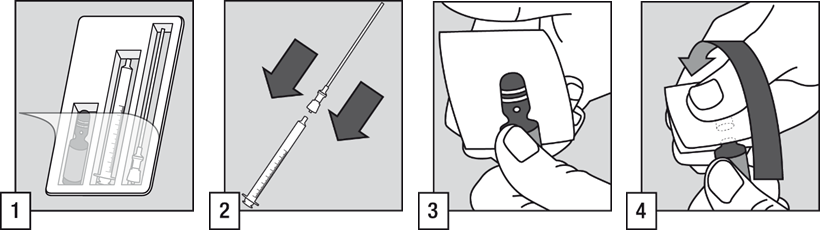
- Administreringen till patienten kräver användning av ampullen, filterkanylen och den orala applikatorn.
- Anslut filterröret till den orala applikatorns ände.
- Knacka på ampullens topp så att all vätska rinner till botten. Täck ampullens topp med en kompress och placera din ena tumme på den vita pricken.
- Håll fast ordentligt i ampullen och se till att den vita pricken pekar uppåt och mot dig. Pressa tillbaka den övre delen av ampullen så öppnas den lätt.
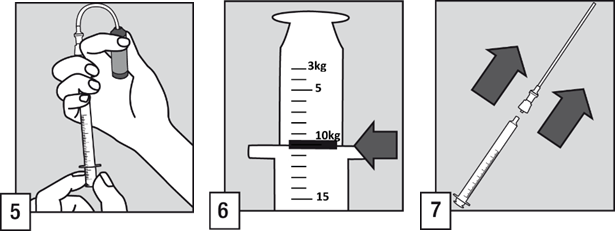
- För in filterröret i ampullen. Före justering av dosen och i syfte att minska eventuell luft i filterröret rekommenderas en kort pumpning med den orala applikatorn (dra in och tryck ut) av lösningen i ampullen.
- Medan du håller ampullen upprätt, fyll den orala applikatorn till markeringen som motsvarar patientens vikt i kilogram (kg). Se till att markeringen och toppen på flänsen är i nivå för att få rätt dos.
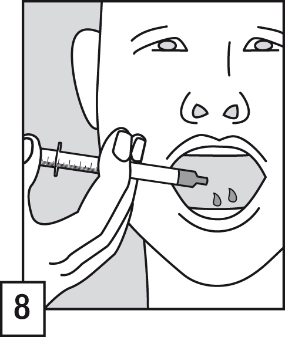
- Avlägsna filterröret från den orala applikatorns ände.
- Töm innehållet i den orala applikatorn i patientens mun. Lösningen ska sväljas direkt.
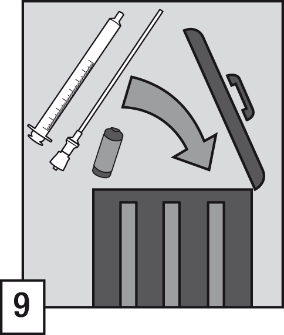
- Efter användning: Kassera ampullen, filterröret, den orala applikatorn och eventuell överbliven lösning i en behållare som förberetts för detta syfte, i enlighet med de lokala föreskrifterna för kassering av läkemedel och medicinsk utrustning.
Ersättning
OZALIN oraaliliuos, kerta-annospakkaus
2 mg/ml 10 x 5 ml
- Ei korvausta.
Atc-kod
N05CD08
Datum för översyn av produktresumén
23.08.2023
Yhteystiedot
Hyllie Stationstorg 31, vån 5
215 32 Malmö
Sweden
+46 31 7880599
www.galen-pharma.com
info@poaab.com
