RIGEVIDONCONT dragerad tablett 150/30 mikrog
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteita: Viimeisintä tietoa naisille
Terveydenhuollon ammattilainen
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yhdistelmäehkäisyvalmisteet: Materiaalia naisen yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Kvalitativ och kvantitativ sammansättning
21 vita dragerade tabletter
150 mikrogram levonorgestrel och 30 mikrogram etinylestradiol.
Hjälpämnen med känd effekt
Varje tablett innehåller 31,35 mg laktos (som laktosmonohydrat) och 22,46 mg sackaros.
7 gröna dragerade placebotabletter (inaktiva tabletter)
Tabletterna innehåller inte aktiv substans.
Hjälpämnen med känd effekt
Varje tablett innehåller 37,26 mg laktosanhydrat, 30,58 mg sackaros och 0,000134 mg para-orange aluminiumlack (E110).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Dragerade tabletter.
Kliniska uppgifter
Terapeutiska indikationer
Antikonception.
Vid beslut att förskriva Rigevidoncont ska den enskilda kvinnans riskfaktorer beaktas, framför allt de för venös tromboembolism (VTE), och risken för VTE med Rigevidoncont jämfört med andra kombinerade hormonella preventivmedel (se avsnitt Kontraindikationer och Varningar och försiktighet).
Dosering och administreringssätt
Dosering
Hur Rigevidoncont ska tas
De aktiva tabletterna (vita tabletter) ska tas oralt vid ungefär samma tidpunkt varje dag, vid behov med en liten mängd vätska, i den ordning som anges på tablettkartan.
Dagen efter den sista vita tabletten fortsätter man med de 7 gröna tabletterna (placebo) från den separata raden på samma tablettkarta. Tabletterna tas utan avbrott. En tablett ska tas dagligen under 28 dagar i följd.
Nästa tablettkarta ska påbörjas dagen efter att den sista tabletten tagits från föregående karta.
En bortfallsblödning startar vanligtvis på dag 2–3 efter att den sista aktiva tabletten tagits och har inte nödvändigtvis upphört innan nästa tablettkarta påbörjas.
Så här inleds behandling med Rigevidoncont
Om hormonellt preventivmedel inte har använts under den senaste månaden
Tablettintaget påbörjas dag 1 i kvinnans normala menstruationscykel (dvs. menstruationsblödningens första dag).
Vid byte från annat hormonellt kombinerat preventivmedel (kombinerade p-piller, vaginalring eller depotplåster)
Kvinnan bör helst ta den första tabletten av Rigevidoncont 150 mikrog/30 mikrog dagen efter intaget av den sista tabletten som innehåller de aktiva substanserna av den tidigare behandlingen med kombinerade p-piller, men senast dagen efter tablettuppehållet eller efter intaget av sista placebotabletten på föregående p-pillerkarta.
Om en vaginalring eller ett depotplåster har använts bör kvinnan helst börja använda Rigevidoncont 150 mikrog/30 mikrog samma dag som ringen eller plåstret tas bort, men senast när behandling med nästa ring eller plåster skulle ha inletts.
Vid byte från metod med enbart gestagen (minipiller, injektion, p-stav eller ett gestagenfrisättande intrauterint inlägg)
Byte från minipiller kan ske vilken dag som helst under menstruationscykeln och behandlingen med Rigevidoncont påbörjas direkt dagen efter. Byte från p-stav eller intrauterint inlägg ska ske samma dag som p-staven eller det intrauterina inlägget avlägsnas och byte från injektion den dag som nästa injektion skulle ha administrerats. I alla dessa fall ska komplettering med annan form av preventivmedel användas under de första 7 dagarna av behandlingen.
Efter avslutad graviditet i första trimestern
Kvinnan kan påbörja behandlingen omedelbart. Inga ytterligare antikonceptionsmetoder är nödvändiga.
Efter förlossning eller avslutad graviditet i andra trimestern
Om kvinnan inte ammar ska tabletterna börja tas 21‑28 dagar efter förlossningen eller avslutad graviditet i andra trimestern, p.g.a. den ökade risken för tromboembolism under post partum-perioden. Om tabletterna börjar tas senare ska en barriärmetod användas under de första 7 dagarna av tablettintaget. Har samlag redan ägt rum bör graviditet uteslutas innan p-pilleranvändningen påbörjas eller så måste kvinnan invänta sin första menstruation.
Amning
Se avsnitt Fertilitet, graviditet och amning.
Om man har glömt att ta tabletter
Den antikonceptionella effekten kan minska vid glömd dos, speciellt om det gått mer än 12 timmar.
Den antikonceptionella effekten påverkas inte om kvinnan har glömt att ta placebotabletter.
Om kvinnan har glömt en aktiv tablett och det har gått mindre än 12 timmar sedan tabletten skulle ha tagits är det preventiva skyddet inte nedsatt. Tabletten bör tas så snart som möjligt och nästa tablett tas sedan vid ordinarie tidpunkt.
Om det har gått mer än 12 timmar sedan tabletten skulle ha tagits, kan det preventiva skyddet vara nedsatt. Följande två grundregler gäller vid glömd tablett:
- Tablettuppehållet får aldrig överskrida 7 dagar.
- 7 dagars oavbrutet tablettintag krävs för att bibehålla tillräcklig hämning av hypotalamus-hypofys-ovarial-axeln.
Baserat på ovanstående kan följande praktiska riktlinjer ges:
Vecka 1:
Den senast glömda tabletten skall tas så snart som möjligt, även om detta innebär att två tabletter tas vid samma tillfälle. Därefter tas tabletterna vid ordinarie tidpunkt.
En barriärmetod som t.ex. kondom bör användas de närmaste 7 dagarna. Har samlag ägt rum under de föregående 7 dagarna, bör möjligheten av graviditet övervägas. Ju fler tabletter som glömts bort och ju närmare placeboperioden de glömda tabletterna är, desto större är risken för graviditet.
Vecka 2:
Den senast glömda tabletten skall tas så snart som möjligt, även om detta innebär att två tabletter tas vid samma tillfälle. Därefter tas tabletterna vid ordinarie tidpunkt.
Under förutsättning att tabletterna tagits enligt instruktionerna under 7 dagar innan glömd tablett, behövs inget ytterligare preventivt skydd. Om tabletterna inte har tagits enligt instruktionerna eller om mer än 1 tablett har glömts, bör en barriärmetod (såsom kondom) användas under de följande 7 dagarna.
Vecka 3:
Tillförlitlighet av antikonceptionen kan ha försämrats eftersom perioden med placebotabletter är nära. Genom att justera schemat för tablettintaget, går det emellertid att förhindra att skyddseffekten minskar. Följer man något av de två alternativen nedan behövs därför inget extra kontraceptivt skydd, under förutsättning att tabletterna har tagits enligt anvisningarna under de 7 sista dagarna före den första glömda tabletten. Om så inte är fallet, bör det första alternativet följas. Dessutom bör även en barriärmetod (såsom kondom) användas samtidigt under de kommande 7 dagarna.
-
Den senast glömda tabletten bör tas så snart som möjligt, även om detta innebär att två tabletter tas vid samma tidpunkt. Därefter tas tabletterna på ordinarie tidpunkt tills alla aktiva tabletter är slut. De 7 placebotabletterna måste kasseras. Nästa tablettkarta måste påbörjas på en gång. Bortfallsblödningen uteblir troligtvis innan de aktiva tabletterna på den nya tablettkartan är slut, men stänkblödningar eller genombrottsblödning kan uppträda under tiden tabletter tas.
- Man kan också avbryta tablettintaget från den pågående tablettkartan. Därefter skall man ta placebotabletter under 7 dagar, inklusive de dagar man glömt ta tabletter, och därefter fortsätta med nästa förpackning.
Vid glömda tabletter och vid utebliven bortfallsblödning under perioden med placebotabletter, bör möjligheten för graviditet beaktas.
Råd vid gastrointestinala besvär
Vid svåra gastrointestinala besvär (t.ex. kräkning eller diarré) kan absorptionen av de aktiva substanserna bli ofullständig och ytterligare preventivmetoder bör användas.
Om kräkning eller svår diarré inträffar inom 3–4 timmar efter tablettintaget, ska en ny tablett (ersättningstablett) tas så snart som möjligt. Den nya tabletten bör om möjligt tas inom 12 timmar efter det normala tablettintaget. Om det går mer än 12 timmar gäller anvisningarna om glömda tabletter (se avsnitt Dosering och administreringssätt). Diarré kan minska effekten genom att förhindra fullständig absorption. Om kvinnan inte vill ändra sitt normala schema för intag av tabletter, måste de extra tabletterna tas från en annan tablettkarta.
Att flytta fram menstruationen eller ändra startdatum
För att flytta fram menstruationen skall kvinnan hoppa över placebotabletterna (på den aktuella tablettkartan) och fortsätta med de aktiva tabletterna från en annan Rigevidoncont 150 mikrog/30 mikrog -tablettkarta. Framflyttningen kan pågå så länge kvinnan önskar fram till att de aktiva tabletterna på den andra tablettkartan är slut. Under framflyttningen kan genombrottsblödning eller stänkblödningar uppträda. Användning av Rigevidoncont 150 mikrog/30 mikrog -tabletter återupptas efter den vanliga 7-dagars placeboperioden.
För att flytta menstruationen till en annan veckodag än den kvinnan har med nuvarande behandlingsschema, kan den nästkommande placeboperioden förkortas med önskat antal dagar. Ju kortare placeboperiod, desto större risk att bortfallsblödningen uteblir och att kvinnan får genombrottsblödning och stänkblödningar under intag av tabletter från den efterföljande kartan (på samma sätt som vid framflyttning av menstruationen). Det är viktigt att betona att placebointervallet inte ska förlängas.
Pediatrisk population
Det finns ingen relevant användning av Rigevidoncont för en pediatrisk population innan puberteten.
Administreringssätt
Oral användning
Kontraindikationer
Kombinerade p-piller ska inte användas vid något av följande tillstånd. Om något av dessa tillstånd skulle inträffa för första gången under p-pillerbehandlingen ska behandlingen avslutas omedelbart:
-
förekomst av eller risk för venös tromboembolism (VTE)
- venös tromboembolism – pågående VTE (på antikoagulantia) eller anamnes på (t.ex. djup ventrombos [DVT] eller lungemboli [PE])
- känd ärftlig eller förvärvad predisposition för venös tromboembolism, t.ex. APC‑resistens (inklusive Faktor V Leiden), antitrombin‑III‑brist, protein C‑brist, protein S‑brist
- större kirurgiskt ingrepp med långvarig immobilisering (se avsnitt Varningar och försiktighet)
- hög risk för venös tromboembolism på grund av förekomst av flera riskfaktorer (se avsnitt Varningar och försiktighet)
-
förekomst av eller risk för arteriell tromboembolism (ATE)
- arteriell tromboembolism – pågående arteriell tromboembolism, anamnes på arteriell tromboembolism (t.ex. myokardiell infarkt) eller prodromalsymtom (t.ex. angina pectoris)
- cerebrovaskulär sjukdom – pågående stroke, anamnes på stroke eller prodromalsymtom (t.ex. transitorisk ischemisk attack, TIA)
- känd ärftlig eller förvärvad predisposition för arteriell tromboembolism, t.ex. hyperhomocysteinemi och antifosfolipidantikroppar (antikardiolipinantikroppar, lupus antikoagulant)
- migrän med fokala neurologiska symtom i anamnesen
- hög risk för arteriell tromboembolism på grund av flera riskfaktorer (se avsnitt Varningar och försiktighet) eller på grund av förekomst av en allvarlig riskfaktor som:
- diabetes mellitus med vaskulära symtom
- svår hypertoni
- svår dyslipoproteinemi
- pågående eller tidigare allvarlig leversjukdom, så länge levervärdena inte återgått till det normala
- förekomst av eller anamnes på levertumör (benign eller malign)
- känd eller misstänkt könshormonberoende malignitet (t.ex. i genitalorganen eller brösten)
- odiagnostiserad vaginalblödning
- samtidig användning av johannesört (Hypericum perforatum) (se avsnitt Interaktioner)
- överkänslighet mot de aktiva substanserna (levonorgestrel och etinylestradiol) eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Rigevidoncont är kontraindicerat vid samtidig behandling med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir, dasabuvir, glekaprevir/pibrentasvir och sofosbuvir/velpatasvir/voxilaprevir (se avsnitt Varningar och försiktighet och Interaktioner).
Varningar och försiktighet
Varningar
Om något av tillstånden eller någon av riskfaktorerna nedan förekommer ska fördelarna av att använda kombinerade p-piller vägas mot de möjliga riskerna för den enskilda kvinnan och diskuteras med kvinnan innan hon beslutar sig för att börja använda preparatet.
Om något av dessa tillstånd eller riskfaktorer förvärras eller uppträder för första gången bör kvinnan kontakta läkare. Läkaren ska då avgöra om behandlingen skall avbrytas.
1. Cirkulationsstörningar
Risk för venös tromboemboli (VTE)
Användning av ett kombinerat hormonellt preventivmedel ökar risken för venös tromboembolism (VTE) jämfört med icke‑användning. Produkter som innehåller levonorgestrel (såsom Rigevidoncont), norgestimat eller noretisteron förknippas med den lägsta risken för VTE. Beslutet att använda Rigevidoncont ska tas först efter en diskussion med kvinnan för att säkerställa att hon känner till risken för VTE med Rigevidoncont, hur hennes riskfaktorer påverkar den här risken, och att hennes VTE-risk är störst under det första året hon använder produkten. Det finns också vissa belägg för att risken är större när ett kombinerat hormonellt preventivmedel används igen efter ett uppehåll på 4 veckor eller längre.
Hos kvinnor som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla en VTE under en period om ett år. Hos en enskild kvinna kan dock risken vara betydligt högre, beroende på hennes underliggande riskfaktorer (se nedan).
Epidemiologiska studier med kvinnor som använder låg dos av kombinerade p-piller (< 50 μg etinylestradiol) har visat att av 10 000 kvinnor kommer mellan 6 och 12 att utveckla VTE under ett år.
Det uppskattas att av 10 000 kvinnor som använder ett kombinerat hormonellt preventivmedel som innehåller levonorgestrel kommer cirka 6 kvinnor1 att utveckla en VTE under ett år.
Detta antal VTE-händelser per år är färre än det antal händelser som förväntas hos kvinnor under graviditet eller under postpartumperioden.
VTE är dödligt i 1–2 % av fallen.
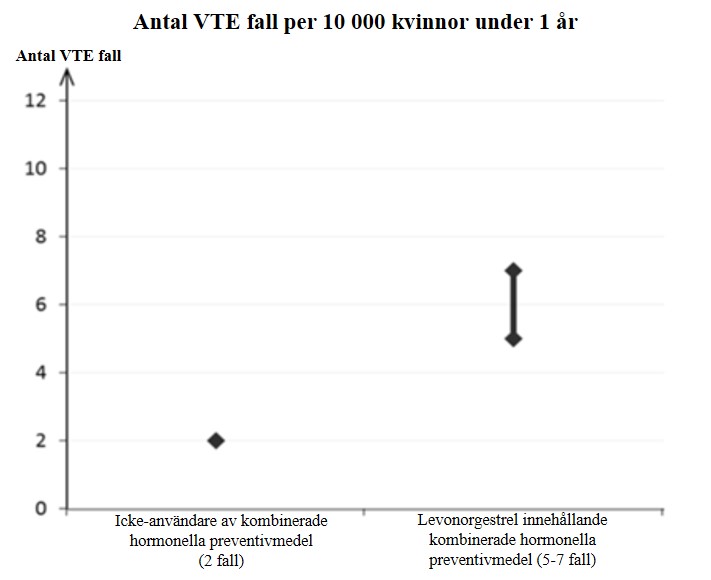
1Genomsnittsintervallet är på 5–7 per 10 000 kvinnoår, baserat på en relativ risk för kombinerade hormonella preventivmedel som innehåller levonorgestrel jämfört med en ickeanvändning på cirka 2,3–3,6.
I extremt sällsynta fall har trombos rapporterats hos användare av kombinerade hormonella preventivmedel i andra blodkärl, t.ex. i hepatiska, mesenteriska, renala eller retinala vener och artärer.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt hos kvinnor med ytterligare riskfaktorer, framför allt om flera riskfaktorer föreligger (se tabell).
Rigevidoncont är kontraindicerat om en kvinna har flera riskfaktorer som innebär att hon löper hög risk för venösa tromboser (se avsnitt Kontraindikationer). Om en kvinna har mer än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om förhållandet nytta‑risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för VTE
Riskfaktor | Kommentar |
Fetma (BMI över 30 kg/m2) | Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt att beakta om det också finns andra riskfaktorer. |
Långvarig immobilisering, större kirurgiskt ingrepp, alla operationer i ben eller bäcken, neurokirurgi eller omfattande skada
Anm: tillfällig immobilisering inklusive flygresor >4 timmar kan också vara en riskfaktor för VTE, särskilt hos kvinnor med andra riskfaktorer | I dessa situationer är det lämpligt att göra ett uppehåll i användningen av plåstret/p‑pillret/ringen (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän två veckor efter fullständig remobilisering. En annan preventivmetod bör användas för att undvika oavsiktlig graviditet.
Antitrombotisk behandling bör övervägas om Rigevidoncont inte har satts ut i förväg. |
Positiv familjeanamnes (venös tromboembolism hos ett syskon eller förälder särskilt i relativt unga år, t.ex. före 50 års ålder). | Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
Andra medicinska tillstånd som förknippas med VTE. | Cancer, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecellanemi. |
Stigande ålder | Framför allt hos kvinnor över 35 år. |
Det råder inte enighet om den eventuella betydelsen av varicer och ytlig tromboflebit har för uppkomst eller progression av venös trombos.
Den ökade risken för tromboembolism vid graviditet, och framför allt 6‑veckorsperioden i puerperiet måste beaktas (för information om ”Graviditet och amning” se avsnitt Fertilitet, graviditet och amning).
Symtom på VTE (djup ventrombos och lungemboli)
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera vårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på djup ventrombos (DVT) kan omfatta:
- unilateral svullnad av ben och/eller fot eller längs en ven i benet
- smärta eller ömhet i benet som bara känns vid stående eller gående
- ökade värme i det drabbade benet med rödfärgning eller missfärgning av benet.
Symtom på lungemboli (PE) kan omfatta:
- plötslig debut av oförklarlig andfåddhet eller snabb andning
- plötslig hosta som kan förknippas med hemoptys
- kraftig bröstsmärta
- kraftig ostadighetskänsla eller yrsel
- snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t.ex. andfåddhet och hosta) är icke‑specifika och kan feltolkas som mer vanliga eller mindre allvarliga händelser (t.ex. luftvägsinfektioner).
Andra tecken på vaskulär ocklusion kan omfatta: plötslig smärta, svullnad och lätt blå missfärgning av en extremitet.
Om ocklusionen uppkommer i ögonen kan symtomen variera från smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästan omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har också visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för arteriell tromboembolism (myokardinfarkt) eller cerebrovaskulär händelse (t.ex. transitorisk ischemisk attack, stroke). Arteriella tromboemboliska händelser kan vara dödliga.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel ökar hos kvinnor med riskfaktorer (se tabell). Rigevidoncont är kontraindicerat om kvinnan har en allvarlig eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt Kontraindikationer). Om kvinnan har mer än en riskfaktor är det möjligt att riskökningen är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om förhållandet nytta‑risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för ATE
Riskfaktor | Kommentar |
Stigande ålder | Framför allt hos kvinnor över 35 år |
Rökning | Kvinnor ska rekommenderas att sluta röka om de vill använda ett kombinerat hormonellt preventivmedel. Kvinnor över 35 år som fortsätter att röka ska starkt rekommenderas att använda en annan preventivmetod. |
Hypertoni | |
Fetma (BMI över 30 kg/m2) | Risken ökar betydligt när BMI ökar. Detta är särskilt viktigt för kvinnor med ytterligare riskfaktorer. |
Positiv familjeanamnes (arteriell tromboembolism hos ett syskon eller förälder särskilt i relativt unga år, t.ex. före 50 års ålder). | Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
Migrän | En ökning av frekvens eller svårighetsgrad av migrän vid användning av kombinerade hormonella preventivmedel (som kan vara prodromalsymtom på en cerebrovaskulär händelse) kan vara ett skäl för omedelbart utsättande. |
Andra medicinska tillstånd som förknippas med negativa vaskulära händelser. | Diabetes mellitus, hyperhomocysteinemi, hjärtklaffssjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus. |
Symtom på ATE
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera hälso- och sjukvårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på en cerebrovaskulär händelse kan omfatta:
- plötslig domning eller svaghet i ansikte, armar eller ben, speciellt på en sida av kroppen
- plötsliga problem med att gå, yrsel, förlorad balans eller koordination
- plötslig förvirring, svårigheter att tala eller förstå
- plötsliga synproblem i ett eller båda ögonen
- plötslig, svår eller långvarig huvudvärk utan känd orsak
- medvetslöshet eller svimning med eller utan anfall.
Tillfälliga symtom som tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtom på en hjärtinfarkt kan vara:
- smärta, obehag, tryck, tyngdkänsla, tryck eller fyllnadskänsla i bröstet, armen eller nedanför bröstbenet
- obehag som strålar mot ryggen, käken, halsen, armen, magen
- mättnadskänsla, matsmältningsbesvär eller kvävning
- svettning, illamående, kräkningar eller yrsel
- extrem svaghet, ångest eller andfåddhet
- snabba eller oregelbundna hjärtslag.
2. Tumörer:
Livmoderhalscancer
En ökad risk för livmoderhalscancer har rapporterats i vissa epidemiologiska studier hos kvinnor som använt kombinerade p-piller under lång tid, men det råder fortsatt oenighet om i vilken utsträckning detta resultat kan bero på sexuellt beteende och andra faktorer såsom humant papillomvirus (HPV).
Bröstcancer
En metaanalys av 54 epidemiologiska studier visade att kvinnor som använder kombinerade p-piller löper en något ökad relativ risk (RR = 1,24) att få bröstcancer. Den förhöjda risken avtar gradvis under de följande tio åren efter avslutad användning. Eftersom bröstcancer är ovanligt hos kvinnor under 40 år är ökningen av antalet fall av bröstcancer hos kvinnor som använder eller nyligen har använt kombinerade p-piller litet i förhållande till den totala risken för bröstcancer. Dessa studier bevisar inte något orsakssamband.
Det observerade mönstret med en ökad risk kan bero på att bröstcancer diagnostiseras tidigare hos p-pilleranvändare, de biologiska effekterna av kombinerade p-piller eller en kombination av båda faktorerna.
Bröstcancer som diagnostiseras hos dem som använt p-piller tenderar att vara mindre kliniskt avancerade jämfört med bröstcancer hos dem som aldrig använt p-piller.
Levertumörer
I sällsynta fall har benigna levertumörer (ex. leveradenom, fokal nodulär hyperplasi) rapporterats, och ännu mer sällan har maligna levertumörer rapporterats hos användare av kombinerade p-piller. I enstaka fall har dessa tumörer lett till livshotande intraabdominella blödningar. En levertumör bör övervägas i differentialdiagnosen vid svår smärta i övre delen av buken, vid leverförstoring eller vid tecken på intraabdominell blödning hos kvinnor som använder kombinerade p-piller.
Användning av kombinerat hormonellt preventivmedel i höga doser (50 µg etinylestradiol) minskar risken för endometrie- och äggstockscancer. Det har ännu inte bekräftats om detta även gäller för låg dos kombinerat hormonellt preventivmedel.
3. Övriga tillstånd
Depression
Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depressioner kan vara allvarliga och är en välkänd riskfaktor för självmordsbeteende och självmord. Kvinnor ska rådas att kontakta läkare vid humörförändringar och depressiva symtom, också direkt efter inledd behandling.
Hypertriglyceridemi
Kvinnor med hypertriglyceridemi eller där detta har förekommit inom familjen kan löpa ökad risk att få pankreatit vid användning av kombinerade p-piller.
Leversjukdomar
Akuta eller kroniska störningar av leverfunktionen kan göra det nödvändigt att sätta ut kombinerade p-piller tills leverfunktionen åter är normal.
Hypertoni
Även om en liten ökning av blodtrycket har rapporterats hos många kvinnor som använder kombinerade p-piller, är kliniskt betydelsefulla ökningar sällsynta. Endast i dessa sällsynta fall finns skäl för att omedelbart avbryta användningen av kombinerade p-piller. Hos patienter med hypertoni måste det kombinerade p-pillret sättas ut om blodtrycket fortsätter att vara högt eller om betydande förhöjning av blodtrycket inte svarar tillfredsställande på antihypertensiv behandling. Användning av kombinerade p-piller kan fortsätta om normala blodtrycksvärden har uppnåtts med antihypertensiv behandling och återinsättning av kombinerade p-piller anses vara lämplig.
Angioödem
Exogena östrogener kan inducera eller förvärra symtom av ärftligt eller förvärvat angioödem.
Glukosintolerans/diabetes
Även om kombinerade p-piller kan ha effekt på den perifera insulinresistensen och glukostoleransen, finns ingen dokumentation om ett behov att ändra behandlingsregimen hos diabetiker som använder kombinerade p-piller i låg dos (innehållande mindre än 0,05 mg etinylestradiol). Kvinnor med diabetes ska dock kontrolleras noggrant särskilt under den första tiden med kombinerade p-piller.
Övrigt
Recidiv av kolestatisk gulsot eller klåda som tidigare uppträtt under en graviditet eller under tidigare användning av könshormoner gör det nödvändigt att avbryta användningen av kombinerade p-piller.
Följande tillstånd har rapporterats förekomma eller förvärras både i samband med graviditet och användning av kombinerade p-piller, men det finns inte övertygande bevis för ett samband med användning av kombinerade p-piller: kolestatisk gulsot och/eller klåda, gallsten, porfyri, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, Sydenhams korea, herpes gestationis, och otosklerosrelaterad hörselnedsättning.
Försämring av endogen depression, Crohns sjukdom och ulcerös kolit har rapporterats i vissa fall under användning kombinerade p-piller.
Ibland kan kloasma förekomma, särskilt hos kvinnor som tidigare haft kloasma under graviditet. Kvinnor med benägenhet för kloasma bör undvika för solexponering eller exponering för ultraviolett ljus under användning av kombinerade p-piller.
Läkarundersökning/konsultation
Innan användning av Rigevidoncont påbörjas eller används igen ska en fullständig anamnes (inklusive hereditet) tas och graviditet uteslutas. Blodtrycket ska tas och en läkarundersökning ska utföras baserat på kontraindikationer (se avsnitt Kontraindikationer) och varningar (se avsnitt Varningar och försiktighet). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Rigevidoncont jämfört med andra kombinerade hormonella preventivmedel, symtomen på VTE och ATE, de kända riskfaktorerna och vad hon ska göra i händelse av en misstänkt trombos.
Kvinnan ska också informeras om att noggrant läsa igenom bipacksedeln och följa anvisningarna. Frekvensen och typen av undersökningar ska baseras på fastställda riktlinjer och anpassas individuellt till varje kvinna.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hiv‑infektioner (AIDS) och andra sexuellt överförbara sjukdomar.
Nedsatt effekt
Effekten av kombinerade p-piller kan vara nedsatt vid glömd tablett, kräkningar eller diarré (se avsnitt Dosering och administreringssätt) eller samtidigt intag av andra läkemedel (se avsnitt Interaktioner).
Nedsatt cykelkontroll
Oregelbundna blödningar (stänkblödning eller genombrottsblödning) kan förekomma vid användning av alla kombinerade p-piller, särskilt under de första behandlingsmånaderna. På grund av detta är det meningsfullt att utvärdera oregelbundna blödningar först efter en anpassningsperiod, som bör omfatta ungefär tre menstruationscykler.
Om oregelbundna blödningar kvarstår eller uppstår efter tidigare regelbundna cykler, ska icke-hormonella orsaker övervägas och lämpliga diagnostiska åtgärder vidtas för att utesluta malignitet eller graviditet. Detta kan inkludera skrapning.
Vissa kvinnor får kanske ingen bortfallsblödning under perioden med placebotabletter. Om tabletterna tagits enligt beskrivningen i avsnitt Dosering och administreringssätt är det osannolikt att kvinnan är gravid. Om tabletterna inte tagits enligt anvisningarna innan den första uteblivna blödningsperioden, eller om två blödningsperioder uteblir måste graviditet uteslutas innan behandling med kombinerade p-piller fortsätter.
Förhöjda ALAT-värden
I kliniska studier med patienter som behandlas för hepatit C‑virusinfektioner (HCV) med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, sågs en alanintransaminasstegring (ALAT) som var mer än 5 gånger högre än den normala övre gränsen. ALAT-stegringen inträffade signifikant oftare hos kvinnor som använde etinylestradiolinnehållande läkemedel, såsom kombinerade preventivmedel (CHCs). ALAT-stegringar har också observerats med HCV antivirala läkemedel som innehåller glekaprevir/pibrentasvir och sofosbuvir/velpatasvir/voxilaprevir (se avsnitt Kontraindikationer och Interaktioner).
Hjälpämnen med kända effekter
Laktos och sackaros
Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption eller fruktosintolerans eller sukras-isomaltas-brist.
Para-orange (E110)
Placebotabletterna innehåller para-orange, vilket kan ge allergiska reaktioner.
Natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per tablett, d.v.s. är näst intill ”natriumfritt”.
Interaktioner
Observera! Produktresumén för andra samtidigt använda läkemedel ska konsulteras för att identifiera potentiella interaktioner.
Interaktioner mellan kombinerade preventivmedel och andra substanser kan leda till en ökning eller minskning av plasmakoncentrationen av östrogen och progesteron.
Minskning av östrogens och progesterons plasmakoncentration kan leda till en ökning av mellanblödningar och minska effekten av kombinerade preventivmedel.
Kontraindicerade kombinationer
-
Johannesört (Hypericum perforatum) (se avsnitt Kontraindikationer)
Minskad plasmakoncentration av hormonella preventivmedel på grund av enzyminducerande effekt av johannesört, med risk för lägre effekt eller utebliven effekt vilket kan leda till allvarliga konsekvenser (graviditet). -
Ombitasvir/paritaprevir/ritonavir och dasabuvir (se avsnitt Kontraindikationer)
Ökad hepatotoxicitet.
Farmakodynamiska interaktioner
Samtidig behandling med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, glekaprevir/pibrentasvir och sofosbuvir/velpatasvir/voxilaprevir kan öka risken för alanintransaminasstegring (ALAT) (se avsnitt Kontraindikationer och Varningar och försiktighet). Därför måste patienter som behandlas med Rigevidoncont byta till ett alternativt preventivmedel (t.ex. endast gestagen-innehållande preventivmedel eller icke hormonella metoder) innan dessa behandlingar påbörjas. Behandling med Rigevidoncont kan påbörjas igen 2 veckor efter att dessa behandlingar avslutats.
Farmakokinetiska interaktioner
- Effekter av andra läkemedel på Rigevidoncont
Interaktioner kan förekomma med läkemedel som inducerar mikrosomala enzymer, vilket kan resultera i ökat clearance av könshormoner och leda till genombrottsblödning och/eller utebliven preventiv effekt.
Behandling
Enzyminduktion kan ses redan efter några dagars behandling. Maximal enzyminduktion ses vanligen inom några veckor. Efter att läkemedelsbehandlingen avslutats kan enzyminduktion fortsätta i cirka 4 veckor.
Korttidsbehandling
Kvinnor som behandlas med enzyminducerande läkemedel bör tillfälligt använda en barriärmetod eller någon annan preventivmetod som tillägg till kombinerade p-piller. Barriärmetod bör användas under hela samtidiga läkemedelsbehandlingen samt i ytterligare 28 dagar efter avslutad behandling. Om läkemedelsbehandlingen pågår längre än de aktiva tabletterna i p-pillerförpackningen, ska placebotabletterna kasseras och nästa p-pillerförpackning påbörjas omedelbart.
Långtidsbehandling
För kvinnor som står på långvarig behandling med leverenzyminducerande aktiva substanser rekommenderas användning av en annan pålitlig, icke-hormonell preventivmetod.
Följande interaktioner har rapporterats i litteraturen.
Läkemedel som ökar clearance av kombinerade p-piller (minskar effekten av kombinerade p-piller genom att inducera leverenzymer) t.ex.:
Barbiturater, bosentan, karbamazepin, fenytoin, primidon, rifampicin och HIV-läkemedlen ritonavir, nevirapin och efavirenz och möjligen också felbamat, griseofulvin, oxkarbazepin, topiramat och produkter som innehåller Johannesört (Hypericum perforatum).
Läkemedel som har varierande effekt på clearance av kombinerade p-piller:
Vid samtidig administrering med kombinerade p-piller kan flera kombinationer av HIV‑proteashämmare och icke-nukleosida omvända transkriptashämmare (bl.a. kombinationer med HCV-hämmare) öka eller minska plasmakoncentrationer av östrogen eller progestin. Den totala effekten av dessa förändringar kan i vissa fall vara kliniskt signifikant.
Därför ska produktresumén för samtidigt använda HIV/HCV-läkemedel konsulteras för att identifiera potentiella interaktioner och eventuella tillhörande rekommendationer. I tveksamma fall ska kvinnor som tar proteashämmare eller icke-nukleosida omvända transkriptashämmare även använda en barriärmetod.
- Effekten av Rigevidoncont på andra läkemedel
Kombinerade p-piller kan påverka metabolismen av vissa andra aktiva substanser. Koncentrationer i plasma och vävnader kan således antingen öka (t.ex. ciklosporin) eller minska (t.ex. lamotrigin).
- Andra typer av interaktioner
Modafinil
Risk för nedsatt preventiv effekt under behandlingen och under en menstruationscykel efter utsättningen av modafinil på grund av läkemedlets enzymhämmande potential. Användning av p-piller i högre dos (normodose) eller ett annat preventivmedel rekommenderas.
Vemurafenib
Risk för minskad koncentration av östrogen eller progestogen och därmed risk för nedsatt effekt.
Perampanel
För perampaneldoser på ≥ 12 mg/dygn: risk för nedsatt preventiv effekt. Användning av ett annat preventivmedel (särskilt barriärmetod) rekommenderas.
Ulipristal
Risk för antagonistisk effekt av progesteron. Återuppta inte användning av kombinerade p-piller på minst 12 dagar efter att ulipristal avslutats.
Rufinamid
Måttlig minskning av etinylestradiolkoncentrationen. Användning av ett annat preventivmedel (särskilt barriärmetod) rekommenderas.
Etoricoxib
Koncentrationen av etinylestradiol ökar vid samtidig användning av etoricoxib.
Laboratorietester
Användning av kombinerade p-piller kan påverka resultaten av vissa laboratorietester, såsom biokemiska parametrar för lever-, thyreoidea-, binjure- och njurfunktionen; plasmanivåer av bärarproteiner t.ex. kortikosteroidbindande globulin och lipid/lipoproteinfraktioner, parametrar för kolhydratmetabolismen och parametrar för blodkoagulation och fibrinolys. Förändringarna ligger vanligtvis inom normala laboratorievärden.
Fertilitet, graviditet och amning
Graviditet
Rigevidoncont ska inte användas under graviditet.
Om graviditet inträffar under användning av Rigevidoncont, ska behandlingen omedelbart avbrytas. Omfattande epidemiologiska studier har dock inte visat på en förhöjd risk för medfödda missbildningar hos barn födda av kvinnor som använt kombinerade p-piller före graviditeten, eller på teratogena effekter när kombinerade p-piller oavsiktligt använts tidigt under graviditeten. Den ökade risken för VTE under postpartumperioden ska beaktas vid återinsättning av Rigevidoncont (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Amning
Amningen kan påverkas av kombinerade p-piller eftersom dessa kan minska mängden bröstmjölk och ändra dess sammansättning. Därför rekommenderas i allmänhet inte användning av kombinerade p-piller förrän den ammande kvinnan helt har slutat amma. Små mängder av kontraceptiva steroider och/eller deras metaboliter kan utsöndras i bröstmjölken. Dessa mängder kan påverka barnet. Om kvinnan önskar att amma, bör en annan preventivmetod rekommenderas.
Effekter på förmågan att framföra fordon och använda maskiner
Inga studier på förmågan att framföra fordon och använda maskiner har utförts. Ingen effekt på förmågan att framföra fordon och använda maskiner har observerats hos personer som använder kombinerade p-piller.
Biverkningar
Följande biverkningar har rapporterats vid användning av levonorgestrel/etinylestradiol:
Organsystem | Vanliga (≥ 1/100, < 1/10) | Mindre vanliga (≥ 1/1 000, < 1/100) | Sällsynta (≥1/10 000, < 1/1 000) | Mycket sällsynta (< 1/10 000) | Ingen känd frekvens (kan inte beräknas från tillgängliga data) |
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) | Hepatocellulär carcinom Godartade levertumörer (t.ex. fokal nodulär hyperplasi, leveradenom) | ||||
Infektioner och infestationer | Vaginit, inklusive vaginal kandidos | ||||
Immunsystemet | Anafylaktiska reaktioner med mycket sällsynta fall av nässelutslag Angioödem Cirkulatorisk sjukdom och svår luftvägssjukdom | Försämring av systemisk lupus erythematosus | Förvärrade symtom av ärftligt eller förvärvat angioödem | ||
Metabolism och nutrition | Förändrad aptit (ökad eller minskad) | Glukosintolerans | Försämring av porfyri | ||
Psykiska störningar | Humörsvängningar, inklusive depression Förändrad libido | ||||
Centrala och perifera nervsystemet | Nervositet Yrsel | Försämrad korea | |||
Ögon | Kontaktlinsintolerans | Opticusneurit Retinal vaskulär trombos | |||
Blodkärl | Hypertoni | Venös trombo-embolism och arteriell tromboembolism | Förvärrat åderbråck | ||
Magtarmkanalen | Illamående Kräkning Buksmärta | Magkramper Uppblåsthet | Ischemisk kolit | Inflammatorisk tarmsjukdom (Crohns sjukdom, ulcerös kolit) | |
Lever och gallvägar | Kolestatisk gulsot | Bukspottkörtelinflammation Gallsten Kolestas | Leverskada (t.ex. leverinflammation, avvikande leverfunktion) | ||
Hud och subkutan vävnad | Akne | Utslag Kloasma (melasma) som kan vara långvarigt Hirsutism Håravfall | Erythema nodosum | Erythema multiforme | |
Njurar och urinvägar | Hemolytiskt-uremiskt syndrom | ||||
Reproduktions-organ och bröstkörtel | Smärta i brösten, ömma bröst, svullnad och sekretion Dysmenorré Förändrade cykler Förändrad ektropion och vaginalsekretet Amenorré | ||||
Allmänna symtom och/eller symtom vid administrerings-stället | Vätskeretention/ödem Viktförändring (ökning eller minskning) | ||||
Undersökningar | Modifierade plasmalipider, inklusive hyper-triglyceridemi | Minskad serumfolat |
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och trombemboliska händelser, t.ex. myokardiell infarkt, stroke, transitoriska ischemiska attacker, venös trombos och lungemboli har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket diskuteras mer i detalj i avsnitt Varningar och försiktighet.
Följande allvarliga biverkningar har rapporterats hos kvinnor som använder kombinerade hormonella preventivmedel. Dessa beskrivs i avsnitt Varningar och försiktighet.
- venös tromboembolisk sjukdom
- arteriell tromboembolisk sjukdom
- hypertoni
- levertumörer
- Crohns sjukdom, ulcerös kolit, porfyri, systemisk lupus erythematosus, herpes gestationis, Sydenhams korea, hemolytiskt-uremiskt syndrom, kolestatisk gulsot.
Förekomsten av bröstcancerdiagnoser är något ökad hos användare av p-piller. Då bröstcancer är ovanligt hos kvinnor under 40 år, är det ökade antalet litet i förhållande till den totala risken för bröstcancer. Dess orsakssamband med p-pilleranvändning är inte känt. För mer information, se avsnitt Kontraindikationer och Varningar och försiktighet.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Symtom på överdos av p-piller har rapporterats hos vuxna, ungdomar och barn under 12 år. Överdosering kan orsaka följande symtom: illamående, kräkningar, smärta i brösten, yrsel, magsmärtor, sömnighet/trötthet samt vaginalblödning hos unga flickor. Det finns ingen antidot och behandlingen är symtomatisk.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Könshormoner och modulatorer av könsorgan, gestagener och estrogener, ATC-kod: G03AA07
Verkningsmekanism
Den antikonceptionella effekten av Rigevidoncont 150 mikrog/30 mikrog -tabletter är baserad på interaktion mellan flera olika faktorer. De viktigaste av dessa är hämning av ägglossning och förändringar av endometriet och cervixsekretet.
Pearl Index (antalet graviditeter/100 kvinnoår) för kombinerade lågdos monofasiska p-piller innehållande 0,15 mg levonorgestrel och 0,03 mg etinylestradiol är 0,1 (metodsvikt).
Farmakokinetiska egenskaper
Levonorgestrel
Absorption
Levonorgestrel absorberas snabbt och nästan fullständigt efter oralt intag av Rigevidoncont 150 mikrog/30 mikrog. Efter oral administration nås maximala plasmakoncentrationen av levonorgestrel inom 30 till 120 minuter Biotillgängligheten är ca 100 % och levonorgestrel utsätts inte för förstapassagemetabolism.
Distribution
Levonorgestrel är till stor del bundet till albumin och könshormonbindande globulin (SHBG) i plasma.
Metabolism
Metabolism sker huvudsakligen genom reduktion av Δ4-3-oxo gruppen och hydroxylering vid position 2α, 1β och 16β följt av konjugering. Majoriteten av metaboliterna som cirkulerar i blodet är sulfater av 3α, 5β-tetrahydro-levonorgestrel, medan utsöndring huvudsakligen sker som glukuronider. En del av den ursprungliga levonorgestrelen cirkulerar även som 17β-sulfat. Metabolisk clearance varierar avsevärt mellan individer, vilket delvis skulle kunna förklara den stora variationen av levonorgestrelkoncentrationer hos olika patienter.
Eliminering
Levonorgestrel elimineras med en halveringstid på ca 36 timmar vid steady state. Levonorgestrel och dess metaboliter utsöndras primärt i urin (40–68 %) och ca 16-48 % utsöndras i feces.
Etinylestradiol
Absorption
Etinylestradiol absorberas snabbt och nästan fullständigt via det gastrointestinala systemet, och maximala plasmanivåer nås inom 60‑180 minuter.
Som en följd av presystemisk konjugering och förstapassagemetabolism är den genomsnittliga biotillgängligheten 40‑45 %. AUC (arean under kurvan) och Cmax kan förväntas stiga något över tiden.
Distribution
Etinylestradiol är till 98,8 % bundet till plasmaproteiner, nästan uteslutande till albumin.
Metabolism
Etinylestradiol genomgår presystemisk konjugering både i tunntarmens slemhinna och i levern. Hydrolys av konjugaten av etinylestradiol sker med hjälp av tarmfloran och ger etinylestradiol som kan reabsorberas, vilket skapar en enterohepatisk cirkulation. Den primära vägen för metabolismen av etinylestradiol är cytokrom P-450-medierad hydroxylering och de primära metaboliterna är 2-OH-etinylestradiol och 2-metoxi-etinylestradiol. 2-OH-etinylestradiol metaboliseras vidare till kemiskt reaktiva metaboliter.
Eliminering
Etinylestradiol försvinner från plasma med en halveringstid på cirka 29 timmar (26–33 timmar), plasmaclearance varierar från 10–30 l/timme. Konjugaten av etinylestradiol och dess metaboliter utsöndras via urin och feces (kvot 1:1).
Prekliniska säkerhetsuppgifter
Den akuta toxiciteten för etinylestradiol och levonorgestrel är låg. På grund av tydliga artskillnader har prekliniska resultat ett begränsat prediktivt värde vid användning av östrogen hos människa.
Hos försöksdjur visade östrogen en embryoletal effekt redan vid relativt låga doser; missbildningar av urogenitala trakten och feminisering av manliga foster observerades. Levonorgestrel påvisade en viriliserande effekt hos kvinnliga foster. Studier av reproduktionstoxicitet hos råtta, möss och kanin visade inga andra tecken på teratogenicitet förutom effekten på sexuell differentiering.
Prekliniska data baserade på konventionella studier på repeterad dostoxicitet, genotoxicitet och carcinogen potential visade inte några särskilda risker för människa utöver vad som redan har beskrivits i andra avsnitt av produktresumén.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Aktiva tabletter:
Tablettkärna
kiseldioxid, kolloidal, vattenfri, magnesiumstearat, talk, majsstärkelse, laktosmonohydrat
Dragering
kiseldioxid, kolloidal, vattenfri, talk, sackaros, kalciumkarbonat, titandioxid (E 171), kopovidon K-28, makrogol 6000, povidon K-30, karmellosnatrium
Placebo tabletter:
Tablettkärna
laktos, vattenfri, mikrokristallin cellulosa, stärkelse, pregelatiniserad, kiseldioxid, kolloidal, vattenfri, magnesiumstearat
Dragering
povidon K-90, titandioxid (E 171), makrogol 6000, sackaros, indigokarmin aluminiumlack (E132), kinolingult aluminiumlack (E104), natriumbensoat (E211), para-orange aluminiumlack (E110), talk, kalciumkarbonat
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
RIGEVIDONCONT tabletti, päällystetty
150/30 mikrog (L:kyllä) 3 x 28 fol (14,71 €)
PF-selosteen tieto
Rigevidoncont 150 mikrog/30 mikrog dragerade tabletter är förpackade i PVC/PVDC/aluminium-blister. Blisterkartorna är förpackade i pappkartonger tillsammans med en bipacksedel, en förvaringspåse samt klistermärken för veckodagarna.
Förpackningsstorlekar:
1x(21+7) dragerade tabletter
3x(21+7) dragerade tabletter
6x(21+7) dragerade tabletter
13x(21+7) dragerade tabletter
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
De aktiva dragerade tabletterna är vita, runda, bikonvexa sockerdragerade tabletter med diameter ca 6 mm.
Placebotabletterna är gröna, runda, bikonvexa sockerdragerade tabletter med diameter ca 7 mm.
Särskilda anvisningar för destruktion och övrig hantering
Inga särskilda anvisningar.
Ej använt läkemedel och avfall skall hanteras enligt gällande anvisningar.
Ersättning
RIGEVIDONCONT tabletti, päällystetty
150/30 mikrog 3 x 28 fol
- Ei korvausta.
Atc-kod
G03AA07
Datum för översyn av produktresumén
26.09.2022
Yhteystiedot
Barnhusgatan 22, 5tr
111 23 Stockholm
Sweden
+358105793700
medinfo.fi@gedeonrichter.eu
