QTERN tabletti, kalvopäällysteinen 5/10 mg
Vaikuttavat aineet ja niiden määrät
Yksi tabletti sisältää saksagliptiinihydrokloridia määrän, joka vastaa 5 mg saksagliptiinia, ja dapagliflotsiinipropaanidiolimonohydraattia määrän, joka vastaa 10 mg dapagliflotsiinia.
Apuaine, jonka vaikutus tunnetaan
Yksi tabletti sisältää 40 mg laktoosia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kalvopäällysteinen tabletti (tabletti).
Kliiniset tiedot
Käyttöaiheet
Qtern, saksagliptiinin ja dapagliflotsiinin kiinteäannoksinen yhdistelmä, on tarkoitettu tyypin 2 diabetesta sairastaville vähintään 18‑vuotiaille aikuispotilaille:
- parantamaan glukoositasapainoa, kun metformiinilla ja/tai sulfonyyliurealla ja Qtern-valmisteen jommankumman lääkeaineen yksittäisellä käytöllä ei saavuteta riittävää glukoositasapainoa
- kun heitä jo hoidetaan samanaikaisesti erillisillä dapagliflotsiini‑ ja saksagliptiinivalmisteilla.
(Ks. kohdista Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet, Yhteisvaikutukset ja Farmakodynamiikka saatavilla olevat tiedot tutkituista yhdistelmistä.)
Annostus ja antotapa
Annostus
Suositeltu vuorokausiannos on yksi tabletti, joka sisältää 5 mg saksagliptiinia ja 10 mg dapagliflotsiinia (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Unohtunut annos
Jos potilas unohtaa ottaa annoksen ja seuraavan annoksen ottamiseen on vähintään 12 tuntia, unohtunut annos otetaan heti. Jos potilas unohtaa ottaa annoksen ja seuraavan annoksen ottamiseen on alle 12 tuntia, unohtunut annos jätetään ottamatta ja seuraava annos otetaan tavanomaiseen aikaan.
Erityisryhmät
Munuaisten vajaatoiminta
Annoksen muuttamista munuaisten toiminnan perusteella ei suositella.
Qtern-valmistetta ei pidä käyttää potilaille, joiden glomerulusten suodatusnopeus (GFR) on jatkuvasti < 45 ml/min, eikä potilaille, joilla on loppuvaiheen munuaissairaus (end-stage renal disease, ESRD) (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset, Farmakodynamiikka ja Farmakokinetiikka).
Maksan vajaatoiminta
Tätä lääkevalmistetta voidaan käyttää potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta. Kohtalaista maksan vajaatoimintaa sairastavien potilaiden status on arvioitava ennen hoidon aloittamista ja hoidon aikana.
Sen käyttöä ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iäkkäät (vähintään 65-vuotiaat)
Annoksen muuttamista iän perusteella ei suositella.
Pediatriset potilaat
Tämän lääkevalmisteen turvallisuutta ja tehoa 0–18‑vuotiaiden lasten ja nuorten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Qtern otetaan suun kautta kerran vuorokaudessa. Se voidaan ottaa mihin aikaan päivästä tahansa joko aterian yhteydessä tai tyhjään mahaan. Tabletti on nieltävä kokonaisena.
Vasta-aiheet
Yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille tai aiemmin ilmennyt minkä tahansa dipeptidyylipeptidaasi 4:n estäjän (DPP‑4:n estäjän) tai minkä tahansa natriumin- ja glukoosinkuljettajaproteiini 2:n estäjän (SGLT2:n estäjän) aiheuttama vakava yliherkkyysreaktio, kuten anafylaktinen reaktio, anafylaktinen sokki tai angioedeema (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Apuaineet).
Varoitukset ja käyttöön liittyvät varotoimet
Akuutti haimatulehdus
DPP‑4:n estäjien käyttöön on liittynyt akuutin haimatulehduksen riski. Potilaalle on kerrottava akuutin haimatulehduksen tyypillisistä oireista, kuten pitkittyneestä voimakkaasta vatsakivusta. Tämän lääkevalmisteen käyttö on keskeytettävä, jos epäillään haimatulehdusta. Hoitoa ei pidä aloittaa uudelleen, jos akuutti haimatulehdusdiagnoosi varmistuu. Varovaisuutta on noudatettava, kun hoidetaan potilaita, joilla on aiemmin ollut haimatulehdus.
Saksagliptiinin myyntiintulon jälkeen spontaaneissa haittavaikutusraporteissa on ilmoitettu akuuttia haimatulehdusta (ks. kohta Haittavaikutukset).
Munuaisten vajaatoiminta
Dapagliflotsiinin glukoosipitoisuutta pienentävä teho riippuu munuaisten toiminnasta. Teho on alentunut potilailla, joiden GFR-arvo on < 45 ml/min, ja todennäköisesti puuttuu potilailta, joilla on vaikea munuaisten vajaatoiminta (ks. kohdat Annostus ja antotapa, Farmakodynamiikka ja Farmakokinetiikka).
Tutkimuksessa, johon osallistui tyypin 2 diabetesta sairastavia potilaita, joilla oli kohtalainen munuaisten vajaatoiminta (GFR < 60 ml/min), kreatiniini‑, fosfori- ja lisäkilpirauhashormoniarvojen suurenemista sekä hypotensiota ilmeni haittavaikutuksina enemmän dapagliflotsiiniryhmässä kuin lumelääkeryhmässä.
Tätä lääkevalmistetta ei pidä käyttää potilaille, joiden GFR on jatkuvasti < 45 ml/min. Saksagliptiinin ja dapagliflotsiinin kiinteäannoksista yhdistelmää ei ole tutkittu vaikeaa munuaisten vajaatoimintaa (GFR < 30 ml/min) tai loppuvaiheen munuaisten vajaatoimintaa (ESRD) sairastavilla potilailla.
Munuaisten toiminta on suositeltavaa arvioida ennen tämän lääkevalmisteen käytön aloittamista, ja sen jälkeen munuaiset on arvioitava säännöllisesti tavanomaisen hoitokäytännön mukaisesti (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Hoito tällä lääkevalmisteella on keskeytettävä, jos munuaisten toiminta heikkenee niin, että GFR on jatkuvasti < 45 ml/min.
Käyttö nestehukan ja/tai hypotension riskiryhmään kuuluville potilaille
Dapagliflotsiinin vaikutusmekanismin vuoksi tämä lääkevalmiste lisää virtsaneritystä, mikä saattaa aiheuttaa vähäistä verenpaineen laskua, jota on havaittu kliinisissä tutkimuksissa (ks. kohta Farmakodynamiikka). Lasku voi olla merkittävämpi potilailla, joilla on erittäin korkea veren glukoosipitoisuus.
Varovaisuutta on noudatettava potilailla, joille dapagliflotsiinin aiheuttama verenpaineen lasku saattaa olla riski, kuten potilailla, joilla on ollut hypotensiota verenpainelääkityksen yhteydessä, tai iäkkäillä potilailla.
Nestetasapainon huolellista seurantaa (esim. lääkärintarkastus, verenpainemittaukset, laboratoriotutkimukset, mukaan lukien hematokriitti ja elektrolyytit) suositellaan, jos potilaalla on lisäksi muita sairaustiloja, jotka saattavat johtaa nestehukkaan (esim. maha-suolikanavan sairaus). Tämän lääkevalmisteen käytön tilapäistä keskeyttämistä suositellaan, jos potilaalle kehittyy nestehukka, kunnes nestehukka on korjaantunut (ks. kohta Haittavaikutukset).
Käyttö maksan vajaatoimintaa sairastaville potilaille
Kliinisissä tutkimuksissa on vähän kokemusta käytöstä potilaille, joilla on maksan vajaatoiminta. Dapagliflotsiini- ja saksagliptiinialtistus suurenevat potilailla, joilla on vaikea maksan vajaatoiminta (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka). Saksagliptiinin ja dapagliflotsiinin kiinteäannoksista yhdistelmää voidaan käyttää potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta. Kohtalaista maksan vajaatoimintaa sairastavien potilaiden status on arvioitava ennen hoidon aloittamista ja hoidon aikana. Tämän lääkevalmisteen käyttöä ei suositella potilaille, joilla on vaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa).
Diabeettinen ketoasidoosi
Harvinaisia diabeettisen ketoasidoosin tapauksia, myös henkeä uhkaavia ja kuolemaan johtaneita, on ilmoitettu potilailla, joita on hoidettu SGLT2:n estäjillä, dapagliflotsiini mukaan lukien. Useissa tapauksissa sairaustila ilmeni epätyypillisenä sikäli, että veren glukoosipitoisuudet olivat vain jonkin verran koholla, alle 14 mmol/l (250 mg/dl). Ei tiedetä, ilmeneekö diabeettista ketoasidoosia todennäköisemmin käytettäessä suuria dapagliflotsiiniannoksia.
Diabeettisen ketoasidoosin riski täytyy ottaa huomioon, jos potilaalla on epäspesifisiä oireita, kuten pahoinvointia, oksentelua, ruokahaluttomuutta, vatsakipua, epänormaalin voimakasta janoa, hengitysvaikeuksia, sekavuutta, epätavallista väsymystä tai uneliaisuutta. Jos tällaisia oireita ilmenee, potilas on tutkittava ketoasidoosin varalta välittömästi veren glukoosipitoisuudesta riippumatta.
Hoito tällä lääkevalmisteella on lopetettava välittömästi, jos potilaalla epäillään olevan tai todetaan diabeettinen ketoasidoosi.
Hoito on keskeytettävä potilailta, jotka ovat sairaalahoidossa suuren kirurgisen toimenpiteen tai äkillisen vakavan sairauden takia. Näillä potilailla suositellaan ketonien seurantaa. Ketonipitoisuus kannattaa mitata verestä eikä virtsasta. Dapagliflotsiinihoito voidaan aloittaa uudelleen, kun ketonipitoisuus on normaali ja potilaan tila on jälleen vakaa.
Ennen hoidon aloittamista tällä lääkevalmisteella on otettava huomioon potilaalla aiemmin ilmenneet tekijät, jotka saattavat altistaa ketoasidoosille.
Suurentuneen diabeettisen ketoasidoosin riskiryhmään saattavat kuulua potilaat, joiden toiminnallisten beetasolujen määrä on vähentynyt (kuten tyypin 2 diabetesta sairastavat potilaat, joiden C-peptidiarvot ovat pienet, tai potilaat, joilla on aikuisiällä alkava latentti autoimmuunityyppinen diabetes (LADA) tai joilla on aiemmin ollut haimatulehdus), potilaat, joilla on rajoittuneeseen ravinnonsaantiin tai vaikeaan nestehukkaan johtava tila, potilaat, joiden insuliiniannosta on pienennetty, ja potilaat, joiden insuliinin tarve on lisääntynyt akuutin sairauden, leikkauksen tai alkoholin väärinkäytön vuoksi. SGLT2:n estäjiä on käytettävä varoen tällaisille potilaille.
Hoitoa SGLT2:n estäjällä ei suositella aloittamaan uudelleen, jos potilaalla on aiemmin ollut diabeettinen ketoasidoosi SGLT2:n estäjällä toteutetun hoidon aikana eikä diabeettiselle ketoasidoosille ole löytynyt muuta selkeää selittävää syytä, joka on korjautunut.
Saksagliptiinin ja dapagliflotsiinin kiinteäannoksisen yhdistelmän turvallisuutta ja tehoa tyypin 1 diabetesta sairastavilla potilailla ei ole varmistettu, eikä tällaista yhdistelmää pidä käyttää tyypin 1 diabetesta sairastavien potilaiden hoitoon. Dapagliflotsiinilla tehdyissä tyypin 1 diabetesta koskeneissa tutkimuksissa diabeettista ketoasidoosia ilmoitettiin yleisenä haittavaikutuksena.
Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)
Markkinoille tulon jälkeisistä välilihan nekrotisoivan faskiitin (tämä tunnetaan myös nimellä Fournier’n gangreeni) tapauksista on ilmoitettu nais- ja miespotilailla, jotka käyttävät SGLT2:n estäjiä (ks. kohta Haittavaikutukset). Tämä on harvinainen, mutta vakava ja mahdollisesti hengenvaarallinen tapahtuma, joka edellyttää kiireellistä leikkausta ja antibioottihoitoa.
Potilaita on kehotettava kääntymään lääkärin puoleen, jos heillä on kipua, aristusta, punoitusta tai turvotusta genitaali- tai perineaalialueella ja tähän liittyy kuumetta tai huonovointisuutta. Huomatkaa, että nekrotisoivaa faskiittia voi edeltää urogenitaali-infektio tai perineaaliabsessi. Jos Fournier’n gangreenia epäillään, Qtern-valmisteen käyttö on keskeytettävä ja hoito (mukaan lukien antibioottihoito ja puhdistusleikkaus) on aloitettava.
Yliherkkyysreaktiot
Tätä lääkevalmistetta ei saa käyttää, jos potilaalla on ollut vakava yliherkkyysreaktio dipeptidyylipeptidaasi 4:n (DPP‑4:n) estäjien tai natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2:n) estäjän käytön yhteydessä (ks. kohta Vasta-aiheet).
Valmisteen markkinoille tulon jälkeen spontaaneissa raporteissa ja kliinisissä tutkimuksissa on ilmoitettu seuraavia saksagliptiinin käyttöön liittyneitä haittavaikutuksia: vakavat yliherkkyysreaktiot, kuten anafylaktinen reaktio, anafylaktinen sokki ja angioedeema. Jos vakavaa yliherkkyysreaktiota epäillään, hoito tällä lääkevalmisteella on lopetettava, tapahtuma on arvioitava ja on aloitettava vaihtoehtoinen diabeteshoito (ks. kohta Haittavaikutukset).
Virtsatieinfektiot
Glukoosin erittymiseen virtsaan saattaa liittyä suurentunut virtsatieinfektion riski. Sen vuoksi tämän lääkevalmisteen käytön tilapäistä keskeyttämistä on harkittava, kun hoidetaan pyelonefriittiä tai urosepsista.
Iäkkäät (vähintään 65-vuotiaat)
Iäkkäillä potilailla nestehukan riski saattaa olla suurentunut, ja heitä hoidetaan todennäköisemmin diureeteilla.
Iäkkäillä potilailla heikentyneen munuaisten toiminnan todennäköisyys kasvaa ja/tai heitä hoidetaan todennäköisemmin verenpainelääkkeillä, jotka saattavat muuttaa munuaisten toimintaa, kuten angiotensiinikonvertaasin estäjillä (ACE-I) ja angiotensiinireseptorin (tyypin 1) salpaajilla (ATR-salpaajat). Kaikkien potilaiden munuaisten toiminnan seurannasta annetut suositukset koskevat myös iäkkäitä potilaita (ks. kohdat Annostus ja antotapa, Varoitukset ja käyttöön liittyvät varotoimet, Haittavaikutukset ja Farmakodynamiikka).
Tämän lääkevalmisteen käytöstä vähintään 65‑vuotiaille potilaille on vähän ja vähintään 75‑vuotiaille potilaille erittäin vähän kokemusta.
Ihosairaudet
Saksagliptiinilla tehdyissä ei-kliinisissä toksisuustutkimuksissa on raportoitu haavaisia ja nekroottisia iholeesioita apinoiden raajoissa (ks. kohta Prekliiniset tiedot turvallisuudesta). Iholeesioiden esiintyvyyden suurenemista ei havaittu saksagliptiinilla tehdyissä kliinisissä tutkimuksissa. DPP‑4:n estäjien ryhmään kuuluvien lääkeaineiden käytön yhteydessä on niiden markkinoille tulon jälkeen raportoitu ihottumaa. Ihottumaa on todettu myös tämän lääkevalmisteen haittavaikutuksena (ks. kohta Haittavaikutukset). Siksi suositellaan ihomuutosten, kuten rakkuloiden, haavaumien tai ihottuman, seurantaa diabeetikkojen rutiinihoidon mukaisesti.
Rakkulainen pemfigoidi
Myyntiluvan myöntämisen jälkeen DPP-4:n estäjiä, mukaan lukien saksagliptiinia, saaneilla potilailla on ilmoitettu sairaalahoitoa vaatinutta rakkulaista pemfigoidia. Ilmoitetuissa tapauksissa potilaat saivat tavallisesti vasteen paikalliseen tai systeemiseen immunosuppressiiviseen hoitoon ja DPP-4:n estäjän käytön lopettamiseen. Jos potilaalle kehittyy saksagliptiinin käytön aikana rakkuloita tai haavaumia ja hänellä epäillään rakkulaista pemfigoidia, tämän lääkevalmisteen käyttö on lopetettava ja on harkittava lähetettä ihotautilääkärille diagnoosia ja asianmukaista hoitoa varten (ks. kohta Haittavaikutukset).
Sydämen vajaatoiminta
Kokemusta dapagliflotsiinin käytöstä New York Heart Association (NYHA) ‑luokan IV potilaille on vain vähän. NYHA-luokkien III–IV potilaiden hoidosta saksagliptiinilla on vähän kokemusta.
SAVOR-tutkimuksessa sairaalajaksojen lukumäärä sydämen vajaatoiminnan vuoksi suureni hieman saksagliptiinihoitoryhmässä lumelääkkeeseen verrattuna, vaikka syy-yhteyttä ei ole osoitettu (ks. kohta Farmakodynamiikka). Tarkemmassa analyysissä NYHA-luokissa ei todettu vaikutuseroja.
Varovaisuutta on noudatettava, jos saksagliptiinin ja dapagliflotsiinin kiinteäannoksista yhdistelmää käytetään potilaille, joilla tiedetään olevan riskitekijöitä, jotka voivat johtaa sairaalahoitoon sydämen vajaatoiminnan vuoksi, kuten aiemmin todettu sydämen vajaatoiminta tai kohtalainen tai vaikea munuaisten vajaatoiminta. Potilaille on kerrottava sydämen vajaatoiminnan tyypillisistä oireista ja potilaita on kehotettava ilmoittamaan näistä oireista välittömästi.
Nivelkipu
Myyntiluvan myöntämisen jälkeisissä DPP‑4:n estäjiä koskevissa raporteissa on ilmoitettu nivelkipua, joka saattaa olla vaikea-asteista (ks. kohta Haittavaikutukset). Potilaiden oireet lievittyivät lääkevalmisteen käytön keskeyttämisen jälkeen ja osalla potilaista oireet uusiutuivat, kun hoito aloitettiin uudelleen samalla tai muulla DPP‑4:n estäjällä. Oireet saattavat ilmaantua nopeasti hoidon aloittamisen jälkeen tai vasta pitkän hoitojakson jälkeen. Jos potilaalla ilmenee vaikeaa nivelkipua, hoidon jatkamista on harkittava yksilöllisesti.
Immuunipuutteiset potilaat
Immuunipuutteisia potilaita, kuten potilaita, joille on tehty elinsiirto, tai potilaita, joilla on todettu ihmisen immuunivajeoireyhtymä, ei ole tutkittu saksagliptiinin kliinisessä tutkimusohjelmassa. Saksagliptiinin ja dapagliflotsiinin kiinteäannoksisen yhdistelmän teho- ja turvallisuusprofiilia näiden potilaiden osalta ei ole selvitetty.
Hematokriitin suureneminen
Dapagliflotsiinihoidon yhteydessä on havaittu hematokriitin suurenemista (ks. kohta Haittavaikutukset). Jos potilaan hematokriitti on suurentunut merkittävästi, hänen vointiaan on seurattava ja hänet on tutkittava taustalla olevan hematologisen sairauden varalta.
Alaraajojen amputaatiot
Käynnissä olevissa toisella SGLT2:n estäjällä tehdyissä pitkäaikaisissa kliinisissä tutkimuksissa on havaittu alaraaja-amputaatioiden (pääasiassa varvasamputaatioiden) määrän lisääntymistä. Ei tiedetä, onko kyseessä luokkavaikutus. Kuten kaikkien diabetespotilaiden kohdalla, on tärkeää antaa potilaalle ohjeita rutiininomaisesta ennaltaehkäisevästä jalkojenhoidosta.
Samanaikainen käyttö tunnetusti hypoglykemiaa aiheuttavien lääkevalmisteiden kanssa
Sekä saksagliptiini että dapagliflotsiini voivat erikseen suurentaa hypoglykemian riskiä, kun niitä käytetään yhdessä insuliinin eritystä lisäävän lääkeaineen kanssa. Jos tätä lääkevalmistetta käytetään yhdessä insuliinin eritystä lisäävän lääkeaineen (sulfonyyliurean) kanssa, sulfonyyliurea-annoksen pienentäminen saattaa olla tarpeen hypoglykemiariskin pienentämiseksi (ks. kohta Haittavaikutukset).
Virtsan laboratoriotutkimukset
Dapagliflotsiinin vaikutusmekanismin vuoksi tätä lääkevalmistetta käyttävien potilaiden virtsan glukoosimääritys on positiivinen.
Käyttö voimakkaiden CYP 3A4:n induktorien kanssa
CYP 3A4:n induktorien, kuten karbamatsepiinin, deksametasonin, fenobarbitaalin, fenytoiinin tai rifampisiinin, samanaikainen käyttö saattaa heikentää tämän lääkevalmisteen glukoosipitoisuutta alentavaa tehoa. Glukoositasapainoa on seurattava, kun valmistetta käytetään samanaikaisesti voimakkaan CYP 3A4/5:n induktorin kanssa (ks. kohta Yhteisvaikutukset).
Laktoosi
Tabletit sisältävät laktoosia. Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, täydellinen laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei pidä käyttää tätä lääkettä.
Natrium
Tämä lääkevalmiste sisältää alle 1 mmol (23 mg) natriumia per tabletti eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Farmakodynaamiset yhteisvaikutukset
Diureetit
Dapagliflotsiini saattaa lisätä tiatsidi- ja loop-diureettien diureettisia vaikutuksia, ja dehydraation ja hypotension riski saattaa suurentua (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Samanaikainen käyttö tunnetusti hypoglykemiaa aiheuttavien lääkevalmisteiden kanssa
Jos tätä lääkevalmistetta käytetään yhdessä insuliinin eritystä lisäävän lääkeaineen (sulfonyyliurean) kanssa, sulfonyyliurea-annoksen pienentäminen saattaa olla tarpeen hypoglykemiariskin pienentämiseksi (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakokineettiset yhteisvaikutukset
Saksagliptiini: Saksagliptiinin metabolia on ensisijaisesti sytokromi P450 3A4/5 (CYP 3A4/5) ‑välitteinen.
Dapagliflotsiini: Dapagliflotsiini metaboloituu pääasiassa UDP-glukuronosyylitransferaasi 1A9 -entsyymin (UGT1A9) välittämän glukuronidikonjugaation kautta.
Yhteisvaikutukset muiden suun kautta otettavien diabeteksen tai sydän- ja verisuonitaudin hoitoon käytettävien lääkevalmisteiden kanssa
Saksagliptiini: Saksagliptiini ei merkittävästi muuttanut dapagliflotsiinin, metformiinin, glibenklamidin, pioglitatsonin, digoksiinin, diltiatseemin tai simvastatiinin farmakokinetiikkaa. Nämä lääkevalmisteet eivät muuttaneet saksagliptiinin tai sen aktiivisen päämetaboliitin farmakokinetiikkaa.
Dapagliflotsiini: Dapagliflotsiini ei merkittävästi muuttanut saksagliptiinin, metformiinin, pioglitatsonin, sitagliptiinin, glimepiridin, vogliboosin, hydroklooritiatsidin, bumetanidin, valsartaanin tai simvastatiinin farmakokinetiikkaa. Nämä lääkevalmisteet eivät muuttaneet dapagliflotsiinin farmakokinetiikkaa.
Muiden lääkevalmisteiden vaikutukset saksagliptiiniin tai dapagliflotsiiniin
Saksagliptiini: Saksagliptiinin samanaikainen anto keskivahvan CYP 3A4/5:n estäjän, diltiatseemin, kanssa suurensi saksagliptiinin Cmax‑arvoa 63 % ja AUC-arvon 2,1‑kertaiseksi, ja vastaavat aktiivisen metaboliitin arvot pienenivät 44 % ja 34 %. Nämä farmakokineettiset vaikutukset eivät ole kliinisesti merkityksellisiä eikä annoksen muuttaminen ole tarpeen.
Saksagliptiinin samanaikainen anto voimakkaan CYP 3A4/5:n estäjän, ketokonatsolin, kanssa suurensi saksagliptiinin Cmax‑arvoa 62 % ja AUC-arvon 2,5‑kertaiseksi, ja vastaavat aktiivisen metaboliitin arvot pienenivät 95 % ja 88 %. Nämä farmakokineettiset vaikutukset eivät ole kliinisesti merkityksellisiä eikä annoksen muuttaminen ole tarpeen.
Saksagliptiinin samanaikainen anto voimakkaan CYP 3A4/5:n induktorin, rifampisiinin, kanssa pienensi saksagliptiinin Cmax‑arvoa 53 % ja AUC-arvoa 76 %. Rifampisiinilla ei ollut vaikutusta altistukseen aktiiviselle metaboliitille eikä plasman DPP‑4-aktiivisuuden estoon antovälin aikana (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Saksagliptiinin antoa samanaikaisesti muiden CYP 3A4/5:n induktorien kuin rifampisiinin (kuten karbamatsepiinin, deksametasonin, fenobarbitaalin ja fenytoiinin) kanssa ei ole tutkittu. Samanaikainen käyttö saattaa kuitenkin pienentää saksagliptiinin pitoisuutta ja suurentaa sen päämetaboliitin pitoisuutta plasmassa. Glukoositasapainoa on seurattava huolellisesti, kun saksagliptiinia käytetään samanaikaisesti voimakkaan CYP 3A4/5:n induktorin kanssa.
Terveillä tutkittavilla tehdyissä tutkimuksissa metformiini, glibenklamidi, pioglitatsoni, digoksiini, simvastatiini, omepratsoli, antasidit tai famotidiini eivät merkittävästi muuttaneet saksagliptiinin eivätkä sen päämetaboliitin farmakokinetiikkaa.
Dapagliflotsiini: Kun rifampisiinia (useiden aktiivisten kuljettajaproteiinien ja lääkkeitä metaboloivien entsyymien induktori) annettiin samanaikaisesti dapagliflotsiinin kanssa, systeemisen altistuksen (AUC) dapagliflotsiinille havaittiin pienentyneen 22 %, mutta kliinisesti merkittävää vaikutusta glukoosin erittymiseen virtsaan 24 tunnin aikana ei todettu. Annoksen muuttamista ei suositella. Kliinisesti merkittävää vaikutusta ei odoteta muiden induktorien (kuten karbamatsepiinin, fenytoiinin tai fenobarbitaalin) samanaikaisen annon yhteydessä.
Dapagliflotsiinin ja mefenaamihapon (UGT1A9:n estäjä) samanaikaisen annon jälkeen systeemisen dapagliflotsiinialtistuksen havaittiin suurentuneen 55 %, mutta kliinisesti merkityksellistä vaikutusta glukoosin erittymiseen virtsaan 24 tunnin aikana ei todettu.
Saksagliptiinin ja dapagliflotsiinin vaikutukset muihin lääkevalmisteisiin
Saksagliptiini: Saksagliptiini ei merkittävästi muuttanut metformiinin, glibenklamidin (CYP 2C9:n substraatti), pioglitatsonin [(merkittävä) CYP 2C8:n ja (heikompi) CYP 3A4:n substraatti], digoksiinin (P-glykoproteiinin substraatti), simvastatiinin (CYP 3A4:n substraatti), yhdistelmäehkäisytabletin vaikuttavien aineiden (etinyyliestradiolin ja norgestimaatin), diltiatseemin tai ketokonatsolin farmakokinetiikkaa.
Dapagliflotsiini:Dapagliflotsiini saattaa lisätä litiumin erittymistä munuaisten kautta, ja veren litiumpitoisuudet saattavat pienentyä. Seerumin litiumpitoisuutta on seurattava useammin dapagliflotsiinihoidon aloittamisen jälkeen. Potilas tulee ohjata litiumia määränneen lääkärin vastaanotolle seerumin litiumpitoisuuden seurantaa varten.
Terveillä tutkittavilla pääasiassa kerta-annoksia käyttämällä tehdyissä yhteisvaikutustutkimuksissa dapagliflotsiinin ei todettu muuttavan metformiinin, pioglitatsonin [(merkittävä) CYP 2C8:n ja (heikompi) CYP3A4:n substraatti], sitagliptiinin, glimepiridin (CYP 2C9:n substraatti), hydroklooritiatsidin, bumetanidin, valsartaanin, digoksiinin (P-glykoproteiinin substraatti) tai varfariinin (S-varfariini, CYP 2C9:n substraatti) farmakokinetiikkaa tai varfariinin veren hyytymistä estäviä vaikutuksia INR-lukemilla mitattuna. Dapagliflotsiinin 20 mg kerta-annoksen ja simvastatiinin (CYP 3A4:n substraatti) samanaikainen käyttö suurensi simvastatiinin AUC-arvoa 19 % ja simvastatiinihapon AUC-arvoa 31 %. Suurentunutta simvastatiini- ja simvastatiinihappoaltistusta ei pidetä kliinisesti merkittävinä.
Häiriöt 1,5-anhydroglusitolin (1,5-AG) määrityksessä
Glukoositasapainon seurantaa 1,5-AG-määrityksellä ei suositella, koska SGLT2:n estäjiä käyttäviltä potilailta 1,5-AG-määrityksellä mitatut arvot eivät luotettavasti kuvaa glukoositasapainoa. Vaihtoehtoisten menetelmien käyttöä glukoositasapainon seurantaan suositellaan.
Raskaus ja imetys
Raskaus
Saksagliptiinin ja dapagliflotsiinin käytöstä raskaana oleville naisille ei ole olemassa tietoja. Saksagliptiinia koskeneissa eläimillä tehdyissä tutkimuksissa on havaittu lisääntymistoksisuutta suurilla annoksilla (ks. kohta Prekliiniset tiedot turvallisuudesta). Rotilla tehdyissä dapagliflotsiinia koskevissa tutkimuksissa on osoitettu toksisia vaikutuksia kehittyvään munuaiseen ajanjaksolla, joka vastaa ihmisen toista ja kolmatta raskauskolmannesta (ks. kohta Prekliiniset tiedot turvallisuudesta). Tämän vuoksi Qtern-valmistetta ei pidä käyttää raskauden aikana.
Qtern-hoito on keskeytettävä, jos raskaus havaitaan.
Imetys
Ei tiedetä, erittyvätkö saksagliptiini ja dapagliflotsiini ja/tai niiden metaboliitit ihmisillä äidinmaitoon. Eläinkokeissa on osoitettu saksagliptiinin ja/tai sen metaboliitin erittyvän maitoon. Olemassa olevat farmakokineettiset/toksikologiset tiedot koe-eläimistä ovat osoittaneet dapagliflotsiinin ja/tai sen metaboliittien erittyvän maitoon sekä farmakologisesti välittyviä vaikutuksia imetetyissä jälkeläisissä (ks. kohta Prekliiniset tiedot turvallisuudesta). Imetettävään vauvaan kohdistuvia riskejä ei voida sulkea pois. Qtern-valmistetta ei pidä käyttää imetyksen aikana.
Hedelmällisyys
Saksagliptiinin ja dapagliflotsiinin vaikutusta ihmisten hedelmällisyyteen ei ole tutkittu. Millään tutkitulla dapagliflotsiiniannoksella ei ollut vaikutusta uros- ja naarasrottien hedelmällisyyteen. Saksagliptiinin suurilla annoksilla havaittiin olevan vaikutuksia uros- ja naarasrottien hedelmällisyyteen. Nämä annokset aiheuttivat ilmeisiä myrkytyksen merkkejä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Qtern-valmisteella ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn. Ajettaessa autoa tai käytettäessä koneita on otettava huomioon, että saksagliptiinin ja dapagliflotsiinin yhdistelmällä tehdyissä tutkimuksissa on raportoitu ilmenneen heitehuimausta. Potilaita on myös varoitettava hypoglykemian riskistä, jos Qtern-valmistetta käytetään yhdessä muiden sellaisten diabeteslääkkeiden kanssa, joiden tiedetään aiheuttavan hypoglykemiaa (kuten sulfonyyliureoiden kanssa).
Haittavaikutukset
Saksagliptiinin ja dapagliflotsiinin yhdistelmän turvallisuusprofiilin yhteenveto
Kolmessa enintään 52 viikon pituisessa vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, aktiivi/lumekontrolloidussa, rinnakkaisryhmillä toteutetussa kliinisessä monikeskustutkimuksessa arvioitiin saksagliptiinin (5 mg) ja dapagliflotsiinin (10 mg) yhdistelmää 1 169 aikuisella potilaalla, joilla oli tyypin 2 diabetes ja joilla ei saavutettu riittävää glukoositasapainoa metformiinilla (ks. kohta Farmakodynamiikka). Yhdistetty turvallisuusanalyysi sisälsi kolme hoitoryhmää: saksagliptiinin, dapagliflotsiinin ja metformiinin yhdistelmä (492 tutkittavaa), saksagliptiinin ja metformiinin yhdistelmä (336 tutkittavaa) ja dapagliflotsiinin ja metformiinin yhdistelmä (341 tutkittavaa). Saksagliptiinin, dapagliflotsiinin ja metformiinin yhteiskäytön turvallisuusprofiili vastasi yksittäisillä komponenteilla havaittuja haittavaikutuksia.
Qtern-valmisteen käytön yhteydessä yleisimmin ilmoitetut haittavaikutukset olivat ylempien hengitysteiden infektiot (hyvin yleinen), hypoglykemia yhdessä sulfonyyliurean kanssa käytettynä (hyvin yleinen) ja virtsatieinfektiot (yleinen). Diabeettista ketoasidoosia saattaa ilmetä harvoin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Haittavaikutustaulukko
Taulukossa 1 on esitetty haittavaikutukset. Turvallisuusprofiili perustuu saksagliptiinin ja dapagliflotsiinin yhdistelmällä tehtyjen kliinisten tutkimusten yhdistettyihin turvallisuutta koskeviin tietoihin sekä tietoihin, jotka on saatu yksittäisiä lääkeaineita koskeneista kliinisistä tutkimuksista, myyntiluvan myöntämisen jälkeisistä turvallisuustutkimuksista ja markkinoille tulon jälkeisistä kokemuksista. Haittavaikutukset on lueteltu elinjärjestelmäluokituksen ja esiintymistiheyden mukaisesti. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, ˂ 1/10), melko harvinainen (≥ 1 / 1 000, ˂ 1/100), harvinainen (≥ 1 / 10 000, < 1 / 1 000), hyvin harvinainen (< 1 / 10 000), ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 1. Ilmoitettujen haittavaikutusten yhteenveto
| Elinjärjestelmä | Hyvin yleinen | YleinenA | Melko harvinainenB | Harvinainen | Hyvin harvinainen | Tuntematon |
| Infektiot | Ylempien hengitysteiden infektio1 | Virtsatieinfektio2, vulvovaginiitti, balaniitti ja vastaavat genitaali-infektiot3, gastroenteriittiD | Sieni-infektio | Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)C,F,7 | ||
| Immuunijärjestelmä | YliherkkyysreaktiotC | Anafylaktiset reaktiot, myös anafylaktinen sokkiC | ||||
| Aineenvaihdunta ja ravitsemus | HypoglykemiaD (yhdessä sulfonyyliurean kanssa käytettynä) | Dyslipidemia4 | NestehukkaF, jano | Diabeettinen ketoasidoosiF,G,7 | ||
| Hermosto | Päänsärky, heitehuimaus | |||||
| Ruoansulatuselimistö | VatsakipuC, ripuli, dyspepsiaD, gastriittiD, pahoinvointiC, oksenteluD | Ummetus, suun kuivuus, haimatulehdusC | ||||
| Iho ja ihonalainen kudos | Ihottuma5 | IhotulehdusC, kutinaC, nokkosihottumaC | AngioedeemaC | Rakkulainen pemfigoidiC,7 | ||
| Luusto, lihakset ja sidekudos | Nivelkipu, selkäkipu, lihaskipuD | |||||
| Munuaiset ja virtsatiet | Dysuria, polyuriaD,6 | Nokturia | Tubulointerstitiaalinen nefriitti | |||
| Sukupuolielimet ja rinnat | Erektiohäiriö, sukupuolielinten kutina, vulvovaginaalinen kutina | |||||
| Yleisoireet ja antopaikassa todettavat haitat | VäsymysD, perifeerinen turvotusD | |||||
| Tutkimukset | Pienentynyt munuaisten kreatiniinipuhdistuma hoidon alussaF, hematokriitin kohoaminenE | Veren kreatiniinipitoisuuden suureneminen hoidon alussaF, veren ureapitoisuuden suureneminen, painon lasku |
A Haittavaikutukset, joita ilmoitettiin yhdistetyssä turvallisuusanalyysissä vähintään 2 %:lla tutkittavista, jotka olivat saaneet saksagliptiinin ja dapagliflotsiinin yhdistelmää, tai jos haittavaikutuksia oli ilmoitettu alle 2 %:lla tutkittavista yhdistetyssä turvallisuusanalyysissä, ne perustuivat yksittäisistä komponenteista saatuihin tietoihin.
B Kaikkien melko harvinaisten haittavaikutusten esiintymistiheydet perustuivat yksittäisistä komponenteista saatuihin tietoihin.
C Haittavaikutus on peräisin saksagliptiinin tai dapagliflotsiinin myyntiluvan myöntämisen jälkeisen seurannan tiedoista.
D Haittavaikutuksia ilmoitettiin vähintään 2 %:lla tutkittavista jommankumman lääkeaineen yksittäisen käytön yhteydessä ja vähintään 1 %:lla enemmän kuin lumelääkkeellä, mutta ei yhdistetyssä analyysissä.
E Yli 55 %:n hematokriittiarvoja ilmoitettiin dapagliflotsiinilla hoidetuilla tutkittavilla 1,3 % verrattuna lumelääkkeellä hoidetuilla ilmoitettuun 0,4 %:iin.
F Esiintymistiheys perustuu tapahtumiin dapagliflotsiinin kliinisessä tutkimusohjelmassa.
G Ilmoitettu dapagliflotsiinilla tehdyssä kardiovaskulaarisia tuloksia koskevassa tutkimuksessa, johon osallistui tyypin 2 diabetesta sairastavia potilaita (DECLARE). Esiintymistiheys perustuu vuotuiseen esiintyvyyteen.
1 Ylempien hengitysteiden infektio sisältää seuraavat suositellut termit: nenänielun tulehdus, influenssa, ylempien hengitysteiden infektio, nielutulehdus, nuha, poskiontelotulehdus, bakteerin aiheuttama nielutulehdus, nielurisatulehdus, akuutti nielurisatulehdus, kurkunpäätulehdus, viruksen aiheuttama nielutulehdus ja viruksen aiheuttama ylempien hengitysteiden infektio.
2 Virtsatieinfektio sisältää seuraavat suositellut termit: virtsatieinfektio, Escherichia colin aiheuttama virtsatieinfektio, pyelonefriitti ja eturauhastulehdus.
3 Vulvovaginiitti, balaniitti ja vastaavat genitaali-infektiot sisältävät seuraavat suositellut termit: vulvovaginaalinen mykoottinen infektio, balanopostiitti, genitaalialueen sieni-infektio, vaginaalinen infektio ja vulvovaginiitti.
4 Dyslipidemia sisältää seuraavat suositellut termit: dyslipidemia, hyperlipidemia, hyperkolesterolemia ja hypertriglyseridemia.
5 Ihottumaa on ilmoitettu saksagliptiinin ja dapagliflotsiinin markkinoille tulon jälkeisessä käytössä. Dapagliflotsiinin kliinisissä tutkimuksissa ilmoitetut suositellut termit esiintymistiheyden mukaisesti: ihottuma, yleistynyt ihottuma, kutiava ihottuma, täpläinen ihottuma, täpläinen ja näppyläinen ihottuma, märkärakkulainen ihottuma, vesirakkulainen ihottuma ja punoittava ihottuma.
6 Polyuria sisältää seuraavat suositellut termit: polyuria ja pollakisuria.
7 Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet
SU = sulfonyyliurea
Valikoitujen haittavaikutusten kuvaus
Vulvovaginiitti, balaniitti ja vastaavat genitaali-infektiot
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Yhdistetyn turvallisuusanalyysin ilmoitetut haittatapahtumat vulvovaginiitti, balaniitti ja vastaavat genitaali-infektiot kuvastivat dapagliflotsiinin turvallisuusprofiilia. Genitaali-infektiohaittatapahtumia ilmoitettiin 3,0 %:lla tutkittavista saksagliptiinin, dapagliflotsiinin ja metformiinin yhdistelmää saaneiden ryhmässä, 0,9 %:lla tutkittavista saksagliptiinin ja metformiinin yhdistelmää saaneiden ryhmässä ja 5,9 %:lla tutkittavista dapagliflotsiinin ja metformiinin yhdistelmää saaneiden ryhmässä. Useimmat genitaali-infektioihin liittyvät haittatapahtumat ilmoitettiin naisilla (84 % tutkittavista, joilla ilmeni genitaali-infektio, oli naisia), ne olivat vaikeusasteeltaan lieviä tai keskivaikeita, ilmenivät vain kerran, ja useimmat potilaat jatkoivat hoitoa.
Dapagliflotsiinin käytön yhteydessä on raportoitu esiintyvän fimoosia / hankinnaista fimoosia samanaikaisesti sukupuolielinten infektioiden kanssa, ja joissakin tapauksissa tarvittiin ympärileikkaus.
Hypoglykemia
Yhdistetyssä turvallisuusanalyysissä hypoglykemian kokonaisilmaantuvuus (kaikki ilmoitetut tapahtumat, mukaan lukien ne, joissa keskuslaboratoriossa mitattu paastoglukoosiarvo oli ≤ 3,9 mmol/l) oli 2,0 % saksagliptiinia (5 mg), dapagliflotsiinia (10 mg) sekä metformiinia (yhdistelmähoito) saaneilla tutkittavilla, 0,6 % saksagliptiinia ja metformiinia saaneiden ryhmässä ja 2,3 % dapagliflotsiinia ja metformiinia saaneiden ryhmässä.
24 viikkoa kestäneessä tutkimuksessa, jossa saksagliptiinin, dapagliflotsiinin ja metformiinin yhdistelmää joko sulfonyyliurean kanssa tai ilman sitä verrattiin insuliinin ja metformiinin yhdistelmään joko sulfonyyliurean kanssa tai ilman sitä, hypoglykemian kokonaisilmaantuvuus potilailla, jotka eivät saaneet taustahoitona sulfonyyliureaa, oli 12,7 % yhdistelmähoitoa saaneilla potilailla ja 33,1 % insuliinia saaneilla potilailla. Kahdesta 52 viikkoa kestäneestä tutkimuksesta, joissa yhdistelmähoitoa verrattiin glimepiridiin (sulfonyyliurea), hypoglykemian kokonaisilmaantuvuus oli ensimmäisessä tutkimuksessa 4,2 % yhdistelmähoitoa saaneilla, 27,9 % glimepiridia ja metformiinia saaneilla ja 2,9 % dapagliflotsiinia ja metformiinia saaneilla. Toisessa tutkimuksessa kokonaisilmaantuvuus oli 18,5 % yhdistelmähoitoa saaneilla ja 43,1 % glimepiridia ja metformiinia saaneilla.
Nestehukka
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Nestehukkaan viittaavia tapahtumia (matala verenpaine, dehydraatio ja hypovolemia) ilmoitettiin kahdella (0,4 %) tutkittavista, jotka saivat saksagliptiinin, dapagliflotsiinin ja metformiinin yhdistelmää [vakava haittatapahtuma (pyörtyminen) ja haittatapahtuma (vähentynyt virtsaneritys)], ja kolmella (0,9 %) tutkittavista, jotka saivat dapagliflotsiinin ja metformiinin yhdistelmää [kaksi haittatapahtumaa (pyörtyminen) ja yksi matalan verenpaineen tapaus].
Heikentyneeseen munuaisten toimintaan liittyvät tapahtumat
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Yhdistetyssä turvallisuusanalyysissä heikentyneeseen munuaisten toimintaan liittyvien haittatapahtumien ilmaantuvuus oli 2,0 % saksagliptiinin, dapagliflotsiinin ja metformiinin yhdistelmää saaneilla, 1,8 % saksagliptiinin ja metformiinin yhdistelmää saaneilla ja 0,6 % dapagliflotsiinin ja metformiinin yhdistelmää saaneilla tutkittavilla. Tutkittavilla, joilla oli munuaisten heikentyneeseen toimintaan liittyviä haittatapahtumia, todettiin pienemmät keskimääräiset eGFR-arvot lähtötilanteessa (61,8 ml/min / 1,73 m2) koko potilasjoukkoon verrattuna (93,6 ml/min / 1,73 m2). Suurin osa tapahtumista katsottiin vaikeusasteeltaan ei-vakaviksi, lieviksi tai keskivaikeiksi ja ne korjaantuivat. Keskimääräisen eGFR:n muutos lähtötilanteeseen nähden oli viikolla 24 ‑1,17 ml/min / 1,73 m2 saksagliptiinin, dapagliflotsiinin ja metformiinin yhdistelmää saaneiden ryhmässä, ‑0,46 ml/min / 1,73 m2 saksagliptiinin ja metformiinin yhdistelmää saaneiden ryhmässä ja 0,81 ml/min / 1,73 m2 dapagliflotsiinin ja metformiinin yhdistelmää saaneiden ryhmässä.
Dapagliflotsiini: Kreatiniinipitoisuuden suurenemiseen liittyviä haittavaikutuksia on ilmoitettu, kun dapagliflotsiinia on annettu yksittäisenä komponenttina. Kreatiniiniarvojen suureneminen oli yleensä tilapäistä jatkuvan hoidon aikana tai palautuvaa hoidon lopettamisen jälkeen.
Välilihan nekrotisoiva faskiitti (Fournier’n gangreeni)
Fournier’n gangreenin tapauksia on ilmoitettu myyntiluvan myöntämisen jälkeen potilailla, jotka käyttävät SGLT2:n estäjiä, dapagliflotsiini mukaan lukien (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Dapagliflotsiinilla tehdyssä kardiovaskulaarisia tuloksia koskevassa tutkimuksessa (DECLARE), johon osallistui 17 160 potilasta, joilla oli tyypin 2 diabetes, ja jossa altistusajan mediaani oli 48 kuukautta, ilmoitettiin yhteensä kuusi Fournier’n gangreenin tapausta, yksi dapagliflotsiiniryhmässä ja viisi lumelääkeryhmässä.
Diabeettinen ketoasidoosi
Dapagliflotsiinilla tehdyssä kardiovaskulaarisia tuloksia koskevassa tutkimuksessa (DECLARE), jossa altistusajan mediaani oli 48 kuukautta, diabeettisen ketoasidoosin tapahtumia ilmoitettiin 27 potilaalla dapagliflotsiinia (10 mg) saaneiden ryhmässä ja 12 potilaalla lumelääkeryhmässä. Tapahtumat jakautuivat tasaisesti koko tutkimusjaksolle. 27:stä dapagliflotsiiniryhmän potilaasta, joilla ilmeni diabeettisen ketoasidoosin tapahtumia, 22 sai tapahtuman ilmetessä samanaikaisesti insuliinia. Diabeettisen ketoasidoosin taustalla olevat syyt olivat sellaisia kuin tyypin 2 diabetesta sairastavien potilaiden populaatiossa on odotettavissa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Virtsatieinfektiot
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Yhdistetyssä turvallisuutta koskevassa analyysissä virtsatieinfektioita ilmeni yhtä usein kolmessa hoitoryhmässä: 5,7 %:lla potilaista saksagliptiinia, dapagliflotsiinia ja metformiinia saaneiden ryhmässä, 7,4 %:lla potilaista saksagliptiinia ja metformiinia saaneiden ryhmässä ja 5,6 %:lla potilaista dapagliflotsiinia ja metformiinia saaneiden ryhmässä. Yhdellä potilaalla saksagliptiinia, dapagliflotsiinia ja metformiinia saaneiden ryhmässä ilmeni vakava haittatapahtuma, pyelonefriitti, ja hän keskeytti hoidon. Useimmat virtsatieinfektioihin liittyvät haittatapahtumat ilmoitettiin naisilla (81 % tutkittavista, joilla ilmeni virtsatieinfektio, oli naisia), ne olivat vaikeusasteeltaan lieviä tai keskivaikeita, ilmenivät vain kerran ja useimmat potilaat jatkoivat hoitoa.
Laboratoriolöydökset
Lymfosyyttimäärän väheneminen
Saksagliptiini: Viiden lumekontrolloidun tutkimuksen yhdistetyissä tiedoissa havaittiin lymfosyyttien absoluuttisen määrän pientä vähenemistä, suunnilleen 100 solua/mikrolitra lumelääkkeeseen nähden. Absoluuttisen lymfosyyttimäärän keskiarvo pysyi vakaana, kun tutkimuslääkettä annettiin päivittäin korkeintaan 102 viikon ajan. Tähän absoluuttisen lymfosyyttimäärän keskiarvon pienenemiseen ei liittynyt kliinisesti merkityksellisiä haittavaikutuksia.
Lipidit
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Kolmen vaiheen 3 tutkimuksen saksagliptiinin, dapagliflotsiinin ja metformiinin yhdistelmän hoitohaaroista saadut tiedot osoittivat, että kokonaiskolesteroli- (0,4–3,8 %), LDL-kolesteroli- (2,1–6,9 %) ja HDL-kolesteroliarvoilla (2,3–5,4 %) on taipumus keskimääräiseen prosentuaaliseen suurenemiseen lähtötilanteeseen nähden (pyöristys lähimpään prosentin kymmenesosaan) ja triglyseridiarvoilla (‑3,0 – ‑10,8 %) on taipumus keskimääräiseen prosentuaaliseen pienenemiseen lähtötilanteeseen nähden.
Erityisryhmät
Iäkkäät
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Kolmen kliinisen tutkimuksen yhdistettyihin turvallisuutta koskeviin tietoihin sisällytetyistä 1 169 tutkittavasta 1 007 tutkittavaa (86,1 %) oli alle 65‑vuotiaita, 162 tutkittavaa (13,9 %) oli vähintään 65‑vuotiaita ja 9 tutkittavaa (0,8 %) oli vähintään 75‑vuotiaita. Vähintään 65‑vuotiailla yleisimmin ilmoitetut haittatapahtumat olivat yleensä vastaavanlaisia kuin alle 65‑vuotiailla. Vähintään 65-vuotiaiden potilaiden hoidosta on vähän ja vähintään 75‑vuotiaiden potilaiden hoidosta erittäin vähän kokemusta.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Saksagliptiinin ja dapagliflotsiininkiinteäannoksisen yhdistelmän yliannostuksesta ei ole saatavilla tietoja. Yliannostustilanteessa on aloitettava asianmukainen tukihoito potilaan kliinisen tilan mukaan.
Saksagliptiini
Saksagliptiini ei vaikuttanut kliinisesti merkityksellisesti QTc-aikaan tai sykkeeseen, kun saksagliptiinia annettiin suun kautta enintään 400 mg vuorokaudessa kahden viikon ajan (80‑kertainen annos verrattuna suositeltuun annokseen). Saksagliptiini ja sen päämetaboliitti voidaan poistaa hemodialyysilla (23 % annoksesta neljän tunnin aikana).
Dapagliflotsiini
Dapagliflotsiinin ei osoitettu aiheuttavan toksisia vaikutuksia terveille tutkittaville, kun dapagliflotsiinia annettiin suun kautta enintään 500 mg:n kerta-annoksina (50‑kertainen annos verrattuna ihmisille suositeltuun enimmäisannokseen). Aika, jolloin tutkittavilla voitiin todeta glukoosia virtsassa, riippui annoksesta (vähintään 5 päivää 500 mg:n annoksella). Nestehukkaa, hypotensiota tai elektrolyyttitasapainon häiriöitä ei ilmoitettu, eikä kliinisesti merkityksellistä vaikutusta QTc-aikaan todettu. Hypoglykemian ilmaantuvuus oli vastaavanlainen kuin lumelääkkeellä. Kliinisissä tutkimuksissa, joissa terveille tutkittaville ja tyypin 2 diabetesta sairastaville tutkittaville annettiin kerran vuorokaudessa enintään 100 mg:n annoksia (10‑kertainen annos verrattuna ihmisille suositeltuun enimmäisannokseen) kahden viikon ajan, hypoglykemian ilmaantuvuus oli hieman suurempi kuin lumelääkkeellä eikä ilmaantuvuus ollut annoksesta riippuvaista. Haittatapahtumien, mukaan lukien nestehukan ja hypotension, määrät olivat vastaavanlaisia kuin lumelääkkeellä, eikä laboratorioarvoissa, seerumin elektrolyyttipitoisuudet ja munuaisten toimintaa kuvaavat merkkiaineet mukaan lukien, todettu kliinisesti merkityksellisiä annoksesta riippuvaisia muutoksia. Dapagliflotsiinin poistamista hemodialyysilla ei ole tutkittu.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Diabeteslääkkeet, Oraalisten veren glukoosipitoisuutta pienentävien lääkkeiden yhdistelmävalmisteet, ATC-koodi: A10BD21.
Vaikutusmekanismi
Tämä lääkevalmiste sisältää saksagliptiinia ja dapagliflotsiinia, joilla on toisiaan täydentävät vaikutusmekanismit, jotka parantavat glukoositasapainoa. Saksagliptiini on dipeptidyylipeptidaasi 4:n (DPP‑4) selektiivinen estäjä, minkä ansiosta se tehostaa glukoosivälitteistä insuliinineritystä (inkretiinivaikutus). Dapagliflotsiini on natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2) selektiivinen estäjä, joka estää glukoosin takaisinimeytymistä munuaisissa insuliinista riippumatta. Plasman glukoosipitoisuus säätelee molempien lääkevalmisteiden vaikutuksia.
Saksagliptiini
Saksagliptiini on erittäin voimakas (Ki: 1,3 nM), selektiivinen, reversiibeli ja kilpaileva DPP‑4:n estäjä. DPP‑4-entsyymi vastaa inkretiinihormonien pilkkomisesta. Se lisää insuliinineritystä glukoosista riippuvaisella tavalla pienentäen siten veren glukoosipitoisuuksia paaston ja aterian jälkeen.
Dapagliflotsiini
Dapagliflotsiini on erittäin voimakas (Ki: 0,55 nM), selektiivinen ja reversiibeli natriumin- ja glukoosinkuljettajaproteiini 2:n (SGLT2) estäjä.
Dapagliflotsiini estää SGLT2:ta, mikä vähentää glukoosin takaisinimeytymistä glomerulussuodoksesta proksimaaliseen munuaistiehyeen ja samanaikaisesti vähentää natriumin takaisinimeytymistä, mikä johtaa glukoosin erittymiseen virtsaan ja osmoottiseen diureesiin. Siten dapagliflotsiini lisää natriumin kulkeutumista distaaliseen tiehyeen, mikä lisää tubuloglomerulaarista palautetta ja pienentää intraglomerulaarista painetta. Tämä yhdessä osmoottisen diureesin kanssa johtaa tilavuusylikuormituksen vähenemiseen, alentaa verenpainetta ja pienentää sydämen esikuormitusta ja jälkikuormitusta, millä saattaa olla hyödyllisiä vaikutuksia sydämen remodellaatioon ja diastoliseen toimintaan ja mikä saattaa ylläpitää munuaisten toimintaa. Dapagliflotsiinin sydämeen ja munuaisiin liittyvät hyödyt eivät perustu pelkästään verensokeria alentavaan vaikutukseen. Muita vaikutuksia ovat hematokriitin suureneminen ja painon lasku.
Dapagliflotsiini parantaa sekä plasman paastoglukoosiarvoja että aterian jälkeisiä glukoosiarvoja vähentämällä glukoosin takaisinimeytymistä munuaisissa, mikä johtaa glukoosin erittymiseen virtsaan. Tämä glukoosin erittyminen (glukosuurinen vaikutus) havaitaan ensimmäisen annoksen jälkeen, ja se jatkuu 24 tunnin annosvälien aikana ja kestää koko hoidon ajan. Munuaisten tällä mekanismilla poistaman glukoosin määrä riippuu veren glukoosipitoisuudesta ja glomerulusten suodatusnopeudesta. Siksi henkilöillä, joilla veren glukoosipitoisuus on normaali, dapagliflotsiinin taipumus aiheuttaa hypoglykemiaa on pieni. Dapagliflotsiini ei heikennä normaalia hypoglykemian aiheuttamaa endogeenista glukoosin tuotantoa. Dapagliflotsiini toimii insuliinin erityksestä ja toiminnasta riippumatta. Beetasolujen toiminnan on havaittu parantuneen homeostaasimallimäärityksessä (HOMA beta cell) dapagliflotsiinilla tehdyissä kliinisissä tutkimuksissa.
SGLT2 ilmentyy selektiivisesti munuaisissa. Dapagliflotsiini ei estä muita glukoosin kuljettajaproteiineja, jotka ovat tärkeitä glukoosin kuljettamisessa perifeerisiin kudoksiin. Se on > 1 400 kertaa selektiivisempi SGLT2-kuljettajaproteiinille kuin SGLT1-kuljettajaproteiinille, joka on suolessa tärkein glukoosin imeytymisestä vastaava kuljettajaproteiini.
Farmakodynaamiset vaikutukset
Saksagliptiinin antaminen tyypin 2 diabetesta sairastaville potilaille esti DPP‑4-entsyymin aktiivisuutta 24 tunnin ajan. Saksagliptiini estää plasman DPP‑4-aktiivisuutta vähintään 24 tunnin ajan saksagliptiinin suun kautta ottamisen jälkeen suuren voimakkuuden, suuren affiniteetin ja pitkittyneen aktiiviseen kohtaan sitoutumisen ansiosta. Glukoosin nielemisen jälkeen tämä DPP‑4:n esto johti glukagoninkaltaisen peptidi 1:n (GLP‑1) ja glukoosiriippuvaisen insulinotrooppisen polypeptidin (GIP) 2–3‑kertaiseen pitoisuuksien suurenemiseen verenkierrossa. Lisäksi glukagonipitoisuus pieneni ja beetasolujen reaktioherkkyys parani, minkä seurauksena insuliinin ja C‑peptidin pitoisuudet suurenivat. Haiman beetasolujen insuliininerityksen suurenemiseen ja haiman alfasolujen glukagoninerityksen pienenemiseen liittyi pienempi paastoglukoosin pitoisuus ja vähäisempi glukoosipitoisuuden vaihtelu glukoosin nielemisen tai aterian jälkeen.
Dapagliflotsiinin glukosuurinen vaikutus havaitaan ensimmäisen annoksen jälkeen ja se jatkuu 24 tunnin annosvälien aikana ja kestää koko hoidon ajan. Virtsaan erittyvän glukoosin määrän havaittiin lisääntyneen terveillä tutkittavilla ja tyypin 2 diabetesta sairastavilla tutkittavilla dapagliflotsiinin antamisen jälkeen. Dapagliflotsiinin 10 mg:n vuorokausiannoksella virtsaan erittyi noin 70 grammaa glukoosia vuorokaudessa (mikä vastaa 280 kilokaloria vuorokaudessa) tyypin 2 diabetesta sairastavilla tutkittavilla 12 viikon ajan. Jatkuvaa glukoosin erittymistä havaittiin tyypin 2 diabetesta sairastavilla tutkittavilla, joille annettiin 10 mg dapagliflotsiinia vuorokaudessa 2 vuoden ajan. Myös virtsahapon erittyminen virtsaan lisääntyi hetkellisesti (3–7 päivän ajaksi), mitä seurasi pysyvä lasku seerumin virtsahappopitoisuudessa. Viikolla 24 seerumin virtsahappopitoisuuden väheneminen vaihteli ‑48,3 ja ‑18,3 mikromoolin/l (‑0,87 ja ‑0,33 mg/dl) välillä.
Kliininen teho ja turvallisuus
Saksagliptiinin (5 mg) ja dapagliflotsiinin (10 mg) kiinteäannoksisen yhdistelmän turvallisuutta ja tehoa arvioitiin kolmessa vaiheen 3 satunnaistetussa, kaksoissokkoutetussa, aktiivi/lumekontrolloidussa kliinisessä tutkimuksessa, joihin osallistui 1 169 aikuista tutkittavaa, joilla oli tyypin 2 diabetes. Yhdessä 24 viikkoa kestäneessä tutkimuksessa arvioitiin saksagliptiinia ja dapagliflotsiinia, joita käytettiin samanaikaisesti metformiinin lisälääkkeinä. Kaksi lisälääketutkimusta, joissa käytettiin joko dapagliflotsiinia saksagliptiinin ja metformiinin lisälääkkeenä tai saksagliptiinia dapagliflotsiinin ja metformiinin lisälääkkeenä, toteutettiin myös 24 viikon aikana ja sen jälkeen 28 viikon pituisena jatkohoitojaksona. Saksagliptiinin ja dapagliflotsiinin yhdistelmäkäytön turvallisuusprofiili vastasi näissä tutkimuksissa viikkoon 52 asti yksittäisillä komponenteilla havaittuja haittavaikutuksia.
Glukoositasapaino
Saksagliptiinin ja dapagliflotsiinin samanaikainen käyttö potilaille, joilla ei ole saavutettu riittävää hoitotasapainoa metformiinihoidolla
Tähän 24 viikon pituiseen satunnaistettuun, kaksoissokkoutettuun, aktiiviverrokkikontrolloituun paremmuustutkimukseen (superiority trial) osallistui kaikkiaan 534 aikuispotilasta, joilla oli tyypin 2 diabetes ja joilla ei ollut saavutettu riittävää glukoositasapainoa pelkällä metformiinilla (HbA1c ≥ 8 % ja ≤ 12 %). Tutkimuksessa verrattiin saksagliptiinin ja dapagliflotsiinin yhdistelmää samanaikaisesti käytettävänä metformiinin lisälääkkeenä saksagliptiiniin (DPP‑4:n estäjä) tai dapagliflotsiiniin (SGLT2:n estäjä) metformiinin lisälääkkeinä. Potilaat satunnaistettiin johonkin kolmesta kaksoissokkoutetusta hoitoryhmästä saamaan 5 mg saksagliptiinia ja 10 mg dapagliflotsiinia metformiinin lisälääkkeinä, 5 mg saksagliptiinia ja lumelääkettä metformiinin lisälääkkeinä tai 10 mg dapagliflotsiinia ja lumelääkettä metformiinin lisälääkkeinä.
24 viikon kohdalla HbA1c-arvot olivat pienentyneet saksagliptiinia ja dapagliflotsiinia saaneiden ryhmässä merkitsevästi enemmän kuin saksagliptiinia saaneiden tai dapagliflotsiinia saaneiden ryhmissä (ks. taulukko 2).
Taulukko 2. Viikon 24 HbA1c-tulokset aktiivikontrolloidusta tutkimuksesta, jossa verrattiin saksagliptiinin ja dapagliflotsiinin yhdistelmää samanaikaisesti käytettynä metformiinin lisälääkkeenä joko saksagliptiiniin tai dapagliflotsiiniin metformiinin lisälääkkeinä
| Tehoparametri | Saksagliptiini 5 mg + dapagliflotsiini 10 mg + metformiiniN = 1792 | Saksagliptiini 5 mg + metformiini N = 1762 | Dapagliflotsiini 10 mg + metformiini N = 1792 |
| HbA1c (%) viikolla 241 | |||
| Lähtötilanne (keskiarvo) | 8,93 | 9,03 | 8,87 |
| Muutos lähtötilanteesta (korjattu keskiarvo3) (95 %:n luottamusväli) | ‑1,47 (‑1,62, ‑1,31) | ‑0,88 (‑1,03, ‑0,72) | ‑1,20 (‑1,35, ‑1,04) |
| Ero saksagliptiiniin + metformiiniin nähden (korjattu keskiarvo3) (95 %:n luottamusväli) | ‑0,594 (‑0,81, ‑0,37) | - | - |
| Ero dapagliflotsiiniin + metformiiniin nähden (korjattu keskiarvo3) (95 %:n luottamusväli) | ‑0,275 (‑0,48, ‑0,05) | - | - |
1. LRM = Toistetut pitkittäismittaukset (käyttämällä ennen hätälääkityksen käyttöä saatuja arvoja).
2. Satunnaistetut lääkettä saaneet potilaat.
3. Pienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon.
4. p-arvo < 0,0001.
5. p-arvo = 0,0166.
Suurimmalla osalla tämän tutkimuksen potilaista lähtötilanteen HbA1c oli yli 8 % (ks. taulukko 3). Saksagliptiinin ja dapagliflotsiinin yhdistelmä metformiinin lisälääkkeenä pienensi HbA1c-arvoja johdonmukaisesti enemmän kuin saksagliptiini tai dapagliflotsiini yksinään metformiinin lisälääkkeinä lähtötilanteen HbA1c-arvoista riippumatta. Erillisessä etukäteen määritellyn alaryhmän analyysissä HbA1c-arvot pienenivät lähtötilanteeseen nähden yleensä keskimäärin enemmän, jos potilaan HbA1c-arvo oli lähtötilanteessa suurempi.
Taulukko 3. Satunnaistettujen tutkittavien HbA1c-alaryhmäanalyysi lähtötilanteen HbA1c-arvojen mukaan viikolla 24
| Lääkehoidot | Korjattu keskimääräinen muutos lähtötilanteesta lähtötilanteen HbA1c-arvojen mukaan | ||
| < 8,0 % | ≥ 8 %, < 9,0 % | ≥ 9,0 % | |
Saksagliptiini + dapagliflotsiini + metformiini Korjattu keskimääräinen muutos lähtötilanteesta (95 %:n luottamusväli) | ‑0,80 (n = 37) (‑1,12, ‑0,47) | ‑1,17 (n = 56) (‑1,44, ‑0,90) | ‑2,03 (n = 65) (‑2,27, ‑1,80) |
Saksagliptiini + metformiini Korjattu keskimääräinen muutos lähtötilanteesta (95 %:n luottamusväli) | ‑0,69 (n = 29) (‑1,06, ‑0,33) | ‑0,51 (n = 51) (‑0,78, ‑0,25) | ‑1,32 (n = 63) (‑1,56, ‑1,09) |
Dapagliflotsiini + metformiini Korjattu keskimääräinen muutos lähtötilanteesta (95 %:n luottamusväli) | ‑0,45 (n = 37) (‑0,77, ‑0,13) | ‑0,84 (n = 52) (‑1,11, ‑0,57) | ‑1,87 (n = 62) (‑2,11, ‑1,63) |
n = niiden tutkittavien määrä, joilta oli saatavilla sekä lähtötilanteen että viikon 24 arvot.
Niiden potilaiden osuus, jotka saavuttivat HbA 1c -arvon < 7 %
41,4 % (95 %:n luottamusväli: 34,5, 48,2) yhdistelmähoitoa saksagliptiinilla ja dapagliflotsiinilla saaneista potilaista saavutti alle 7 %:n HbA1c-arvot, kun saksagliptiiniryhmässä näiden potilaiden osuus oli 18,3 % (95 %:n luottamusväli: 13,0, 23,5) ja dapagliflotsiiniryhmässä 22,2 % (95 %:n luottamusväli: 16,1, 28,3).
Dapagliflotsiinin käyttö lisälääkkeenä potilaille, joilla ei ole saavutettu riittävää hoitotasapainoa saksagliptiinilla ja metformiinilla
24 viikon pituisessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa verrattiin dapagliflotsiinin 10 mg:n annoksen sekventiaalista lisäämistä saksagliptiinin (5 mg) ja metformiinin yhdistelmään ja lumelääkkeen lisäämistä saksagliptiinin (5 mg) (DPP‑4:n estäjä) ja metformiinin yhdistelmään tyypin 2 diabetesta sairastavilla potilailla, joilla ei ollut saavutettu riittävää glukoositasapainoa (HbA1c ≥ 7 % ja ≤ 10,5 %). 320 tutkittavaa satunnaistettiin tasan joko hoitoryhmään, jossa tutkittaville annettiin dapagliflotsiinia saksagliptiinin ja metformiinin lisälääkkeenä, tai hoitoryhmään, jossa tutkittaville annettiin lumelääkettä, saksagliptiinia ja metformiinia. Potilaat, jotka jatkoivat 24 viikon tutkimusjakson loppuun, saivat siirtyä kontrolloituun 28 viikon mittaiseen pitkäaikaisjatkotutkimukseen (52 viikkoa).
Viikon 24 kohdalla ryhmässä, jossa tutkittaville annettiin dapagliflotsiinia sekventiaalisesti saksagliptiinin ja metformiinin lisälääkkeenä, HbA1c-arvot pienenivät tilastollisesti merkitsevästi (p-arvo < 0,0001) enemmän kuin ryhmässä, jossa tutkittaville annettiin lumelääkettä sekventiaalisesti saksagliptiinin ja metformiinin lisälääkkeenä (ks. taulukko 4). Viikolla 24 havaittu vaikutus HbA1c-arvoon oli säilynyt viikolle 52 asti.
Saksagliptiinin käyttö lisälääkkeenä potilaille, joilla ei ole saavutettu riittävää hoitotasapainoa dapagliflotsiinilla ja metformiinilla
24 viikon pituisessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa saksagliptiinin 5 mg:n annoksen sekventiaalista lisäämistä dapagliflotsiinin (10 mg) ja metformiinin yhdistelmään verrattiin lumelääkkeen lisäämiseen dapagliflotsiinin (10 mg) ja metformiinin yhdistelmään tyypin 2 diabetesta sairastavilla potilailla, joilla ei ollut saavutettu riittävää glukoositasapainoa (HbA1c ≥ 7 % ja ≤ 10,5 %) pelkästään metformiinilla ja dapagliflotsiinilla. 153 potilasta satunnaistettiin hoitoryhmään, jossa saksagliptiinia annettiin dapagliflotsiinin ja metformiinin lisälääkkeenä, ja 162 potilasta satunnaistettiin hoitoryhmään, jossa lumelääkettä annettiin dapagliflotsiinin ja metformiinin lisälääkkeenä. Potilaat, jotka jatkoivat 24 viikon tutkimusjakson loppuun, saivat siirtyä kontrolloituun 28 viikon mittaiseen pitkäaikaisjatkotutkimukseen (52 viikkoa). Dapagliflotsiinin ja metformiinin lisälääkkeenä käytetyn saksagliptiinin turvallisuusprofiili oli pitkäaikaishoitojakson aikana yhdenmukainen turvallisuusprofiilien kanssa, jotka oli aiemmin todettu samanaikaista hoitoa arvioineessa kliinisessä tutkimuksessa ja tämän tutkimuksen 24 viikon mittaisen hoitojakson aikana.
Viikon 24 kohdalla ryhmässä, jossa tutkittaville annettiin saksagliptiinia sekventiaalisesti dapagliflotsiinin ja metformiinin lisälääkkeenä, HbA1c-arvot pienenivät tilastollisesti merkitsevästi (p-arvo < 0,0001) enemmän kuin ryhmässä, jossa tutkittaville annettiin lumelääkettä sekventiaalisesti dapagliflotsiinin ja metformiinin lisälääkkeenä (ks. taulukko 4). Viikolla 24 havaittu vaikutus HbA1c-arvoon säilyi viikkoon 52 asti.
Taulukko 4. HbA1c-arvon muutos lähtötilanteesta viikolla 24, pois lukien tiedot satunnaistetuista tutkittavista hätälääkityksen käyttämisen jälkeen – tutkimukset MB102129 ja CV181168
| Tehoparametri | Sekventiaalisesti annettua lisälääkitystä koskevat kliiniset tutkimukset | |||||
| Tutkimus MB102129 | Tutkimus CV181168 | |||||
Dapagliflotsiini 10 mg saksagliptiinin 5 mg + metformiinin lisälääkkeenä (N = 160)† | Lumelääke + saksagliptiini 5 mg + metformiini (N = 160)† | Saksagliptiini 5 mg dapagliflotsiinin 10 mg + metformiinin lisälääkkeenä (N = 153)† | Lumelääke + dapagliflotsiini 10 mg + metformiini (N = 162) † | |||
| HbA1c (%) viikolla 24* | ||||||
| Lähtötilanne (keskiarvo) | 8,24 | 8,16 | 7,95 | 7,85 | ||
| Muutos lähtötilanteesta (korjattu keskiarvo‡) (95 %:n luottamusväli) | ‑0,82 (‑0,96, 0,69) | ‑0,10 (‑0,24, 0,04) | ‑0,51 (‑0,63, ‑0,39) | ‑0,16 (‑0,28, ‑0,04) | ||
Ero vaikutuksessa HbA1c-arvoon Korjattu keskiarvo (95 %:n luottamusväli) p-arvo | ‑0,72 (‑0,91, ‑0,53) < 0,0001 | ‑0,35 (‑0,52, ‑0,18) < 0,0001 | ||||
* LRM = Toistetut pitkittäismittaukset (käyttämällä ennen hätälääkityksen käyttöä saatuja arvoja).
† N on niiden satunnaistettujen lääkettä saaneiden potilaiden määrä.
‡ Pienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon.
Niiden potilaiden osuus, jotka saavuttivat HbA 1c -arvon < 7 %
Niiden potilaiden osuus, jotka saavuttivat HbA1c-arvon < 7,0 % viikolla 24 dapagliflotsiinia saksagliptiinin ja metformiinin lisälääkkeenä koskevassa tutkimuksessa, oli suurempi dapagliflotsiinia, saksagliptiinia ja metformiinia saaneiden ryhmässä (38,0 %, 95 %:n luottamusväli: 30,9, 45,1) kuin lumelääkettä, saksagliptiinia ja metformiinia saaneiden ryhmässä (12,4 %, 95 %:n luottamusväli: 7,0, 17,9). Viikolla 24 havaittu vaikutus HbA1c-arvoon oli säilynyt viikolle 52 asti. Niiden potilaiden osuus, jotka saavuttivat HbA1c-arvon < 7 % viikolla 24 saksagliptiinia dapagliflotsiinin ja metformiinin lisälääkkeenä koskevassa tutkimuksessa, oli suurempi saksagliptiinia, dapagliflotsiinia ja metformiinia saaneiden ryhmässä (35,3 %, 95 %:n luottamusväli: 28,2, 42,2) kuin lumelääkettä, dapagliflotsiinia ja metformiinia saaneiden ryhmässä (23,1 %, 95 %:n luottamusväli: 16,9, 29,3). Viikolla 24 havaittu vaikutus HbA1c-arvoon oli säilynyt viikolle 52 asti.
Paino
Potilaan painon korjattu keskimääräinen muutos lähtötilanteesta viikolla 24 (pois lukien hätälääkityksen käytön jälkeen saadut tulokset) oli samanaikaista antoa koskeneessa tutkimuksessa ‑2,05 kg (95 %:n luottamusväli: ‑2,52, ‑1,58) saksagliptiinia (5 mg), dapagliflotsiinia (10 mg) ja metformiinia saaneiden ryhmässä ja ‑2,39 kg (95 %:n luottamusväli: ‑2,87, ‑1,91) dapagliflotsiinia (10 mg) ja metformiinia saaneiden ryhmässä, kun taas saksagliptiinia (5 mg) ja metformiinia saaneiden ryhmässä ei todettu painon muutosta (0,00 kg, 95 luottamusväli: ‑0,48, 0,49).
Verenpaine
Hoito saksagliptiinin ja dapagliflotsiinin kiinteäannoksisella yhdistelmällä muutti systolista verenpainetta lähtötilanteesta ‑1,3 mmHg – ‑2,2 mmHg ja diastolista verenpainetta ‑0,5 mmHg – ‑1,2 mmHg, minkä aiheutti yhdistelmän lievä diureettinen vaikutus. Kohtalaiset verenpainetta alentavat vaikutukset säilyivät yhdenmukaisina ajan mittaan, ja viikolla 24 kaikissa hoitoryhmissä oli yhtä paljon tutkittavia, joiden systolinen verenpaine oli < 130 mmHg tai diastolinen verenpaine < 80 mmHg.
Sydän- ja verisuoniturvallisuus
Kolmen tutkimuksen yhdistetyissä tiedoissa sydän- ja verisuonitapahtumia, jotka arvioitiin ja vahvistettiin sydän- ja verisuonitapahtumiksi, ilmoitettiin yhteensä 1,0 %:lla tutkittavista saksagliptiinia, dapagliflotsiinia ja metformiinia saaneiden ryhmässä, 0,6 %:lla tutkittavista saksagliptiinia ja metformiinia saaneiden ryhmässä ja 0,9 %:lla tutkittavista dapagliflotsiinia ja metformiinia saaneiden ryhmässä.
Kardiovaskulaarisia hoitotuloksia koskevat tutkimukset tyypin 2 diabetesta sairastavilla potilailla
Kardiovaskulaarisia hoitotuloksia koskevia tutkimuksia ei ole tehty saksagliptiinin ja dapagliflotsiinin yhdistelmän arvioimiseksi.
SAVOR-tutkimus (Saxagliptin Assessment of Vascular Outcome Recorded in Patients with Diabetes Mellitus - Thrombolysis in Myocardial Infarction)
SAVOR-tutkimuksessa arvioitiin kardiovaskulaarisia hoitotuloksia 16 492 potilaalla, joiden HbA1c oli ≥ 6,5 % ja < 12 % (12 959 tutkittavalla oli todettu sydän- ja verisuonitauti; 3 533 tutkittavalla oli ainoastaan useita riskitekijöitä). Potilaat satunnaistettiin saamaan saksagliptiinia (n = 8 280) tai lumelääkettä (n = 8 212), jotka lisättiin HbA1c:n ja sydän- ja verisuonitaudin riskitekijöiden paikallisten hoitokäytäntöjen mukaiseen lääkitykseen. Tutkimuspopulaatioon kuuluivat ≥ 65-vuotiaat (n = 8 561) ja ≥ 75-vuotiaat (n = 2 330) ja tutkittavilla oli normaalisti toimivat munuaiset tai lievä munuaisten vajaatoiminta (n = 13 916) tai kohtalainen (n = 2 240) tai vaikea (n = 336) munuaisten vajaatoiminta.
Ensisijainen turvallisuutta (samanveroisuutta) ja tehoa (paremmuutta) mittaava päätemuuttuja oli yhdistetty päätemuuttuja, jonka muodosti aika ensimmäiseen MACE-tapahtumaan (merkittävä kardiovaskulaarinen haittatapahtuma, major adverse CV event). Näitä tapahtumia olivat: sydän- ja verisuonitautikuolema, kuolemaan johtamaton sydäninfarkti ja kuolemaan johtamaton iskeeminen aivohalvaus.
Keskimäärin kahden vuoden seurannan jälkeen tutkimus saavutti ensisijaisen turvallisuutta mittaavan päätemuuttujansa osoittamalla, että käytössä olevaan taustahoitoon lisätty saksagliptiini ei lisännyt sydän- ja verisuonitaudin riskiä tyypin 2 diabetesta sairastavilla potilailla lumelääkkeeseen verrattuna.
Hyötyä ei havaittu MACE-tapahtumien tai kaikki kuolemansyyt käsittävän kuolleisuuden suhteen.
Yhtä toissijaisen yhdistelmäpäätemuuttujan osatekijää, sydämen vajaatoiminnasta johtuvia sairaalajaksoja, oli enemmän saksagliptiiniryhmässä (3,5 %) kuin lumeryhmässä (2,8 %) ja nimellinen tilastollinen merkitsevyys suosi lumelääkettä [riskisuhde = 1,27; 95 %:n luottamusväli 1,07, 1,51; p = 0,007]. Saksagliptiinihoitoon liittyviä kliinisesti merkittäviä lisääntynyttä suhteellista riskiä ennustavia tekijöitä ei voitu varmuudella tunnistaa. Tutkittavat, joilla oli määrätystä hoidosta riippumatta suurentunut riski joutua sairaalahoitoon sydämen vajaatoiminnan vuoksi, voitiin tunnistaa sydämen vajaatoiminnan tunnettujen riskitekijöiden avulla, kuten lähtötilanteessa todetun olemassa olevan sydämen vajaatoiminnan tai heikentyneen munuaisten toiminnan perusteella. Saksagliptiinia saaneilla tutkittavilla, joilla lähtötilanteessa tiedettiin olleen sydämen vajaatoiminta tai heikentynyt munuaisten toiminta, ei kuitenkaan ollut lumelääkkeeseen verrattuna lisääntynyttä riskiä ensisijaisten tai toissijaisten yhdistettyjen päätemuuttujien tai kaikki kuolemansyyt käsittävän kuolleisuuden suhteen.
Toista toissijaista päätemuuttujaa, kaikki kuolemansyyt käsittävää kuolleisuutta, ilmeni saksagliptiiniryhmässä 5,1 %:lla tutkittavista ja lumelääkeryhmässä 4,6 %:lla tutkittavista. Sydän- ja verisuonitautikuolemia oli molemmissa hoitoryhmissä saman verran. Muiden kuin sydän- ja verisuonitaudista johtuvien kuolemien lukumäärässä oli ero hoitoryhmien välillä ja näitä tapahtumia oli enemmän saksagliptiiniryhmässä (1,8 %) lumelääkeryhmään (1,4 %) verrattuna [riskisuhde = 1,27; 95 %:n luottamusväli 1,00, 1,62; p = 0,051].
DECLARE-tutkimus (Dapagliflozin Effect on Cardiovascular Events)
DECLARE-tutkimus oli kansainvälinen, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, kliininen monikeskustutkimus, jossa arvioitiin käytössä olevaan taustahoitoon lisätyn dapagliflotsiinin vaikutuksia sydän- ja verisuonituloksiin verrattuna lumelääkkeeseen. Kaikilla potilailla oli tyypin 2 diabetes ja joko vähintään kaksi muuta sydän- ja verisuonitaudin riskitekijää (ikä ≥ 55 vuotta miehillä tai ≥ 60 vuotta naisilla ja vähintään yksi seuraavista: dyslipidemia, verenpainetauti tai tupakointi) tai todettu sydän- ja verisuonitauti.
17 160 satunnaistetusta potilaasta 6 974:llä (40,6 %) oli todettu sydän- ja verisuonitauti ja 10 186:lla (59,4 %) ei ollut todettua sydän- ja verisuonitautia. 8 582 potilasta satunnaistettiin saamaan 10 mg dapagliflotsiinia ja 8 578 potilasta saamaan lumelääkettä, ja seurannan keston mediaani oli 4,2 vuotta.
Tutkittavien keskimääräinen ikä oli 63,9 vuotta, ja 37,4 % tutkittavista oli naisia. Yhteensä 22,4 %:lla oli ollut diabetes ≤ 5 vuotta, ja diabeteksen keskimääräinen kesto oli 11,9 vuotta. Keskimääräinen HbA1c-arvo oli 8,3 % ja keskimääräinen painoindeksi (BMI) oli 32,1 kg/m2.
Lähtötilanteessa 10,0 %:lla potilaista oli aiemmin todettu sydämen vajaatoiminta. Keskimääräinen eGFR‑arvo oli 85,2 ml/min/1,73 m2, 7,4 %:lla potilaista eGFR oli < 60 ml/min/1,73 m2, ja 30,3 %:lla potilaista oli mikroalbuminuria (virtsan albumiinin ja kreatiniinin suhde [U-AlbKrea] ≥30 – ≤ 300 mg/g) tai makroalbuminuria (virtsan albumiinin ja kreatiniinin suhde [U‑AlbKrea] > 300 mg/g).
Suurin osa potilaista (98 %) käytti lähtötilanteessa vähintään yhtä diabeteslääkettä, kuten metformiinia (82 %), insuliinia (41 %) tai sulfonyyliureaa (43 %)
Ensisijaiset päätemuuttujat olivat aika sydän- ja verisuonikuoleman, sydäninfarktin ja iskeemisen aivohalvauksen (MACE-tapahtumien) muodostaman yhdistelmäpäätemuuttujan ensimmäiseen tapahtumaan ja aika sydämen vajaatoiminnasta johtuvan sairaalajakson ja sydän- ja verisuonikuoleman muodostaman yhdistelmäpäätemuuttujan ensimmäiseen tapahtumaan. Toissijaiset päätemuuttujat olivat munuaisiin liittyvä yhdistelmäpäätemuuttuja ja kaikista syistä johtuva kuolleisuus.
Merkittävät kardiovaskulaariset haittatapahtumat
Dapagliflotsiini (10 mg) osoitettiin vähintään samanveroiseksi kuin lumelääke sydän- ja verisuonikuoleman, sydäninfarktin ja iskeemisen aivohalvauksen muodostaman yhdistelmäpäätemuuttujan suhteen (yksitahoinen p < 0,001).
Sydämen vajaatoiminta tai sydän- ja verisuonitautikuolema
Dapagliflotsiinin (10 mg) osoitettiin ehkäisevän sydämen vajaatoiminnasta johtuvan sairaalajakson ja sydän- ja verisuonikuoleman muodostamaa yhdistelmäpäätemuuttujaa paremmin kuin lumelääke (kuva 1). Ero hoitovaikutuksessa liittyi sydämen vajaatoiminnasta johtuviin sairaalajaksoihin, eikä sydän- ja verisuonikuolemissa ollut eroa (kuva 2).
Dapagliflotsiinihoidon hyöty lumelääkkeeseen verrattuna havaittiin riippumatta siitä, oliko potilailla todettu sydän- ja verisuonitauti ja oliko potilailla lähtötilanteessa sydämen vajaatoiminta. Hyöty oli johdonmukainen kaikissa keskeisissä alaryhmissä, mukaan lukien ikä, sukupuoli, munuaisten toiminta (eGFR) ja maantieteellinen alue.
Kuva 1: Aika ensimmäiseen sydämen vajaatoiminnasta johtuvaan sairaalajaksoon tai sydän- ja verisuonikuolemaan
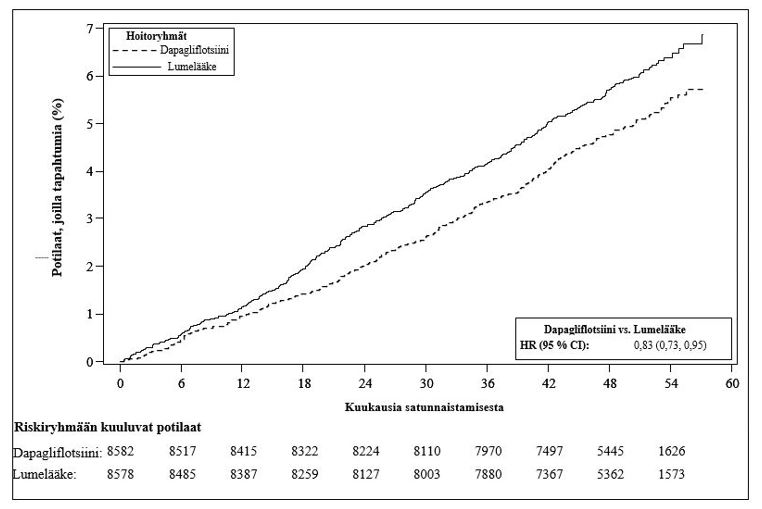
Riskiryhmään kuuluvien potilaiden määrä on riskiryhmään kuuluvien potilaiden määrä jakson alussa.
HR = riskisuhde, CI = luottamusväli
Ensisijaisia ja toissijaisia päätemuuttujia koskevat tulokset on esitetty kuvassa 2. Dapagliflotsiinin paremmuutta lumelääkkeeseen verrattuna ei osoitettu MACE-tapahtumien suhteen (p = 0,172). Munuaisiin liittyvää yhdistelmäpäätemuuttujaa tai kaikista syistä johtuvaa kuolleisuutta ei näin ollen testattu osana tulokset vahvistavaa testaustoimenpidettä.
Kuva 2: Hoitovaikutukset ensisijaisten yhdistelmäpäätemuuttujien ja niiden komponenttien sekä toissijaisten yhdistelmäpäätemuuttujien ja niiden komponenttien suhteen
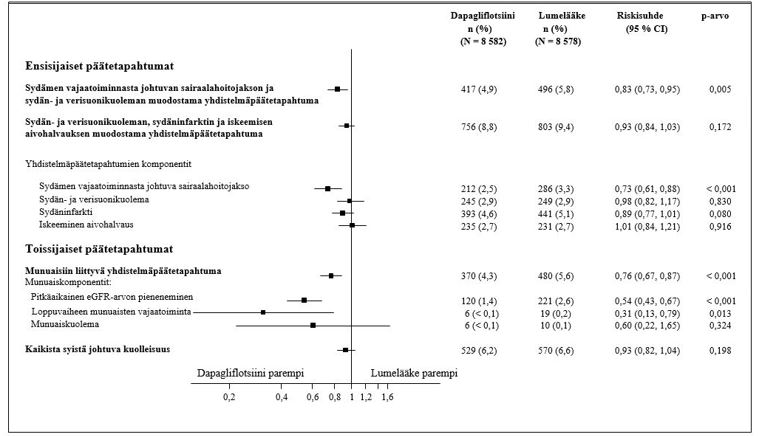
Munuaisiin liittyvän yhdistelmäpäätemuuttujan määritelmä: pitkäaikainen vahvistettu eGFR-arvon ≥ 40 %:n pieneneminen arvoon eGFR < 60 ml/min/1,73 m2 ja/tai loppuvaiheen munuaisten vajaatoiminta (≥ 90 päivää dialyysihoitoa tai munuaisensiirto, pitkäaikainen vahvistettu eGFR < 15 ml/min/1,73 m2) ja/tai munuais- tai sydän- ja verisuonikuolema.
p-arvot ovat kaksitahoisia. Toissijaisten päätemuuttujien ja yksittäisten komponenttien p-arvot ovat nimellisiä. Aika ensimmäiseen tapahtumaan analysoitiin käyttämällä Coxin suhteellisten riskitiheyksien mallia. Yksittäisten komponenttien ensimmäisten tapahtumien lukumäärät ovat kunkin komponentin ensimmäisten tapahtumien todellisia lukumääriä eikä niiden yhteenlaskettu summa vastaa yhdistelmäpäätemuuttujan tapahtumien lukumäärää.
CI = luottamusväli
Nefropatia
Dapagliflotsiini pienensi eGFR-arvon vahvistetun pitkäaikaisen pienenemisen, loppuvaiheen munuaisten vajaatoiminnan ja munuais- tai sydän- ja verisuonikuoleman muodostaman yhdistelmäpäätemuuttujan tapahtumien ilmaantuvuutta. Ryhmien välinen ero liittyi munuaiskomponenttien (eGFR-arvon pitkäaikaisen pienenemisen, loppuvaiheen munuaisten vajaatoiminnan ja munuaiskuoleman) tapahtumien vähenemiseen (kuva 2).
Dapagliflotsiinin ja lumelääkkeen välinen riskisuhde ajalle nefropatiaan (eGFR-arvon pitkäaikainen pieneneminen, loppuvaiheen munuaisten vajaatoiminta tai munuaiskuolema) oli 0,53 (95 %:n luottamusväli 0,43, 0,66).
Lisäksi dapagliflotsiini vähensi pitkäkestoisen albuminurian ilmaantumista (riskisuhde 0,79; 95 %:n luottamusväli 0,72, 0,87) ja johti makroalbuminurian suurempaan regressioon (riskisuhde 1,82; 95 %:n luottamusväli 1,51, 2,20) verrattuna lumelääkkeeseen.
Munuaisten vajaatoiminta
Keskivaikea munuaisten vajaatoiminta CKD-luokka 3A (eGFR ≥ 45 – < 60 ml/min/1,73 m2)
Dapagliflotsiini
Dapagliflotsiinin tehoa arvioitiin tutkimuksessa, joka tehtiin nimenomaan diabetespotilailla, joiden eGFR oli ≥ 45 − < 60 ml/min/1,73 m2 ja joiden glukoositasapaino oli tavanomaisella hoidolla riittämätön. Dapagliflotsiinihoito pienensi HbA1c-arvoja ja painoa lumelääkkeeseen verrattuna (taulukko 5).
Taulukko 5. Tulokset viikolla 24 lumevertailututkimuksessa, jossa tutkittiin dapagliflotsiinia diabetespotilailla, joiden eGFR oli ≥ 45 − < 60 ml/min/1,73 m2
Dapagliflotsiinia 10 mg | Lumelääkea | |
| Nb | 159 | 161 |
| HbA1c (%) | ||
| Lähtötilanne (keskiarvo) | 8,35 | 8,03 |
| Muutos lähtötilanteestab | ‑0,37 | ‑0,03 |
Ero lumelääkkeeseen verrattunab (95 %:n luottamusväli) | ‑0,34* (‑0,53, ‑0,15) | |
| Paino (kg) | ||
| Lähtötilanne (keskiarvo) | 92,51 | 88,30 |
| Prosentuaalinen muutos lähtötilanteestac | -3,42 | -2,02 |
Prosentuaalisen muutoksen ero lumelääkkeeseen verrattunac (95 %:n luottamusväli) | -1,43* (-2,15, -0,69) |
a Metformiini tai metformiinihydrokloridi olivat osa tavanomaista hoitoa 69,4 %:lla dapagliflotsiiniryhmän potilaista ja 64,0 %:lla lumeryhmän potilaista.
b Pienimmän neliösumman keskiarvo suhteutettuna lähtötilanteen arvoon.
c Johdettu pienimmän neliösumman keskiarvosta suhteutettuna lähtötilanteen arvoon.
* p ≤ 0,001.
Viikolla 24 dapagliflotsiinihoito oli pienentänyt paastoglukoosiarvoa: ‑1,19 mmol/l (‑21,46 mg/dl), verrattuna lumelääkkeeseen: ‑0,27 mmol/l (‑4,87 mg/dl) (p ≤ 0,001) sekä pienentänyt potilaan istuessa mitattua systolista verenpainetta: ‑4,8 mmHg, verrattuna lumelääkkeeseen: ‑1,7 mmHg (p < 0,05).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Qtern-valmisteen käytöstä tyypin 2 diabeteksen hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Kaiken kaikkiaan saksagliptiinin ja dapagliflotsiinin farmakokinetiikassa ei havaittu kliinisesti merkittävää eroa, kun verrattiin kiinteäannoksisen yhdistelmän antamista saksagliptiinin ja dapagliflotsiinin antamiseen erikseen.
Seuraavassa kuvataan saksagliptiinin ja dapagliflotsiinin kiinteäannoksisen yhdistelmän farmakokineettisiä ominaisuuksia, ellei ole mainittu, että esitetyt tulokset on saatu saksagliptiini- tai dapagliflotsiinihoidosta.
Qtern 5 mg/10 mg ‑tabletin ja erikseen annettujen saksagliptiini- (5 mg) ja dapagliflotsiini (10 mg) ‑tablettien välinen bioekvivalenssi terveille tutkittaville paastotilassa annetun kerta-annoksen jälkeen on varmistettu. Dapagliflotsiinin ja saksagliptiinin ja sen päämetaboliitin farmakokinetiikka oli samanlainen sekä terveillä tutkittavilla että tyypin 2 diabetesta sairastavilla potilailla.
Saksagliptiinin ja dapagliflotsiinin kiinteäannoksisen yhdistelmän ottaminen rasvaisen aterian yhteydessä pienentää dapagliflotsiinin Cmax‑arvoa jopa 35 % ja pidentää tmax‑arvoa noin 1,5 tuntia, mutta ei muuta AUC-arvoa paastotilaan verrattuna. Näitä muutoksia ei pidetty kliinisesti merkittävinä. Ruuan ei havaittu vaikuttavan saksagliptiiniin. Tämä lääkevalmiste voidaan ottaa joko aterian yhteydessä tai tyhjään mahaan.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa
Saksagliptiinin ja dapagliflotsiinin yhdistelmä: Saksagliptiinin ja dapagliflotsiinin kiinteäannoksisella yhdistelmällä ja muilla lääkevalmisteilla ei ole tehty yhteisvaikutustutkimuksia. Tällaisia tutkimuksia on tehty kullakin yksittäisellä vaikuttavalla aineella.
Saksagliptiini: In vitro ‑tutkimuksissa saksagliptiini ja sen päämetaboliitti eivät estäneet CYP 1A2:ta, ‑2A6:ta, ‑2B6:ta, ‑2C8:aa, ‑2C9:ää, ‑2C19:ää, ‑2D6:ta, ‑2E1:tä tai ‑3A4:ä eivätkä indusoineet CYP 1A2:ta, ‑2B6:ta, ‑2C9:ää tai ‑3A4:ää.
Dapagliflotsiini: In vitro -tutkimuksissa dapagliflotsiini ei estänyt sytokromi P450 (CYP) 1A2‑, CYP 2A6‑, CYP 2B6‑, CYP 2C8‑, CYP 2C9‑, CYP 2C19‑, CYP 2D6- tai CYP 3A4 ‑entsyymejä eikä indusoinut CYP 1A2‑, CYP 2B6- tai CYP 3A4 ‑entsyymejä. Tämän vuoksi dapagliflotsiinin ei odoteta muuttavan näiden entsyymien kautta metaboloituvien, samanaikaisesti annettavien lääkevalmisteiden metabolista puhdistumaa.
Imeytyminen
Saksagliptiini: Nielty saksagliptiini imeytyi nopeasti paastotilassa niin, että saksagliptiinin huippupitoisuus plasmassa (Cmax) saavutettiin 2 tunnissa (tmax) ja saksagliptiinin päämetaboliitin huippupitoisuus plasmassa (Cmax) saavutettiin 4 tunnissa (tmax). Saksagliptiinin ja sen päämetaboliitin Cmax‑ ja AUC-arvot suurenivat suhteessa saksagliptiiniannoksen suurentamiseen, ja tämä annos-pitoisuussuhde pysyi samana vielä enintään 400 mg:n annoksilla. Saksagliptiinin suun kautta otetun 5 mg:n kerta-annoksen ottamisen jälkeen terveiden tutkittavien plasman keskimääräiset saksagliptiinin ja sen päämetaboliitin AUC-arvot olivat 78 ng·h/ml ja 214 ng·h/ml. Vastaavat plasman Cmax‑arvot olivat 24 ng/ml ja 47 ng/ml. Yksilölliset vaihtelukertoimet saksagliptiinin Cmax‑ ja AUC-arvoille olivat alle 12 %.
Dapagliflotsiini: Dapagliflotsiini imeytyi nopeasti ja tehokkaasti suun kautta annettuna. Dapagliflotsiinin huippupitoisuus plasmassa (Cmax) saavutettiin paastotilassa yleensä kahdessa tunnissa lääkkeen antamisen jälkeen. Dapagliflotsiinin geometrinen vakaan tilan Cmax‑keskiarvo oli 158 ng/ml ja AUCτ-keskiarvo oli 628 ng h/ml kerran vuorokaudessa otetun 10 mg dapagliflotsiiniannoksen jälkeen. Suun kautta otetun 10 mg dapagliflotsiiniannoksen absoluuttinen hyötyosuus oli 78 %.
Jakautuminen
Saksagliptiini: Ihmisen seerumissa saksagliptiinin ja sen päämetaboliitin sitoutuminen proteiineihin in vitro on merkityksetöntä. Siten eri sairauksiin (kuten munuaisten tai maksan vajaatoimintaan) liittyvät veren proteiiniarvojen muutokset eivät oletettavasti muuta saksagliptiinin jakautumista. Saksagliptiinin keskimääräinen jakautumistilavuus oli 205 l.
Dapagliflotsiini: Dapagliflotsiini sitoutuu proteiineihin noin 91-prosenttisesti. Sitoutuminen proteiineihin ei vaihdellut eri sairaustiloissa (esim. munuaisen tai maksan vajaatoiminta). Dapagliflotsiinin keskimääräinen jakautumistilavuus vakaassa tilassa oli 118 l.
Biotransformaatio
Saksagliptiini: Saksagliptiinin biotransformaatio on ensisijaisesti sytokromi P450 (CYP 3A4/5) ‑välitteinen. Myös saksagliptiinin aktiivinen päämetaboliitti, 5-OH-saksagliptiini, on selektiivinen, reversiibeli ja kilpaileva DPP‑4:n estäjä ja se on puoliksi niin voimakas kuin saksagliptiini.
Dapagliflotsiini: Dapagliflotsiini metaboloituu laajasti ja sen päämetaboliitti on inaktiivinen dapagliflotsiini-3-O-glukuronidi. Dapagliflotsiini-3-O-glukuronidilla tai muilla metaboliiteilla ei ole glukoosipitoisuutta pienentävää vaikutusta. Dapagliflotsiini-3-O-glukuronidin muodostumiseen vaikuttaa UGT1A9-entsyymi, jota esiintyy maksassa ja munuaisissa. CYP-välitteinen metabolia oli ihmisillä vähäisempi puhdistumareitti.
Eliminaatio
Saksagliptiini: Saksagliptiinin keskimääräinen terminaalinen puoliintumisaika (t½) plasmassa on 2,5 tuntia ja sen päämetaboliitin 3,1 tuntia. DPP‑4:n eston keskimääräinen puoliintumisaika plasmassa oli 26,9 tuntia. Saksagliptiini eliminoituu sekä munuaisten että maksan kautta. 14C‑saksagliptiinin 50 mg kerta-annoksen ottamisen jälkeen annoksesta erittyi virtsaan 24 % saksagliptiininä ja 36 % sen aktiivisena metaboliittina. Virtsaan erittynyt kokonaisradioaktiivisuus oli 75 % annoksesta. Saksagliptiinin keskimääräinen munuaispuhdistuma (~230 ml/min) oli suurempi kuin keskimääräinen glomerulusten laskennallinen suodatusnopeus (GFR) (~120 ml/min), mikä viittaa jonkinasteiseen aktiiviseen erittymiseen munuaisten kautta.
Dapagliflotsiini: Dapagliflotsiinin keskimääräinen terminaalinen puoliintumisaika (t1/2) plasmassa oli terveillä tutkittavilla 12,9 tuntia yhden suun kautta otetun dapagliflotsiinin 10 mg annoksen jälkeen. Laskimoon annetun dapagliflotsiinin keskimääräinen systeeminen kokonaispuhdistuma oli 207 ml/min. Dapagliflotsiini ja sen metaboliitit poistuvat pääasiassa erittymällä virtsaan, jolloin alle 2 % erittyneestä lääkeaineesta on metaboloitumatonta dapagliflotsiinia.
Lineaarisuus
Saksagliptiini: Saksagliptiinin ja sen päämetaboliitin Cmax‑ ja AUC-arvot suurenivat samassa suhteessa saksagliptiiniannokseen. Saksagliptiinin tai sen päämetaboliitin merkittävää kumuloitumista ei havaittu toistetulla kerran vuorokaudessa annolla millään annoksella. Annoksen suuruuteen tai antoaikaan liittyvää riippuvuutta ei havaittu saksagliptiinin ja sen päämetaboliitin puhdistumassa 14 päivän aikana, kun saksagliptiinia annettiin kerran vuorokaudessa 2,5–400 mg:n annoksina.
Dapagliflotsiini: Dapagliflotsiinialtistus suureni dapagliflotsiiniannoksen mukaisesti alueella 0,1–500 mg, eikä sen farmakokinetiikka muuttunut ajan myötä, kun toistuvia vuorokausiannoksia jatkettiin viikolle 24.
Erityisryhmät
Munuaisten vajaatoiminta
Saksagliptiini: Kun kreatiniinipuhdistuman perusteella luokiteltua lievää, kohtalaista tai vaikeaa munuaisten vajaatoimintaa (tai loppuvaiheen munuaissairautta) sairastaville tutkittaville annettiin kerta-annos saksagliptiinia, keskimääräiset saksagliptiinin AUC-arvot olivat 1,2 kertaa (lievä vajaatoiminta), 2,1 kertaa (kohtalainen vajaatoiminta) ja 4,5 kertaa (vaikea vajaatoiminta) suurempia kuin AUC-arvot tutkittavilla, joiden munuaiset toimivat normaalisti. Myös 5-OH-saksagliptiinin AUC-arvot suurenivat. Munuaisten vajaatoiminnan vaikeusaste ei vaikuttanut saksagliptiinin tai sen päämetaboliitin Cmax‑arvoon.
Dapagliflotsiini: Vakaassa tilassa (20 mg dapagliflotsiinia kerran vuorokaudessa 7 päivän ajan) olevilla tutkittavilla, jotka sairastivat tyypin 2 diabetesta ja lievää, kohtalaista tai vaikeaa munuaisten vajaatoimintaa (plasman ioheksolipuhdistumalla määritettynä), keskimääräinen systeeminen dapagliflotsiinialtistus oli 32 % (lievä munuaisten vajaatoiminta), 60 % (kohtalainen munuaisten vajaatoiminta) ja 87 % (vaikea munuaisten vajaatoiminta) suurempi kuin tutkittavilla, joilla oli tyypin 2 diabetes ja normaali munuaisten toiminta. Vakaassa tilassa glukoosin eritys virtsaan 24 tunnin aikana riippui voimakkaasti munuaisten toiminnasta: tyypin 2 diabetesta sairastavilla tutkittavilla glukoosia erittyi päivässä 85 g normaalissa munuaisten toiminnassa, 52 g lievässä vajaatoiminnassa, 18 g kohtalaisessa vajaatoiminnassa ja 11 g vaikeassa vajaatoiminnassa. Hemodialyysin vaikutusta dapagliflotsiinialtistukseen ei tunneta.
Maksan vajaatoiminta
Saksagliptiini: Lievää (Child-Pugh-luokka A) maksan vajaatoimintaa sairastavilla tutkittavilla saksagliptiinialtistus oli 1,1 kertaa suurempi, keskivaikeassa (Child-Pugh-luokka B) 1,4 kertaa suurempi ja vaikeassa (Child-Pugh-luokka C) 1,8 kertaa suurempi, ja vastaavat altistukset BMS-510849:lle (saksagliptiinin metaboliitti) olivat 22 %, 7 % ja 33 % pienempiä kuin arvot, joita havaittiin terveillä tutkittavilla.
Dapagliflotsiini: Tutkittavilla, joilla oli lievä tai kohtalainen maksan vajaatoiminta (Child-Pugh-luokat A ja B), dapagliflotsiinin Cmax‑keskiarvo oli enintään 12 % suurempi ja AUC-keskiarvo oli enintään 36 % suurempi kuin kaltaistetuilla terveillä verrokeilla. Näitä eroja ei pidetty kliinisesti merkittävinä. Vaikeaa maksan vajaatoimintaa sairastavilla tutkittavilla (Child-Pugh-luokka C) dapagliflotsiinin Cmax‑keskiarvo oli 40 % suurempi ja AUC-keskiarvo 67 % suurempi kuin terveillä kaltaistetuilla verrokkihenkilöillä.
Iäkkäät
Saksagliptiini: Saksagliptiinin AUC-arvo oli iäkkäillä (65–80‑vuotiailla) potilailla noin 60 % suurempi kuin nuorilla (18–40‑vuotiailla) potilailla. Tätä ei pidetä kliinisesti merkityksellisenä ja sen vuoksi saksagliptiinin annoksen sovittamista ei suositella pelkästään iän perusteella.
Dapagliflotsiini: Alle 70‑vuotiailla tutkittavilla altistus ei lisääntynyt kliinisesti merkittävästi pelkästään iän perusteella. Altistuksen voidaan kuitenkin olettaa lisääntyvän ikään liittyvän munuaistoiminnan heikkenemisen vuoksi. Tutkimustuloksia ei ole riittävästi, jotta voitaisiin tehdä johtopäätöksiä yli 70‑vuotiaiden potilaiden altistuksesta.
Sukupuoli
Saksagliptiini: Naisilla todettiin suunnilleen 25 % suuremmat systeemiset saksagliptiinialtistukset. Saksagliptiinin farmakokinetiikassa ei havaittu kliinisesti merkittäviä eroja miesten ja naisten välillä.
Dapagliflotsiini: Dapagliflotsiinin AUCss-keskiarvon arvioitiin olevan naisilla noin 22 % suurempi kuin miehillä.
Rotu
Saksagliptiini: Rodun ei todettu olevan saksagliptiinin ja sen metaboliitin näennäisen puhdistuman tilastollisesti merkitsevä kovariaatti.
Dapagliflotsiini: Systeemisissä altistuksissa ei ollut kliinisesti merkittäviä eroja valkoihoisten, mustaihoisten ja aasialaisten välillä.
Paino
Saksagliptiini: Painolla oli vähäinen ja kliinisesti merkityksetön vaikutus saksagliptiinialtistukseen. Naisilla todettiin noin 25 % suuremmat systeemiset saksagliptiinialtistukset, mutta tätä eroa ei pidetty kliinisesti merkityksellisenä.
Dapagliflotsiini: Dapagliflotsiinialtistuksen havaittiin pienenevän painon lisääntyessä. Tämän vuoksi hoikilla potilailla altistus saattaa olla hieman suurentunut ja tavallista painavammilla potilailla hieman pienentynyt. Näitä eroja ei kuitenkaan pidetty kliinisesti merkityksellisinä.
Prekliiniset tiedot turvallisuudesta
Saksagliptiinilla tai dapagliflotsiinilla tehtyjen farmakologista turvallisuutta, genotoksisuutta tai karsinogeenisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Cynomolgus-apinoilla saksagliptiini aiheutti korjautuvia iholeesioita (ruvettumista, haavaumia ja nekroosia) ulkonevissa ruumiinosissa (hännässä, sormissa/varpaissa, kivespusseissa ja/tai kuonossa). Leesioihin liittyvä vaikutukseton annostaso (NOEL) on saksagliptiinilla sama ja päämetaboliitilla 2‑kertainen verrattuna ihmisen altistukseen ihmiselle suositellulla 5 mg:n vuorokausiannoksella. Iholeesioiden kliinistä merkitystä ei tunneta, eikä ihmisillä ole todettu iholeesioita.
Kaikilla testatuilla lajeilla raportoitiin vastustuskykyyn liittyviä löydöksiä, kuten minimaalista ei-etenevää lymfoidia hyperplasiaa pernassa, imusolmukkeissa ja luuytimessä aina 7‑kertaisesta ihmiselle suositellusta vuorokausiannoksesta alkaen. Näillä ei kuitenkaan ollut haitallisia seurauksia.
Saksagliptiini aiheutti gastrointestinaalista toksisuutta koirilla, kuten verisiä/limaisia ulosteita ja enteropatiaa, suuremmilla annoksilla, kun saksagliptiinin NOEL oli saksagliptiinilla 4‑kertainen ja saksagliptiinin päämetaboliitilla 2‑kertainen ihmisen altistukseen nähden käytettäessä suositeltua vuorokausiannosta. Vaikutus jälkeläisten painoon huomattiin naaraista 92 päivään ja uroksista 120 päivään asti syntymästä.
Lisääntymis- ja kehitystoksisuus
Saksagliptiinin vaikutuksia uros- ja naarasrottien hedelmällisyyteen havaittiin suurilla annoksilla, jotka tuottivat selviä toksisuuden merkkejä. Saksagliptiini ei ollut teratogeeninen millään rotilla tai kaneilla tutkituilla annoksilla. Rotilla suuret saksagliptiiniannokset hidastivat sikiön lantion luutumista (kehitysviivästymä) ja pienensivät sikiön painoa (emolle toksisilla annoksilla). Saksagliptiinin NOEL oli 303‑kertainen ja sen päämetaboliitin NOEL 30‑kertainen ihmisen altistukseen nähden käytettäessä ihmiselle suositeltua vuorokausiannosta. Kaneilla saksagliptiinin vaikutukset rajoittuivat vähäisiin luustomuutoksiin, joita todettiin vain emolle toksisilla annoksilla (saksagliptiinin NOEL oli 158‑kertainen ja sen päämetaboliitin NOEL 224‑kertainen ihmisen altistukseen nähden käytettäessä ihmiselle suositeltua vuorokausiannosta). Rotilla tehdyssä pre- ja postnataalisessa kehitystutkimuksessa saksagliptiini pienensi poikasten painoa emolle toksisilla annoksilla. Saksagliptiinin NOEL oli 488‑kertainen ja sen päämetaboliitin NOEL 45‑kertainen ihmisen altistukseen nähden käytettäessä ihmiselle suositeltua vuorokausiannosta. Vaikutus jälkeläisten painoon huomattiin naarailla 92 päivään ja uroksilla 120 päivään asti syntymän jälkeen.
Dapagliflotsiinin suora antaminen vastavieroitetuille rotanpoikasille ja epäsuora altistus myöhäisen tiineyden aikana (aikana, joka vastaa toista ja kolmatta raskauskolmannesta ihmisen munuaisten kehittymisen suhteen) ja imetyksen aikana johtivat jälkeläisten munuaisaltaan ja munuaistiehyiden laajenemisen esiintymistiheyden ja/tai vaikeusasteen kasvamiseen.
Nuorilla eläimillä tehdyssä tutkimuksessa dapagliflotsiinia annettiin suoraan rotanpoikasille 21.:stä syntymän jälkeisestä päivästä päivään 90 saakka. Munuaisaltaan ja munuaistiehyiden laajenemista raportoitiin kaikilla annoksilla. Poikasten altistukset pienimmällä tutkitulla annoksella olivat ≥ 15 kertaa ihmisille suositeltuja enimmäisannoksia suurempia. Näihin löydöksiin liittyi annosriippuvaista munuaisen painon kasvua ja makroskooppista munuaisten suurenemista, jota havaittiin kaikilla annoksilla. Nuorilla eläimillä havaitut munuaisaltaan ja -tiehyiden laajenemiset eivät täysin palautuneet noin yhden kuukauden mittaisen palautumisjakson aikana.
Emorotille annettiin dapagliflotsiinia kuudennesta tiineyspäivästä 21. syntymänjälkeiseen päivään, ja poikaset altistuivat epäsuorasti in utero ja koko imetyksen ajan. Munuaisaltaan laajenemisen esiintymistiheyden tai vaikeusasteen kasvua havaittiin käsiteltyjen emojen täysikasvuisilla jälkeläisillä, mutta vain suurimmalla tutkitulla annoksella (emon dapagliflotsiinialtistukset olivat 1 415 kertaa ja poikasten altistukset 137 kertaa suurempia kuin ihmiselle saadut arvot ihmiselle suositellulla enimmäisannoksella). Kehitykseen kohdistunut lisätoksisuus rajoittui poikasten annoksesta riippuvaiseen painon laskuun, ja sitä havaittiin vain annoksilla ≥ 15 mg/kg/vrk (poikasten altistuksen ollessa ≥ 29‑kertainen ihmiselle saatuihin arvoihin nähden ihmiselle suositellulla enimmäisannoksella). Maternaalinen toksisuus oli ilmeistä vain suurimmalla tutkitulla annoksella, ja se rajoittui ohimenevään painonlaskuun ja ruuankulutuksen vähenemiseen. Kehitystoksisuuden suurin haitaton annostaso (NOAEL) liittyy emon systeemiseen altistukseen, joka on 19‑kertainen verrattuna ihmisen altistukseen ihmisille suositellulla enimmäisannoksella.
Kaneilla tehdyissä alkioiden ja sikiöiden kehitystä koskeneissa tutkimuksissa dapagliflotsiini ei aiheuttanut maternaalista toksisuutta eikä kehitystoksisuutta millään tutkitulla annoksella; suurin tutkittu annos vastasi systeemistä altistusta, joka oli noin 1 191 kertaa ihmiselle suositeltu enimmäisannos. Rotilla dapagliflotsiini ei ollut alkiolle letaali eikä teratogeeninen altistuksella, joka oli 1 441 kertaa ihmiselle suositeltu enimmäisannos.
Farmaseuttiset tiedot
Apuaineet
Tabletin ydin
Mikrokiteinen selluloosa (E460i)
Kroskarmelloosinatrium (E468)
Laktoosi
Magnesiumstearaatti (E470b)
Piidioksidi, hammaslääkintään (E551)
Kalvopäällyste
Poly(vinyylialkoholi) (E1203)
Makrogoli 3350 (E1521)
Titaanidioksidi (E171)
Talkki (E553b)
Keltainen rautaoksidi (E172)
Punainen rautaoksidi (E172)
Painoväri
Shellakka
Indigokarmiini alumiinilakka (E132)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
QTERN tabletti, kalvopäällysteinen
5/10 mg (L:kyllä) 28 fol (90,53 €)
PF-selosteen tieto
PA/Alumiini/PVC-alumiiniläpipainopakkaus.
14, 28 tai 98 kalvopäällysteistä tablettia kalenteriläpipainopakkauksissa.
30 kalvopäällysteistä tablettia läpipainopakkauksissa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Vaaleanruskea tai ruskea, kaksoiskupera, 0,8 cm:n suuruinen, pyöreä kalvopäällysteinen tabletti, jonka toisella puolella on sinisellä musteella tehty merkintä "5/10" ja toisella puolella merkintä "1122".
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia.
Korvattavuus
QTERN tabletti, kalvopäällysteinen
5/10 mg 28 fol
- Ei korvausta.
ATC-koodi
A10BD21
Valmisteyhteenvedon muuttamispäivämäärä
22.05.2025
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
