TREVICTA injektioneste, depotsuspensio 175 mg, 263 mg, 350 mg, 525 mg
Vaikuttavat aineet ja niiden määrät
175 mg injektioneste, depotsuspensio
Yksi esitäytetty ruisku sisältää 273 mg paliperidonipalmitaattia 0,88 ml:ssa, mikä vastaa 175 mg:aa paliperidonia.
263 mg injektioneste, depotsuspensio
Yksi esitäytetty ruisku sisältää 410 mg paliperidonipalmitaattia 1,32 ml:ssa, mikä vastaa 263 mg:aa paliperidonia.
350 mg injektioneste, depotsuspensio
Yksi esitäytetty ruisku sisältää 546 mg paliperidonipalmitaattia 1,75 ml:ssa, mikä vastaa 350 mg:aa paliperidonia.
525 mg injektioneste, depotsuspensio
Yksi esitäytetty ruisku sisältää 819 mg paliperidonipalmitaattia 2,63 ml:ssa, mikä vastaa 525 mg:aa paliperidonia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, depotsuspensio
Kliiniset tiedot
Käyttöaiheet
Trevicta on kerran kolmessa kuukaudessa annettava injektioliuos, joka on tarkoitettu skitsofrenian ylläpitohoitoon aikuispotilaille, kun potilaan tila on kliinisesti vakaa kerran kuukaudessa injektiona annetulla paliperidonipalmitaatilla (ks. kohta Farmakodynamiikka).
Annostus ja antotapa
Annostus
Potilas voi siirtyä kerran kolmessa kuukaudessa injektiona annettavaan paliperidonipalmitaattihoitoon, jos hoitotasapaino kerran kuukaudessa injektiona annetulla paliperidonipalmitaatilla on ollut riittävän hyvä vähintään neljän kuukauden ajan eikä annosta ole tarpeen muuttaa.
Trevicta-hoito pitää aloittaa kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin hoito-ohjelman mukaisen seuraavan annoksen antoajankohtana (± 7 päivää). Trevicta-annoksen pitää perustua aiempaan kerran kuukaudessa annettuun paliperidonipalmitaattiannokseen siten, että käytetään 3,5‑kertaista annosta seuraavan taulukon mukaisesti:
Trevicta-annokset potilaille, jotka ovat riittävässä hoitotasapainossa kerran kuukaudessa injektiona annettavalla paliperidonipalmitaatilla | |
Jos kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin viimeisin annos on | Aloita Trevicta-hoito seuraavalla annoksella |
50 mg | 175 mg |
75 mg | 263 mg |
100 mg | 350 mg |
150 mg | 525 mg |
Trevicta-valmisteella ei ole kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin annosta 25 mg vastaavaa annosta, koska sitä ei tutkittu.
Trevicta-injektioita pitää antaa ensimmäisen Trevicta-annoksen jälkeen lihakseen kerran kolmessa kuukaudessa (± 2 viikkoa, ks. myös kohta Annoksen väliin jääminen).
Trevicta-annosta voidaan tarvittaessa muuttaa kerran kolmessa kuukaudessa 175–525 mg:n annosmuutoksin potilaan yksilöllisen sietokyvyn ja hoidon tehon mukaan. Koska Trevicta on pitkävaikutteinen valmiste, potilaan vaste annosmuutokseen saattaa olla havaittavissa vasta usean kuukauden kuluttua (ks. kohta Farmakokinetiikka). Jos potilaalla on edelleen oireita, ne pitää hoitaa kliinisen käytännön mukaisesti.
Siirtyminen muista psykoosilääkevalmisteista
Potilaan ei pidä siirtyä suoraan muista psykoosilääkevalmisteista, sillä kerran kolmessa kuukaudessa injektiona annettava paliperidonipalmitaattihoito aloitetaan vasta, kun potilaan tila on saatu vakaaksi kerran kuukaudessa annettavalla paliperidonipalmitaatti-injektiolla.
Siirtyminen Trevicta-hoidosta muiden psykoosilääkevalmisteiden käyttöön
Jos Trevicta-hoito lopetetaan, sen pitkäkestoinen vaikutus on otettava huomioon.
Siirtyminen Trevicta-hoidosta kerran kuukaudessa injektiona annettavaan paliperidonipalmitaattiin
Siirryttäessä Trevicta-hoidosta kerran kuukaudessa injektiona annettavaan paliperidonipalmitaattiin, kerran kuukaudessa annettava paliperidonipalmitaatti pitää antaa seuraavan Trevicta-annoksen antoajankohtana 3,5‑kertaa pienempänä annoksena seuraavan taulukon mukaisesti. Kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin valmisteyhteenvedossa mainittu aloitusannostus ei ole tarpeen. Kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin käyttämistä pitää sen jälkeen jatkaa kuukauden välein, kuten sen valmisteyhteenvedossa kuvataan.
Kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin annokset Trevicta-hoidosta siirtyville potilaille | |
Jos viimeinen Trevicta-annos on | Aloita kerran kuukaudessa injektiona annettavan paliperidonin käyttö kolmen kuukauden kuluttua seuraavina annoksina |
175 mg | 50 mg |
263 mg | 75 mg |
350 mg | 100 mg |
525 mg | 150 mg |
Siirtyminen Trevicta-hoidosta suun kautta päivittäin otettavien paliperidonidepottablettien käyttöön
Siirryttäessä Trevicta-hoidosta paliperidonidepottablettien käyttöön päivittäin otettavien paliperidonidepottablettien käyttö pitää aloittaa kolmen kuukauden kuluttua viimeisestä Trevicta-annoksesta. Sen jälkeen hoitoa jatketaan ottamalla paliperidonidepottabletteja seuraavassa taulukossa kuvatulla tavalla. Seuraavassa taulukossa esitetään suositellut annosmuutokset, jotta hoitotasapainossa eri Trevicta-annoksilla olevat potilaat saavat paliperidonidepottableteista samankaltaisen paliperidonialtistuksen.
Trevicta-hoidosta siirtyvien potilaiden paliperidonidepottablettiannos* | |||
Viimeinen Trevicta-annos (viikko 0) | Viikkoa viimeisestä Trevicta-annoksesta | ||
Viikosta 12 viikkoon 18 (nämä viikot mukaan lukien) | Viikosta 19 viikkoon 24 (nämä viikot mukaan lukien) | Viikosta 25 lähtien | |
Päivittäinen paliperidonidepottablettiannos | |||
175 mg | 3 mg | 3 mg | 3 mg |
263 mg | 3 mg | 3 mg | 6 mg |
350 mg | 3 mg | 6 mg | 9 mg |
525 mg | 6 mg | 9 mg | 12 mg |
* Kaikki kerran vuorokaudessa otettavat paliperidonidepottablettiannokset pitää määrittää kullekin potilaalle yksilöllisesti, ja siinä pitää ottaa huomioon mm. syy hoidon vaihtamiseen, vaste aiempaan paliperidonihoitoon, psykoottisten oireiden vaikeusaste ja alttius haittavaikutuksille. | |||
Annoksen väliin jääminen
Annosten välinen aika
Trevicta-injektio pitää antaa kerran kolmessa kuukaudessa. Jotta Trevicta-annoksen väliin jääminen voidaan välttää, injektio voidaan antaa potilaalle enintään kaksi viikkoa ennen kolmen kuukauden antoajankohtaa tai kaksi viikkoa kyseisen ajankohdan jälkeen.
Annoksen väliin jääminen | |
Jos hoitoaikataulun mukainen annos jää väliin ja viimeisimmästä annoksesta kulunut aika on | Toimenpide |
> 3,5 kuukautta, mutta enintään 4 kuukautta | Injektio pitää antaa mahdollisimman pian, ja sen jälkeen jatketaan injektioiden antamista kolmen kuukauden välein. |
4–9 kuukautta | Noudata seuraavassa taulukossa esitettyä suositusta hoidon aloittamisesta uudelleen. |
> 9 kuukautta | Aloita hoito uudelleen kerran kuukaudessa injektiona annettavalla paliperidonipalmitaatilla sen valmisteyhteenvedossa kuvatulla tavalla. Trevicta-hoito voidaan aloittaa uudelleen, kun potilaan hoitotasapaino on ollut riittävän vakaa vähintään neljän kuukauden ajan kerran kuukaudessa injektiona annetulla paliperidonipalmitaatilla. |
Hoidon aloittaminen uudelleen, kun Trevicta-hoidon väliin jäämisestä on kulunut 4–9 kuukautta | |||
Jos viimeinen Trevicta-annos oli | Anna kerran kuukaudessa injektiona annettavaa paliperidonipalmitaattia kaksi annosta viikon välein (hartialihakseen) | Anna sen jälkeen Trevicta-injektio (joko hartiaa tai pakaralihakseen) | |
Päivä 1 | Päivä 8 | 1 kuukausi päivän 8 jälkeen | |
175 mg | 50 mg | 50 mg | 175 mg |
263 mg | 75 mg | 75 mg | 263 mg |
350 mg | 100 mg | 100 mg | 350 mg |
525 mg | 100 mg | 100 mg | 525 mg |
a Ks. myös Lääkäreille ja terveydenhuollon ammattilaisille tarkoitetut tiedot injektioneulan valinnasta painon perusteella hartiaan annettavaa pistosta varten. | |||
Erityiset potilasryhmät
Iäkkäät
Valmisteen turvallisuutta ja tehoa yli 65 vuoden ikäisten potilaiden hoidossa ei ole osoitettu.
Trevicta-injektioiden suositusannostus iäkkäille potilaille, joiden munuaisten toiminta on normaali, on yleensä sama kuin nuoremmille potilaille, joiden munuaisten toiminta on normaali. Koska iäkkäiden potilaiden munuaisten toiminta saattaa olla heikentynyt, ks. munuaisten vajaatoimintaa sairastavia potilaita koskevat annostussuositukset jäljempänä kohdassa Munuaisten vajaatoiminta.
Munuaisten vajaatoiminta
Trevicta-valmistetta ei ole tutkittu munuaisten vajaatoimintaa sairastavilla potilailla (ks. kohta Farmakokinetiikka). Jos potilaalla on lievä munuaisten vajaatoiminta (kreatiniinipuhdistuma ≥ 50 – < 80 ml/min), annosta pitää säätää ja potilaan tila pitää vakauttaa kerran kuukaudessa injektiona annettavalla paliperidonipalmitaatilla, minkä jälkeen siirrytään Trevicta-hoitoon.
Trevicta-hoitoa ei suositella keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastaville potilaille (kreatiniinipuhdistuma < 50 ml/min).
Maksan vajaatoiminta
Trevicta-valmistetta ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla. Lievää tai keskivaikeaa maksan vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa. Tämä perustuu suun kautta annettavasta paliperidonista saatuun kokemukseen. Koska paliperidonin käyttöä vaikeaa maksan vajaatoimintaa sairastavien potilaiden hoitoon ei ole tutkittu, tämän potilasryhmän hoidossa suositellaan varovaisuutta (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Trevicta-valmisteen turvallisuutta ja tehoa lasten ja alle 18 vuoden ikäisten nuorten hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Trevicta on tarkoitettu annettavaksi vain lihakseen. Sitä ei saa antaa minkään muun antoreitin kautta. Injektion antaa aina terveydenhuollon ammattilainen vain täysinä kerta-annoksina. Valmiste injisoidaan hitaasti syvälle hartia- tai pakaralihakseen. Antopaikan vaihtamista pakaralihaksesta hartialihakseen (tai päinvastoin) seuraavia injektioita annettaessa on syytä harkita, jos antopaikassa esiintyy epämiellyttäviä tuntemuksia (ks. kohta Haittavaikutukset).
Trevicta-valmisteen saa antaa vain Trevicta-pakkauksen sisältämillä neuloilla (thin wall). Trevicta-valmistetta ei saa antaa kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin pakkaukseen sisältyvillä neuloilla eikä muilla kaupan olevilla neuloilla (ks. Tiedot lääkäreille ja terveydenhuollon ammattilaisille).
Esitäytetyn ruiskun sisältö pitää tarkistaa ennen antoa silmämääräisesti, ettei siinä ole vierashiukkasia eikä värimuutoksia havaittavissa. On tärkeää ravistaa ruiskua voimakkaasti rennolla ranteella ruiskun kärki ylöspäin suunnattuna vähintään 15 sekunnin ajan, jotta varmistetaan homogeeninen suspensio. Trevicta pitää antaa 5 minuutin kuluessa ravistamisesta. Jos ravistamisesta kuluu yli 5 minuuttia, ravista ruiskua uudelleen voimakkaasti vähintään 15 sekunnin ajan, jotta lääkevalmiste sekoittuu uudelleen suspensioksi. (Ks. Tiedot lääkäreille ja terveydenhuollon ammattilaisille).
Anto hartialihakseen
Sopiva neulakoko Trevicta-injektion antamiseen hartialihakseen määräytyy potilaan painon mukaan.
- Jos potilaan paino on ≥ 90 kg, käytettävä neulakoko (thin wall) on 1½", 22G (0,72 mm x 38,1 mm).
- Jos potilaan paino on < 90 kg, käytettävä neulakoko (thin wall) on 1", 22G (0,72 mm x 25,4 mm).
Injektio annetaan hartialihaksen keskiosaan. Hartialihakseen annettavat pistokset on annettava vuorotellen kumpaankin hartialihakseen.
Anto pakaralihakseen
Trevicta-valmistetta pakaralihakseen annettaessa käytettävä neulakoko (thin wall) on 1½", 22G (0,72 mm x 38,1 mm) potilaan painosta riippumatta. Injektio annetaan pakaralihaksen ylä‑ulkoneljännekseen. Pakaralihakseen annettavat pistokset on annettava vuorotellen kumpaankin pakaralihakseen.
Annon keskeytyminen
Jotta Trevicta‑injektion annon keskeytyminen voidaan välttää, esitäytettyä ruiskua pitää ravistaa voimakkaasti vähintään 15 sekunnin ajan enintään 5 minuuttia ennen sen antoa, jotta varmistetaan homogeeninen suspensio (ks. Tiedot lääkäreille ja terveydenhuollon ammattilaisille).
Jos annoksen injisoiminen kuitenkin jää kesken, ruiskuun jäljelle jäävää annosta ei saa injisoida uudelleen eikä uutta annosta saa antaa, koska annoksen todellisuudessa annettua osuutta on vaikea arvioida. Potilasta pitää seurata tarkoin ja hoitaa kliinisesti asianmukaisella tavalla seuraavaan hoitoaikataulun mukaiseen kolmen kuukauden välein annettavaan Trevicta‑injektioon saakka.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle, risperidonille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Käyttö potilaan akuutin agitaatiotilan tai vaikea-asteisen psykoottisen tilan hoitoon
Trevicta-valmistetta ei saa käyttää akuutin agitaatiotilan tai vaikea-asteisen psykoottisen tilan hoitoon, kun oireet on saatava nopeasti hallintaan.
QT-aika
Paliperidonihoidon määräämisessä on oltava varovainen, jos potilaan tiedetään sairastavan sydän- ja verisuonitautia tai hänen suvussaan tiedetään esiintyneen aiemmin QT-ajan pitenemistä tai jos valmistetta käytetään samanaikaisesti muiden sellaisten lääkkeiden kanssa, joiden epäillään aiheuttavan QT-ajan pitenemistä.
Maligni neuroleptioireyhtymä
Malignia neuroleptioireyhtymää on ilmoitettu paliperidonin käytön yhteydessä. Sen tyypillisiä oireita ovat kuume, lihasjäykkyys, autonomisen hermoston häiriöt, tajunnantason vaihtelut ja kohonnut seerumin kreatiinifosfokinaasipitoisuus. Kliinisenä löydöksenä voi lisäksi ilmetä myoglobinuriaa (rabdomyolyysi) ja äkillistä munuaisten vajaatoimintaa. Jos potilaalle ilmaantuu maligniin neuroleptioireyhtymään viittaavia oireita tai löydöksiä, paliperidonihoito on lopetettava. Trevicta‑valmisteen pitkä vaikutusaika on otettava huomioon.
Tardiivi dyskinesia / ekstrapyramidaalioireet
Dopamiinireseptoreita salpaavien lääkkeiden käyttöön on liittynyt tardiivin dyskinesian kehittymistä. Tardiiville dyskinesialle on tyypillistä erityisesti kielen ja/tai kasvojen tahdosta riippumattomat rytmiset liikkeet. Jos potilaalle ilmaantuu tardiivin dyskinesian oireita ja löydöksiä, kaikkien antipsykoottien, myös paliperidonin, käytön lopettamista on harkittava. Trevicta‑valmisteen pitkä vaikutusaika on otettava huomioon.
Hoidossa pitää olla varovainen, jos potilas käyttää samanaikaisesti sekä psykostimulantteja (esim. metyylifenidaattia) että paliperidonia, sillä toista tai kumpaakin lääkehoitoa säädettäessä voi ilmaantua ekstrapyramidaalioireita. Stimulanttihoito suositellaan lopettamaan vähitellen (ks. kohta Yhteisvaikutukset).
Leukopenia, neutropenia ja agranulosytoosi
Leukopeniaa, neutropeniaa ja agranulosytoosia on raportoitu paliperidonin käytön yhteydessä. Jos potilaalla on aiemmin ollut kliinisesti merkityksellinen pieni veren valkosolumäärä tai lääkkeestä aiheutunut leukopenia/neutropenia, potilasta on seurattava muutamien ensimmäisten hoitokuukausien aikana. Trevicta‑hoidon lopettamista on harkittava veren valkosolumäärän kliinisesti merkitykselliseen vähenemiseen viittaavien ensimmäisten oireiden ilmaantuessa, kun potilaalla ei ole muita tällaista aiheuttavia tekijöitä. Jos potilaalla on kliinisesti merkityksellistä neutropeniaa, potilasta on seurattava tarkasti kuumeen ja muiden infektion oireiden ja löydösten havaitsemiseksi ja hoidettava heti, jos tällaisia oireita tai löydöksiä ilmaantuu. Jos potilaalla on vaikea-asteinen neutropenia (absoluuttinen neutrofiilimäärä < 1 x 109/l), Trevicta-hoito on lopetettava ja veren valkosolumäärää on seurattava potilaan toipumiseen saakka. Trevicta‑valmisteen pitkä vaikutusaika on otettava huomioon.
Yliherkkyysreaktiot
Yliherkkyysreaktioita voi esiintyä, vaikka potilas olisi aikaisemmin sietänyt suun kautta otettavaa risperidonia tai suun kautta otettavaa paliperidonia (ks. kohta Haittavaikutukset).
Hyperglykemia ja diabetes mellitus
Paliperidonihoidon aikana on raportoitu hyperglykemiaa, diabetes mellitusta ja aiemmin puhjenneen diabeteksen pahenemista sekä diabeettista koomaa ja ketoasidoosia. Asianmukaista kliinistä seurantaa suositellaan psykoosilääkkeiden käyttöön liittyvien ohjeistojen mukaisesti. Trevicta-hoitoa saavia potilaita on seurattava hyperglykemian oireiden (kuten polydipsian, polyurian, polyfagian ja heikotuksen) havaitsemiseksi ja diabetes mellitusta sairastavia potilaita on seurattava säännöllisesti glukoositasapainon heikkenemisen havaitsemiseksi.
Painon nousu
Trevicta-hoidon yhteydessä on raportoitu huomattavaa painon nousua. Painoa on seurattava säännöllisesti.
Käyttö potilaille, joilla on prolaktiiniriippuvaisia kasvaimia
Kudosviljelmillä tehdyt tutkimukset viittaavat siihen, että prolaktiini saattaa stimuloida ihmisen rintarauhaskasvainten solujen kasvua. Vaikka tähänastisissa kliinisissä ja epidemiologisissa tutkimuksissa ei ole osoitettu tällä olevan selvää yhteyttä psykoosilääkkeiden käyttöön, potilaan hoidossa on oltava varovainen, jos tällä on merkitystä potilaan aiempien sairauksien suhteen. Paliperidonihoidossa on oltava varovainen, jos potilaalla on kasvain, joka saattaa olla prolaktiiniriippuvainen.
Ortostaattinen hypotensio
Paliperidoni saattaa aiheuttaa joillekin potilaille ortostaattista hypotensiota alfareseptoreja salpaavan vaikutuksensa vuoksi. Trevicta-valmisteella tehdyissä kliinisissä tutkimuksissa 0,3 % potilaista raportoi ortostaattiseen hypotensioon liittyneen haittavaikutuksen. Trevicta-valmistetta on annettava varoen potilaille, joiden tiedetään sairastavan sydän- ja verisuonitautia (esim. sydämen vajaatoiminta, sydäninfarkti tai iskemia, johtumishäiriöt), aivoverenkiertosairautta tai jos potilaalla on matalalle verenpaineelle altistava tila (esim. nestehukka ja hypovolemia).
Kouristuskohtaukset
Trevicta-hoidossa on oltava varovainen, jos potilaalla on aiemmin esiintynyt kouristuskohtauksia tai muu kouristuskynnystä mahdollisesti alentava tila.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavien potilaiden plasman paliperidonipitoisuudet ovat suurentuneet. Jos potilaalla on lievä munuaisten vajaatoiminta (kreatiniinipuhdistuma ≥ 50 – < 80 ml/min), annosta pitää säätää ja potilaan tila pitää vakauttaa kerran kuukaudessa injektiona annettavalla paliperidonipalmitaatilla, minkä jälkeen siirrytään Trevicta‑hoitoon. Trevicta-hoitoa ei suositella keskivaikeaa tai vaikeaa munuaisten vajaatoimintaa sairastaville potilaille (kreatiniinipuhdistuma < 50 ml/min). (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Maksan vajaatoiminta
Vaikeaa maksan vajaatoimintaa sairastavista potilaista (Child–Pugh‑luokka C) ei ole tietoja. Varovaisuutta suositellaan, jos paliperidonia annetaan tälle potilasryhmälle.
Iäkkäät dementiapotilaat
Trevicta-valmistetta ei ole tutkittu iäkkäillä dementiapotilailla. Trevicta-hoitoa ei suositella iäkkäille dementiapotilaille suurentuneen kokonaiskuolleisuuden ja aivoverisuoniin kohdistuvien haittavaikutusten riskin vuoksi.
Jäljempänä esitetyn risperidonia koskevan kokemuksen katsotaan pätevän myös paliperidoniin.
Kokonaiskuolleisuus
Meta‑analyysi 17 kontrolloidusta kliinisestä tutkimuksesta osoitti, että muilla atyyppisillä psykoosilääkkeillä, kuten risperidonilla, aripipratsolilla, olantsapiinilla ja ketiapiinilla, hoidettujen iäkkäiden dementiapotilaiden kuolleisuusriski oli suurentunut lumelääkehoitoon verrattuna. Risperidonihoitoa saaneiden potilaiden kuolleisuus oli 4 % verrattuna 3,1 %:iin lumelääkettä saaneista.
Aivoverisuoniin kohdistuvat haittavaikutukset
Joidenkin atyyppisten psykoosilääkkeiden, kuten risperidonin, aripipratsolin ja olantsapiinin, on satunnaistetuissa, lumekontrolloiduissa dementiapotilailla tehdyissä kliinisissä tutkimuksissa havaittu lisäävän aivoverisuoniin kohdistuvien haittavaikutusten riskin noin kolminkertaiseksi. Lisääntyneen riskin mekanismia ei tunneta.
Parkinsonin tauti ja Lewyn kappale ‑dementia
Lääkärin on punnittava riskejä hyötyihin nähden määrätessään Trevicta-hoidon Parkinsonin tautia tai Lewyn kappale ‑dementiaa sairastaville, koska kummallakin potilasryhmällä malignin neuroleptioireyhtymän riski saattaa olla suurentunut ja herkkyys psykoosilääkkeille saattaa olla lisääntynyt. Tämä lisääntynyt herkkyys voi ilmetä sekavuutena, turtuneisuutena, kehon asennon epävakautena ja siitä aiheutuvina toistuvina kaatumisina sekä ekstrapyramidaalioireina.
Priapismi
Alfareseptoreja salpaavien psykoosilääkkeiden (myös paliperidonin) on ilmoitettu aiheuttavan priapismia. Potilaita on kehotettava hakeutumaan kiireellisesti hoitoon, jos priapismin oireet eivät häviä 4 tunnin kuluessa.
Kehon lämpötilan säätely
Psykoosilääkkeiden käyttöön on liittynyt häiriöitä elimistön kyvyssä alentaa kehon ydinlämpötilaa. Asianmukaista varovaisuutta suositellaan määrättäessä Trevicta-valmistetta potilaalle, joka altistuu elimistön ydinlämpötilan nousua edistäville olosuhteille, joita ovat esim. raskas liikunta, altistuminen erittäin korkeille lämpötiloille, samanaikainen lääkitys antikolinergisesti vaikuttavilla lääkevalmisteilla tai altistuminen nestehukalle.
Laskimoveritulppa
Psykoosilääkkeiden käytön yhteydessä on raportoitu laskimoveritulppatapauksia. Psykoosilääkkeillä hoidettavilla potilailla on usein hankittuja laskimotulpan riskitekijöitä, joten kaikki laskimoveritulpan riskitekijät on selvitettävä ennen Trevicta-hoidon aloittamista ja hoidon aikana ja ehkäiseviin toimenpiteisiin on ryhdyttävä.
Antiemeettinen vaikutus
Prekliinisissä tutkimuksissa paliperidonilla havaittiin antiemeettistä vaikutusta. Tällainen vaikutus saattaa peittää ihmisellä tiettyjen lääkkeiden yliannoksen tai joidenkin sairauksien, kuten suolitukoksen, Reyen oireyhtymän ja aivokasvaimen, oireita ja löydöksiä.
Anto
Trevicta-injektion antamista vahingossa verisuoneen on vältettävä tarkoin.
IFIS-oireyhtymä
Alfa‑1a-adrenergisia reseptoreita salpaavilla lääkevalmisteilla, kuten Trevicta-valmisteella, hoitoa saaneilla potilailla on havaittu kaihileikkauksen aikana IFIS-oireyhtymää (intraoperative floppy iris syndrome eli pienen pupillin syndrooman variantti) (ks. kohta Haittavaikutukset).
IFIS-oireyhtymä saattaa lisätä silmäkomplikaatioriskiä leikkauksen aikana ja sen jälkeen. Alfa‑1a-adrenergisia reseptoreita salpaavien lääkevalmisteiden käytöstä parhaillaan tai aiemmin on kerrottava silmäleikkauksen tekevälle kirurgille ennen leikkausta. Alfa-1-adrenergisia reseptoreita salpaavien lääkkeiden käytön lopettamisen mahdollista hyötyä ennen kaihileikkausta ei ole varmistettu ja se on siten arvioitava psykoosilääkkeen käytön lopettamisesta aiheutuviin riskeihin nähden.
Apuaineet
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Varovaisuutta on syytä noudattaa määrättäessä Trevicta-valmistetta samanaikaiseen käyttöön QT-aikaa tunnetusti pidentävien lääkkeiden, esim. ryhmän IA rytmihäiriölääkkeiden (esim. kinidiinin, disopyramidin) ja ryhmän III rytmihäiriölääkkeiden (esim. amiodaronin, sotalolin), joidenkin antihistamiinien, joidenkin antibioottien (esim. fluorokinolonien), joidenkin muiden psykoosilääkkeiden ja joidenkin malarialääkkeiden (esim. meflokiinin) kanssa. Tämä luettelo on vain suuntaa-antava eikä se ole täydellinen.
Trevicta-valmisteen mahdolliset vaikutukset muihin lääkkeisiin
Paliperidoni ei oletettavasti aiheuta kliinisesti merkittäviä farmakokineettisiä yhteisvaikutuksia sellaisten lääkevalmisteiden kanssa, jotka metaboloituvat sytokromi P450 -isoentsyymien välityksellä.
Koska paliperidoni vaikuttaa ensisijaisesti keskushermostoon (ks. kohta Haittavaikutukset), Trevicta-valmistetta on käytettävä varoen yhdessä muiden keskushermostoon vaikuttavien lääkkeiden (esim. anksiolyytit, useimmat psykoosilääkkeet, unilääkkeet, opiaatit jne.) tai alkoholin kanssa.
Paliperidoni saattaa kumota levodopan ja muiden dopamiiniagonistien vaikutuksen. Jos tämä lääkeyhdistelmä katsotaan välttämättömäksi, etenkin loppuvaiheen Parkinsonin taudin hoidossa, kustakin lääkkeestä on määrättävä pienin tehokas annos.
Koska Trevicta voi aiheuttaa ortostaattista hypotensiota (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet), sen käytössä yhdessä muiden ortostaattista hypotensiota mahdollisesti aiheuttavien lääkevalmisteiden (esim. muut psykoosilääkkeet, trisykliset masennuslääkkeet) kanssa saatetaan havaita additiivinen vaikutus.
Varovaisuutta suositellaan, jos paliperidonia käytetään yhdistelmänä muiden sellaisten lääkkeiden kanssa, joiden tiedetään alentavan kouristuskynnystä (fentiatsiinit tai butyrofenonit, trisykliset masennuslääkkeet tai serotoniinin takaisinoton estäjät, tramadoli, meflokiini, jne.).
Paliperidonidepottablettien (12 mg kerran päivässä) käyttö yhdessä valproaattidepottablettien (500–2 000 mg kerran päivässä) kanssa ei vaikuttanut valproaatin vakaan tilan farmakokinetiikkaan.
Trevicta-valmisteen ja litiumin välisiä yhteisvaikutuksia ei ole tutkittu, mutta farmakokineettisten yhteisvaikutusten esiintyminen ei ole todennäköistä.
Muiden lääkkeiden mahdolliset vaikutukset Trevicta-valmisteeseen
Tutkimukset in vitro osoittavat, että CYP2D6 ja CYP3A4 saattavat osallistua vähäisessä määrin paliperidonin metaboliaan, mutta tutkimuksissa in vitro ja in vivo ei saatu viitteitä siitä, että näillä isoentsyymeillä olisi merkittävää osuutta paliperidonin metaboliassa. Kun paliperidonia annettiin suun kautta samanaikaisesti voimakkaan CYP2D6:n estäjän, paroksetiinin, kanssa, kliinisesti merkittävää vaikutusta paliperidonin farmakokinetiikkaan ei havaittu.
Suun kautta kerran päivässä annettavan depotmuotoisen paliperidonin samanaikainen käyttö karbamatsepiinin kanssa karbamatsepiiniannoksella 200 mg kahdesti päivässä pienensi paliperidonin keskimääräistä vakaan tilan huippupitoisuutta (Cmax) ja altistusta (AUC) noin 37 %. Tämä pieneneminen johtui merkittävältä osin paliperidonin munuaispuhdistuman lisääntymisestä 35 %:lla, mikä todennäköisesti johtui karbamatsepiinin munuaisten P‑glykoproteiinia indusoivasta vaikutuksesta. Muuttumattomana virtsaan erittyneen vaikuttavan aineen määrän pieni väheneminen viittaa vain vähäiseen vaikutukseen paliperidonin CYP‑metaboliaan tai biologiseen hyötyosuuteen karbamatsepiinin samanaikaisen käytön yhteydessä. Suuremmat karbamatsepiiniannokset saattavat pienentää paliperidonin pitoisuutta plasmassa enemmän. Kun karbamatsepiinihoito aloitetaan, Trevicta‑annos on tarkistettava ja annosta on tarvittaessa suurennettava. Kun karbamatsepiinihoito lopetetaan, Trevicta‑annos on myös tarkistettava ja annosta on tarvittaessa pienennettävä. Trevicta‑valmisteen pitkä vaikutusaika on otettava huomioon.
Kun 12 mg:n paliperidonidepottabletti annettiin suun kautta kerta‑annoksena valproaattidepottablettien (kaksi 500 mg:n tablettia kerran päivässä) kanssa, paliperidonin huippupitoisuus (Cmax) ja altistus (AUC) suurenivat noin 50 %, todennäköisesti lisääntyneen imeytymisen seurauksena. Koska vaikutusta systeemiseen puhdistumaan ei havaittu, valproaattidepottablettien ja lihakseen annettavien Trevicta-injektioiden välillä ei odoteta esiintyvän kliinisesti merkityksellisiä yhteisvaikutuksia. Tätä yhteisvaikutusta ei ole tutkittu Trevicta-valmisteella.
Trevicta-valmisteen samanaikainen käyttö risperidonin tai suun kautta otettavan paliperidonin kanssa
Risperidonin pääasiallinen aktiivinen metaboliitti on paliperidoni, joten Trevicta-valmisteen pitkään kestävässä samanaikaisessa käytössä risperidonin tai suun kautta otettavan paliperidonin kanssa on noudatettava varovaisuutta. Trevicta-valmisteen ja muiden psykoosilääkkeiden samanaikaisesta käytöstä on vähän turvallisuutta koskevaa tietoa.
TREVICTA-valmisteen samanaikainen käyttö psykostimulanttien kanssa
Psykostimulanttien (esim. metyylifenidaatin) käytöstä yhdistelmänä paliperidonin kanssa voi aiheutua ekstrapyramidaalioireita, kun joko toista tai kumpaakin lääkehoitoa muutetaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Raskaus ja imetys
Raskaus
Ei ole olemassa tarkkoja tietoja paliperidonin käytöstä raskaana oleville naisille. Lihakseen injektiona annettu paliperidonipalmitaatti ja suun kautta annettu paliperidoni eivät olleet eläinkokeissa teratogeenisia, mutta muuntyyppistä lisääntymistoksisuutta havaittiin (ks. kohta Prekliiniset tiedot turvallisuudesta). Paliperidonille kolmannen raskauskolmanneksen aikana altistuneilla vastasyntyneillä on ekstrapyramidaali- ja lääkevieroitusoireiden riski. Oireiden vaikeusaste ja kesto synnytyksen jälkeen voi vaihdella. Näitä vastasyntyneillä esiintyviä oireita voivat olla agitaatio, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeus tai syömishäiriöt. Siksi vastasyntyneiden vointia pitää seurata huolellisesti. Trevicta-valmistetta ei saa käyttää raskauden aikana, ellei se ole selvästi välttämätöntä.
Trevicta-valmisteen pitkä vaikutusaika pitää ottaa huomioon, sillä paliperidonia on havaittu plasmassa 18 kuukauteen saakka Trevicta‑kerta-annoksen antamisen jälkeen. Äidin altistuminen Trevicta-valmisteelle ennen raskautta ja raskauden aikana saattaa aiheuttaa vastasyntyneelle lapselle haittavaikutuksia.
Imetys
Paliperidoni erittyy rintamaitoon siinä määrin, että hoitoannoksina imettävälle äidille annetusta lääkkeestä aiheutuu todennäköisesti vaikutuksia imetettävälle lapselle. Trevicta-valmisteen pitkä vaikutusaika pitää ottaa huomioon, sillä paliperidonia on havaittu plasmassa 18 kuukauteen saakka Trevicta‑kerta-annoksen antamisen jälkeen. Imetettävälle lapselle saattaa näin ollen aiheutua riski jo huomattavasti ennen imetystä annetusta Trevicta-valmisteesta. Trevicta‑valmistetta ei saa käyttää imetysaikana.
Hedelmällisyys
Nonkliinisissä tutkimuksissa ei havaittu oleellisia vaikutuksia hedelmällisyyteen.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Paliperidonilla voi olla vähäinen tai kohtalainen vaikutus ajokykyyn ja koneidenkäyttökykyyn, koska keskushermostoon ja näkökykyyn kohdistuvat vaikutukset, kuten sedaatio, uneliaisuus, pyörtyminen, näön sumeneminen, ovat mahdollisia (ks. kohta Haittavaikutukset). Potilasta on siksi kehotettava olemaan ajamatta autoa ja käyttämättä koneita, kunnes hänen yksilöllinen herkkyytensä Trevicta-valmisteelle tiedetään.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Trevicta‑valmisteella tehdyissä kahdessa kaksoissokkoutetussa kontrolloidussa kliinisessä tutkimuksessa mukana olleilla potilailla yleisimmin (≥ 5 %) havaitut haittavaikutukset olivat painon nousu, ylähengitystieinfektio, ahdistuneisuus, päänsärky, unettomuus ja injektiokohdan reaktio.
Haittavaikutusten taulukkomuotoinen yhteenveto
Seuraavassa esitetään kaikki paliperidonin käytön yhteydessä ilmoitetut haittavaikutukset, joiden esiintyvyys on arvioitu paliperidonipalmitaatilla tehtyjen kliinisten tutkimusten perusteella. Haittavaikutukset esitetään seuraavina termeinä ja esiintyvyyksinä: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000), hyvinharvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Elinjärjestelmäluokka | Haittavaikutukset | ||||
Yleisyys | |||||
Hyvin yleinen | Yleinen | Melko harvinainen | Harvinainen | Tuntematona | |
Infektiot | ylähengitystieinfektio, virtsatieinfektio, influenssa | keuhkokuume, keuhkoputkitulehdus, hengitystieinfektio, sinuiitti, kystiitti, korvatulehdus, tonsilliitti, kynsisilsa, selluliitti, ihonalainen absessi | silmätulehdus, akarodermatiitti | ||
Veri ja imukudos | vähentynyt veren valkosolumäärä, anemia | neutropenia, trombosytopenia, lisääntynyt eosinofiilimäärä | agranulosytoosi | ||
Immuunijärjestelmä | yliherkkyys | anafylaktinen reaktio | |||
Umpieritys | hyperprolaktinemiab |
| antidiureettisen hormonin epäasianmukainen eritys, glukoosin esiintyminen virtsassa | ||
Aineenvaihdunta ja ravitsemus | hyperglykemia, painon nousu, painon lasku, heikentynyt ruokahalu | diabetes mellitusd, hyperinsulinemia, lisääntynyt ruokahalu, anoreksia, suurentunut veren triglyseridipitoisuus, suurentunut veren kolesterolipitoisuus | diabeettinen ketoasidoosi, hypoglykemia, polydipsia | vesimyrkytystila | |
Psyykkiset häiriöt | unettomuuse | agitaatio, masennus, ahdistuneisuus | unihäiriöt, mania, heikentynyt sukupuolivietti, hermostuneisuus, painajaiset | katatonia, sekavuustila, unissakävely, tunnetilojen latistuminen, anorgasmia | unen aikainen syömishäiriö |
Hermosto | parkinsonismic, akatisiac, sedaatio/ uneliaisuus, dystoniac, heitehuimaus, pakkoliikkeetc, vapina, päänsärky | tardiivi dyskinesia, pyörtyminen, psykomotorinen hyperaktiivisuus, asentohuimaus, keskittymiskyvyn häiriöt, dysartria, makuaistin häiriöt, hypestesia, parestesia | maligni neuroleptioireyhtymä, aivoiskemia, reagoimattomuus ärsykkeisiin, tajunnanmenetys, alentunut tajunnantaso, kouristuksete, tasapainon häiriöt, koordinaatiokyvyn häiriöt, pään vapina | diabeettinen kooma | |
Silmät | näön sumeneminen, sidekalvotulehdus, kuivat silmät | glaukooma, silmien liikehäiriö, silmien pyöritys, valonarkuus, lisääntynyt kyynelnesteen eritys, silmien verekkyys | IFIS-oireyhtymä (leikkauksen aikana) | ||
Kuulo ja tasapainoelin | kiertohuimaus, tinnitus, korvakipu | ||||
Sydän | takykardia | eteis-kammiokatkos, johtumishäiriö, EKG:ssä todettava QT-ajan pidentyminen, posturaalinen ortostaattinen takykardiasyndrooma, bradykardia, poikkeava EKG, sydämentykytys | eteisvärinä, sinusarytmia | ||
Verisuonisto | hypertensio | hypotensio, ortostaattinen hypotensio | keuhkoembolia, laskimotromboosi, punastelu | iskemia | |
Hengityselimet, rintakehä ja välikarsina | yskä, nenän tukkoisuus | hengenahdistus, nielun ja kurkunpään kipu, nenäverenvuoto | uniapnea-oireyhtymä, keuhkojen verentungos, hengitysteiden verentungos, hengitysäänen rahinat, hengityksen vinkuminen | hyperventilaatio, aspiraatiokeuhkokuume, dysfonia | |
Ruoansulatuselimistö | vatsakipu, oksentelu, pahoinvointi, ummetus, ripuli, ruoansulatushäiriöt, hammassärky | epämukava tunne vatsassa, gastroenteriitti, dysfagia, suun kuivuminen, ilmavaivat | haimatulehdus, suolitukos, kielen turpoaminen, ulosteen pidätyskyvyttömyys, fekalooma, huulitulehdus | ileus | |
Maksa ja sappi | suurentunut transaminaasipitoisuus | suurentunut gammaglutamyyli-transferaasipitoisuus, suurentunut maksa-entsyymipitoisuus | ikterus | ||
Iho ja ihonalainen kudos |
| urtikaria, kutina, ihottuma, alopesia, ekseema, kuiva iho, eryteema, akne | lääkeaineihottuma, hyperkeratoosi, seborrooinen ihotulehdus, hilse | Stevens-Johnsonin oireyhtymä/toksinen epidermaalinen nekrolyysi, angioedeema, ihon värinmuutos | |
Luusto, lihakset ja sidekudos | tuki- ja liikuntaelimistön kipu, selkäkipu, nivelkipu | suurentunut veren kreatiinifosfokinaasi-pitoisuus, lihasspasmit, nivelten jäykkyys, lihasheikkous | rabdomyolyysi, nivelten turpoaminen | asennon poikkeavuudet | |
Munuaiset ja virtsatiet | virtsankarkailu, pollakisuria, dysuria | virtsaumpi | |||
Raskauteen, synnytykseen ja perinataalikauteen liittyvät haitat | vastasyntyneen lääkeainevieroitusoireyhtymä (ks. kohta Raskaus ja imetys) | ||||
Sukupuolielimet ja rinnat | amenorrea | erektiohäiriö, ejakulaatiohäiriö, kuukautishäiriöte, gynekomastia, maidonvuoto, seksuaalinen toimintahäiriö, rintojen kipu | priapismi, epämukava tunne rinnoissa, rintojen turvotus, rintojen suureneminen, erite emättimestä |
| |
Yleisoireet ja antopaikassa todettavat haitat | kuume, astenia, väsymys, injektiokohdan reaktiot | kasvojen turvotus, turvotuse, kohonnut ruumiinlämpö, poikkeava kävely, rintakipu, epämukava tunne rintakehässä, huonovointisuus, kovettuma | hypotermia, vilunväristykset, jano, lääkevieroitusoireyhtymä, injektiokohdan absessi, injektiokohdan selluliitti, injektiokohdan kysta, injektiokohdan hematooma | alentunut ruumiinlämpö, injektiokohdan nekroosi, injektiokohdan haavauma | |
| Vammat, myrkytykset ja hoitokomplikaatiot | kaatuminen | ||||
a Näiden haittavaikutusten esiintyvyydeksi on määritelty ”tuntematon”, koska niitä ei havaittu paliperidonipalmitaatilla tehdyissä kliinisissä tutkimuksissa. Ne perustuvat joko valmisteen markkinoille tulon jälkeiseen spontaaniraportointiin, jolloin esiintyvyyttä ei voi määrittää, tai risperidonilla (kaikilla lääkemuodoilla) tai suun kautta otettavalla paliperidonilla tehtyihin kliinisiin tutkimuksiin ja/tai valmisteen markkinoille tulon jälkeisiin raportteihin. b Ks. hyperprolaktinemia alempana. c Ks. ekstrapyramidaalioireet alempana. d Diabetes mellitusta raportoitiin lumekontrolloiduissa tutkimuksissa 0,32 %:lla paliperidonipalmitaattia kerran kuukaudessa injektioina saaneista tutkimuspotilaista verrattuna 0,39 %:n esiintyvyyteen lumeryhmässä. Kokonaisilmaantuvuus kaikissa kliinisissä tutkimuksissa paliperidonipalmitaattia kerran kuukaudessa injektioina saaneilla potilailla oli 0,65 %. eUnettomuus käsittää: nukahtamisvaikeudet, katkonaisen unen. Kouristukset käsittävät: grand mal ‑kouristukset. Turvotus käsittää: yleistyneen turvotuksen, raajojen turvotuksen, kuoppaturvotuksen. Kuukautishäiriöt käsittävät: kuukautisten viivästyminen, epäsäännölliset kuukautiset, harvoin esiintyvät kuukautiset. | |||||
Risperidonivalmisteiden käytön yhteydessä havaitut haittavaikutukset
Paliperidoni on risperidonin aktiivinen metaboliitti, joten näiden yhdisteiden (sekä suun kautta otettavien että injektiona annettavien lääkemuotojen) haittavaikutusprofiilit ovat toistensa kannalta olennaiset.
Joidenkin haittavaikutusten kuvaus
Anafylaktinen reaktio
Markkinoille tulon jälkeen anafylaktisia reaktioita on raportoitu esiintyneen harvoin kerran kuukaudessa injektiona annettavan paliperidonin käytössä potilailla, jotka ovat aikaisemmin sietäneet suun kautta otettavaa risperidonia tai paliperidonia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Injektiokohdan reaktiot
Trevicta-valmisteella tehdyissä kliinisissä tutkimuksissa 5,3 % tutkittavista raportoi injektiokohtaan liittyneen haittavaikutuksen. Yksikään näistä tapahtumista ei ollut vakava eikä johtanut hoidon keskeyttämiseen. Tutkijat arvioivat, että kovettumat, punoitus ja turvotus hävisivät tai olivat lieviä ≥ 95 %:ssa arvioiduista tapauksista. Tutkittavan VAS‑kipujanalla (visual analogue scale) arvioima pistoskohdan kipu oli vähäistä ja sen voimakkuus väheni ajan mittaan.
Ekstrapyramidaalioireet
Trevicta-valmisteella tehdyissä kliinisissä tutkimuksissa raportoitiin akatisiaa 3,9 %:lla, pakkoliikkeitä 0,8 %:lla, dystoniaa 0,9 %:lla, parkinsonismia 3,6 %:lla ja vapinaa 1,4 %:lla tutkittavista.
Ekstrapyramidaalioireet käsittivät seuraavien termien yhdistetyn analyysin: parkinsonismi (mukaan lukien ekstrapyramidaalihäiriö, ekstrapyramidaalioireet, on- ja off-tilat, Parkinsonin tauti, akineettinen kriisi, lisääntynyt syljeneritys, tuki- ja liikuntaelimistön jäykkyys, parkinsonismi, kuolaaminen, hammasratasjäykkyys, hidasliikkeisyys, hypokinesia, kasvojen ilmeettömyys, lihasten kireys, akinesia, niskan jäykkyys, lihasjäykkyys, parkinsonistinen kävely ja epänormaali otsakolmion refleksi, parkinsonistinen lepovapina), akatisia (mukaan lukien akatisia, levottomuus, hyperkinesia ja levottomat jalat ‑oireyhtymä), dyskinesia (dyskinesia, korea, liikehäiriö, lihasten nykiminen, koreoatetoosi, atetoosi ja myoklonus), dystonia (mukaan lukien dystonia, servikaalinen spasmi, emprostotonus, okulogyyrinen kriisi, oromandibulaarinen dystonia, kouristusirvistys, tetania, lisääntynyt lihasjänteys, torticollis, tahattomat lihassupistukset, lihaskontraktuura, blefarospasmi, silmämunan antero-posteriorinen liike, kielen halvaus, kasvospasmi, laryngospasmi, myotonia, opistotonus, suunielun spasmi, pleurototonus, kielikramppi ja leukalukko) ja vapina.
Painon nousu
Pitkäkestoisessa satunnaistetussa hoidon lopettamista koskeneessa tutkimuksessa painon poikkeavaa ≥ 7 %:n nousua kaksoissokkoutetusta lähtötilanteesta kaksoissokkoutettuun päätetapahtumaan mennessä raportoitiin 10 %:lla Trevicta-ryhmän tutkittavista ja 1 %:lla lumeryhmän tutkittavista. Sitä vastoin poikkeavaa painon laskua (≥ 7 %) raportoitiin kaksoissokkoutetusta lähtötilanteesta kaksoissokkoutettuun päätetapahtumaan mennessä 1 %:lla Trevicta-ryhmän tutkittavista ja 8 %:lla lumeryhmän tutkittavista. Painon keskimääräinen muutos kaksoissokkoutetusta lähtötilanteesta kaksoissokkoutettuun päätetapahtumaan mennessä oli Trevicta-ryhmässä +0,94 kg ja lumeryhmässä ‑1,28 kg.
Hyperprolaktinemia
Pitkäkestoisen satunnaistetun hoidon lopettamista koskeneen tutkimuksen kaksoissokkoutetun vaiheen aikana havaittiin prolaktiinipitoisuuden kohoamista viitearvoja suuremmaksi (miehillä > 13,13 ng/ml ja naisilla > 26,72 ng/ml) suuremmalla osalla Trevicta-ryhmän naisista ja miehistä (9 % vs. 3 %) verrattuna lumeryhmään (5 % vs. 1 %). Trevicta‑ryhmässä keskimääräinen muutos kaksoissokkoutetusta lähtötilanteesta kaksoissokkoutettuun päätetapahtumaan oli miehillä +2,90 ng/ml (verrattuna ‑10,26 ng/ml lumeryhmässä) ja naisilla +7,48 ng/ml (verrattuna ‑32,93 ng/ml lumeryhmässä). Yhdellä Trevicta-ryhmään kuuluneella naisella (2,4 %) esiintyi haittavaikutuksena amenorreaa, kun taas lumeryhmään kuuluneilla naisilla ei havaittu prolaktiiniin mahdollisesti liittyviä haittavaikutuksia. Kummankaan ryhmän miehillä ei esiintynyt prolaktiiniin mahdollisesti liittyviä haittavaikutuksia.
Luokkavaikutukset
Psykoosilääkkeiden käytön yhteydessä saattaa esiintyä QT-ajan pitenemistä, kammioperäisiä rytmihäiriöitä (kammiovärinää, kammioperäistä takykardiaa), äkillinen selittämätön kuolema, sydänpysähdys ja kääntyvien kärkien takykardiaa (torsade de pointes).
Psykoosilääkkeiden käytön yhteydessä on raportoitu laskimoveritulppatapauksia, mukaan lukien keuhkoemboliaa ja syviä laskimoveritulppia (esiintyvyys tuntematon).
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Oireet
Odotettavissa olevat oireet ja löydökset johtuvat yleensä paliperidonin tunnettujen farmakologisten vaikutusten, kuten uneliaisuuden, sedaation, takykardian, matalan verenpaineen, QT-ajan pitenemisen ja ekstrapyramidaalioireiden, ylikorostumisesta. Suun kautta otetun paliperidonin yliannostuksen yhteydessä potilailla on raportoitu kääntyvien kärkien takykardiaa (torsade de pointes) ja kammiovärinää. Akuutin yliannostuksen yhteydessä on pidettävä mielessä mahdollisuus useiden lääkkeiden osallisuudesta.
Hoito
Hoitotarpeen ja potilaan toipumisen arvioinnissa on otettava huomioon depotmuotoisen lääkevalmisteen luonne ja paliperidonin pitkä puoliintumisaika. Paliperidonille ei ole erityistä vasta-ainetta. Yleisiä elintoimintoja tukevia hoitotoimenpiteitä on käytettävä. Hengitystiet on avattava ja pidettävä avoimina ja riittävä hapensaanti ja ventilaatio on varmistettava.
Verenkiertoelimistön seuranta on aloitettava heti ja sen tulee käsittää jatkuva EKG-seuranta mahdollisten rytmihäiriöiden varalta. Matala verenpaine ja verenkiertokollapsi on hoidettava asianmukaisin hoitotoimenpitein, kuten antamalla nestettä ja/tai sympatomimeettisiä lääkeaineita laskimoon. Jos potilaalla ilmenee vaikea-asteisia ekstrapyramidaalioireita, hänelle on annettava antikolinergistä lääkeainetta. Potilaan tilaa on seurattava tarkoin hänen toipumiseensa asti.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Psykoosi- ja neuroosilääkkeet sekä unilääkkeet, muut psykoosilääkkeet, ATC-koodi: N05AX13
Trevicta sisältää raseemisen seoksen (+)‑ ja (‑)‑paliperidonia.
Vaikutusmekanismi
Paliperidoni on monoamiinivaikutuksia selektiivisesti salpaava lääkeaine, jonka farmakologiset ominaisuudet ovat erilaiset perinteisiin neurolepteihin nähden. Paliperidoni sitoutuu voimakkaasti serotonergisiin 5‑HT2‑reseptoreihin ja dopaminergisiin D2‑reseptoreihin. Paliperidoni salpaa myös alfa-1‑adrenergisia reseptoreita ja hieman vähäisemmässä määrin H1‑histaminergisia ja alfa-2‑adrenergisia reseptoreita. Paliperidonin (+)‑ ja (‑)‑enantiomeerien farmakologinen vaikutus on laadullisesti ja määrällisesti samankaltainen.
Paliperidoni ei sitoudu kolinergisiin reseptoreihin. Vaikka paliperidoni onkin voimakas D2‑reseptoriantagonisti, jonka uskotaan lievittävän skitsofrenian oireita, se aiheuttaa vähemmän katalepsiaa ja heikentää motorisia toimintoja vähemmän kuin perinteiset neuroleptit. Vallitseva sentraalinen serotoniiniantagonismi saattaa vähentää paliperidonin taipumusta aiheuttaa ekstrapyramidaalisia haittavaikutuksia.
Kliininen teho
Trevicta‑valmisteen tehoa tutkittiin skitsofreniaa sairastavien tutkittavien ylläpitohoitoon potilailla, jotka olivat olleet riittävässä hoitotasapainossa vähintään neljän kuukauden ajan kuukauden välein injektiona annetulla paliperidonilla, mistä kaksi viimeistä annosta oli samaa annosvahvuutta. Tätä arvioitiin yhdessä pitkäkestoisessa, satunnaistetussa, kaksoissokkoutetussa lumekontrolloidussa hoidon lopettamista koskeneessa tutkimuksessa ja yhdessä pitkäkestoisessa, kaksoissokkoutetussa, aktiivisella aineella kontrolloidussa vertailukelpoisuustutkimuksessa. Kummankin tutkimuksen ensisijainen päätetapahtuma oli relapsi.
Pitkäkestoisen satunnaistetun hoidon lopettamista koskeneen tutkimuksen avoimeen siirtymisjaksoon otettiin mukaan 506 aikuista tutkittavaa, jotka täyttivät skitsofrenian DSM‑IV‑kriteerit. Nämä tutkittavat saivat kerran kuukaudessa injektiona annettavaa paliperidonipalmitaattia joustavalla annostuksella (50–150 mg) hartia‑ tai pakaralihakseen 17 viikon ajan (annosta säädettiin viikoilla 5 ja 9). Sen jälkeen yhteensä 379 tutkittavaa sai avoimen vakauttamisjakson aikana Trevicta‑kerta‑annoksen joko hartia- tai pakaralihakseen (annos oli 3,5-kertainen viimeiseen kerran kuukaudessa annettavaan paliperidonipalmitaattiannokseen verrattuna). Tutkittavat, joiden tilan katsottiin olevan kliinisesti vakaa 12 viikon vakauttamisjakson lopussa, satunnaistettiin suhteessa 1:1 saamaan kaksoissokkoutetun jakson aikana joko Trevicta‑ tai lumehoitoa vaihtelevan pituisen ajan (Trevicta‑annos oli sama kuin vakauttamisjakson viimeinen annos, ja tätä käytettiin vakioannoksena koko kaksoissokkoutetun jakson ajan). Tämän jakson aikana 305 tutkittavaa, joiden tila oli oireiden suhteen vakaa, satunnaistettiin jatkamaan hoitoa joko Trevicta-valmisteella (n = 160) tai lumevalmisteella (n = 145) relapsiin, hoidon keskeyttämiseen tai tutkimuksen päättymiseen saakka. Tehon ensisijainen muuttuja oli aika ensimmäiseen relapsiin. Kun 283 tutkittavaa oli satunnaistettu ja 42 relapsia havaittu, tehtiin ennalta suunniteltu välianalyysi, jonka perusteella tutkimus lopetettiin. Loppuanalyysin (n = 305) perusteella 42 tutkittavalla (29,0 %) lumeryhmässä ja 14 tutkittavalla (8,8 %) Trevicta-ryhmässä oli esiintynyt relapsi kaksoissokkovaiheen aikana. Riskisuhde oli 3,81 (95 %:n luottamusväli: 2,08–6,99), mikä osoittaa, että Trevicta vähensi relapsin riskiä 74 % lumevalmisteeseen verrattuna. Kuvassa 1 esitetään relapsin tapahtumiseen kuluneen ajan Kaplan-Meier-kuvaaja hoitoryhmittäin. Ryhmien välillä oli merkitsevä (p < 0,0001) ja Trevicta-valmisteen kannalta edullinen ero relapsin tapahtumiseen kuluneessa ajassa. Lumeryhmässä relapsin tapahtumiseen kulunut aika (mediaani 395 päivää) oli merkitsevästi lyhyempi kuin Trevicta-ryhmässä (mediaania ei voitu arvioida, koska relapsin saaneiden tutkittavien prosenttiosuus oli pieni [8,8 %]).
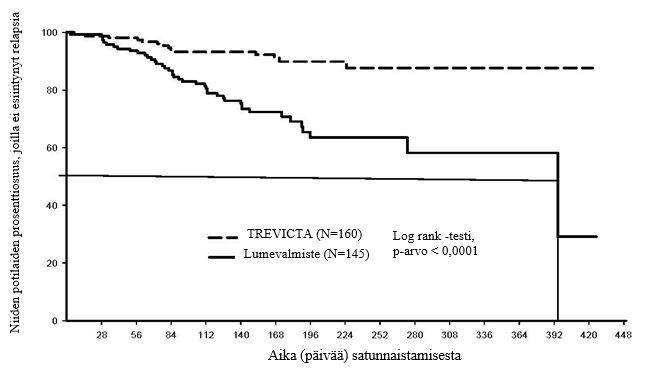
Kuva 1. Kaplan-Meier-kuvaaja ajasta relapsiin, loppuanalyysi
Vertailukelpoisuustutkimuksen avoimeen vaiheeseen otettiin mukaan 1 429 akuutisti sairasta skitsofrenian DSM‑IV‑kriteerit täyttänyttä tutkittavaa (lähtötilanteen keskimääräiset PANSS‑kokonaispisteet: 85,7), ja he saivat hoitona kerran kuukaudessa injektiona annettavaa paliperidonipalmitaattia 17 viikon ajan. Annosta voitiin säätää (eli 50 mg, 75 mg, 100 mg tai 150 mg) viikoilla 5 ja 9 annettavien injektioiden yhteydessä, ja injektiot voitiin antaa hartia- tai pakaralihakseen. Satunnaistamiskriteerit viikoilla 14 ja 17 täyttäneistä tutkittavista 1 016 satunnaistettiin suhteessa 1:1 saamaan edelleen kuukausittain kerran kuukaudessa injektiona annettavaa paliperidonipalmitaattia tai siirtymään Trevicta‑hoitoon 48 viikon ajaksi 3,5‑kertaisella annoksella verrattuna viikoilla 9 ja 13 annettuihin kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin annoksiin. Tutkittavat saivat Trevicta‑hoitoa kerran kolmessa kuukaudessa, ja muina kuukausina he saivat lumeinjektion sokkoutuksen säilyttämiseksi. Tehon ensisijainen päätetapahtuma tässä tutkimuksessa oli niiden tutkittavien prosenttiosuus, joilla ei 48 viikon Kaplan–Meier-estimaatin perusteella ollut esiintynyt relapsia 48 viikon kaksoissokkoutetun jakson päättyessä (Trevicta: 91,2 %, kerran kuukaudessa injektiona annettava paliperidoni: 90,0 %). Kummankaan ryhmän ajan mediaania relapsiin ei voitu arvioida, koska tutkittavien, joilla relapsi esiintyi, prosenttiosuus oli liian pieni. Hoitoryhmien välinen ero (95 %:n luottamusväli) oli 1,2 % (‑2,7 %–5,1 %) ja se täyttää ‑10 %:n marginaaliin perustuvan vertailukelpoisuuskriteerin. Trevicta‑hoitoryhmä oli siten vertailukelpoinen kerran kuukaudessa injektioita saaneeseen paliperidonipalmitaattiin nähden. Avoimen vakauttamisjakson aikana havaitun toimintakyvyn paranemisen, jota mitattiin PSP‑asteikolla (Personal and Social Performance scale), todettiin säilyneen kummassakin hoitoryhmässä kaksoissokkoutetun jakson ajan.
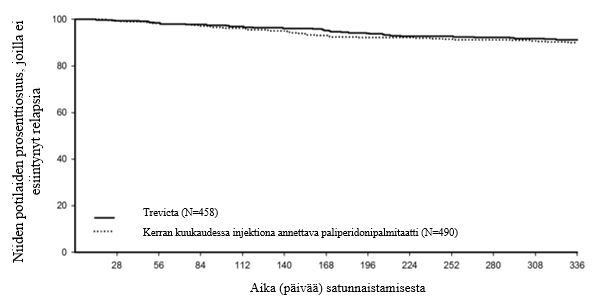
Kuva 2. Trevicta‑hoitoa ja kerran kuukaudessa injektiona annettavaa paliperidonipalmitaattia saaneiden ryhmien välillä tehdyn ajasta relapsiin vertailun Kaplan–Meierin kuvaaja
Tehon tulokset olivat kummassakin tutkimuksessa yhdenmukaiset kaikissa potilasryhmissä (sukupuoli, ikä ja rotu).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Trevicta-valmisteen käytöstä skitsofrenian hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen ja jakautuminen
Koska paliperidonipalmitaatin vesiliukoisuus on hyvin pieni, paliperidonipalmitaatin kerran kolmessa kuukaudessa annettava lääkemuoto liukenee lihakseen annetun injektion jälkeen hitaasti ennen hydrolysoitumista paliperidoniksi ja imeytymistä systeemiseen verenkiertoon. Vaikuttavan aineen vapautuminen alkaa jo päivänä 1 ja jatkuu 18 kuukauden ajan.
Tässä kappaleessa esitetyt tiedot perustuvat populaatiofarmakokineettiseen analyysiin. Paliperidonin pitoisuus plasmassa suurenee vähitellen lihakseen annetun Trevicta-kerta-annoksen jälkeen, ja huippupitoisuus plasmassa saavutetaan 30–33 vuorokaudessa (Tmax, mediaani). Hartialihakseen annoksina 175–525 mg lihaksensisäisesti annetun Trevicta-injektion jälkeen havaittiin keskimäärin 11–12 % suurempi huippupitoisuus (Cmax) verrattuna pakaralihakseen annettuun injektioon. Trevicta-valmisteen vapautumisprofiili ja annostusohjelma ylläpitävät pitoisuuden pitkään terapeuttisella tasolla. Paliperidonin kokonaisaltistus oli Trevicta‑valmisteen antamisen jälkeen suhteessa annokseen, kun annetut annokset olivat 175–525 mg. Cmax‑arvo oli lähes suhteessa annokseen. Trevicta‑annoksista saatujen suurimpien ja pienimpien pitoisuuksien keskimääräinen suhde vakaassa tilassa oli hartialihakseen annettuna 1,6 ja pakaralihakseen annettuna 1,7.
Plasman proteiineihin sitoutuu 74 % raseemisesta paliperidonista.
Trevicta-valmisteen annon jälkeen paliperidonin (+)‑ ja (‑)-enantiomeerit muuntuvat toisikseen, jolloin (+)- ja (-)-enantiomeerien suhteen AUC-arvo on noin 1,7–1,8.
Biotransformaatio ja eliminaatio
Kun 14C‑paliperidonin välittömästi vapauttavaa lääkemuotoa annettiin sitä koskeneessa tutkimuksessa suun kautta 1 mg:n kerta-annoksena, annoksesta oli viikon kuluttua erittynyt muuttumattomana aineena virtsaan 59 %, mikä osoittaa, ettei paliperidoni metaboloidu tehokkaasti maksan kautta. Noin 80 % annetusta radioaktiivisuudesta havaittiin virtsasta ja 11 % ulosteista. Neljä metaboliareittiä on tunnistettu in vivo, joista jokainen vastasi enintään 10 % annoksesta: dealkylaatio, hydroksylaatio, dehydrogenaatio ja bentsisoksatsoliketjun katkaiseminen. Vaikka tutkimukset in vitro viittasivatkin siihen, että CYP2D6 ja CYP3A4 osallistuvat paliperidonin metaboliaan, näyttöä ei ole saatu in vivo, että näiden isoentsyymien osuus paliperidonin metaboliassa olisi merkittävä. Populaatiofarmakokineettiset analyysit eivät osoittaneet havaittavaa eroa paliperidonin näennäisessä puhdistumassa suun kautta annettavan paliperidonin annon jälkeen CYP2D6-substraatteja nopeasti tai hitaasti metaboloivien henkilöiden välillä. Ihmisen maksan mikrosomeilla tehdyt tutkimukset in vitro osoittivat, ettei paliperidoni estä merkittävästi sytokromi P450 ‑isoentsyymien, kuten CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ja CYP3A5, kautta metaboloituvien lääkeaineiden metaboliaa.
Tutkimukset in vitro ovat osoittaneet, että paliperidoni on P‑glykoproteiinin substraatti ja suurina pitoisuuksina P‑glykoproteiinin heikko estäjä. Tietoja in vivo ei ole eikä tämän kliinistä merkitystä tiedetä.
Paliperidonin näennäisen puoliintumisajan mediaani annoksina 175–525 mg annetun Trevicta‑valmisteen annon jälkeen oli populaatiofarmakokineettisen analyysin perusteella hartialihakseen annettuna 84–95 vuorokautta ja pakaralihakseen annettuna 118–139 vuorokautta.
Pitkävaikutteinen kerran kolmessa kuukaudessa injektiona annettava paliperidonipalmitaatti vs. paliperidonin muut lääkemuodot
Trevicta on kehitetty vapauttamaan paliperidonia kolmen kuukauden ajan, kun taas kerran kuukaudessa injektiona annettavaa paliperidonia annetaan kuukausittain. Kun Trevicta‑valmistetta annetaan 3,5‑kertaisina annoksina vastaavaan kerran kuukaudessa injektiona annettaviin paliperidonipalmitaattiannoksiin verrattuna (ks. kohta Annostus ja antotapa), paliperidonialtistukset ovat samankaltaiset kuin kerran kuukaudessa injektiona annettavan paliperidonipalmitaatin kuukausittain annettujen annosten jälkeen ja vastaavat kuin kerran päivässä otettavien paliperidonidepottablettiannosten jälkeen. Trevicta-valmisteen altistuksen vaihteluväli on samansuuruinen kuin paliperidonidepottablettien hyväksytyistä annosvahvuuksista saatavan altistuksen vaihteluväli.
Maksan vajaatoiminta
Paliperidoni ei metaboloidu maksassa huomattavassa määrin. Vaikka Trevicta-valmistetta ei ole tutkittu maksan vajaatoimintaa sairastavilla potilailla, lievää tai keskivaikeaa maksan vajaatoimintaa sairastavien potilaiden annosta ei tarvitse muuttaa. Keskivaikeaa maksan vajaatoimintaa sairastavilla (Child–Pugh-luokka B) potilailla suun kautta annettavalla paliperidonilla tehdyssä tutkimuksessa vapaan paliperidonin pitoisuudet plasmassa olivat samankaltaisia kuin terveillä tutkittavilla. Paliperidonia ei ole tutkittu vaikeaa maksan vajaatoimintaa sairastavilla potilailla.
Munuaisten vajaatoiminta
Trevicta-valmistetta ei ole tutkittu systemaattisesti munuaisten vajaatoimintaa sairastavilla potilailla. Suun kautta kerta-annoksena annettujen 3 mg:n paliperidonidepottablettien ominaisuuksia tutkittiin potilailla, joilla oli eriasteista munuaisten vajaatoimintaa. Paliperidonin eliminaatio väheni arvioidun kreatiniinipuhdistuman pienetessä. Lievää munuaisten vajaatoimintaa sairastavien potilaiden paliperidonin kokonaispuhdistuma pieneni keskimäärin 32 % (CrCl = 50 – < 80 ml/min), keskivaikeaa munuaisten vajaatoimintaa sairastavien 64 % (CrCl = 30 – < 50 ml/min) ja vaikeaa munuaisten vajaatoimintaa sairastavien 71 % (CrCl = 10 – < 30 ml/min), mikä vastaa keskimäärin altistuksen suurenemista (AUCinf) vastaavasti 1,5-, 2,6- ja 4,8-kertaiseksi terveisiin tutkittaviin verrattuna.
Iäkkäät
Populaatiofarmakokineettinen analyysi ei osoittanut farmakokinetiikassa ikään liittyviä eroja.
Painoindeksi (BMI)/paino
Ylipainoisten ja liikalihavien tutkittavien Cmax-arvon havaittiin olevan muita potilasryhmiä pienempi. Normaalipainoisten, ylipainoisten ja liikalihavien tutkittavien alimmat pitoisuudet olivat Trevicta‑valmisteen näennäisessä vakaassa tilassa samankaltaiset.
Rotu
Populaatiofarmakokineettinen analyysi ei osoittanut farmakokinetiikassa rotuun liittyviä eroja.
Sukupuoli
Populaatiofarmakokineettinen analyysi ei osoittanut farmakokinetiikassa sukupuoleen liittyviä eroja.
Tupakointi
Ihmisen maksaentsyymeillä in vitro tehtyjen tutkimusten perusteella paliperidoni ei ole CYP1A2:n substraatti eikä tupakoinnin siten oleteta vaikuttavan paliperidonin farmakokinetiikkaan. Tupakoinnin vaikutusta paliperidonin farmakokinetiikkaan ei ole tutkittu Trevicta-valmisteella. Suun kautta otetuista paliperidonidepottableteista saatuihin tietoihin perustuva populaatiofarmakokineettinen analyysi osoitti paliperidonialtistuksen olevan tupakoijilla hieman pienempi kuin tupakoimattomilla. Tällä erolla ei todennäköisesti ole kliinistä merkitystä.
Prekliiniset tiedot turvallisuudesta
Rotilla ja koirilla lihakseen injisoidulla paliperidonipalmitaatilla (kerran kuukaudessa annettava lääkemuoto) ja suun kautta annetulla paliperidonilla tehdyt tutkimukset toistettujen paliperidoniannosten toksisuudesta viittasivat pääasiassa farmakologisiin vaikutuksiin, kuten sedaatioon sekä rintarauhasiin ja sukuelimiin kohdistuviin prolaktiinivälitteisiin vaikutuksiin. Paliperidonipalmitaatilla hoidetuilla eläimillä havaittiin antokohdan lihaksessa tulehdusreaktio. Toisinaan siihen kehittyi märkäpesäke.
Rotilla tehty lisääntymistutkimus toteutettiin suun kautta annettavalla risperidonilla, joka muuntuu huomattavassa määrin paliperidoniksi rotilla ja ihmisellä. Rotilla havaittiin haittavaikutuksia syntymäpainoon ja jälkeläisten eloonjäämiseen. Kun paliperidonipalmitaattia annettiin tiineille rotille lihakseen suurimpiin annoksiin saakka (160 mg/kg/vrk), mikä vastaa 2,2 kertaa ihmisen suurimmasta suositellusta annoksesta 525 mg aiheutuvaa altistusta, ei havaittu sikiötoksisuutta eikä epämuodostumia. Tiineille eläimille annetut muut dopamiiniantagonistit ovat aiheuttaneet haitallisia vaikutuksia jälkeläisten oppimiskykyyn ja motoriseen kehitykseen.
Paliperidonipalmitaatti ja paliperidoni eivät olleet geenitoksisia. Rotilla ja hiirillä tehdyissä karsinogeenisuustutkimuksissa suun kautta annetulla risperidonilla havaittiin aivolisäkkeen adenooman (hiirillä), haiman adenooman (rotilla) ja maitorauhasen adenokarsinooman (molemmilla lajeilla) esiintyvyyden lisääntymistä. Lihakseen annetun paliperidonipalmitaatin karsinogeenisuutta tutkittiin rotilla. Naarasrotilla esiintyi tilastollisesti merkitsevää rintarauhasen adenokarsinoomien lisääntymistä annoksilla 10, 30 ja 60 mg/kg/kuukausi. Urosrotilla todettiin tilastollisesti merkitsevää rintarauhasen adenoomien ja karsinoomien lisääntymistä annoksilla 30 ja 60 mg/kg/kuukausi, joista aiheutuva altistus on 0,6- ja 1,2-kertainen ihmiselle suurimmasta suositellusta annoksesta 525 mg aiheutuvaan altistukseen nähden. Nämä kasvaimet saattavat liittyä pitkäkestoiseen dopamiini D2‑reseptoriantagonismiin ja hyperprolaktinemiaan. Näiden jyrsijöillä todettujen löydösten merkitystä ihmiselle aiheutuvan riskin kannalta ei tiedetä.
Farmaseuttiset tiedot
Apuaineet
Polysorbaatti 20
Polyetyleeniglykoli 4 000
Sitruunahappomonohydraatti
Natriumdivetyfosfaattimonohydraatti
Natriumhydroksidi (pH:n säätöön)
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TREVICTA injektioneste, depotsuspensio
175 mg (L:ei) 1 kpl (2 neulaa) (596,59 €)
263 mg (L:ei) 1 kpl (2 neulaa) (810,09 €)
350 mg (L:ei) 1 kpl (2 neulaa) (1015,52 €)
525 mg (L:ei) 1 kpl (2 neulaa) (1421,54 €)
PF-selosteen tieto
175 mg
0,88 ml suspensiota esitäytetyssä ruiskussa (syklistä olefiinikopolymeeriä), jossa männänpysäytin, pidätinrengas ja kärkisuojus (bromobutyylikumia) sekä 22G, 1½" turvaneula (thin wall) (0,72 mm x 38,1 mm) ja 22G, 1" turvaneula (thin wall) (0,72 mm x 25,4 mm).
263 mg
1,32 ml suspensiota esitäytetyssä ruiskussa (syklistä olefiinikopolymeeriä), jossa männänpysäytin, pidätinrengas ja kärkisuojus (bromobutyylikumia) sekä 22G, 1½" turvaneula (thin wall) (0,72 mm x 38,1 mm) ja 22G, 1" turvaneula (thin wall) (0,72 mm x 25,4 mm).
350 mg
1,75 ml suspensiota esitäytetyssä ruiskussa (syklistä olefiinikopolymeeriä), jossa männänpysäytin, pidätinrengas ja kärkisuojus (bromobutyylikumia) sekä 22G, 1½" turvaneula (thin wall) (0,72 mm x 38,1 mm) ja 22G, 1" turvaneula (thin wall) (0,72 mm x 25,4 mm).
525 mg
2,63 ml suspensiota esitäytetyssä ruiskussa (syklistä olefiinikopolymeeriä), jossa männänpysäytin, pidätinrengas ja kärkisuojus (bromobutyylikumia) sekä 22G, 1½" turvaneula (thin wall) (0,72 mm x 38,1 mm) ja 22G, 1" turvaneula (thin wall) (0,72 mm x 25,4 mm).
Pakkauskoot:
Pakkaus sisältää 1 esitäytetyn ruiskun ja 2 neulaa.
Valmisteen kuvaus:
Suspensio on valkoista tai luonnonvalkoista. Suspension pH on neutraali (noin 7,0).
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Trevicta-valmisteen tarkat käyttö- ja käsittelyohjeet, ks. pakkausseloste (Tiedot lääkäreille ja terveydenhuollon ammattilaisille).
Korvattavuus
TREVICTA injektioneste, depotsuspensio
175 mg 1 kpl
263 mg 1 kpl
350 mg 1 kpl
525 mg 1 kpl
- Ylempi erityiskorvaus (100 %). Vaikeat psykoosit ja muut vaikeat mielenterveyden häiriöt (112).
- Peruskorvaus (40 %).
ATC-koodi
N05AX13
Valmisteyhteenvedon muuttamispäivämäärä
25.05.2023
Yhteystiedot
 JANSSEN-CILAG OY
JANSSEN-CILAG OY PL 15
02621 Espoo
020 753 1300
innovativemedicine.jnj.com/finland
jacfi@its.jnj.com
