AMLODIPIN KRKA tabletti 5 mg, 10 mg
Vaikuttavat aineet ja niiden määrät
Amlodipin Krka 5 mg tabletit
Yksi tabletti sisältää 6,94 mg amlodipiinibesilaattia, mikä vastaa 5 mg amlodipiinia.
Amlodipin Krka 10 mg tabletit
Yksi tabletti sisältää 13,88 mg amlodipiinibesilaattia, mikä vastaa 10 mg amlodipiinia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Tabletti
Kliiniset tiedot
Käyttöaiheet
Kohonnut verenpaine
Krooninen, stabiili angina pectoris
Angiospastinen (Prinzmetalin) angina
Annostus ja antotapa
Annostus
Aikuiset
Sekä kohonneen verenpaineen että angina pectoriksen hoidossa tavallinen aloitusannos on 5 mg kerran vuorokaudessa. Annosta voidaan suurentaa enintään 10 mg:aan potilaan yksilöllisen vasteen mukaan.
Verenpainepotilaille amlodipiinia on käytetty samanaikaisesti tiatsididiureetin, alfasalpaajan, beetasalpaajan tai angiotensiinikonvertaasin (ACE:n) estäjän kanssa. Angina pectoriksen hoidossa amlodipiinia voidaan käyttää ainoana lääkkeenä tai yhdessä muiden angina pectorista lievittävien lääkevalmisteiden kanssa potilaille, joilla on nitraattihoidosta ja/tai riittävästä beetasalpaajahoidosta huolimatta oirehtiva angina pectoris.
Amlodipiinin annosta ei tarvitse muuttaa, kun sitä käytetään samanaikaisesti tiatsididiureettien, beetasalpaajien tai ACE:n estäjien kanssa.
Erityisryhmät
Iäkkäät potilaat
Iäkkäät potilaat sietävät samansuuruisia amlodipiiniannoksia yhtä hyvin kuin nuoremmat potilaat. Iäkkäille potilaille suositellaan normaalia annostusta, mutta varovaisuutta on noudatettava annostusta suurennettaessa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka).
Maksan vajaatoiminta
Annossuosituksia ei ole vahvistettu potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta. Sen vuoksi annos on valittava huolellisesti ja hoito on aloitettava annostusasteikon pienemmästä päästä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakokinetiikka). Amlodipiinin farmakokinetiikkaa ei ole tutkittu potilaissa, joilla on vaikea maksan vajaatoiminta. Amlodipiinin anto on aloitettava pienimmällä annoksella ja annosta suurennettava hitaasti potilailla, joilla on vaikea maksan vajaatoiminta.
Munuaisten vajaatoiminta
Amlodipiinipitoisuuden muutokset plasmassa eivät riipu munuaisten vajaatoiminnan vaikeusasteesta ja siksi suositellaan normaaliannostusta. Amlodipiini ei dialysoidu.
Pediatriset potilaat
6-17-vuotiaat lapset ja nuoret, joilla on kohonnut verenpaine
Suun kautta annettava suositeltu aloitusannos kohonneen verenpaineen hoitoon 6–17-vuotiaille lapsipotilaille on 2,5 mg kerran vuorokaudessa. Annosta voidaan suurentaa 5 mg:aan kerran vuorokaudessa, jos verenpaineen hoitotavoitetta ei saavuteta 4 viikon kuluessa. Yli 5 mg vuorokausiannoksia ei ole tutkittu lapsipotilaiden hoidossa (ks. kohdat Farmakodynamiikka ja Farmakokinetiikka).
2,5 mg annos saadaan puolittamalla Amlodipin Krka 5 mg tabletti kahteen samansuuruiseen puolikkaaseen.
Alle 6-vuotiaat lapset
Tietoja ei ole saatavilla.
Antotapa
Suun kautta otettava tabletti.
Vasta-aiheet
Amlodipiinia ei saa antaa potilaalle:
- joka on yliherkkä dihydropyridiinijohdoksille, amlodipiinille tai jollekin kohdassa Apuaineet mainitulle apuaineelle
- jolla on vaikea hypotensio
- jolla on sokki (mukaan lukien sydänperäinen sokki)
- jolla on sydämen vasemman kammion ulosvirtauskanavan ahtauma (esim. vaikea aorttastenoosi)
- jolla on akuutin sydäninfarktin jälkeinen hemodynaamisesti epävakaa sydämen vajaatoiminta.
Varoitukset ja käyttöön liittyvät varotoimet
Amlodipiinin turvallisuutta ja tehoa hypertensiivisen kriisin hoidossa ei ole varmistettu.
Sydämen vajaatoiminta
Sydämen vajaatoimintapotilaita hoidettaessa on noudatettava varovaisuutta. Vaikeaa sydämen vajaatoimintaa (NYHA-luokka III tai IV) sairastavilla potilailla tehdyssä pitkäkestoisessa, lumelääkekontrolloidussa tutkimuksessa amlodipiinin käytön yhteydessä raportoitiin ilmenneen keuhkoedeemaa useammin kuin lumelääkeryhmässä (ks. kohta Farmakodynamiikka). Varovaisuutta on noudatettava annettaessa kalsiumkanavan salpaajia amlodipiini mukaan lukien kongestiivista sydämen vajaatoimintaa sairastaville potilaille, koska ne saattavat lisätä kardiovaskulaaritapahtumien ja kuolleisuuden riskiä.
Maksan vajaatoiminta
Amlodipiinin puoliintumisaika pidentyy ja kokonaisaltistus (AUC) kohoaa potilailla, joilla maksan toiminta on heikentynyt. Annossuosituksia ei ole määritetty. Sen vuoksi amlodipiinin aloitusannos on valittava annostusasteikon pienemmästä päästä ja varovaisuutta on noudatettava sekä hoitoa aloitettaessa että annosta suurennettaessa. Vaikeaa maksan vajaatoimintaa sairastaville potilaille hidas annoksen suurentaminen ja huolellinen seuranta voivat olla tarpeen.
Iäkkäät potilaat
Iäkkäille potilaille lääkeannosta suurennettaessa on noudatettava varovaisuutta (ks. kohdat Annostus ja antotapa ja Farmakokinetiikka).
Munuaisten vajaatoiminta
Amlodipiinia voidaan antaa tavanomaisina annoksina. Amlodipiinipitoisuuden muutokset plasmassa eivät riipu munuaisten vajaatoiminnan vaikeusasteesta. Amlodipiini ei dialysoidu.
Natrium
Tämä lääkevalmiste sisältää natriumia alle 1 mmol (23 mg) per tabletti eli se on olennaisesti natriumiton.
Yhteisvaikutukset
Muiden lääkevalmisteiden vaikutukset amlodipiiniin
CYP3A4:n estäjät: Amlodipiinin samanaikainen käyttö voimakkaiden tai kohtalaisten CYP3A4:n estäjien (proteaasin estäjät, atsoliryhmän sienilääkkeet, makrolidit, kuten erytromysiini tai klaritromysiini, verapamiili tai diltiatseemi) kanssa voi aiheuttaa merkittävää amlodipiinialtistuksen suurenemista, mikä lisää matalan verenpaineen riskiä. Näiden farmakokineettisten vaihteluiden kliininen vaikutus saattaa olla voimakkaampi iäkkäillä potilailla. Näin ollen potilaan kliininen seuranta ja annoksen muuttaminen voivat olla tarpeen.
CYP3A4:n induktorit: Amlodipiinin samanaikainen anto tunnettujen CYP3A4:n induktoreiden kanssa saattaa muuttaa amlodipiinin pitoisuutta plasmassa. Sen vuoksi verenpainetta tulisi seurata sekä annosta säätää erityisesti voimakkaiden CYP3A4:n induktoreiden (esim. rifampisiini, mäkikuisma) samanaikaisen annon kanssa.
Amlodipiinin antoa samanaikaisesti greipin tai greippimehun kanssa ei suositella, sillä joillakin potilailla amlodipiinin biologinen hyötyosuus voi kasvaa, mikä johtaa verenpainetta laskevien vaikutusten voimistumiseen.
Dantroleeni (infuusio): Eläimiä hoidettaessa on havaittu kuolemaan johtaneita kammiovärinöitä ja kardiovaskulaarisia kollapseja hyperkalemiaan liittyneinä, kun eläimille annettiin verapamiilia ja dantroleenia laskimoon. Hyperkalemian vaaran vuoksi kalsiumkanavan salpaajien, kuten amlodipiinin, samanaikaista antoa on syytä välttää malignin hypertermian hoidossa sekä hoidettaessa potilaita, jotka ovat alttiita malignille hypertermialle.
Amlodipiinin vaikutukset muihin lääkevalmisteisiin
Amlodipiini lisää muiden verenpainetta alentavien lääkkeiden vaikutusta.
Takrolimuusi: Riski veren takrolimuusipitoisuuden kohoamiseen on olemassa, jos sitä annetaan samanaikaisesti amlodipiinin kanssa. Takrolimuusin toksisuuden välttämiseksi veren takrolimuusipitoisuutta on tarkkailtava ja tarvittaessa takrolimuusiannosta on muutettava, jos amlodipiinia annetaan takrolimuusihoitoa saavalle potilaalle.
mTOR:in (nisäkkään rapamysiinin kohde -proteiini) estäjät: mTOR:in estäjät kuten sirolimuusi, temsirolimuusi ja everolimuusi ovat CYP3A:n substraatteja. Amlodipiini on heikko CYP3A:n estäjä. Samanaikaisesti käytettäessä amlodipiini saattaa lisätä mTOR:in estäjien altistusta.
Siklosporiini: Siklosporiinin ja amlodipiinin yhteisvaikutustutkimuksia ei ole tehty terveillä vapaaehtoisilla eikä muilla potilasryhmillä kuin munuaissiirtopotilailla, joilla havaittiin siklosporiinin minimipitoisuuden vaihtelevaa nousua (keskimäärin 0 %–40 %). Amlodipiinia käyttävien munuaissiirtopotilaiden veren siklosporiiniarvojen tarkkailua on harkittava ja siklosporiiniannosta on tarvittaessa pienennettävä.
Simvastatiini: Toistuvien 10 mg:n amlodipiiniannosten samanaikanen anto 80 mg:n simvastatiiniannoksen kanssa suurensi simvastatiinialtistusta 77 % pelkkään simvastatiinihoitoon verrattuna. Simvastatiinin annos ei saa olla yli 20 mg/vrk, jos potilas käyttää amlodipiinia.
Kliinisissä yhteisvaikutustutkimuksissa amlodipiini ei vaikuttanut atorvastatiinin, digoksiinin eikä varfariinin farmakokinetiikkaan.
Raskaus ja imetys
Raskaus
Amlodipiinin käytön turvallisuutta raskauden aikana ei ole varmistettu.
Eläinkokeissa havaittiin lisääntymistoksisuutta suurilla annoksilla (ks. kohta Prekliiniset tiedot turvallisuudesta).
Amlodipiinin käyttöä raskausaikana suositellaan vain, jos turvallisempaa hoitovaihtoehtoa ei ole tai jos sairaus itsessään aiheuttaa suuremman riskin äidille ja sikiölle.
Imetys
Amlodipiini erittyy äidinmaitoon. Imeväisen saaman annoksen osuuden äidin annoksesta on arvioitu olevan kvartiilivälillä 3-7 % ja enintään 15 %. Amlodipiinin vaikutusta imeväiseen ei tunneta. Päätös imetyksen tai amlodipiinihoidon jatkamisesta/keskeyttämisestä on tehtävä ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja amlodipiinihoidosta koituvat hyödyt äidille.
Hedelmällisyys
Joillakin kalsiumkanavan salpaajilla hoidetuilla potilailla on ilmoitettu siittiöiden pään palautuvia biokemiallisia muutoksia. Amlodipiinin mahdollista hedelmällisyyteen kohdistuvaa vaikutusta koskevat kliiniset tiedot ovat riittämättömät. Yhdessä rotilla tehdyssä tutkimuksessa todettiin haitallisia vaikutuksia urosten hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Amlodipin Krka ‑valmisteella voi olla lievä tai kohtalainen vaikutus ajokykyyn tai kykyyn käyttää koneita. Jos amlodipiinia käyttävällä potilaalla ilmenee heitehuimausta, päänsärkyä, väsymystä tai pahoinvointia, hänen reaktiokykynsä saattaa olla heikentynyt. Varovaisuutta on noudatettava erityisesti hoidon alussa.
Haittavaikutukset
Yhteenveto
Yleisimmin raportoituja haittavakutuksia ovat uneliaisuus, heitehuimaus, päänsärky, sydämentykytys, punoitus, vatsakipu, pahoinvointi, nilkkojen turvotus, turvotus ja väsymys.
Haittavaikutustaulukko
Seuraavia haittavaikutuksia on raportoitu amlodipiinin käytön yhteydessä. Ilmaantuvuus on määritelty seuraavasti:
Hyvin yleinen: ≥1/10
Yleinen: ≥1/100, <1/10
Melko harvinainen: ≥1/1 000, <1/100
Harvinainen: ≥1/10 000, <1/1 000
Hyvin harvinainen: <1/10 000
Tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
| Elinjärjestelmä | Esiintymistiheys | Haittavaikutus |
| Veri ja imukudos | Hyvin harvinainen | Leukosytopenia, trombosytopenia |
| Immuunijärjestelmä | Hyvin harvinainen | Allergiset reaktiot |
| Aineenvaihdunta ja ravitsemus | Hyvin harvinainen | Hyperglykemia |
| Psyykkiset häiriöt | Melko harvinainen | Unettomuus, mielialan muutokset mukaan lukien ahdistuneisuus, masennus |
| Harvinainen | Sekavuus | |
| Hermosto | Yleinen | Uneliaisuus, heitehuimaus, päänsärky (varsinkin hoidon alussa) |
| Melko harvinainen | Vapina, makuaistin muutokset, pyörtyminen, hypestesia, parestesiat | |
| Hyvin harvinainen | Lisääntynyt lihasjännitys, perifeerinen neuropatia | |
| Tuntematon | Ekstrapyramidaalinen häiriö | |
| Silmät | Yleinen | Näköhäiriöt (mukaan lukien diplopia) |
| Kuulo ja tasapainoelin | Melko harvinainen | Tinnitus |
| Sydän | Yleinen | Sydämentykytys |
| Melko harvinainen | Rytmihäiriöt (mukaan lukien bradykardia, kammiotakykardia, eteisvärinä) | |
| Hyvin harvinainen | Sydäninfarkti | |
| Verisuonisto | Yleinen | Punoitus |
| Melko harvinainen | Hypotensio | |
| Hyvin harvinainen | Verisuonitulehdus | |
| Hengityselimet, rintakehä ja välikarsina | Yleinen | Hengenahdistus |
| Melko harvinainen | Yskä, nuha | |
| Ruoansulatuskanava | Yleinen | Vatsakipu, pahoinvointi, dyspepsia, suolentoiminnan muutokset (mukaan lukien ripuli ja ummetus) |
| Melko harvinainen | Oksentelu, suun kuivuminen | |
| Hyvin harvinainen | Haimatulehdus, gastriitti, ienhyperplasia | |
| Maksa ja sappi | Hyvin harvinainen | Maksatulehdus, keltaisuus, kohonneet maksaentsyymi-arvot* |
| Iho ja ihonalainen kudos | Melko harvinainen | Alopesia, purppura, ihon värimuutos, lisääntynyt hikoilu, kutina, ihottuma, eksanteema, nokkosihottuma |
| Hyvin harvinainen | Angioedeema, erythema multiforme, eksfoliatiivinen dermatiitti, Stevens-Johnsonin oireyhtymä, Quincken edeema, valoyliherkkyys | |
| Tuntematon | Toksinen epidermaalinen nekrolyysi | |
| Luusto, lihakset ja sidekudos | Yleinen | Nilkkojen turvotus, lihaskrampit |
| Melko harvinainen | Nivelkipu, lihaskipu, selkäkipu | |
| Munuaiset ja virtsatiet | Melko harvinainen | Virtsaamishäiriöt, nokturia, tihentynyt virtsaamistarve |
| Sukupuolielimet ja rinnat | Melko harvinainen | Impotenssi, gynekomastia |
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Turvotukset |
| Yleinen | Väsymys, voimattomuus | |
| Melko harvinainen | Rintakipu, kivuntunne, huonovointisuus | |
| Tutkimukset | Melko harvinainen | Painonnousu, painonlasku |
* viittaa useimmiten kolestaasiin.
Poikkeuksellisina tapauksina on ilmoitettu ekstrapyramidaalioireyhtymää.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Kokemusta tahallisesta yliannostuksesta on vähän.
Oireet
Saatavissa olevan tiedon perusteella merkittävä yliannostus saattaa johtaa liialliseen perifeeriseen vasodilataatioon ja mahdollisesti reflektoriseen takykardiaan. Merkittävää ja todennäköisesti pitkittynyttä systeemistä hypotensiota, joka voi johtaa sokkiin (myös kuolemaan johtavaan), on raportoitu.
Amlodipiinin yliannostuksen seurauksena on harvoin raportoitu ei-sydänperäistä keuhkoedeemaa, joka voi ilmetä viiveellä (24-48 tunnin kuluessa lääkevalmisteen ottamisesta) ja joka saattaa vaatia hengityksen tukihoitoa. Aikaiset elvytystoimet (mukaan lukien nesteylikuormitus) perfuusion ja sydämen minuuttitilavuuden ylläpitämiseksi saattavat olla käynnistäviä tekijöitä.
Hoito
Amlodipiinin yliannostuksesta johtuvaa kliinisesti merkitsevää hypotensiota hoidetaan tukemalla aktiivisesti sydäntä ja verenkiertoa, muun muassa seuraamalla tiiviisti sydämenja hengityksen toimintaa, kohottamalla raajat ja tarkkailemalla kiertävän veren määrää ja erittyneen virtsan määrää.
Vasokonstriktorista voi olla hyötyä verisuonten tonuksen ja verenpaineen normalisoinnissa edellyttäen, ettei sen käyttö ole vasta-aiheista. Kalsiumglukonaatin anto laskimoon voi auttaa kumoamaan kalsiuminkanavan salpauksen vaikutukset.
Joissakin tapauksissa mahahuuhtelu voi auttaa. Amlodipiinin imeytyminen väheni, kun terveille vapaaehtoisille tutkimushenkilöille annettiin aktiivihiiltä kahden tunnin kuluessa 10 mg amlodipiiniannoksen jälkeen.
Koska amlodipiini sitoutuu hyvin suuressa määrin proteiineihin, dialyysistä ei todennäköisesti ole hyötyä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Kalsiumkanavan salpaajat, pääasiassa verisuonistoon vaikuttavat selektiiviset kalsiumkanavan salpaajat, ATC-koodi: C08AA01.
Vaikutusmekanismi
Amlodipiini on dihydropyridiinien ryhmään kuuluva kalsiumionien sisäänvirtauksen estäjä (hitaan kanavan sulkija tai kalsiumionin salpaaja) ja se estää solukalvon läpi tapahtuvaa kalsiumionien sisäänvirtausta sydämen ja verisuonten sileään lihakseen.
Farmakodynaamiset vaikutukset
Amlodipiinin verenpainetta alentava vaikutusmekanismi perustuu sen suoraan verisuonten sileää lihasta relaksoivaan vaikutukseen. Tarkkaa vaikutusmekanismia, jolla amlodipiini lievittää angina pectoriksen oireita, ei ole täysin selvitetty. Amlodipiini vähentää kuitenkin iskeemistä kokonaiskuormitusta seuraavalla kahdella tavalla:
- Amlodipiini laajentaa perifeerisiä arterioleja, mikä vähentää ääreisverenkierron kokonaisvastusta (afterload), jota vastaan sydän työskentelee. Koska sydämen rytmi pysyy vakaana, tämä sydämen kuormituksen väheneminen pienentää sydänlihaksen energiankulutusta ja hapentarvetta.
- Amlodipiini laajentaa todennäköisesti myös suuria ja pieniä sepelvaltimoita sekä normaaleilla että iskeemisillä alueilla. Dilataatio lisää sydänlihaksen hapensaantia koronaarispasmissa (Prinzmetalin angina, variantti angina).
Kerran vuorokaudessa tapahtuva anto alentaa verenpainepotilaiden verenpainetta kliinisesti merkitsevästi sekä makuulla että pystyasennossa koko 24 tunnin antovälin ajan. Koska amlodipiinin vaikutus alkaa hitaasti, se ei aiheuta akuuttia hypotensiota.
Kerran vuorokaudessa otettu amlodipiini pidentää angina pectoris -potilaiden rasituksen sietoaikaa ja siirtää rintakivun alkamista ja aikaa 1 mm:n ST-välin laskun ilmaantumiseen. Amlodipiini harventaa myös rintakipukohtauksia ja vähentää nitroglyseriinitablettien tarvetta.
Amlodipiinin käyttöön ei ole liittynyt haitallisia vaikutuksia aineenvaihduntaan eikä se aiheuta muutoksia plasman lipideihin, joten se sopii myös niiden potilaiden hoitoon, joilla on astma, diabetes tai kihti.
Kliininen teho ja turvallisuus
Käyttö potilaille, joilla on sepelvaltimotauti
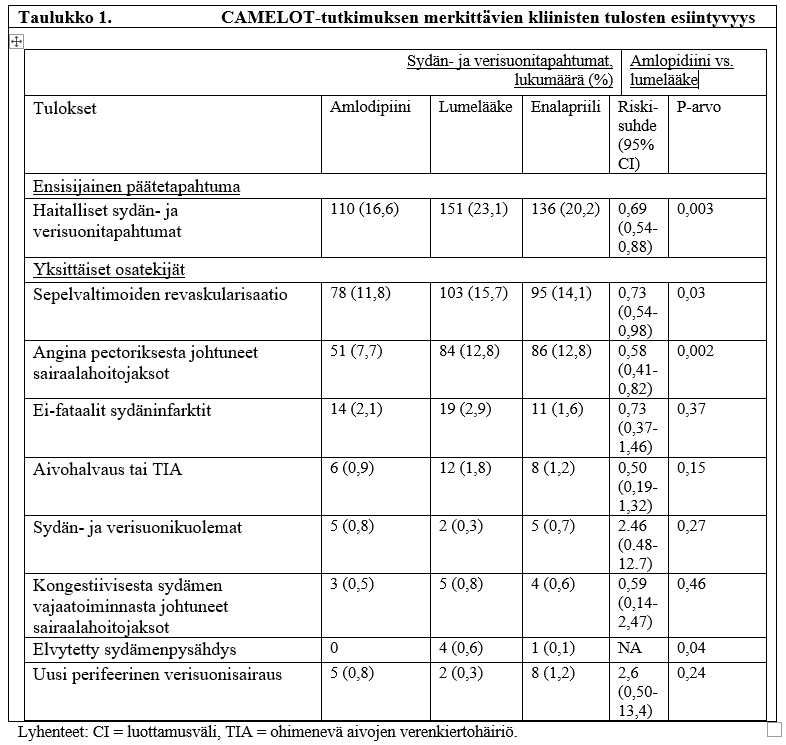
Amlodipiinin tehoa sepelvaltimotautipotilaiden kliinisten tapahtumien ehkäisyssä arvioitiin CAMELOT-tutkimuksessa (Comparison of Amlodipine vs Enalapril to Limit Occurrences of Thrombosis). Tutkimus oli itsenäinen, satunnaistettu, kaksoissokkoutettu, lumelääkekontrolloitu monikeskustutkimus, johon osallistui 1 997 potilasta. Tavanomaisen statiini-, beetasalpaaja-, diureetti- ja asetyylisalisyylihappohoidon lisäksi 663 potilasta sai amlodipiinia 5−10 mg/vrk, 673 potilasta sai enalapriilia 10–20 mg/vrk ja 655 potilasta sai lumelääkettä 2 vuoden ajan. Taulukossa 1 on yhteenveto tärkeimmistä tehoa kuvaavista tuloksista. Tulokset osoittavat, että amlodipiinihoitoa saaneilla sepelvaltimotautipotilailla oli vähemmän angina pectoriksesta aiheutuneita sairaalahoitojaksoja ja revaskularisaatiotoimenpiteitä.
Käyttö potilaille, joilla on sydämen vajaatoiminta
NYHA-luokan II-IV sydämen vajaatoimintaa sairastavilla potilailla tehdyt hemodynaamiset tutkimukset ja rasituksensiedon mittaamiseen perustuvat kontrolloidut kliiniset tutkimukset ovat osoittaneet, ettei amlodipiini heikennä kliinistä tilaa rasituksen sietokyvyn, vasemman kammion ejektiofraktion ja kliinisten oireiden osalta.
Digoksiini-, diureetti- ja ACE:n estäjähoitoa saaneiden NYHA-luokan III-IV sydämen vajaatoimintaa sairastavien potilaiden arvioimiseen suunniteltu lumelääkekontrolloitu tutkimus (PRAISE) osoitti, ettei amlodipiini suurentanut kuolleisuuden riskiä eikä kuolleisuuden ja sydämen vajaatoimintaan sairastuvuuden yhdistettyä riskiä.
Amlodipiini ei vaikuttanut kokonaiskuolleisuuteen tai sydän- ja verisuoniperäiseen kuolleisuuteen pitkäkestoisessa lumelääkekontrolloidussa seurantatutkimuksessa (PRAISE-2) kiinteäannoksista ACE:n estäjää, digitalista ja diureettia saavilla potilailla, joilla oli NYHA-luokan III-IV sydämen vajaatoiminta ilman kliinisiä oireita tai iskeemiseen perussairauteen viittaavia objektiivisia löydöksiä. Samassa potilaspopulaatiossa amlodipiinihoitoon liittyi keuhkoedeeman lisääntymistä.
ALLHAT-tutkimus (Treatment to Prevent Heart Attack Trial)
Satunnaistettu, kaksoissokkoutettu sairastuvuus-kuolleisuustutkimus ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) tehtiin potilailla, joilla oli lievästi tai kohtalaisesti kohonnut verenpaine. Tutkimuksessa vertailtiin uudempia lääkehoitoja: amlodipiini 2,5‑10 mg/vrk (kalsiumkanavan salpaaja) tai lisinopriili 10–40 mg/vrk (ACE:n estäjä) ensilinjan hoitona verrattuna hoitoon tiatsididiureetti klooritalidonilla 12,5–25 mg/vrk.
Tutkimukseen satunnaistettiin yhteensä 33 357 vähintään 55-vuotiasta verenpainepotilasta, joita seurattiin keskimäärin 4,9 vuotta. Potilailla oli lisäksi vähintään yksi muu sepelvaltimotaudin riskiä lisäävä tekijä, kuten aiempi sydäninfarkti tai aivohalvaus (> 6 kk ennen tutkimukseen osallistumista) tai viitteet jostakin muusta ateroskleroottisesta sydän- ja verisuonitaudista (yhteensä 51,5 %), tyypin 2 diabetes (36,1 %), HDL-kolesteroli < 0,90 mmol/l (11,6 %), EKG:llä tai kaikukardiografialla diagnosoitu sydämen vasemman kammion hypertrofia (20,9 %) tai tupakointitottumus tutkimushetkellä (21,9 %).
Ensisijainen päätetapahtuma oli kuolemaan johtaneen sepelvaltimotaudin ja ei-kuolemaan johtaneen sydäninfarktin yhdistelmä. Ensisijaisen päätetapahtuman osalta merkitsevää eroa ei havaittu amlodipiiniin perustuvan ja klooritalidoniinperustuvan hoidon välillä: suhteellinen riski 0,98 (95 % luottamusväli [0,90–1,07], p = 0,65). Toissijaisista päätetapahtumista sydämen vajaatoiminnan esiintyvyys (osa yhdistetystä sydän- ja verisuonitaudin päätetapahtumasta) oli merkitsevästi suurempi amlodipiiniryhmässä verrattuna klooritalidoniryhmään (10,2 % vs. 7,7 %, suhteellinen riski 1,38 (luottamusväli 95 % [1,25–1,52] p < 0,001)). Amlodipiiniryhmän ja klooritalidoniryhmän välinen ero ei kuitenkaan ollut merkitsevä kokonaiskuolleisuuden suhteen: suhteellinen riski 0,96 (luottamusväli 95 % [0,89–1,02] p = 0,20).
Pediatriset potilaat (vähintään 6-vuotiaat)
Tutkimus, johon osallistui 268 iältään 6–17-vuotiasta ja pääosin sekundaarista hypertensiota sairastavaa lasta ja jossa verrattiin 2,5 mg ja 5,0 mg amlodipiiniannoksia lumelääkkeeseen, osoitti molempien amlodipiiniannosten alentavan systolista verenpainetta merkittävästi enemmän kuin lumelääke. Kahden annoksen välinen ero ei ollut tilastollisesti merkitsevä.
Amlodipiinin pitkäaikaisen käytön vaikutuksia kasvuun, puberteettiin ja yleiseen kehitykseen ei ole tutkittu. Lapsuusiässä saadun amlodipiinihoidon pitkäaikaista vaikutusta sydän- ja verisuoniperäisen sairastuvuuden ja kuolleisuuden vähentämiseen aikuisiässä ei ole osoitettu.
Farmakokinetiikka
Imeytyminen, jakautuminen, sitoutuminen plasman proteiineihin
Suun kautta annettuina hoitoannoksina amlodipiini imeytyy hyvin ja huippupitoisuus saavutetaan 6‑12 tunnin kuluttua lääkkeen ottamisesta. Absoluuttinen biologinen hyötyosuus on arviolta 64–80 %. Jakautumistilavuus on noin 21 l/kg. In vitro -tutkimukset ovat osoittaneet, että noin 97,5 % verenkierrossa olevasta amlodipiinista sitoutuu plasman proteiineihin.
Ruoan nauttiminen ei vaikuta amlodipiinin hyötyosuuteen.
Biotransformaatio/eliminaatio
Amlodipiinin plasmasta mitattu terminaalinen eliminaation puoliintumisaika on noin 35–50 tuntia, mikä mahdollistaa kerran päivässä tapahtuvan annostelun. Amlodipiini metaboloituu suurelta osin maksassa inaktiivisiksi metaboliiteikseen. Amlodipiinista kulkeutuu virtsaan 10 % kanta-aineena ja 60 % metaboliitteina.
Maksan vajaatoiminta
Kliinistä tietoa amlodipiinin antamisesta maksanvajaatoimintapotilaille on hyvin vähän. Maksan vajaatoimintaa sairastavilla potilailla amlodipiinin puhdistuma on pienentynyt, mistä seuraa puoliintumisajan pidentyminen ja kokonaisaltistuksen (AUC) suureneminen (noin 40−60 %).
Iäkkäät potilaat
Amlodipiinin huippupitoisuuden saavuttamiseen plasmassa kuluu iäkkäillä ja nuoremmilla potilailla yhtä kauan aikaa. Potilaan ikääntyessä amlodipiinin puhdistuma pyrkii hidastumaan, jolloin kokonaisaltistus suurenee ja eliminaation puoliintumisaika pitenee. Kokonaisaltistuksen suureneminen ja eliminaation puoliintumisajan piteneminen olivat tutkitulle ikäryhmälle odotetun mukaiset, kun potilailla oli kongestiivinen sydämen vajaatoiminta.
Pediatriset potilaat
Populaatiofarmakokineettinen tutkimus tehtiin 74 iältään 1–17-vuotiaalle hypertensiiviselle lapselle (34 potilasta oli 6–12-vuotiaita ja 28 potilasta oli 13–17-vuotiaita), jotka saivat 1,25–20 mg amlodipiinia vuorokaudessa joko kerran tai kahdesti päivässä annettuna. 6–12-vuotiailla pojilla tyypillinen puhdistuma suun kautta annon jälkeen (CL/F) oli 22,5 l/h ja tytöillä 16,4 l/h. 13–17-vuotiailla nuorilla vastaava puhdistuma oli pojilla 27,4 l/h ja tytöillä 21,3 l/h. Yksilöidenvälinen altistus vaihteli suuresti. Alle 6-vuotiaista lapsista raportoituja tietoja on vähän.
Prekliiniset tiedot turvallisuudesta
Lisääntymistoksisuus
Rotilla ja hiirillä tehdyissä lisääntymistoksisuustutkimuksissa havaittiin synnytyksen viivästymistä, synnytyksen pidentymistä ja poikasten eloonjäännin heikkenemistä, kun käytetyt annokset olivat noin 50-kertaiset ihmiselle suositeltuun enimmäisannokseen (mg/kg) nähden.
Hedelmällisyyden heikkeneminen
Amlodipiinia saaneiden rottien (urokset 64 vuorokautta ja naaraat 14 vuorokautta ennen parittelua) hedelmällisyyteen kohdistuvia vaikutuksia ei esiintynyt, kun käytetyt annokset olivat enintään 10 mg amlodipiinia/kg/vrk (noin 8* kertaa ihmiselle suositeltu ihon pinta-alaan perustuva [mg/m2] enimmäisannos 10 mg). Toisessa rotilla tehdyssä tutkimuksessa, jossa uroksille annettiin amlodipiinibesilaattia 30 päivän ajan ja käytetyt annokset olivat verrannolliset ihmisen elimistön pinta-alaan (mg/m2) perustuvaan annokseen, todettiin follikkelia stimuloivan hormonin ja testosteronin pitoisuuden plasmassa pienentyneen samoin kuin siemennesteen tiheyden ja kypsien spermatidien ja Sertolin solujen lukumäärän vähentyneen.
Karsinogeenisuus, mutageenisuus
Rotilla ja hiirillä, jotka saivat amlodipiinia ravinnon mukana 2 vuoden ajan pitoisuuksilla, joiden laskettiin vastaavan 0,5, 1,25 ja 2,5 mg/kg/vrk vuorokausiannostasoa, karsinogeenisuutta ei todettu. Suurin annos (hiirillä vastaava kuin ja rotilla 2-kertainen* suurimpaan suositeltuun ihon pinta-alaan perustuvaan [mg/m2] 10 mg:n hoitoannokseen nähden) oli lähellä suurinta siedettyä annosta hiirillä, mutta ei rotilla. Mutageenisuustutkimuksissa ei ilmennyt lääkkeeseen liittyviä vaikutuksia geeneissä eikä kromosomeissa.
*perustuu potilaan painoon 50 kg.
Farmaseuttiset tiedot
Apuaineet
Mikrokiteinen selluloosa (E460)
Esigelatinoitu maissitärkkelys
Natriumtärkkelysglykolaatti (tyyppi A)
Vedetön kolloidinen piidioksidi (E551)
Magnesiumstearaatti (E470b)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
5 vuotta
Säilytys
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
AMLODIPIN KRKA tabletti
5 mg (J) (L:ei) 30 fol (4,04 €), 100 fol (5,15 €)
10 mg (L:ei) 30 fol (5,68 €), 100 fol (5,63 €)
PF-selosteen tieto
Läpipainopakkaus (OPA/Al/PVC/Al): 10, 14, 20, 28, 30, 50, 56, 60, 90, 98, 100, 112, 120, 200 ja 250 tablettia kotelossa.
Läpipainopakkaus (yksittäispakattu) (OPA/Al/PVC/Al): 100 x 1 tabletti kotelossa.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
5 mg tabletit:
Valkoinen, pyöreä, hieman kaksoiskupera, viistoreunainen tabletti, jossa jakouurre toisella puolella, halkaisija 8 mm. Tabletin voi jakaa yhtä suuriin annoksiin.
10 mg tabletit:
Valkoinen, pyöreä, hieman kaksoiskupera, viistoreunainen tabletti, halkaisija 10 mm.
Käyttö- ja käsittelyohjeet
Ei erityisvaatimuksia hävittämisen suhteen.
Korvattavuus
AMLODIPIN KRKA tabletti
5 mg 30 fol, 100 fol
10 mg 30 fol, 100 fol
- Alempi erityiskorvaus (65 %). Krooninen verenpainetauti (205), Krooninen sepelvaltimotauti ja krooniseen sepelvaltimotautiin liittyvä rasva-aineenvaihdunnan häiriö (206).
- Peruskorvaus (40 %).
ATC-koodi
C08CA01
Valmisteyhteenvedon muuttamispäivämäärä
21.11.2024
Yhteystiedot
Tekniikantie 14
02150 Espoo
Suomi
020-7545330
www.krka.biz
info.fi@krka.biz
