ORADEXON injektionsvätska, lösning 5 mg/ml
Kvalitativ och kvantitativ sammansättning
En ml innehåller 5 mg glukokortikoid, dexametasonnatriumfosfat, som aktiv substans.
Hjälpämne(n) med känd effekt
Natrium: < 1 mmol natrium (23 mg) per dos.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
Oradexon injektionsvätska används för att behandla olika inflammatoriska tillstånd och autoimmuna sjukdomar, till exempel:
Reumatism: smärta, stelhet eller rörelsebegränsning, särskilt i leder och tillhörande strukturer, inklusive muskler, slemsäckar, senor, fibrig bindväv.
Kollagen sjukdom: lupus erythematosus (SLE), dermatomyosit, polyarteritis nodosa, idiopatisk trombocytopen purpura och reumatoid artrit.
Allergier: status asthmaticus, inflammation i ögat och tillhörande strukturer, svåra överkänslighetsreaktioner mot läkemedel eller insektsbett, anafylaktisk chock, hotande avstötning av allotransplantat.
Akut binjurebarksinsufficiens: vid operation, svår stress eller trauma.
Dessutom används Oradexon för adjuvant behandling vid hjärnödem (ej då svullnaden beror på huvudskada), som antiemetikum vid cancerbehandling och för palliativ behandling i slutskedet av neoplastiska sjukdomar.
Oradexon används för behandling av coronavirussjukdom 2019 (COVID-19) hos vuxna och ungdomar (12 år och äldre med en kroppsvikt på minst 40 kg) som behöver kompletterande syrgasbehandling.
Dosering och administreringssätt
Administreringssätt
Oradexon injektionsvätska används då tillståndets allvarlighetsgrad förutsätter snabb och kraftig symtomlindring eller då oral behandling inte är möjlig.
Oradexon kan ges intravenöst, intramuskulärt eller som lokal injektion. Oradexon kan också spädas med infusionsvätska eller injiceras direkt i överföringsslangen.
Injektion av höga doser i en ven ska ges långsamt, under flera minuter.
Intramuskulär injektion ges djupt i en muskel för att förhindra atrofi i subkutan fettvävnad.
Intraartikulär injektion ska ges under strikt aseptiska förhållanden eftersom glukokortikoider minskar motståndskraften mot infektioner.
Oradexon kan spädas med någon av följande infusionsvätskor eller injiceras direkt i överföringsslangen utan utfällning av produktens beståndsdelar.
Efter spädning med dessa infusionsvätskor bibehåller Oradexon sin effekt antingen 12 timmar vid förvaring i rumstemperatur eller 24 timmar vid förvaring vid 2–8 °C.
Infusionsvätskor: 0,9 % natriumklorid, 5 % glukosanhydrid, 10 % invertsocker, 5 % sorbitol, Ringers lösning, Hartmanns lösning (Ringers laktat), Rheomacrodex, Isodex, Haemaccel.
Dosering
Doseringen av Oradexon beror på tillståndets svårighetsgrad och på behandlingssvaret. Biverkningar kan minimeras genom att använda lägsta effektiva dos under kortast möjliga tid eller genom dosering varannan dag. Patienten ska följas noggrant för att anpassa dosen efter sjukdomsaktiviteten. Om ingen positiv effekt observeras inom ett par dagar rekommenderas inte fortsatt glukokortikoidbehandling.
Vid systemisk behandling är 0,05–0,20 mg/kg/dygn vanligtvis tillräckligt. Så snart symptomen lindras ska dosen minskas till lägsta möjliga nivå med kontinuerlig uppföljning av den kliniska bilden, eller gradvis sättas ut helt.
I akuta situationer (t.ex. anafylaxi, akut svår astma eller hjärnödem som inte beror på huvudskada) krävs betydligt högre doser. Startdosen är 10–20 mg (vuxna) intravenöst följt av 6 mg intravenöst eller intramuskulärt var sjätte timme tills ett tillfredsställande svar har uppnåtts. Därefter ska dosen gradvis minskas.
Vid lokal behandling rekommenderas följande doser:
i leder: 2–4 mg i stora och 0,8–1 mg i små leder
i slemsäcken: 2–4 mg, i senskidan: 0,4–1 mg.
Injektionsintervallet är mellan 3–5 dagar och 2–3 veckor.
I händelse av sjukdom, trauma eller kirurgiska ingrepp under behandlingen krävs en tillfällig dosökning. Långtidsbehandling ska alltid sättas ut gradvis för att undvika akut binjureinsufficiens. Dosen ska reduceras under flera veckor eller månader beroende på dos och behandlingstid. Dosreduktion ska utföras med en dos peroral glukokortikoid med en kortare biologisk halveringstid än dexametason, t.ex. prednis(ol)on, som ges dagligen eller helst som en engångsdos på morgonen varannan dag. Om glukokortikoidbehandlingen avslutas efter en längre tids användning kan den tillfälligt behöva återupptas.
Abstinenssyndrom är möjliga och inkluderar feber, muskel- och ledvärk, rinit, konjunktivit, smärtsamma kliande knölar i huden och viktminskning.
En alltför snabb minskning av glukokortikoiddosen efter långvarig behandling kan leda till akut binjureinsufficiens, blodtryckssänkning och död.
Behandling av COVID-19
För vuxna 7,89 mg (motsvarande 6 mg av basformen av dexametason) intravenöst en gång dagligen i upp till 10 dagar.
Pediatrisk population
Rekommenderad dos för pediatriska patienter (ungdomar i åldern 12 år och äldre) är 7,89 mg (motsvarande 6 mg av basformen av dexametason) intravenöst en gång dagligen i upp till 10 dagar.
Behandlingstiden ska anpassas efter kliniskt svar och patientens individuella behov.
Äldre, nedsatt njurfunktion, nedsatt leverfunktion
Ingen dosjustering är nödvändig.
Kontraindikationer
Systemisk eller lokal infektion i eller runt den led som behandlas, om inte särskild antimikrobiell behandling används.
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Svåra allergiska reaktioner. Sällsynta fall av anafylaktoida/anafylaktiska reaktioner med eller utan chock har rapporterats hos patienter som behandlats med parenterala kortikosteroider. Lämpliga försiktighetsåtgärder ska vidtas hos patienter som tidigare har fått allergiska reaktioner mot kortikosteroider.
Allvarliga neurologiska biverkningar relaterade till epidural användning. Allvarliga neurologiska biverkningar, i några fall med fatal utgång, har rapporterats vid epidural injektion av kortikosteroider. De rapporterade biverkningarna omfattar bland annat ryggmärgsinfarkt, paraplegi, tetraplegi, kortikal blindhet och stroke. Dessa allvarliga biverkningar har rapporterats både med och utan fluoroskopi. Säkerhet och effekt vid epidural användning av kortikosteroider har inte fastställts och kortikosteroider har inte godkänts för denna användning.
Tumörlyssyndrom. Efter marknadsintroduktion har tumörlyssyndrom rapporterats hos patienter med malign blodsjukdom som använt enbart dexametason eller dexametason tillsammans med något annat kemoterapeutiskt medel. Patienter med hög risk för tumörlyssyndrom (t.ex. patienter med hög proliferationshastighet, hög tumörbörda och hög känslighet för cytotoxiska medel) ska övervakas noggrant och lämpliga försiktighetsåtgärder vidtas.
Binjurebarksatrofi utvecklas under långtidsbehandling och kan fortsätta flera år efter avslutad behandling. Därför ska långtidsbehandling med kortikosteroider alltid sättas ut gradvis för att undvika akut binjureinsufficiens och dosen reduceras under flera veckor eller månader beroende på dos och behandlingstid. I händelse av sjukdom, trauma eller kirurgiska ingrepp under långtidsbehandling krävs tillfällig dosökning. Om kortikoidsteroidbehandlingen avslutas efter en längre tids användning kan den tillfälligt behöva återupptas.
Antiinflammatoriska/immunsuppressiva effekter. Glukokortikoidbehandling är ospecifik, undertrycker sjukdomssymtomen och försämrar motståndskraften mot infektioner. Den kliniska bilden kan ofta vara atypisk, och svåra infektioner såsom septikemi och tuberkulos kan döljas och framskrida långt innan de upptäcks. Vid behov ska glukokortikoidbehandling kombineras med effektiv antimikrobiell behandling.
Levande vacciner ska inte ges till personer med nedsatt immunsvar. Antikroppsbildningen mot andra vacciner kan minska.
Synrubbing. Synrubbning kan rapporteras vid systemisk eller topikal användning av kortikosteroider. Om en patient inkommer med symtom såsom dimsyn eller andra synrubbningar ska man remittera patienten till en oftalmolog för utredning av möjliga orsaker.
Dessa kan innefatta katarakt, glaukom eller sällsynta sjukdomar såsom central serös korioretinopati, som har rapporterats efter användning av systemiska och topiska kortikosteroider.
Feokromocytomrelaterad kris. Feokromocytomrelaterad kris, som kan vara dödlig, har rapporterats efter administrering av systemiska kortikosteroider. Kortikosteroider ska endast administreras till patienter med misstänkt eller identifierat feokromocytom efter en noggrann nytta–riskbedömning.
Vattkoppor är en särskild orsak till oro eftersom denna i normala fall övergående sjukdom kan vara dödlig hos immunsupprimerade patienter. Vid vattkoppor krävs akut specialmedicinsk behandling. Kortikosteroider ska inte sättas ut och dosen kan till och med behöva ökas.
Glukokortikoider kan orsaka dosberoende tillväxthämning hos barn och ungdomar som kan vara bestående.
Allmänna biverkningar av systemiska glukokortikoider kan få allvarligare konsekvenser hos äldre patienter, särskilt osteoporos, hypertoni, hypokalemi, diabetes, infektionsbenägenhet och hudförtunning. Noggrann klinisk övervakning är nödvändig för att undvika livshotande reaktioner.
Långvarig och upprepad användning av glukokortikoider i belastade leder kan leda till ytterligare degeneration av leden. Detta beror förmodligen på överansträngning av den sjuka leden när smärtan och de andra symtomen avtar.
Hos patienter med något av följande tillstånd bör användning av systemiska glukokortikoider övervägas noggrant och patienterna övervakas frekvent:
- Osteoporos (postmenopausala kvinnor utgör en särskild riskgrupp)
- Hypertoni eller kongestiv hjärtsvikt
- Befintlig eller tidigare svår affektiv störning (särskilt tidigare steroidpsykos)
- Diabetes mellitus (eller diabetes i släkten)
- Tidigare tuberkulos
- Glaukom (eller glaukom i släkten)
- Tidigare glukokortikoidinducerad myopati
- Leverdysfunktion
- Nedsatt njurfunktion
- Epilepsi
- Peptiskt sår
Kortikosteroider ska inte användas vid behandling av huvudskador och stroke, eftersom det sannolikt inte är till nytta och till och med kan vara skadligt.
Prematura nyfödda barn: Tillgängliga data tyder på att långvariga biverkningar som påverkar nervsystemets utveckling har inträffat efter att prematura barn med kronisk lungsjukdom behandlats i ett tidigt skede (< 96 timmar) med startdoser om 0,25 mg/kg två gånger dagligen.
Hypertrofisk kardiomyopati. Hypertrofisk kardiomyopati rapporterades efter systemisk administrering av kortikosteroider, inklusive dexametason, till för tidigt födda spädbarn. I de flesta rapporterade fall var detta reversibelt när behandlingen sattes ut. Hos prematura spädbarn som behandlas systemiskt med dexametason ska diagnostisk utvärdering och övervakning av hjärtats funktion och struktur utföras (avsnitt Biverkningar).
Behandling med systemiska kortikosteroider ska inte avbrytas hos patienter som redan behandlas med systemiska (orala) kortikosteroider av andra skäl (t.ex. patienter med kronisk obstruktiv lungsjukdom), men som inte behöver kompletterande syrgas.
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Interaktioner
Rifampicin, rifabutin, karbamazepin, fenobarbital, fenytoin, primidon och aminoglutetimid påskyndar metabolismen av glukokortikoider och kan försämra den terapeutiska effekten.
Glukokortikoider kan hämma effekten av antidiabetika (inklusive insulin), antihypertensiva läkemedel och diuretika och förstärka den hypokalemiska effekten av acetazolamid, loopdiuretika, tiaziddiuretika och karbenoxolon.
Effekten av kumarinantikoagulantia kan förstärkas vid samtidig behandling med glukokortikoid och blodkoagulationsvärden (t.ex. protrombintid) ska övervakas noga för att undvika spontan blödning.
Renalt clearance av salicylat ökar under behandling med glukokortikoid och utsättande av behandlingen kan leda till salicylatförgiftning.
Dexametason är en måttlig inducerare av CYP3A4. Samtidig administrering av dexametason och läkemedel som metaboliseras av CYP3A4 (inklusive indinavir, erytromycin) kan öka clearance av dessa läkemedel, vilket leder till lägre plasmakoncentrationer av dessa läkemedel.
Kombination med CYP3A-hämmare, t.ex. läkemedel som innehåller kobicistat, förväntas öka risken för systembiverkningar. Kombinationen ska undvikas såvida inte nyttan uppväger den ökade risken för systemiska biverkningar av kortikosteroider, och om så är fallet ska patienter övervakas avseende systemiska biverkningar av kortikosteroider.
Fertilitet, graviditet och amning
Graviditet
Dexametason passerar placentabarriären med lätthet.
Administrering av kortikosteroider till dräktiga djur kan leda till avvikelser i fosterutvecklingen, inklusive gomspalt, hämmad fostertillväxt och effekter på hjärnans tillväxt och utveckling. Det finns inga belägg för att kortikosteroider skulle öka incidensen av medfödda missbildningar såsom gomspalt/läppspalt hos människa. Se även avsnitt Prekliniska säkerhetsuppgifter.
Hypoadrenalism kan förekomma hos det nyfödda barnet.
Om behandling med glukokortikoid ändå är nödvändig (t.ex. för att förhindra andnödssyndrom, RDS) och graviditeten fortskrider normalt, kan modern behandlas på samma sätt som en person som inte är gravid. Patienter med preeklampsi eller vätskeretention ska övervakas noggrant.
Studier har visat en ökad risk för neonatal hypoglykemi efter prenatal administrering av en kort kur med kortikosteroider, inklusive dexametason, till kvinnor som riskerar att föda under den sena prematura perioden.
Amning
Glukokortikoider utsöndras i liten utsträckning i bröstmjölk och barn till mödrar som ges farmakologiska doser ska övervakas noggrant med avseende på binjuresuppression.
Effekter på förmågan att framföra fordon och använda maskiner
Glukokortikoider kan orsaka humörsvängningar eller synrubbningar. Om detta inträffar ska man vara försiktig med att framföra fordon och använda maskiner.
Biverkningar
Tumörlyssyndrom har rapporterats i mycket sällsynta fall (se avsnitt Varningar och försiktighet).
Incidensen av förväntade biverkningar av glukokortikoider är relaterad till dos, tidpunkt för administrering och behandlingens längd. Läkaren ska balansera den terapeutiska effekten av glukokortikoider och risken för biverkningar genom att använda den lägsta effektiva dosen under kortast möjliga tid, helst enligt schemat med behandling varannan dag. Tidig upptäckt av biverkningar och lämplig behandling kan minimera eventuella allvarliga komplikationer av glukokortikoidbehandling.
Mag- och duodenalsår samt eventuell blödning kan ibland förekomma efter kortvarig behandling.
Följande biverkningar har förknippats med långtidsbehandling med systemisk glukokortikoid:
Endokrina/metaboliska. Suppression av hypotalamus-hypofys-binjureaxeln, tillväxthämning hos barn och ungdomar, oregelbunden och utebliven menstruation. Ansiktsförändringar vid Cushings, hirsutism, viktökning, minskad kolhydrattolerans och ökat behov av antidiabetika. Negativ protein- och kalciumbalans. Ökad aptit.
Antiinflammatoriska och immunsuppressiva effekter. Ökad infektionsbenägenhet och maskering av kliniska tecken på allvarliga infektioner, opportunistiska infektioner, aktivering av tuberkulos.
Muskuloskeletala. Osteoporos, frakturer i ryggkotor och rörben, avaskulär osteonekros, senruptur. Proximal myopati.
Vätske- och elektrolytrubbningar. Natrium- och vätskeretention, hypertoni, kaliumförlust, hypokalemisk alkalos.
Neuropsykiatriska. Eufori, psykologiskt beroende, depression, insomni, förvärrad schizofreni. Intrakraniell tryckökning och papillödem hos barn (pseudotumor cerebri), vanligen efter avslutad behandling. Förvärrad epilepsi.
Ögon. Ökat intraokulärt tryck, glaukom, papillödem, posterior subkapsulär katarakt, uttunning av kornea och sklera, förvärrade virus- eller svampinfektioner i ögat, korioretinopati, dimsyn (se även avsnitt Varningar och försiktighet).
Gastrointestinala. Dyspepsi, peptiskt sår, perforation och blödning, akut pankreatit, candidiasis.
Hud. Försämrad läkning, hudatrofi, blåmärken, telangiektasi, hudbristningar, akne.
Vanliga. Överkänslighet, inklusive anafylaxi och angioödem, har rapporterats. Leukocytos. Tromboemboli.
Hjärtat. Hypertrofisk kardiomyopati hos för tidigt födda spädbarn (se avsnitt Varningar och försiktighet) (ingen känd frekvens).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Det är svårt att definiera en överdos av glukokortikoid eftersom den terapeutiska dosen varierar beroende på indikation och patientens behov. Pulsbehandling med massiva intravenösa glukokortikoiddoser i nödsituationer är relativt oskadligt. Glukokortikoideffekten kan vara för stark. Behandlingen är symtomatisk och vid behov understödjande.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Kortikosteroider för systemiskt bruk, Glukokortikoider, ATC-kod: H02AB02
Dexametason är en syntetisk glukokortikoid med en inflammatorisk effekt som är cirka 7 gånger högre än för prednisolon och 30 gånger högre än för hydrokortison.
Glukokortikoider påverkar hypotalamus-hypofysaxeln vid specifika cellmembranreceptorer. Glukokortikoider diffunderas genom cellmembranet till andra vävnader och binder till specifika cytoplasmareceptorer som därefter förflyttar sig till cellkärnan och stimulerar proteinsyntesen. Glukokortikoider har en antiallergisk, antitoxisk, chockmotverkande, antipyretisk och immunsuppressiv effekt.
Dexametason har endast en svag mineralokortikoideffekt och är därför lämpligt för behandling av patienter med hjärtsvikt eller hypertoni.
RECOVERY-studien (Randomised Evaluation of COVid-19 thERapY) är en prövarinitierad, individuellt randomiserad, kontrollerad, öppen, adaptiv plattformsstudie för att utvärdera effekten av möjliga behandlingar för sjukhusinlagda COVID-19-patienter.
Studien utfördes på 176 sjukhus i Storbritannien.
6425 patienter randomiserades och fick endera dexametason (2104 patienter) eller enbart standardbehandling (4321 patienter). 89 % av patienterna hade laboratoriebekräftad SARS-CoV-2-infektion.
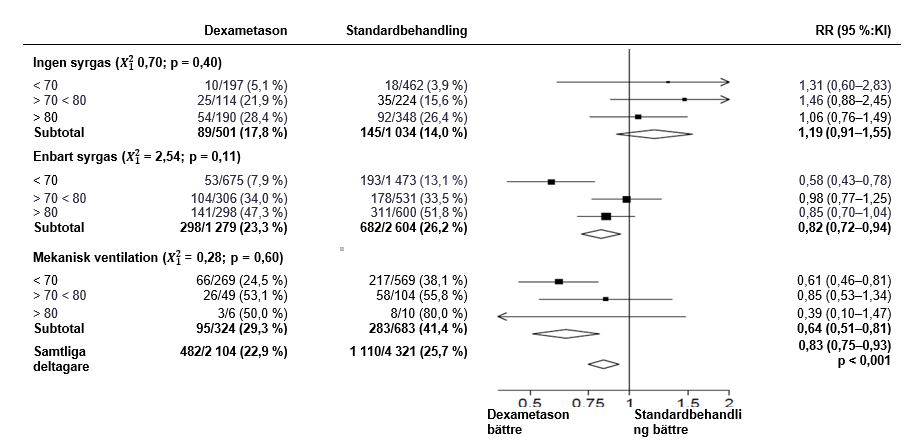
Vid randomisering erhöll 16 % av patienterna invasiv mekanisk ventilation eller extrakorporeal membransyresättning (ECMO), 60 % fick enbart syrgasbehandling (med eller utan icke-invasiv ventilatorbehandling) och 24 % fick ingen av behandlingarna ovan.
Patienternas medelålder var 66,1+/-15,7 år. 36 % av patienterna var kvinnor. 24 % av patienterna hade en historik av diabetes, 27 % av hjärtsjukdom, 21 % av kronisk lungsjukdom.
Primärt effektmått
Dödligheten vid 28 dagar var signifikant lägre i dexametasongruppen jämfört med gruppen som fick standardbehandling, dödsfall rapporterades hos 482 av 2104 patienter (22,9 %) jämfört med hos 1110 av 4321 patienter (25,7 %) (frekvenskvot, 0,83; 95 % konfidensintervall [KI], 0,75–0,93; p < 0,001).
I dexametasongruppen var incidensen av dödsfall lägre än hos gruppen som fick standardbehandling för de patienter i dexametasongruppen som fick invasiv mekanisk ventilation (29,3 % vs. 41,4 %; frekvenskvot, 0,64; 95 % KI, 0,51–0,81) samt hos de som fick syrgasbehandling utan invasiv mekanisk ventilation) (23,3 % vs. 26,2 %; frekvenskvot, 0,82; 95 % KI, 0,72–0,94).
Det sågs ingen tydlig effekt av dexametason hos patienter som inte fick något respiratoriskt stöd vid randomisering (17,8 % vs. 14,0 %; frekvenskvot, 1,19; 95 % KI, 0,91–1,55).
Sekundära effektmått
Patienterna i dexametasongruppen hade kortare sjukhusinläggning än de i gruppen som fick standardbehandling (median, 12 dagar vs. 13 dagar) samt större sannolikhet att vara vid liv och skrivas ut inom 28 dagar (frekvenskvot, 1,10; 95 % KI, 1,03 till 1,17).
I linje med det primära effektmåttet sågs den största effekten på utskrivning inom 28 dagar hos patienter som fick invasiv mekanisk ventilation vid randomisering (frekvenskvot, 1,48; 95 % KI 1,16–1,90), följt av patienter som fick enbart syrgasbehandling (frekvenskvot, 1,15; 95 % KI 1,06–1,24).
Hos patienter som inte fick syrgasbehandling sågs ingen fördelaktig effekt (frekvenskvot, 0,96; 95 %
KI 0,85–1,08).
Dexametason | Standardbehandling | Frekvens- eller riskkvot | |
Behandlingsresultat | (N = 2 104) | (N = 4 321) | (95 %:KI* |
antal patienter/totala antalet patienter (%) | |||
Primärt behandlingsresultat | |||
Dödlighet vid 28 dagar | 482 / 2 104 (22,9) | 1 110 / 4 321 (25,7) | 0,83 (0,75–0,93) |
Sekundära behandlingsresultat | |||
Utskrivning från sjukhus inom 28 dagar | 1 413 / 2 104 (67,2) | 2 745 / 4 321 (63,5) | 1,10 (1,03–1,17) |
Invasiv mekanisk ventilation eller död† | 456 / 1 780 (25,6) | 994 / 3 638 (27,3) | 0,92 (0,84–1,01) |
Invasiv mekanisk ventilation | 102 / 1 780 (5,7) | 285 / 3 638 (7,8) | 0,77 (0,62–0,95) |
Död | 387 / 1 780 (21,7) | 827 / 3 638 (22,7) | 0,93 (0,84–1,03) |
* Frekvenskvoten har åldersjusterats avseende resultat för 28-dagarsmortaliteten samt sjukhusutskrivning. Riskkvoten har åldersjusterats avseende resultat för behandling med Invasiv mekanisk ventilation eller död samt dess undergrupper.
† Patienter som fick invasiv mekanisk ventilation vid randomisering är exkluderade från denna kategori.
Säkerhet
Fyra allvarliga biverkningar (Serious Adverse Events (SAEs)) var relaterade till studiebehandlingen: två allvarliga biverkningar avseende hyperglykemi, en allvarlig biverkning avseende steroidinducerad psykos, och en allvarlig biverkning avseende blödning från övre mag-tarmkanalen. Samtliga biverkningar var övergående.
Undergruppanalyser
Effekten av administrering av DEXAMETASON på 28-dagarsmortaliteten, fördelat på ålder samt respiratoriskt stöd vid tidpunkten för randomisering2
Effekten av administrering av DEXAMETASON på 28-dagarsmortaliteten, fördelat på respiratoriskt stöd vid tidpunkten för randomisering samt förekomst av kronisk sjukdom i anamnesen3
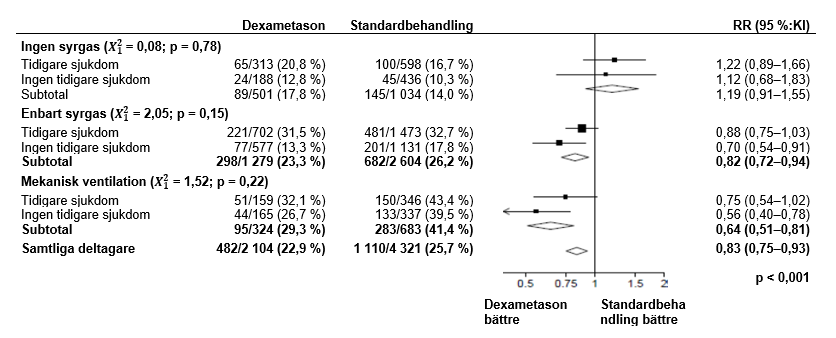
2, 3 (källa: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1; doi: https://doi.org/10.1101/2020.06.22.20137273)
Farmakokinetiska egenskaper
Absorption
Efter injektion av Oradexon hydrolyseras dexametasonnatriumfosfatet snabbt till dexametason. Maximal koncentration i plasma uppnås inom 5 minuter vid intravenös administrering av 20 mg dexametason.
Distribution
Dexametason binds (upp till 77 %) till plasmaproteiner, huvudsakligen albumin. Dexametason ackumuleras i levern, njurarna och binjurarna.
Metabolism och eliminering
Det metaboliseras långsamt i levern och utsöndras främst i urinen, huvudsakligen som okonjugerade steroider. Halveringstiden för eliminering i plasma är 3,5–4,5 timmar, men eftersom effekten varar längre än de signifikanta steroidkoncentrationerna i plasma har halveringstiden i plasma ingen nämnvärd betydelse och den biologiska halveringstiden är mer relevant. Halveringstiden för dexametasons biologiska aktivitet är 36–54 timmar.
Prekliniska säkerhetsuppgifter
I djurstudier har gomspalt observerats hos råtta, mus, hamster, kanin, hund och primater, men inte hos hästar eller får. I vissa fall var dessa avvikelser förknippade med CNS- och hjärtdefekter. Hos primater sågs effekter i hjärnan efter exponering. Dessutom kan fostertillväxten hämmas. Alla dessa effekter observerades vid höga doser.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Dinatriumedetat, glycerol, natriumhydroxid och fosforsyra, vatten för injektionsvätskor.
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C–8 °C). Får ej frysas. Förvaras i originalförpackningen.
Efter spädning med infusionsvätskor bibehåller Oradexon sin effekt antingen 12 timmar vid förvaring i rumstemperatur (15–25 °C) eller 24 timmar vid förvaring vid 2–8 °C.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ORADEXON injektioneste, liuos
5 mg/ml (L:ei) 10 x 1 ml (33,05 €)
PF-selosteen tieto
10 x 1 ml och 50 x 1 ml
2 ml färglös injektionsflaska.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Färglös, klar lösning.
Särskilda anvisningar för destruktion och övrig hantering
Inga särskilda anvisningar.
Ersättning
ORADEXON injektioneste, liuos
5 mg/ml 10 x 1 ml
- Ei korvausta.
Atc-kod
H02AB02
Datum för översyn av produktresumén
29.08.2022
Yhteystiedot
Borupvang 3
2750 Ballerup
Denmark
+358 9 74790156
aspennordic@aspenpharma.eu
