MIDIANA filmdragerad tablett 0,03/3 mg
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Kysymyksiä ja vastauksia yhdistelmäehkäisyvalmisteista: Viimeisintä tietoa naisille
Terveydenhuollon ammattilainen
Tarkistuslista yhdistelmäehkäisyvalmisteiden määrääjille
Yhdistelmäehkäisyvalmisteet: Materiaalia naisen yksilöllisten veritulppariskitekijöiden arviointiin, keskustelun tueksi ja sopivimman valmisteen valitsemiseksi
Kvalitativ och kvantitativ sammansättning
En tablett innehåller 0,03 mg etinylestradiol och 3 mg drospirenon.
Hjälpämnen med känd effekt:
En filmdragerad tablett innehåller 48,17 mg laktosmonohydrat och 0,070 mg sojalecitin.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Filmdragerad tablett.
Kliniska uppgifter
Terapeutiska indikationer
Antikonception.
Vid beslut om att förskriva Midiana ska läkaren beakta den enskilda kvinnans nuvarande riskfaktorer, framför allt risken för venös tromboembolism (VTE), och risken för VTE med Midiana jämfört med andra kombinerade hormonella preventivmedel (se avsnitt Kontraindikationer och Varningar och försiktighet).
Dosering och administreringssätt
Administreringssätt: oral användning
Dosering
Hur Midiana ska tas
Tabletterna måste tas varje dag vid ungefär samma tidpunkt, vid behov med lite vätska, i den ordning som visas på blisterförpackningen. En tablett måste tas dagligen i 21 på varandra följande dagar. Varje efterföljande blisterförpackning ska påbörjas efter ett tablettuppehåll på sju dagar. Under den här tiden inträffar normalt en bortfallsblödning. Den börjar normalt 2–3 dagar efter intaget av den sista tabletten och kanske inte är slut innan nästa förpackning påbörjas.
Så här påbörjas Midiana
- Ingen tidigare användning av hormonell preventivmetod (den senaste månaden)
Tablettintaget måste påbörjas dag 1 i kvinnans normala menstruationscykel (d.v.s. på menstruationsblödningens första dag).
- Byte från en annan kombinerad hormonell preventivmetod (kombinerat p‑piller, vaginalring eller depotplåster)
Kvinnan ska helst börja ta Midiana dagen efter den sista aktiva tabletten (den sista tabletten som innehåller de aktiva substanserna) av hennes tidigare kombinerade p‑piller, men inte senare än dagen efter det vanliga tablettuppehållet eller intaget av placebotabletterna med hennes tidigare kombinerade p‑piller. Om vaginalring eller depotplåster har använts ska kvinnan helst börja ta Midiana samma dag som ringen eller plåstret tas bort, men inte senare än vid tidpunkten för när nästa ring eller plåster skulle ha satts in/applicerats.
- Byte från ett preventivmedel som enbart innehåller gestagen (minipiller, injektion, implantat) eller från en hormonspiral som frisätter gestagen
Kvinnan kan byta från minipiller vilken dag som helst (från implantat eller hormonspiral samma dag som de tas bort, från injektion vid tidpunkten för nästa injektion) men ska i samtliga dessa fall rådas att samtidigt använda en barriärmetod under de första sju dagarna av tablettintag.
- Efter abort i den första trimestern
Kvinnan kan börja ta tabletterna omedelbart. Om hon gör det behöver hon inte använda någon ytterligare preventivmetod.
- Efter förlossning eller abort i den andra trimestern
Kvinnan ska rådas att börja ta Midiana 21–28 dagar efter förlossning eller abort i den andra trimestern. Om kvinnan startar senare ska hon rådas att samtidigt använda en barriärmetod under de första sju dagarna. Om samlag redan ägt rum ska graviditet uteslutas innan kvinnan börjar använda kombinerade p‑piller, alternativt ska kvinnan vänta på sin första menstruationsperiod.
Användning under amning, se avsnitt Fertilitet, graviditet och amning.
Om man har glömt att ta tabletter
Om det har gått mindre än 12 timmar sedan kvinnan skulle ta en tablett är skyddet mot graviditet inte nedsatt. Kvinnan ska ta tabletten så snart hon kommer ihåg det och därefter ta övriga tabletter vid den vanliga tidpunkten.
Om det har gått mer än 12 timmar sedan kvinnan skulle ha tagit en tablett kan skyddet mot graviditet vara nedsatt. Vid glömda tabletter gäller följande två grundregler:
- Tablettuppehållet får aldrig vara längre än sju dagar.
- Sju dagars oavbrutet tablettintag krävs för att uppnå adekvat hämning av hypotalamus-hypofys‑ovarieaxeln.
Således kan följande råd ges:
- Vecka 1
Kvinnan ska ta den senast glömda tabletten så snart hon kommer ihåg det, även om det betyder att hon måste ta två tabletter samtidigt. Hon ska därefter fortsätta ta tabletterna vid den vanliga tidpunkten. En barriärmetod (till exempel kondom) ska samtidigt användas de följande sju dagarna. Om samlag ägt rum de föregående sju dagarna bör möjligheten av en graviditet övervägas. Ju fler glömda tabletter och ju närmare det månatliga tablettuppehållet detta sker, desto större är risken för graviditet.
- Vecka 2
Kvinnan ska ta den senast glömda tabletten så snart hon kommer ihåg det, även om det betyder att hon måste ta två tabletter samtidigt. Hon ska därefter fortsätta ta tabletterna vid den vanliga tidpunkten. Under förutsättning att kvinnan har tagit tabletterna på rätt sätt under de sju dagar som föregått den glömda tabletten behövs ingen extra preventivmetod. Om kvinnan har glömt fler än en tablett ska hon rådas att använda en extra preventivmetod i sju dagar.
- Vecka 3
Risken för nedsatt skydd mot graviditet är stor på grund av det kommande tablettuppehållet på sju dagar. Genom att ändra tablettintaget kan emellertid nedsatt skydd mot graviditet fortfarande förhindras. Genom att följa ett av de två alternativen nedan behöver kvinnan inte använda någon annan preventivmetod, under förutsättning att hon under de sju dagar som föregått den glömda tabletten har tagit alla tabletter på rätt sätt. Om så inte är fallet ska hon följa det första av de två alternativen och använda en extra preventivmetod de följande sju dagarna.
-
Kvinnan ska ta den senast glömda tabletten så snart hon kommer ihåg det, även om det betyder att hon måste ta två tabletter samtidigt. Hon ska därefter fortsätta ta tabletterna vid den vanliga tidpunkten. Nästa blisterförpackning ska därefter påbörjas så snart sista tabletten i den aktuella blisterförpackningen har tagits, d.v.s. det ska inte vara något uppehåll mellan förpackningarna. Kvinnan får troligen ingen bortfallsblödning förrän alla tabletter i den andra blisterförpackningen har tagits men kan få stänkblödningar eller genombrottsblödning de dagar hon tar tabletter.
- Kvinnan kan också rådas att sluta ta tabletter från den aktuella blisterförpackningen. Därefter ska hon ha ett tablettuppehåll på högst sju dagar, inklusive de dagar hon har glömt tabletter, och sedan fortsätta med nästa blisterförpackning.
Om kvinnan har glömt tabletter och inte får någon bortfallsblödning under det första vanliga tablettuppehållet ska möjligheten av en graviditet övervägas.
Råd vid gastrointestinala besvär
Vid svåra gastrointestinala besvär (t.ex. kräkningar eller diarré) kan absorptionen bli ofullständig, och då ska en kompletterande preventivmetod användas.
Om kräkning inträffar inom 3–4 timmar efter tablettintaget ska en ny, ersättande tablett tas så snart som möjligt. Den nya tabletten ska om möjligt tas inom 12 timmar efter det normala tablettintaget. Om det gått mer än 12 timmar gäller råden om glömda tabletter (avsnitt Dosering och administreringssätt ”Om man har glömt att ta tabletter”). Om kvinnan inte vill ändra sitt normala schema för tablettintaget måste hon ta den extra tabletten (de extra tabletterna) från en annan blisterförpackning.
Att skjuta upp en menstruationsperiod
Om kvinnan vill skjuta upp en menstruationsperiod ska hon fortsätta med nästa blisterförpackning med Midiana utan något tablettuppehåll. Förskjutningen kan pågå så länge kvinnan önskar, dock högst tills den andra blisterförpackningen är slut. Under den här perioden kan kvinnan få genombrottsblödning eller stänkblödning. Regelbundet intag av Midiana ska återupptas efter det vanliga tablettfria intervallet på sju dagar.
Om kvinnan vill flytta den första blödningsdagen till en annan veckodag än den nuvarande kan hon rådas att förkorta det kommande tablettuppehållet med önskat antal dagar. Ju kortare intervallet är, desto större är risken att hon inte får någon bortfallsblödning utan får genombrottsblödning och stänkblödning under intaget av tabletter från nästa förpackning (på samma sätt som när en menstruation skjuts upp).
Pediatrisk population
Midiana är endast indicerat efter menarke. Epidemiologiska data från över 2 000 unga kvinnor under 18 år tyder inte på att säkerhet och effekt skulle vara annorlunda i denna unga åldersgrupp än hos kvinnor över 18 år.
Kontraindikationer
Kombinerade hormonella preventivmedel ska inte användas vid något av nedanstående tillstånd. Om något av dessa tillstånd uppkommer för första gången vid användning av kombinerade hormonella preventivmedel ska läkemedlet sättas ut omedelbart.
-
Förekomst av eller risk för venös tromboembolism (VTE)
- venös tromboembolism – pågående VTE (på antikoagulantia) eller anamnes på (t.ex. djup ventrombos [DVT] eller lungemboli [PE])
- känd ärftlig eller förvärvad predisposition för venös tromboembolism, t.ex. APC‑resistens (inklusive Faktor V Leiden), antitrombin III‑brist, protein C‑brist, protein S‑brist
- större kirurgiskt ingrepp med långvarig immobilisering (se avsnitt Varningar och försiktighet)
- hög risk för venös tromboembolism på grund av förekomst av flera riskfaktorer (se avsnitt Varningar och försiktighet)
-
Förekomst av eller risk för arteriell tromboembolism (ATE)
- arteriell tromboembolism – pågående arteriell tromboembolism, anamnes på arteriell tromboembolism (t.ex. myokardiell infarkt) eller prodromalsymtom (t.ex. angina pectoris)
- cerebrovaskulär sjukdom – pågående stroke, anamnes på stroke eller prodromalsymtom (t.ex. transitorisk ischemisk attack, TIA)
- känd ärftlig eller förvärvad predisposition för arteriell tromboembolism, t.ex. hyperhomocysteinemi och antifosfolipidantikroppar (antikardiolipinantikroppar, lupusantikoagulant)
- migrän med fokala neurologiska symtom i anamnesen
- hög risk för arteriell tromboembolism på grund av flera riskfaktorer (se avsnitt Varningar och försiktighet) eller på grund av förekomst av en allvarlig riskfaktor som:
- diabetes mellitus med vaskulära symtom
- svår hypertoni
- svår dyslipoproteinemi.
- Pågående eller tidigare svår leversjukdom så länge leverfunktionsvärdena inte har normaliserats
- Grav njursvikt eller akut njursvikt
- Nuvarande eller tidigare förekomst av levertumörer (benigna eller maligna)
- Kända eller misstänkta könshormonberoende maligniteter (t.ex. i könsorgan eller bröst)
- Odiagnostiserad vaginalblödning
- Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen
- Överkänslighet mot jordnötter eller soja
Midiana är kontraindicerat vid samtidig användning med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, läkemedel som innehåller glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir (se avsnitt Interaktioner).
Varningar och försiktighet
Varningar
-
Vid förekomst av någon av de tillstånd eller riskfaktorer som anges nedan, bör lämpligheten av Midiana diskuteras med kvinnan.
-
Om något av dessa tillstånd eller riskfaktorer förvärras eller uppträder för första gången, ska kvinnan ta kontakt med sin läkare. Läkaren ska då besluta om användningen av Midiana ska avbrytas.
-
Vid bekräftad eller misstänkt venös eller arteriell tromboembolism ska användningen av kombinerade hormonella preventivmedel avslutas. Om antikoagulationsbehandling inleds ska en adekvat alternativ preventivmetod sättas in på grund av teratogeniciteten av antikoagulantia (kumariner).
- Cirkulationsrubbningar
Risk för venös tromboembolism (VTE)
Användning av ett kombinerat hormonellt preventivmedel ökar risken för venös tromboembolism (VTE) jämfört med icke‑användning. Produkter som innehåller levonorgestrel, norgestimat eller noretisteron förknippas med den lägsta risken för VTE. Andra produkter som t.ex. Midiana kan ha en risk som är dubbelt så stor. Beslutet att använda en annan produkt än den med den lägsta risken för VTE ska tas först efter en diskussion med kvinnan för att säkerställa att hon känner till risken för VTE med Midiana, hur hennes riskfaktorer påverkar den här risken, och att hennes VTE‑risk är störst under det första året hon använder produkten. Det finns också vissa belägg för att risken är större när ett kombinerat hormonellt preventivmedel används igen efter ett uppehåll på 4 veckor eller längre.
Hos kvinnor som inte använder ett kombinerat hormonellt preventivmedel och som inte är gravida kommer cirka 2 av 10 000 att utveckla en VTE under en period om ett år. Hos en enskild kvinna kan dock risken vara betydligt högre, beroende på hennes underliggande riskfaktorer (se nedan).
Man uppskattar1 att av 10 000 kvinnor som använder kombinerade hormonella preventivmedel innehållande drospirenon kommer mellan 9 och 12 kvinnor att utveckla en VTE under ett år; detta kan jämföras med cirka 62 kvinnor som använder kombinerade hormonella preventivmedel som innehåller levonorgestrel.
I båda fallen är antalet VTE-händelser per år färre än det antal händelser som förväntas hos kvinnor under graviditet eller under postpartumperioden.
VTE kan vara dödligt i 1–2 % av fallen.
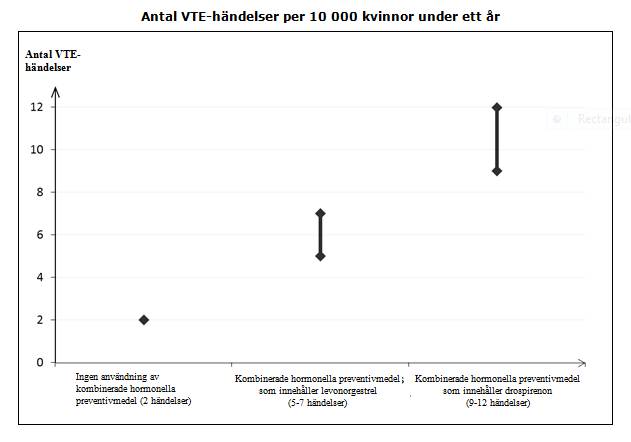
1 Incidensen uppskattades från samtliga epidemiologiska studiedata genom att jämföra relativa risker för de olika produkterna med kombinerade hormonella preventivmedel som innehåller levonorgestrel.
2 Genomsnittsintervallet är på 5–7 per 10 000 kvinnoår, baserat på en relativ risk för kombinerade hormonella preventivmedel som innehåller levonorgestrel jämfört med en icke‑användning som har ett genomsnittsintervall på cirka 2,3–3,6.
I extremt sällsynta fall har trombos rapporterats hos användare av kombinerade hormonella preventivmedel i andra blodkärl, t.ex. i hepatiska, mesenteriska, renala eller retinala vener och artärer.
Riskfaktorer för VTE
Risken för venösa tromboemboliska komplikationer hos användare av kombinerade hormonella preventivmedel kan öka betydligt hos kvinnor med ytterligare riskfaktorer, framför allt om flera riskfaktorer föreligger (se tabell).
Midiana är kontraindicerat om en kvinna har flera riskfaktorer som innebär att hon löper hög risk för venösa tromboser (se avsnitt Kontraindikationer). Om en kvinna har mer än en riskfaktor är det möjligt att risken är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk för VTE beaktas. Om förhållandet nytta‑risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för VTE
Riskfaktor | Kommentar |
Fetma (BMI över 30 kg/m2) | Risken ökar betydligt när BMI ökar. |
Långvarig immobilisering, större kirurgiskt ingrepp, alla operationer i ben eller bäcken, neurokirurgi eller omfattande skada | I dessa situationer är det lämpligt att göra ett uppehåll i användningen av p‑piller (vid elektiv kirurgi minst fyra veckor i förväg) och inte återuppta användningen förrän två veckor efter fullständig remobilisering. En annan preventivmetod bör användas för att undvika oavsiktlig graviditet. |
Positiv familjeanamnes (venös tromboembolism hos ett syskon eller en förälder i relativt unga år, t.ex. före 50 års ålder) | Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
Andra medicinska tillstånd som förknippas med VTE | Cancer, systemisk lupus erythematosus, hemolytiskt uremiskt syndrom, kronisk inflammatorisk tarmsjukdom (Crohns sjukdom eller ulcerös kolit) och sicklecellsjukdom. |
Stigande ålder | Framför allt hos kvinnor över 35 år. |
Det råder inte enighet om den eventuella betydelsen av varicer och ytlig tromboflebit har för uppkomst eller progression av venös trombos.
Den ökade risken för tromboembolism vid graviditet, och framför allt 6‑veckorsperioden i puerperiet, måste beaktas (för information om ”Graviditet och amning” se avsnitt Fertilitet, graviditet och amning).
Symtom på VTE (djup ventrombos och lungemboli)
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera vårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på djup ventrombos (DVT) kan omfatta:
- unilateral svullnad av ben och/eller fot eller längs en ven i benet
- smärta eller ömhet i benet som bara känns vid stående eller gående
- ökad värme i det drabbade benet med rödfärgning eller missfärgning av benet.
Symtom på lungemboli (PE) kan omfatta:
- plötslig debut av oförklarlig andfåddhet eller snabb andning
- plötslig hosta som kan förknippas med hemoptys
- kraftig bröstsmärta
- kraftig ostadighetskänsla eller yrsel
- snabba eller oregelbundna hjärtslag.
En del av dessa symtom (t.ex. andfåddhet och hosta) är icke‑specifika och kan feltolkas som mer vanliga eller mindre allvarliga händelser (t.ex. luftvägsinfektioner).
Andra tecken på vaskulär ocklusion kan omfatta: plötslig smärta, svullnad och lätt blå missfärgning av en extremitet.
Om ocklusionen uppkommer i ögonen kan symtomen variera från smärtfri dimsyn som kan utvecklas till synförlust. Ibland kan synförlust uppkomma nästan omedelbart.
Risk för arteriell tromboembolism (ATE)
Epidemiologiska studier har visat ett samband mellan användning av kombinerade hormonella preventivmedel och en ökad risk för arteriell tromboembolism (myokardinfarkt) eller cerebrovaskulär händelse (t.ex. transitorisk ischemisk attack, stroke). Arteriella tromboemboliska händelser kan vara dödliga.
Riskfaktorer för ATE
Risken för arteriella tromboemboliska komplikationer eller för en cerebrovaskulär händelse hos användare av kombinerade hormonella preventivmedel ökar hos kvinnor med riskfaktorer (se tabell). Midiana är kontraindicerat om kvinnan har en allvarlig eller flera riskfaktorer som innebär att hon löper hög risk för ATE (se avsnitt Kontraindikationer). Om kvinnan har mer än en riskfaktor är det möjligt att riskökningen är större än summan av de enskilda faktorerna – i detta fall bör hennes totala risk beaktas. Om förhållandet nytta‑risk anses vara negativt ska ett kombinerat hormonellt preventivmedel inte förskrivas (se avsnitt Kontraindikationer).
Tabell: Riskfaktorer för ATE
Riskfaktor | Kommentar |
Stigande ålder | Framför allt hos kvinnor över 35 år |
Rökning | Kvinnor över 35 år bör starkt rekommenderas att sluta röka om de vill använda ett kombinerat hormonellt preventivmedel. Kvinnor över 35 år som fortsätter att röka ska starkt rekommenderas att använda en annan preventivmetod. |
Hypertoni | |
Fetma (BMI över 30 kg/m2) | Risken ökar betydligt när BMI ökar. |
Positiv familjeanamnes (arteriell tromboembolism hos ett syskon eller en förälder i relativt unga år, t.ex. före 50 års ålder) | Om man misstänker en hereditär predisposition, ska kvinnan remitteras till en specialist för rådgivning innan hon beslutar sig för att använda någon form av kombinerade hormonella preventivmedel. |
Migrän | En ökning av frekvens eller svårighetsgrad av migrän vid användning av kombinerade hormonella preventivmedel (som kan vara prodromalsymtom på en cerebrovaskulär händelse) kan vara ett skäl för omedelbart utsättande. |
Andra medicinska tillstånd som förknippas med negativa vaskulära händelser | Diabetes mellitus, hyperhomocysteinemi, hjärtklaffssjukdom och förmaksflimmer, dyslipoproteinemi och systemisk lupus erythematosus. |
Symtom på ATE
Vid symtom ska kvinnan rådas att omedelbart söka läkare och informera hälso- och sjukvårdpersonalen om att hon tar kombinerade hormonella preventivmedel.
Symtom på en cerebrovaskulär händelse kan omfatta:
- plötslig domning eller svaghet i ansikte, armar eller ben, speciellt på en sida av kroppen
- plötsliga problem med att gå, yrsel, förlorad balans eller koordination
- plötslig förvirring, svårigheter att tala eller förstå
- plötsliga synproblem i ett eller båda ögonen
- plötslig, svår eller långvarig huvudvärk utan känd orsak
- medvetslöshet eller svimning med eller utan krampanfall.
Tillfälliga symtom som tyder på att händelsen är en transitorisk ischemisk attack (TIA).
Symtom på en hjärtinfarkt kan vara:
- smärta, obehag, tryck, tyngdkänsla, tryck eller fyllnadskänsla i bröstet, armen eller nedanför bröstbenet
- obehag som strålar mot ryggen, käken, halsen, armen, magen
- mättnadskänsla, matsmältningsbesvär eller kvävning
- svettning, illamående, kräkningar eller yrsel
- extrem svaghet, ångest eller andfåddhet
-
snabba eller oregelbundna hjärtslag.
- Tumörer
En ökad risk för livmoderhalscancer har rapporterats i vissa epidemiologiska studier hos kvinnor som under lång tid (> 5 år) använt kombinerade p‑piller, men det råder fortsatt oenighet om i vilken utsträckning denna observation påverkas av vilseledande faktorer, t.ex. sexuellt beteende, och andra faktorer såsom humant papillomvirus (HPV).
En metaanalys från 54 epidemiologiska studier visade att det finns en obetydligt ökad relativ risk (RR = 1,24) för bröstcancer hos kvinnor som använder kombinerade p‑piller. Den ökade risken minskar successivt under 10 år efter att användningen av kombinerade p‑piller har upphört. Eftersom bröstcancer är sällsynt hos kvinnor under 40 år är det ökade antalet bröstcancerdiagnoser hos kvinnor som för närvarande använder eller nyligen har använt kombinerade p‑piller litet i förhållande till den totala risken för bröstcancer. Dessa studier visar inte på någon kausalitet. Det observerade mönstret för ökad risk kan bero på att bröstcancer diagnosticeras tidigare hos användare av kombinerade p‑piller, på de biologiska effekterna av kombinerade p‑piller eller en kombination av båda. De fall av bröstcancer som diagnostiseras hos användare av p‑piller tenderar att vara mindre kliniskt avancerade än de cancerfall som diagnostiseras hos icke‑användare.
I sällsynta fall har benigna levertumörer, och ännu mer sällan maligna levertumörer, rapporterats hos användare av kombinerade p‑piller. I enstaka fall har dessa tumörer lett till livshotande intraabdominella blödningar. En levertumör bör övervägas som differentialdiagnos vid svår smärta i övre delen av buken, leverförstoring eller tecken på intraabdominell blödning hos kvinnor som använder kombinerade p‑piller.
Vid användning av kombinerade p‑piller i hög dos (0,05 mg etinylestradiol) är risken för cancer i endometriet och äggstockarna lägre. Huruvida detta även gäller lågdoserade kombinerade p‑piller är ännu inte fastställt.
- Övriga tillstånd
Nedstämdhet och depression är välkända biverkningar vid användning av hormonella preventivmedel (se avsnitt Biverkningar). Depression kan vara allvarligt och är en välkänd riskfaktor för självdestruktivt beteende och självmord. Kvinnor ska rådas att kontakta läkare om de upplever humörförändringar och depressiva symtom, också direkt efter inledd behandling.
Gestagenkomponenten i produkten är en aldosteronantagonist med kaliumsparande egenskaper. Hos de flesta användarna förväntas ingen ökning av kaliumnivåerna. I en klinisk studie sågs emellertid en liten, men inte signifikant, höjning av kaliumnivåerna i serum hos vissa patienter med lätt eller måttligt nedsatt njurfunktion vid samtidigt intag av kaliumsparande läkemedel och drospirenon. Således rekommenderas kontroll av kaliumnivåerna i serum under den första behandlingscykeln hos patienter med nedsatt njurfunktion, om serumkalium låg i det övre referensintervallet före behandling, och i synnerhet om patienten samtidigt använder kaliumsparande läkemedel. Se även avsnitt Interaktioner.
Kvinnor med hypertriglyceridemi eller hereditet för detta kan löpa ökad risk för pankreatit vid användning av kombinerade p‑piller.
Även om små ökningar av blodtrycket har rapporterats hos många kvinnor som använder kombinerade p‑piller är kliniskt relevanta ökningar sällsynta. Endast i dessa sällsynta fall ska kombinerade p‑piller sättas ut omedelbart. Om blodtrycket förblir konstant förhöjt under användning av kombinerade p‑piller eller om ett signifikant förhöjt blodtryck inte svarar adekvat på blodtryckssänkande läkemedelsbehandling hos en patient med preexisterande hypertoni måste det kombinerade p-pillret sättas ut. Användningen av det kombinerade p‑pillret kan återupptas om normala blodtrycksvärden uppnås med blodtryckssänkande behandling.
Följande tillstånd har rapporterats uppkomma eller förvärras vid både graviditet och användning av kombinerade p‑piller, men det finns inte övertygande bevis för ett samband mellan dem och användning av kombinerade p‑piller: kolestatisk ikterus och/eller kolestasrelaterad pruritus, gallstenar, porfyri, systemisk lupus erythematosus, hemolytiskt‑uremiskt syndrom, Sydenhams korea, herpes gestationis, otosklerosrelaterad hörselnedsättning.
Exogena östrogener kan inducera eller förvärra symtom av ärftligt eller förvärvat angioödem.
Akuta eller kroniska störningar av leverfunktionen kan göra det nödvändigt att sätta ut kombinerade p‑piller tills leverfunktionen åter är normal. Återfall av kolestatisk ikterus och/eller kolestasrelaterad pruritus, som tidigare uppkommit under graviditet eller vid användning av könshormoner, gör det nödvändigt att sätta ut det kombinerade p‑pillret.
Även om kombinerade p‑piller kan ha en effekt på den perifera insulinresistensen och glukostoleransen finns inga bevis för att det är nödvändigt att ändra behandlingsregimen för diabetiker som använder östrogeninnehållande kombinerade p‑piller i låg dos (< 0,05 mg etinylestradiol). Kvinnor med diabetes ska dock kontrolleras noggrant, särskilt under den första tiden med kombinerade p‑piller.
Försämring av endogen depression, epilepsi, Crohns sjukdom och ulcerös kolit har rapporterats vid användning av kombinerade p‑piller.
Kloasma kan förekomma i enstaka fall, speciellt hos kvinnor som haft kloasma under tidigare graviditet. Kvinnor med tendens till kloasma ska undvika exponering för solljus och ultraviolett strålning under användning av kombinerade p‑piller.
Läkarundersökning/konsultation
Innan användning av Midiana påbörjas eller används igen ska en fullständig anamnes (inklusive hereditet) tas och graviditet uteslutas. Blodtrycket ska tas och en läkarundersökning ska utföras baserat på kontraindikationerna (se avsnitt Kontraindikationer) och varningarna (se avsnitt Varningar och försiktighet). Det är viktigt att informera kvinnan om venösa och arteriella tromboser, inklusive risken med Midiana jämfört med andra kombinerade hormonella preventivmedel, symtomen på VTE och ATE, de kända riskfaktorerna och vad hon ska göra i händelse av en misstänkt trombos.
Kvinnan ska också informeras om att noggrant läsa igenom bipacksedeln och följa anvisningarna. Frekvensen och typen av undersökningar ska baseras på fastställda riktlinjer och anpassas individuellt till varje kvinna.
Kvinnan ska informeras om att hormonella preventivmedel inte skyddar mot hivinfektioner (AIDS) och andra sexuellt överförbara sjukdomar.
Nedsatt effekt
Effekten av kombinerade p‑piller kan försvagas vid t.ex. glömda tabletter (se avsnitt Dosering och administreringssätt), gastrointestinala störningar (se avsnitt Dosering och administreringssätt) eller vid samtidig användning av andra läkemedel (se avsnitt Interaktioner).
Nedsatt cykelkontroll
Oregelbundna blödningar (stänkblödningar eller genombrottsblödningar) kan förekomma vid användning av alla kombinerade p‑piller, särskilt under de första månaderna. Därför är utvärdering av oregelbundna blödningar meningsfullt först efter en anpassningsperiod om cirka tre cykler.
Om de oregelbundna blödningarna kvarstår eller uppkommer efter tidigare regelbundna cykler bör icke‑hormonella orsaker övervägas och adekvata diagnostiska åtgärder vidtas för att utesluta malignitet eller graviditet. Detta kan inkludera kyrettage.
Vissa kvinnor får ingen bortfallsblödning under tablettuppehållet. Om det kombinerade p‑pillret har tagits i enlighet med anvisningarna i avsnitt Dosering och administreringssätt är det osannolikt att kvinnan är gravid. Men om det kombinerade p‑pillret inte har tagits enligt anvisningarna före den första uteblivna bortfallsblödningen, eller om två bortfallsblödningar uteblir, måste graviditet uteslutas innan intaget av kombinerade p‑piller fortsätter.
Detta läkemedel innehåller 48,17 mg laktosmonohydrat per dos. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Detta läkemedel innehåller 0,070 mg sojalecitin per dos. Detta läkemedel ska inte administreras till patienter som är allergiska mot jordnötter eller soja.
Interaktioner
Observera: Produktresuméerna för andra samtidigt använda läkemedel ska konsulteras för att identifiera potentiella interaktioner.
Farmakodynamiska interaktioner
I kliniska studier med patienter som behandlas för hepatit C-virusinfektioner (HCV) med läkemedel som innehåller ombitasvir/paritaprevir/ritonavir och dasabuvir, med eller utan ribavirin, sågs en alanintransaminasstegring (ALAT) som var mer än 5 gånger högre än den normala övre gränsen. ALAT-stegringen inträffade signifikant oftare hos kvinnor som använde etinylestradiolinnehållande läkemedel, såsom kombinerade preventivmedel (CHCs). ALAT-stegringar har också observerats hos patienter som behandlas med glekaprevir/pibrentasvir eller sofosbuvir/velpatasvir/voxilaprevir och använder läkemedel innehållande etinylestradiol såsom CHCs (se avsnitt Kontraindikationer). Därför måste användare av Midiana byta till en alternativ preventivmetod (t.ex. minipiller eller icke-hormonella metoder) innan inledning av behandling med dessa läkemedelskombinationer. Midiana kan återinsättas 2 veckor efter avslutande av behandling med dessa läkemedelskombinationer.
Farmakokinetiska interaktioner
- Effekter av andra läkemedel på Midiana
Interaktioner kan förekomma med läkemedel som inducerar mikrosomala enzymer, vilket kan resultera i ökat clearance av könshormoner och leda till nedsatt preventiv effekt och/eller genombrottsblödningar.
Behandling
Enzyminduktion kan ses redan efter några dagar av behandling. Maximal enzyminduktion ses vanligen inom några veckor. Efter att läkemedelsbehandlingen avslutats kan enzyminduktionen kvarstå i fyra veckor.
Korttidsbehandling
Kvinnor som behandlas med enzyminducerande läkemedel ska tillfälligt använda en barriärmetod eller någon annan preventivmetod som tillägg till kombinerade p‑piller. Barriärmetod ska användas under hela den samtidiga läkemedelsbehandlingen samt i ytterligare 28 dagar efter avslutad behandling. Om läkemedelsbehandlingen fortsätter efter att tabletterna i p‑pillerförpackningen tagit slut måste nästa p‑pillerförpackning påbörjas omedelbart utan den vanliga tablettfria perioden.
Långtidsbehandling
För kvinnor som står på långvarig behandling med leverenzyminducerande läkemedel rekommenderas andra tillförlitliga, icke‑hormonella preventivmetoder.
Följande interaktioner har rapporterats i litteraturen.
Läkemedel som ökar clearance av könshormoner (minskar effekten av kombinerade p-piller genom enzyminduktion):
Barbiturater, bosentan, karbamazepin, fenytoin, primidon, rifampicin och HIV-läkemedlen ritonavir, nevirapin och efavirenz samt möjligen också felbamat, griseofulvin, oxkarbazepin, topiramat och produkter som innehåller johannesört (Hypericum perforatum).
Läkemedel som har varierande effekt på clearance av könshormoner:
Vid samtidig användning av kombinerade p‑piller kan många kombinationer av HIV-proteashämmare och icke‑nukleosida hämmare av omvänt transkriptas (inklusive kombinationer med HCV‑proteashämmare) öka eller minska plasmakoncentrationerna av östrogen eller progestin. Den totala effekten av dessa förändringar kan i vissa fall vara kliniskt betydelsefull.
Därför ska produktresuméerna för samtidiga HIV/HCV‑läkemedel konsulteras för att identifiera potentiella interaktioner och eventuella rekommendationer om dem. Om en interaktion misstänks kunna uppkomma ska kvinnor som använder proteashämmare eller icke‑nukleosida hämmare av omvänt transkriptas använda en barriärmetod som kompletterande skydd.
Läkemedel som minskar clearance av könshormoner (enzymhämmare):
Den kliniska relevansen av potentiella interaktioner mellan enzymhämmare och kombinerade p‑piller är okänd.
Samtidig användning av starka CYP3A4‑hämmare och kombinerade p‑piller kan öka plasmakoncentrationerna av östrogen och/eller progestin.
En multipeldosstudie med drospirenon (3 mg/dag) och etinylestradiol (0,02 mg/dag) visade att samtidig användning av den starka CYP3A4‑hämmaren ketokonazol i 10 dagar ökade AUC(0–24 h) för drospirenon och etinylestradiol 2,7 gånger respektive 1,4 gånger.
När etoricoxib i doser om 60–120 mg/dag tas samtidigt med ett kombinationspreparat som innehåller 0,035 mg etinylestradiol ökar plasmakoncentrationen av etinylestradiol 1,4–1,6 gånger.
- Effekten av Midiana på andra läkemedel
P‑piller kan påverka metabolismen av vissa andra läkemedel. Koncentrationerna i plasma och vävnader kan således antingen öka (t.ex. ciklosporin) eller minska (t.ex. lamotrigin).
Baserat på interaktionsstudier in vivo med frivilliga kvinnor (omeprazol, simvastatin eller midazolam användes som markörer) är det osannolikt att drospirenon i en dos om 3 mg skulle ha en kliniskt betydelsefull effekt på den CYPP450‑medierade metabolismen av andra läkemedel.
Kliniska data tyder på att etinylestradiol hämmar clearance av CYP1A2‑substrat, vilket ger en svag (t.ex. teofyllin) till måttlig (t.ex. tizanidin) ökning av plasmakoncentrationerna av dessa.
Farmakodynamiska interaktioner
Samtidig användning av läkemedel som innehåller kombinationen ombitasvir/paritaprevir/ritonavir och dasabuvir med eller utan ribavirin kan öka risken för förhöjning av ALAT (se avsnitt Kontraindikationer och Varningar och försiktighet). Därför måste användare av Midiana byta till en annan preventivmetod (t.ex. preventivmedel med enbart gestagen eller en icke‑hormonell metod) innan behandling med denna läkemedelskombination inleds. Midiana kan återinsättas 2 veckor efter att kombinationsbehandlingen avslutats.
- Andra typer av interaktioner
Hos patienter som inte har nedsatt njurfunktion visade samtidig användning av drospirenon och ACE‑hämmare eller NSAID‑preparat ingen signifikant effekt på serumkalium. Samtidig användning av drospirenon/etinylestradiol och aldosteronantagonister eller kaliumsparande diuretika har dock inte studerats. I sådana fall bör serumkalium kontrolleras under den första behandlingscykeln. Se även avsnitt Varningar och försiktighet.
- Laboratorieprover
Användning av steroider för antikonception kan påverka resultaten av vissa laboratorieanalyser, däribland biokemiska parametrar för lever-, sköldkörtel-, binjure- och njurfunktion, plasmanivåerna av (transport)proteiner (t.ex. kortikosteroidbindande globulin och lipid-/lipoproteinfraktioner), parametrar för kolhydratmetabolism och parametrar för koagulation och fibrinolys. Förändringarna ligger i allmänhet inom normala laboratorievärden. Drospirenon leder till en ökad aktivitet hos plasmarenin och plasmaaldosteron, inducerad av dess lätta antimineralkortikoida aktivitet.
Fertilitet, graviditet och amning
Graviditet
Midiana ska inte användas under graviditet.
Om kvinnan blir gravid under användning av drospirenon/etinylestradiol ska preparatet omedelbart sättas ut. Omfattande epidemiologiska studier har dock varken visat en ökad risk för medfödda missbildningar hos barn till kvinnor som använt kombinerade p‑piller före graviditeten eller teratogena effekter i fall där kombinerade p‑piller av misstag använts under graviditeten.
Djurstudier har visat biverkningar under dräktighet och laktation (se avsnitt Prekliniska säkerhetsuppgifter). Baserat på dessa djurdata kan biverkningar på grund av hormonella effekter av de aktiva substanserna inte uteslutas. Den allmänna erfarenheten av användning av kombinerade p‑piller under graviditet har dock inte gett belägg för att de skulle medföra egentliga biverkningar hos människa.
Tillgängliga data om användningen av drospirenon/etinylestradiol under graviditet är än så länge för begränsade för att några slutsatser ska kunna dras avseende negativa effekter av drospirenon/etinylestradiol på graviditet och fostrets eller det nyfödda barnets hälsa. Hittills finns inga relevanta epidemiologiska data.
Den ökade risken för VTE under postpartumperioden ska beaktas vid återinsättning av Midiana (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Amning
Amning kan påverkas av kombinerade p‑piller eftersom de kan minska mängden bröstmjölk och ändra dess sammansättning. Därför rekommenderas användning av kombinerade p‑piller inte förrän mamman helt har slutat amma barnet. Små mängder av kontraceptiva steroider och/eller deras metaboliter kan utsöndras i bröstmjölk under användning av kombinerade p‑piller. Dessa mängder kan påverka barnet.
Effekter på förmågan att framföra fordon och använda maskiner
Inga studier har utförts avseende preparatets inverkan på förmågan att framföra fordon eller använda maskiner. Inga effekter på förmågan att framföra fordon och använda maskiner har observerats hos användare av kombinerade p‑piller.
Biverkningar
Information om allvarliga biverkningar hos kvinnor som använder kombinerade p‑piller finns i avsnitt Varningar och försiktighet.
Följande biverkningar har rapporterats vid användning av drospirenon/etinylestradiol (t.ex. Midiana):
Organsystem (MedDRA) | Biverkningsfrekvenser | |||
| Vanliga ≥ 1/100, < 1/10 | Mindre vanliga > 1/1 000, < 1/100 | Sällsynta ≥ 1/10 000, < 1/1 000 | Ingen känd frekvens (kan inte beräknas från tillgängliga data) |
Immunsystemet | överkänslighet, astma | förvärrade symtom av ärftligt eller förvärvat angioödem | ||
Psykiska störningar | deprimerat tillstånd | minskad libido, ökad libido | ||
Centrala och perifera nervsystemet | huvudvärk |
| ||
Öron och balansorgan | hypakusi | |||
Blodkärl | migrän | hypertoni, hypotoni | venös tromboembolism, arteriell tromboembolism | |
Magtarmkanalen | illamående | kräkningar, diarré | ||
Hud och subkutan vävnad |
| akne, eksem, klåda, alopeci | erythema nodosum, erythema multiforme | |
Reproduktionsorgan och bröstkörtel | menstruationsstörningar, mellanblödningar, bröstsmärta, ömhet i brösten, flytningar från slidan, vulvovaginal candidiasis | bröstförstoring, infektion i slidan | utsöndring från brösten
| |
Allmänna symtom och/eller symtom vid administreringsstället |
| vätskeretention, viktökning, viktminskning |
| |
Beskrivning av utvalda biverkningar
En ökad risk för arteriella och venösa trombotiska och trombemboliska händelser, t.ex. myokardiell infarkt, stroke, transitoriska ischemiska attacker, venös trombos och lungemboli, har observerats hos kvinnor som använder kombinerade hormonella preventivmedel, vilket diskuteras mer i detalj i avsnitt Varningar och försiktighet.
Följande allvarliga biverkningar har rapporterats hos kvinnor som använder kombinerade p‑piller, och dessa diskuteras i avsnitt Varningar och försiktighet:
- Venösa tromboemboliska händelser
- Arteriella tromboemboliska händelser
- Hypertoni
- Levertumörer
- Ett samband mellan uppkomst eller försämring av följande tillstånd och användning av kombinerade p‑piller kan inte uteslutas: Crohns sjukdom, ulcerös kolit, epilepsi, uterusmyom, porfyri, systemisk lupus erythematosus, herpes gestationis, Sydenhams korea, hemolytiskt‑uremiskt syndrom, kolestatisk ikterus
- Kloasma
- Akuta eller kroniska störningar i leverfunktionen kan göra det nödvändigt att sätta ut kombinerade p‑piller tills leverfunktionen åter är normal
- Exogena östrogener kan inducera eller förvärra symtom av ärftligt eller förvärvat angioödem.
Frekvensen av bröstcancerdiagnoser är något högre bland användare av kombinerade p‑piller. Eftersom bröstcancer är sällsynt hos kvinnor under 40 år är ökningen av antalet diagnoser liten i förhållande till den totala risken för bröstcancer. Orsakssambandet med användning av kombinerade p‑piller är inte fastställt. Ytterligare information finns i avsnitt Kontraindikationer och Varningar och försiktighet.
Interaktioner
Genombrottsblödningar och/eller nedsatt preventiv effekt kan uppstå på grund av interaktioner mellan andra läkemedel (enzyminducerare) och kombinerade p‑piller (se avsnitt Interaktioner).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta‑riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Det finns i nuläget ingen erfarenhet av överdosering av drospirenon/etinylestradiol. Baserat på allmän erfarenhet av andra kombinerade p‑piller är de symtom som potentiellt kan förekomma i detta fall illamående, kräkningar och bortfallsblödning. Bortfallsblödning kan även förekomma hos flickor före menarke om de har tagit läkemedlet av misstag. Det finns inget antidot, och den fortsatta behandlingen ska vara symtomatisk.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: gestagener och estrogener, fasta kombinationer
ATC‑kod: G03AA12
Pearl‑index för metodfel: 0,09 (övre tvåsidig 95 % konfidensgräns: 0,32).
Totalt Pearl‑index (metodfel + användarfel): 0,57 (övre tvåsidig 95 % konfidensgräns: 0,90).
Verkningsmekanism
Den preventiva effekten av Midiana är baserad på ett samspel mellan många olika faktorer. Den viktigaste är hämning av ägglossning samt förändringar i endometriet.
Midiana är ett kombinerat p‑piller innehållande etinylestradiol och gestagenet drospirenon. Vid terapeutiska doser har drospirenon också antiandrogena och svagt antimineralkortikoida egenskaper. Det har ingen östrogen, glukokortikoid eller antiglukokortikoid aktivitet. Detta innebär att drospirenon har en farmakologisk profil som påminner mycket om det naturliga hormonet progesteron.
Det finns indikationer från kliniska studier om att de svagt antimineralkortikoida egenskaperna hos drospirenon leder till att preparatet har en lätt antimineralkortikoid effekt.
Farmakokinetiska egenskaper
- Drospirenon
Absorption
Oralt administrerat drospirenon absorberas snabbt och nästan fullständigt. Efter intag av en engångsdos uppnås maximal serumkoncentration (cirka 38 ng/ml) på 1–2 timmar. Biotillgängligheten för drospirenon är 76–85 %. Samtidigt intag av mat har ingen inverkan på biotillgängligheten för drospirenon.
Distribution
Efter oral administrering minskar serumnivåerna av drospirenon i två faser, med en terminal halveringstid på 31 timmar. Drospirenon är bundet till serumalbumin. Det binder varken till könshormonbindande globulin (SHBG) eller kortikoidbindande globulin (CBG). Endast 3–5 % av den totala mängden drospirenon i serum förekommer som en fri steroid. Den etinylestradiolinducerade ökningen av SHBG‑koncentrationen påverkar inte bindningen av drospirenon till serumproteiner. Den genomsnittliga distributionsvolymen för drospirenon är 3,7 ± 1,2 l/kg.
Metabolism
Drospirenon metaboliseras i hög grad efter oral administrering. Huvudmetaboliterna i plasma är syraformen av drospirenon, som bildas genom öppning av laktonringen, och 4,5‑dihydro‑drospirenon-3‑sulfat, som bildas genom reduktion och efterföljande sulfatkonjugering. Drospirenon genomgår även oxidativ metabolism katalyserad av CYP3A4.
Drospirenon är in vitro kapabelt att hämma CYP450‑enzymerna CYP1A1, CYP2C9, CYP2C19 och CYP3A4 svagt till måttligt.
Eliminering
Metaboliskt clearance för drospirenon i serum är 1,5 ± 0.2 ml/min/kg. Endast spårmängder av substansen utsöndras i oförändrad form. Metaboliterna av drospirenon utsöndras via feces och urin i förhållandet 1,2:1,4. Halveringstiden för metabolitutsöndringen via urin och feces är cirka 40 timmar.
Steady state
Under en behandlingscykel uppnås den maximala steady state‑koncentrationen för drospirenon i serum (cirka 70 ng/ml) efter cirka 8 dagars behandling. Drospirenonnivåerna i serum ackumuleras med en faktor på cirka 3 som en följd av förhållandet mellan terminal halveringstid och doseringsintervall.
Särskilda populationer
Nedsatt njurfunktion
Serumkoncentrationen av drospirenon vid steady state hos kvinnor med lätt nedsatt njurfunktion (kreatininclearance 50–80 ml/min) var jämförbar med den hos kvinnor med normal njurfunktion. Serumkoncentrationen av drospirenon var cirka 37 % högre hos kvinnor med måttligt nedsatt njurfunktion (kreatininclearance 30–50 ml/min) jämfört med den hos kvinnor med normal njurfunktion. Drospirenon tolererades också väl av kvinnor med lätt och måttligt nedsatt njurfunktion.
Drospirenon hade ingen kliniskt signifikant effekt på kaliumkoncentrationen i serum.
Nedsatt leverfunktion
I en singeldosstudie minskade oralt clearance med cirka 50 % hos frivilliga med måttligt nedsatt leverfunktion jämfört med frivilliga med normal leverfunktion. Den observerade minskningen av drospirenonclearance hos frivilliga med måttligt nedsatt leverfunktion konstaterades inte medföra någon väsentlig skillnad i kaliumkoncentrationerna i serum. Inte heller vid diabetes och samtidig behandling med spironolakton (två faktorer som kan predisponera en patient för hyperkalemi) observerades någon ökning av kaliumkoncentrationen i serum över den övre normalgränsen. Slutsatsen är således att drospirenon tolereras väl av patienter med lätt eller måttligt nedsatt leverfunktion (Child‑Pugh B).
Etniska grupper
Inga kliniskt betydelsefulla skillnader i farmakokinetiken av drospirenon eller etinylestradiol har observerats mellan japanska och ljushyade kvinnor.
- Etinylestradiol
Absorption
Etinylestradiol absorberas snabbt och fullständigt efter oralt intag. Efter administrering av en dos på 30 µg uppnås maximal plasmakoncentration (100 pg/ml) på 1–2 timmar. Etinylestradiol genomgår omfattande förstapassagemetabolism som visar stor interindividuell variation. Den absoluta biotillgängligheten är cirka 45 %.
Distribution
Etinylestradiol har en skenbar distributionsvolym på 5 l/kg, och bindningen till plasmaproteiner är cirka 98 %. Etinylestradiol inducerar leversyntesen av SHBG och CBG. Under användning av etinylestradiol (30 µg/dag) ökar plasmakoncentrationen av SHBG från 70 nmol/l till cirka 350 nmol/l.
Etinylestradiol passerar i små mängder över i bröstmjölk (0,02 % av dosen).
Metabolism
Etinylestradiol genomgår betydande förstapassagemetabolism i magtarmkanalen och levern. Etinylestradiol metaboliseras primärt via aromatisk hydroxylering, men ett stort antal hydroxylerade och metylerade metaboliter bildas, och dessa förekommer som fria metaboliter och som konjugat med glukuronider och sulfat. Metabol clearance‑hastighet för etinylestradiol är cirka 5 ml/min/kg.
Etinylestradiol är in vitro en reversibel hämmare av enzymerna CYP2C19, CYP1A1 och CYP1A2 samt även en mekanismbaserad hämmare av CYP3A4/5, CYP2C8 och CYP2J2.
Eliminering
Etinylestradiol utsöndras inte i oförändrad form i någon stor omfattning. Metaboliterna av etinylestradiol utsöndras i urin och galla i förhållandet 4:6. Halveringstiden för metabolitutsöndringen är cirka 1 dygn. Eliminationshalveringstiden är 20 timmar.
Steady state
Steady state uppnås under den andra halvan av behandlingscykeln, och serumnivåerna av etinylestradiol ackumuleras med en faktor på 1,4–2,1.
Prekliniska säkerhetsuppgifter
Hos försöksdjur var effekterna av drospirenon och etinylestradiol begränsade till dem som förknippas med den kända farmakologiska effekten. Framför allt reproduktionstoxicitetsstudier på djur visade artspecifika embryotoxiska och fetotoxiska effekter. Vid exponering som överstiger den hos användare av drospirenon och etinylestradiol observerades effekter på könsdifferentieringen hos råttfoster men inte hos apor.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Tablettkärna: laktosmonohydrat, pregelatiniserad majsstärkelse, majsstärkelse, povidon K‑25, magnesiumstearat.
Filmdragering: polyvinylalkohol, titandioxid (E171), talk (E553b), makrogol 3350, lecitin (soja).
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C. Förvaras i originalförpackningen. Ljuskänsligt.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
MIDIANA tabletti, kalvopäällysteinen
0,03/3 mg (L:kyllä) 3 x 21 fol (24,74 €)
PF-selosteen tieto
Midiana 0,03 mg/3 mg filmdragerade tabletter är förpackade i PVC/PVDC/aluminium‑blisterförpackning.
Blisterförpackningarna är förpackade i en kartong. Ett förvaringsetui medföljer varje kartong.
Förpackningsstorlekar:
21 filmdragerade tabletter
3 × 21 filmdragerade tabletter
6 × 21 filmdragerade tabletter
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vit eller nästan vit, rund, bikonvex filmdragerad tablett. Prägling ”G63” på ena sidan, ingen prägling på andra sidan.
Särskilda anvisningar för destruktion och övrig hantering
Inga särskilda anvisningar.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
MIDIANA tabletti, kalvopäällysteinen
0,03/3 mg 3 x 21 fol
- Ei korvausta.
Atc-kod
G03AA12
Datum för översyn av produktresumén
30.01.2023
Yhteystiedot
Barnhusgatan 22, 5tr
111 23 Stockholm
Sweden
+358105793700
medinfo.fi@gedeonrichter.eu
