ELIGARD pulver och vätska till injektionsvätska, lösning 7,5 mg, 22,5 mg, 45 mg
Kvalitativ och kvantitativ sammansättning
7,5 mg: En förfylld spruta med pulver till injektionsvätska, lösning innehåller 7,5 mg leuprorelinacetat, vilket motsvarar 6,96 mg leuprorelin.
22,5 mg: En förfylld spruta med pulver till injektionsvätska, lösning innehåller 22,5 mg leuprorelinacetat, vilket motsvarar 20,87 mg leuprorelin.
45 mg: En förfylld spruta med pulver till injektionsvätska, lösning innehåller 45 mg leuprorelinacetat, vilket motsvarar 41,7 mg leuprorelin.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver och vätska till injektionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
Eligard är indicerat för behandling av hormonberoende prostatacancer i avancerat stadium och för behandling av lokaliserad prostatacancer av högrisktyp, samt lokalt avancerad hormonberoende prostatacancer i kombination med strålbehandling.
Dosering och administreringssätt
Dosering
Vuxna män
Eligard ska administreras under överinseende av vårdpersonal som har tillräcklig kunskap för att övervaka och värdera behandlingssvaret.
Eligard administreras som en enstaka subkutan injektion varje månad (7,5 mg), var tredje månad (22,5 mg) eller var sjätte månad (45 mg). Den injicerade lösningen bildar en fast läkemedelsdepå som kontinuerligt frisätter leuprorelinacetat under en månad (7,5 mg), en tremånadersperiod (22,5 mg) eller en sexmånadersperiod (45 mg).
Som regel krävs långvarig behandling med Eligard mot prostatacancer i avancerat stadium och behandlingen ska inte avbrytas vid remission eller förbättring.
Eligard kan användas som neoadjuvant eller adjuvant behandling i kombination med strålbehandling vid lokaliserad prostatacancer av högrisktyp och vid lokalt avancerad prostatacancer.
Behandlingssvaret vid behandling med Eligard ska övervakas med kliniska parametrar och genom bestämning av prostataspecifikt antigen (PSA) i serum. Kliniska studier har visat att testosteronnivåerna ökade under behandlingens första 3 dagar hos majoriteten av de patienter som inte genomgått orkidektomi och att de sedan minskade till under nivåerna för medicinsk kastrering inom 3-4 veckor. När kastratnivåerna nåtts, bibehålls de så länge läkemedelsbehandling fortsätter (< 1 % genombrott av testosteron). Om patientens respons tycks vara suboptimal, bör man fastställa att serumtestosteronnivåerna har nått eller bibehålls på kastratnivåer. Då utebliven effekt kan uppkomma vid felaktig beredning, rekonstituering eller administrering, bör testosteronnivåerna utvärderas i misstänkta eller kända fall av hanteringsfel (se avsnitt Varningar och försiktighet).
Patienter med metastaserad kastrationsresistent prostatacancer som inte är kirurgiskt kastrerade och får en GnRH-agonist, som t.ex. leuprorelin, kan fortsätta behandling med GnRH-agonist även om de är kvalificerade för behandling med androgen-biosynteshämmare eller androgenreceptorhämmare.
Pediatrisk population
Säkerhet och effekt för Eligard för barn i åldern 0 till 18 år har inte fastställts (se även avsnitt Kontraindikationer).
Särskilda patientgrupper
Inga kliniska studier har utförts hos patienter med vare sig lever- eller njurinsufficiens.
Administreringssätt
Eligard 7,5 mg, 22,5 mg och 45 mg bör beredas, rekonstitueras och administreras endast av sjukvårdspersonal som är förtrogna med dessa rutiner. Instruktionerna för rekonstituering och administrering måste följas noggrant (se avsnitt Varningar och försiktighet och Särskilda anvisningar för destruktion och övrig hantering). Om produkten inte bereds på rätt sätt, bör den inte administreras.
Innehållet i de två förfyllda sterila sprutorna måste blandas omedelbart före administrering av Eligard genom subkutan injektion.
Mot bakgrund av djurdata måste oavsiktlig intraarteriell respektive intravenös injektion noga undvikas.
Liksom för andra läkemedel som administreras genom subkutan injektion, ska injektionsstället varieras med jämna mellanrum.
Kontraindikationer
Eligard är kontraindicerat hos kvinnor och hos pediatriska patienter.
Överkänslighet mot leuprorelinacetat, mot andra GnRH-agonister eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Tidigare genomgången orkidektomi (liksom för andra GnRH-agonister leder Eligard inte till ytterligare minskning av serumtestosteron vid kirurgisk kastrering).
Som enda behandling hos prostatacancerpatienter med ryggmärgskompression eller tecken på spinala metastaser (se även avsnitt Varningar och försiktighet).
Varningar och försiktighet
Korrekt rekonstituering: Fall av felaktig hantering, vilket kan inträffa under alla steg i beredningsprocessen och skulle kunna leda till utebliven effekt, har rapporterats. Instruktionerna för rekonstituering och administrering måste följas noggrant (se avsnitt Särskilda anvisningar för destruktion och övrig hantering). Vid misstänkta eller kända fall av hanteringsfel ska patienten övervakas på lämpligt sätt (se avsnitt Dosering och administreringssätt).
Androgen deprivationsterapi kan förlänga QT-intervallet:
För patienter med QT-förlängning i anamnesen eller med riskfaktorer för QT-förlängning samt för patienter som samtidigt behandlas med andra läkemedel som kan förlänga QT-intervallet (se avsnitt Interaktioner), bör förskrivare bedöma nytta/risk-balansen inklusive risken för torsade de pointes, innan behandling med Eligard 7,5 mg, 22,5 mg och 45 mg påbörjas.
Hjärt-och kärlsjukdomar: Ökad risk för att utveckla hjärtinfarkt, plötslig hjärtdöd och stroke har rapporterats i samband med användning av GnRH-agonister hos män. Risken verkar låg baserat på rapporter om relativ risk och bör utvärderas noggrant tillsammans med kardiovaskulära riskfaktorer vid fastställande av behandling av patienter med prostatacancer. Patienter som får GnRH-agonister bör övervakas för symtom och tecken som tyder på kardiovaskulära sjukdomar och ska behandlas enligt gällande behandlingsriktlinjer.
Övergående testosteron påslag: Leuprorelinacetat orsakar, liksom andra GnRH-agonister, en övergående ökning av serumkoncentrationerna av testosteron, dihydrotestosteron och sur fosfatas under den första behandlingsveckan. Patienter kan uppleva försämring av symtom eller debut av nya symtom, inklusive skelettsmärta, neuropati, hematuri eller obstruktion av urinledarens- eller blåsans utgång (se avsnitt Biverkningar). Dessa symtom försvinner vanligtvis vid fortsatt behandling.
Tilläggsadministrering av en lämplig antiandrogen bör övervägas med början 3 dagar före leuprorelinterapin och fortsätta under de första 2–3 behandlingsveckorna. Detta har rapporterats förhindra efterverkningar av den inledande förhöjningen av serumtestosteron.
Eligard 7,5 mg, 22,5 mg och 45 mg sänker inte serumnivåerna av testosteron ytterligare hos manliga patienter som genomgått kirurgisk kastrering.
Bentäthet: Minskad bentäthet har rapporterats i den medicinska litteraturen hos män som har genomgått orkidektomi eller som har behandlats med GnRH-agonister (se avsnitt Biverkningar).
Antiandrogen terapi ökar risken för frakturer på grund av osteoporos avsevärt, men data är begränsade. Frakturer på grund av osteoporos observerades hos 5 % av patienterna efter 22 månaders farmakologisk androgenblockad och hos 4 % av patienterna efter 5 till 10 års behandling. Risken för frakturer på grund av osteoporos är i allmänhet högre än risken för patologiska frakturer. Förutom långvarig testosteronbrist kan hög ålder, rökning och alkoholkonsumtion, fetma och otillräcklig motion påverka utvecklingen av osteoporos.
Hypofysapoplexi: Efter marknadsföring har sällsynta fall av hypofysapoplexi (ett kliniskt syndrom sekundärt till hypofysinfarkt) rapporterats efter administrering av GnRH-agonister. Majoriteten av dessa fall inträffade inom 2 veckor efter den första dosen, i något fall inom den första timmen. I dessa fall var tecknen på hypofysapoplexi plötslig huvudvärk, kräkningar, synförändringar, oftalmoplegi, förändrad mental status och ibland kardiovaskulär kollaps. Omedelbar medicinsk tillsyn krävs.
Metabola förändringar: Hyperglykemi och en ökad risk att utveckla diabetes har rapporterats hos män som får GnRH-agonister. Hyperglykemi kan tyda på utveckling av diabetes mellitus eller försämring av glykemisk kontroll hos patienter med diabetes. Kontrollera blodglukos och/eller glykosylerat hemoglobin (HbA1c) regelbundet hos patienter som får GnRH-agonister och behandla dem enligt gällande riktlinjer för behandling av hyperglykemi eller diabetes. Metabola förändringar som förknippas med GnRH-agonister kan även omfatta fettlever.
Kramper: Efter marknadsföring har det observerats kramper hos patienter som behandlas med leuprorelinacetat med eller utan predisponerande faktorer. Kramper ska hanteras enligt gällande klinisk praxis.
Idiopatisk intrakraniell hypertension: Idiopatisk intrakraniell hypertension (pseudotumor cerebri) har rapporterats hos patienter som fått leuprorelin. Patienterna ska varnas om tecken och symtom på idiopatisk intrakraniell hypertension, däribland svår eller återkommande huvudvärk, synstörningar och tinnitus. Om idiopatisk intrakraniell hypertension uppstår ska utsättning av leuprorelin övervägas.
Mycket allvarliga hudbiverkningar: Mycket allvarliga hudbiverkningar (SCARs), inklusive Stevens-Johnsons syndrom (SJS) och toxisk epidermal nekrolys (TEN) som kan vara livshotande eller dödliga, har rapporterats i samband med behandling av leuprorelin. Vid förskrivningstillfället ska patienten informeras om tecken och symptom och ska övervakas noga för allvarliga hudreaktioner. Om tecken och symptom som tyder på dessa reaktioner uppstår ska leuprorelin omedelbart sättas ut och en alternativ behandling ska övervägas (enligt vad som är lämpligt).
Övriga händelser: Fall av urinvägsobstruktion och ryggmärgskompression, som kan bidra till förlamning med eller utan fatala komplikationer, har rapporterats med GnRH-agonister. Om ryggmärgskompression eller nedsatt njurfunktion utvecklas, ska standardbehandling av dessa komplikationer inledas.
Patienter med vertebral- och/eller hjärnmetastaser samt patienter med urinvägsobstruktion ska övervakas noggrant under de första behandlingsveckorna.
Interaktioner
Inga studier av farmakokinetiska interaktioner mellan läkemedel har genomförts med Eligard. Det finns inga tillgängliga rapporter angående interaktioner av leuprorelinacetat med andra läkemedelsprodukter.
Eftersom androgen deprivationsterapi kan förlänga QT-intervallet, bör en noggrann övervägning göras av samtidig användning av Eligard med läkemedel som förlänger QT-intervallet, eller med läkemedel som kan framkalla torsade de pointes såsom klass IA antiarytmika (t.ex. kinidin, disopyramid) eller klass III antiarytmika (t.ex. amiodaron, sotalol, dofetilid, ibutilid), metadon, moxifloxacin, antipsykotika m.fl. (se avsnitt Varningar och försiktighet).
Fertilitet, graviditet och amning
Ej relevant eftersom Eligard är kontraindicerat hos kvinnor.
Effekter på förmågan att framföra fordon och använda maskiner
Det har inte genomförts några studier av Eligards effekter på förmågan att köra fordon och använda maskiner.
Förmågan att framföra fordon och använda maskiner kan försämras på grund av trötthet, yrsel och synrubbningar, som är möjliga biverkningar av behandlingen eller som kan bero på den underliggande sjukdomen.
Biverkningar
De biverkningar som iakttagits med Eligard beror huvudsakligen på den specifika farmakologiska verkningsmekanismen hos leuprorelinacetat, nämligen ökningar och minskningar av vissa hormonnivåer. De vanligaste rapporterade biverkningarna är värmevallningar, illamående, sjukdomskänsla och trötthet samt övergående lokal irritation vid injektionsstället. Lindriga till måttliga värmevallningar förekommer hos omkring 58 % av patienterna.
Tabell över biverkningar
Följande biverkningar rapporterades under kliniska studier med Eligard hos patienter med framskriden prostatakarcinom. Biverkningarnas frekvens klassificeras som mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000) och mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
| Tabell 1: Biverkningar i kliniska studier med Eligard | |
| Infektioner och infestationer | |
| vanliga | nasofaryngit |
| mindre vanliga | urinvägsinfektion, lokal hudinfektion |
| Metabolism och nutrition | |
| mindre vanliga | förvärrad diabetes mellitus |
| Psykiska störningar | |
| mindre vanliga | onormala drömmar, depression, minskat libido |
| Centrala och perifera nervsystemet | |
| mindre vanliga | yrsel, huvudvärk, hypestesi, sömnlöshet, rubbning av smaksinne och luktsinne, vertigo |
| sällsynta | onormala ofrivilliga rörelser |
| ingen känd frekvens | idiopatisk intrakraniell hypertension (pseudotumor cerebri) (se avsnitt Varningar och försiktighet) |
| Hjärtat | |
| ingen känd frekvens | QT-förlängning (se avsnitt Varningar och försiktighet och Interaktioner) |
| Blodkärl | |
| mycket vanliga | värmevallningar |
| mindre vanliga | hypertoni, hypotoni |
| sällsynta | svimning |
| Andningsvägar, bröstkorg och mediastinum | |
| mindre vanliga | rinorré, dyspné |
| ingen känd frekvens | interstitiell lungsjukdom |
| Magtarmkanalen | |
| vanliga | illamående, diarré, gastroenterit/kolit |
| mindre vanliga | konstipation, muntorrhet, dyspepsi, kräkning |
| sällsynta | flatulens, rapning |
| Hud och subkutan vävnad | |
| mycket vanliga | ekkymoser, erytem |
| vanliga | klåda, nattliga svettningar |
| mindre vanliga | klibbighet, ökad svettning |
| sällsynta | alopeci, hudutslag |
| ingen känd frekvens | Stevens-Johnsons syndrom/toxisk epidermal nekrolys (SJS/TEN) (se avsnitt Varningar och försiktighet) Toxiskt hudutslag Erythema multiforme |
| Muskuloskeletala systemet och bindväv | |
| vanliga | ledvärk, värk i extremiteter, myalgi, stelhet, svaghet |
| mindre vanliga | ryggsmärta, muskelkramper |
| Njurar och urinvägar | |
| vanliga | infrekvent urintömning, miktionssvårighet, dysuri, nykturi, oliguri |
| mindre vanliga | blåskramp, hematuri, förvärrad frekvent urintömning, urinretention |
| Reproduktionsorgan och bröstkörtel | |
| vanliga | ömma bröst, testikelatrofi, smärta i testiklarna, infertilitet, brösthypertrofi, erektil dysfunktion, minskad penisstorlek |
| mindre vanliga | gynekomasti, impotens, testikelrubbning |
| sällsynta | bröstsmärta |
| Allmänna symtom och/eller fynd vid administreringsstället | |
| mycket vanliga | trötthet, sveda vid injektionsstället, parestesi vid injektionsstället |
| vanliga | sjukdomskänsla, smärta vid injektionsstället, blåmärke och stickningar vid injektionsstället |
| mindre vanliga | klåda vid injektionsstället, förhårdnad vid injektionsstället, letargi, smärta, feber |
| sällsynta | sår vid injektionsstället |
| mycket sällsynta | nekros vid injektionsstället |
| Blodet och lymfsystemet | |
| vanliga | hematologiska förändringar, anemi |
| Undersökningar | |
| vanliga | ökad blodkreatininfosfokinas, förlängd koagulationstid |
| mindre vanliga | ökad alaninaminotransferas, ökade blodtriglycerider, förlängd protrombintid, viktökning |
Andra biverkningar som har rapporterats att allmänt förekomma vid behandling med leuprorelinacetat inbegriper perifert ödem, lungemboli, hjärtklappning, myalgi, känselförändringar i huden, muskelsvaghet, rysningar, utslag, amnesi och synrubbningar. Muskelatrofi har observerats vid långtidsanvändning av produkter i denna läkemedelsklass. Infarcering av befintlig hypofysapoplexi har rapporterats i sällsynta fall efter tillförsel av såväl kort- som långverkande GnRH-agonister. Det har förekommit sällsynta rapporter om trombocytopeni och leukopeni. Förändrad glukostolerans har rapporterats.
Kramper har rapporterats efter administrering med GnRH-agonist/analog (se avsnitt Varningar och försiktighet).
Lokala biverkningar som rapporterats efter injektion med Eligard är sådana som ofta förknippas med liknande subkutant injicerade produkter.
I allmänhet är dessa lokala biverkningar efter subkutan injektion lindriga och beskrivs ha kort varaktighet.
Anafylaktiska/anafylaktoida reaktioner har rapporterats i sällsynta fall efter administrering med GnRH-agonist/analog.
Ändringar i bentäthet
Minskad bentäthet har rapporterats i den medicinska litteraturen hos män som har genomgått orkidektomi eller som har behandlats med en GnRH-analog. Det kan förväntas att långvarig behandling med leuprorelin kan leda till ökade tecken på osteoporos. Den ökade risken för frakturer på grund av osteoporos, se avsnitt Varningar och försiktighet.
Försämring av sjukdomstecken och -symtom
Behandling med leuprorelinacetat kan göra att sjukdomstecken och -symtomen förvärras under de första veckorna. Om tillstånd såsom vertebralmetastaser och/eller urinvägsobstruktion eller hematuri försvåras, kan neurologiska problem uppstå såsom svaghet och/eller parestesi i de nedre extremiteterna eller förvärrade urinvägssymtom.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
PB 55
00034 FIMEA
Överdosering
Eligard har inte missbrukspotential och avsiktlig överdosering anses som osannolik. Det finns inga rapporter om missbruk eller överdosering vid klinisk användning av leuprorelinacetat. I händelse av en överdos ska patienten övervakas och lämplig symtomatisk behandling ges efter behov.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: gonadotropinfrisättande hormonanaloger
ATC-kod: L02A E02
Leuprorelinacetat är en syntetisk nonapeptidagonist till naturligt förekommande gonadotropinfrisättande hormon (GnRH), som vid kontinuerlig tillförsel hämmar hypofysens utsöndring av gonadotropin och undertrycker steroidgenes i testiklarna hos män. Denna effekt är reversibel när läkemedelsterapin upphör. Analogen är mer potent än det naturliga hormonet och tiden det tar för att normalisera testosteronhalten kan variera mellan patienter.
Administrering av leuprorelinacetat resulterar inledningsvis i ökade nivåer av cirkulerande luteiniseringshormon (LH) och follikelstimulerande hormon (FSH) i blodet, vilket leder till en övergående ökning av gonadsteroidnivåerna, testosteron och dihydrotestosteron, hos män. Kontinuerlig administrering av leuprorelinacetat leder till minskade nivåer av LH och FSH. Hos män sjunker testosteronnivån till under kastrattröskeln (≤ 50 ng/dl). Dessa minskningar inträffar inom 3‑4 veckor (45 mg), 3-5 veckor (22,5 mg) och 5 veckor (7,5 mg) efter att behandlingen inletts. Genomsnittliga testosteronnivåer efter 6 månader är 10,4 (± 0,53) ng/dl (45 mg), 10,1 (± 0,7) ng/dl (22,5 mg) och 6,1 (± 0,4) ng/dl (7,5 mg), vilket är jämförbart med nivåerna efter bilateral orkidektomi. Samtliga patienter i den pivotala kliniska studien (förutom en för 45 mg) nådde kastratnivåer inom 4 veckor (45 mg), 5 veckor (22,5 mg) eller 6 veckor (7,5 mg); 99 % (22,5 mg) och 94 % (7,5 mg) hade nått denna dag 28 och 98 % (7,5 mg) dag 35. Hos de allra flesta patienterna var de iakttagna testosteronnivåerna under 20 ng/dl, men det fulla värdet av dessa låga nivåer har ännu inte fastställts. PSA-nivåerna sjönk med 97 % (45 mg), 98 % (22,5 mg) eller 94 % (7,5 mg) under sex månader.
Långtidsstudier har visat att vid fortsatt terapi bibehålls testosteron under kastratnivå i upp till sju år och förmodligen på obestämd tid.
Tumörstorleken mättes inte direkt under det kliniska försöksprogrammet med Eligard, men ett indirekt fördelaktigt tumörsvar visades genom en 97-procentig reduktion (45 mg), 98-procentig reduktion (22,5 mg) och 94-procentig reduktion (7,5 mg) av genomsnittligt PSA.
I en fas III randomiserad klinisk studie inkluderades 970 patienter med lokalt avancerad prostatacancer (främst T2c-T4 och några T1c-T2b patienter med patologisk regional nodal sjukdom) varav 483 fick korttids androgensuppression (6 månader) i kombination med strålbehandling och 487 fick långtidsbehandling (3 år), användes en non-inferiority-analys för jämförelse av korttidsbehandlingen med långtidsbehandlingen och samtidig adjuvant hormonell behandling med GnRH-agonist (triptorelin eller goserelin). Den 5-åriga totala mortaliteten var 19,0 % respektive 15,2 % i korttids- respektive långtidsgrupperna. Den observerade Hazard Ratio på 1,42 med ett övre ensidigt 95,71 % konfidensintervall av 1,79 eller tvåsidigt 95,71 % CI 1,09; 1,85 (p = 0,65 för non inferiority), visar att kombinationen av strålbehandling plus 6 månaders androgendeprivationterapi ger sämre överlevnad jämfört med strålbehandling plus 3 års androgendeprivationterapi. Total överlevnad efter 5 års långtidsbehandling respektive korttidsbehandling visar 84,8 % överlevnad respektive 81,0 %. Total livskvalitet vid användning av QLQ-C30 skilde sig inte signifikant mellan de två grupperna (P = 0,37). Resultaten domineras av patientpopulationen med lokalt avancerad prostatacancer.
Bevis för indikationen lokaliserad prostatacancer av högrisktyp är baserat på publicerade studier med strålbehandling i kombination med GnRH-analoger, inklusive leuprorelinacetat. Analyser av kliniska data från fem publicerade studier (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610, och D'Amico et al., JAMA, 2004), visar samtliga på fördel för kombinationen GnRH-analog med strålbehandling. Tydlig differentiering av respektive studiepopulation för indikationerna lokalt avancerad prostatacancer och lokaliserad prostatacancer av högrisktyp var inte möjlig i de publicerade studierna.
Kliniska data har visat att strålbehandling följt av 3 års androgendeprivationterapi är att föredra framför strålbehandling följt av 6 månaders androgendeprivationterapi.
Den rekommenderade androgendeprivationterapin i medicinska riktlinjer för T3-T4 patienter som får strålbehandling är 2-3 år.
Farmakokinetiska egenskaper
Absorption: Hos patienter med prostatacancer i avancerat stadium stiger de genomsnittliga leuprorelinkoncentrationerna i serum efter den första injektionen till 25,3 ng/ml (22,5 mg: 127 ng/ml, 45 mg: 82 ng/ml) 4–8 timmar (22,5 mg: 4,6 timmar, 45 mg: 4,4 timmar) (Cmax) efter injektion. Efter den initiala ökningen som följer varje injektion (en platåfas 2–28 dagar (7,5 mg), 3–84 dagar (22,5 mg) och 3–168 dagar (45 mg) efter varje dos), är nivåerna i serum relativt konstanta (0,28–1,67 ng/ml (7,5 mg) och 0,2–2 ng/ml (22,5 mg och 45 mg)). Det finns inga belägg för ackumulering vid upprepad dosering.
Distribution: Den genomsnittliga distributionsvolymen av leuprorelin vid steady-state efter intravenös bolusadministrering till friska frivilliga män var 27 liter. In vitro-bindning till humana plasmaproteiner varierade mellan 43 % och 49 %.
Eliminering: Hos friska frivilliga män resulterade intravenös bolusadministrering av 1 mg leuprorelinacetat i ett genomsnittligt systemiskt clearance på 8,34 l/timme och en terminal elimineringshalveringstid på omkring 3 timmar, baserat på en två-kompartmentmodell.
Inga exkretionsstudier har genomförts med Eligard.
Inga metabolismstudier har genomförts med Eligard.
Prekliniska säkerhetsuppgifter
Prekliniska studier med leuprorelinacetat visade effekter på reproduktionssystemet hos båda könen, vilket förväntades utifrån de kända farmakologiska egenskaperna. Dessa effekter visades vara reversibla vid avslutad behandling och efter en lämplig regenereringstid. Leuprorelinacetat visade inte teratogenicitet. Embryotoxicitet/-dödlighet iakttogs hos kanin, vilket överensstämmer med leuprorelins farmakologiska effekter på reproduktionssystemet.
Karcinogenicitetsstudier utfördes på råtta och mus under 24 månader. Hos råtta sågs en dosrelaterad ökning av hypofysapoplexi efter subkutan administrering av doser på 0,6 till 4 mg/kg/dag. Inga sådana effekter observerades hos mus.
Leuprorelinacetat och den besläktade enmånadsprodukten Eligard 7,5 mg var inte mutagena i en serie in vitro- och in vivo-analyser.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Spädningsvätska (spruta A): DL-laktid-glukolid-sampolymer (50:50 (7,5 mg), 75:25 (22,5 mg) eller 85:15 (45 mg)), N-metylpyrrolidon
Pulver (spruta B): -
Inkompatibiliteter
Leuprorelin i spruta B får endast blandas med spädningsvätskan i spruta A och får inte blandas med andra läkemedel.
Hållbarhet
2 år
När produkten har tagits ur kylskåpet, kan den förvaras i originalförpackningen i rumstemperatur (under 25 °C) i upp till 4 veckor.
När brickförpackningen har öppnats första gången måste pulvret och spädningsvätskan omedelbart blandas och ges till patienten.
Efter beredning ska lösningen användas omedelbart då viskositeten ökar med tiden.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C–8 °C).
Förvaras i originalförpackningen. Fuktkänsligt.
Produkten ska uppnå rumstemperatur före injektion. Ta ut ur kylen cirka 30 minuter före användning. När produkten har tagits ur kylen kan den förvaras i originalförpackningen vid rumstemperatur (under 25 °C) i upp till 4 veckor.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ELIGARD injektiokuiva-aine ja liuotin, liuosta varten
7,5 mg (L:ei) 1 kpl (136,43 €)
22,5 mg (L:ei) 1 kpl (346,32 €)
45 mg (L:ei) 1 kpl (635,50 €)
PF-selosteen tieto
Ett förkopplat sprutsystem innehållande:
• en förfylld spruta av cyklisk olefinsampolymer innehållande pulver (spruta B)
• en förfylld spruta av polypropen innehållande spädningsvätska (spruta A)
• en konnektor med låsknapp för spruta A och B.
Spruta A har en kolvspets av termoplastiskt gummi. Kolvproppen på spruta B är tillverkad av klorbutylgummi.
Följande förpackningsstorlekar finns tillgängliga (7,5 mg och 22,5 mg):
- En sats bestående av en formpressad bricka och en steril 20-gauge kanyl i en pappkartong. Brickan innehåller ett förkopplat sprutsystem och en torkmedelspåse.
- En multiförpackning innehållande satser om 3 förkopplade sprutsystem.
Följande förpackningsstorlekar finns tillgängliga (45 mg):
- En sats bestående av en formpressad bricka och en steril 18-gauge kanyl i en pappkartong. Brickan innehåller ett förkopplat sprutsystem och en torkmedelspåse.
- En multiförpackning innehållande satser om 2 förkopplade sprutsystem.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Pulver (spruta B):
Förfylld spruta med vitt till nästan vitt pulver.
Spädningsvätska (spruta A) (7,5 mg):
Förfylld spruta med klar, färglös till gul-/brunaktig lösning.
Spädningsvätska (spruta A) (22,5 mg och 45 mg):
Förfylld spruta med klar, färglös till gulaktig lösning.
Särskilda anvisningar för destruktion och övrig hantering
Låt produkten få rumstemperatur genom att ta den ut ur kylen cirka 30 minuter innan användning.
Förbered först patienten för injektionen. Förbered därefter produkten enligt instruktionerna nedan. Om produkten inte bereds på rätt sätt, bör den inte administreras då utebliven klinisk effekt kan uppstå vid felaktig beredning av produkten.
Steg 1
Öppna brickan på en ren yta genom att riva av folien från hörnen för att ta ut innehållet. Kassera torkmedelspåsen. Ta bort det förkopplade sprutsystemet (figur 1.1) från brickan. Öppna förpackningen med säkerhetskanylen (figur 1.2) genom att dra av pappersfliken. Notera: spruta A och spruta B ska ännu inte placeras mot varandra.
| 7,5 mg och 22,5 mg | 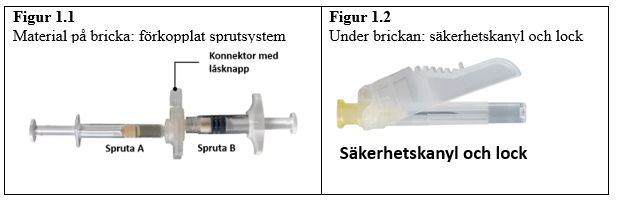 |
| 45 mg | 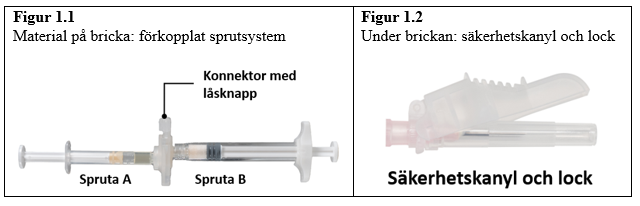 |
Steg 2
Ta tag i låsknappen på konnektorn med ditt finger och tumme och tryck (figur 2) tills du hör ett klickljud. De två sprutorna kommer vara mot varandra. Ingen speciell montering av sprutsystemet krävs för att aktivera konnektorn. Böj inte sprutsystemet (observera att detta kan orsaka läckage eftersom du delvis kan skruva isär sprutorna).
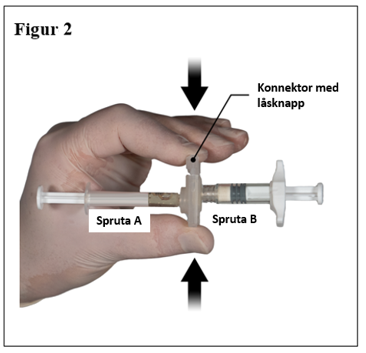 |
Steg 3
Håll sprutorna i en horisontell position, överför vätskeinnehållet från spruta A till leuprorelinacetat pulvret i spruta B. Blanda produkten noga i 60 cykler genom att försiktigt trycka innehållet i båda sprutorna fram och tillbaka mellan båda sprutorna (en cykel är ett tryck på kolven för spruta A och ett tryck på kolven för spruta B) i ett horisontellt läge för att erhålla en homogen, viskös lösning (figur 3). Böj inte sprutsystemet (observera att detta kan orsaka läckage eftersom du delvis kan skruva isär sprutorna).
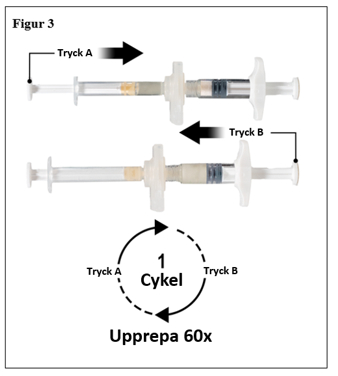 |
7,5 mg: Den viskösa lösningen kommer att ha en färg från färglös till vit till svagt brun (vilket kan innefatta nyanser av vitt till svagt gult) när den har blandats ordentligt.
22,5 mg och 45 mg: Den viskösa lösningen kommer att ha en färg från färglös till vit till svagt gul (vilket kan innefatta nyanser av vitt till svagt gult) när den har blandats ordentligt.
Viktigt: Efter blandning, fortsätt omedelbart med nästa steg eftersom produkten blir mer trögflytande med tiden. Kylförvara inte den blandade produkten.
Observera: Produkten måste blandas enligt beskrivningen; skakning KOMMER INTE att ge en fullgod blandning av produkten.
Steg 4
Efter att ha blandat, håll sprutorna lodrätt med spruta B underst. Sprutorna ska vara säkert ihopkopplade. Dra ner all blandad produkt i spruta B (kort, bred spruta) genom att trycka ner kolven i spruta A och lätt dra tillbaks kolven i spruta B (figur 4).
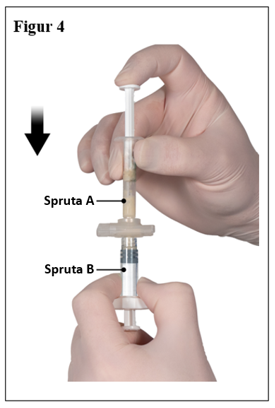 | 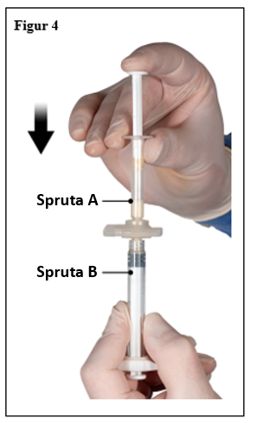 |
| 7,5 mg och 22,5 mg | 45 mg |
Steg 5
Medan kolven på spruta A hålls fortsatt nedtryckt, håll konnektorn och skruva loss den från spruta B. Spruta A kommer fortsätta vara ansluten till konnektorn (figur 5). Se till att ingen produkt läcker ut eftersom kanylen i sådana fall inte kommer att fästa säkert när den sätts på.
Observera: en stor eller några små luftbubblor kan finnas kvar i beredningen - detta är acceptabelt. Tryck inte ut luftbubblorna från spruta B i detta skede eftersom produkt kan förloras!
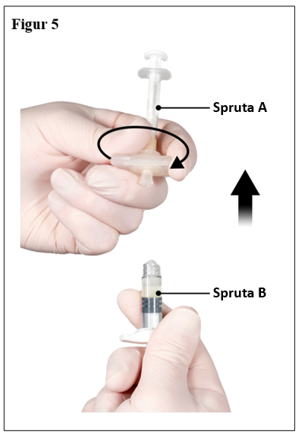 | 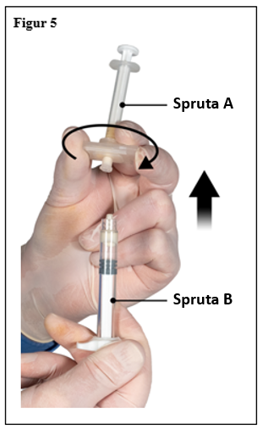 |
| 7,5 mg och 22,5 mg | 45 mg |
Steg 6
- Håll spruta B upprätt och håll tillbaka den vita kolven så att produkten inte rinner ut.
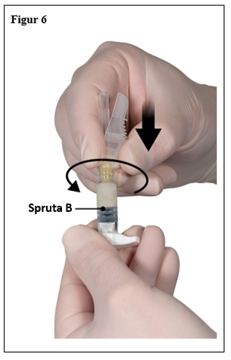
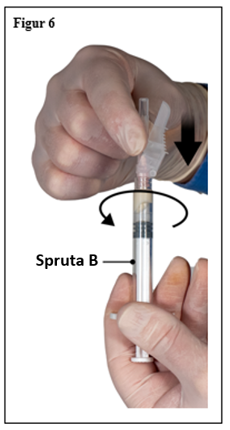
- Fäst säkerhetskanylen på spruta B genom att hålla i sprutan och vrida kanylen försiktigt medurs cirka trekvarts varv tills kanylen sitter fast (figur 6).
Skruva inte för hårt eftersom detta kan orsaka sprickor i kanylfattningen och därmed resultera i att produkten läcker ut under injektion. Säkerhetsskyddet kan skadas om nålen skruvas på med för mycket kraft.
Om kanylfattningen skulle spricka, verka skadad eller läcka ska produkten inte användas. Den skadade kanylen ska inte bytas ut och produkten ska inte injiceras. Hela produkten ska kasseras på ett säkert sätt.
Om det uppstår skador på kanylfattningen ska en ny produkt användas.
 |  |
| 7,5 mg och 22,5 mg | 45 mg |
Steg 7
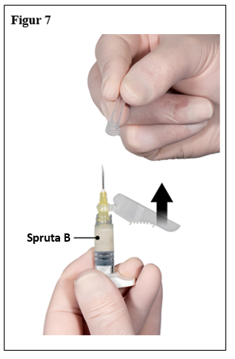
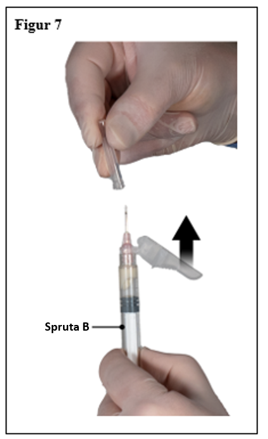
Dra säkerhetshöljet ifrån kanylen och dra av kanylens skydd omedelbart före administrering (figur 7).
Viktigt: Aktivera inte säkerhetskanylens mekanism före administrering. Om kanylfattningen verkar vara skadad, eller läcka, ska produkten INTE användas. Den skadade kanylen ska INTE ersättas och produkten ska INTE injiceras. Vid skada på kanylfattningen, använd ett annat ELIGARD kit.
 |  |
| 7,5 mg och 22,5 mg | 45 mg |
Steg 8
Tryck ut alla stora luftbubblor från spruta B före administrering. Administrera produkten subkutant och håll samtidigt säkerhetshöljet ifrån kanylen.
Administreringssätt:
| 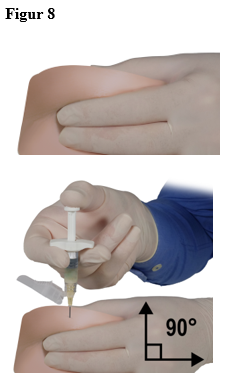 | 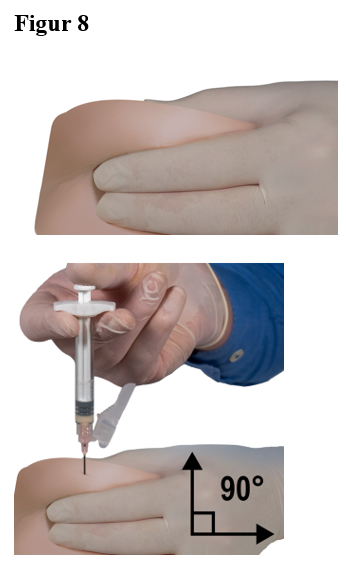 |
| 7,5 mg, 22,5 mg och 45 mg | 7,5 mg och 22,5 mg | 45 mg |
Steg 9
Efter injektion, lås kanylens hölje genom att använda någon av metoderna för aktivering nedan.
1. Stängning mot en plan yta
Tryck säkerhetshöljet med spaken nedåt mot en plan yta (figur 9a) för att täcka kanylen och låsa höljet.
Säkerställ det låsta läget genom ett hörbart och distinkt ”klick”. Låst position kommer att fullständigt täcka nålspetsen (figur 9b).
2. Stängning med tummen
Placera tummen på säkerhetshöljet (figur 9b), täck nålspetsen och lås höljet. Säkerställ det låsta läget genom ett hörbart och distinkt ”klick”. Låst läge kommer att fullständigt täcka nålspetsen.
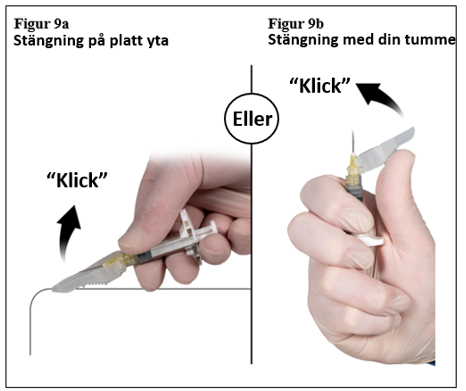 | 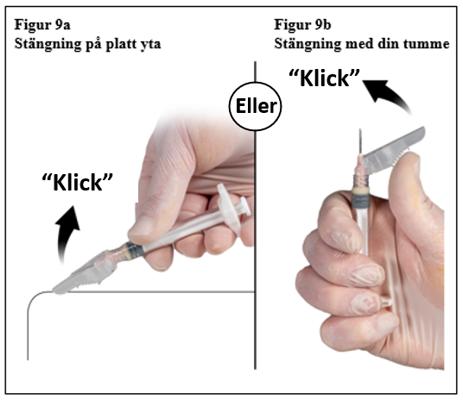 |
| 7,5 mg och 22,5 mg | 45 mg |
Då säkerhetshöljet är låst, kassera genast kanylen och sprutan i en godkänd avfallsbehållare.
Ersättning
ELIGARD injektiokuiva-aine ja liuotin, liuosta varten
7,5 mg 1 kpl
22,5 mg 1 kpl
45 mg 1 kpl
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
Atc-kod
L02AE02
Datum för översyn av produktresumén
11.10.2024
Yhteystiedot
Berzelius väg 8
171 65 Solna
Sverige
+46 8 545 802 30
www.recordati.com
