APOGO PEN injektionsvätska, lösning 10 mg/ml
Kvalitativ och kvantitativ sammansättning
1 ml innehåller 10 mg apomorfinhydroklorid.
Varje 3 ml penna innehåller 30 mg apomorfinhydroklorid.
Hjälpämne med känd effekt:
Natriumbisulfit 0,93 mg/ml.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
Behandling av patienter med Parkinsons sjukdom med motoriska svängningar (”on-off”-perioder) där orala antiparkinsonmedel inte ger fullgod kontroll.
Villkor
Hoito tulee aloittaa ja sitä tulee seurata Parkinsonin tautiin perehtyneen erikoislääkärin valvonnassa.
Dosering och administreringssätt
Selektion av patienter lämpliga för Apogo-injektioner:
Patienter som behandlas med Apogo skall kunna känna igen de initiala symptomen på en ”off”-period och själva kunna injicera läkemedlet eller ha en ansvarig vårdare som vid behov kan ge injektionen.
Patienter behandlade med apomorfin behöver vanligtvis påbörja behandling med domperidon minst två dagar innan behandling initieras. Domperidondosen ska titreras till den lägsta effektiva dosen och sättas ut så snart som möjligt. Innan beslut om att initiera behandling med domperidon och apomorfin ska riskfaktorer för förlängt QT-intervall hos den enskilda patienten bedömas noggrant för att säkerställa att nyttan överväger risken (se avsnitt Varningar och försiktighet).
Apomorfinbehandlingen skall inledas under kontrollerade förhållanden på en specialistklinik. Patienten skall skötas av en läkare med erfarenhet av behandling av Parkinsons sjukdom (t.ex. neurolog). Innan behandling med Apogo inleds ska patientens behandling med L-dopa, med eller utan dopaminagonister, optimeras.
Dosering
Inställning av tröskeldosen
Rätt dos för den enskilda patienten ställs in genom dostitrering. Följande dostitrering föreslås:
1 mg apomorfinhydroklorid (0,1 ml), dvs ca 15-20 mikrogram/kg, injiceras subkutant under en hypokinetisk episod, s k ”off”-period, och patientens motoriska respons observeras i 30 minuter.
Om responsen uteblir eller är otillräcklig, injiceras en andra dos på 2 mg apomorfinhydroklorid (0,2 ml) subkutant och patienten observeras under ytterligare 30 minuter.
Dosen kan därefter stegvis ökas, med minst 40 minuters intervall mellan injektionerna, till dess att tillfredsställande motorisk respons erhålls.
Inställning av behandlingen
När rätt dos har ställts in, ges en subkutan injektion i nedre delen av buken eller på yttersidan av låret vid de första tecknen på en ”off”-period. Det bör observeras att absorptionen av apomorfinhydroklorid kan variera mellan olika injektionsställen hos den enskilde patienten. Patienten ska sedan observeras under den närmaste timmen och bedömas med avseende på behandlingsresponsens kvalitet. Doseringen kan ändras på grundval av patientens respons.
Den optimala doseringen av apomorfinhydroklorid varierar mellan olika personer, men när man väl har ställt in rätt dos, förblir den relativt konstant hos den individuelle patienten.
Försiktighet under på gåendebehandling
Den totala dygnsdosen av Apogo varierar avsevärt mellan olika patienter, men ligger normalt på 3 - 30 mg fördelade på 1 - 10 injektioner, i vissa fall upp till 12 injektioner per dag.
Den totala dygnsdosen apomorfinhydroklorid bör inte överstiga 100 mg och man bör inte ge mer än 10 mg per bolusinjektion.
I kliniska studier har man vanligen kunnat minska dosen L-dopa något. Detta varierar dock betydligt mellan olika patienter och måste ske under noggrann övervakning av en erfaren läkare.
När behandlingen har ställts in kan man hos vissa patienter gradvis reducera domperidonbehandlingen. Hos ett fåtal patienter kan domperidon sättas ut helt utan kräkningar eller hypotoni som följd.
Pediatrisk population
Apogo PEN är kontraindicerat för barn och ungdomar under 18 år (se avsnitt Kontraindikationer).
Äldre
Äldre personer utgör en stor grupp av parkinsonpatienterna och representerar en stor andel av de patienter som har studerats i kliniska prövningar av Apogo. Behandlingen med Apogo har varit densamma för äldre som för yngre patienter. Särskild försiktighet rekommenderas dock vid initiering av behandling av äldre patienter beroende på risken för postural hypotoni.
Nedsatt njurfunktion
Doseringstitrering liknande den som rekommenderas till vuxna och äldre kan följas även till patienter med nedsatt njurfunktion (se avsnitt Varningar och försiktighet).
Administreringssätt
Apogo PEN 10 mg/ml injektionsvätska ska injiceras subkutant genom intermittent bolusinjektion.
Apomorfin får inte administreras intravenöst.
Använd inte om lösningen blivit grönfärgad. Lösningen ska kontrolleras visuellt innan användning. Endast klar färglös lösning utan partiklar ska användas.
Kontraindikationer
Andningsdepression, demens, psykotiska sjukdomar eller leverinsufficiens.
Behandling med apomorfinhydroklorid får inte ges till patienter som har en ”on”-respons som svar på levodopabehandling som störs av svår dyskinesi eller dystoni.
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen. Apogo skall inte ges till patienter med känd överkänslighet mot apomorfin eller någon annan ingående substans.
Samtidig användning med ondansetron (se avsnitt Interaktioner).
Apogo skall inte ges till barn och ungdomar under 18 års ålder.
Varningar och försiktighet
Apomorfinhydroklorid ska ges med försiktighet till patienter med njur-, lung- eller hjärt-kärlsjukdom och till personer med benägenhet för illamående och kräkningar.
Vid behandling av äldre och/eller svaga patienter rekommenderas särskild försiktighet i den inledande fasen.
Eftersom apomorfin kan framkalla hypotoni, även när det ges i kombination med domperidon, måste försiktighet iakttagas vid behandling av patienter med hjärtsjukdom och patienter som tar vasoaktiva läkemedel, t.ex. blodtryckssänkande medel, särskilt hos patienter med tidigare känd postural hypotoni.
Eftersom apomorfin, särskilt i höga doser, kan medföra QT-förlängning, skall försiktighet vidtas vid behandling av patienter med risk för torsades de pointes arytmi.
Vid användning i kombination med domperidon ska riskfaktorer hos den enskilda patienten bedömas noggrant. Detta ska göras innan behandling initieras och under behandling. Viktiga riskfaktorer inkluderar allvarliga underliggande hjärtsjukdomar som kongestiv hjärtsvikt, gravt nedsatt leverfunktion eller signifikant elektrolytrubbning. Även läkemedel som eventuellt kan påverka elektrolytbalans, CYPO3A4-metabolism eller QT-intervall ska bedömas. Övervakning för en effekt på QTc-intervallet rekommenderas. Ett EKG bör tas:
- före behandling med domperidon
- under behandlingens initieringsfas
- om kliniskt motiverat
Patienten ska informeras att rapportera eventuella hjärtsymtom inklusive palpitationer, svimning eller svimningskänsla. De ska också rapportera kliniska förändringar som kan leda till hypokalemi, t.ex. gastroenterit eller initiering av behandling med diuretika.
Riskfaktorerna ska bedömas på nytt vid varje läkarbesök.
Apomorfin associeras med lokala subkutana reaktioner. Dessa kan i vissa fall reduceras genom att byta injektionsställe eller möjligtvis genom använda ultraljud (om detta finns tillgängligt) för att
undvika områden med knutor och förhårdnader.
Hemolytisk anemi och trombocytopeni har rapporterats för patienter som behandlas med apomorfin. Hematologiska prover skall regelbundet kontrolleras på samma sätt som vid levodopabehandling när det ges tillsammans med apomorfin.
Försiktighet bör iakttagas då apomorfin kombineras med andra läkemedel, särskilt sådana med smalt terapeutiskt fönster (se avsnitt Interaktioner).
Många patienter med avancerad Parkinsons sjukdom utvecklar neuropsykiatriska problem. Det finns belägg för att apomorfin hos vissa patienter kan förvärra de neuropsykiatriska störningarna. Särskild försiktighet bör iakttas när dessa patienter behandlas med apomorfin.
Apomorfin har associerats med somnolens och plötsliga sömnattacker särskilt hos patienter med Parkinsons sjukdom. Patienter måste informeras om detta och rådas till försiktighet under bilkörning eller hantering av maskiner under behandling med apomorfin. Patienter som har uppvisat somnolens och/eller plötsliga sömnattacker måste avstå från bilkörning och hantering av maskiner. Dessutom kan en dosreduktion eller utsättande av behandlingen övervägas.
Störd impulskontroll
Patienter ska regelbundet kontrolleras för utveckling av störd impulskontroll. Patienter och dess vårdare ska uppmärksammas på att beteendemässiga symtom som tyder på störd impulskontroll såsom patologiskt spelberoende, ökad libido, hypersexualitet, tvångsmässigt spenderande av pengar och tvångsmässigt köpbeteende, hetsätning och tvångsmässigt ätande kan förekomma hos patienter som behandlas med dopaminagonister inklusive apomorfin. Dosreduktion/gradvis utsättning bör övervägas om patienten utvecklar dessa symtom.
Dopaminergt dysregleringssyndrom (DDS) är en beroendestörning som leder till överdriven
användning av produkten, vilket ses hos vissa patienter som behandlas med apomorfin. Innan
behandlingen inleds ska patienter och vårdgivare varnas för den potentiella risken för DDS.
Apogo PEN 10 mg/ml infusionsvätska innehåller natriumbisulfit som i sällsynta fall kan ge allvarliga allergiska reaktioner och bronkospasm.
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per 10 ml, dvs det är nästintill ”natriumfritt”.
Interaktioner
Patienter som ordineras behandling med apomorfinhydroklorid tar med största sannolikhet även andra läkemedel mot Parkinsons sjukdom. I den inledande fasen av behandlingen med apomorfinhydroklorid bör patienten övervakas med avseende på ovanliga biverkningar eller tecken på förstärkt effekt.
Neuroleptika kan ha en antagonistisk effekt vid samtidig medicinering med apomorfin. Potentiellt kan en interaktion förekomma mellan klozapin och apomorfin. Klozapin kan emellertid också användas för att reducera symtomen av neuropsykiatriska komplikationer.
Samtidig användning av apomorfin och ondansetron kan leda till svår hypotoni och medvetslöshet och är därför kontraindicerat (se avsnitt Kontraindikationer). Sådana effekter kan också uppträda med andra 5-HT3-antagonister.
Det är inte studerat huruvida apomorfin kan påverka plasmakoncentrationerna av andra läkemedel. Försiktighet rekommenderas därför vid kombination av apomorfin och andra läkemedel, särskilt sådana med smalt terapeutiskt fönster.
Blodtryckssänkande medel och hjärtaktiva medel
Även vid samtidig behandling med domperidon kan apomorfin förstärka dessa läkemedels blodtryckssänkande effekt (se avsnitt Varningar och försiktighet) .
Administrering av apomorfin tillsammans med andra läkemedel som kan orsaka förlängning av QT-intervallet bör undvikas.
Fertilitet, graviditet och amning
Graviditet
Det finns ingen erfarenhet av användning av apomorfin hos gravida kvinnor.
Reproduktionsstudier i djur indikerar ingen teratogen effekt men doser till råttor, som är toxiska för modern, kan medföra andningssvikt hos den nyfödda avkomman. Den potentiella risken för människa är okänd (se avsnitt Prekliniska säkerhetsuppgifter).
Apogo ska endast användas under graviditet om det är absolut nödvändigt.
Amning
Det är inte känt om apomorfin passerar över i modersmjölk. Beslut om huruvida amning ska fortsätta/avbrytas eller om behandlingen med Apogo ska fortsätta/avbrytas ska tas efter övervägande mellan fördelarna med amning för barnet och fördelarna med Apogo behandling för modern.
Effekter på förmågan att framföra fordon och använda maskiner
Apomorfinhydroklorid har mindre eller måttlig effekt på förmågan att framföra fordon och använda maskiner.
Patienter som behandlas med apomorfin och uppvisar somnolens och/eller plötsliga sömnattacker måste informeras om att avstå från bilkörning och andra aktiviteter (t.ex. användning av maskiner) där sänkt uppmärksamhet kan utsätta dem själva eller andra för risk för allvarlig skada eller död. Detta gäller till dess att de återkommande sömnattackerna och somnolensen har upphört (se avsnitt Varningar och försiktighet).
Biverkningar
Mycket vanliga (≥1/10)
Vanliga (≥1/100, <1/10)
Mindre vanliga (≥1/1 000, <1/100)
Sällsynta (≥1/10 000, <1/1 000)
Mycket sällsynta (<1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
Blodet och lymfsystemet
Mindre vanliga:
Hemolytisk anemi och trombocytopeni har rapporterats för patienter som behandlats med apomorfin.
Sällsynta:
Eosinofili har i sällsynta fall uppträtt under behandling med apomorfinhydroklorid.
Immunsystemet
Sällsynta:
På grund av innehållet av natriumbisulfit, kan allergiska reaktioner (inklusive anafylaxi och bronkospasm) förekomma.
Psykiska störningar
Mycket vanliga:
Hallucinationer
Vanliga:
Neuropsykiatriska störningar (inklusive övergående, lindrig konfusion och synhallucinationer) har förkommit under behandling med apomorfinhydroklorid.
Ingen känd frekvens:
Störd impulskontroll
Patologiskt spelberoende, ökad libido, hypersexualitet, tvångsmässigt spenderande av pengar och tvångsmässigt köpbeteende, hetsätning och tvångsmässigt ätande kan förekomma hos patienter som behandlas med dopaminagonister inklusive apomorfin (se avsnitt Varningar och försiktighet).
Aggression, agitation
Centrala och perifera nervsystemet
Vanliga:
I början av behandlingen kan övergående sedation förekomma i anslutning till varje dos apomorfinhydroklorid. Detta försvinner vanligen under de första behandlingsveckorna.
Apomorfin associeras med somnolens.
Yrsel/omtöckning har också rapporterats.
Mindre vanliga:
Under ”on”-perioder kan apomorfin orsaka dyskinesi som i vissa fall kan vara svår, och kan hos ett fåtal patienter leda till att behandlingen måste sättas ut.
Apomorfin har associerats med plötsliga sömnattacker (se avsnitt Varningar och försiktighet).
Ingen känd frekvens:
Synkope
Huvudvärk
Blodkärl
Mindre vanliga:
Postural hypotension kan förekomma och är vanligen övergående (se avsnitt Varningar och försiktighet) .
Andningsvägar, bröstkorg och mediastinum
Vanliga:
Gäspningar har rapporterats under apomorfinbehandling.
Mindre vanliga:
Andningssvårigheter har rapporterats.
Magtarmkanalen
Vanliga:
Illamående och kräkningar, särskilt i början av behandlingen, vanligen på grund av att domperidon inte använts (se avsnitt Dosering och administreringssätt).
Hud och subkutan vävnad
Mindre vanliga:
Lokala eller allmänna hudutslag har rapporterats.
Allmänna symtom och/eller symtom vid administreringsstället
Mycket vanliga:
De flesta patienter utvecklar reaktioner vid injektionsstället, särskilt vid kontinuerlig användning. Dessa kan innefatta subkutana knutor, förhårdnader, erytem, ömhet och pannikulit. Ett flertal andra lokala reaktioner (såsom irritation, klåda, blåmärken och smärta) kan också förekomma.
Mindre vanliga:
Nekros och ulceration på injektionsstället har rapporterats.
Ingen känd frekvens:
Perifera ödem har rapporterats.
Undersökningar
Mindre vanliga:
Positivt Coombs test har rapporterats för patienter som har behandlats med apomorfin.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via:
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Det finns mycket begränsad klinisk erfarenhet av överdosering av apomorfin för detta administreringssätt. Symptom på överdosering kan behandlas empiriskt enligt nedanstående förslag:
- våldsam emes kan behandlas med domperidon.
- andningsdepression kan behandlas med naloxon.
- hypotoni: lämpliga åtgärder ska vidtas, t.ex. höjd fotända på sängen.
- bradykardi kan behandlas med atropin.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Dopaminagonister, ATC-kod: N04BC07
Apomorfin har en direkt stimulerande effekt på dopaminreceptorer. Trots att det har såväl D1- som D2-receptorstimulerande egenskaper, har det inte samma transportvägar eller metaboliska vägar som L-dopa.
Även om apomorfin hos intakta försöksdjur hämmar utlösningsfrekvensen hos nigrostriatala celler och
låga doser framkallar en minskad rörelseaktivitet (som antas representera presynaptisk hämning av den
endogena dopaminfrisättningen) medieras dess effekter på parkinsonframkallad motorisk
funktionsnedsättning troligen vid postsynaptiska receptorställen. Denna tvåfaseffekt observeras också hos människa.
Farmakokinetiska egenskaper
Distribution och eliminering
Efter subkutan injektion kan apomorfinets farmakokinetik och distribution beskrivas med en 2-kompartmentmodell där distributionshalveringstiden är 5(±1,1) minuter och eliminationshalveringstiden är 33 (±3,9) minuter. Den kliniska responsen korrelerar väl med nivåerna av apomorfin i cerebrospinalvätskan; distributionen av den aktiva substansen beskrivs bäst med en 2-kompartmentmodell.
Absorption
Apomorfin absorberas snabbt och fullständigt från subkutan vävnad, vilket överensstämmer med den snabbt insättande kliniska effekten (4 ‑ 12 minuter) och läkemedlets kortvariga kliniska effektduration (ca 1 timme) förklaras av dess snabba clearance. Apomorfin metaboliseras till minst 10% via glukuronidering och sulfonering. Andra metabolismvägar finns inte beskrivna.
Prekliniska säkerhetsuppgifter
Toxicitetsstudier med upprepad subkutan behandling visade inte några särskilda risker för människa utöver vad som redan beaktats i övriga delar av produktresumén.
Gentoxicitetsstudier in vitro har visat mutagena och klastogena effekter, troligen medierade av produkter som bildats vid oxidation av apomorfin. Apomorfin har dock inte visat någon gentoxicitet i in vivo studier .
Apomorfinets effekt på reproduktionen har studerats hos råttor. Apomorfin var ej teratogent i denna art, men det observerades att doser som är toxiska för modern kan medföra minskad moderlig omsorg samt andningssvikt hos den nyfödda avkomman.
Inga karcinogenicitetsstudier har utförts.
Miljöriskbedömning
Apomorfinhydroklorid är en beprövad aktiv aktiv substans för medicinskt bruk och Apogo har funnits på marknaden i tio år. Vår slutsats är att det inte finns något behov av en miljöriskbedömning för denna aktiva substans.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Natriumbisulfit (E222)
Koncentrerad saltsyra (37 %) (för justering av pH-värdet)
Vatten för injektionsvätskor
Inkompatibiliteter
Då blandbarhetsstudier saknas, skall detta läkemedel inte blandas med andra läkemedel.
Hållbarhet
2 år.
Bruten förpackning är hållbar i 48 timmar.
Särskilda förvaringsanvisningar
Förvaras vid högst 25oC.
Förvaras i originalförpackningen. Ljuskänsligt.
Läkemedlet ska förvaras under samma förhållanden efter öppnandet och mellan användningarna.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
APOGO PEN injektioneste, liuos
10 mg/ml (L:ei) 5 x 3 ml (kertakäyttöinen moniannoksinen injektiokynä) (186,61 €)
PF-selosteen tieto
Cylinderampull
Apogo Pen är en förfylld injektionspenna med flera doser med en cylinderampull av glas (typ I) som innehåller en klar injektionsvätska. Cylinderampullen är förseglad i ena änden med en kolv av bromobutylgummi och i den andra änden med ett membran av bromobutylgummi och aluminium.
Varje penna innehåller 3 ml injektionsvätska, lösning.
Tillgängliga förpackningar: kartong med 1, 5 eller 10 injektionspennor à 3 ml, i formgjuten plastbricka.
Multiförpackningar innehållande 25 (5 förpackningar med 5) pennor.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Lösningen är klar, praktiskt taget färglös, luktfri och fri från synliga partiklar.
pH 2.5 – 4,0
Särskilda anvisningar för destruktion och övrig hantering
Apogo PEN
Får ej användas om injektionslösningen blivit grönfärgad.
Injektionspennan skall kasseras senast 48 timmar efter första injektionen.
(se bifogad bild)
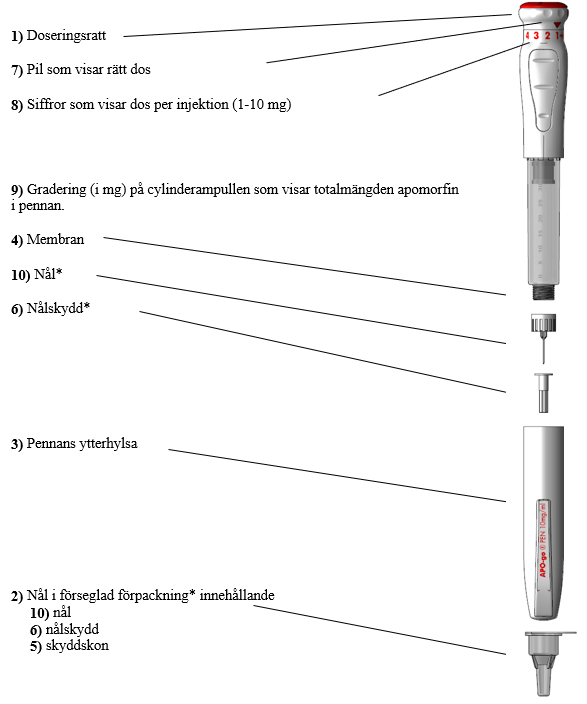
*Denna förpackning innehåller INTE nålar för användning med pennan.
Använd pennålar som inte är längre än 12,7 mm (1/2″) och inte smalare än 30 G.
Pennålar som rekommenderas för användning i insulinpennor passar i Apogo PEN.
VIKTIGT: Dra inte ut den röda doseringsratten (se 1) innan du ställt in dosen
(se Inställning av rätt dos).
Montering av nålen
(a) Innan Du använder Apogo injektionspenna behöver Du några sterila spritkompresser och en nål i sin skyddskon (se2).
(b) Ta ut pennan ur kartongen och ta av ytterhylsan (se 3).

(c) Torka membranet på pennan (se 4) med en spritkompress.
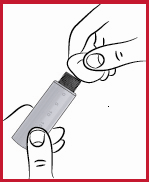
(d) Tag av skyddspapperet från nålkonen (se2).
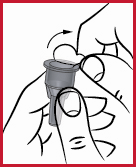
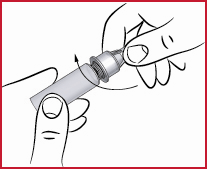
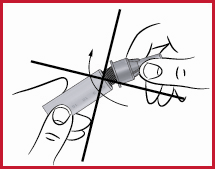
(e) Det är viktigt att nålen hålls i rak linje med pennan då den sätts fast, som visas ovan. Om nålen fästs snett på pennan kan det hända att pennan kommer att läcka.
(f) Skruva på konen (se2) medurs på membranet tills det sitter tätt. Detta fäster nålen på ett säkert sätt.
(g) Ta av skyddskonen (se 5), men kasta den inte. Ta inte av nålskyddet ännu (se 6).
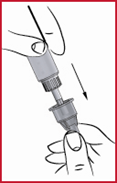
(h) Sätt tillbaka ytterhylsan på pennan (se 3).
Inställning av rätt dos
(i) Tryck ned den röda doseringsratten (se 1) och, under det att den hålls ned, vrid ratten medurs tills pilen pekar på den ordinerade dosen (se 7 och 8). Släpp det nedåtriktade trycket på den röda doseringsratten. Nu är dosen inställd och Du behöver inte ställa in doseringen på nytt inför efterföljande injektioner.
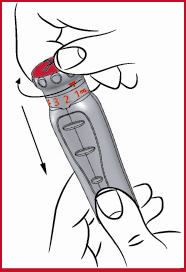
Viktigt: Om Du råkar vrida ratten för långt, fortsätter du bara att trycka ned och vrida ratten i samma riktning tills pilen pekar på rätt dos igen. Du får aldrig dra och vrida i den röda doseringsratten på samma gång.
Om din dos är 1 mg, börja med att tömma en 1 mg-dos på en pappersnäsduk som du sedan kastar. Detta kallas för att “förbereda” pennan och är viktigt eftersom det försäkrar att du får en full dos första gången du använder pennan. Ställ sedan in den önskade dosen för injicering och injicera på vanligt sätt (se nedan under “Injicering”). Om den första önskade dosen är större än 1 mg, behöver Du inte förbereda pennan.
Injicering
(j) När Du ställt in dosen, dra ut den röda doseringsratten så långt det går. Kontrollera den röda skalan på kolven (se 9) och injicera endast om linjen som nätt och jämt syns motsvarar den avsedda dosen.
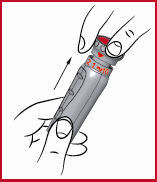

(k) Tvätta injektionsstället och huden runt omkring med en steril spritkompress.
(l) Ta av pennans ytterhylsa (se 3).
(m) Ta av nålskyddet (se 6).
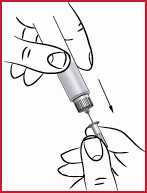
(n) Stick in nålen (se 10) på det sätt som din läkare eller sjuksköterska har lärt dig.
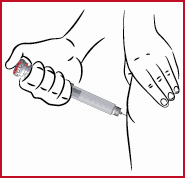
(o) Injicera genom att, trycka ned den röda doseringsratten (se 1) så långt det går. Använd tummen om möjligt. När den röda doseringsratten är helt nedtryckt räknar du till tre innan du drar ut nålen.
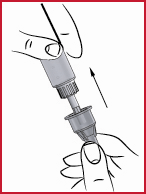
(p) Sätt åter på skyddskonen på den använda nålen (se 5) och tryck den försiktigt på plats. När konen sitter ordentligt på plats skruvar du loss nålen moturs för att skruva upp den.
Kassera nålen med skyddskonen på ett säkert sätt, t.ex. i en punkteringssäker avfallsbehållare för använda nålar eller i en tom kaffeburk.
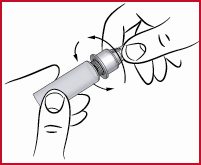
Förberedelse av nästa injektion:
(q) Avlägsna pennans ytterhylsa och kontrollera att det finns tillräckligt med apomorfin i cylinderampullen för din nästa injektion. Om det gör det, montera en ny nål på samma sätt som förut.
(r) Om det inte finns tillräckligt med apomorfin i cylinderampullen för en ny injektion, gör Du i ordning en ny penna.
(s) Sätt slutligen tillbaka pennans ytterhylsa.

Ersättning
APOGO PEN injektioneste, liuos
10 mg/ml 5 x 3 ml
- Ylempi erityiskorvaus (100 %). Parkinsonin tauti ja siihen verrattavat liikehäiriöt (110).
- Peruskorvaus (40 %).
Atc-kod
N04BC07
Datum för översyn av produktresumén
26.09.2023
Yhteystiedot
PL 1310, Puolikkotie 8, 02230 Espoo (käyntiosoite)
00101 Helsinki
0207 416 888
