WILFACTIN pulver och vätska till injektionsvätska, lösning 100 IU/ml
Kvalitativ och kvantitativ sammansättning
Wilfactin levereras som pulver och vätska till injektionsvätska, lösning som innehåller nominellt 500 IE 1 000 IE eller 2 000 IE human von Willebrand‑faktor (VWF) per injektionsflaska.
Läkemedlet innehåller cirka 100 IE human von Willebrand-faktor per ml efter beredning med 5 ml (500 IE), 10 ml (1 000 IE) eller 20 ml (2 000 IE) vatten för injektionsvätskor.
Innan albumin tillsätts är den specifika aktiviteten för Wilfactin större än eller lika med 60 IE VWF:RCo/mg protein.
Aktiviteten hos VWF (IE) mäts enligt ristocetinkofaktoraktiviteten (VWF:RCo) jämfört med den internationella standarden för von Willebrand-faktorkoncentrat (WHO).
Kvantiteten human faktor VIII (FVIII) i Wilfactin är ≤ 10 IE/100 IE VWF:RCo.
FVIII-aktiviteten (IE) fastställs med användning av kromogen analys enligt den europeiska farmakopén.
Hjälpämne med känd effekt:
Detta läkemedel innehåller natrium:
- En 5 ml injektionsflaska (500 IE) innehåller 0,15 mmol (3,4 mg) natrium
- En 10 ml injektionsflaska (1 000 IE) innehåller 0,3 mmol (6,9 mg) natrium
- En 20 ml injektionsflaska (2 000 IE) innehåller 0,6 mmol (13,8 mg) natrium
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver och vätska till injektionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
Wilfactin är indicerat för prevention och behandling av blödningar eller operationsblödning hos patienter med von Willebrands sjukdom (VWD) när behandling med enbart desmopressin (DDAVP) ej är tillräcklig eller kontraindicerad.
Wilfactin kan användas för alla åldersgrupper.
Wilfactin bör inte användas vid behandlingen av hemofili A.
Dosering och administreringssätt
Behandling av von Willebrands sjukdom bör övervakas av en läkare med erfarenhet av att behandla hemostassjukdomar.
Dosering
Generellt sett ökar 1 IE/kg av von Willebrand-faktor den cirkulerande nivån av VWF:RCo med 0,02 IE/ml (2 %).
Nivåer av VWF:RCo på > 0,6 IE/ml (60 %) och av FVIII:C på > 0,4 IE/ml (40 %) bör uppnås.
Hemostas kan inte garanteras förrän faktor VIII-koagulationsaktiviteten (FVIII:C) har nått 0,4 IE/ml (40 %). En enstaka injektion med enbart von Willebrand-faktor inducerar inte en maximal ökning av FVIII:C på minst 6–12 timmar. Administreringen kan inte omedelbart korrigera FVIII:C-nivån, så om patientens plasmanivå av FVIII:C är under denna kritiska nivå vid utgångsmätningen är det nödvändigt att i alla situationer där en snabb korrigering av hemostas ska uppnås, exempelvis vid behandling av blödning, svårt trauma eller akut kirurgi, administrera en faktor VIII-produkt tillsammans med den första injektionen av von Willebrand-faktor för att uppnå en hemostasplasmanivå av FVIII:C.
Om det inte är nödvändigt att omedelbart höja nivån av FVIII:C, exempelvis vid en planerad operation, eller om nivån av FVIII:C vid utgångsmätningen är tillräcklig för att garantera hemostas, kan dock läkaren bestämma sig för att utesluta samadministreringen av FVIII vid den första injektionen av VWF.
- Behandlingsstart
Den första dosen av Wilfactin är 40 till 80 IE/kg för behandling av blödning eller trauma, tillsammans med den mängd som krävs av faktor VIII-produkt, beräknat i enlighet med patientens plasmanivå av FVIII:C vid utgångsläget, för att uppnå en tillräcklig plasmanivå av FVIII:C omedelbart före ingreppet eller snarast möjligt efter debuten av en blödningsepisod eller ett svårt trauma. Om patienten ska opereras ges läkemedlet 1 timme innan ingreppet.
Det kan krävas en inledande dos på 80 IE/kg av Wilfactin, i synnerhet till patienter med typ 3 av von Willebrands sjukdom där underhållet av adekvata nivåer kan kräva högre doser än vid andra typer av sjukdomen.
Inför planerade operationer bör behandlingen med Wilfactin inledas 12‑24 timmar före operationen och upprepas 1 timme före ingreppet. I detta fall behövs ingen samadministrering av faktor VIII-produkt eftersom endogent FVIII:C brukar ha nått den kritiska nivån på 0,4 IE/ml (40 %) före operationen. Detta bör dock bekräftas för varje enskild patient.
- Påföljande injektioner
Vid behov bör behandlingen fortsätta med en lämplig dos av Wilfactin, 40‑80 IE/kg per dag i 1 eller 2 dagliga injektioner under en till flera dagar. Dosen och behandlingens varaktighet beror på patientens kliniska status, blödningens typ och svårighetsgrad och nivåerna av både VWF:RCo och FVIII:C.
- Långtidsprofylax
Wilfactin kan administreras som långtidsprofylax i en dos som bestäms individuellt för varje patient. Wilfactin-doser på mellan 40 och 60 IE/kg, administrerade två till tre gånger per vecka, reducerar antalet blödningsepisoder.
- Öppenvård
Behandling i hemmet kan initieras med behandlande läkares godkännande, särskilt vid fall av lätt till måttlig blödning eller under långtidsprofylax för att förebygga blödning. Läkaren ska säkerställa lämplig upplärning och att behandlingen ses över vid förbestämda intervaller.
Pediatrisk population
För varje indikation ska doseringen baseras på kroppsvikten. Dosen och behandlingens varaktighet ska anpassas till patientens kliniska status och plasmanivåerna av VWF:RCo och FVIII:C.
-
Behandlingsstart:
- För barn yngre än 6 år kan den inledande dosen bestämmas med vägledning av patientens ökande utbyte (IR), eller om IR-data inte finns tillgängliga, kan en inledande dos mellan 60 och 100 IE/kg krävas för att höja patientens nivåer av VWF:RCo till 100 IE/dl.
- Doseringen till barn äldre än 6 år och ungdomar är densamma som för vuxna.
-
Påföljande injektioner:
Påföljande doser till barn och ungdomar ska individanpassas till klinisk status och nivåer av VWF:RCo och justeras enligt det kliniska svaret. -
Elektiv kirurgi:
- För elektiv kirurgi kan, efter en första dos administrerad 12 till 24 timmar före ingreppet, den upprepade dosen administreras 30 minuter före ingreppet för barn yngre än 6 år.
- Doseringen till barn äldre än 6 år och ungdomar är densamma som för vuxna.
-
Profylax:
Dosen och återadministreringsfrekvensen för barn och ungdomar ska individanpassas till patientens ökande utbyte och nivåer av VWF:RCo och justeras enligt det kliniska svaret.
Administreringssätt
Lös upp produkten enligt beskrivning i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Wilfactin ska administreras intravenöst med en maximal hastighet på 4 ml/minut.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något innehållsämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
När det gäller patienter med en aktiv blödning rekommenderas att man som förstahandsbehandling, i tillägg till von Willebrand-faktorprodukten (som har ett lågt FVIII-innehåll) samadministrerar en FVIII-produkt i en separat spruta.
Överkänslighet
I likhet med all intravenös administrering av ett protein som har utvunnits ur plasma, är överkänslighetsreaktioner möjliga. Patienter måste övervakas och observeras noga avseende symtom under injektionen. Patienter bör informeras om de tidiga tecknen på överkänslighetsreaktioner inklusive nässelfeber, generaliserad urtikaria, tryck över bröstet, pipande andning, hypotoni och anafylaxi. Om dessa symtom uppkommer ska administreringen upphöra omedelbart. Om anafylaktisk chock inträffar bör vedertagen medicinsk behandling sättas in.
Överförbara agens
Sedvanliga åtgärder för att förhindra infektioner som uppkommer till följd av användningen av läkemedelsprodukter, som har tillverkats av humant blod eller plasma, innefattar selektering av blodgivare, screening av enskilda donationer och plasmapooler avseende specifika infektionsmarkörer och användande av effektiva tillverkningssteg för inaktivering/avlägsnande av virus.
Trots detta kan inte risken för att överföra smittämnen uteslutas helt när läkemedelsprodukter som har framställts från humant blod eller plasma administreras. Detta gäller även okända virus eller virus under utveckling och andra patogener.
De vidtagna åtgärderna anses vara effektiva för höljebärande virus som t.ex. human immunbristvirus (HIV), hepatit B-virus (HBV) och hepatit C-virus (HCV). De vidtagna åtgärderna kan vara av begränsat värde mot icke höljebärande virus som t.ex. hepatit A-virus (HAV) och parvovirus B19. En infektion med parvovirus B19 kan vara allvarlig för gravida kvinnor (infektion hos fostret) och för personer med immunbrist eller ökad erytropoes (t.ex. hemolytisk anemi).
Lämplig vaccination (hepatit A och hepatit B) bör övervägas för patienter som regelbundet får von Willebrand-faktor som härrör från human plasma.
Det rekommenderas starkt att notera namn och tillverkningssatsnummer på läkemedlet varje gång Wilfactin administreras till en patient, för att upprätthålla en koppling mellan patient och tillverkningssats av läkemedlet.
Tromboembolism
Wilfactin är en von Willebrand-faktorprodukt med lågt FVIII innehåll. Det finns trots allt en risk för förekomst av tromboemboliska händelser, särskilt hos patienter med kända kliniska eller laboratoriemässiga riskfaktorer. Därför måste riskpatienter övervakas avseende tidiga tecken på trombos. Profylax mot venös tromboembolism bör sättas in i enlighet med gällande rekommendationer.
När Wilfactin används ska den behandlande läkaren vara medveten om att fortsatt behandling kan orsaka en överdriven höjning av FVIII:C. För att undvika ihållande, alltför höga FVIII:C-plasmanivåer, vilka kan öka risken för tromboemboliska händelser, bör plasmanivåerna av FVIII:C övervakas hos patienter som kräver frekvent dosering av Wilfactin särskilt i kombination med en faktor VIII-produkt.
Immunogenicitet
Patienter med von Willebrands sjukdom, i synnerhet typ 3-patienter, kan utveckla neutraliserande antikroppar (inhibitorer) mot von Willebrand-faktorn. Om förväntade VWF:RCo-aktivitetsnivåer i plasma inte uppnås, eller om blödning inte kontrolleras med en lämplig dos, bör en lämplig analys utföras för att fastställa om det finns en von Willebrand-faktorn -inhibitor. Hos patienter med höga inhibitornivåer är det inte säkert att behandlingen med von Willebrand-faktor är effektiv och andra terapeutiska alternativ bör övervägas.
Information om hjälpämne (natriuminnehåll)
Detta läkemedel innehåller natrium.
Om mer än 3 300 IE injiceras (mer än 1 mmol natrium), bör detta beaktas av patienter som ordinerats saltfattig kost (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING för mängd per injektionsflaska).
Interaktioner
Inga interaktioner är kända mellan produkter med human von Willebrand-faktor och andra läkemedel.
Fertilitet, graviditet och amning
Djurstudier är otillräckliga för att bedöma säkerhet av Wilfactin vad gäller fertilitet, reproduktion, graviditet, embryo-/fosterutveckling eller peri- och postnatal utveckling.
Säkerheten för Wilfactin under graviditet och amning har inte undersökts i kliniska studier.
Wilfactin skall användas till gravida och ammande kvinnor med brist på von Willebrand-faktor endast då det är absolut nödvändigt.
Effekter på förmågan att framföra fordon och använda maskiner
Inga effekter på förmågan att framföra fordon eller använda maskiner har observerats.
Biverkningar
Sammanställning av säkerhetsprofilen
Under behandling med Wilfactin kan följande biverkningar förekomma:
Allergiska och anafylaktiska reaktioner (inklusive chock i sällsynta fall), tromboemboliska händelser (huvudsakligen hos patienter med riskfaktorer), bildning av VWF-inhibitor och reaktioner vid administreringsstället).
Tabell över biverkningar
Tabellen nedan ger en överblick av observerade biverkningar i sex kliniska studier och en icke-interventionsstudie efter produktens lansering, och från andra källor efter lansering. Under studierna exponerades 226 patienter för Wilfactin under totalt 16 640 exponeringsdagar.
Biverkningarna kategoriseras enligt MedDRAs organklassificering (SOC), Preferred Term Level (PT) och frekvens).
Biverkningsfrekvenserna har beräknats enligt följande konvention: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Spontant rapporterade biverkningar efter lansering kategoriseras som ingen känd frekvens.
| Klassificering av organsystem enligt MedDRA | Biverkningar (Preferred Term) | Frekvens utifrån antal patienter |
| Blodet och lymfsystemet | Inhibition av von Willebrand-faktor* | Ingen känd frekvens |
| Immunsystemsjukdomar | Överkänslighet | Mindre vanliga |
| Anafylaktisk chock* | Ingen känd frekvens | |
| Centrala och perifera nervsystemet | Yrsel | Mindre vanliga |
| Parestesi, hypoestesi | Mindre vanliga | |
| Vaskulära sjukdomar | Värmevallningar | Mindre vanliga |
| Tromboemboliska händelser* | Ingen känd frekvens | |
| Sjukdomar i hud och subkutan vävnad | Pruritus | Mindre vanliga |
| Allmänna sjukdomar och tillstånd på administreringsstället | Reaktioner vid administreringsstället** (inklusive reaktion vid infusionsstället, inflammation vid infusionsstället och inflammation vid kärlpunktionsstället) | Vanliga |
| Känsla av förstämdhet | Mindre vanliga | |
| Frossa, frusenhet | Mindre vanliga | |
| Pyrexi* | Ingen känd frekvens |
* Rapporterat genom erfarenhet/övervakning efter lansering med frekvens ”ingen känd frekvens” enligt konventionen ovan.
** MedDRA High Level Group Term
Beskrivning av utvalda biverkningar
Överkänslighet eller allergiska reaktioner (som kan inkludera angioödem, svidande och stickande känsla vid infusionsstället, frossa, värmevallningar, generaliserad urtikaria, huvudvärk, nässelutslag, hypotoni, lipotymi/sjukdomskänsla letargi, illamående, rastlöshet, takykardi, tryck över bröstet, stickningar, kräkning, pipande andning) har sällan observerats, och kan i vissa fall utvecklas till allvarlig anafylaxi (inklusive chock).
Patienter med von Willebrands sjukdom, i synnerhet typ 3-patienter, kan i mycket sällsynta fall utveckla neutraliserande antikroppar (inhibitorer) mot von Willebrand-faktorn. Om sådana inhibitorer uppstår kommer tillståndet att manifesteras som ett otillräckligt kliniskt svar. Sådana antikroppar kan förekomma i nära samband med anafylaktiska reaktioner. Därför bör patienter som får anafylaktiska reaktioner utvärderas avseende förekomst av en inhibitor.
I alla sådana fall rekommenderas att en specialiserad hemofiliklinik kontaktas.
Wilfactin är en von Willebrand-faktorprodukt med lågt FVIII-innehåll. Det finns trots allt en risk för uppkomst av tromboemboliska händelser, särskilt hos patienter med kända kliniska eller laboratoriemässiga riskfaktorer. Riskpatienter måst därför övervakas.
För säkerhetsinformation avseende överförbara agens, se avsnitt Varningar och försiktighet.
Pediatrisk population
Wilfactin bedömdes hos 56 patienter under 18 år varav 23 var yngre än 6 år, 21 var mellan 6 och 11 år och 12 var äldre än 11 år.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Inga symtom på överdosering med von Willebrand-faktor har rapporterats.
Tromboembolier kan uppkomma i fall av stora överdoser.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp:
Hemostatika: von koagulationsfaktorer, human Willebrand-faktor
ATC-kod: B02BD10
Verkningsmekanism
Wilfactin verkar på samma sätt som endogen von Willebrand-faktor.
Administrering av von Willebrand-faktor möjliggör korrigering på två nivåer av de onormala hemostasfunktionerna hos patienter med brist på von Willebrand-faktor (von Willebrands sjukdom).
- von Willebrand-faktorn återställer trombocyternas adhesion vid det vaskulära subendotelet vid platsen för kärlskadan (eftersom det binds både till det vaskulära subendotelet och till trombocytmembranet) vilket ger primär hemostas, visat genom förkortad blödningstid. Denna effekt inträffar omedelbart och man vet att den till stora delar beror på den aktiva substansens nivå av multimerer.
- von Willebrand-faktor ger en fördröjd korrigering av den associerade bristen på faktor VIII. Vid intravenös administrering binds von Willebrand-faktorn till endogen faktor VIII (vilken produceras normalt av patienten) och snabb nedbrytning av faktorn undviks genom att den stabiliseras. På grund av detta återställer administreringen av ren von Willebrand-faktor (VWF-produkt med en låg FVIII-nivå) FVIII:C-nivån till den normala som en sekundär effekt efter den första infusionen. Administrering av en VWF-produkt som innehåller FVIII:C återställer FVIII:C-nivån till den normala omedelbart efter den första infusionen.
Farmakokinetiska egenskaper
En farmakokinetisk studie med Wilfactin utfördes på 8 vuxna patienter med von Willebrands sjukdom typ 3. Studien visade följande för VWF:RCo:
- Genomsnittlig AUC0-∞ är 3 444 IE*timme/dl efter engångsdos på 100 IE/kg Wilfactin.
- Genomsnittlig recovery är 2,1 [IE/dl]/[IE/kg] av den injicerade produkten.
- Halveringstiden är mellan 8 och 14 timmar med ett genomsnittligt värde på 12 timmar.
- Genomsnittlig clearance är 3,0 ml/timme/kg.
Maximal nivå av von Willebrand-faktor i plasma uppnås vanligtvis inom 30 minuter till 1 timme efter injektion.
Normaliseringen av FVIII-nivån är progressiv, varierar och tar vanligtvis mellan 6 och 12 timmar. Denna effekt kvarstår under 2 till 3 dagar.
Höjningen av FVIII-nivån är progressiv och återgår till det normala efter 6 till 12 timmar. FVIII-nivån höjs med i genomsnitt 6 % (IE/dl) per timme. Även hos patienter med en inledande FVIII:C-nivå som är lägre än 5 % (IE/dl) stiger FVIII:C-nivån till omkring 40 % (IE/dl) 6 timmar efter injektionen, och denna nivå upprätthålls i 24 timmar.
Pediatriska data
Fullständig farmakokinetisk profil (Cmax, Tmax, AUC, clearance, halveringstid och genomsnittlig uppehållstid) efter injektion av Wilfactin karakteriseras inte i den pediatriska populationen < 18 år.
Hos 7 barn yngre än 6 år (2 i åldern 28 dagar till 23 månader och 5 i åldern 24 månader till 6 år) med svår von Willebrands sjukdom (5 med typ 3, 1 med typ 1 och 1 med typ 2) observerades ett genomsnittligt ökande utbyte för VWF:RCo på 1,75 ± 0,35 (IE/dl)/(IE/kg) efter en genomsnittlig infusion på 101,1 ± 5,0 IE/kg 15 minuter efter infusion, med en stor variation mellan individer (intervall från 1,14 till 2,03). Endast fyra av dessa barn hade både utvärderingsbara inledande kontrollutbytestester och kontrollutbytestester 6 månader efter exponering under 3 till 9 behandlingsdagar. Den observerade genomsnittliga utbyteskvoten var 0,87 ± 0,12 (IE/dl)/(IE/kg) (intervall från 0,7 till 1,0).
Prekliniska säkerhetsuppgifter
Med utgångspunkt från uppgifter som har erhållits från flera prekliniska studier med användning av djurmodeller saknas evidens för andra toxiska effekter av Wilfactin än de som har samband med immunogeniciteten för humana proteiner hos laboratoriedjur. Upprepade tester av dostoxicitet är omöjliga på grund av utvecklingen av antikroppar mot heterologa protein i djurmodeller.
De prekliniska säkerhetsuppgifterna tyder inte på att Wilfactin skulle ha någon mutagen potential.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Pulver:
humant albumin
argininhydroklorid
glycin
natriumcitrat
kalciumklorid
Spädningsvätska:
vatten för injektionsvätskor
Inkompatibiliteter
Wilfactin får inte blandas med andra läkemedel i samma spruta förutom ”plasmautvunnet koagulations-faktor-VIII producerat av LFB-BIOMEDICAMENTS”, med vilket en kompatibilitetsstudie har utförts. Denna FVIII-koagulationsfaktor finns dock inte på marknaden i alla länder.
Endast licensierade polypropeninjektionsset bör användas, eftersom behandlingssvikt kan uppkomma som en följd av att human von Willebrand-faktor adsorberas på insidan av viss injektionsutrustning.
Hållbarhet
3 år.
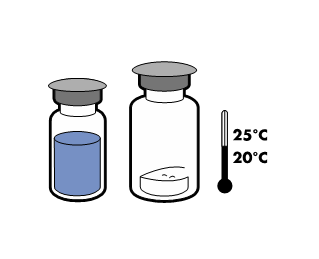
Det har visats att den bruksfärdiga produkten är kemiskt och fysikaliskt stabil i 24 timmar vid 25 °C.
Ur mikrobiologisk synpunkt bör produkten användas omedelbart.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C. Förvaras i originalförpackningen. Ljuskänsligt.
Får ej frysas.
Förvaringsanvisningar efter beredning av läkemedlet, se avsnitt Hållbarhet.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
WILFACTIN injektiokuiva-aine ja liuotin, liuosta varten
100 IU/ml (L:ei) 1000 IU + 10 ml (996,85 €)
PF-selosteen tieto
Pulver i en injektionsflaska (typ I-glas) med en propp (brombutyl) och ett skyddande lock + 5 ml spädningsvätska i en injektionsflaska (typ I- eller typ II-glas) med en propp (brombutyl eller klorbutyl) och ett skyddande lock med ett överföringssystem – Förpackningsstorlek om 1.
Pulver i en injektionsflaska (typ I-glas) med en propp (brombutyl) och ett skyddande lock + 10 ml spädningsvätska i en injektionsflaska (typ I- eller typ II-glas) med en propp (brombutyl) och ett skyddande lock med ett överföringssystem – Förpackningsstorlek om 1.
Pulver i en injektionsflaska (typ I-glas) med en propp (brombutyl) och ett skyddande lock + 20 ml spädningsvätska i en injektionsflaska (typ I- eller typ II-glas) med en propp (brombutyl eller klorbutyl) och ett skyddande lock med ett överföringssystem – Förpackningsstorlek om 1.
Läkemedlets utseende:
Pulver: Vitt eller ljusgul pulver eller sprött fast ämne.
Vätska: Klar och färglös.
Särskilda anvisningar för destruktion och övrig hantering
Beredning
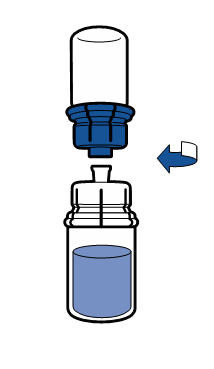
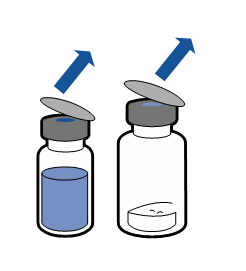
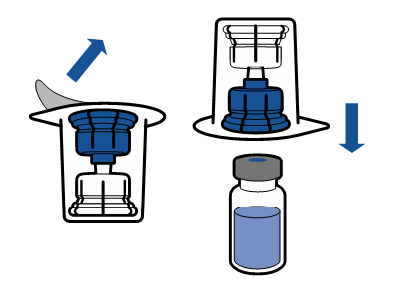
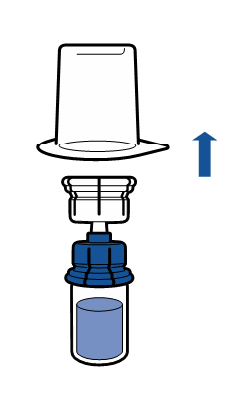
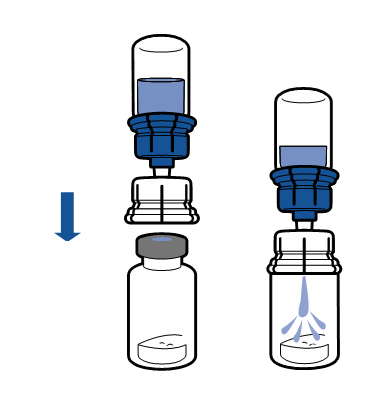
De gällande riktlinjerna för aseptiska procedurer måste följas. Överföringsanordningen (Mix2Vial) används endast för att bereda läkemedlet enligt nedanstående beskrivning. Den är inte avsedd för att administrera läkemedlet till patienten.
 |
|
 |
|
 |
|
 |
|
 |
|
|
|
Vanligtvis löses pulvret upp omedelbart och det bör vara upplöst inom mindre än 5 minuter.
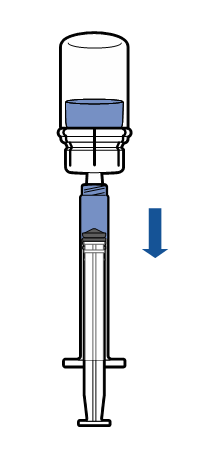
Administrering
 |
|
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Den färdigberedda produkten ska inspekteras visuellt med avseende på partiklar och missfärgning före administrering. Lösningen ska vara klar eller svagt opalskimrande, färglös eller svagt gulaktig. Använd inte lösning som är grumlig eller har utfällningar.
Ersättning
WILFACTIN injektiokuiva-aine ja liuotin, liuosta varten
100 IU/ml 1000 IU + 10 ml
- Ylempi erityiskorvaus (100 %). Von Willebrand -tekijävalmiste ja vonikogi alfa: Kroonisten hyytymishäiriöiden hoito erityisin edellytyksin (161).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Von Willebrand -tekijävalmiste ja vonikogi alfa: von Willebrandin taudin hoito erityisin edellytyksin (357).
Atc-kod
B02BD10
Datum för översyn av produktresumén
19.01.2024
Yhteystiedot
 PROTHYA BIOSOLUTIONS FINLAND OY
PROTHYA BIOSOLUTIONS FINLAND OY Lars Sonckin kaari 14
02600 Espoo
09 6120 9122
www.prothya.com
info@prothya.fi