HEINIX filmdragerad tablett 10 mg
Kvalitativ och kvantitativ sammansättning
En filmdragerad tablett innehåller 10 mg cetirizindihydroklorid.
Hjälpämne med känd effekt: en filmdragerad tablett innehåller 66,4 mg laktosmonohydrat.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Filmdragerad tablett
Kliniska uppgifter
Terapeutiska indikationer
Vuxna och barn från 6 år:
- cetirizin är indicerat för lindring av nasala symtom och ögonsymtom på säsongsbunden och perenn allergisk rinit.
- cetirizin är indicerat för behandling av symtom på kronisk idiopatisk urtikaria.
Dosering och administreringssätt
Dosering
Vuxna: 10 mg en gång dagligen (1 tablett).
Särskilda patientgrupper
Äldre
Data indikerar att minskning av dosen inte är nödvändig för äldre med normal njurfunktion.
Patienter med måttligt eller svårt nedsatt njurfunktion
Det finns inga data för att dokumentera effekt-/säkerhetsförhållandet hos patienter med nedsatt njurfunktion. Eftersom cetirizin huvudsakligen utsöndras via njurarna (se avsnitt Farmakokinetiska egenskaper), ska doseringsintervallen justeras individuellt med hänsyn till njurfunktion i de fall där ingen alternativ behandling kan ges. Justera dosen i enlighet med tabellen nedan. För att använda doseringstabellen behövs en beräkning av patientens kreatininclearance (CLcr) i ml/min. CLcr (ml/min) kan beräknas från serumkreatinin (mg/dl) med hjälp av följande formel:
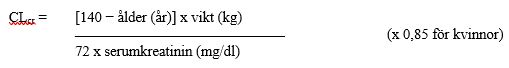
Dosjustering för vuxna patienter med nedsatt njurfunktion
Patientgrupp | Kreatininclearance (ml/min) | Dos och frekvens |
Normal | ≥ 80 | 10 mg en gång dagligen |
Lätt | 50–79 | 10 mg en gång dagligen |
Måttligt | 30–49 | 5 mg en gång dagligen |
Svårt | ≤ 30 | 5 mg varannan dag |
Njursjukdom i slutstadiet eller patienter som genomgår dialys | ≤ 10 | Kontraindicerat |
Patienter med nedsatt leverfunktion:
Dosjustering behövs inte för patienter med enbart nedsatt leverfunktion.
Patienter med nedsättning av både lever- och njurfunktion:
Dosjustering rekommenderas (se ”Patienter med måttligt eller svårt nedsatt njurfunktion” ovan).
Pediatrisk population
Tabletterna ska inte användas till barn under 6 år eftersom denna formulering inte är anpassad för nödvändig dosjustering.
Barn 6–12 år: 5 mg (en halv tablett) två gånger dagligen.
Ungdomar över 12 år: 10 mg (1 tablett) en gång dagligen.
För barn med nedsatt njurfunktion justeras dosen individuellt med hänsyn till patientens renala clearance, ålder och kroppsvikt.
Administreringssätt
Tabletterna sväljs med ett glas vatten.
Kontraindikationer
Överkänslighet mot den aktiva substansen, hydroxizin, något piperazinderivat eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Patienter med svårt nedsatt njurfunktion med kreatininclearance mindre än 10 ml/min.
Varningar och försiktighet
Vid terapeutiska doser har inga kliniskt signifikanta interaktioner visats med alkohol (blodalkoholnivå 0,5 g/l). Försiktighet rekommenderas ändå vid samtidigt intag av alkohol.
Försiktighet ska iakttas hos patienter med predisponerande faktorer för urinretention (t.ex. ryggmärgsskada, prostatahyperplasi) eftersom cetirizin kan öka risken för urinretention.
Försiktighet rekommenderas hos patienter med epilepsi eller risk för konvulsioner.
Allergitester på hud kan inte utföras under behandling med antihistaminer och därför krävs ett behandlingsuppehåll (3 dygn) för att läkemedlet ska elimineras ur kroppen innan testen utförs.
Klåda och/eller urtikaria kan uppstå när cetirizinbehandling avslutas, även om dessa symtom inte var närvarande före behandlingsstart. I vissa fall kan symtomen vara kraftiga och kräva att behandlingen återstartas. Då borde symptomen försvinna.
Pediatrisk population
De filmdragerade tabletterna rekommenderas inte till barn under 6 år eftersom denna formulering inte är anpassad för nödvändig dosjustering. För patienter i denna ålder rekommenderas en cetirizinprodukt som är avsedd för barn.
Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Interaktioner
På grund av cetirizins profil beträffande farmakokinetik, farmakodynamik och tolerans förväntas inga interaktioner med denna antihistamin. Faktiskt har varken farmakodynamiska eller signifikanta farmakokinetiska interaktioner rapporterats i läkemedelsinteraktionsstudier, i synnerhet inte med pseudoefedrin eller teofyllin (400 mg/dag).
Graden av absorption av cetirizin minskas inte av mat även om absorptionshastigheten minskas.
Hos känsliga patienter kan ett samtidigt alkoholintag eller intag av andra CNS-dämpande medel orsaka ytterligare nedsättning av uppmärksamhet och prestationsförmåga, trots att cetirizin inte stärker effekten av alkohol (blodalkoholnivån 0,5 g/l).
Fertilitet, graviditet och amning
Graviditet
Prospektivt insamlade data om resultat från graviditeter tyder inte på att cetirizin orsakar någon ökning av toxiciteten hos mödrar eller foster/embryon jämfört med bakgrundsincidensen.
Prekliniska studier har inte visat direkta eller indirekta skadliga effekter med avseende på dräktighet, embryo- eller fosterutveckling, förlossning eller postnatal utveckling. Försiktighet ska ändå iakttagas vid ordination av läkemedlet till gravida kvinnor.
Amning
Cetirizin utsöndras i bröstmjölk i koncentrationer som är 0,25–0,90-faldiga jämfört med de koncentrationer som uppmätts i plasma, beroende på tiden mellan administrering och provtagning. På grund av detta ska försiktighet iakttas vid ordination av cetirizin till ammande kvinnor.
Fertilitet
Data gällande påverkan på fertiliteten hos människa är begränsade, men inga säkerhetsproblem har identifierats.
Prekliniska data tyder inte på säkerhetsproblem vid mänsklig reproduktion.
Effekter på förmågan att framföra fordon och använda maskiner
Objektiva mätningar av körförmåga, sömnlatens och monteringsprestation har inte visat några kliniskt relevanta effekter vid rekommenderad dos på 10 mg. Om sömnighet ändå uppstår ska patienten inte framföra fordon, delta i potentiellt farliga aktiviteter eller använda maskiner. Den rekommenderade dosen får inte överskridas och patientens respons på läkemedlet ska beaktas.
Biverkningar
Kliniska studier
Sammanfattning
Kliniska studier har visat att cetirizin vid rekommenderad dos har små oönskade effekter på CNS, inklusive dåsighet, trötthet, yrsel och huvudvärk. I vissa fall har paradoxal CNS-stimulering rapporterats.
Även om cetirizin är en selektiv antagonist till perifera H1-receptorer och är relativt fritt från antikolinerg aktivitet, har enstaka fall av urineringssvårigheter, ackommodationsstörningar i ögonen och muntorrhet rapporterats.
Onormal leverfunktion med förhöjda leverenzymer och förhöjt bilirubin har rapporterats. Detta upphör oftast vid avbrytande av behandlingen med cetirizindihydroklorid.
Lista över biverkningar
Dubbelblinda kontrollerade kliniska prövningar som jämfört cetirizin (10 mg dagligen) med placebo eller andra antihistaminer vid rekommenderad dos för vilka rikligt med säkerhetsdata finns tillgängliga, inkluderade mer än 3200 personer som exponerats för cetirizin. Baserat på poolade data från dessa placebokontrollerade prövningar rapporterades följande biverkningar med frekvenser på 1,0 % eller mer hos patienter som fick 10 mg cetirizin:
Biverkningar (WHO-ART) | Cetirizin 10 mg (n=3260) | Placebo (n=3061) |
| Allmänna symtom och/eller symtom vid administreringsstället | ||
| Trötthet | 1,63 % | 0,95 % |
| Centrala och perifera nervsystemet | ||
| Yrsel | 1,10 % | 0,98 % |
Huvudvärk | 7,42 % | 8,07 % |
| Magtarmkanalen | ||
Buksmärta | 0,98 % | 1,08 % |
| Muntorrhet | 2,09 % | 0,82 % |
| Illamående | 1,07 % | 1,14 % |
| Psykiska störningar | ||
Sömnighet | 9,63 % | 5,00 % |
| Andningsvägar, bröstkorg och mediastinum | ||
Faryngit | 1,29 % | 1,34 % |
Sömnighet, som visserligen förekom statistiskt sett oftare i cetirizingruppen än placebogruppen, var mild till måttlig i de flesta fallen. Objektiva tester i andra studier har visat att normala dagliga aktiviteter inte påverkas av den rekommenderade dagliga dosen hos friska, unga försökspersoner.
Pediatrisk population
Biverkningar med frekvenser på 1 % eller mer hos barn i åldern 6 månader till 12 år, som deltagit i placebokontrollerade kliniska prövningar, är:
Biverkning (WHO-ART) | Cetirizin (n=1656) | Placebo (n=1294) |
| Magtarmkanalen | ||
Diarré | 1,0 % | 0,6 % |
| Psykiska störningar | ||
Sömnighet | 1,8 % | 1,4 % |
| Andningsvägar, bröstkorg och mediastinum | ||
Rinit | 1,4 % | 1,1 % |
| Allmänna symtom och/eller symtom vid administreringsstället | ||
Trötthet | 1,0 % | 0,3 % |
Biverkningar som observerats efter marknadsintroduktion
Utöver de biverkningar som rapporterats i kliniska prövningar och som angetts ovan har följande biverkningar rapporterats efter marknadsintroduktion.
Biverkningarna anges enligt MedDRA-organsystem och uppskattning av frekvens baserar sig på erfarenhet efter marknadsföring.
Frekvensen definieras enligt följande: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Blodet och lymfsystemet:
mycket sällsynta: trombocytopeni
Immunsystemet:
sällsynta: överkänslighet
mycket sällsynta: anafylaktisk chock
Metabolism och nutrition:
ingen känd frekvens: ökad aptit
Psykiska störningar:
mindre vanliga: agitation
sällsynta: aggression, konfusion, depression, hallucinationer, insomni
mycket sällsynta: tics
ingen känd frekvens: självmordstankar, mardrömmar
Centrala och perifera nervsystemet:
mindre vanliga: parestesi
sällsynta: konvulsioner
mycket sällsynta: dysgeusi, synkope, tremor, dystoni, dyskinesi
ingen känd frekvens: amnesi, försämrat minne
Ögon:
mycket sällsynta: ackommodationsstörningar, dimsyn, cirkelformade ögonrörelser
Öron och balansorgan:
ingen känd frekvens: yrsel
Hjärtat
sällsynta: takykardi
Magtarmkanalen:
mindre vanliga: diarré
Lever och gallvägar:
sällsynta: onormal leverfunktion (ökade transaminaser, alkaliskt fosfatas, gammaglutamyltransferas och bilirubin)
Hud och subkutan vävnad:
mindre vanliga: klåda, utslag
sällsynta: urtikaria
mycket sällsynta: angioneurotiskt ödem, fixt läkemedelsutslag (erythema fixum)
ingen känd frekvens: akut generaliserad exantematös pustulos
Muskuloskeletala systemet och bindväv:
ingen känd frekvens: ledsmärta
Njurar och urinvägar:
mycket sällsynta: dysuri, enures
ingen känd frekvens: urinretention
Allmänna symtom och/eller symtom vid administreringsstället:
mindre vanliga: asteni, sjukdomskänsla
sällsynta: ödem
Undersökningar:
sällsynta: viktökning
Beskrivning av utvalda biverkningar
Efter avslutad cetirizinbehandling har kraftig klåda och/eller urtikaria rapporterats.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Symtom
Symtom som observerats efter en överdos av cetirizin är huvudsakligen kopplade till CNS-effekter eller med effekter som tyder på en antikolinerg effekt.
Biverkningar som observerats efter intag av minst fem gånger rekommenderad dygnsdos är konfusion, diarré, yrsel, trötthet, huvudvärk, sjukdomskänsla, mydriasis, klåda, rastlöshet, dåsighet, sömnighet, stupor, takykardi, tremor och urinretention.
Behandling
Det finns inget känt motgift mot cetirizin.
Vid överdos rekommenderas symtomatisk eller understödjande behandling. Ventrikeltömning kan övervägas om intaget skett nyligen.
Cetirizin elimineras inte effektivt vid dialys.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Antihistaminer för systemiskt bruk, piperazinderivat, ATC-kod: R06A E07.
Verkningsmekanism
Cetirizin, en metabolit av hydroxizin, är en potent och selektiv antagonist till perifera H1-receptorer. Receptorbindningsstudier in vitro har inte visat någon mätbar affinitet till annat än H1-receptorer.
Farmakodynamisk effekt
Cetirizin har utöver den H1-receptorblockerande effekten även visat allergilindrande effekter: 10 mg cetirizin en eller två gånger dagligen hämmar senfasrekryteringen av eosinofiler i huden och ögats bindhinna hos atopiska patienter utsatta för allergener.
Klinisk effekt och säkerhet
Studier på friska försökspersoner visar att cetirizin vid doser om 5 och 10 mg kraftigt hämmar kvaddelbildning och hudrodnad inducerad av mycket höga histaminkoncentrationer i huden men sambandet med effekt är inte säkerställt.
I en sex veckor lång placebokontrollerad studie på 186 patienter med allergisk rinit och samtidig mild till måttlig astma, förbättrade cetirizin 10 mg en gång dagligen rinitsymtomen utan förändring av lungfunktionen. Resultaten från denna studie stödjer säkerheten vid administrering av cetirizin till patienter med allergi och mild till måttlig astma.
I en placebokontrollerad studie orsakade cetirizin, som gavs i en hög daglig dos om 60 mg i sju dagar, ingen statistiskt signifikant ökning av QT-intervallet.
Vid rekommenderad dosering har cetirizin påvisats förbättra livskvaliteten för patienter med perenn och säsongsbunden allergisk rinit.
Pediatrisk population
I en 35 dagars studie på barn i åldern 5-12 år observerades ingen tolerans för cetirizins antihistamineffekt (dämpning av kvaddelbildning och hudrodnad). När behandling med cetirizin avslutas efter upprepad dosering, återfår huden sin normala histaminreaktivitet inom tre dagar.
Farmakokinetiska egenskaper
Absorption
Plasmakoncentration vid steady-state är ca 300 ng/ml och uppnås inom 1,0 ± 0,5 timmar. Distributionen av farmakokinetiska parametrar som maximal plasmakoncentration (Cmax) och AUC är unimodal hos friska försökspersoner.
Absorptionen av cetirizin minskar inte med mat även om absorptionshastigheten minskar. Biotillgängligheten är liknande vid administrering av cetirizin som lösningar, kapslar eller tabletter.
Distribution
Den skenbara distributionsvolymen är 0,50 l/kg. Plasmaproteinbindningen av cetirizin är 93 ± 0,3 %.
Cetirizin ändrar inte proteinbindningen av warfarin.
Metabolism
Cetirizin genomgår ingen större förstapassagemetabolism.
Eliminering
Den terminala halveringstiden är ungefär 10 timmar och ingen ackumulering har observerats för cetirizin vid administrering av 10 mg/dygn i tio dagar. Omkring två tredjedelar av dosen utsöndras oförändrad i urin.
Linjäritet/icke-linjäritet
Cetirizin visar linjär kinetik i intervallet 5–60 mg.
Särskilda patientgrupper
Äldre: Efter en enstaka oral dos om 10 mg ökade halveringstiden med 50 % och clearance minskade med 40 % hos 16 äldre försökspersoner jämfört med övriga försökspersoner. Minskningen i cetirizinclearance hos dessa äldre försökspersoner verkade ha samband med nedsatt njurfunktion.
Pediatrisk population: Halveringstiden för cetirizin var omkring 6 timmar hos barn i åldern 6–12 år och 5 timmar hos barn i åldern 2–6 år. Halveringstiden var 3,1 timmar hos spädbarn och småbarn i åldern 6 månader–2 år.
Patienter med nedsatt njurfunktion: Farmakokinetiken för läkemedlet var liknande hos patienter med lätt nedsättning av njurfunktionen (kreatininclearance > 40 ml/min) och friska försökspersoner. Patienter med måttligt nedsatt njurfunktion hade en trefaldig ökning av halveringstiden och 70 % minskning av clearance jämfört med friska försökspersoner.
Patienter som genomgår hemodialys (kreatininclearance < 7 ml/min) som gavs en enstaka oral dos om 10 mg cetirizin hade en trefaldig ökning av halveringstiden och 70 % minskning av clearance jämfört med friska försökspersoner. Cetirizin elimineras dåligt vid hemodialys. Dosjustering är nödvändig hos patienter med måttligt eller svårt nedsatt njurfunktion (se avsnitt Dosering och administreringssätt).
Patienter med nedsatt leverfunktion: Patienter med kronisk leversjukdom (hepatocellulär, kolestatisk och biliär cirros) som gavs 10 eller 20 mg cetirizin som en enstaka dos hade 50 % ökad halveringstid tillsammans med 40 % minskning i clearance jämfört med friska försökspersoner. Dosjustering är endast nödvändigt hos patienter med nedsatt leverfunktion om nedsatt njurfunktion förekommer samtidigt.
Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet, karcinogenicitet och reproduktionseffekter visade inte några särskilda risker för människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Tablettkärna:
laktosmonohydrat
mikrokristallin cellulosa
kroskarmellosnatrium
vattenfri kolloidal kiseldioxid
magnesiumstearat
Filmdragering:
hypromellos 5cP (E 464)
titandioxid (E 171)
makrogol 400
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
HEINIX tabletti, kalvopäällysteinen
10 mg (J) (L:kyllä) 30 fol (4,80 €), 100 fol (5,60 €)
Itsehoito
HEINIX tabletti, kalvopäällysteinen
10 mg (J) (L:kyllä) 10 fol (4,59 €), 30 fol (9,15 €), 100 fol (18,50 €)
PF-selosteen tieto
PVC/PVDC/aluminium-blisterförpackning.
Förpackningsstorlekar: 7, 10, 30 och 100 filmdragerade tabletter.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vit eller nästan vit, rund, bikonvex filmdragerad tablett med brytskåra på ena sidan.
Tabletten kan delas i två lika stora doser.
Särskilda anvisningar för destruktion och övrig hantering
Inga särskilda anvisningar.
Ersättning
HEINIX tabletti, kalvopäällysteinen
10 mg 30 fol, 100 fol
- Peruskorvaus (40 %).
HEINIX tabletti, kalvopäällysteinen
10 mg 10 fol, 30 fol, 100 fol
- Ei korvausta.
Atc-kod
R06AE07
Datum för översyn av produktresumén
27.06.2022
Yhteystiedot
Äyritie 8 C, PL 164
01511 Vantaa
09 279 8020
www.verman.fi
etunimi.sukunimi@verman.fi
