FRAGMIN injektionsvätska, lösning 12500 IU/ml, 25000 IU/ml
Kvalitativ och kvantitativ sammansättning
12 500 IU anti-Xa/ml
1 ml injektionsvätska, lösning innehåller 12 500 IU dalteparinnatrium.
0,2 ml endosspruta: 0,2 ml injektionsvätska, lösning innehåller 2 500 IU dalteparinnatrium.
25 000 IU anti-Xa/ml
1 ml injektionsvätska, lösning innehåller 25 000 IU dalteparinnatrium.
0,2 ml endosspruta: 0,2 ml injektionsvätska, lösning innehåller 5 000 IU dalteparinnatrium.
0,3 ml endosspruta: 0,3 ml injektionsvätska, lösning innehåller 7 500 IU dalteparinnatrium.
0,4 ml endosspruta: 0,4 ml injektionsvätska, lösning innehåller 10 000 IU dalteparinnatrium.
0,5 ml endosspruta: 0,5 ml injektionsvätska, lösning innehåller 12 500 IU dalteparinnatrium.
0,6 ml endosspruta: 0,6 ml injektionsvätska, lösning innehåller 15 000 IU dalteparinnatrium.
0,72 ml endosspruta: 0,72 ml injektionsvätska, lösning innehåller 18 000 IU dalteparinnatrium.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
- Trombosprofylax vid kirurgi.
- Trombosprofylax till patienter med begränsad rörlighet på grund av akut sjukdom.
- Behandling av symtomatisk venös tromboemboli och långvarig förebyggande behandling av återfall av den hos cancerpatienter.
- Behandling av akut djup ventrombos och lungemboli.
- Instabil kranskärlssjukdom såsom instabil angina pectoris och icke Q-vågsinfarkt.
Pediatrisk population
Behandling av symtomatisk venös tromboembolism (VTE) hos pediatriska patienter från 1 månads ålder och äldre.
Dosering och administreringssätt
Trombosprofylax vid kirurgi
Dalteparininjektion ges subkutant (s.c.). Den antikoagulerande effekten behöver vanligtvis inte övervakas. Om effekten övervakas ska prover tas vid toppvärden (3 till 4 timmar efter s.c.-injektion). Vid de rekommenderade doserna är den maximala plasmakoncentrationen vanligtvis 0,1–0,4 IU anti-Xa/ml.
Allmän kirurgi med risk för tromboemboliska komplikationer
2 500 IU subkutant 1–2 timmar före operation och därefter 2 500 IU subkutant varje morgon tills patienten är mobiliserad, vanligtvis i minst 5–7 dygn eller längre. Hos överviktiga patienter som väger 90 kg eller mer rekommenderas Fragminprofylax i en dos på 5 000 IU en gång dagligen med ett BMI större än 25 och i en dos på 7 500 IU en gång dagligen med ett BMI större än 35 (se avsnitt Farmakodynamiska egenskaper).
Allmän kirurgi med ytterligare riskfaktorer (t.ex. cancer)
Preoperativ start kvällen före
5 000 IU subkutant natten före operationen och 5 000 IU varje natt efter operationen.
Preoperativ start på operationsdagen
Alternativt kan 2 500 IU administreras subkutant 1–2 timmar före operationen och 2 500 IU subkutant 8–12 timmar senare men inte tidigare än 4 timmar efter operationens slut. Under de följande dagarna ges 5 000 IU subkutant på morgonen.
Behandlingen fortsätter tills patienten är mobiliserad, vanligtvis i minst 5–7 dygn eller längre.
Ortopedisk kirurgi (t.ex. höftledsplastik)
Fragmin används i upp till fem veckor efter operationen enligt en av behandlingsregimerna som beskrivs nedan.
Preoperativ start - kvällen före operation
5 000 IU subkutant natten före operationen och 5 000 IU subkutant varje natt efter operationen.
Preoperativ start - operationsdagen
2 500 IU administreras subkutant inom mindre än 2 timmar före operationen och 2 500 IU subkutant 8–12 timmar senare men inte tidigare än 4 timmar efter operationens slut. Från morgonen efter operationen, 5 000 IU subkutant varje morgon.
Postoperativ start
2 500 IU subkutant 4–8 timmar efter operationen, men inte tidigare än 4 timmar efter operationens slut. Från dagen efter operationen, 5 000 IU subkutant varje dag.
Trombosprofylax till patienter med begränsad rörlighet
5 000 IU dalteparin subkutant en gång dagligen, i allmänhet under minst 12–14 dagar. Den antikoagulerande effekten behöver vanligtvis inte övervakas.
Behandling av symtomatisk venös tromboemboli hos cancerpatienter och långvarig förebyggande behandling av återfall av den
1:a månaden
200 IU/kg subkutant en gång dagligen under de första 30 behandlingsdagarna. Den maximala dagliga dosen är 18 000 IU.
Månad 2–6
Cirka 150 IU/kg subkutant en gång dagligen med endossprutor enligt tabell 1.
Tabell 1. Dos under behandlingsmånaderna 2–6.
Vikt (kg) | Dalteparindos (IU) |
≤ 56 | 7 500 |
57–68 | 10 000 |
69–82 | 12 500 |
83–98 | 15 000 |
≥ 99 | 18 000 |
Dosreduktion vid kemoterapi-inducerad trombocytopeni
Trombocytopeni
Om trombocytantalet vid kemoterapi-inducerad trombocytopeni är mindre än 50 x 109/l, ska dalteparin avbrytas tills trombocytantalet igen är större än 50 x 109/l.
Om trombocytantalet är mellan 50 x 109/l och 100 x 109/l, bör dalteparindosen minskas med 17–33 % av initial dos beroende på patientens vikt (tabell 2). När trombocytantalet åter är ≥ 100 x 109/l ges dalteparin åter som en full dos.
Tabell 2. Dalteparindosreduktion vid trombocytopeni (50 x 109–100 x 109/l)
Vikt (kg) | Dalteparindos (IU) enligt behandlingsregim | Reducerad dalteparin dos (IU) | Dos reducerad i medeltal (%) |
≤ 56 | 7 500 | 5 000 | 33 |
57–68 | 10 000 | 7 500 | 25 |
69–82 | 12 500 | 10 000 | 20 |
83–98 | 15 000 | 12 500 | 17 |
≥ 99 | 18 000 | 15 000 | 17 |
Nedsatt njurfunktion
Om patienten har kraftigt nedsatt njurfunktion (kreatininclearance < 30 ml/min) bör dalteparindosen justeras så att anti-Xa-koncentrationen upprätthålls på den terapeutiska nivån 1 IU/ml (intervall 0,5–1,5 IU/ml) mätt 4–6 timmar efter dalteparininjektionen. Om anti-Xa-nivån är under eller över den terapeutiska intervallet, bör dalteparindosen ökas eller minskas i enlighet med detta med en preparatstyrka, och anti-Xa-nivån bör mätas igen efter 3–4 nya doser. Dosen ska justeras tills terapeutisk anti-Xa nivå uppnås.
Behandling av akut djup ventrombos och lungemboli
Dalteparininjektionen administreras subkutant (s.c.) antingen en eller två gånger om dagen.
Samtidig behandling med vitamin K-antagonister kan påbörjas omedelbart under Fragmin-behandling. Kombinationsbehandlingen fortsätter på behandlingsenheten tills de använda metoderna har visat att nivåerna av protrombinkomplexfaktorer (F II, VII, IX och X) har sjunkit till terapeutisk nivå av vitamin K-antagonister. Fragminbehandling ges vanligtvis i minst 5 dagar.
Subkutan injektion
Den rekommenderade dosen är 200 IU/kg en gång dagligen. Den antikoagulerande effekten behöver vanligtvis inte övervakas.
Tabell 3. Dos vid behandling av akut djup ventrombos eller lungemboli
Vikt (kg) | Dos | Endosspruta 25 000 IU/ml |
46–56 57–68 69–82 83– > 90 se mer information nedan | 10 000 IU 12 500 IU 15 000 IU 18 000 IU | 0,4 ml 0,5 ml 0,6 ml 0,72 ml |
Fragmin förfyllda sprutor finns tillgängliga i en sprutstorlek som är lämplig för patientvikt upp till 90 kg. För patienter som väger mer än 90 kg bör en kombination av förfyllda sprutor användas anpassat till den totala dos som behövs.
Vid behandling av venös trombos och lungemboli finns det begränsad erfarenhet av warfarinöverbryggning med doser på 200 IU/kg för överviktiga patienter med normal njurfunktion upp till en vikt på 190 kg. Studiedata för patienter som väger mer än 190 kg saknas (se avsnitt Farmakodynamiska egenskaper).
Ökad risk för blödning
Patienter med ökad risk för blödning kan ges 100 IU/kg var 12:e timme.
Övervakning av patienten är vanligtvis inte nödvändig, men övervakning bör övervägas i vissa speciella populationer (se avsnitt Varningar och försiktighet). Maximala plasmakoncentrationer uppnås 3–4 timmar efter subkutan injektion, då prover bör tas. Den rekommenderade maximala plasmakoncentrationen är 0,5–1,0 IU/ml.
Instabil kranskärlssjukdom såsom instabil angina pectoris och icke Q-vågsinfarkt
120 IU/kg administreras subkutant två gånger dagligen. Den maximala dosen är 10 000 IU/12 timmar. Samtidig behandling med låga doser acetylsalicylsyra rekommenderas såvida det inte är specifikt kontraindicerat hos patienten. I kliniska prövningar varierade dosen från 75–325 mg/dag enligt lokala behandlingsregimer.
Behandlingen fortsätter tills patienten är kliniskt stabil. Vanligtvis i minst 6 dagar eller längre om läkaren anser det gynnsamt.
Det rekommenderas att behandlingen fortsätter tills det invasiva förfarandet (PCI eller CABG), vilket kan schemaläggas som brådskande, tidigt eller konservativt, beroende på patientens tillstånd. Behandlingstiden bör inte överstiga 45 dagar.
Dosen bestäms av kön och vikt enligt följande:
Kvinnor < 80 kg och män < 70 kg: 5 000 IU subkutant var 12:e timme
Kvinnor ≥ 80 kg och män ≥ 70 kg: 7 500 IU subkutant var 12:e timme
Den antikoagulerande effekten behöver vanligtvis inte övervakas, men bör övervägas för vissa speciella populationer (se nästa avsnitt och avsnitt Varningar och försiktighet). Maximala plasmakoncentrationer uppnås 3–4 timmar efter subkutan injektion, då prover bör tas. Den rekommenderade maximala plasmakoncentrationen är 0,5–1,0 IU anti-Xa/ml.
Särskilda grupper
Pediatrisk population
Behandling av symtomatisk venös tromboembolism (VTE) hos pediatriska patienter från 1 månads ålder och äldre.
Behandling av symtomatisk venös tromboembolism hos pediatriska patienter
Den rekommenderade startdosen beroende på pediatrisk ålder anges i tabellen nedan.
Tabell 4. Startdoser för pediatriska patienter med symtomatisk VTE | |
Åldersgrupp | Startdos |
1 månad till yngre än 2 år | 150 IU/kg två gånger dagligen |
2 år till yngre än 8 år | 125 IU/kg två gånger dagligen |
8 år till yngre än 18 år | 100 IU/kg två gånger dagligen |
Fragmin är kompatibelt med infusionslösningar med natriumklorid (9 mg/ml) eller glukos (50 mg/ml) i glasflaskor och plastbehållare (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Övervakning av anti-Xa-nivåer hos barn
Efter att Fragmin har satts in ska anti-Xa-nivån initialt mätas efter den första, andra eller tredje dosen. Prover för anti-Xa-nivå ska tas 4 timmar efter administreringen.
Doser ska justeras i steg om 25 IU/kg till målnivån för anti-Xa på mellan 0,5 IU/ml och 1 IU/ml och anti-Xa-nivån ska mätas efter varje justering. Underhållsdosen ska individanpassas baserat på den dos som uppnår målnivån för anti-Xa registrerad 4 timmar efter administreringen.
Kontroll av anti-Xa-nivåer ska fortsätta till dess att en lämplig underhållsdos fastställts och fortsätta regelbundet för att bibehålla målnivån för anti-Xa. Hos mycket små barn rekommenderas att anti-Xa-nivåerna kontrolleras efter första dosen, och tätare kontroller kan behövas som guide för dosjusteringar tills målnivån för anti-Xa uppnås (se avsnitt Farmakodynamiska egenskaper och Farmakokinetiska egenskaper).
Vid låg och föränderlig fysiologisk njurfunktion, som hos nyfödda, rekommenderas noggrann kontroll av anti-Xa-nivån.
Liksom för andra antitrombotiska medel finns det risk för systemisk blödning med Fragmin. Försiktighet bör iakttas vid användning av Fragmin i höga doser till nyopererade patienter. Efter påbörjad behandling bör patienterna övervakas noggrant med avseende på blödningskomplikationer, såsom regelbundna läkarundersökningar, noggrann övervakning av operationsdränage och regelbundna hemoglobin- och anti-Xa-mätningar.
Säkerhet och effekt för dalteparinnatrium vid profylaxbehandling av VTE hos barn har inte fastställts. Tillgänglig information om profylaxbehandling av VTE finns i avsnitt Farmakodynamiska egenskaper, men ingen doseringsrekommendation kan fastställas.
Äldre
Se avsnitt Varningar och försiktighet
Nedsatt leverfunktion
Se avsnitt Varningar och försiktighet
Nedsatt njurfunktion
Patienter med gravt nedsatt njurfunktion (kreatininclearance < 30 ml/min)
I kliniska prövningar har trombotisk profylaktisk behandling med Fragmin i doser upp till 5 000 IU en gång dagligen i upp till 10 dagar hos kritiskt sjuka patienter med gravt nedsatt njurfunktion tolererats väl. Vid användning av behandlingsdoser (10 000 IU eller högre) samt då behandlingstiden överstiger 3 dagar, bör anti-Xa nivåerna kontrolleras (se avsnitt Farmakodynamiska egenskaper).
Administreringssätt
Pediatrisk population
Fragmin ges genom subkutan administrering, helst i den subkutana vävnaden i buken anterolateralt eller posterolateralt, eller på den laterala delen av låren med en vinkel på mellan 45° och 90°.
Utförliga anvisningar om administreringen av Fragmin finns i avsnitt 3 i bipacksedeln.
Kontraindikationer
Överkänslighet för den aktiva substansen eller för något av hjälpämnena listade i avsnitt Förteckning över hjälpämnen eller för andra lågmolekylära hepariner och/eller heparin, t.ex. tidigare konstaterad eller misstänkt immunologiskt medierad heparininducerad trombocytopeni (typ II).
Akut gastroduodenalt ulcus eller hjärnblödning eller annan aktiv blödning.
Svår koagulationsrubbning.
Akut eller subakut septisk endokardit.
Skador och operationer i centrala nervsystemet, öga och öra.
Epidural anestesi eller punktion av spinalkanalen och samtidig behandling med höga doser dalteparin (såsom vid behandling av akut djup venös trombos, lungemboli och instabil kranskärlssjukdom).
Varningar och försiktighet
Försiktighet bör iakttas hos patienter med trombocytopeni, trombocytfunktions-störningar, grav lever- eller njurinsufficiens, okontrollerad hypertension eller hypertensiv eller diabetisk retinopati. Försiktighet bör också iakttas vid högdosbehandling med dalteparin (krävs för behandling av t.ex. akut djup venös trombos, lungemboli och instabil kranskärlssjukdom) av nyopererade patienter och andra tillstånd med misstanke på ökad blödningsrisk.
Samtidig användning av läkemedel som påverkar hemostasen, såsom trombolytika, andra antikoagulantia, icke-steroida antiinflammatoriska läkemedel (NSAID), trombocytaggregationshämmare eller dextran kan förstärka den antikoagulerande effekten av dalteparin och rekommenderas inte. Lämplig försiktighet ska iakttas under särskilda omständigheter vid byte av antikoagulantiabehandling (se avsnitt Interaktioner).
Om en patient genomgår epidural- eller spinal anestesi eller spinalpunktion finns risk för utvecklandet av epidural- eller spinalhematom, vilket kan resultera i långvarig eller permanent förlamning. Kvarliggande epiduralkatetrar och samtidig användning av läkemedel som påverkar hemostas (såsom NSAID, trombocytaggregationshämmare och andra antikoagulantia) ökar risken för sådana händelser. Traumatiska eller upprepande epidural- eller spinalpunkteringar verkar också öka risken. Patienten ska noggrant övervakas för tecken och symtom på försämrat neurologiskt status när den får antikoaguleringsbehandling under epidural eller spinalbedövning.
Insättning eller borttagande av epidural- eller spinalkatetern bör skjutas upp i 10–12 timmar efter administration av dalteparindoser som trombosprofylax, medan vid högre terapeutiska dalteparindoser (såsom 100–120 IU/kg var 12:e timme eller 200 IU/kg en gång dagligen) ska intervallet vara minst 24 timmar.
Om läkaren, efter klinisk bedömning, beslutar att antikoagulantiabehandling krävs i samband med epidural- eller spinalanestesi, måste extrem vaksamhet iakttas och patienten måste övervakas frekvent för att upptäcka eventuella tecken och symtom på neurologisk försämring. Dessa inkluderar ryggont, sensoriska eller motoriska brister (domningar och svaghet i nedre extremiteterna) och dysfunktion av tarm eller urinblåsa. Sjukskötare bör utbildas för att upptäcka sådana tecken och symtom. Patienterna bör instrueras att omedelbart underrätta sjukskötare eller läkare om de upplever något av dessa symtom.
Om tecken eller symtom på epiduralt eller spinalt hematom misstänks, kan akut diagnostik och behandling omfatta dekompression av ryggmärgen.
Det finns inga adekvata studier för att utvärdera säker och effektiv användning av Fragmin för att förhindra klafftrombos hos patienter med prostetiska hjärtklaffar. Profylaktiska doser av Fragmin är inte tillräckligt för att förhindra klafftrombos hos dessa patienter och Fragmin kan inte rekommenderas för detta ändamål.
Vid längre tids behandling av instabil kranskärlssjukdom, (som t.ex. inför revaskularisering), bör dosreduktion övervägas vid njurfunktionsnedsättning (S-kreatinin > 150 mikromol/l.)
Trombocyter bör räknas innan dalteparinbehandling påbörjas och övervakas regelbundet under behandlingen.
Särskild försiktighet bör iakttas vid administrering av dalteparin eller andra lågmolekylära hepariner och/eller heparin till en patient med snabbt utvecklande och svår trombocytopeni (< 100 x 109/l) bekräftad med in vitro-metod på blodplättsantikroppar. Särskild försiktighet bör också iakttas när resultatet av dessa in vitro-tester är okänt.
Monitorering av den antikoagulanta effekten av dalteparin är vanligtvis inte nödvändig men ska övervägas för speciella patientgrupper såsom barn, patienter med njursvikt, patienter som är allvarligt underviktiga eller sjukligt överviktiga, patienter som väger mer än 90 kg, gravida kvinnor eller patienter med ökad risk för blödning eller retrombos.
Heparin kan hämma adrenal sekretion av aldosteron vilket leder till hyperkalemi, särskilt hos patienter med diabetes mellitus, kronisk njurinsufficiens, tidigare metabolisk acidos, förhöjt plasmakalium eller som tar kaliumsparande läkemedel. Risken för hyperkalemi tycks öka med behandlingstidens längd men är vanligtvis reversibel. Plasmakaliumvärden bör mätas hos riskpatienter innan behandling med heparin startas och kontrolleras regelbundet därefter särskilt om behandlingen är längre än ca 7 dagar.
Dalteparin förlänger endast måttligt koaguleringstiden, mätt till exempel genom aktiverad partiell tromboplastintid (APTT). Dosökning som syftar till att förlänga den aktiverade partiella tromboplastintiden (APTT) kan resultera i överdos och blödning. För laboratoriemässig övervakning av effekt rekommenderas funktionella anti-Xa metoder.
Vid kronisk hemodialys behöver dosen av dalteparin vanligtvis bara ändras några gånger, så anti-Xa-nivån behöver bara kontrolleras några gånger. Vid akut hemodialys kan patientens tillstånd vara mer instabilt och anti-Xa-nivåer bör övervakas oftare.
Den biologiska aktiviteten hos olika lågmolekylära hepariner, ofraktionerade hepariner och syntetiska polysackarider kan inte uttryckas i ett test som medger enkel dosjämförelse mellan olika preparat. Det är därför viktigt att användningsföreskrifterna för respektive produkt iakttas.
Fragmin får inte administreras intramuskulärt. På grund av risken för hematom bör intramuskulär injektion av andra läkemedel undvikas när dygnsdosen av Fragmin överstiger 5 000 IU.
Om en patient med instabil kranskärlssjukdom, såsom instabil angina pectoris och icke Q-vågsinfarkt, drabbas av hjärtinfarkt, kan trombolytisk behandling vara lämplig. Detta medför inte att Fragmin-behandlingen måste avbrytas men ökar risken för blödning.
Pediatrisk population
Anti-Xa-nivåer ska mätas när behandlingen sätts in och efter varje dosjustering (se avsnitt Dosering och administreringssätt).
Det finns inga data för barn med cerebral venös trombos och sinustrombos som har CNS-infektion. Blödningsrisken ska utvärderas noga innan och under behandling med dalteparin.
Äldre
Äldre patienter, särskilt de 80 år och äldre, kan löpa ökad risk för blödningskomplikationer vid terapeutiska doser. Noggrann klinisk övervakning rekommenderas.
Allergiska reaktioner
Nålskyddet på Fragmin förfyllda sprutor kan innehålla latex (naturgummi), vilket kan orsaka allvarliga allergiska reaktioner hos personer som är överkänsliga mot latex (naturgummi).
Hjälpämnen
Natrium
Fragmin 12 500 IU anti-Xa/ml och Fragmin 25 000 IU anti-Xa/ml endosprutar innehåller mindre än 1 mmol (23 mg) natrium per ampull, d.v.s. är näst intill ”natriumfria”. Patienter som äter natriumfattig kost och föräldrar vars barn behandlas med Fragmin kan informeras om att dessa läkemedelsformuleringar är näst intill ”natriumfria”.
Detta läkemedel kan spädas ytterligare med lösningar som innehåller natrium (se avsnitt Dosering och administreringssätt och avsnitt Särskilda anvisningar för destruktion och övrig hantering) och detta ska tas i beaktande med hänsyn till den totala mängden natrium från alla källor som administreras till patienten.
Interaktioner
Läkemedel som ökar effekterna av dalteparin
Samtidig medicinering som påverkar hemostas (t.ex. trombocytaggregationshämmare, andra antikoagulantia, acetylsalicylsyra, NSAID, glykoprotein IIb/IIIa-receptorantagonister, vitamin K-antagonister, trombolytika eller dextran) kan förstärka den antikoagulerande effekten av dalteparin (se avsnitt Varningar och försiktighet).
Särskild försiktighet bör iakttas när dalteparin administreras samtidigt med NSAID eller höga doser acetylsalicylsyra till patienter med nedsatt njurfunktion, eftersom smärtstillande doser av NSAID och acetylsalicylsyra reducerar produktionen av vasodilaterande prostaglandiner och därmed det renala blodflödet och den renala utsöndringen.
Om inte specifika kontraindikationer föreligger ska dock patienter med instabil kranskärlssjukdom, såsom instabil angina pectoris och icke Q-vågsinfarkt, behandlas med låga doser acetylsalicylsyra.
Läkemedel som antagoniserar effekterna av dalteparin
Samtidig användning av dalteparin och andexanet alfa kan minska effekten av dalteparin. Andexanet alfa, en rekombinant modifierad human koagulationsfaktor Xa som används för att reversera antikoagulering med apixaban eller rivaroxaban, har visat sig binda till heparinbundet antitrombin III (ATIII) och kan minska den antikoagulerande effekten av dalteparin.
Övriga interaktioner
Eftersom heparin har visats interagera med intravenöst nitroglycerin, höga doser penicillin, sulfinpyrazon, probenecid, etakrynsyra, cytostatika, kinidin, antihistaminer, digitalis, tetracykliner och tobaksrökning och askorbinsyra, kan interaktion med dalteparin inte uteslutas.
Fertilitet, graviditet och amning
Graviditet
Dalteparin passerar inte placentan. En stor mängd data från gravida kvinnor (fler än 1 000 exponerade utfall) visar inte på missbildningar eller feto/neonatal toxicitet. Fragmin kan användas under graviditet om kliniskt motiverat.
Det finns fler än 2 000 publicerade fall (främst fallserier och öppna studier) om administrering av dalteparin under graviditet. Jämfört med ofraktionerat heparin, rapporterades en lägre blödningstendens och minskad risk för osteoporotiska frakturer. Den största prospektiva öppna studien (”Efficacy of Thromboprophylaxis as an Intervention during Gravidity”, EThIG) inkluderade 810 gravida kvinnor och undersökte graviditetsspecifik riskklassificering (låg, hög, mycket hög risk för venös tromboembolism) och riskbaserad dosering. Dagliga doser av dalteparin varierade från 50 till 150 IU/kg (i enstaka fall upp till max 200 IU/kg). Dock finns det endast ett begränsat antal randomiserade och kontrollerade studier om användning av lågmolekylärt heparin under graviditet.
Inga teratogena eller fetotoxiska egenskaper hos dalteparin har påvisats i djurstudier (se avsnitt Prekliniska säkerhetsuppgifter).
Epidural anestesi under förlossning är absolut kontraindicerat hos kvinnor som behandlas med höga doser antikoagulantia (se avsnitt Kontraindikationer). Försiktighet bör iakttas vid behandling av patienter med en ökad risk för blödning (t.ex. kvinnor strax före, under eller strax efter förlossningen) (se avsnitt Varningar och försiktighet). Hos gravida kvinnor har halveringstider för anti-Xa på 4–5 timmar uppmätts under den sista trimestern.
Behandlingsmisslyckanden har rapporterats för gravida kvinnor med prostetiska hjärtklaffar som har fått antikoagulantia av lågmolekylärt heparin i fulldos. Fragmin har inte studerats tillräckligt för användning till gravida kvinnor med prostetiska hjärtklaffar.
Amning
Små mängder av dalteparinnatrium passerar över i bröstmjölk. Studier (15 kvinnor, tredje till femte amningsdagen, 2–3 timmar efter subkutan administrering av dalteparin) har visat att anti-Xa-halten i bröstmjölk är 2–8 % av plasma-anti-Xa. Antikoagulerande effekt på barnet är osannolik.
En risk för det ammade barnet kan inte uteslutas. Ett beslut om att fortsätta/avbryta amningen eller fortsätta/avbryta behandlingen med Fragmin bör göras med hänsyn till nyttan av amning för barnet och nyttan av Fragmin-behandling för kvinnan.
Fertilitet
Baserat på aktuella kliniska data finns det inget som tyder på att dalteparinnatrium påverkar fertiliteten. Inga effekter på fertilitet, parning eller peri- och postnatal utveckling noterades när dalteparinnatrium testades i djur.
Effekter på förmågan att framföra fordon och använda maskiner
Deltaparin har ingen effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Biverkningar förekommer hos cirka 3 % av patienterna som behandlas med profylax.
De biverkningar som rapporterats för dalteparinnatrium, är listade nedan efter klassificering av organsystem och frekvens: vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ /1 000, < 1/100), sällsynta (≥ 1/10 000, < 1 000).
Tabell 5. Möjliga biverkningar i samband med behandling med dalteparinnatrium
Organsystem | Frekvens | Biverkningar |
Blodet och lymfsystemet | Vanliga | Mild trombocytopeni (typ I), som vanligen är reversibel under behandlingen. |
Ingen känd frekvens* | Immunologiskt medierad heparin-inducerad trombocytopeni (typ II), med eller utan tillhörande trombotiska komplikationer. | |
Immunsystemet | Mindre vanliga | Överkänslighet |
Ingen känd frekvens* | Anafylaktiska reaktioner | |
Metabolism och nutrition | Vanliga | Hyperkalemi** |
Centrala och perifera nervsystemet | Ingen känd frekvens* | Intrakraniell blödning, i något fall fatal. |
Blodkärl | Vanliga | Blödning |
Magtarmkanalen | Ingen känd frekvens* | Retroperitoneala blödningar, i något fall fatal. |
Lever och gallvägar | Vanliga | Övergående transaminasstegring |
Hud och subkutan vävnad | Sällsynta | Nekros, övergående alopeci |
Ingen känd frekvens* | Utslag | |
Allmänna symtom och/eller symtom vid administreringsstället | Vanliga | Subkutant hematom vid injektionsstället, smärta vid injektionsstället |
Skador och förgiftningar | Ingen känd frekvens* | Epiduralt eller spinalt hematom |
* Frekvens kan inte beräknas från tillgängliga data.
** Heparinprodukter kan orsaka hypoaldosteronism som kan resultera i en ökning av plasmakalium. Kliniskt signifikant hyperkalemi kan uppkomma framförallt hos patienter med kronisk njursvikt och diabetes mellitus (se avsnitt Varningar och försiktighet).
Blödningsrisken är dosberoende, flertalet blödningar är lindriga. Svårare blödningar har rapporterats, i vissa fall fatala.
En risk för osteoporos har observerats i samband med långvarig behandling med heparin. Även om detta inte har observerats vid behandling med dalteparin kan risken inte helt uteslutas.
Pediatrisk population
Biverkningarnas frekvens, typ och svårighetsgrad hos barn förväntas vara desamma som hos vuxna. Säkerheten vid långvarig administrering av dalteparin har inte fastställts.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Den antikoagulerande effekten inducerad av dalteparinnatrium kan inhiberas av protamin. Ett milligram protamin blockerar anti-Xa-effekten av en 100 IU dos dalteparinnatrium, men anti-Xa-aktiviteten minskas med endast 25–50 %. Protamin har i sig själv en inhiberande effekt på den primära hemostasen och ska bara användas i nödlägen.
Farmakologiska egenskaper
Farmakologiska egenskaper
Farmakoterapeutisk grupp: Antitrombotiska läkemedel, dalteparin, ATC-kod: B01AB04
Farmakodynamiska egenskaper
Dalteparinnatrium är ett depolymeriserat heparin med låg molekylvikt med en medelmolekylvikt på 6 000 dalton (intervall 5 600 till 6 400 dalton) som erhålls från heparin från svintarm genom nedbrytning med salpetersyra och kromatografisk rening. De flesta av komponenterna har en 2-O-sulfo-alfa-L-idopyranosuronsyrastruktur vid den icke-reducerande änden av kedjan och en 6-O-sulfo-2,5-anhydro-D-mannitolstruktur vid den reducerande änden av kedjan. Graden av sulfatering är 2 till 2,5 disackaridenheter.
Produktens styrka uttrycks i International Anti-Xa Units (IU) enligt den första internationella standarden för lågmolekylärt heparin.
Den antitrombotiska effekten av dalteparinnatrium beror på dess förmåga att förstärka den hämmande effekten av antitrombin (AT III) på faktor X (faktor Xa) och trombinhämning. Dalteparinnatrium potentierar hämningen av faktor Xa relativt sett starkare än förlänger plasmakoagulationstiden (APTT). Dalteparinnatrium har en lägre effekt på trombocytfunktion och vidhäftning än heparin, så det har liten effekt på primär hemostas. Ändå antas vissa av de antitrombotiska effekterna av dalteparinnatrium bero på dess effekt på kärlväggen eller fibrinolytiska systemet.
En retrospektiv studie analyserade 135 patienter som genomgick viktminskningskirurgi, vilka fick Fragmin för trombotisk profylax i en dos av 7 500 IU dagligen. Patienterna vägde 148,8 kg (± SD 31,2 kg) och hade ett BMI ≥ 40 (eller ≥ 35 plus någon annan allvarlig sjukdom). Anti-Xa-nivåerna var på målnivån (0,2–0,5 IU/ml) hos 81 patienter (60 %), under 0,2 IU/ml hos 48 patienter (30 %) och över 0,5 IU/ml hos 13 patienter (10 %). Det fanns ett signifikant inverst förhållande mellan anti-Xa-nivåer och kroppsvikt. Tre blödningshändelser noterades.
I en prospektiv studie fick 37 överviktiga patienter med venös tromboembolism och normal njurfunktion Fragmin en dos på 200 IU/kg (baserat på verklig kroppsvikt). Under behandlingen mättes dalvärdet för anti-Xa på dag 3 och 5 under behandlingen samt toppvärdet för anti-Xa på dag 3. Den tyngsta patienten vägde 190 kg (BMI 58). Patienterna delades in i tre viktklasser: 1) inom 20 % av idealvikten, 2) 20–40 % över idealvikt och 3) mer än 40 % över idealvikten. Ingen relevant skillnad i anti-Xa nivåer mellan de olika grupperna observerades vid någon mätning. Inga tromboemboliska händelser eller blödningar drabbade någon patient under studien.
I en prospektiv multicenter kohortstudie (DIRECT) behandlades 138 kritiskt sjuka patienter med nedsatt njurfunktion (kreatininclearance 18,9 ± 6,5 ml/min) med Fragmin som profylax mot venös tromboembolism (5 000 IU en gång per dag). Medianen för behandlingslängden var 7 dagar. Dalvärdet för anti-Xa mättes 2 gånger per vecka, 20 timmar efter föregående subkutana injektion. De maximala anti-Xa-koncentrationerna som mättes under studien överensstämde med profylaktiska anti-Xa-koncentrationer (0,20–0,40 IU/ml) hos andra hospitaliserade medicin- och kirurgiska patienter.
Pediatrisk population
Behandling av symtomatisk venös tromboembolism (VTE) hos pediatriska patienter
I en öppen, klinisk multicenterstudie i fas 2 studerades 38 pediatriska patienter med objektivt diagnostiserad akut djup ventrombos (DVT) och/eller lungemboli (PE) (24 pojkar, 14 flickor) som representerade 5 ålderskohortgrupper, med cancer (N = 26) och utan cancer (N = 12). Totalt 26 patienter slutförde studien och 12 avbröt tidigare (4 på grund av biverkningar, 3 patienter drog tillbaka sitt samtycke och 5 av andra skäl). Patienterna behandlades med dalteparin två gånger dagligen i upp till 3 månader, med startdoser beroende på ålder och vikt och med en dosjusteringsökning på 25 IU/kg.
Effekten av behandlingen i fråga om regression, progression, upplösning och utebliven förändring av kvalificerande VTE bedömdes genom bilddiagnostik vid screening och vid studiens slut (EOS). När studien slutfördes hade (N = 34) 21 (61,8 %) patienter uppnått upplösning av den kvalificerande VTE:n, 7 (20,6 %) patienter uppvisade regression, 2 (5,9 %) patienter uppvisade utebliven förändring, ingen patient uppvisade progression och 4 (11,8 %) patienter bidrog inte med data till denna analys. Dessutom upplevde 1 (2,9 %) patient en ny VTE under studien. Mediandoserna av dalteparin (IU/kg) som krävdes för att uppnå en terapeutisk anti-Xa-nivå (0,5 till 1,0 IU/ml) under dosjusteringsperioden på 7 dagar presenteras i tabell 6. Terapeutiska anti-Xa-nivåer (0,5 till 1,0 IU/ml) uppnåddes inom 2,6 dagar, i genomsnitt. Blödningshändelser hos patienter som fick minst en dos av studieläkemedlet (N = 38) omfattade 1 (2,6 %) större blödningshändelse, 0 (0 %) kliniskt relevanta, ej större blödningshändelser, 16 (42,1 %) mindre blödningshändelser, och 14 (36,8 %) patienter hade inga blödningshändelser.
Tabell 6. Medianunderhållsdoser av dalteparin (IU/kg) efter dosjustering (med ökningar i steg om 25 IU/kg) kopplade till terapeutisk anti-Xa-nivå (0,5 till 1,0 IU/ml) efter ålderskohort (N = 34)
Ålderskohort | N | Mediandos (IU/kg) |
0 till yngre än 8 veckor | 0 | Inte tillämpligt |
Äldre än eller 8 veckor till yngre än 2 år | 2 | 208 |
Äldre än eller 2 år till yngre än 8 år | 8 | 128 |
Äldre än eller 8 år till yngre än 12 år | 7 | 125 |
Äldre än eller 12 år till yngre än 19 år | 17 | 117 |
I en prospektiv, randomiserad, kontrollerad klinisk multicenterstudie utvärderades längden på behandlingen av trombos hos 18 barn (0 till 21 år) som fick antikoagulantiabehandling med dalteparin två gånger dagligen, och dalteparindosen per kg som krävdes för att uppnå en anti-Xa-nivå på 0,5–1,0 IU/ml 4–6 timmar efter dosering fastställdes per åldersgrupp (förspecificerade som spädbarn < 12 månader, barn 1–< 13 år och ungdomar 13–< 21 år).
Resultaten av studien visade att de terapeutiska mediandoserna (intervall) per åldersgrupp var följande: spädbarn (N = 3), 180 IU/kg (146–181 IU/kg); barn (N = 7), 125 IU/kg (101–175 IU/kg); och ungdomar (N = 8), 100 IU/kg (91–163 IU/kg).
En retrospektiv analys granskade kliniska resultat och laboratorieresultat av profylaktisk och terapeutisk användning av dalteparin hos barn (0–18 år) vid en enda institution (Mayo Clinic) för behandling av VTE från 1 december 2000 till och med 31 december 2011.
Behandlingsdata för totalt 166 patienter granskades, inklusive 116 patienter som fick profylaxdoser av dalteparin och 50 patienter som fick terapeutiska doser. De 50 patienter som fick terapeutiska doser, antingen en eller två gånger dagligen, omfattade 13 patienter under 1 års ålder och 21 patienter med maligniteter. Resultaten visade att patienter under 1 års ålder behövde avsevärt högre viktbaserad dosering för att uppnå terapeutiska anti-Xa-nivåer jämfört med barn (1–10 år) eller ungdomar (> 10–18 år) (genomsnittliga dosenheter/kg/dag: 396,6 jämfört med 236,7 respektive 178,8, p < 0,0001).
Av de 50 barn som fick behandling i denna retrospektiva studie var 17 småbarn yngre än 2 års ålder (genomsnittlig ålder 6 månader; 10/17 pojkar). De flesta av småbarnen (12/17) doserades två gånger dagligen med en medianstartdos av dalteparin på 151 IU/kg; (intervall 85–174 IU/kg); 5 småbarn doserades enbart en gång dagligen med liknande doser. De 17 småbarnen behandlades i mellan 1 till 3 månader (mediantid 2 månader) och VTE upplöstes hos 82 %; ingen av patienterna drabbades av blödningskomplikationer eller biverkningar relaterade till dalteparin.
Profylax av venös tromboembolism hos pediatriska patienter
En prospektiv studie (Nohe et al 1999) undersökte effekten, säkerheten och sambandet mellan dos och dalteparins anti-Xa-aktivitet i plasma vid profylax och behandling av arteriell och venös trombos hos 48 pediatriska patienter (32 pojkar, 16 flickor; födda prematurt i vecka 31 till 18 års ålder). Åtta barn med riskfaktorer för trombos (fetma, protein C-brist, karcinom) fick dalteparin som immobiliseringsprofylax och 2 som ”högrisk”-profylax efter hjärtkirurgi (grupp I). Trettiosex barn fick dalteparin som behandling efter arteriella eller venösa tromboemboliska händelser (grupp II–IV). I behandlingsgruppen behandlades 8 av 36 barn (22 %) med dalteparin för att förebygga ny ocklusion efter framgångsrik trombolysbehandling (grupp II), 5 av 36 (14 %) efter otillräcklig, misslyckad trombolysbehandling med rtPA eller urokinas (grupp III) och 23 av 36 (64 %) för primär antitrombotisk behandling på grund av kontraindikationer för trombolys (grupp IV).
I denna studie behövde 10 patienter som fick dalteparin för trombosprofylax en underhållsdos på 95 ± 52 IU/kg subkutant (s.c.) en gång dagligen för att uppnå en anti-Xa-nivå på 0,2 till 0,4 IU/ml över en period på 3 till 6 månader. Ingen tromboembolisk händelse inträffade hos de 10 patienter som fick dalteparin som trombosprofylax.
Farmakokinetiska egenskaper
Efter intravenös injektion är halveringstiden för dalteparinnatrium 2 timmar och efter subkutan injektion 3 till 4 timmar. Biotillgängligheten för en subkutant administrerad dos är cirka 90 % och substansens farmakokinetik är inte signifikant dosberoende. Halveringstiden är längre hos uremiska patienter. Dalteparinnatrium elimineras huvudsakligen renalt.
Pediatrisk population
Farmakokinetiken för subkutant (s.c.) dalteparin två gånger dagligen, mätt som anti-faktor Xa-aktivitet, karakteriserades hos 89 pediatriska patienter med eller utan cancer i två kliniska studier och 1 observationsstudie. Farmakokinetiken (PK) för dalteparin beskrevs med en 1-kompartmentsmodell med linjär absorption och eliminering och PK-parametrar visas i tabell 7. Efter korrigering för kroppsvikt minskade clearance (CL/F) med stigande ålder, medan distributionsvolymen vid steady-state (Vd/F) förblev likartad. Den genomsnittliga halveringstiden i elimineringsfasen ökade med ålder.
Tabell 7. Farmakokinetiska parametrar för dalteparin i pediatrisk population
Parameter | Födsel < 8 veckor | ≥ 8 veckor till < 2 år | ≥ 2 år till < 8 år | ≥ 8 år till < 12 år | ≥ 12 år till < 19 år |
Antal patienter (N) | 6 | 13 | 14 | 11 | 45 |
Medianålder (intervall) (år) | 0,06 (0,04–0,14) | 0,5 (0,2–1,91) | 4,47 (2,01–7,6) | 9,62 (8,01–10,5) | 15,9 (12,0–19,5) |
Härledd genomsnittlig (SD) CL/F (ml/h/kg) | 55,8 (3.91) | 40,4 (8,49) | 26,7 (4,75) | 22,4 (3,40) | 18,8 (3,01) |
Härledd genomsnittlig (SD) Vd/F (ml/kg) | 181 (15,3) | 175 (55,3) | 160 (25,6) | 165 (27,3) | 171 (38,9) |
Härledd (SD) t½β (h) | 2,25 (0,173) | 3,02 (0,688) | 4,27 (1,05) | 5,11 (0,509) | 6,28 (0,937) |
CL=clearance, F=Absolut biotillgänglighet, SD=standardavvikelse, t½β=halveringstid i elimineringsfasen, Vd=distributionsvolym. | |||||
Prekliniska säkerhetsuppgifter
Den akuta toxiciteten för dalteparinnatrium är väsentligt lägre än för heparin. Den enda signifikanta reaktion, som konsekvent återkom under toxicitetsstudierna efter administrering av höga dosnivåer, var lokal blödning vid injektionsstället. Effekten var dosberoende både avseende incidens och grad. Blödning på injektionsstället var dock inte kumulativ. Den lokala blödningsreaktionen korrelerade med dosrelaterade förändringar i antikoagulerande effekt, mätta som APTT och anti-Xa aktivitet.
Det visades att dalteparinnatrium inte har större osteopen effekt än heparin, då denna effekt var jämförbar vid ekvivalenta doser.
Dalteparinnatrium visade sig inte vara organtoxiskt oavsett administreringssätt, dos och behandlingslängd. Det var inte heller mutagent, embryotoxiskt eller teratogent och påverkade inte fertiliteten eller peri- och postnatal utveckling.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
12 500 IU anti-Xa/ml − 0,2 ml endosspruta
Natriumklorid 0–1,5 mg
Vatten för injektionsvätskor ad 0,2 ml.
25 000 IU anti-Xa/ml
0,2 ml endosspruta: Vatten för injektionsvätskor ad 0,2 ml.
0,3 ml endosspruta: Vatten för injektionsvätskor ad 0,3 ml.
0,4 ml endosspruta: Vatten för injektionsvätskor ad 0,4 ml.
0,5 ml endosspruta: Vatten för injektionsvätskor ad 0,5 ml.
0,6 ml endosspruta: Vatten för injektionsvätskor ad 0,6 ml.
0,72 ml endosspruta: Vatten för injektionsvätskor ad 0,72 ml.
Inkompatibiliteter
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Hållbarhet
3 år.
Används före utgångsdatum som anges på etiketten.
Fragmin spädd med fysiologisk koksaltlösning (9 mg/ml) eller glukos (50 mg/ml) till en koncentration på 2 500 IU/ml: kemisk och fysisk hållbarhet har påvisats i 24 timmar vid 20 °C förvaring i en polypropylenspruta eller glasinjektionsflaska.
Från mikrobiologisk synvinkel ska läkemedlet användas omedelbart, såvida inte metoden för öppnande och spädning utesluter risk för mikrobiell kontamination. Om det inte används omedelbart ansvarar användaren för förvaringstider och -förhållanden vid användning.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 °C.
Ljus eller förvaring under 0 °C påverkar inte produktens kvalitet.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
FRAGMIN injektioneste, liuos
12500 IU/ml (L:ei) (2500 IU) 25 x 0,2 ml (2500 IU/0,2 ml) (65,29 €)
25000 IU/ml (L:ei) (5000 IU) 10 x 0,2 ml (5000 IU/0,2 ml) (45,09 €), (7500 IU) 10 x 0,3 ml (7500 IU/0,3 ml) (62,67 €), (5000 IU) 25 x 0,2 ml (5000 IU/0,2 ml) (104,91 €), (10000 IU) 5 x 0,4 ml (10000 IU/0,4 ml) (39,92 €), (12500 IU) 5 x 0,5 ml (12500 IU/0,5 ml) (49,74 €), (15000 IU) 5 x 0,6 ml (15000 IU/0,6 ml) (59,56 €), (18000 IU) 5 x 0,72 ml (18000 IU/0,72 ml) (70,37 €)
PF-selosteen tieto
12 500 IU anti-Xa/ml
5 x 0,2 ml, 10 x 0,2 ml, 25 x 0,2 ml.
25 000 IU anti-Xa/ml
5 x 0,2 ml, 10 x 0,2 ml, 25 x 0,2 ml, 10 x 0,3 ml, 5 x 0,4 ml, 5 x 0,5 ml, 5 x 0,6 ml och 5 x 0,72 ml.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Injektionsvätskan tillhandahålls i en förfylld endosspruta (glas typ I) med ett nålskydd (gummi), en kolvpropp (klorbutylgummi), en sprutkolv (polypropylen eller polystyren). Sprutan kan vara utrustad med ett Needle Trap stickskydd som en säkerhetsfunktion.
Endossprutorna är förpackade i en PVC/folieblister och en ytterkartong av kartong. Nålskyddet kan innehålla latex (se avsnitt Varningar och försiktighet).
Läkemedlets utseende:
Klar, färglös till svagt gul lösning.
Särskilda anvisningar för destruktion och övrig hantering
När spädning till en koncentration på 2 500 IU/ml krävs kan Fragmin spädas med infusionslösningar med natriumklorid (9 mg/ml) eller glukos (50 mg/ml) i glasflaskor och plastbehållare.
Det rekommenderas att lösningen används omedelbart efter spädning (se avsnitt Hållbarhet).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Fragmin injiceras primärt i den subkutana vävnaden i buken antero- eller posterolateralt eller i skinkorna. Injektionsnålen förs in i en 45–90 graders vinkel så djupt som möjligt i det tjocka hudvecket som erhålls genom att klämma ihop huden mellan tummen och pekfingret. Hudvecket ska hållas på plats under hela injektionen.
Utförliga anvisningar om administreringen av Fragmin finns i avsnitt 3 i bipacksedeln.
Needle Trap (vissa endossprutor kan ha) - Beskrivning och bruksanvisning
Beskrivning:
Needle Trap är ett hjälpmedel för att förhindra oavsiktliga nålstick när du använder Fragmin förfyllda sprutor.
Needle Trap består av en nålhållare av plast fäst på en etikett på sprutan.
Bruksanvisning:
Ta tag i nålhållaren i plast och vik bort den från nålskyddet.
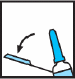
Ta bort nålskyddet från sprutan.
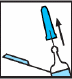
Ge injektionen.
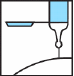
Efter injektionen, aktivera Needle Trap genom att trycka in nålen i nålhållaren mot en hård, plan yta och vända sprutan uppåt. Fortsätt att trycka på nålen tills vinkeln mellan sprutan och ytan är mer än 45 grader och nålen är fastsatt i hållaren, vilket gör sprutan oanvändbar.
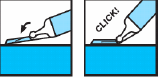
Lägg sprutan i lämplig avfallsbehållare.
Ersättning
FRAGMIN injektioneste, liuos
12500 IU/ml (2500 IU) 25 x 0,2 ml
25000 IU/ml (5000 IU) 10 x 0,2 ml, (7500 IU) 10 x 0,3 ml, (5000 IU) 25 x 0,2 ml, (10000 IU) 5 x 0,4 ml, (12500 IU) 5 x 0,5 ml, (15000 IU) 5 x 0,6 ml, (18000 IU) 5 x 0,72 ml
- Ylempi erityiskorvaus (100 %). Daltepariini ja tintsapariini (yli 6 kuukauden hoidossa): Aktiivisen syöpätaudin hoitoon liittyvän laskimon tromboembolian hoito ja pitkäaikainen estohoito erityisin edellytyksin (166).
- Rajoitettu ylempi erityiskorvaus reseptimerkinnällä (100 %). Rintasyöpä (115), Eturauhassyöpä (116), Leukemiat, muut pahanlaatuiset veri- ja luuydintaudit sekä pahanlaatuiset imukudostaudit (117), Gynekologiset syövät (128), Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Laskimotukos (E008) Tromboembolia (E007) Keuhkoembolia (E004).
- Peruskorvaus (40 %).
Atc-kod
B01AB04
Datum för översyn av produktresumén
02.10.2025
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
