ZITHROMAX IV pulver till infusionsvätska, lösning 500 mg
Kvalitativ och kvantitativ sammansättning
En injektionsflaska innehåller azitromycindihydrat motsvarande 500 mg azitromycin, vilket motsvarar koncentrationen 100 mg/ml efter beredning.
Hjälpämnen med känd effekt:
Varje injektionsflaska innehåller 114 mg natrium.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver till infusionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
För intravenös behandling av samhällsförvärvad pneumoni (CAP) orsakad av mikrober känsliga för azitromycin, däribland Legionella pneumophila.
För intravenös behandling av bäckeninflammation (PID) orsakad av mikrober känsliga för azitromycin.
Officiella eller lokala riktlinjer om antibiotikaresistens och korrekt antimikrobiell behandling ska följas vid antibiotikabehandling.
Dosering och administreringssätt
Administreringssätt
För intravenös infusion (efter beredning och spädning) under minst 60 minuter. Beredningen ska inte ges som intravenös bolusinjektion eller som intramuskulär injektion (se avsnitt Varningar och försiktighet).
Infusatets koncentration och infusionshastigheten för azitromycin ska vara antingen 1 mg/ml under tre timmar eller 2 mg/ml under en timme.
Dosering
Pneumoni hos vuxna
Rekommenderad dos för behandling av vuxna patienter med pneumoni är 500 mg intravenöst en gång dagligen i minst två dagar. Intravenös behandling ska följas av 500 mg azitromycin peroralt en gång dagligen tills den totala behandlingstiden är 7 till 10 dagar. Tidpunkten för bytet till peroral behandling bestäms av läkaren baserat på den kliniska responsen.
Bäckeninflammation hos vuxna
Rekommenderad dos för behandling av vuxna patienter med bäckeninflammation (PID) är 500 mg intravenöst en gång dagligen i en eller två dagar. Intravenös behandling ska följas av 250 mg azitromycin peroralt en gång dagligen tills den totala behandlingstiden är 7 dagar. Tidpunkten för bytet till peroral behandling bestäms av läkaren baserat på den kliniska responsen.
Äldre
Ingen dosjustering är nödvändig. Till äldre patienter används samma dos som till vuxna.
Eftersom proarytmiska tillstånd kan förekomma hos äldre patienter rekommenderas särskild försiktighet på grund av risken för hjärtarytmi och torsades de pointes (se avsnitt Varningar och försiktighet).
Nedsatt njurfunktion
Ingen dosjustering är nödvändig för patienter med glomerulär filtrationshastighet (GFR) 10−80 ml/min. Försiktighet ska iakttas när azitromycin ges till patienter med GFR < 10 ml/min (se avsnitt Varningar och försiktighet och Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Patienter med lätt till måttligt nedsatt leverfunktion kan få samma dos som patienter med normal leverfunktion (se avsnitt Varningar och försiktighet).
Pediatrisk population
Säkerhet och effekt för intravenöst azitromycin vid behandling av infektioner hos barn har inte fastställts.
Kontraindikationer
Överkänslighet mot den aktiva substansen (azitromycin) eller andra antibiotika i makrolid- eller ketolidgruppen, eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Allergiska reaktioner
Liksom med erytromycin och andra makrolider har allvarliga allergiska reaktioner, såsom angioödem, anafylaxi (i sällsynta fall dödlig) och hudreaktioner som akut generaliserad exantematös pustulos (AGEP), Stevens-Johnsons syndrom, toxisk epidermal nekrolys (i sällsynta fall dödlig) och läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) rapporterats med azitromycin i sällsynta fall. Några av dessa reaktioner resulterade i återkommande symtom och krävde övervakning och behandling under längre tid.
Om en allergisk reaktion inträffar ska behandlingen avbrytas och lämplig behandling sättas in. Man bör vara medveten om att de allergiska symtomen kan återkomma när den symtomatiska behandlingen avslutas.
Nedsatt leverfunktion
Eftersom azitromycin främst elimineras via levern ska patienter med signifikant leversjukdom behandlas med försiktighet med azitromycin. Avvikande leverfunktion, hepatit, obstruktionsikterus, levernekros och leversvikt har rapporterats, i vissa fall med dödlig utgång. Fall av fulminant hepatit som kan leda till livshotande leversvikt har rapporterats med azitromycin (se avsnitt Biverkningar). En del patienter kan ha haft en tidigare leversjukdom eller ha tagit andra hepatotoxiska läkemedel.
Vid tecken eller symtom på leverdysfunktion, t.ex. snabbt utvecklad asteni med gulsot, mörk urin, blödningsbenägenhet eller leverencefalopati, ska leverfunktionstester/undersökningar utföras omedelbart. Vid leverdysfunktion ska azitromycinbehandlingen avbrytas.
Infantil hypertrofisk pylorusstenos (IHPS)
Infantil hypertrofisk pylorusstenos (IHPS) har rapporterats efter användning av azitromycin till nyfödda (behandling fram till 42:a levnadsdagen). Föräldrar och vårdare ska informeras om att kontakta läkare om barnet kräks eller visar irritabilitet vid matning.
Ergotalkaloider
Samtidig administrering av ergotalkaloider och antibiotika i makrolidgruppen har visat sig påskynda utveckling av ergotism. Inga interaktionsstudier mellan ergotalkaloider och azitromycin har utförts. På grund av den teoretiska risken för ergotism ska azitromycin och ergotderivat inte administreras samtidigt.
Superinfektioner
Liksom vid all antibiotikabehandling rekommenderas vaksamhet vad gäller tecken på superinfektion med icke-känsliga organismer, inklusive svamp.
Diarré orsakad av Clostridium difficile
Diarré orsakad av Clostridium difficile har rapporterats vid användning av nästan alla antibakteriella medel, inklusive azitromycin, och kan variera i svårighetsgrad från lätt diarré till dödlig kolit. Behandling med antibakteriella medel påverkar den normala floran i kolon och leder till överväxt av C. difficile.
C. difficile bildar toxin A och B, vilka bidrar till utveckling av Clostridium difficile-associerad diarré. Hypertoxinbildande stammar av C. difficile leder till ökad morbiditet och mortalitet eftersom dessa infektioner kan vara resistenta mot antimikrobiell behandling och kolektomi kan bli nödvändig.
Diarré på grund av Clostridium difficile måste övervägas hos alla patienter som får diarré efter antibiotikaanvändning. Noggrann medicinsk anamnes krävs eftersom Clostridium difficile-associerad diarré har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Nedsatt njurfunktion
Hos patienter med GFR < 10 ml/min har en 33-procentig ökning av den systemiska exponeringen för azitromycin observerats (se avsnitt Farmakokinetiska egenskaper).
Hjärtat
Förlängd repolarisering och förlängt QT-intervall, som medför risk för hjärtarytmi och torsades de pointes, har setts vid behandling med andra makrolider, däribland azitromycin (se avsnitt Biverkningar). Eftersom följande situationer kan leda till ökad risk för kammararytmier (inklusive torsades de pointes), som kan leda till hjärtstopp (ibland dödligt), ska azitromycin användas med försiktighet till patienter som redan har proarytmiska tillstånd (särskilt kvinnor och äldre patienter), t.ex. patienter:
- med medfödd eller dokumenterad QT-förlängning
- som samtidigt behandlas med andra aktiva substanser som förlänger QT-intervallet, t.ex. antiarytmika i klass IA (kinidin och prokainamid) och klass III (dofetilid, amiodaron och sotalol), cisaprid och terfenadin, antipsykotika (t.ex. pimozid), antidepressiva som citalopram och fluorokinoloner (t.ex. moxifloxacin och levofloxacin)
- med elektrolytrubbningar, i synnerhet hypokalemi och hypomagnesemi
- med kliniskt relevant bradykardi, hjärtarytmi eller svår hjärtinsufficiens.
Myasthenia gravis
Exacerbationer av symtomen på myasthenia gravis och debut av myasthenia gravis har rapporterats hos patienter som behandlas med azitromycin (se avsnitt Biverkningar).
Pediatrisk population
Säkerhet och effekt för intravenöst azitromycin för behandling av infektioner hos barn har inte fastställts.
Säkerhet och effekt för azitromycin för behandling av infektioner med Mycobacterium avium-komplex (MAC) hos barn har inte fastställts.
Intravenös administrering
Azitromycin ska ges intravenöst (efter beredning och spädning enligt anvisningarna) under minst 60 minuter. Beredningen ska inte ges som bolusinjektion eller som intramuskulär injektion (se avsnitt Dosering och administreringssätt och Särskilda anvisningar för destruktion och övrig hantering).
Reaktioner på infusionsstället
Frivilliga försökspersoner som fick infusionslösning i koncentrationer som översteg 2,0 mg/ml fick reaktioner på infusionsstället (lokal smärta och inflammation vid infusionsstället), varför högre koncentrationer ska undvikas.
Information om hjälpämne
Detta läkemedel innehåller 114 mg natrium per injektionsflaska, motsvarande 5,7 % av WHO:s högsta rekommenderat dagligt intag (RDI) (2 g natrium för vuxna).
Detta läkemedel kan beredas ytterligare för administrering med lösningar som innehåller natrium (se avsnitt Särskilda anvisningar för destruktion och övrig hantering) och det ska beaktas i förhållande till den totala natriumhalten från alla källor som ges till patienten.
Interaktioner
Antacida: I en farmakokinetisk studie som undersökte effekterna av samtidig administrering av antacida och azitromycin sågs ingen effekt på den totala biotillgängligheten, men maximala serumkoncentrationer minskade med cirka 24 %. Patienter som behandlas med både azitromycin och antacida ska inte ta läkemedlen vid samma tillfälle. Antacidum ska tas minst en timme före eller minst två timmar efter azitromycin.
Samtidig administrering av läkemedlet som innehåller Zithromax depotgranulat för oral suspension och aluminiumhydroxid- och magnesiumhydroxidinnehållande läkemedel (co-magaldrox, engångsdos 20 ml) påverkade inte hastigheten eller omfattningen av azitromycinabsorptionen.
Cetirizin: Hos friska frivilliga försökspersoner resulterade samtidig administrering av azitromycin (5-dagarsregim) och cetirizin 20 mg vid steady state, inte i någon farmakokinetisk interaktion och inga signifikanta förändringar av QT-intervallet.
Didanosin (dideoxyinosin): Samtidig administrering av azitromycin (1 200 mg/dag) och didanosin (400 mg/dag) till sex hiv-positiva försökspersoner verkade inte påverka farmakokinetiken för didanosin vid steady state vid jämförelse med placebo.
Digoxin och kolkicin (p-glykoproteinsubstrat): Samtidig administrering av makrolidantibiotika (inklusive azitromycin) och P-gp-substrat (t.ex. digoxin och kolkicin) har rapporterats resultera i ökade serumkoncentrationer av P-gp-substratet. Om azitromycin och P-gp-substrat, såsom digoxin, administreras samtidigt måste denna risk beaktas. Klinisk övervakning och eventuellt kontroll av digoxinkoncentrationen i serum är nödvändig under och efter behandlingen med azitromycin.
Zidovudin: Enstaka doser om 1 000 mg och multipla doser om 1 200 mg eller 600 mg azitromycin hade ringa effekt på farmakokinetiken i plasma eller urinutsöndringen av zidovudin eller dess glukoronidmetabolit. Administrering av azitromycin ökade emellertid koncentrationen av fosforylerat zidovudin (den kliniskt aktiva metaboliten) i perifera mononukleära blodkroppar. Den kliniska signifikansen av detta är oklar men det kan vara till nytta för patienterna.
Azitromycin interagerar inte signifikant med det hepatiska cytokrom P450-systemet. Det anses inte genomgå de läkemedelsinteraktioner som ses med erytromycin och andra makrolider. Ingen induktion av hepatiskt cytokrom P450 eller inaktivering genom bildande av cytokrom-metabolit-komplex sker med azitromycin.
Ergotalkaloider: Det finns en teoretisk risk för interaktion när azitromycin administreras samtidigt som ergotderivat (se avsnitt Varningar och försiktighet).
Cytokrom P450-systemet
Farmakokinetiska studier har utförts på samtidig administrering av azitromycin och följande läkemedel som metaboliseras via cytokrom P450.
Atorvastatin: Samtidig administrering av atorvastatin (10 mg/dag) och azitromycin (500 mg/dag) förändrade inte plasmakoncentrationerna av atorvastatin (baserat på analys av HMG-CoA-reduktashämning). Fall av rabdomyolys hos patienter som fått azitromycin samtidigt med statiner har emellertid rapporterats efter godkännandet för försäljning.
Karbamazepin: I en farmakokinetisk interaktionsstudie på friska frivilliga försökspersoner som fick azitromycin samtidigt med karbamazepin sågs inga signifikanta förändringar av plasmakoncentrationen av karbamazepin eller dess aktiva metaboliter.
Cimetidin: I en farmakokinetisk studie sågs ingen effekt av en engångsdos cimetidin på azitromycins farmakokinetik, när det administrerades två timmar före azitromycin.
Orala antikoagulantia av kumarintyp: I en farmakokinetisk interaktionsstudie förändrade inte azitromycin den antikoagulerande effekten av en engångsdos på 15 mg warfarin administrerad till friska frivilliga försökspersoner. Efter godkännandet för försäljning har en förstärkt antikoagulationseffekt rapporterats efter samtidig administrering av azitromycin och orala antikoagulantia av kumarintyp. Inget orsakssamband har fastställts men frekvensen för kontroll av protrombintid vid samtidig användning av azitromycin och orala antikoagulantia av kumarintyp ska trots det övervägas.
Ciklosporin: I en farmakokinetisk studie på friska frivilliga försökspersoner som fick azitromycin peroralt i doser om 500 mg/dag i 3 dagar och därefter fick en oral engångsdos ciklosporin om 10 mg/kg sågs en signifikant ökning av Cmax och AUC0-5 för ciklosporin. Behandlingssituationen ska därför övervägas noga innan dessa läkemedel administreras samtidigt. Om läkemedlen måste ges samtidigt ska ciklosporinkoncentrationen övervakas och dosen justeras vid behov.
Efavirenz: Inga kliniskt signifikanta farmakokinetiska interaktioner har observerats när en engångsdos azitromycin (600 mg) har getts samtidigt med efavirenz (400 mg/dag i sju dagar).
Flukonazol: Samtidig administrering av en engångsdos (1 200 mg) azitromycin förändrade inte farmakokinetiken för en engångsdos (800 mg) flukonazol. Total exponering och halveringstid för azitromycin var oförändrade vid samtidig administrering av flukonazol. Dock sågs en kliniskt ej signifikant minskning av Cmax (18 %) för azitromycin.
Indinavir: Samtidig administrering av en engångsdos (1 200 mg) azitromycin hade inte någon statistiskt signifikant effekt på farmakokinetiken för indinavir administrerat som 800 mg tre gånger dagligen i 5 dagar.
Metylprednisolon: I en farmakokinetisk interaktionsstudie på friska frivilliga hade azitromycin ingen signifikant effekt på farmakokinetiken för metylprednisolon.
Midazolam: Hos friska frivilliga ledde samtidig administrering av azitromycin (500 mg/dag i 3 dagar) inte till några kliniskt signifikanta förändringar av farmakokinetiken och farmakodynamiken för midazolam (engångsdos om 15 mg).
Nelfinavir: Samtidig administrering av azitromycin (1 200 mg) och nelfinavir vid steady state (750 mg x 3/dag vid steady state) resulterade i högre koncentration av azitromycin. Inga kliniskt signifikanta biverkningar observerades och dosjustering krävdes inte.
Rifabutin: Samtidig administrering av azitromycin och rifabutin påverkar inte serumkoncentrationen av något av läkemedlen. Neutropeni har observerats hos patienter som får denna kombinationsbehandling. Något orsakssamband med azitromycin har inte fastställts (ses avsnitt Biverkningar).
Sildenafil: Hos friska frivilliga män sågs inga tecken på någon effekt av azitromycin (500 mg/dag i 3 dagar) på AUC eller Cmax för sildenafil eller dess huvudsakliga cirkulerande metabolit.
Terfenadin: I farmakokinetiska studier har inga belägg för interaktioner mellan azitromycin och terfenadin rapporterats. I några sällsynta fall kunde möjligheten av interaktioner inte helt uteslutas, dock fanns inga specifika belägg för att en sådan interaktion hade inträffat.
Teofyllin: Det finns inget som tyder på en kliniskt signifikant farmakokinetisk interaktion mellan azitromycin och teofyllin när de ges samtidigt till friska frivilliga försökspersoner.
Triazolam: Hos 14 friska frivilliga hade samtidig administrering av azitromycin (500 mg dag 1 och 250 mg dag 2) och triazolam (0,125 mg dag 2) ingen signifikant effekt på någon farmakokinetisk variabel för triazolam, jämfört med triazolam och placebo.
Trimetoprim/sulfametoxazol: Samtidig administrering av trimetoprim/sulfametoxazol (160 mg/800 mg) i 7 dagar och 1 200 mg azitromycin dag 7 hade ingen signifikant effekt på maxkoncentration, total exponering eller urinutsöndring för varken trimetoprim eller sulfametoxazol. Serumkoncentrationen av azitromycin var densamma som i andra studier.
Fertilitet, graviditet och amning
Graviditet
I reproduktionstoxikologiska studier på djur visades azitromycin passera placenta, men inga teratogena effekter observerades. Det finns en stor mängd data från observationsstudier som utförts i flera länder om exponering för azitromycin under graviditeten, jämfört med ingen antibiotikaanvändning eller användning av ett annat antibiotikum under samma period. Även om de flesta studier inte tyder på ett samband med negativa effekter på fostret, såsom större medfödda missbildningar eller kardiovaskulära missbildningar, finns det begränsade epidemiologiska bevis för en ökad risk för missfall efter exponering för azitromycin i tidig graviditet.
Azitromycin ska endast användas under graviditet om det är kliniskt nödvändigt och om nyttan av behandlingen förväntas uppväga eventuella små ökade risker som kan finnas.
Amning
Begränsad information i publicerad litteratur tyder på att azitromycin finns i bröstmjölk med en uppskattad högsta mediandos på 0,1 till 0,7 mg/kg/dag. Inga allvarliga biverkningar av azitromycin på spädbarn som ammas har observerats.
Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med azitromycin efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Fertilitet
I fertilitetsstudier utförda på råtta sågs färre dräktigheter efter administrering av azitromycin. Relevansen av detta fynd för människa är okänd.
Effekter på förmågan att framföra fordon och använda maskiner
Det finns inget som tyder på att Zithromax påverkar förmågan att framföra fordon eller använda maskiner.
Biverkningar
I tabellen nedan redovisas biverkningar som förekommit vid kliniska prövningar och under övervakning efter godkännandet för försäljning. Biverkningar som noterats efter godkännandet för försäljning anges med kursiv stil. Biverkningarna delas in efter organsystem och frekvens: mycket vanliga (≥1/10); vanliga (≥1/100, <1/10); mindre vanliga (≥1/1 000, <1/100); sällsynta (≥1/10 000, <1/1 000); mycket sällsynta (<1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom varje frekvensgrupp presenteras biverkningarna i fallande allvarlighetsgrad.
Biverkningar som möjligen eller sannolikt har samband med azitromycin baserat på kliniska prövningar och övervakning efter godkännandet för försäljning

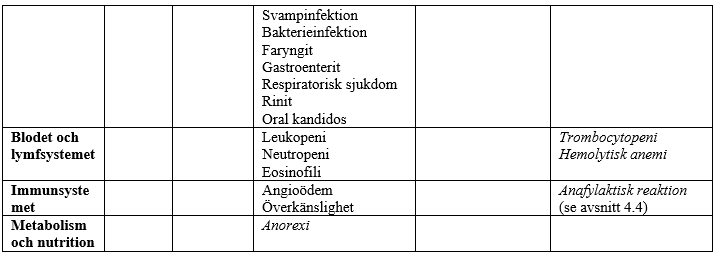
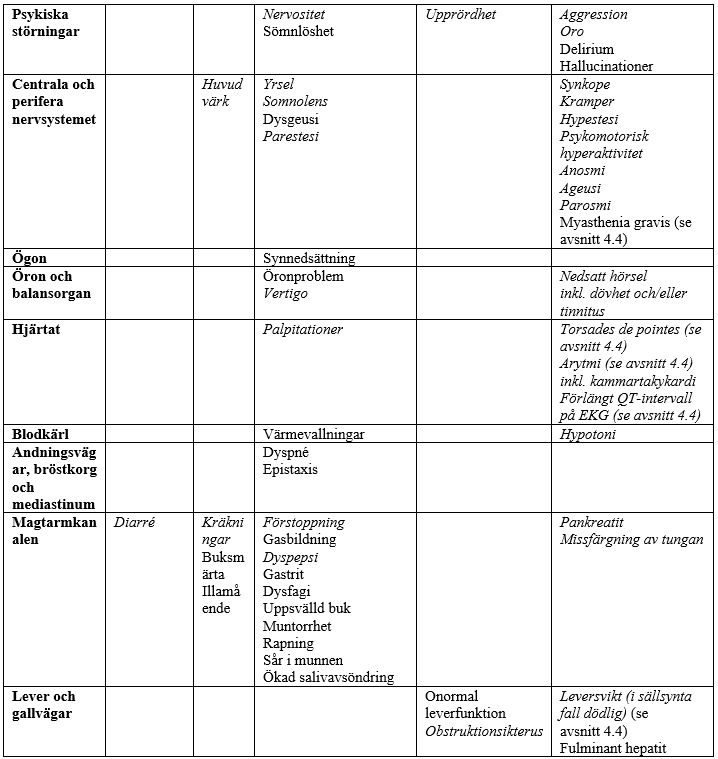
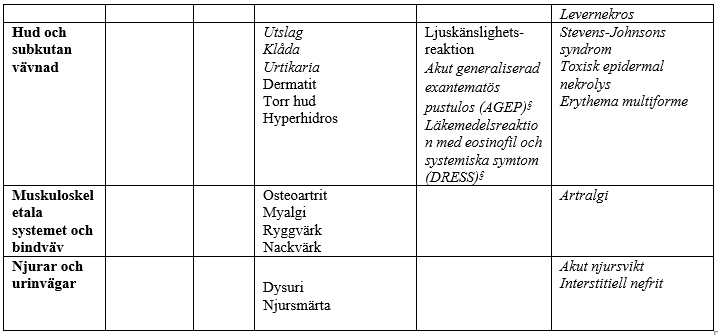
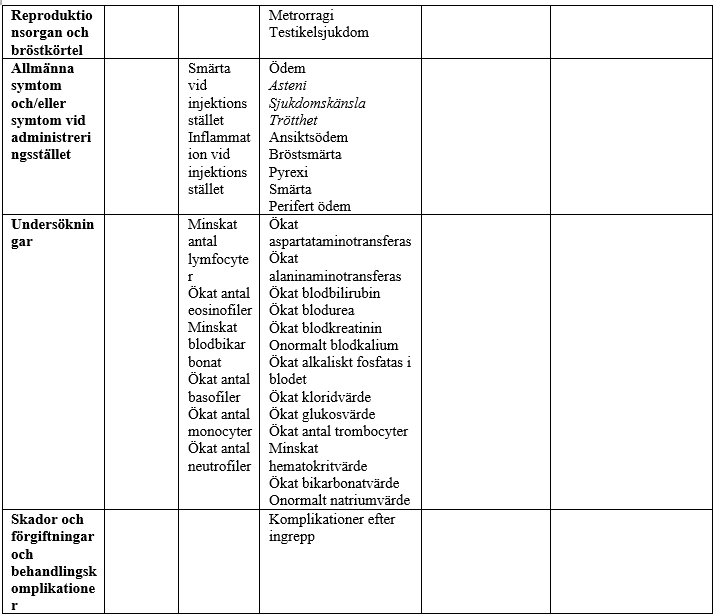
§Biverkningsfrekvens angiven som uppskattad övre gräns för 95-procentigt konfidensintervall beräknad enligt ”rule of 3”.
Biverkningar som möjligen eller sannolikt har samband med profylax och behandling av Mycobacterium avium-komplex baserat på kliniska prövningar och övervakning efter godkännandet för försäljning. Dessa biverkningar skiljer sig från dem som rapporterats för läkemedel med omedelbar frisättning eller depotberedningar, antingen vad gäller art eller frekvens:
Mycket vanliga | Vanliga | Mindre vanliga | |
Metabolism och nutrition | Anorexi | ||
Centrala och perifera nervsystemet | Yrsel Huvudvärk Parestesi Dysgeusi | Hypestesi | |
Ögon | Synnedsättning | ||
Öron och balansorgan | Dövhet | Nedsatt hörsel Tinnitus | |
Hjärtat | Palpitationer | ||
Magtarmkanalen | Diarré Buksmärta Illamående Gasbildning Obehag från buken Lös avföring | ||
Lever och gallvägar | Hepatit | ||
Hud och subkutan vävnad | Utslag Klåda | Stevens-Johnsons syndrom Ljuskänslighetsreaktion | |
Muskuloskeletala systemet och bindväv | Artralgi | ||
Allmänna symtom och/eller symtom vid administreringsstället | Trötthet | Asteni Sjukdomskänsla |
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via:
www-sivusto: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PL 55
00034 FIMEA
Överdosering
De biverkningar som förekommit vid doser högre än de rekommenderade är desamma som vid normala doser. Vid överdosering ska aktivt kol och allmänna symtomatiska och stödjande åtgärder sättas in efter indikation.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Makrolider, ATC-kod: J01FA10
Azitromycin är det första makrolidantibiotikumet i azalidgruppen. Det skiljer sig kemiskt från erytromycin. Molekylen bildas genom att en kväveatom läggs till i laktonringen på erytromycin A. Azitromycins kemiska namn är 9-deoxi-9a-aza-9a-metyl-9a-homoerytromycin A. Molekylvikten är 749,0.
Verkningsmekanism
Azitromycin binds till 23S rRNA på den ribosomala 50S-subenheten. Det blockerar proteinsyntesen genom att hämma transpeptiderings-/translokationssteget under proteinsyntesen och genom att hämma uppbyggnaden av den ribosomala subenheten 50S.
Hjärtats elektrofysiologi
Förlängning av QTc-intervallet studerades i en randomiserad, placebokontrollerad parallellgruppsprövning på 116 friska försökspersoner som fick antingen 1 000 mg klorokin enbart eller i kombination med azitromycin. Samtidig administrering av azitromycin ökade QTc-intervallet på ett dos- och koncentrationsberoende sätt. I jämförelse med enbart klorokin var den största genomsnittliga ökningen (95 % övre konfidensgräns) av QTc 5 ms (10 ms), 7 ms (12 ms) och 9 ms (14 ms) vid samtidig administrering av 500 mg, 1 000 mg respektive 1 500 mg azitromycin en gång dagligen.
Resistensmekanism
De två vanligaste resistensmekanismerna med makrolider, däribland azitromycin, är modifiering av målstrukturerna (oftast genom metylering av 23S rRNA) och aktiv efflux. Förekomsten av dessa resistensmekanismer varierar mellan olika arter och inom en art kan resistensfrekvensen variera beroende på geografisk lokalisation.
Den viktigaste ribosomala modifiering som leder till svagare bindning av makrolider är posttranskriptionell (N6)-dimetylering av adenin i nukleotid A2058 (Escherichia coli-numrering) i 23S rRNA av metylaser som kodas av erm-gener (erytromycin-ribosom-metylas-gener). Ribosomala modifieringar bestämmer ofta förekomsten av korsresistens (MLSB-fenotyp) mot andra antibiotikaklasser vars ribosomala bindningsställen överlappar makrolidernas bindningsställen: linkosamiderna (inklusive klindamycin) och B-streptograminerna (som t.ex. inkluderar kinupristinkomponenten i kinupristin/dalfopristin). Olika erm-gener förekommer i olika bakteriearter, särskilt bland streptokocker och stafylokocker. Känsligheten för makrolider kan också påverkas av mindre frekventa mutationer i nukleotiderna A2058 och A2059, och vid vissa andra positioner i 23S rRNA, eller i den stora subenheten av de ribosomala proteinerna L4 och L22.
Effluxpumpar finns hos ett antal arter, inklusive gram-negativa såsom Haemophilus influenzae (där de kan medföra endogena högre MIC-värden) samt hos stafylokocker. Hos streptokocker och enterokocker kodas en effluxpump som identifierar 14- och 15-ledade makrolider (vilket inkluderar erytromycin respektive azitromycin) av mef(A)-gener.
Metod för bestämning av bakteriers känslighet för azitromycin in vitro
Känslighetstester ska utföras med standardiserade laboratoriemetoder såsom de metoder som är beskrivna av CLSI, Clinical and Laboratory Standards Institute. Dessa omfattar spädningsmetoder (MIC-bestämning) och diskdiffusionsmetoder. Både CLSI och EUCAST (European Committee on Antimicrobial Susceptibility Testing) tillhandahåller tolkningskriterier för dessa metoder.
Baserat på ett antal studier rekommenderas att azitromycins aktivitet in vitro testas vid rumstemperatur för att tillförsäkra ett fysiologiskt pH i odlingsmediet. Ökat koldioxidtryck, som ofta används för streptokocker och anaerober, och ibland även för andra arter, leder till sänkt pH i odlingsmediet. Detta har större negativ effekt på azitromycins styrka än på andra makroliders.
EUCAST har fastställt brytpunkter för azitromycinkänsligheten baserat på MIC-bestämning. Känslighetskriterier enligt EUCAST redovisas i nedanstående tabell.
MIC-brytpunkter enligt EUCAST MIC (1.1.2012) − Minsta hämmande koncentration av azitromycin (MIC)
Patogen | Känslig | Resistent | |
Staphylococcus-arter | ≤1 mg/l | >2 mg/l | |
Streptococcus pneumoniae | ≤0,25 mg/l | >0,5 mg/l | |
β‑-hemolytiska streptokocker (grupp A, B, C och G) | ≤0,25 mg/l | >0,5 mg/l | |
Haemophilus influenzae | ≤0,12 mg/l | >4 mg/l | |
Moraxella catarrhalis | ≤0,25 mg/l | >0,5 mg/l | |
Neisseria gonorrhoeae | ≤0,25 mg/l | >0,5 mg/l | |
Källa: EUCAST:s webbplats. EUCAST tabell över kliniska brytpunkter v. 2.0, gällande från 1.1.2012 www.eucast.org/.../EUCAST.../Breakpoint_table_v_2.0_120221.pdf | |||
Följande bakterier är känsliga för azitromycin in vitro:
Grampositiva aeroba bakterier: Staphylococcus aureus, Streptococcus pyogenes (beta-hemolytiska streptokocker grupp A), Streptococcus pneumoniae, alfa-hemolytiska streptokocker (viridans-gruppen) och andra streptokocker, samt Corynebacterium diphtheriae.
Gramnegativa aeroba bakterier: Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis, Acinetobacter-arter, Yersinia-arter, Legionella pneumophila, Bordetella pertussis, Bordetella parapertussis, Shigella-arter, Pasteurella-arter, Vibrio cholerae och parahaemolyticus, Plesiomonas shigelloides.
Anaeroba bakterier: Bacteroides fragilis och Bacteroides-arter, Clostridium perfringens, Peptostreptococcus-arter, Fusobacterium necrophorum och Propionibacterium acnes och Peptococcus-arter.
Patogener för sexuellt överförbara sjukdomar: Chlamydia trachomatis, Treponema pallidum, Haemophilus ducreyi och Neisseria gonorrhoeae.
Övriga organismer: Borrelia burgdorferi (patogen för Lyme-borrelios), Chlamydia pneumoniae, Toxoplasma gondii, Mycoplasma pneumoniae, Mycoplasma hominis, Ureaplasma urealyticum, Mycobacterium avium intracellulare, Pneumocystis carinii, Campylobacter-arter och Listeria monocytogenes.
Azitromycin har varierande effekt mot Escherichia coli, Salmonellae, Enterobacter-arter och Aeromonas hydrophila samt Klebsiella-arter, vilket är anledningen till att känslighetstester ska utföras.
Följande bakterier är resistenta mot azitromycin in vitro:
Grampositiva aeroba bakterier: Streptococcus faecalis (enterokocker) och andra erytromycinresistenta stammar samt stammar av meticillinresistenta stafylokocker.
Gramnegativa aeroba bakterier: Proteus-arter, Serratia-arter, Morganella-arter och Pseudomonas aeruginosa.
Kliniska farmakologiska data
Behandling av pneumoni
I en öppen icke jämförande studie fick patienterna azitromycin, först som intravenös infusion i 2 till 5 dagar och därefter peroralt till en komplett behandlingskur på 7 till 10 dagar. Kliniskt lyckat resultat (återhämtning samt förbättrat tillstånd) 10 till 14 dagar efter behandlingen hade uppnåtts hos 88 % (74/84) och 4 till 6 veckor efter behandlingen hos 86 % (73/85) av de utvärderingsbara patienterna.
I en öppen randomiserad jämförande studie, där azitromycin (intravenöst och peroralt) jämfördes med cefuroxim (intravenöst och peroralt, med erytromycin vid behov) sågs inga statistiskt signifikanta skillnader mellan de två behandlingarna.
I dessa studier var den totala återhämtningsfrekvensen hos patienter som testats positiva för Legionella pneumophila 84 % (16/19). I en öppen icke jämförande studie, där patienterna testats positiva för Legionella pneumophila (serogrupp 1) med ett specifikt test för antigen i urinen, fick deltagarna azitromycin först intravenöst och därefter peroralt. 10 till 14 dagar efter behandlingen var 16 av de 17 utvärderingsbara patienterna kliniskt friska, och efter 4 till 6 veckor var 20 av 20 patienter kliniskt friska.
Behandling av bäckeninflammation (PID)
Resultaten av en öppen studie visar att tre behandlingsregimer (azitromycin respektive azitromycin/metronidazol respektive doxycyklin, metronidazol, cefoxitin och probenecid) är jämförbara vad gäller effekten och säkerheten vid akut PID. I en annan öppen jämförande studie på patienter med akut bäckeninflammation behandlades patienterna med azitromycin i.v./peroralt respektive azitromycin i.v. + metronidazol i.v./peroralt respektive doxycyklin peroralt + amoxicillin-klavulansyra i.v./peroralt. Även dessa behandlingsregimer var jämförbara vad gällde effekt och säkerhet. Baserat på dessa studieresultat var den totala frekvensen lyckade behandlingar minst 97 % i samtliga grupper vid behandlingens slut, och minst 96 % av patogenerna hade eradikerats. Vid uppföljning hade minst 90 % av patogenerna eradikerats.
Pediatrisk population
Efter utvärdering av studier utförda på barn rekommenderas inte azitromycin för behandling av malaria hos barn, varken som monoterapi eller i kombination med klorokin, artemisinin eller derivat av dessa, eftersom jämförbarhet med de malarialäkemedel som rekommenderas för behandling av okomplicerad malaria inte kan bevisas.
Farmakokinetiska egenskaper
Absorption
Hos människa distribueras peroralt azitromycin allmänt i kroppen. Biotillgängligheten är cirka 37 %. Maximal plasmakoncentration uppnås 2 till 3 timmar efter intaget.
Distribution
I djurstudier har höga azitromycinkoncentrationer uppmätts i fagocyter. I experimentella modeller frisätts högre koncentrationer av azitromycin under aktiv fagocytos än hos icke-stimulerade fagocyter. I djurmodeller leder detta till att högre koncentrationer azitromycin avges till infektionsstället.
Farmakokinetiska studier på människa har visat betydligt högre azitromycinkoncentrationer i vävnader än i plasma (upp till 50 gånger högre än maximal plasmakoncentration). Detta tyder på att azitromycin är starkt vävnadsbundet. Koncentrationen i vävnader (som lungor, tonsiller och prostata) överstiger MIC90-värdena för sannolika patogener efter en engångsdos på 500 mg.
Infusionsbehandling
När inneliggande patienter med pneumoni fick 500 mg azitromycin (2 mg/ml) som intravenös infusion under en timme en gång dagligen i 2 till 5 dagar, var genomsnittligt Cmax±SD 3,63±1,60 mikrogram/ml, lägsta värdet under 24 timmar var 0,20±0,15 mikrogram/ml och AUC24 var 9,60±4,80 mikrogram·h/ml.
När friska frivilliga fick 500 mg azitromycin (1 mg/ml) som intravenös infusion under tre timmar, var genomsnittligt Cmax 1,14±0,14 mikrogram/ml, lägsta värdet under 24 timmar var 0,18±0,02 mikrogram/ml och AUC24 var 8,03±0,86 mikrogram·h/ml.
Peroral behandling
Efter daglig administrering av 600 mg azitromycin peroralt var genomsnittlig maximal plasmakoncentration (Cmax) 0,33 mikrogram/ml dag 1 och 0,55 mikrogram/ml dag 22. Genomsnittlig maximal koncentration som uppmättes i leukocyter (viktigaste platsen för disseminerad MAC-infektion) var 252 mikrogram/ml (±49 %). Värdet kvarstod över 146 mikrogram/ml (±33 %) i 24 timmar vid steady state.
Eliminering
Halveringstiden i plasma i elimineringsfasen är nära nog densamma som halveringstiden i vävnader: 2 till 4 dagar. Cirka 12 % av en intravenöst administrerad azitromycindos utsöndras i urinen inom tre dagar i form av modersubstans, merparten under det första dygnet. Utsöndring av azitromycin via gallan är en viktig elimineringsväg för oförändrat läkemedel efter peroral administrering. Mycket höga koncentrationer av oförändrat azitromycin har återfunnits i galla, tillsammans med 10 metaboliter som bildats genom N- och O-demetylering, hydroxylering av desosamin- och aglykonringar samt delning av kladinoskonjugat. Jämförelser av HPLC och mikrobiologiska analyser av vävnadsprover tyder på att metaboliterna inte spelar någon roll för azitromycins mikrobiologiska aktivitet.
Farmakokinetik i särskilda patientgrupper
Äldre
Hos äldre frivilliga (>65 år) sågs något högre AUC-värden efter 5 dagars behandling än hos yngre frivilliga (<40 år). Dessa skillnader bedöms dock inte vara kliniskt signifikanta varför ingen dosjustering rekommenderas.
Nedsatt njurfunktion
Efter en peroral engångsdos om 1 gram azitromycin sågs ingen påverkan på farmakokinetiken hos patienter med GFR 10−80 ml/min. Statistiskt signifikanta skillnader observerades mellan patienter med GFR < 10 ml/min och patienter med GFR > 80 ml/min: AUC0-120 (8,8 mikrogram⋅h/ml vs. 11,7 mikrogram⋅h/ml), Cmax (1,0 mikrogram/ml vs. 1,6 mikrogram/ml) och CLr (2,3 ml/min/kg vs. 0,2 ml/min/kg).
Nedsatt leverfunktion
Hos patienter med lätt (klass A) till måttligt (klass B) nedsatt leverfunktion finns det inga tecken på en betydande förändring av serumfarmakokinetiken för azitromycin jämfört med hos personer med normal leverfunktion. Hos patienter med nedsatt leverfunktion verkar utsöndringen av azitromycin via urinen öka, möjligen för att kompensera för lägre leverclearance.
Prekliniska säkerhetsuppgifter
I djurstudier där doser gavs som var 40 gånger högre än de kliniska doserna orsakade azitromycin reversibel fosfolipidos, oftast utan några märkbara toxikologiska följder. Azitromycin har inte orsakat några toxiska reaktioner hos patienter när det administreras enligt rekommendationerna.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Citronsyra, vattenfri
Natriumhydroxid
Inkompatibiliteter
Zithromax IV infusionsvätska, lösning, får endast spädas enligt anvisningarna i avsnitt Särskilda anvisningar för destruktion och övrig hantering med de infusionsvätskor, lösningar, som anvisas. Inga andra substanser eller läkemedel ska adderas till Zithromax IV-beredningen, inte heller ska några andra substanser infunderas via samma intravenösa kanyl.
Hållbarhet
Pulver till infusionsvätska, lösning: 3 år.
Koncentrerad lösning upplöst enligt anvisningarna: kemisk och fysikalisk stabilitet kvarstår i 24 timmar i temperatur under 30 °C.
Utspädd lösning: kemisk och fysikalisk stabilitet kvarstår i 24 timmar vid temperatur under 30 °C, eller i 7 dagar i kylskåp (5 °C).
Ur mikrobiologisk synvinkel ska den rekonstituerade infusionslösningen användas omedelbart. Om den inte används omedelbart ansvarar användaren för förvaringstid och förvaringsförhållanden före användningen. I normala fall ska läkemedlet förvaras i högst 24 timmar vid 2 °C till 8 °C, såvida inte läkemedlet har lösts upp/spätts ut under kontrollerade och validerade aseptiska förhållanden.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Förvaringsanvisningar för läkemedlet efter rekonstitution, se avsnitt Hållbarhet.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ZITHROMAX IV infuusiokuiva-aine, liuosta varten
500 mg (L:ei) 1 kpl (79,90 €)
PF-selosteen tieto
Zithromax IV är förpackat i 10 ml injektionsflaskor av typ I-glas och förslutna med grå propp av butylgummi med aluminiumförsegling.
En injektionsflaska om 500 mg.
Läkemedlets utseende:
Vitaktigt eller vitt pulver.
Särskilda anvisningar för destruktion och övrig hantering
Azitromycin pulver till infusionsvätska, lösning, levereras i injektionsflaskor för engångsbruk.
Beredning
Upplösning
Tillsätt 4,8 ml sterilt vatten för injektionsvätskor till injektionsflaskan med azitromycin pulver för infusionsvätska, lösning (100 mg/ml azitromycin).
För tillsättning av vattnet rekommenderas en standardiserad 5 ml injektionsspruta så att mängden sterilt vatten för injektion är exakt 4,8 ml.
Skaka injektionsflaskan tills pulvret har lösts upp.
Spädning
Tillsätt 5 ml av azitromycinlösningen 100 mg/ml till lämplig mängd kompatibel infusionsvätska för att erhålla en slutlig mängd azitromycin infusionsvätska, lösning, med antingen 1,0 mg/ml eller 2,0 mg/ml.
Slutlig koncentration (mg/ml) infusionsvätska, lösning | Mängd infusionsvätska, lösning (ml) |
1,0 mg/ml | 500 ml |
2,0 mg/ml | 250 ml |
Det upplösta pulvret för infusion kan spädas med följande infusionsvätskor, lösningar:
0,9 % natriumklorid
5 % glukos och 0,45 % natriumklorid
5 % glukos
0,45% natriumklorid
Inspektera alltid parenterala läkemedel visuellt före administreringen avseende eventuella partiklar. Om det finns synliga partiklar i den färdigberedda lösningen ska denna kasseras.
Infusionens varaktighet: se avsnitt Dosering och administreringssätt.
Zithromax IV infusionsvätska, lösning, ska inte administreras som bolus eller intramuskulär injektion.
Ersättning
ZITHROMAX IV infuusiokuiva-aine, liuosta varten
500 mg 1 kpl
- Ei korvausta.
Atc-kod
J01FA10
Datum för översyn av produktresumén
09.06.2023
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
