PROSTIVAS koncentrat till infusionsvätska, lösning 0,5 mg/ml
Kvalitativ och kvantitativ sammansättning
1 milliliter innehåller 0,5 mg alprostadil.
Hjälpämne med känd effekt
Prostivas innehåller 790 mg vattenfri etanol i varje 1 ml ampull, vilket motsvarar 790 mg/ml (79 % w/v).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Koncentrat till infusionsvätska, lösning.
Kliniska uppgifter
Terapeutiska indikationer
Alprostadil är avsett för palliativ, inte kurativ, behandling för att temporärt hålla ductus arteriosus öppen tills korrigerande eller palliativ kirurgi kan utföras på nyfödda som har medfött hjärtfel och som är beroende av att ductus arteriosus är öppen för att överleva. Sådana medfödda hjärtfel inkluderar exempelvis atresi i mitralklaff, atresi i pulmonalklaff, pulmonalklaffstenos, atresi i trikuspidalklaff, Fallots tetrad, utvecklingsabnormitet i aortabågen, aortastenos eller transposition av de stora blodkärlen med eller utan andra fel.
Endast personal med medicinsk utbildning får använda koncentrat till infusionsvätska, lösning med alprostadil under omständigheter där pediatriska patienter kan få intensivvård och en barnintensivvårdsavdelning finns tillgänglig vid behov.
Dosering och administreringssätt
Vanligtvis startas infusionen med en dos som varierar från 0,05 till 0,1 mikrogram alprostadil per kg kroppsvikt per minut. När behandlingssvaret har uppnåtts ska infusionen minskas till den lägsta möjliga doseringen vid vilken den önskade effekten bibehålls. En lämplig infusionshastighet vid underhållsbehandling är ofta 0,01 mikrogram/kg/min.
Om den inledande dosen på 0,1 mikrogram/kg/min är otillräcklig kan dosen försiktigt ökas till högst 0,4 mikrogram/kg/min. I allmänhet förbättras dock inte svaret av att man ökar dosen. Det rekommenderas att Prostivas-koncentrat till infusionsvätska ges som en kontinuerlig infusion i en stor ven. Det kan också ges genom en navelartärkateter som placeras vid den duktala öppningen. Syresättningen i blodet (pO2) ökar på ett liknande sätt oavsett administreringsväg.
Administrering av infusion: En infusionspump med steglös hastighetsjustering ska användas till infusionen för att uppnå önskad effekt.
Spädning: 1 Prostivas-ampull (= 500 mikrogram PGE1/1 ml) späds med 100 ml 0,9 % natriumkloridlösning för infusion eller 5 % steril glukoslösning för infusion. Eftersom alprostadil är instabilt ska det förvaras i kylskåp (2–8 °C). Färska alprostadilspädningar ska förberedas var 24:e timme. Spädningar som är äldre än 24 timmar ska kasseras.
Infusionshastighet 0,6 ml/kg/h =
0,01 ml/kg/min =
0,05 mikrogram/kg/min i.v.
Alprostadilkoncentrationerna (mikrogram/ml) som anges i tabellen uppnås genom att 100, 250 och 500 mikrogram alprostadil tillsätts i de angivna mängderna av ett spädningsmedel.
| Tillsättning av alprostadil (mikrogram) | |||
| Total volym | 100 mikrogram (0,2 ml)* | 250 mikrogram (0,5 ml)* | 500 mikrogram (1,0 ml)* |
| 250 ml | 0,4 | 1,0 | 2,0 |
| 100 ml | 1,0 | 2,5 | 5,0 |
| 50 ml | 2,0 | 5,0 | 10,0 |
| 25 ml | 4,0 | 10,0 | 20,0 |
*tillsättning i milliliter.
Beräkning av infusionshastigheten:

Ett exempel: Ett nyfött barn med en vikt på 2,8 kg ska administreras 0,1 mikrogram/kg/min alprostadil när den resulterande koncentrationen som ska användas är 5 mikrogram/ml:
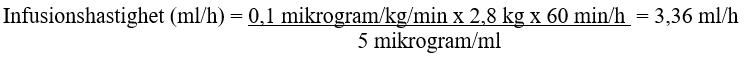
Pediatrisk population
Prostivas innehåller en mängd etanol som sannolikt påverkar barn (se avsnitt Varningar och försiktighet).
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Användningen av alprostadil ska undvikas hos nyfödda barn med respiratoriskt distressyndrom (RDS, hyalinmembransjukdom). Sjukdomen kan ibland feltolkas som cyanotisk hjärtsjukdom (begränsat blodflöde till lungorna). Om det inte finns någon lättillgänglig diagnosutrustning ska diagnosen baseras på förekomsten av cyanos (pO2 mindre än 40 torr) och begränsat blodflöde till lungorna som bekräftas genom röntgen.
Varningar och försiktighet
Alprostadil ska endast administreras av välutbildad sjukvårdspersonal och på inrättningar där det finns en barnintensivvårdsavdelning.
Apné förekommer hos cirka 10 till 12 procent av nyfödda med medfödda hjärtfel som får alprostadil (prostaglandin E1). Apné observeras oftast hos nyfödda som väger mindre än 2 kg vid födseln och uppkommer vanligtvis under den första timmen efter att infusionen har inletts.
Detta läkemedel ska endast användas under omständigheter där eventuell respiratorisk suppression kan behandlas snabbt. Om spädbarnet behöver flyttas till ett annat sjukhus ska en andningsslang vanligtvis sättas in före flytten.
Patologiska studier av ductus arteriosus och lungartärer hos spädbarn som behandlas med prostaglandin E1 har visat histologiska förändringar som är associerade med den försvagande effekten på dessa strukturer. Specificiteten och den kliniska relevansen av dessa resultat är inte kända.
Långvariga infusioner av alprostadil har orsakat kortikal proliferation i rörbenen hos nyfödda. Proliferationen upphörde hos spädbarnen efter utsättande av läkemedlet.
Försvagning av ductus arteriosus-kärlväggen och lungartärer har huvudsakligen rapporterats vid långvarig administrering.
Administreringen av alprostadil till nyfödda kan orsaka ventrikeltömningsobstruktion sekundärt till hyperplasi i antrum. Denna effekt tycks vara relaterad till behandlingens längd samt kumulativ dos av läkemedlet.
Nyfödda barn som får alprostadil i rekommenderade doser i mer än 120 timmar ska övervakas noggrant för att upptäcka eventuell hyperplasi i antrum och ventrikeltömningsobstruktion.
Läkemedlet ska infunderas under så kort tid som möjligt och med en så låg dos som möjligt som ger önskad effekt. Riskerna som är associerade med långvarig alprostadilinfusion ska vägas mot de potentiella fördelarna för det kritiskt sjuka spädbarnet.
Eftersom prostaglandin E1 (alprostadil) är starkt hämmande för trombocytaggregation ska försiktighet iakttas vid användning hos nyfödda med blödningstendens.
Artärtrycket ska mätas regelbundet hos alla nyfödda, med en navelartärkateter, auskultation eller en Doppler-transduktor. Om artärtrycket sjunker avsevärt ska infusionshastigheten minskas omedelbart.
Hos spädbarn med begränsat blodflöde till lungorna är ökningen av syresättningen av blodet omvänt proportionerlig till pO2-värdena före behandlingen. Till följd av detta uppnås det bästa terapeutiska svaret hos patienter med låga pO2-värden (mindre än 40 torr) och endast ett litet terapeutiskt svar uppnås hos patienter med höga pO2-värden (mer än 40 torr). Hos spädbarn med begränsat blodflöde till lungorna mäts den terapeutiska effekten genom förbättrad syresättning av blodet. Hos spädbarn med begränsat systemiskt blodflöde mäts den terapeutiska effekten genom förbättrat systemiskt blodtryck och pH-värden i blodet.
Information om hjälpämne
Varje 1 ml ampull med Prostivas innehåller 790 mg vattenfri etanol (se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING), vilket motsvarar mindre än 20 ml öl eller 8 ml vin.
Ett exempel på etanolexponering baserat på en infusionshastighet på 0,1 mikrogram/kg/minut under 24 timmar (se avsnitt Dosering och administreringssätt) är följande:
Administrering av 0,576 ml av detta läkemedel till ett barn som är 1 månad gammalt och väger 2 kg ger en exponering av 227,52 mg etanol per kg, vilket kan orsaka förhöjd alkoholkoncentration i blodet (BAC) motsvarande ungefär 37,9 mg/100 ml.
Som jämförelse, för en vuxen som dricker ett glas vin eller 500 ml öl, är alkoholkoncentrationen i blodet troligtvis ungefär 50 mg/100 ml.
Etanolinnehållet i denna beredning påverkar sannolikt barn. Dessa effekter kan innefatta somnolens och beteendeförändringar.
Eftersom detta läkemedel administreras långsamt under 24 timmar kan effekten av alkohol vara lägre (se avsnitt Dosering och administreringssätt).
Samtidig använding av läkemedel som innehåller t.ex. propylenglykol eller etanol, kan leda till ackumulering av etanol och orsaka biverkningar, särskilt hos yngre barn med låg eller outvecklad metaboliseringsförmåga.
Etanolinnehållet i detta läkemedel ska noggrant övervägas för följande patientgrupper som löper högre risk för etanolrelaterade biverkningar:
- Patienter med leversjukdom
- Patienter med epilepsi
Mängden etanol i detta läkemedel kan påverka effekten av andra läkemedel.
Interaktioner
Inga interaktioner har rapporterats mellan alprostadil och standardläkemedlen som används för att behandla nyfödda med medfödda hjärtfel. Standardläkemedlen som används vid behandling består vanligtvis av antibiotika (t.ex. penicillin eller gentamicin), vasopressorer (t.ex. dopamin), hjärtglykosider och diuretika (t.ex. furosemid).
Fertilitet, graviditet och amning
Ej relevant.
Effekter på förmågan att framföra fordon och använda maskiner
Ej relevant.
Biverkningar
De flesta biverkningarna orsakade av alprostadilinfusioner som har upptäckts hos nyfödda med medfödda hjärtfel och som är beroende av att ductus arteriosus är öppen för att överleva är associerade med kända farmakologiska effekter av alprostadil.
Följande biverkningar har observerats och rapporterats vid behandling med alprostadil (434 nyfödda behandlade) med följande frekvenser: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000).
Systemorganklass | Frekvens | Biverkningar |
Metabolism och nutrition | Vanliga | Hypokalemi |
Centrala och perifera nervsystemet | Vanliga | Epileptiska anfall |
Hjärtat | Vanliga | Bradykardi, hypotension, takykardi |
Andningsvägar, bröstkorg och mediastinum | Mycket vanliga | Apné |
Magtarmkanalen | Vanliga | Diarré |
Mindre vanliga | Ventrikeltömningsobstruktion, hypertrofi av magsäcksslemhinnan | |
Muskuloskeletala systemet och bindväv | Mindre vanliga | Exostos |
Blodkärl | Mindre vanliga | Vaskulär skörhet |
Allmänna symtom och/eller symtom vid administreringsstället | Mycket vanliga | Övergående feber |
Vanliga | Kutan vasodilatation (rodnad)* |
*Denna biverkning är direkt relaterad till administreringsvägen och är mer frekvent vid intraarteriell administrering.
Sambandet mellan följande biverkningar och alprostadil är okänt: sepsis (1,6 %), disseminerad intravasal koagulation (1,1 %), hjärtstillestånd (1,1 %), ödem (1,1 %).
Långvariga infusioner av alprostadil har visat sig orsaka kortikal proliferation i rörbenen.
Patologiska studier av ductus arteriosus och lungartärer hos spädbarn som behandlades med prostaglandin E1 har visat histologiska förändringar som är kompatibla med försvagning av dessa strukturer. Specificiteten och den kliniska signifikansen av dessa resultat är inte kända.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
Webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Överdosering av läkemedlet kan orsaka apné, bradykardi, feber, hypotension och rodnad. Om apné eller bradykardi uppträder ska infusionen avbrytas och lämplig behandling sättas in. Försiktighet ska iakttas om infusionen återupptas. Om feber eller hypotension uppträder ska infusionshastigheten minskas till dess att dessa symtom försvinner. Rodnad beror vanligtvis på felaktig placering av navelartärkatetern och kan oftast lindras genom omplacering av kateterspetsen.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: prostaglandiner, ATC-kod: C01EA01
Alprostadil (prostaglandin E1) är en naturlig fettsyra med flera farmakologiska effekter. De mest betydande är vasodilatation, hämmande av trombocytaggregation och stimulering av glatt muskulatur i tarm och uterus. När 1 till 10 mikrogram/kg alprostadil administreras intravenöst till däggdjur minskar den perifera resistensen, vilket leder till minskat blodtryck. Dessutom ökar hjärtminutvolym och hjärtfrekvens.
Den glatta muskulaturen i ductus arteriosus är särskilt känslig mot effekterna av alprostadil: substansen relaxerar prover tagna från ductus hos lamm avsevärt. Alprostadil återöppnar även stängd ductus hos nyfödda råttor, kaniner och lamm. Baserat på dessa resultat har användningen av alprostadil studerats hos spädbarn med medfödda fel som reducerar det pulmonella eller systemiska blodflödet och hos spädbarn där bibehållande av adekvat syresättning av blodet och lägre perfusion är beroende av att ductus arteriosus är öppen. I studierna reagerade hälften av spädbarnen med begränsat blodflöde till lungorna på alprostadilinfusion: pO2 för blod ökade med minst 10 torr (medelökning på cirka 14 torr och medelökning av syremättnaden på cirka 23 %). Det bästa behandlingssvaret uppnåddes generellt hos patienter som inte var mer än 4 dagar gamla med låga pO2 -värden före behandlingen. Hos spädbarn med begränsat systemiskt blodflöde ledde alprostadil ofta till ökat pH-värde i acidos, ökat systemiskt blodtryck och minskad kvot mellan pulmonellt artärtryck och aortatryck.
Verkningsmekanism: Verkningsmekanismen för alprostadil är okänd. Naturliga prostaglandiner kan dock hjälpa till att hålla ductus arteriosus öppen genom att relaxera den glatta muskulaturen i ductus.
Prostivas-koncentrat till infusionsvätska som ges som en kontinuerlig intraarteriell eller intravenös infusion dilaterar ductus arteriosus hos nyfödda.
Farmakokinetiska egenskaper
Alprostadil är en naturlig komponent i vävnaden hos däggdjur, men dess koncentrationer är normalt för låga för tillförlitlig mätning. Intravenöst eller intraarteriellt administrerad alprostadil metaboliseras snabbt hos djur och människor och distribueras i hela kroppen, med undantag för det centrala nervsystemet, där distributionen tydligt är mindre omfattande. Om lungorna fungerar normalt metaboliseras alprostadil i lungorna i stor utsträckning: 68–70 % hos människor, 87–95 % hos hundar och 90 % hos katter och kaniner. Den uppskattade halveringstiden för alprostadil och dess cirkulerande huvudmetabolit (13,14-dihydro-15-oxoprostaglandin E1) i plasma är 5–10 minuter när 0,2 till 0,5 mikrogram alprostadil administreras till människor som en intravenös engångsdos. En annan metabolit som uppmätts i betydande koncentrationer i plasma hos både råttor och hundar är 15-oxoprostaglandin E1. Den biologiska aktiviteten för båda dessa metaboliter är mycket lägre än för alprostadil. Metaboliterna av alprostadil elimineras huvudsakligen via njurarna. Ingen oförändrad alprostadil har uppmätts i urin. Utsöndringen av metaboliter i urin och avföring är fullständig inom 24 timmar efter att läkemedlet administreras. Det finns ingen evidens på vävnadsretention av alprostadil och dess metaboliter.
Prekliniska säkerhetsuppgifter
Inga långsiktiga karcinogenicitets- eller fertilitetsstudier har utförts. Ingen mutagenes har påvisats i Ames-analyser eller analyser med alkalisk eluering.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Etanol, vattenfri
Inkompatibiliteter
Om ospätt Prostivas-koncentrat till infusionsvätska kommer i direkt kontakt med en infusionsflaska av plast kan mjukgöringsmedel från flaskans väggar hamna i lösningen. Lösningen kan bli grumlig och plastens utseende kan förändras. Om detta händer ska lösningen kasseras och plastflaskan bytas ut mot en ny. Reaktionen beror på koncentrationen. För att förhindra att Prostivas-koncentrat till infusionsvätska blir grumlig ska den tillsättas direkt i infusionslösningen så att direkt kontakt med plastflaskan undviks.
Hållbarhet
Koncentrat till infusionsvätska: 3 år.
Utspättkoncentrat till infusionsvätska: Utspädningar av Prostivas-koncentrat till infusionsvätska är kemiskt och fysiskt stabila i 8 timmar efter spädning vid rumstemperatur, eller 24 timmar i kylskåp. Den utspädda lösningen ska användas omedelbart av mikrobiologiska anledningar. Om den inte används omedelbart ansvarar användaren för förvaringstiden och förvaringsförhållanden före användning, vilka normalt inte ska överstiga 24 timmar vid 2 till 8 °C, såvida inte spädningen har gjorts under kontrollerade och validerade aseptiska förhållanden.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C – 8 °C).
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
PROSTIVAS infuusiokonsentraatti, liuosta varten
0,5 mg/ml (L:ei) 1 ml (852,16 €)
PF-selosteen tieto
Ampuller gjorda av typ I-glas: 1 ml
Läkemedlets utseende:
Klar, färglös lösning.
Särskilda anvisningar för destruktion och övrig hantering
Koncentrat till infusionsvätska måste spädas före användning.
Se avsnitt 4.2 Dosering och administreringssätt, Spädning. Spädningar som är äldre än 24 timmar ska kasseras.
Ersättning
PROSTIVAS infuusiokonsentraatti, liuosta varten
0,5 mg/ml 1 ml
- Ei korvausta.
Atc-kod
C01EA01
Datum för översyn av produktresumén
29.08.2024
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
