SYNARELA nässpray, lösning 200 mikrog/dos
Kvalitativ och kvantitativ sammansättning
En milliliter spraylösning innehåller 2 mg nafarelin (som nafarelinacetat).
En dos innehåller 200 mikrogram nafarelin.
Hjälpämne med känd effekt
Detta läkemedel innehåller 0,01 mg bensalkoniumklorid per dos (= per 0,1 ml spray) motsvarande 0,1 mg/ml.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Nässpray, lösning
Kliniska uppgifter
Terapeutiska indikationer
Behandling av svår endometrios i högst sex månader.
Förbehandling vid in vitro ‑fertilisering (desensibilisering av hypofysen vid induktion av ovulation).
Preoperativ behandling av myom.
Rekommendation: Rekommendationen är att behandlingen sker endast under övervakning av en specialistläkare inom gynekologi och obstetrik.
Dosering och administreringssätt
Vid administrering ska huvudet böjas lätt nedåt och efter sprayningen lätt bakåt. En paus på 30 sekunder ska hållas mellan sprayningar.
Endometrios
Rekommenderad dygnsdos är en sprayning om 200 mikrogram Synarela i den ena näsborren på morgonen och en sprayning i den andra näsborren på kvällen (total dygnsdos 400 mikrogram) under sex månader.
En dos om 400 mikrogram framkallar nödvändigtvis inte amenorré hos samtliga patienter. Hos dessa patienter kan dygnsdosen ökas till 800 mikrogram om endometriossymtomen kvarstår.
Behandlingen sätts in på dag 2–4 i menstruationscykeln.
Nafarelin hämmar ovulation då det används regelbundet och i enlighet med dosrekommendationen. Patienter ska instrueras att använda icke‑hormonella preventivmedel. Om en dos uteblir är ovulation och graviditet möjliga.
Förbehandling vid in vitro ‑fertilisering
Behandlingen kan sättas in antingen på dag 1 eller 2 av follikelfas eller i mitten av lutealfas (dag 21 i menstruationscykeln). Doseringen är 400–800 mikrogram/24 h. En sprayning i någondera eller vardera näsborren både morgon och kväll.
Kliniska studier har visat att behandlingsresponsen är pålitligare vid en dos om 800 mikrogram/24 h.
Då steroidproduktionen har upphört efter 3–4 veckor borde behandling med gonadotropin sättas in tills tillräcklig follikelmognad uppnåtts. Därefter sker induktion av ovulation.
Preoperativ behandling av myom
En nafarelinsprayning (200 mikrogram) i den ena näsborren på morgonen och en sprayning i den andra näsborren på kvällen (total dygnsdos 400 mikrogram) under 3 månader.
Nässlemhinneavsvällande produkter får inte användas 30 minuter före eller efter administrering av Synarela.
Nysningar under administrering kan orsaka nedsatt absorption av läkemedlet. Om patienten nyser vid administrering, rekommenderas en ny dos.
Pediatrisk population
Regelbunden uppföljning, framför allt under de 3–6 första behandlingsmånaderna, krävs vid hjärnrelaterad för tidig pubertet för att kunna fastställa snabb hämning av hypofys‑gonadfunktionen.
Då nafarelinacetat ges i rekommenderad dos åt flickor med hjärnrelaterad för tidig pubertet kan bortfallsblödning förekomma hos vissa patienter i början, vanligtvis inom 6 veckor efter insättning av behandling. Därefter borde menstruationen upphöra.
Viktiga råd vid användning av Synarela‑sprayflaska
- Pumpen ska producera ett fint spraymoln, vilket bara kan ske genom ett snabbt och fast tryck. Det är normalt att se några större vätskedroppar i det fina molnet. Men om spraydosen kommer ut som en tunn vätskestråle istället för ett fint moln, så fungerar inte sprayen och då ska patienten kontakta apoteket för hjälp.
- Sprayspetsen ska rengöras efter aktivering av pumpen (vid tidpunkten för första användningen). Sprayspetsen ska sedan rengöras före och efter varje användning. Om spetsen inte rengörs kan det leda till att den täpps till, vilket kan medföra att patienten inte får rätt mängd av läkemedlet som förskrivits. Säkerhetsklämman och skyddshatten på sprayspetsen ska alltid sättas tillbaka efter användning för att förhindra att spetsen blir tilltäppt.
- Pumpen är utformad för att bara ge en förutbestämd mängd läkemedel, oavsett hur hårt den trycks.
- Undvik att göra det lilla hålet i sprayspetsen större. Om hålet i sprayspetsen görs större, kommer en felaktig dos av Synarela att levereras.
Aktivering av pumpen
Innan patienten använder en Synarela‑flaska första gången måste pumpen aktiveras. Detta behöver bara göras en gång, innan den första dosen tas.
1. Ta av och spara skyddshatten och säkerhetsklämman. Placera pek- och långfingret på flaskhalsens skulderdel på var sida om sprayspetsen och stöd samtidigt med tummen under flaskan. Håll flaskan upprätt så att sprayspetsen är riktad ifrån dig.
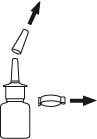
2. Aktivera pumpen genom att trycka flera gånger (vanligtvis cirka 5–7 gånger) kraftigt, jämnt och snabbt för att avlägsna luft tills spraydosen kommer som en fin, jämn spray ur sprayspetsen. När sprayflaskan aktiverats, behöver den inte aktiveras igen vid dagligt bruk. Läkemedel kommer att slösas om pumpen aktiveras varje gång den används.
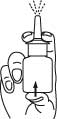
3. Rengör sprayspetsen efter aktivering av pumpen:
Håll flaskan vågrätt och skölj sprayspetsen med varmt vatten samtidigt som du gnuggar den med fingret eller en ren, mjuk trasa i 15 sekunder.
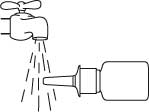
Rengör inte sprayspetsen med något vasst föremål. Detta kan leda till att pumpen levererar en felaktig dos av sprayen. Ta inte av pumpen från flaskan eftersom det nödvändiga trycket i flaskan släpps ut.
Torka av sprayspetsen med en ren, mjuk trasa eller näsduk.
Användning
1. Snyt dig för att rensa näsborrarna.

2. Ta av och spara skyddshatten och säkerhetsklämman. Håll flaskan så som visades tidigare.
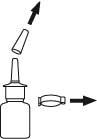
3. Rengör sprayspetsen.
Håll flaskan vågrätt och skölj sprayspetsen med varmt vatten samtidigt som du gnuggar den med fingret eller en mjuk trasa i 15 sekunder.
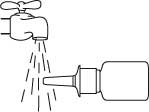
Rengör inte sprayspetsen med något vasst föremål. Detta kan leda till att pumpen levererar en felaktig dos av sprayen. Ta inte av pumpen från flaskan eftersom det nödvändiga trycket i flaskan släpps ut.
Torka av sprayspetsen med en ren, mjuk trasa eller näsduk.
4. Böj huvudet något nedåt. Tryck ihop den ena näsborren med ett finger och för doseringsspetsen in i den andra näsborren så att spetsen pekar mot den bakre delen och ytterväggen av näsan.
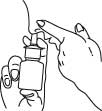
5. Pumpa snabbt och kraftigt en gång, samtidigt som du lugnt andas in genom näsborren.
Om din läkare har sagt till dig att ta 4 sprayningar varje dag ska du nu spraya också in i den andra näsborren.
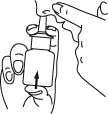
6. Ta ut sprayspetsen från näsborren och böj huvudet bakåt för några sekunder så att lösningen sprider sig över nässlemhinnan.

7. Rengör sprayspetsen.
Håll flaskan vågrätt och skölj sprayspetsen med varmt vatten samtidigt som du gnuggar den med fingret eller en mjuk trasa i cirka 15 sekunder.
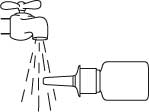
Rengör inte sprayspetsen med något vasst föremål. Detta kan leda till att pumpen levererar en felaktig dos av sprayen. Ta inte av pumpen från flaskan eftersom det nödvändiga trycket i flaskan släpps ut.
Torka av sprayspetsen med en ren, mjuk trasa eller näsduk.
Det är viktigt att rengöra sprayspetsen före och efter användning för att förhindra att den blir tilltäppt, vilket annars kan medföra att du får en felaktig dos av läkemedlet.
8. Placera tillbaka säkerhetsklämman och skyddshatten på sprayspetsen igen. Detta är viktigt för att förhindra att sprayspetsen blir tilltäppt.
Kontraindikationer
Nafarelinacetat får inte ges till patienter
- med överkänslighet mot den aktiva substansen, GnRH‑agonistanaloger eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen
- med odiagnostiserade onormala vaginala blödningar
- som är gravida
- som ammar.
Varningar och försiktighet
Nafarelin hämmar hormonproduktion i hypofysen och könskörtlarna (äggstockarna och testiklarna) då det används regelbundet och i enlighet med dosrekommendationen. Hypofys‑gonadfunktionen (endogen hormonproduktion) återställs till det normala vanligtvis 4–8 veckor efter utsättning av behandlingen. Diagnostiska test av hypofys‑gonadfunktionen under behandling och 4–8 veckor efter avslutad behandling kan därför ge felaktiga resultat.
Graviditet ska uteslutas innan behandling sätts in. Om patienten glömmer ta läkemedel kan det resultera i genombrottsovulation och eventuell befruktning. Därför ska patienter instrueras att använda icke‑hormonella preventivmedel.
Om patienten blir gravid under behandlingen ska behandlingen avbrytas och patienten ska informeras om eventuella risker för fostrets utveckling och/eller risk för eventuellt missfall. Eftersom det i denna patientpopulation finns en risk för missfall är orsakssambandet med nafarelinacetat oklart.
Liksom för andra läkemedel i denna grupp har ovarialcystor rapporterats under de två första behandlingsmånaderna med nafarelinacetat. Många, dock inte alla, av dessa inträffade hos patienter med polycystiskt ovariesyndrom.
Dessa förstorade cystor kan försvinna spontant, vanligen efter 4–6 veckors behandling. I vissa fall kan dock utsättning av läkemedlet och/eller kirurgiskt ingrepp bli nödvändigt.
Om fortsatt behandling med nafarelinacetat för endometrios eller fibrom övervägs efter en behandlingsomgång rekommenderas bentäthetsmätning innan ny behandling inleds för att kontrollera att värdena är normala.
Inga data finns tillgängliga om bentäthetsförändringar hos barn. Hos vuxna sågs knappt någon minskning av bentätheten i distala radius och andra metakarpalbenet efter 6 månaders behandling med nafarelinacetat. Minskning av vertebral trabekulär bentäthet och total vertebral benmassa var i genomsnitt 8,7 % respektive 4,3 %. Efter utsättning av behandlingen sågs avsevärd återhämtning av benmassan. Total vertebral benmassa, uppmätt med hjälp av dubbel fotonabsorptiometri, hade minskat i genomsnitt med 5,9 % i slutet av behandlingen. Då mätningen upprepades 6 månader efter behandlingen var medelvärdet för total vertebral benmassa endast 1,4 % lägre än före behandlingen.
Det finns inga kliniska data om användning av nafarelinacetat för kontrollerad ovariestimulering hos kvinnor med polycystiskt ovariesyndrom. Det kan emellertid finnas en möjlighet för överdriven follikelstimulering.
I kliniska studier har Synarela endast sällan konstaterats orsaka förhöjda värden vid leverfunktionstester. Emellertid rekommenderas uppföljning av S‑ASAT och S‑ALAT.
Liksom med andra GnRH-agonister har ovariellt hyperstimuleringssyndrom (OHSS), associerat med användning av nafarelin i kombination med gonadotropin, rapporterats. Patienter som inför in vitro-fertilisering får behandling för kontrollerad ovariestimulering ska övervakas noggrant. Vid tecken på OHSS ska behandlingen sättas ut (se avsnitt Biverkningar).
Det finns en ökad risk för depression (som kan vara allvarlig) hos patienter som behandlas med GnRH‑agonister, som nafarelinacetat. Patienter ska informeras om denna risk och behandlas på lämpligt sätt om symtom uppkommer.
Effekt och säkerhet av Synarela för behandling av barn under 18 år är inte fastställd.
Tillsvidare rekommenderas inte upprepad behandlingsomgång.
Nysning under eller omedelbart efter administrering kan försämra absorption av läkemedlet. Om patienten nyser vid administreringen kan ytterligare en dos behövas.
Om nässlemhinneavsvällande produkt behövs ska den administreras först 30 minuter efter administrering av nafarelinacetat (se avsnitt Interaktioner).
Information om hjälpämne
Synarela innehåller konserveringsmedlet bensalkoniumklorid. Långtidsbruk kan orsaka ödem i nässlemhinnan. Om långvarigt ödem i nässlemhinnan misstänks ska ett läkemedel för nasal bruk utan bensalkoniumklorid användas, om möjligt. Om ett sådant läkemedel för nasalt bruk inte är tillgängligt bör användning av andra formuleringar av läkemedlet övervägas.
Interaktioner
Inga farmakokinetiska interaktionsstudier har genomförts med nafarelinacetat. Eftersom nafarelinacetat är en peptid som främst bryts ner av peptidas, inte av cytokrom P450‑enzymer, och eftersom läkemedlet är till ungefär 80 % bundet till plasmaproteiner vid 4 °C, förväntas inga läkemedelsinteraktioner inträffa.
Rinit försämrar inte absorption av nafarelin i näsan. Hos patienter med perenn rinit som använde avsvällande oximetazolinhydroklorid 30 minuter före administrering av nafarelin minskade absorptionen av nafarelinacetat signifikant (med 39 % vid AUC0–8h och med 49 % vid Cmax) i jämförelse med den absorption som uppnåddes hos patienter med friska nässlemhinnor. Patienter som tar nafarelin ska undvika samtidig användning av avsvällande läkemedel (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Fertilitet, graviditet och amning
Graviditet
Säkerhet av användning av nafarelinacetat under graviditet har inte fastställts kliniskt.
I reproduktionstoxikologiska studier på råttor observerades fostertoxicitet vid doser som var 10 gånger större än humana doser vid nasal användning. Motsvarande toxicitet konstaterades inte hos möss eller kaniner (se avsnitt Prekliniska säkerhetsuppgifter).
Nafarelinacetat kan orsaka fosterskador om det används under graviditet (se avsnitt Prekliniska säkerhetsuppgifter). Därför är nafarelinacetat kontraindicerat under graviditet (se avsnitt Kontraindikationer).
Graviditet ska uteslutas innan behandling med Synarela sätts in.
Amning
Det är okänt om nafarelinacetat utsöndras i bröstmjölk. Eftersom effekten av nafarelinacetat på ammade spädbarn inte har utretts är amning kontraindicerad (se avsnitt Kontraindikationer).
Effekter på förmågan att framföra fordon och använda maskiner
Ej relevant.
Biverkningar
I början kan nafarelinbehandling orsaka övergående exacerbation av endometrios, medan långtidsbehandling kan inducera ett menopausalt tillstånd.
Biverkningsfrekvenserna har definierats enligt följande: Mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Följande biverkningar har observerats och rapporterats hos 282 vuxna patienter under behandling med nafarelinacetat:
Organsystem | Frekvens | Biverkningar |
Immunsystemet | Vanliga | läkemedelsöverkänslighet (bröstsmärta, andnöd, klåda, hudutslag, urtikaria) |
Endokrina systemet | Vanliga | estrogenbrist |
Metabolism och nutrition | Mycket vanliga | viktökning |
Vanliga | viktminskning | |
Psykiska störningar | Mycket vanliga | affektlabilitet, nedsatt libido |
Vanliga | depression, insomnia, ökad libido | |
Centrala och perifera nervsystemet | Mycket vanliga | huvudvärk |
Vanliga | parestesier | |
Blodkärl | Mycket vanliga | blodvallningar |
Vanliga | hypertoni, hypotoni | |
Andningsvägar, bröstkorg och mediastinum | Mycket vanliga | rinit |
Hud och subkutan vävnad | Mycket vanliga | akne, seborré |
Vanliga | hirsutism | |
Mindre vanliga | alopeci | |
Muskuloskeletala systemet och bindväv | Mycket vanliga | muskelsmärta |
Mindre vanliga | artralgi | |
Reproduktionsorgan och bröstkörtel | Mycket vanliga | minskad bröststorlek, vulvovaginal torrhet |
Vanliga | inducerad menopaus, livmoderblödning | |
Mindre vanliga | bröstförstoring, ovarialcysta | |
Ingen känd frekvens | Ovariellt hyperstimulationssyndrom | |
Allmänna symtom och/eller symtom vid administreringsstället | Mycket vanliga | ödem |
Undersökningar | Vanliga | Minskad bentäthet |
Följande biverkningar har observerats och rapporterats hos 155 pediatriska patienter under behandling med nafarelinacetat:
Organsystem | Frekvens | Biverkningar |
Immunsystemet | Vanliga | läkemedelsöverkänslighet (bröstsmärta, andnöd, klåda, hudutslag, urtikaria) |
Psykiska störningar | Vanliga | affektlabilitet |
Blodkärl | Vanliga | blodvallningar |
Andningsvägar, bröstkorg och mediastinum | Vanliga | rinit |
Hud och subkutan vävnad | Vanliga | akne, hirsutism, seborré, avvikande luktande hud |
Reproduktionsorgan och bröstkörtel | Vanliga | bröstförstoring, vaginal sekret, vaginal blödning |
Följande biverkningar har observerats och rapporterats under användning GnRH‑agonister (t.ex. buserelin, goserelin, histrelin, leuprorelin, nafarelin, triptorelin):
Organsystem | Frekvens | Biverkningar |
Centrala och perifera nervsystemet/psykiska störningar | Långvarig användning: Vanliga | affektlabilitet, depression |
Kortvarig användning: Mindre vanliga* | affektlabilitet, depression |
*Frekvensen kan vara högre för vissa produkter till följd av produkt‑ och indikationsspecifika kliniska studier.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Hos djur gav subkutan administrering av upp till 60 gånger den rekommenderade humana doser (mikrogram/kg nafarelin) inga biverkningar. Efter oral administrering genomgår nafarelinacetat enzymatisk nedbrytning i magtarmkanalen och är därför inaktivt.
Behandling av överdosering är symtomatisk och understödjande.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Gonadotropinfrisättande hormoner, ATC-kod: H01CA02
Nafarelin är ett potent agonistderivat av gonadoliberin (GnRH). Engångsdos nafarelin stimulerar frisättning av gonadotropiner, dvs. luteiniserande hormon (LH) och follikelstimulerande hormon (FSH), som i sin tur ger en ökning av steroidproduktion i äggstockarna och testiklarna. Vid upprepad administrering försvagas denna stimulering och med daglig dosering erhålls inom 3–4 veckor en minskad gonadotropinsekretion eller gonadotropiner med lägre biologisk aktivitet. Detta resulterar i minskad steroidproduktion och hämning av könshormonberoende vävnader och funktioner. Sekundär sexuell utveckling avstannar och tillväxt samt skelettutveckling blir långsammare.
Farmakokinetiska egenskaper
Efter nasal administrering absorberas nafarelin snabbt i den systemiska cirkulationen. Efter en dos om 400 mikrogram uppnås maximal plasmakoncentration inom 20 minuter. Halveringstiden i plasma är cirka 4 timmar hos vuxna och 2,6 timmar hos barn. Biologisk tillgänglighet av en nasalt administrerad dos är i genomsnitt 2,8 % (intervall 1,2–5,6 %). Ingen betydande ackumulation i kroppen observerades då 200 eller 400 mikrogram nafarelin administrerades två gånger per dygn i 22 dagar till 18 friska kvinnor.
Användning av nässlemhinneavsvällande produkter 30 minuter före administrering av nafarelin orsakade minskad absorption.
In vitro uppvisade nafarelin en plasmaproteinbindning på 78–84 %, huvudsakligen i albuminfraktion.
Då 14C‑nafarelin administrerades subkutant till tre försökspersoner utsöndrades 44–56 % av dosen i urinen och 19–44 % i avföringen. Cirka 3 % av dosen utsöndrades i urinen som oförändrat nafarelin. Totalt utsöndrades cirka 83 % av administrerad dos. Sex metaboliter har identifierats men deras biologiska aktivitet har inte definierats.
Prekliniska säkerhetsuppgifter
I likhet med andra GnRH‑agonister orsakar långvarig parenteral administrering av nafarelin i höga doser till gnagare hyperplasi och neoplasi i endokrina vävnader, även i frontal hypofys (adenom/karcinom) (både hos råttor och möss); tumörer i langerhanska öarna, binjuremärgen, testiklarna och äggstockarna förekom endast i långtidsstudier på råttor. Inga metastaser av dessa tumörer konstaterades. Inga tumörer eller proliferativa förändringar utvecklades då apor behandlades med höga nafarelindoser i ett år. Det finns ingen evidens om tumörframkallande egenskaper av GnRH‑analoger hos människa.
Ingen evidens om mutagenicitet har erhållits i studier på bakterier och däggdjursceller.
Reproduktionsstudier på hon‑ och hanråttor visade full reversibilitet av fertilitetshämning när produkten utsattes efter regelbunden administration under upp till 6 månader.
I en studie administrerades en intramuskulär dos om 0,4, 1,6 och 6,4 mikrog/kg/dygn (motsvarar en 0,6‑, 2,5‑ och 10‑faldig intranasal dos hos människa) till råttor på dag 6–15 av dräktigheten. I gruppen som fick den största dosen konstaterades allvarliga missbildningar hos 4 foster av 80. Detta observerades inte i en upprepad studie på råttor. Studier på möss och kaniner pekade inte heller på en ökning av fostermissbildningar. Hos råttor konstaterades dosberoende ökad mortalitet och nedsatt vikt hos foster vid den högsta undersökta dosen. Denna effekt på fostermortalitet hos råttor är en logisk följd av förändringar i hormonkoncentrationer hos denna djurart.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Sorbitol 50 mg/ml
Bensalkoniumklorid
Koncentrerad ättiksyra
Natriumhydroxid eller saltsyra (för pH justering)
Vatten, renat
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år.
Särskilda förvaringsanvisningar
Förvaras stående vid högst 25 °C. Förvaras i ytterkartongen. Får ej frysas.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
SYNARELA nenäsumute, liuos
200 mikrog/annos (L:ei) 60 annosta (122,00 €)
PF-selosteen tieto
4 ml = 30 doser, 8 ml = 60 doser
Sprayflaska av glas och med PVC‑hölje och mekanisk pump. Förpackad i en kartong som innehåller bipacksedeln.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Klar, färglös eller svagt gulaktig lösning.
Särskilda anvisningar för destruktion och övrig hantering
För att säkerställa att korrekt dos av läkemedel administreras är det viktigt att sprayspetsen rengörs efter aktivering (vid tidpunkten för första användningen). Sprayspetsen ska sedan rengöras före och efter varje användning för att förhindra att spetsen blir tilltäppt (se avsnitt Dosering och administreringssätt).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
SYNARELA nenäsumute, liuos
200 mikrog/annos 60 annosta
- Peruskorvaus (40 %).
Atc-kod
H01CA02
Datum för översyn av produktresumén
11.08.2022
Yhteystiedot
 PFIZER OY
PFIZER OY Tietokuja 4
00330 Helsinki
09 430 040
www.pfizer.fi
etunimi.sukunimi@pfizer.com
