ENANTON DEPOT DUAL pulver och vätska till injektionsvätska, suspension i förfylld spruta 3,75 mg, 11,25 mg
Kvalitativ och kvantitativ sammansättning
Enanton Depot Dual 3,75 mg: Den förfyllda sprutan innehåller 3,75 mg leuprorelinacetat motsvarande 3,57 mg leuprorelinbas.
Enanton Depot Dual 11,25 mg: Den förfyllda sprutan innehåller 11,25 mg leuprorelinacetat motsvarande 10,72 mg leuprorelinbas.
Hjälpämne med känd effekt
Enanton Depot Dual 3,75 mg och 11,25 mg innehåller polysorbat 1,0 mg/injektionsspruta.
För fullständig förteckning av hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver och vätska till injektionsvätska, suspension i förfylld spruta.
Kliniska uppgifter
Terapeutiska indikationer
Enanton Depot Dual 3,75 mg:
Behandling av avancerad prostatacancer
Behandling av svår endometrios och minskning av livmodermyom (leiomyomata uteri)
Pediatrisk population: Behandling av central pubertas praecox (flickor under 9 år, pojkar under 10 år).
Enanton Depot Dual 11,25 mg:
Behandling av avancerad prostatacancer
Pediatrisk population: Behandling av central pubertas praecox (flickor under 9 år, pojkar under 10 år).
Dosering och administreringssätt
Enanton Depot Dual injektionen ska ges subkutant.
Dosering
Prostatacancer:
En vanlig dos är 3,75 mg som en subkutan engångsdos var fjärde vecka eller 11,25 mg subkutant med tre månaders mellanrum. Behandlingen ska inte avbrytas tillfälligt eller avslutas i förtid då symptomen lindras eller tumören blir mindre.
Enanton Depot Dual ska ges med försiktighet till patienter med urinvägsobstruktion eller ryggmärgsskador, samt till patienter med risk för utveckling av dessa tillstånd (se även avsnitt Varningar och försiktighet).
Endometrios:
En vanlig dos är 3,75 mg som en subkutan engångsdos var fjärde vecka under högst 6 månader. Behandlingen bör inledas under dygn 1–5 av menstruationscykeln.
Livmodermyom:
Den rekommenderade dosen är 3,75 mg som en subkutan engångsdos var fjärde vecka under högst 3 månader.
Administreringssätt
Enanton Depot Dual-injektionen ska endast beredas, färdigställas och administreras av sjukvårdspersonal som är förtrogna med dessa rutiner.
Enanton Depot Dual ges som en subkutan injektion. Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Pediatrisk population
Behandling med leuprorelinacetat ska ske under övervakning av en pediatrisk endokrinolog.
Doseringen justeras individuellt.
Den rekommenderade startdosen beror på kroppsvikten.
Barn med kroppsvikt ≥ 20 kg
1 ml (3,75 mg leuprorelinacetat) lösning, som innehåller 44,1 mg långverkande mikrokapslar i 1 ml transportlösning, administreras subkutant som en engångsinjektion en gång i månaden.
1 ml (11,25 mg leuprorelinacetat) lösning, som innehåller 130,0 mg långverkande mikrokapslar i 1 ml transportlösning, administreras subkutant som en engångsinjektion var tredje månad.
Barn med kroppsvikt < 20 kg
Enanton Depot Dual 3,75 mg och 11,25 mg ska inte användas till barn med kroppsvikt under 20 kg då den förfyllda injektionssprutan inte är anpassad för doseringsvolymer mindre än 1 ml.
Den kvarblivna lösningen ska kasseras. Barnets viktökning ska övervakas.
Dosen ska eventuellt höjas enligt aktiviteten av central pubertas praecox, om suppressionen är otillräcklig (kliniska bevis, t.ex. stänkblödning eller otillräcklig suppression av gonadotropiner i LHRH-test).
Enanton Depot Dual 3,75 mg: Den lägsta effektiva månadsdosen bestäms enligt LHRH-testet.
Enanton Depot Dual 11,25 mg: Den lägsta effektiva dosen som ges med tre månaders mellanrum bestäms enligt LHRH-testet.
Den förfyllda sprutan som används i Enanton Depot Dual-preparaten är inte anpassad för doseringsvolymer mindre än 1 ml.
Sterila abscesser vid injektionsstället förekom ofta då leuprorelinacetat administrerades intramuskulärt i högre doser än de rekommenderade. I dessa fall ska läkemedlet därför ges subkutant (se avsnitt Varningar och försiktighet).
Det rekommenderas att ge de lägsta möjliga injektionsvolymerna till barn för att undvika obehag i samband med intramuskulär/subkutan injektion.
Behandlingens längd beror på kliniska parametrar (prognos för slutlig längd, tillväxthastighet, skelettålder och/eller accelererad skelettålder) som bestäms vid behandlingsstart eller under behandlingen, och längden bestäms av den behandlande läkaren tillsammans med barnets vårdnadshavare och (om lämpligt) med det behandlade barnet. Skelettåldern ska övervakas med 6–12 månaders mellanrum under behandlingen.
Om skelettåldern är över 12 år hos flickor eller över 13 år hos pojkar, ska utsättande av behandlingen övervägas med hänsyn till de kliniska parametrarna.
Behandling av en flicka får inte påbörjas innan graviditet har uteslutits. Förekomsten av graviditet under behandlingen kan vanligtvis inte uteslutas. I sådana fall ska en läkare kontaktas.
Obs:
Enanton Depot Dual 3,75 mg: Doseringsintervallet ska vara 30 ± 2 dygn för att förhindra återfall av symptom på central pubertas praecox.
Enanton Depot Dual 11,25 mg: Doseringsintervallet ska vara 90 ± 2 dygn för att förhindra återfall av symptom på central pubertas praecox.
Särskilda patientgrupper
Farmakokinetiken av leuprorelinacetat har inte studerats hos patienter med lever- eller njursvikt. Enstaka observationer har gjorts avseende skillnader i serumnivåer av leuprorelinacetat (se tilläggsinformation i avsnitt Farmakokinetiska egenskaper).
Kontraindikationer
Leuprorelinacetat är kontraindicerat vid följande fall:
- överkänslighet mot den aktiva substansen, något hjälpämne som anges i avsnitt Förteckning över hjälpämnen, syntetiskt GnRH eller GnRH-derivat
- onormal, odiagnostiserad vaginal blödning
- graviditet (eller misstanke om graviditet) och amning, se även avsnitt Fertilitet, graviditet och amning
-
flickor med central pubertas praecox:
- graviditet och amning
- odiagnostiserad vaginal blödning
Varningar och försiktighet
Enanton Depot Dual 3,75 mg innehåller renat gelatin, som i sällsynta fall kan orsaka en stark allergisk reaktion och anafylaktiska symptom (urtikaria, dyspné, ödem i läppar och struphuvud, o.s.v., se även avsnitt Biverkningar). Patienternas tillstånd ska observeras efter administrering av injektionen ifall av eventuella överkänslighetsreaktioner.
Leverfunktionen ska övervakas under behandling med leuprorelinacetat, eftersom förhöjt transaminas, AFOS, GT, LDH och bilirubin i serum kan uppkomma (se även avsnitt Biverkningar).
Det finns en ökad risk för depression (som kan vara allvarlig) hos patienter som behandlas med GnRH-agonister, såsom leuprorelinacetat. Patienterna ska informeras om risken och behandlas på lämpligt sätt om symptom uppkommer.
Långvarig estrogenbrist (på grund av bilateral ooforektomi, ovarieablation eller GnRH-agonistbehandling) eller androgenbrist (på grund av bilateral orkidektomi eller GnRH-agonistbehandling) är associerade med ökad risk för minskad mineralkoncentration i ben, vilket kan orsaka osteoporos och en ökad risk för benfraktur hos patienter med ytterligare riskfaktorer (se även avsnitt Biverkningar).
Efter marknadsintroduktion har epileptiska anfall upptäckts hos patienter som behandlats med leuprorelinacetat. Epileptiska anfall har förekommit både hos barn och vuxna, oberoende om patienten tidigare haft epilepsi, krampanfall eller utsättande riskfaktorer.
Hämning av endogen könshormonproduktion, under androgenbehandling eller på grund av estrogenbrist (hos menopausala kvinnor), är associerad med en ökad risk för metabola förändringar (såsom glukosintolerans och förvärring av diabetes och fettlever) samt för kardiovaskulära sjukdomar. Forskningsdata om ökad kardiovaskulär dödlighet är motstridiga. Patienter med en förhöjd risk för metabola förändringar, metabolt syndrom eller kardiovaskulära sjukdomar ska utvärderas noggrant innan behandlingen inleds och de ska övervakas noggrant under GnRH-behandlingen.
Idiopatisk intrakraniell hypertension
Idiopatisk intrakraniell hypertension (pseudotumor cerebri) har rapporterats hos patienter som fått leuprorelin. Patienterna ska varnas om tecken och symtom på idiopatisk intrakraniell hypertension, däribland svår eller återkommande huvudvärk, synstörningar och tinnitus. Om idiopatisk intrakraniell hypertension uppstår ska utsättning av leuprorelin övervägas.
Mycket allvarliga hudbiverkningar
Mycket allvarliga hudbiverkningar (SCARs), inklusive Stevens–Johnsons syndrom (SJS) och toxisk epidermal nekrolys (TEN) som kan vara livshotande eller dödliga, har rapporterats i samband med behandling med leuprorelin. Vid förskrivningstillfället ska patienten informeras om tecken och symtom och ska övervakas noga för allvarliga hudreaktioner. Om tecken och symtom som tyder på dessa reaktioner uppstår ska leuprorelin omedelbart sättas ut och en alternativ behandling ska övervägas (enligt vad som är lämpligt).
Prostatacancer
Leuprorelinacetat, som är ett potent GnRH-derivat som påverkar funktionen av hypofysen och könskörtlarna, kan i början av behandlingen öka testosteronkoncentrationen i serum övergående. Detta kan direkt efter den första injektionen orsaka förvärrad skelettsmärta, obstruktion av urinvägar, hematuri, svaghet i de nedre extremiteterna, parestesi och tillfällig försämring av patientens kliniska tillstånd (s.k. ”flare”-fenomen, se även avsnitt Biverkningar). Symptomen ska vanligtvis avta vid fortsatt behandling. För att minska risken för ”flare”-fenomenet kan patienten ges antiandrogen. Behandlingen i fråga inleds tre dagar innan behandling med Enanton Depot Dual och fortsätts i 2–3 veckor.
Patienter med urinvägsobstruktion eller ryggmärgsskada som orsakats av prostatacancer eller en metastas, ska övervakas noggrant under de första behandlingsveckorna, eftersom symptomen kan förvärras (se även avsnitt Biverkningar).
Serumkoncentrationerna av testosteron och PSA (prostate specific antigen) kan monitoreras för att fastställa behandlingssvaret av Enanton Depot Dual. Testosteronkoncentrationen stiger under den första veckan och sjunker efter detta. Kastrationsnivån (definierat 0,25 ng/ml) uppnås inom 2–4 veckor och bibehålls under hela behandlingsperioden.
Androgendeprivationsbehandling kan förlänga QT-intervallet. För patienter med QT-förlängning i anamnesen eller med riskfaktorer för QT-förlängning samt för patienter som samtidigt behandlas med andra läkemedel som kan förlänga QT-intervallet (se avsnitt Interaktioner), bör läkare bedöma nytta/risk-förhållandet inklusive risken för torsades de pointes, innan behandling med leuprorelinacetat påbörjas.
Endometrios och livmodermyom
Innan behandlingen inleds ska graviditet uteslutas (se avsnitt Kontraindikationer). Behandlingen inleds på den första till femte menstruationsdagen. Patienten ska använda icke-hormonell antikonception för att förhindra graviditet under behandlingen.
Innan behandlingen inleds ska man försäkras om endometriosdiagnosen och andra sjukdomar med liknande symptom (t.ex. maligna tumörer) ska uteslutas. Om tumörer upptäcks under behandlingen eller om ingen förbättring i det kliniska tillståndet sker, ska behandlingen med Enanton Depot Dual avslutas.
Enanton Depot Dual inducerar, liksom andra GnRH-analoger, övergående ökning av estradiolkoncentrationer i början av behandlingen.
Efter den första injektionen vid början av behandlingen kan patientens kliniska tillstånd försämras tillfälligt. Vid fortsatt behandling lättar dock symptomen.
Verkningstiden av en injektion med Enanton Depot Dual varar i 4 veckor, och injektioner givna mer sällan kan resultera i en försämring av patientens kliniska tillstånd. Rekommenderad administrering var 4:e vecka ska därför följas.
Minskad estrogenkoncentration som orsakas av leuprorelinacetat kan orsaka osteoporos och benfrakturer. På grund av detta ska behandlingen begränsas till 6 månader. Bentätheten ska övervakas noggrant om behandling med Enanton Depot Dual ska förnyas. Särskild försiktighet ska iakttas om osteoporos tidigare konstaterats hos patienten. Se även avsnitt Biverkningar.
Allvarlig vaginal blödning kan uppträda under behandling med Enanton Depot Dual. Noggrann övervakning av patienten är därför motiverad och då blödningen uppträder ska adekvata behandlingsåtgärder påbörjas.
Pediatrisk population
Innan behandlingsstart är det nödvändigt att noggrant definiera idiopatisk och/eller neurogen central pubertas praecox.
Behandlingen är långvarig och individuell. Enanton Depot Dual 3,75 mg ska ges så exakt som möjligt med en månads mellanrum. I undantagsfall kan tidpunkten flyttas med några dygn (30 ± 2 dygn). Enanton Depot Dual 11,25 mg ska ges så exakt som möjligt med tre månaders mellanrum. I undantagsfall kan tidpunkten flyttas med några dygn (90 ± 2 dygn). Detta påverkar inte behandlingsresultatet.
Utvecklingen av sterila abscesser vid injektionsstället (huvudsakligen rapporterat i samband med intramuskulär injektion av högre doser än rekommenderat) kan minska absorptionen av leuprorelinacetat. Hormonkoncentrationer (testosteron, estradiol) ska då kontrolleras med 2 veckors mellanrum (se avsnitt Dosering och administreringssätt).
Om barnet har en progressiv hjärntumör ska behandlingens risker och nyttor bedömas noggrant innan behandlingen inleds.
Vaginal blödning, stänkblödning och flytningar kan förekomma hos flickor efter den första injektionen. Detta är ett tecken på avstannad hormonutsöndring. Om vaginal blödning fortsätter ännu efter den första eller andra behandlingsmånaden, ska orsaken utredas.
Bentätheten kan minska vid användning av GnRH-agonister vid behandling av central pubertas praecox. Efter avslutad behandling kvarstår dock tillväxten av benmassan och maximal benmassa sent i ungdomsåren verkar inte påverkas av behandlingen.
Epifysglidning i lårbenet kan ske vid utsättning av GnRH-behandling. Det har visats att en låg estrogenkoncentration under behandling med GnRH-agonister försvagar epifysskivan. Tillväxten försnabbas efter avslutad behandling, vilket minskar transversalkraften som krävs för att förskjuta epifysen.
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Enanton Depot Dual innehåller polysorbat. Polysorbater kan orsaka allergiska reaktioner.
Interaktioner
Eftersom androgendeprivationsbehandling kan förlänga QT-intervallet, bör en noggrann övervägning göras av samtidig användning av leuprorelinacetat med läkemedel som förlänger QT-intervallet eller som kan framkalla torsades de pointes, såsom klass IA antiarytmika (t.ex. kinidin, disopyramid) eller klass III antiarytmika (t.ex. amiodaron, sotalol, dofetilid, ibutilid), metadon, moxifloxacin, antipsykotika, o.s.v. (se avsnitt Varningar och försiktighet).
Fertilitet, graviditet och amning
Leuprorelinacetat ska inte ges till gravida kvinnor. Kvinnor i fertil ålder ska använda en effektiv preventivmetod under behandling med Enanton Depot Dual. Se avsnitt Kontraindikationer Kontraindikationer.
Det är inte känt om depot leuprorelinacetat utsöndras i bröstmjölk. Eftersom effekterna av leuprorelinacetat på amning eller barn som ammas är okända, ska kvinnor som behandlas med Enanton Depot Dual inte amma under behandlingen.
Effekter på förmågan att framföra fordon och använda maskiner
Enanton Depot Dual kan ha en effekt på förmågan att framföra fordon och använda maskiner, eftersom trötthet, synstörningar och yrsel ha rapporterats under behandling med leuprorelinacetat. Detta ska beaktas vid bilkörning eller användning av maskiner.
Biverkningar
Allmänt (alla indikationer)
Såsom med andra preparat som tillhör denna grupp, har hypofysär apoplexi rapporterats som en mycket sällsynt biverkning hos patienter med hypofystumör, till följd av den första leuprorelinacetatdosen.
Biverkningarnas frekvensklasser är definierade enligt följande: Vanliga (≥ 1/100 och < 1/10), mindre vanliga (≥ 1/1 000 och < 1/100), sällsynta (≥ 1/10 000 och < 1/1 000), mycket sällsynta (< 1/10 000) inklusive enstaka rapporter och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Patienter med prostatacancer:
”Flare”-fenomen: Skelettsmärta, urinvägsobstruktion och svaghet i nedre extremiteter, parestesier (se även avsnitt Varningar och försiktighet) (hos ≥ 5 % av patienterna).
Organsystem | Vanliga | Mindre vanliga | Sällsynta | Mycket sällsynta | Ingen känd frekvens |
Blodet och lymfsystemet | Anemi, trombocytopeni | ||||
Immunsystemet | Överkänslighet, utslag, klåda, urtikaria, vinande andning, feber, frossa och anafylaktisk reaktion | ||||
Metabolism och nutrition | Viktförändringar, anorexi, förhöjda totalkolesterol-, triglycerid- eller glukos-koncentrationer i serum, hyperkalemi, förhöjda koncentrationer av urinsyra | Metabolt syndrom (hypertension, dyslipidemi, insulin-resistens, försvagad insulin-tolerans), fettlever | |||
Psykiatriska tillstånd | Humör-svängningar, depression, sömnlöshet | ||||
Centrala och perifera nervsystemet | Huvudvärk, yrsel, parestesi | Hypofysär apoplexi | Epileptiskt anfall, idiopatisk intrakraniell hypertension (pseudotumor cerebri) (se avsnitt Varningar och försiktighet) | ||
Ögon | Synstörningar | ||||
Öron och balansorgan | Dövhet, tinnitus | ||||
Hjärtat | Onormala EKG-fynd, ökad kardiothorakal kvot | Palpitationer, QT-förlängning (se avsnitt Varningar och försiktighet och Interaktioner) | |||
Blodkärl | Värme-vallningar | Värmekänsla i ansikte | Trombos | ||
Andningsvägar, bröstkorg och mediastinum | Lungemboli | Interstitiell lungsjukdom | |||
Magtarm-kanalen | Illamående, kräkningar | Diarré | |||
Lever och gallvägar | Förhöjda LDH-koncentrationer, funktions-störning i levern (ikterus) | Förhöjda serumkoncentrationer av transaminaser, GT-AFOS och bilirubin | |||
Hud och subkutan vävnad | Svettning | Dermatit, hårväxt på huvudet, utslag, klåda | Steven–Johnsons syndrom/toxisk epidermal nekrolys (SJS/TEN) (se avsnitt Varningar och försiktighet), toxiskt hudutslag, erythema multiforme, utslag med blåsor, exfoliativ dermatit, akut generaliserad exantematös pustulos (AGEP) | ||
Muskulo-skeletala systemet och bindväv | Muskelsvaghet | Artralgi eller skelettsmärta, smärta i axlarna, nedre ryggen eller extremiteterna | Myalgi | Osteoporos (inklusive ryggrads-fraktur), minskad mineral-koncentration i benen | |
Njurar och urinvägar | Pollakisuri, hematuri, förhöjda ureakoncentrationer i serum | ||||
Reproduktions-organ och bröstkörtel | Minskad libido, impotens, testikelatrofi | Gynekomasti, obehag i perinealregionen | |||
Allmänna symptom och/eller symptom vid administrerings-stället | Reaktion vid injektionsstället, värmekänsla | Svårigheter att gå, ödem, tryckkänsla i bröstet, stelhet, sjukdomskänsla, trötthet, feber. Smärta, induration eller rodnad vid injektionsstället. | Abscess vid injektionsstället |
Patienter med endometrios:
Organsystem | Vanliga | Mindre vanliga | Sällsynta | Mycket sällsynta | Ingen känd frekvens |
Infektioner och infestationer | Vaginit | ||||
Blodet och lymfsystemet | Erytrocytos, leukopeni, trombocytopeni, förlängd partiell tromboplastintid | Anemi | |||
Immunsystemet | Överkänslighet, utslag, klåda, urtikaria, vinande andning, feber, frossa och anafylaktisk reaktion | ||||
Metabolism och nutrition | Vikt-förändringar | Förhöjd serumkoncentration av fosfor, hyperkalcemi, hyperkalemi, förhöjda serumkoncentrationer av totalkolesterol, LDL-kolesterol och triglycerider, anorexi | Metabolt syndrom (hypertension, dyslipidemi, insulinresistens, försvagad insulintolerans), fettlever | ||
Psykiatriska tillstånd | Emotionell labilitet, sömnlöshet | Humörsvängningar, depression, irritabilitet, nedstämdhet | |||
Centrala och perifera nervsystemet | Huvudvärk, yrsel, parestesi, svettning | Domning i extremiteterna, karpaltunnel-syndrom | Hypofysär apoplexi | Epileptiskt anfall, idiopatisk intrakraniell hypertension (pseudotumor cerebri) (se avsnitt Varningar och försiktighet) | |
Ögon | Synstörningar | ||||
Öron och balansorgan | Tinnitus | ||||
Hjärtat | Palpitationer | Förlängt QT-intervall (se avsnitt Varningar och försiktighet och Interaktioner) | |||
Blodkärl | Värme-vallningar, värmekänsla | Förhöjt blodtryck | Trombos | ||
Andningsvägar, bröstkorg och mediastinum | Lungembolism | Interstitiell lungsjukdom | |||
Magtarmkanalen | Illamående, kräkningar, buksmärta, uppblåsthet, diarré, förstoppning, stomatit, domning i läpparna | ||||
Lever och gallvägar | Förhöjda serum-koncentrationer av transaminas, LDH, γ-GT, AFOS och bilirubin, funktionsstörning i levern (ikterus) | ||||
Hud och subkutan vävnad | Akne, torr hud, alopeci, hirsutism, förändringar i naglarna, utslag, klåda | Steven–Johnsons syndrom/toxisk epidermal nekrolys (SJS/TEN) (se avsnitt Varningar och försiktighet), toxiskt hudutslag, erythema multiforme, utslag med blåsor, exfoliativ dermatit, akut generaliserad exantematös pustulos (AGEP) | |||
Muskuloskeletala systemet och bindväv | Ledsmärta, skelettsmärta, muskelsvaghet, stelhet i axlarna | Stela leder, smärta i bäckenområdet, myalgi, smärta i de nedre extremiteterna, osteoporos | Osteoporos (inklusive ryggrads-fraktur), minskad mineral-koncentration i benen | ||
Njurar och urinvägar | Pollakisuri, smärtsam urinering, förhöjda ureakoncentrationer i serum | ||||
Reproduktions-organ och bröstkörtel | Vaginal torrhet, ömma bröst | Vaginal blödning, minskad libido, dyspareuni, ökade vitflytningar, ovarial hyperstimulerings-syndrom, uppsvullnad eller atrofi av bröst | |||
Allmänna symptom och/eller symptom vid administrerings-stället | Smärta, induration och rodnad vid injektionsstället, trötthet, sjukdomskänsla, obehaglig känsla vid bröstet, svullnad, törst | Abscesser vid injektionsstället |
Dessutom kan metabola förändringar (t.ex. glukosintolerans eller förvärring av diabetes) eller en ökad risk för kardiovaskulära händelser förekomma hos manliga patienter vid användning av GnRH-analoger.
Pediatrisk population:
I början av behandlingen kan det uppstå en tillfällig ökning av könshormonkoncentrationen, följt av en minskning av nivåerna till värden inom det prepubertala området. På grund av denna farmakologiska effekt kan biverkningar uppträda, särskilt i början av behandlingen.
Organsystem | Vanliga | Mycket sällsynta | Ingen känd frekvens |
Metabolism och nutrition | Fettlever | ||
Immunsystemet | Överkänslighet, utslag, klåda, urtikaria, vinande andning, feber, frossa och anafylaktisk reaktion | ||
Psykiatriska tillstånd | Humörsvängningar, depression | ||
Centrala och perifera nervsystemet | Huvudvärk | Hypofysär apoplexi | Epileptiskt anfall, idiopatisk intrakraniell hypertension (pseudotumor cerebri) (se avsnitt Varningar och försiktighet) |
Andningsvägar, bröstkorg och mediastinum | Interstitiell lungsjukdom | ||
Magtarmkanalen | Buksmärta/magkramper, illamående/kräkningar | ||
Hud och subkutan vävnad | Akne | Steven–Johnsons syndrom/toxisk epidermal nekrolys (SJS/TEN) (se avsnitt Varningar och försiktighet), toxiskt hudutslag, erythema multiforme, utslag med blåsor, exfoliativ dermatit, akut generaliserad exantematös pustulos (AGEP) | |
Muskuloskeletala systemet och bindväv | Myalgi | ||
Reproduktionsorgan och bröstkörtel | Vaginal blödning, stänkblödning, flytningar* | ||
Allmänna symptom och/eller symptom vid administreringsstället | Reaktioner vid injektionsstället |
*) Vaginal stänkblödning vid fortsatt behandling (följt av eventuell bortfallsblödning den första behandlingsmånaden) kan vara ett tecken på underdosering. Suppression av hypofysen ska då bestämmas med ett LHRH-test.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Patienten ska övervakas noggrant vid överdoseringsfall och behandlas symptomatiskt.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Endokrinterapi, gonadotropinfrisättande hormonanaloger, ATC-kod: L02AE02.
Den aktiva substansen i Enanton Depot Dual-preparaten är leuprorelinacetat, en långverkande GnRH (LHRH)-analog som vid långvarig användning med terapeutiska doser fungerar som en potent hämmare av gonadotropinfrisättningen. Leuprorelinacetat är ca 100 gånger mer potent än naturligt GnRH-hormon.
I studier på människor och djur har steroidogen suppression av ovarier och testiklar observerats efter den stimulering som sker i början av långvarig behandling med leuprorelinacetat. Funktionen av äggcellerna och testiklarna är reversibel efter utsättning av behandlingen.
Hos människor orsakar leuprorelinacetat i början en ökning av koncentrationen av luteiniserande hormon (LH) och follikelstimulerande hormon (FSH), vilket leder till en övergående ökning av gonadsteroidnivåer både hos män och kvinnor. Kontinuerlig administrering av leuprorelin minskar dock gonadotropin- och könssteroidkoncentrationerna. Denna effekt kan observeras inom 2–4 veckor efter behandlingsstart.
Vid behandling av endometrios med leuprorelinacetat sjunker patientens estrogenproduktion. Detta medför en reducerad bentäthet. På grund av detta får behandlingen med Enanton Depot Dual inte pågå längre än 6 månader utan ersättande estrogenbehandling.
Pediatrisk population:
Frigörelsen av gonadotropiner från hypofysen hämmas reversibelt och koncentrationerna av estradiol (E2) eller testosteron minskar till en prepubertal nivå.
Stimulering av könskörtlar kan till en början orsaka vaginal blödning hos flickor, vars menstruation börjat innan behandlingen inleds. Tömningsblödning kan uppträda vid början av behandlingen. Blödningen avstannar vanligtvis då behandlingen fortsätter.
Potentiella terapeutiska effekter är:
- suppression av basala och stimulerade gonadotropnivåer till prepubertala nivåer
- suppression av prematur ökning av könshormoner till prepubertala nivåer och avstannande av prematur menstruation
- avstannande/tillbakagång av somatisk pubertal utveckling (Tannerskalan)
- förbättring/normalisering av förhållandet mellan kronologisk ålder och skelettålder
- förebyggande av progressiv acceleration av skelettålder
- reducerad och normaliserad tillväxthastighet
- ökning av slutlig kroppslängd.
Behandlingen resulterar i att funktionen av den patologiskt och prematurt aktiverade hypotalamus-hypofys-gonadaxeln återställs till en prepubertal nivå.
I en långvarig klinisk studie, där barn som behandlats med leuprorelin med doser upp till 15 mg/månad i över 4 år, observerades att pubertetsutvecklingen återupptogs efter avslutad behandling. 20 flickor uppföljdes till vuxen ålder. 80 % av dessa 20 flickor som studerades hade en normal menstruationsrytm, och 7 flickor hade totalt 12 graviditeter, inklusive flerbördsgraviditet hos 4 personer.
Farmakokinetiska egenskaper
Leuprorelinacetat absorberas inte vid peroral administrering. Biotillgängligheten efter en subkutan injektion är i stort sett fullständig (94 %). Plasmakoncentrationen av leuprorelin stiger initialt till sin topp ca 3 timmar efter injektionen, och efterföljs av en minskning till underhållsnivån inom 7–14 dagar. Leuprorelin frigörs jämnt från 3,75 mg Depot-preparatet under ca 28 dagar, och från 11,25 mg Depot-preparatet i t.o.m. över 3 månader och resulterar i en minskning av testosteronkoncentrationen under kastrationsnivån inom 4 veckor hos de flesta patienterna.
Efter subkutan administrering elimineras leuprorelin bifasiskt från plasma. Läkemedlets kinetik är linjär. Halveringstiden i plasma är kort, cirka 3 timmar (2,6–3,8 h), efter båda administreringssätten. Plasmaproteinbindningen för leuprorelin är 43–49 %. Exogent GnRH distribueras i stor utsträckning i extracellulärvätskan, och distributionsvolymen är 27–36 l. Leuprorelin sönderfaller enzymatiskt och utsöndras via njurarna.
Farmakokinetiken av leuprorelinacetat har inte studerats hos patienter med lever- eller njursvikt. Vid kronisk njursvikt har höga leuprorelinkoncentrationer uppmätts i vissa fall, medan man hos patienter med leversvikt såg lägre leuprorelinkoncentrationer. Denna observation saknar dock klinisk betydelse.
Metabolismen, distributionen och utsöndringen av leuprorelinacetat har inte bestämts fullständigt hos människa.
Data om utsöndring av leuprorelin i bröstmjölk eller passering till placentan saknas.
Pediatrisk population
Enanton Depot Dual 3,75 mg:
Figur 1 visar serumkoncentrationer av leuprorelin efter en subkutan engångsinjektion av leuprorelinacetat i depotformat då dosen var 30 µg/kg. Maximala serumkoncentrationer uppnåddes 60 minuter efter administreringen (7,81 ± 3,59 ng/ml). AUC0-672 är 105,78 ± 52,40 ng x h/ml.
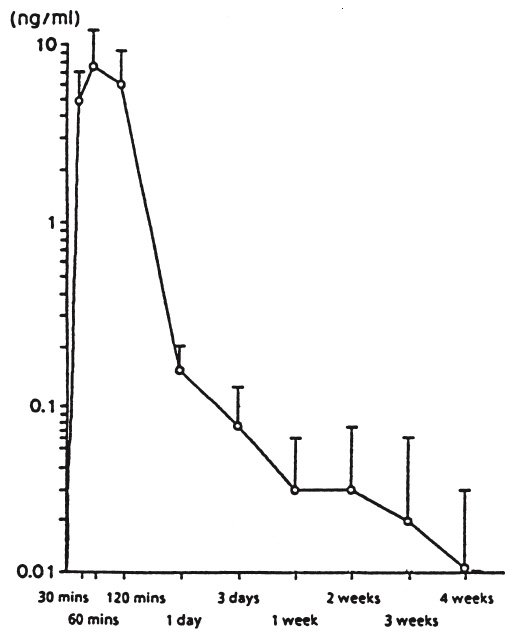
Figur 1: Serumkoncentrationer av leuprorelin efter en subkutan engångsinjektion av leuprorelinacetat i depotformat då dosen var 30 µg/kg (n = 6) (median ± standardavvikelse).
Enanton Depot Dual 11,25 mg:
Serumkoncentrationerna av leuprorelin efter en subkutan, depotformad leuprorelinacetatinjektion (två subkutana injektioner) som administrerats med tre månaders mellanrum under de första sex behandlingsmånaderna är presenterade i figur 2.
Efter den första injektionen uppnåddes den maximala serumkoncentrationen av leuprorelin vid månad 4 (294,79 pg/ml ± 105,42), varefter de minskade något fram till månad 6 (229,02 pg/ml ± 103,33).
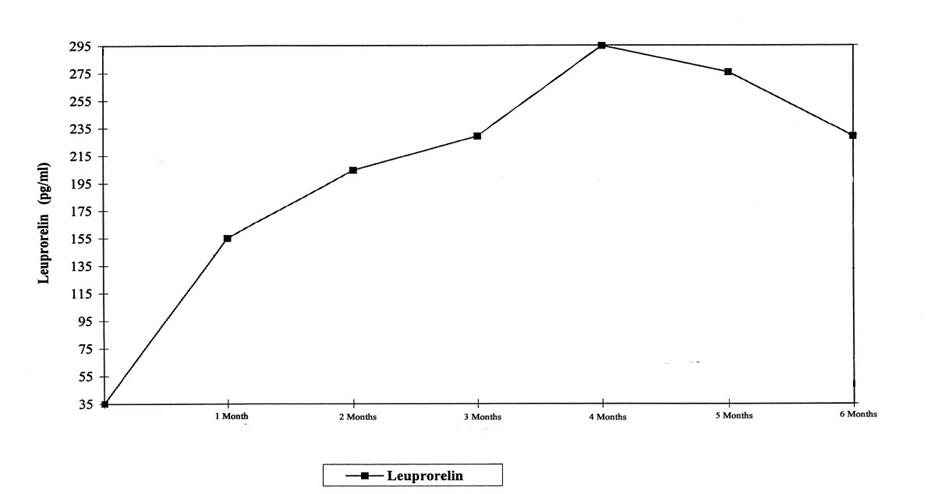
Figur 2: Serumkoncentrationer av leuprorelin efter en subkutan, depotformad leuprorelinacetatinjektion (två subkutana injektioner) som administrerats med tre månaders mellanrum under de första sex behandlingsmånaderna (n = 42–43).
Prekliniska säkerhetsuppgifter
Akut toxicitet (LD50)
Akut toxicitet av leuprorelinets depot-formulering har studerats hos han- och honmöss och -råttor med fyra administreringssätt (i.p., i.m., s.c. och p.o.). Inga dödsfall hos försöksdjuren har observerats med leuprorelindoserna 2 000 mg och 5 000 mg.
Toxicitet vid upprepad dos
Kroniska toxicitetsstudier som varade 13 veckor har utförts hos råttor och hundar med 8 mg leuprorelinacetat per kg kroppsvikt per vecka. I 12 månaders toxicitetsstudier användes leuprorelinacetat med doser på 32 mg/kg/månad.
Lokala hudskador vid injektionsstället förekom med alla dosnivåer (den lägsta testade dosen var 0,8 mg leuprorelinacetat/kg/månad), och dessutom upptäcktes atrofiska förändringar i reproduktionsorganen. Hos råttor utvecklades blåsor på både levern och njurtubulus epitelceller med alla doser. Förändringar i könsorganen orsakas av läkemedlets endokrina effekter.
Karcinogenicitet, mutagenicitet, effekter på fertiliteten
Karcinogenicitet
Karcinogenicitetsstudier på två år har utförts hos råtta och mus. En dosberoende ökning av hypofysadenom upptäcktes hos råtta då 0,6–4 mg leuprorelin gavs dagligen. Hos möss utvecklades inga hypofysadenom trots att doser på 60 mg/kg användes under två års tid.
Mutagenicitet
In vitro- och in vivo-studier med leuprorelinacetat har inte visat någon potentiell mutagenicitet då genetiska mutationer och kromosommutationer har undersökts.
Fertilitet
Då administreringen av leuprorelin avslutades ökade livmoderns och ovariernas vikt, hormonkoncentrationerna steg och en färsk gulkropp konstaterades hos könsmogna honråttor. I denna studie användes 10 µg subkutant två gånger per dag i 14 dagar eller 40 µg subkutant i 13 dagar
Då han- och honråttor gavs leuprorelin kontinuerligt i 3 månader (200 µg/kg/dag) eller intermittent (0,8 eller 2,4 mg/kg/månad), utvecklades genitalierna normalt. Inga avvikelser observerades i F1-generationen. F1-generationens beteende studerades inte.
Kliniska och farmakologiska studier har visat att fertiliteten var reversibel senast 24 veckor efter avslutad administrering av läkemedlet.
Reproduktionstoxicitet
Studier med råtta och kanin visade ingen teratogenicitet. Fostertoxicitet eller -dödlighet har noterats hos kaniner med dosen > 0,24 µg/kg.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Enanton Depot Dual 3,75 mg:
Pulver till injektionsvätska:
Poly(mjölksyra-glykolsyra) blandpolymer (75:25 mol%)
Mannitol
Gelatin
Vätska:
Mannitol
Karmellosnatrium
Polysorbat 80
Ättiksyra, koncentrerad (för pH-justering)
Vatten för injektionsvätskor
Enanton Depot Dual 11,25 mg:
Pulver till injektionsvätska:
Poly(mjölksyra)
Mannitol
Vätska:
Mannitol
Karmellosnatrium
Polysorbat 80
Ättiksyra, koncentrerad (för pH-justering)
Vatten för injektionsvätskor
Inkompatibiliteter
Då blandbarhetsstudier saknas får Enanton Depot Dual 3,75 mg eller Enanton Depot Dual 11,25 mg inte blandas med andra läkemedel.
Hållbarhet
3 år.
Efter beredning ska suspensionen användas omedelbart.
Särskilda förvaringsanvisningar
Förvaras i skydd mot kyla. Får ej frysas.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
3,75 mg (L:ei) 3,75 mg (136,43 €)
11,25 mg (L:ei) 11,25 mg (346,32 €)
PF-selosteen tieto
Enanton Depot Dual 3,75 mg pulver och vätska till injektionsvätska, suspension i förfylld spruta:
1 x 3,75 mg (en tvåkammarspruta [glas, Ph. Eur. typ I, gummiproppar av silikoniserat klorobutylgummi], med injektionsnål [23 G] med säkerhetsskydd).
3 x 3,75 mg (3 tvåkammarsprutor [glas, Ph. Eur. typ I, gummiproppar av silikoniserat klorobutylgummi], med injektionsnål [23 G] med säkerhetsskydd).
Enanton Depot Dual 11,25 mg pulver och vätska till injektionsvätska, suspension i förfylld spruta:
1 x 11,25 mg (en tvåkammarspruta [glas, Ph. Eur. typ I, gummiproppar av silikoniserat klorobutylgummi], med injektionsnål [23 G] med säkerhetsskydd).
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Vitt pulver och klar, färglös lösning.
Särskilda anvisningar för destruktion och övrig hantering
Beredning och administrering av injektionsvätskan
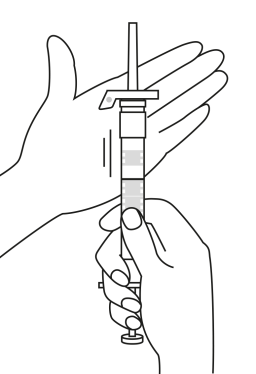
Pulvret och vätskan till injektionsvätskan ska blandas ihop före användningen. OBS! Dra aldrig tillbaka kolven under beredning, detta kan orsaka separation vid propparna vilket kan medföra läckage mellan propparna eller vid kolven.
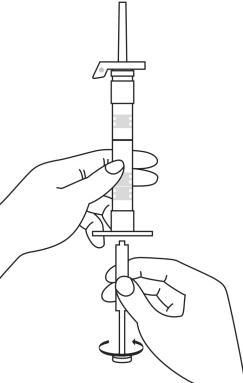
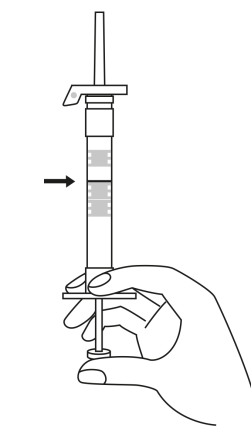
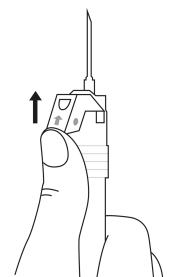
| 1. Håll sprutan upprätt (nålen uppåt). Skruva fast kolvens skaft på sprutans botten tills den bakre gummiproppen börjar snurra. |
| 5. Håll sprutan med nålen uppåt så att du ser om det finns luftbubblor i sprutan. Om luftbubblor syns, tryck försiktigt på kolven tills all luft (men ingen vätska) har avlägsnats från sprutan. |
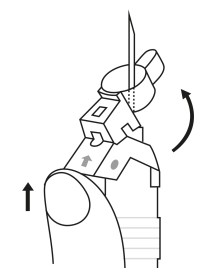
| 2. Håll sprutan upprätt (nålen uppåt). Kontrollera att nålen är ordentligt fastskruvad på sprutan genom att skruva nålskyddet medsols. Skruva inte åt det för hårt. Knacka försiktigt på sprutan med ett finger så att pulvret lossnar från kammarens vägg. |
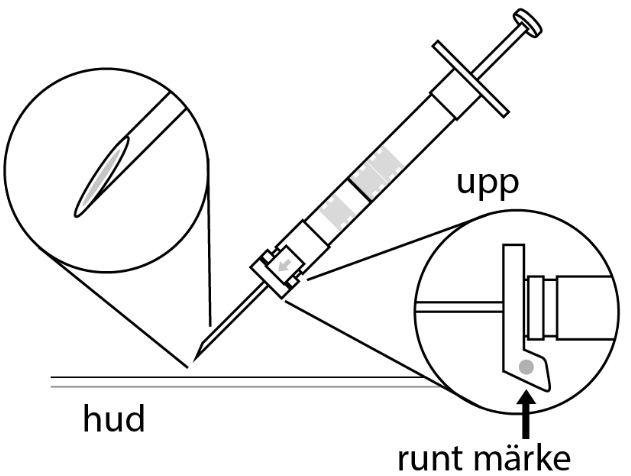
6. Rengör hudområdet med antiseptiskt medel före injektionen. När injektionen ges ska pricken på säkerhetsskyddet peka uppåt. Kontrollera att nålen inte punkterar ett blodkärl och injicera hela innehållet i sprutan på en gång under huden som vid en normal injektion. | |
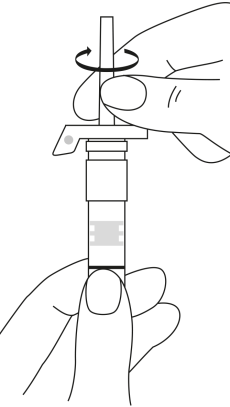
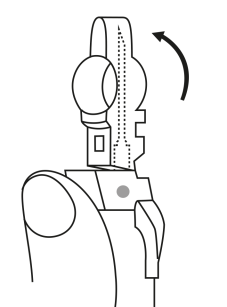
| 3. Håll sprutan upprätt (nålen uppåt). Tryck in kolven långsamt (6‑8 sekunder) tills den mellersta gummiproppens övre del når den blå linjen. | ||
EFTER INJEKTION 7. En pil är tryckt på säkerhetsskyddets klaff. Tryck på säkerhetsskyddets klaff i pilens riktning genast efter injektionen. Då glider skyddet mot nålspetsen och låses som skydd för nålen. Kontrollera låsningen genom att lyssna eller känna (när skyddet låses hör du ett ”klick” eller känner en knäpp). | |||
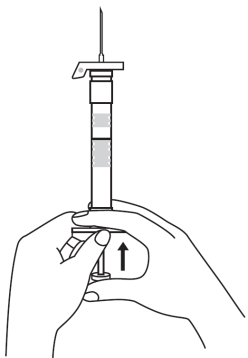
| 4. Håll sprutan upprätt (nålen uppåt). Skaka sprutan försiktigt tills suspensionen är jämn. Färdig injektion är en vit, mjölkaktig suspension. Dra försiktigt av nålskyddet. | ||
Allmänna råd
- Se till att suspensionen har en jämn konsistens före dosering.
- Den färdiga suspensionen ska användas omedelbart.
- Vid behov kan plåster läggas på injektionsstället.
- Läkemedlet får inte injiceras på samma plats två gånger i följd, utan injektionsstället bör varieras.
- Den färdiga suspensionen får inte förvaras, eftersom produkten inte innehåller något konserveringsmedel.
- Injektionsstället får inte masseras.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
3,75 mg 3,75 mg
11,25 mg 11,25 mg
- Ylempi erityiskorvaus (100 %). Eturauhassyöpä (116).
- Peruskorvaus (40 %).
Atc-kod
L02AE02
Datum för översyn av produktresumén
28.10.2024
Yhteystiedot
 ORION OYJ ORION PHARMA
ORION OYJ ORION PHARMA Orionintie 1, PL 65
02101 Espoo
010 4261
www.orion.fi
etunimi.sukunimi@orionpharma.com