SEEBRI BREEZHALER inhalationspulver, hård kapsel 44 mikrog
Kvalitativ och kvantitativ sammansättning
Varje kapsel innehåller 63 mikrogram glykopyrroniumbromid, vilket motsvarar 50 mikrogram glykopyrronium.
Varje avgiven dos (den dos som lämnar inhalatorns munstycke) innehåller 55 mikrogram glykopyrroniumbromid, vilket motsvarar 44 mikrogram glykopyrronium.
Hjälpämne(n) med känd effekt:
Varje kapsel innehåller 23,6 mg laktos (som monohydrat).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Inhalationspulver, hård kapsel (inhalationspulver).
Transparenta, orange kapslar, som innehåller ett vitt pulver, med ”GPL50” tryckt i svart ovanför, och företagslogotypen (
) tryckt i svart nedanför, ett svart streck.
Kliniska uppgifter
Terapeutiska indikationer
Seebri Breezhaler är indicerat som bronkvidgande underhållsbehandling för att lindra symtom hos vuxna patienter med kroniskt obstruktiv lungsjukdom (KOL).
Dosering och administreringssätt
Dosering
Rekommenderad dos är inhalation av innehållet i en kapsel en gång dagligen med Seebri Breezhaler inhalator.
Seebri Breezhaler bör administreras vid samma tidpunkt varje dag. Om en dos glöms bort, ska nästa dos tas så snart som möjligt. Patienterna ska informeras om att inte ta mer än en dos dagligen.
Särskilda populationer
Äldre population
Äldre patienter (75 år och äldre) kan använda rekommenderad dos av Seebri Breezhaler (se avsnitt Biverkningar).
Nedsatt njurfunktion
Patienter med mild till måttlig njurfunktionsnedsättning kan använda rekommenderad dos av Seebri Breezhaler. Patienter med kraftig njurfunktionsnedsättning eller terminal, dialyskrävande njursvikt ska endast använda Seebri Breezhaler om den förväntade nyttan överväger den potentiella risken, eftersom systemisk exponering för glykopyrronium kan öka i denna population (se avsnitt Varningar och försiktighet och Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Inga studier har utförts på patienter med nedsatt leverfunktion. Glykopyrronium elimineras huvudsakligen via njurarna och därför förväntas ingen väsentligt ökad exponering hos patienter med nedsatt leverfunktion. Ingen dosjustering krävs hos patienter med nedsatt leverfunktion.
Pediatrisk population
Det finns ingen relevant användning av Seebri Breezhaler för en pediatrisk population (under 18 år) för indikationen KOL.
Administreringssätt
Endast för inhalation.
Kapslarna får endast administreras med Seebri Breezhaler inhalator (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Kapslarna får endast tas ur blisterkartan precis före användning.
Kapslarna får inte sväljas.
Patienterna ska informeras om hur läkemedlet administreras korrekt. Patienter som inte upplever att andningen förbättras bör tillfrågas om de sväljer läkemedlet i stället för att inhalera det.
Anvisningar om användning av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Varningar och försiktighet
Ej för akut användning
Seebri Breezhaler är en långsiktig underhållsbehandling som tas en gång dagligen och är inte avsett för initial behandling av akuta episoder av bronkospasm, dvs som vidbehovsmedicin.
Överkänslighet
Akuta överkänslighetsreaktioner har rapporterats efter administrering av Seebri Breezhaler. Vid tecken på en allergisk reaktion, i synnerhet angioödem (svårighet att andas eller svälja, svullnad av tunga, läppar och ansikte), nässelutslag eller hudutslag, ska behandlingen omedelbart avbrytas och alternativ behandling ges.
Paradoxal bronkospasm
Paradoxal bronkospasm har inte observerats i kliniska studier med Seebri Breezhaler. Paradoxal bronkospasm har emellertid observerats med andra inhalationsbehandlingar och kan vara livshotande. Om detta inträffar ska behandlingen omedelbart sättas ut och alternativ behandling sättas in.
Antikolinerg effekt
Seebri Breezhaler ska användas med försiktighet till patienter med trångvinkelglaukom och urinretention.
Patienterna ska informeras om tecken och symtom på trångvinkelglaukom samt instrueras att sluta använda Seebri Breezhaler och omedelbart kontakta läkare vid något av dessa tecken eller symtom.
Patienter med kraftigt nedsatt njurfunktion
Hos patienter med mild eller måttlig njurfunktionsnedsättning sågs en måttlig genomsnittlig ökning av den totala systemiska exponeringen (AUClast) på upp till 1,4 gånger och hos patienter med kraftig njurfunktionsnedsättning eller terminal njursvikt på upp till 2,2 gånger. Patienter med kraftigt nedsatt njurfunktion (skattad glomerulär filtrationshastighet under 30 ml/min/1,73 m2), inklusive patienter med terminal, dialyskrävande njursvikt, ska endast använda Seebri Breezhaler om den förväntade nyttan överväger den potentiella risken (se avsnitt Farmakokinetiska egenskaper). Dessa patienter ska följas noga med avseende på potentiella biverkningar.
Patienter med anamnes på kardiovaskulär sjukdom
Patienter med instabil ischemisk hjärtsjukdom, vänsterkammarsvikt, tidigare hjärtinfarkt, arytmi (förutom kroniskt stabilt förmaksflimmer), anamnes på långt QT-syndrom eller de vars QTc-intervall (Fridericia-metoden) var förlängt (>450 ms för män eller >470 ms för kvinnor) exkluderades från kliniska prövningar, varför erfarenheten från dessa patientgrupper är begränsad. Seebri Breezhaler ska användas med försiktighet hos dessa patientgrupper.
Hjälpämnen
Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Interaktioner
Samtidig administrering av Seebri Breezhaler med andra läkemedel som innehåller antikolinergika har inte studerats och rekommenderas därför inte.
Även om inga formella interaktionsstudier har utförts, så har samtidig användning av Seebri Breezhaler och andra läkemedel som ofta används vid behandling av KOL varit utan kliniska tecken på läkemedelsinteraktioner. Dessa läkemedel inkluderar symptomatiska bronkdilaterande, metylxantiner, orala och inhalerade steroider.
Cimetidin, en hämmare av organisk katjontransport som anses bidra till den renala utsöndringen av glykopyrronium, ökade den totala exponeringen (AUC) för glykopyrronium med 22 % och minskade njurclearance med 23 % i en klinisk studie på friska frivilliga. Baserat på omfattningen av dessa förändringar förväntas ingen kliniskt relevant läkemedelsinteraktion vid samtidig administrering av glykopyrronium och cimetidin eller andra hämmare av organisk katjontransport.
Samtidig administrering av glykopyrronium och oral inhalation av indakaterol, en beta2-adrenerg agonist, påverkade inte farmakokinetiken för något av läkemedlen vid steady state för bägge aktiva substanser.
Fertilitet, graviditet och amning
Graviditet
Det finns inga data från användning av Seebri Breezhaler hos gravida kvinnor. Djurstudier visar inga direkta eller indirekta skadliga reproduktionstoxikologiska effekter (se avsnitt Prekliniska säkerhetsuppgifter). Glykopyrronium ska endast användas under graviditet om den förväntade nyttan för patienten överväger den potentiella risken för fostret.
Amning
Det är okänt om glykopyrroniumbromid utsöndras i bröstmjölk. Glykopyrroniumbromid (inklusive dess metaboliter) utsöndrades emellertid i mjölk hos digivande råttor (se avsnitt Prekliniska säkerhetsuppgifter). Användning av glykopyrronium hos ammande kvinnor bör endast övervägas om den förväntade nyttan för kvinnan överväger den eventuella risken för spädbarnet (se avsnitt Prekliniska säkerhetsuppgifter).
Fertilitet
Reproduktionsstudier och andra data från djur tyder inte på någon påverkan på fertiliteten hos vare sig män eller kvinnor (se avsnitt Prekliniska säkerhetsuppgifter).
Effekter på förmågan att framföra fordon och använda maskiner
Glykopyrronium har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Den vanligaste antikolinerga biverkningen var muntorrhet (2,4 %). Flertalet rapporter av muntorrhet ansågs vara relaterade till läkemedlet och var milda. Inget fall var av svår grad.
Säkerhetsprofilen karakteriseras vidare av andra symtom relaterade till de antikolinerga effekterna, däribland tecken på urinretention, som var mindre vanlig. Gastrointestinala biverkningar, däribland gastroenterit och dyspepsi, observerades också. Biverkningar relaterade till lokal tolerabilitet inkluderade halsirritation, nasofaryngit, rinit och sinuit.
Sammanfattning av biverkningar i tabellform
De biverkningar som rapporterades under de första sex månaderna i två poolade, pivotala, 6 respektive 12 månader långa studier i fas III, listas enligt MedDRAs organsystemklass (tabell 1). Inom varje organsystem rangordnas biverkningarna efter frekvens med den oftast förekommande biverkningen först. Biverkningarna anges inom varje frekvensområde efter fallande allvarlighetsgrad. Dessutom bygger frekvenskategorin för varje biverkning på följande konvention: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell 1 Biverkningar
Biverkningar | Frekvenskategori |
Infektioner och infestationer | |
Nasofaryngit1) | Vanliga |
Rinit | Mindre vanliga |
Cystit | Mindre vanliga |
Immunsystemet | |
Överkänslighet | Mindre vanliga |
Angioödem2) | Mindre vanliga |
Metabolism och nutrition | |
Hyperglykemi | Mindre vanliga |
Psykiska störningar | |
Sömnlöshet | Vanliga |
Centrala och perifera nervsystemet | |
Huvudvärk3) | Vanliga |
Nedsatt känsel | Mindre vanliga |
Hjärtat | |
Förmaksflimmer | Mindre vanliga |
Palpitationer | Mindre vanliga |
Andningsvägar, bröstkorg och mediastinum | |
Täppta bihålor | Mindre vanliga |
Produktiv hosta | Mindre vanliga |
Halsirritation | Mindre vanliga |
Näsblod | Mindre vanliga |
Dysfoni2) | Mindre vanliga |
Paradoxal bronkospasm2) | Ingen känd frekvens |
Magtarmkanalen | |
Muntorrhet | Vanliga |
Gastroenterit Illamående2) | Vanliga Mindre vanliga |
Kräkning1) 2) | Mindre vanliga |
Dyspepsi | Mindre vanliga |
Karies | Mindre vanliga |
Hud och subkutan vävnad | |
Hudutslag | Mindre vanliga |
Pruritus2) | Mindre vanliga |
Muskuloskeletala systemet och bindväv | |
Muskuloskeletal smärta1) 2) | Vanliga |
Smärta i extremiteter | Mindre vanliga |
Muskuloskeletal bröstsmärta | Mindre vanliga |
Njurar och urinvägar | |
Urinvägsinfektion3) | Vanliga |
Dysuri | Mindre vanliga |
Urinretention | Mindre vanliga |
Allmänna symtom och/eller symtom vid administreringsstället | |
Trötthet | Mindre vanliga |
Asteni | Mindre vanliga |
1) Endast i 12-månadersdatabasen var detta vanligare för glykopyrronium än placebo.
2) Rapporter har inkommit efter försäljningsgodkännande i samband med användning av Seebri Breezhaler. Dessa rapporteras frivilligt från en population av okänd storlek och det går därför inte att med säkerhet beräkna frekvensen eller att fastställa ett orsakssamband till läkemedelsexponeringen. Frekvensen är därför beräknad från kliniska prövningar.
3) Endast hos äldre >75 år sågs detta oftare för glykopyrronium än placebo.
Beskrivning av vissa biverkningar
I den sammanslagna 6-månadersdatabasen var förekomsen av biverkningar för Seebri Breezhaler respektive placebo följande: muntorrhet 2,2 % mot 1,1 %, insomnia 1,0 % mot 0,8 % och gastroenterit 1,4 % mot 0,9 %.
Muntorrhet rapporterades främst under de första 4 behandlingsveckorna, med en medianduration på 4 veckor hos majoriteten av patienterna. I 40 % av fallen kvarstod emellertid symtomen under hela 6-månadersperioden. Inga nya fall av muntorrhet rapporterades under månad 7‑12.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Höga doser av glykopyrronium kan leda till antikolinerga symtom, för vilka symtomatisk behandling kan vara indicerat.
Akut intoxikation på grund av oavsiktligt oralt intag av Seebri Breezhaler kapslar är osannolikt med tanke på den låga orala biotillgängligheten (cirka 5 %).
Efter intravenös administrering av 150 mikrogram glykopyrroniumbromid (motsvarande 120 mikrogram glykopyrronium) hos friska frivilliga var maximala plasmanivåer och total systemisk exponering cirka 50 respektive 6 gånger högre än vad som uppnås vid steady state med rekommenderad dos (44 mikrogram en gång dagligen) av Seebri Breezhaler och tolererades väl.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Medel vid obstruktiva luftvägssjukdomar, antikolinergika, ATC-kod: R03BB06
Verkningsmekanism
Glykopyrronium är en långverkande muskarinreceptorantagonist (antikolinergikum) för inhalation och bronkvidgande underhållsbehandling av KOL, vilken administreras en gång dagligen. Parasympatiska nerver är den huvudsakliga neurala reaktionsvägen för bronkkonstriktion i luftvägarna och kolinerg tonus är den viktigaste reversibla komponenten i luftvägsobstruktion vid KOL. Glykopyrronium verkar genom att blockera acetylkolins bronksammandragande effekt på luftvägarnas glatta muskelceller, vilket därmed vidgar luftvägarna.
Glykopyrroniumbromid är en antagonist med hög affinitet till muskarinreceptorer. I studier med radioligandbindning påvisades en mer än 4 gånger högre selektivitet för humana M3-receptorer än för humana M2-receptorer. Den har en snabbt insättande effekt, vilket framgår av observerade receptorassociations-/dissociationskinetiska parametrar och tiden från inhalation till effekt i kliniska studier.
Den långvariga effekten kan delvis bero på att koncentrationen av aktiv substans upprätthålls i lungan, vilket återspeglas av glykopyrroniums långa terminala halveringstid i eliminationsfasen efter inhalation med Seebri Breezhaler inhalator, något som skiljer sig från halveringstiden efter intravenös administrering (se avsnitt Farmakokinetiska egenskaper).
Farmakodynamisk effekt
Det kliniska utvecklingsprogrammet inkluderade två fas III-studier, en 6-månaders placebokontrollerad studie och en 12-månadersstudie med placebo och aktiv kontroll (öppet tiotropium 18 mikrogram dagligen), vilka båda utfördes på patienter med klinisk KOL-diagnos av måttlig till svår karaktär.
Effekter på lungfunktionen
Seebri Breezhaler, 44 mikrogram en gång dagligen, gav genomgående en statistiskt signifikant förbättrad lungfunktion (forcerad expiratorisk volym under en sekund, FEV1, forcerad vitalkapacitet, FVC, och inspiratorisk kapacitet, IC) i ett antal kliniska studier. I fas III-studierna sågs en bronkvidgande effekt inom 5 minuter efter den första dosen, vilken kvarstod under doseringsintervallet på 24 timmar från den första dosen. Den bronkvidgande effekten försvagades inte över tid i 6- och 12-månadersstudierna. Effektens omfattning berodde på graden av reversibilitet av obstruktiviteten vid studiestart (testad genom administrering av en kortverkande bronkdilaterande muskarinantagonist). Patienter med den lägsta graden av reversibilitet vid studiestart (<5 %) uppvisade i allmänhet en lägre bronkdilaterande effekt än patienter med en högre grad av reversibilitet vid studiestart (≥5 %). Efter 12 veckor med Seebri Breezhaler (primärt effektmått) ökade dalvärdet av FEV1 med 72 ml hos patienter med den lägsta graden av reversibilitet (<5 %) och med 113 ml hos patienter med en högre grad av reversibilitet vid studiestart (≥5 %) jämfört med placebo (båda p<0,05).
I 6‑månadersstudien med Seebri Breezhaler ökade FEV1 efter den första dosen med 93 ml inom 5 minuter och 144 ml inom 15 minuter från dosering, jämfört med placebo (båda p<0,001). I 12‑månadersstudien ökade FEV1 med 87 ml efter 5 minuter och 143 ml efter 15 minuter (båda p<0,001). I 12‑månadersstudien gav Seebri Breezhaler en statistiskt signifikant ökad FEV1, jämfört med tiotropium under de första 4 timmarna efter dosering dag 1 och vecka 26, och numeriskt högre FEV1-värden än tiotropium under de första 4 timmarna efter dosering vecka 12 och vecka 52.
De FEV1-värden som uppmättes i slutet av doseringsintervallet (24 timmar efter dosering) var jämförbara för den första dosen och efter 1 års dosering. Efter 12 veckor (primärt effektmått) ökade Seebri Breezhaler dalvärdet för FEV1 med 108 ml i 6‑månadersstudien och 97 ml i 12‑månadersstudien, jämfört med placebo (båda p<0,001). I 12‑månadersstudien ökade FEV1 med 83 ml för tiotropium, jämfört med placebo (p<0,001).
Effekter på symtom
Enligt utvärdering med Transitional Dyspnoea Index (TDI) minskade andfåddhet statistiskt signifikant med Seebri Breezhaler, 44 mikrogram en gång dagligen. En sammanslagen analys av de pivotala 6- och 12-månadersstudierna, visade att en statistiskt signifikant större andel av de patienter som fick Seebri Breezhaler svarade med minst 1 poängs förbättring av TDI focal score vecka 26 jämfört med placebo (58,4 % respektive 46,4 %, p<0,001). Dessa fynd var jämförbara med dem som sågs hos patienter som fick tiotropium, av vilka 53,4 % svarade med minst 1 poängs förbättring (p=0,009 jämfört med placebo).
Seebri Breezhaler, en gång dagligen, har också visat statistiskt signifikant effekt på den hälsorelaterade livskvaliteten mätt med St. George’s Respiratory Questionnaire (SGRQ). En sammanslagen analys av de pivotala 6‑ och 12‑månadersstudierna, visade att en statistiskt signifikant större andel av patienterna som fick Seebri Breezhaler, jämfört med placebo, svarade med en förbättring på minst 4 SGRQ-poäng vecka 26 (57,8 % respektive 47,6 %, p<0,001). Av de patienter som fick tiotropium svarade 61,0 % med en förbättring på minst 4 SGRQ-poäng (p=0,004 jämfört med placebo).
Effekter på KOL-exacerbationer
Information om KOL-exacerbationer samlades in i de pivotala studierna om 6 respektive 12 månader. I båda studierna minskade andelen patienter med måttlig eller svår exacerbation (vilket per definition innebar att behandling med orala kortikosteroider och/eller antibiotika eller sjukhusinläggning krävdes). I 6‑månadersstudien var andelen patienter med måttlig eller svår exacerbation 17,5 % för Seebri Breezhaler och 24,2 % för placebo (hazard ratio: 0,69, p=0,023) och i 12‑månadersstudien 32,8 % för Seebri Breezhaler och 40,2 % för placebo (hazard ratio: 0,66, p=0,001). En sammanslagen analys av de första 6 behandlingsmånaderna i 6- och 12-månadersstudierna visade att Seebri Breezhaler, jämfört med placebo, statistiskt signifikant förlängde tiden till den första medelsvåra eller svåra exacerbationen och minskade frekvensen medelsvåra eller svåra exacerbationer (0,53exacerbationer/år mot 0,77exacerbationer/år, p<0,001). Den sammanslagna analysen visade också att färre patienter i Seebri Breezhaler-gruppen än i placebogruppen fick en exacerbation som krävde sjukhusvård (1,7 % mot 4,2 %, p=0,003).
Andra effekter
I 6- respektive 12‑månadersstudien minskade Seebri Breezhaler en gång dagligen användningen av vidbehovsmedicin (salbutamol) statistiskt signifikant med 0,46 puffar per dag (p=0,005) under 26 veckor och med 0,37 puffar per dag (p=0,039) under 52 veckor, jämfört med placebo.
I en 3-veckors studie där ansträngningstoleransen testades med cykelergometer vid submaximal (80 %) belastning (submaximalt ansträngningstoleranstest) minskade Seebri Breezhaler, doserat på morgonen, dynamisk hyperinflation och förlängde tiden under vilken ansträngning kunde upprätthållas, från den första dosen och framåt. På den första behandlingsdagen förbättrades den inspiratoriska kapaciteten med 230 ml och ansträngningstiden förbättrades med 43 sekunder (en ökning med 10 %) jämfört med placebo. Efter tre veckors behandling var förbättringen av inspiratorisk kapacitet jämförbar med den förbättring som uppnåddes den första dagen (200 ml) med Seebri Breezhaler, men ansträngningstiden hade emellertid ökat med 89 sekunder jämfört med placebo (en ökning med 21 %). Seebri Breezhaler minskade dyspné och besvär i benen under ansträngning, enligt Borg-skalorna. Seebri Breezhaler minskade också dyspné i vila, enligt Transitional Dyspnoea Index.
Sekundära farmakodynamiska effekter
Efter dosering av upp till 176 mikrogram Seebri Breezhaler observerades ingen förändring i genomsnittlig hjärtfrekvens eller QTc-intervall hos patienter med KOL. I en noggrann QT-studie på 73 friska frivilliga med inhalation av en engångsdos på 352 mikrogram glykopyrronium (8 gånger den terapeutiska dosen) förlängdes inte QTc-intervallet, men hjärtfrekvensen minskade något jämfört med placebo (maximal effekt ‑5,9 slag/minut; genomsnittlig effekt över 24 timmar ‑2,8 slag/minut). Effekten på hjärtfrekvensen och QTc-intervallet efter intravenös administrering av 150 mikrogram glykopyrroniumbromid (motsvarande 120 mikrogram glykopyrronium) undersöktes hos unga friska studiedeltagare. Den maximala exponering (Cmax) som uppnåddes var cirka 50 gånger högre än steady state-exponeringen efter inhalation av 44 mikrogram glykopyrronium och resulterade inte i takykardi eller QTc-förlängning. En svag minskning av hjärtfrekvensen observerades (genomsnittlig skillnad över 24 timmar ‑2 slag/minut jämfört med placebo), vilket är en känd effekt av låg exponering för antikolinerga substanser hos unga friska.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Seebri Breezhaler, för alla grupper av den pediatriska populationen för KOL (information om pediatrisk användning finns i avsnitt Dosering och administreringssätt).
Farmakokinetiska egenskaper
Absorption
Efter oral inhalation med användning av Seebri Breezhaler inhalator absorberades glykopyrronium snabbt och maximala plasmanivåer uppnåddes 5 minuter efter dosering.
Den absoluta biotillgängligheten av glykopyrronium, via inhalation med Seebri Breezhaler inhalator, beräknades till cirka 45 % av avgiven dos. Cirka 90 % av den systemiska exponeringen efter inhalation kom från absorption i lungan och 10 % från absorption i magtarmkanalen.
Hos patienter med KOL uppnåddes farmakokinetisk steady state för glykopyrronium inom en vecka från behandlingsstart. Genomsnittliga högsta och lägsta plasmakoncentrationer av glykopyrronium, vid steady state meden daglig dos på 44 mikrogram, var 166 pikogram/ml respektive 8 pikogram/ml. Vid steady state var exponeringen för glykopyrronium (AUC för doseringsintervallet på 24 timmar) cirka 1,4‑1,7 gånger högre än efter den första dosen.
Distribution
Efter intravenös dosering var distributionsvolymen av glykopyrronium i steady state 83 liter. I terminalfasen var distributionsvolymen 376 liter. Efter inhalation var den skenbara distributionsvolymen i terminalfasen nästan 20 gånger högre, vilket återspeglar den mycket långsammare elimineringen efter inhalation. In vitro var glykopyrroniums bindning till humana plasmaproteiner 38‑41 % vid koncentrationer på 1‑10 nanogram/ml.
Metabolism
Metabolismstudier in vitro visade att de metabola vägarna för glykopyrroniumbromid är desamma hos djur och människa. Hydroxylering, som gav en rad mono- och bishydroxylerade metaboliter, och direkt hydrolys, som ledde till bildning av ett karboxylsyraderivat (M9), observerades. In vivo bildas M9 från den nedsvalda dosfraktionen av inhalerad glykopyrroniumbromid. Glukuronid- och/eller sulfatkonjugat av glykopyrronium återfanns i urinen hos människa efter upprepad inhalation och stod för cirka 3 % av dosen.
Flera CYP-isoenzymer bidrar till den oxidativa metabolismen av glykopyrronium. Hämning eller induktion av metabolismen av glykopyrronium leder troligen inte till någon relevant förändring av systemisk exponering för den aktiva substansen.
Inhibitionsstudier in vitro visade att glykopyrroniumbromid inte har någon relevant kapacitet att hämma CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 eller CYP3A4/5, effluxtransportörerna MDR1, MRP2 och MXR eller upptagstransportörerna OCT1 och OCT2. Enzyminduktionsstudier in vitro tydde inte på någon kliniskt relevant induktion av glykopyrroniumbromid på cytokrom P450-isozymerna, på UGT1A1 eller transportörerna MDR1 och MRP2.
Eliminering
Efter intravenös administrering av [3H]-märkt glykopyrroniumbromid till människa uppgick den genomsnittliga utsöndringen av radioaktivitet via urinen under 48 timmar till 85 % av dosen. Ytterligare 5 % återfanns i gallan.
Renal eliminering av modersubstansen står för cirka 60‑70 % av totalt clearance av systemiskt tillgängligt glykopyrronium, medan icke-renalt clearance står för cirka 30‑40 %. Biliärt clearance bidrar till icke-renalt clearance, men merparten av icke-renalt clearance anses bero på metabolism.
Genomsnittligt renalt clearance av glykopyrronium efter inhalation låg i intervallet 14,4‑24,4 liter/tim. Aktiv tubulär utsöndring bidrar till den renala elimineringen av glykopyrronium. Upp till 23 % av den avgivna dosen återfanns som modersubstans i urinen.
Plasmakoncentrationen av glykopyrronium sjönk flerfasigt. Den genomsnittliga terminala halveringstiden i eliminationsfasen var mycket längre efter inhalation (33‑57 timmar) än efter intravenös (6,2 timmar) och oral (2,8 timmar) administrering. Elimineringsmönstret tyder på ihållande absorption i lungorna och/eller överföring av glykopyrronium till den systemiska cirkulationen vid, och mer än 24 timmar efter, inhalation.
Linjäritet/icke-linjäritet
Hos patienter med KOL ökade både systemisk exponering och total utsöndring av glykopyrronium i urinen vid farmakokinetisk steady state ungefär dosproportionellt inom dosintervallet 44 till 176 mikrogram.
Särskilda populationer
En populationsfarmakokinetisk analys av data för KOL-patienter identifierade kroppsvikt och ålder som faktorer som bidrar till skillnader i den systemiska exponeringen mellan patienter. Seebri Breezhaler 44 mikrogram en gång dagligen kan användas riskfritt till alla ålders- och kroppsviktsgrupper.
Kön, rökstatus och utgångsvärdet av FEV1 hade ingen synbar effekt på systemisk exponering.
Det fanns inga stora skillnader i total systemisk exponering (AUC) mellan japanska och kaukasiska studiedeltagare efter inhalation av glykopyrroniumbromid. För personer med annat etniskt ursprung är tillgängliga data otillräckliga.
Patienter med nedsatt leverfunktion
Inga kliniska studier har utförts på patienter med nedsatt leverfunktion. Glykopyrronium elimineras huvudsakligen från den systemiska cirkulationen genom renal utsöndring. Minskad levermetabolism av glykopyrronium anses inte leda till någon kliniskt relevant ökad systemisk exponering.
Patienter med nedsatt njurfunktion
Njurfunktionsnedsättning påverkar den systemiska exponeringen för glykopyrroniumbromid. Hos patienter med mild eller måttlig njurfunktionsnedsättning sågs en måttlig genomsnittlig ökning av den totala systemiska exponeringen (AUClast) på upp till 1,4 gånger och hos patienter med kraftig njurfunktionsnedsättning eller terminal njursvikt på upp till 2,2 gånger. KOL-patienter med mild eller måttlig njurfunktionsnedsättning (skattad glomerulär filtrationshastighet, eGFR ≥30 ml/min/1,73 m2) kan använda rekommenderad dos av Seebri Breezhaler. Patienter med kraftig njurfunktionsnedsättning (skattad glomerulär filtrationshastighet under 30 ml//min/1,73 m2), inklusive patienter med terminal, dialyskrävande njursvikt, ska endast använda Seebri Breezhaler om den förväntade nyttan överväger den potentiella risken (se avsnitt Varningar och försiktighet)
Prekliniska säkerhetsuppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet, karcinogenicitet, reproduktionseffekter och effekter på utveckling visade inte några särskilda risker för människa.
Effekter som kan hänföras till glykopyrroniumbromids muskarinreceptorantagonistiska egenskaper inkluderade mild till måttlig ökning av hjärtfrekvensen hos hund, linsgrumling hos råtta och reversibla förändringar associerade med minskad körtelsekretion hos råtta och hund. Mild irritation eller adaptiva förändringar i andningsvägarna sågs hos råtta. Alla dessa fynd uppträdde vid exponeringar som var tillräckligt mycket högre än dem som förutses hos människa.
Glykopyrronium var inte teratogent hos råtta eller kanin efter inhalation. Fertilitet och pre- och postnatal utveckling påverkades inte hos råtta. Glykopyrroniumbromid och dess metaboliter passerar inte placenta i någon väsentlig grad hos dräktiga råttor, kaniner eller hundar. Glykopyrroniumbromid (inklusive dess metaboliter) utsöndrades i mjölk hos digivande råttor och uppnådde där koncentrationer som var upp till 10 gånger högre än i honans blod.
Studier av glykopyrroniumbromid på gentoxicitet visade ingen mutagen eller klastogen risk. Karcinogenicitetsstudier, oral administrering hos transgena möss och inhalation hos råttor, visade inga tecken på karcinogenicitet vid systemisk exponering (AUC) som hos möss var cirka 53 gånger och hos råttor 75 gånger högre än den exponering som uppnås med den högsta rekommenderade dosen på 44 mikrogram en gång dagligen till människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Kapselns innehåll
Laktosmonohydrat
Magnesiumstearat
Kapselskal
Hypromellos
Karragenan
Kaliumklorid
Para-orange FCF (E110)
Tryckbläck
Shellack (E904)
Propylenglykol
Ammoniumhydroxid
Kaliumhydroxid
Svart järnoxid (E172)
Inkompatibiliteter
Ej relevant.
Hållbarhet
2 år
Kassera varje inhalator efter att alla kapslarna i förpackningen har använts.
Särskilda förvaringsanvisningar
Förvaras vid högst 25°C.
Kapslarna måste alltid förvaras i blisterkartan. Fuktkänsligt. Kapslarna får endast tas ur blisterkartan precis före användning.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
SEEBRI BREEZHALER inhalaatiojauhe, kapseli, kova
44 mikrog (L:kyllä) 30 x 1 fol (inhalaattori) (39,87 €), 90 x 1 fol (90 (3 x 30 x 1), 3 inhalaattoria) (112,80 €)
PF-selosteen tieto
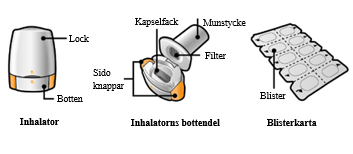
Seebri Breezhaler är en inhalator för engångsdoser. Själva inhalatorn och dess lock är tillverkade av akrylnitrilbutadienstyren, tryckknapparna är tillverkade av metylmetaakrylat akrylnitrilbutadienstyren. Nålar och fjädrar är tillverkade av rostfritt stål. Varje blister innehåller antingen 6 eller 10 hårda kapslar.
PA/Alu/PVC – Alu perforerat endosblister
Förpackning innehållande 6x1, 10x1, 12x1 eller 30x1 hårda kapslar och en inhalator.
Flerpack innehållande 90 (3 förpackningar med 30x1) hårda kapslar och 3 inhalatorer.
Flerpack innehållande 96 (4 förpackningar med 24x1) hårda kapslar och 4 inhalatorer.
Flerpack innehållande 150 (15 förpackningar med 10x1) hårda kapslar och 15 inhalatorer.
Flerpack innehållande 150 (25 förpackningar med 6x1) hårda kapslar och 25 inhalatorer.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Särskilda anvisningar för destruktion och övrig hantering
Inhalatorn som medföljer varje nytt recept ska användas. Kassera varje inhalator efter att alla kapslarna i förpackningen har använts.
Anvisningar för användning och hantering
Läs igenom hela bruksanvisningen innan Seebri Breezhaler används. | |||
|
|
|
|
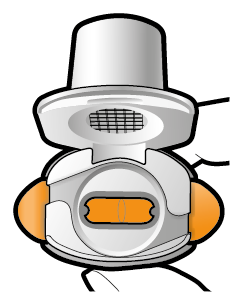
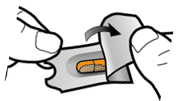
Lägg i kapseln | Stick hål och släpp | Inhalera djupt | Kontrollera att kapseln är tom |
1 ↓ | 2 ↓ | 3 ↓ | 4 ↓ |
|
|
|
|
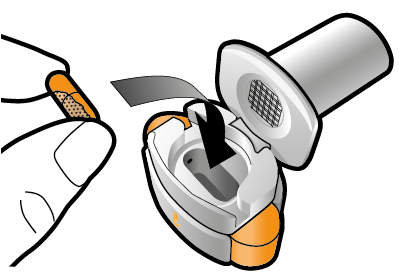
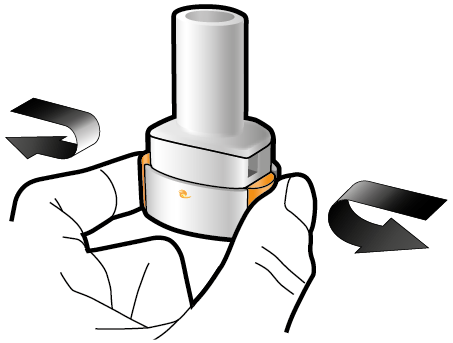
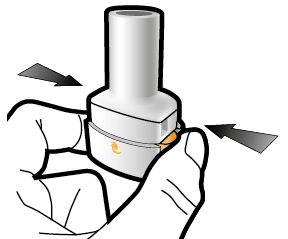
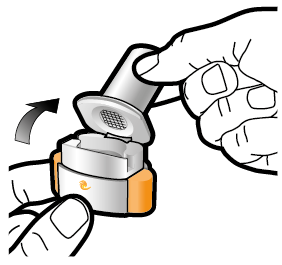
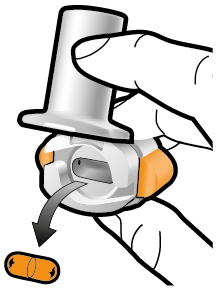
Steg 1a: Ta av locket | Steg 2a: Stick hål på kapseln en gång Håll inhalatorn upprätt. Stick hål på kapseln genom att med en stadig rörelse pressa in de båda knapparna på inhalatorns sidor samtidigt. | Steg 3a: Andas ut helt Blås inte ut i inhalatorn. | Kontrollera att kapseln är tom Öppna inhalatorn för att se om det finns pulver kvar i kapseln. |
| Du ska höra ett klickljud när det går hål på kapseln. Stick bara hål på kapseln en gång. |
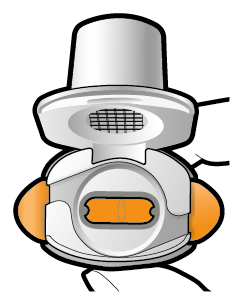
| Om pulver finns kvar i kapseln:
|
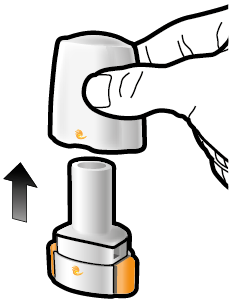
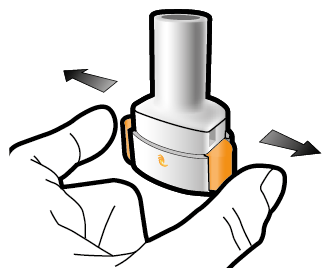
Steg 1b: Öppna inhalatorn |
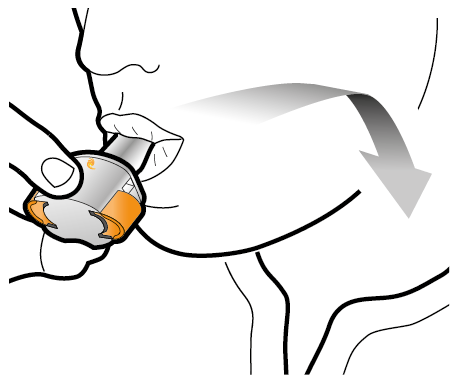
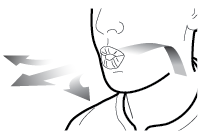
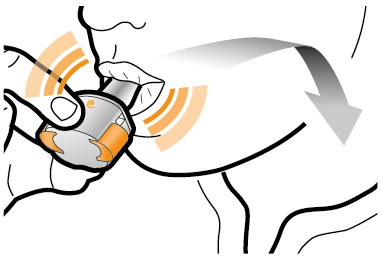
Steg 2b: Släpp sidoknapparna | Steg 3b: Inhalera läkemedlet med ett djupt andetag Håll inhalatorn så som visas på bilden. Placera munstycket i munnen. Slut läpparna ordentligt runt munstycket. Tryck inte in sidoknapparna. |
Kvarvarande Tom pulver |
| Andas in snabbt och så djupt du kan. Under inhalationen kommer du att höra ett surrande ljud. Eventuellt känns smaken av läkemedlet när du inhalerar. |
| |
Steg 1c: Ta ut en kapsel Skilj ett blister från blisterkartan. Dra av skyddsfolien och ta ut kapseln. Tryck inte kapseln genom folien. Svälj inte kapseln. |
Steg 3c: Håll andan Håll andan i upp till 5 sekunder. | Ta ut den tomma kapseln Kasta den tomma kapseln i hushållssoporna. Stäng inhalatorn och sätt på locket. | |
Steg 1d: Lägg i kapseln Lägg inte kapseln direkt i munstycket. | Viktig information
| ||
Steg 1e: Stäng inhalatorn | |||
En Seebri Breezhaler-förpackning innehåller:
| Vanliga frågor Varför hördes inget ljud från inhalatorn när jag inhalerade? Kapseln kan ha fastnat i kapselfacket. Om detta händer kan du försiktigt lossa kapseln genom att knacka på botten av inhalatorn. Inhalera läkemedlet igen genom att upprepa steg 3a till 3c. Vad ska jag göra om det är pulver kvar i kapseln? Du har inte fått i dig tillräcklig mängd av läkemedlet. Stäng inhalatorn och upprepa steg 3a till 3c. Jag hostade efter inhalation, gör det något? Detta kan inträffa. Så länge kapseln är tom har du fått i dig tillräckligt med läkemedel. Jag kände en liten bit av kapseln på tungan, gör det något? Detta kan hända. Det är inte skadligt. Risken för att kapseln krossas ökar om du sticker hål på kapseln mer än en gång. | Rengöring av inhalatorn Torka munstyckets insida och utsida med en ren, torr och luddfri trasa så att eventuellt pulver avlägsnas. Håll inhalatorn torr. Tvätta aldrig inhalatorn med vatten. |
Kassering av inhalatorn efter användning Inhalatorn i varje förpackning ska kasseras efter att alla kapslar i förpackningen har använts. Fråga apotekspersonal hur man kasserar läkemedel och inhalatorer som inte längre används. |
Ersättning
SEEBRI BREEZHALER inhalaatiojauhe, kapseli, kova
44 mikrog 30 x 1 fol, 90 x 1 fol
- Alempi erityiskorvaus (65 %). Krooninen keuhkoastma ja sitä läheisesti muistuttavat krooniset obstruktiiviset keuhkosairaudet (203).
- Peruskorvaus (40 %).
Atc-kod
R03BB06
Datum för översyn av produktresumén
06.08.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com