INNOHEP injektionsvätska, lösning i endosspruta 8000 anti-Xa IU, 10000 anti-Xa IU, 12000 anti-Xa IU, 14000 anti-Xa IU, 16000 anti-Xa IU, 18000 anti-Xa IU
Kvalitativ och kvantitativ sammansättning
Tinzaparinnatrium 20 000 anti-Xa IU/ml
Hjälpämnen vars verkan är känd:
natriummetabisulfit (1,83 mg/ml) och natrium (≤ 40 mg/ml).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Injektionsvätska i förfylld spruta
Kliniska uppgifter
Terapeutiska indikationer
Behandling av venös tromboembolism hos vuxna inklusive djup ventrombos och lungembolism.
Långvarig behandling av venös tromboembolism och långvarig profylax mot förnyelse av sådan för vuxna cancerpatienter.
Övriga behandlingslinjer (såsom operation eller trombolysbehandling) kan användas för vissa lungembolismpatienter (t.ex. patienter med instabil hemodynamik).
Dosering och administreringssätt
Dosering
Vuxna
Subkutan injektion 175 anti‑Xa IU/kg en gång om dygnet under minst 6 dygns tid tills tillräcklig peroral antikoagulation har erhållits.
Långvarig behandling för vuxna cancerpatienter
Subkutan injektion 175 anti-Xa IU/kg en gång om dygnet. Den rekommenderade längden på behandlingen är 6 månader. Nyttan av behandling som överskrider 6 månader måste bedömas från patient till patient.
Neuraxial anestesi
Behandlingsdoserna (175 IU/kg) av innohep är en kontraindikation för patienter som får neuraxial anestesi, se avsnitt Kontraindikationer. Om neuraxial anestesi behövs måste behandlingen med innohep avslutas minst 24 timmar före åtgärden.
Behandlingen med innohep får inte fortsätta innan det har gått minst 4–6 timmar sedan spinalanestesi eller avlägsnande av kateter.
Utbytbarhet
För utbyte mot annan lågmolekylär heparinprodukt, se avsnitt Varningar och försiktighet.
Pediatrisk population
Säkerhet och effekt för innohep för barn under 18 år har ännu inte fastställts. Tillgänglig information finns i avsnitt Farmakokinetiska egenskaper, men ingen doseringsrekommendation kan fastställas.
Nedsatt njurfunktion
Vid misstänkt nedsatt njurfunktion ska njurfunktionen bedömas baserat på kreatininclearance, med hjälp av en formel som baseras på kreatinin i serum.
Användning på patienter vars kreatininclearance är < 30 ml/min rekommenderas inte, eftersom det inte finns tillräckligt mycket information om doseringen hos sådana patienter. Utifrån tillgängliga data sker ingen kumulation hos patienter vars kreatininclearance är större än 20 ml/min. Vid behov kan behandling med innohep påbörjas för sådana patienter om nyttan bedöms vara större än risken och anti-Xa monitoreras (se avsnitt Varningar och försiktighet: Nedsatt njurfunktion). Vid behov måste dosen regleras enligt anti-Xa-aktiviteten. Om anti-Xa-aktiviteten ligger på den önskade nivån eller över måste innohep-dosen ökas eller minskas. Anti-Xa-aktiviteten ska mätas på nytt efter 3–4 doser. Doserna ska justeras tills den önskade anti-Xa-aktiviteten nås. Anvisning: Mätt med kromogen metod har den uppmätta genomsnittliga aktiviteten varit 0,5–1,5 IU/anti-Xa IU/ml hos friska, frivilliga och patienter som inte lider av nedsatt njurfunktion 4–6 timmar efter dosen.
Äldre population
För äldre patienter används sedvanliga doser av innohep. Försiktighet rekommenderas vid behandling av äldre patienter med nedsatt njurfunktion. Vid misstänkt nedsatt njurfunktion, se avsnitten Dosering och administreringssätt: Nedsatt njurfunktion och 4.4: Nedsatt njurfunktion.
Administreringssätt
Produkter som doseras parenteralt ska granskas visuellt före dosering. Om grumlighet eller fällningar konstateras ska produkten inte användas. Vätskan kan bli gul under förvaring, men den är fortfarande helt användbar.
Behandling med innohep utförs som en subkutan injektion i magområdet, på utsidan av eller upptill på låret, nertill på ryggen eller på armen. Produkten får inte injiceras nära ärr, i eller i närheten av naveln eller i sår. Vid injektion i magområdet ska patienten vara liggande eller i halvsittande ställning och injektionsstället ska alterneras mellan den högra och vänstra sidan. Luftbubblan i sprutan ska inte avlägsnas. Injektionen ska ges i ett hudveck.
Med hjälp av måttskalan på sprutan (0,05 ml intervall) kan dosen ökas med 1000 IU:s intervall. Dosen regleras utifrån patientens vikt. Eventuellt överskott ska tömmas ur sprutan innan injektion ges.
Den riktgivande dosen för olika viktklasser – 175 IU/kg som subkutan injektion en gång om dagen | |||
Kg* | Internationell enhet (IU) | Mängd att injicera (ml) | |
20 000 IU/ml spruta med måttskala | 32–37 | 6000 | 0,30 |
38–42 | 7000 | 0,35 | |
43–48 | 8000 | 0,40 | |
49–54 | 9000 | 0,45 | |
55–59 | 10 000 | 0,50 | |
60–65 | 11 000 | 0,55 | |
66–71 | 12 000 | 0,60 | |
72–77 | 13 000 | 0,65 | |
78–82 | 14 000 | 0,70 | |
83–88 | 15 000 | 0,75 | |
89–94 | 16 000 | 0,80 | |
95–99 | 17 000 | 0,85 | |
100–105 | 18 000 | 0,90 | |
*Den ovanstående beräkningsformeln ska användas vid dosbestämning även för personer under <32 kg eller >105 kg.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Nuvarande eller tidigare immunförmedlad trombocytopeni (typ II) orsakad av heparin (se avsnitt Varningar och försiktighet).
Aktiv omfattande blödning eller tillstånd som exponerar för omfattande blödning och som kan definieras som en blödning förknippad med något av följande:
a) framträder i ett kritiskt område eller organ (t.ex. intrakraniellt, intraspinalt, intraokulärt, retroperitonealt, intraartikulärt eller perikardiellt, intrauterint eller intramuskulärt i samband med kompartmentsyndrom),
b) orsakar en sänkning av hemoglobinnivån med 20 g/l (1,24 mmol/l) eller mer, eller
c) leder till transfusion av två eller fler enheter helblod eller röda blodkroppar.
Septisk endokardit
Behandlingsdoserna (175 IU/kg) av innohep är en kontraindikation för patienter som får neuraxial anestesi. Om neuraxiell anestesi behövs, ska innohep-behandlingen avslutas minst 24 timmar före åtgärden. Behandlingen med innohep får inte fortsätta innan det har gått minst 4–6 timmar från spinalanestesi eller avlägsnande av kateter. Patienterna ska övervakas noga med avseende på symtom på neurologisk skada.
Varningar och försiktighet
Blödning
Försiktighet ska iakttas vid vård av patienter med en förhöjd blödningsrisk (se avsnitt Kontraindikationer). Samtidig användning med läkemedel som påverkar trombocyternas funktion eller koaguleringssystemet ska antingen undvikas eller monitoreras noga (se avsnitt Interaktioner).
Intramuskulära injektioner
innohep får inte ges intramuskulärt, utan den administreras subkutant. På grund av hematomrisken ska intramuskulära injektioner undvikas under behandling med innohep.
Heparininducerad trombocytopeni
Trombocytvärdena ska fastställas innan behandlingen påbörjas och därefter regelbundet på grund av risken för antikroppsmedierad heparininducerad trombocytopeni (typ II) Användningen av innohep ska avbrytas genast om antikroppsmedierad heparininducerad trombocytopeni (typ II) framträder (se Kontraindikationer och Biverkningar). Mängden trombocyter normaliseras i regel inom 2–4 veckor efter att behandlingen avslutas.
Vid långvarig behandling av cancerrelaterad trombos ska trombocytvärdena följas regelbundet, särskilt under de första månaderna. Det bör även noteras att cancer och adjuvanta behandlingar kan orsaka trombocytopeni.
Hyperkalemi
Heparinprodukter kan minska utsöndringen av aldosteron i binjuren, vilket kan leda till hyperkalemi framför allt hos patienter med diabetes mellitus, kronisk njursvikt, tidigare manifestation av metabol acidos, förhöjda kaliumvärden i blodet eller personer som använder kaliumsparande läkemedel. Risken för hyperkalemi kan även växa under långvarig behandling med innohep. Kaliumvärdena hos riskpatienter mäts före påbörjande av innohep-behandling och kaliumvärdena följs regelbundet. Hyperkalemi med anknytning till heparinanvändning är i regel övergående när behandlingen med innohep avbryts. Om behandlingen med innohep är livsviktig ska andra alternativ övervägas (till exempel minskat kaliumintag, avslutande av andra läkemedel som påverkar kaliumbalansen).
Hjärtklaffsproteser
Det finns inte tillräckligt med forskning för att kunna bedöma säkerheten och effekten av behandling med innohep för förebyggande av klafftrombos för patienter med hjärtklaffsproteser. Användning av innohep-injektionsvätska rekommenderas inte för detta ändamål.
Nedsatt njurfunktion
Användning på patienter vars kreatininclearance är < 30 ml/min rekommenderas inte, eftersom det inte finns tillräckligt mycket information om doseringen hos sådana patienter. Utifrån tillgängliga data sker ingen kumulation hos patienter vars kreatininclearance är större än 20 ml/min. Vid behov kan behandling med innohep övervägas för sådana patienter om nyttan bedöms vara större än risken och anti-Xa monitoreras (se avsnitt Dosering och administreringssätt). Även om monitoreringen av anti-Xa lämpar sig för mätning av den farmakodynamiska effekten av innohep kan den inte tillförlitligt förutse blödningsrisken hos patienten.
Äldre population
Njurfunktionen hos äldre patienter kan vara nedsatt (se avsnitt Varningar och försiktighet Nedsatt njurfunktion). Därför krävs försiktighet vid behandling av äldre patienter med innohep-injektionsvätska.
Utbytbarhet
På grund av farmakokinetiska skillnader och skillnader i den biologiska aktiviteten kan lågmolekylära heparinprodukter inte bytas ut mot varandra. Framför allt vid långvarig användning ska byte till en alternativ lågmolekylär heparinprodukt göras med iakttagande av försiktighet och i enlighet med doseringsanvisningarna för produkterna.
Varningar beträffande hjälpämnen
innohep 20 000 anti‑Xa IU/ml innehåller natriummetabisulfit. I sällsynta fall kan metabisulfiter orsaka svåra överkänslighetsreaktioner, inklusive bronkospasm. Försiktighet ska iakttas vid användning av innohep-produkter som innehåller natriummetabisulfit för behandling av astmapatienter.
Det här läkemedlet innehåller ≤ 40 mg natrium per milliliter, vilket motsvarar 2 % av WHO:s rekommenderade maximala natriumintag om 2 g per dag för vuxna.
Interaktioner
Vid samtidig användning av läkemedel som påverkar trombocyternas funktion eller koaguleringssystemet kan den antikoagulerande effekten hos innohep förstärkas. Sådana läkemedel är t.ex. trombocytaggregationshämmare (till exempel acetylsalicylsyra och andra icke-steroida antiinflammatoriska läkemedel), trombolytiska medel, K-vitaminantagonister, aktiverat protein C, direkta Xa- och IIa-hämmare. Nämnda kombinationer ska undvikas, alternativt ska behandling med dessa följas noga (se avsnitt Varningar och försiktighet).
Fertilitet, graviditet och amning
Graviditet
Antikoagulantiabehandling av gravida kvinnor förutsätter vård av specialistläkare.
Djurstudier visar inga direkta eller indirekta skadliga reproduktionstoxikologiska effekter (se Prekliniska säkerhetsuppgifter).
Resultaten från över 2200 graviditetsfall visar inte att tinzaparin skulle medföra missbildningar eller toxiska effekter på fostrets/den nyföddas hälsa. Tinzaparin går inte igenom moderkakan. innohep kan användas under alla graviditetstrimestrar om det anses vara kliniskt nödvändigt.
Epidural anestesi
På grund av risken för spinalhematom är behandlingsdoserna (175 IU/kg) av innohep en kontraindikation för patienter som får neuraxial anestesi. Därför kan epiduralanestesi ges åt gravida kvinnor först när det har gått minst 24 timmar från att vårddosen av innohep har getts. Profylaktiska doser kan användas under förutsättning att karenstiden mellan innohep-dosen och införing av nål eller kateter är minst 12 timmar.
Gravida kvinnor med hjärtklaffsprotes
Misslyckade behandlingar har rapporterats vid behandling av gravida patienter med hjärtklaffsproteser med full innohep-dosering och andra lågmolekylära heparinprodukter. innohep rekommenderas inte för gravida kvinnor med hjärtklaffsprotes.
Amning
Djurförsök tyder på att utsöndring av innohep i bröstmjölk är minimal. Det finns inga tillgängliga data om tinzaparin utsöndras i bröstmjölk. Även om det är osannolikt att lågmolekylära hepariner absorberas oralt kan risken för barn i ammande ålder inte uteslutas. För patienter som löper risk för venös tromboembolism är faran som störst under de sex första veckorna efter förlossningen. Därför är det viktigt att bedöma om amningen eller användningen av innohep ska avbrytas med beaktande av nyttan av bröstamning för barnet och nyttan av innohep-behandling för kvinnan.
Fertilitet
Kliniska försök med avseende på effekterna av innohep på fertiliteten har inte gjorts.
Effekter på förmågan att framföra fordon och använda maskiner
innohep har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
De oftast rapporterade biverkningarna är blödningskomplikationer, anemi till följd av blödning och reaktioner vid injektionsstället.
Blödning kan förekomma i olika organ och svårighetsgraden av blödningen kan variera.
Komplikationer kan förekomma framförallt i samband med stora doser. Även om omfattande blödningar är sällsynta har dödsfall eller bestående men rapporterats i vissa fall.
Antikroppsmedierad heparininducerad trombocytopeni (typ II) kan framträda i större grad inom 5–14 dagar efter att behandlingen har påbörjats. Dessutom har snabba utbrott av trombocytopeni beskrivits hos patienter som har exponerats för heparin tidigare. Antikroppsmedierad heparininducerad trombocytopeni (typ II) kan vara förknippad med artär- och ventrombos. Användningen av innohep ska avbrytas vid alla fall av antikroppsmedierad heparininducerad trombocytopeni (se avsnitt Varningar och försiktighet).
I sällsynta fall kan innohep förorsaka hyperkalemi orsakad av hypoaldosteronism. Patienter med diabetes mellitus eller nedsatt njurfunktion hör till riskgruppen (se avsnitt Varningar och försiktighet).
I samband med behandlingen kan det ibland förekomma svåra allergiska reaktioner. Sådana är sällsynta fall av hudnekros, toxisk huderuption (till exempel Stevens–Johnsons syndrom), angioödem och anafylax. Användningen av innohep ska omedelbart avbrytas om det föreligger minsta lilla misstanke om en allvarlig reaktion.
Incidensen av biverkningar baseras på en kombinerad analys av kliniska undersökningar och spontan rapportering.
Biverkningarna har förtecknats enligt MedDRA SOC -klassificeringen och enskilda biverkningar har förtecknats enligt förekomst, med de vanligaste biverkningarna först. I varje klass har biverkningarna angetts i sjunkande ordning med avseende på hur svår biverkningen är.
Mycket vanliga ≥1/10
Vanliga ≥1/100, <1/10
Mindre vanliga ≥1/1 000, <1/100
Sällsynta ≥1/10 000, <1/1 000
Mycket sällsynta <1/10 000
| Blodet och lymfsystemet | |
| Vanliga ≥1/100, <1/10 | Anemi (inbegripet lågt hemoglobin) |
| Mindre vanliga ≥1/1 000 och <1/100 | Trombocytopeni (typ I) (inbegripet minskat trombocytantal) |
| Sällsynta ≥1/10 000, <1/1 000 | Heparininducerad trombocytopeni (typ II) Trombocytos |
| Immunsystemet | |
| Mindre vanliga ≥1/1 000, <1/100 | Överkänslighet |
| Sällsynta ≥1/10 000, <1/1 000 | Anafylaktisk reaktion |
| Metabolism och nutrition | |
| Sällsynta ≥1/10 000, <1/1 000 | Hyperkalemi |
| Blodkärl | |
| Vanliga ≥1/100, <1/10 | Blödningar Hematom |
| Mindre vanliga ≥1/1 000, <1/100 | Blåmärken, ekkymos och purpura |
| Lever och gallvägar | |
| Mindre vanliga ≥1/1 000, <1/100 | Förhöjda leverenzymvärden (inbegripet förhöjda transaminaser, ALT, AST och GGT) |
| Hud och subkutan vävnad | |
| Mindre vanliga ≥1/1 000, <1/100 | Dermatit (inbegripet allergisk och bullös dermatit) Utslag Klåda |
| Sällsynta ≥1/10 000, <1/1 000 | Toxiska hudutslag (inbegripet Stevens–Johnsons syndrom) Hudnekros Angioödem Urtikaria |
| Muskuloskeletala systemet och bindväv | |
| Sällsynta ≥1/10 000, <1/1 000 | Osteoporos (i samband med långvarig behandling) |
| Reproduktionsorgan och bröstkörtel | |
| Sällsynta ≥1/10 000, <1/1 000 | Priapism |
| Allmänna symtom och/eller symtom vid administreringsstället | |
| Vanliga ≥1/100, <1/10 | Reaktioner vid injektionsstället (inbegripet hematom vid injektionsstället, blödning, smärta, klåda, knöl, erytem och extravasation) |
Långvarig behandling av cancerpatienter
Vid klinisk undersökning var biverkningarna vid långvarig behandling (6 månader) av cancerpatienter jämförbara med biverkningarna för andra patienter som vårdats med innohep. Cancerpatienter har i regel en förhöjd blödningsrisk, som ökar av hög ålder, komorbiditet, kirurgiska ingrepp och samtidig medicinering. Som väntat var incidensen av blödningshändelser större än vad som tidigare observerats vid kortvarig användning och på samma nivå som vid långvarig användning av antikoagulantia hos cancerpatienter.
Pediatrisk population
Baserat på de begränsade data som erhållits efter lansering på marknaden och från en undersökning verkar produkten ha en liknande biverkningsprofil hos barn och unga som hos vuxna.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning via:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
FI-00034 Fimea
Överdosering
Blödning är den vanligaste komplikationen med anknytning till överdosering. På grund av den korta halveringstiden hos innohep (se avsnitt Farmakokinetiska egenskaper) kan små blödningar behandlas genom att avbryta användningen av innohep. Svåra blödningar kan kräva administrering av ett antidot, protaminsulfat. Patienterna måste observeras noga.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Antitrombotiska läkemedel, heparingruppen, ATC-kod: B01AB10
Verkningsmekanism
Tinzaparin är ett lågmolekylärt heparin med porcint ursprung med ett anti-Xa/anti-IIa-förhållande mellan 1,5 och 2,5 som erhållits genom enzymatisk depolymerisering av heparin. Precis som konventionellt heparin förhindrar tinzaparinnatrium medierat av antitrombin III verkan av olika koaguleringsfaktorer, framför allt faktorn Xa.
Den biologiska aktiviteten hos tinzaparinnatrium är standardiserad enligt de nuvarande ”internationella standarderna för lågmolekylära hepariner” och uttrycks i anti-Xa internationella enheter (IU).
Anti-Xa-aktiviteten i tinzaparinnatrium understiger inte 70 IU/mg och överstiger inte 120 IU/mg. Anti-IIa-aktiviteten för tinzaparinnatrium är ungefär 55 IU/mg. Tinzaparin har en molekylvikt på i genomsnitt 6500 dalton.
Farmakodynamisk effekt
Tinzaparin har en hög antitrombinaktivitet (anti-IIa), ett lågt anti-Xa/anti-IIa-förhållande och en hämning av trombinbildning med nästan likartad styrka som ofraktionerat heparin. Utöver dess anti-Xa/IIa aktivitet har induktion av TFPI (Tissue factor Pathway Inhibitor) identifierats hos patienter.
Klinisk effekt och säkerhet
Inledande behandling av akut djup ventrombos och lungemboli
I en dubbelblind klinisk studie jämfördes tinzaparin (175 IU/kg subkutant en gång dagligen) med dosjusterat heparin som gavs genom kontinuerlig intravenös infusion för inledande behandling av patienter med proximal ventrombos. Alla patienter påbörjade oral antikoagulation med warfarin dag 2, och behandlades med tinzaparin eller heparin i minst sex dagar. Sex av 213 patienter som fick tinzaparin (2,8 %) och 15 av 219 patienter som fick heparin (6,9 %) hade en återkommande episod med venös tromboembolism (VTE) (p = 0,07) under studiens 3 månader långa uppföljningstid. Allvarliga blödningar som bedömdes som associerade med den inledande behandlingen inträffade hos en patient som fick tinzaparin (0,5 %) och hos 11 patienter som fick heparin (5,0 %), vilket motsvarar en riskreduktion på 91 % (p = 0,006). Det var 10 dödsfall i tinzaparingruppen (4,7 %) och 21 i heparingruppen (9,6 %), vilket motsvarar en riskreduktion på 51 % (p = 0,049).
I en oblindad studie (THESEE) randomiserades 612 patienter med symptomgivande lungemboli till tinzaparin (175 IU/kg subkutant en gång dagligen) eller dosjusterat intravenöst heparin under de första 8 dagarna av behandlingen. Oral antikoagulation inleddes dag 1–3 och gavs i minst 3 månader. Baserat på ett kombinerat effektmått (återkommande VTE, allvarliga blödningar och dödsfall) hade 9 av 308 patienter i heparingruppen (2,9 %) och 9 av 304 patienter i tinzaparingruppen (3,0 %) uppnått minst ett effektmått på dag 8 (absolut skillnad: -0,1 %; 95 % Kl: -2,7 till 2,6).
Förlängd behandling av akut djup ventrombos och lungemboli
I en subanalys (”Main-LITE cancer”) av en randomiserad, öppen klinisk studie jämfördes tinzaparin (175 IU/kg subkutant en gång dagligen) med warfarin för 3 månaders behandling av patienter med proximal ventrombos. Av de 200 patienter som hade cancer (100 patienter i varje grupp) fanns fler fall av återkommande VTE efter 12 månader i warfaringruppen (16 %) jämfört med tinzaparingruppen (7 %) (absolut skillnad: -9,0; 95 % KI: -21,7 till -0,7). Under 3 månader rapporterades allvarliga blödningar för 7 % av patienterna i båda grupperna. Vid ett år var dödligheten 47 % i båda grupperna.
I en öppen, randomiserad studie av 241 patienter med akut proximal djup ventrombos (DVT) varav 69 med cancer jämfördes tinzaparin (175 IU/kg subkutant en gång dagligen) med en oral vitamin K-antagonist (VKA) under 6 månaders DVT-behandling. Hos patienter med cancer var förekomsten av återkommande VTE lägre i tinzaparingruppen (2/36 [5,5 %]) jämfört med sju av 33 [21,2 %]). En allvarlig blödning inträffade i tinzaparingruppen jämfört med 3 i VKA-gruppen.
I en kontrollerad, öppen, randomiserad klinisk studie (”CATCH”) jämfördes effekten och säkerheten för tinzaparin med warfarin efter 6 månaders behandling av akut symptomgivande DVT eller lungemboli hos patienter med aktiv cancer. Studien inkluderade 900 patienter med njurfunktion motsvarande en kreatininclearance (CrCl) ner till 20 ml/min. Patienter med ett trombocytantal under 50 × 109/l ingick inte i studien. Patienterna i tinzaparingruppen fick injektioner med tinzaparin i full dos (175 IU/kg subkutant) en gång dagligen under hela behandlingsperioden (6 månader) och jämfördes med patienter som fick tinzaparin en gång dagligen i 5–10 dagar följt av dosjusterat warfarin (INR: 2,0–3,0) i 6 månader. Effektutfallsmått (DVT i nedre extremiteterna och lungemboli) och säkerhetsutfallsmått (blödningshändelser, heparininducerad trombocytopeni och dödsfall) bedömdes av en blindad kommitté. Återkommande VTE förekom hos 31 av 449 patienter i tinzaparingruppen och 45 av 451 patienter i warfaringruppen (6 månaders kumulativ incidens: 7,2 % för tinzaparin jämfört med 10,5 % för warfarin; hazardkvot [HR]: 0,65; 95 % Kl: 0,41–1,03; p = 0,07). Symptomatisk DVT förekom hos 12 patienter i tinzaparingruppen och hos 24 patienter i warfaringruppen HR]: 0,48; 95 % Kl: 0,24–0,96; p = 0,04). Det fanns ingen signifikant skillnad när det gäller allvarliga blödningshändelser (HR: 0,89; 95 % KI: 0,40–1,99; p = 0,77) eller dödlighet av alla orsaker (1,08; 95 % KI: 0,85–1,36; p = 0,54), men däremot en statiskt signifikant minskad risk för kliniskt relevant icke-allvarlig blödning i tinzaparingruppen jämfört med warfaringruppen (HR: 0,58; 95 % KI: 0,40–0,84; p = 0,004).
I en på förhand specificerad sekundäranalys av CATCH-studien där konkurrerande utfall användes för en regressionsanalys av tiden till första kliniskt relevanta blödning (clinically-relevant bleeding, CRB; allvarliga och kliniskt relevant icke-allvarliga händelser) var risken att få minst en CRB-händelse under 6-månadersstudien signifikant lägre i tinzaparingruppen (n = 60/449) än i warfaringruppen (n = 78/451), HR: 0,64; 95 % Kl: 0,45–0,89; p = 0,009. De kumulativa incidensfrekvenserna av CRB i de två grupperna skiljde sig åt nästan omedelbart och fortsatte att visa en fördel för tinzaparinpatienter under den sex månader långa behandlingsperioden (se figur 1). I en multivariat analys för alla behandlingsgrupper identifierades risken för CRB att öka med ålder > 75 år (HR 1,83) och intrakraniell malignitet (HR 1,97).
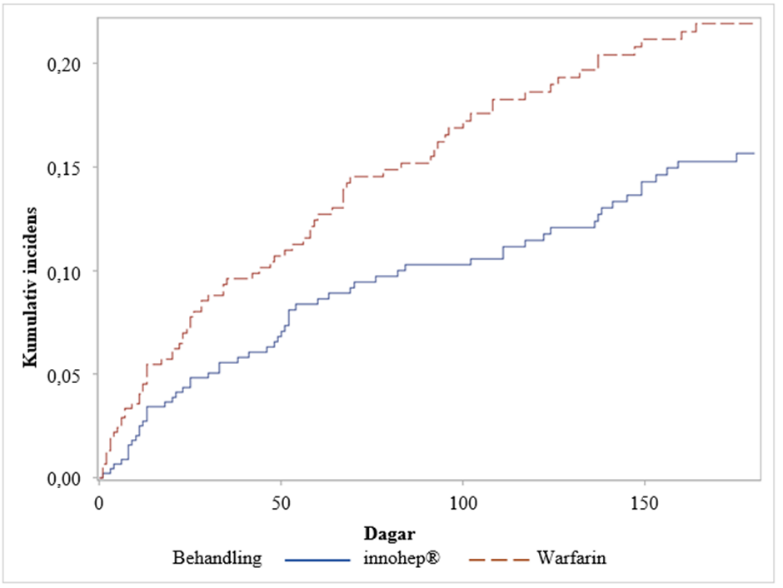
Figur 1
I en sekundäranalys av CATCH-studien bedömdes effekten av nedsatt njurfunktion (renal impairment, RI, definierad som glomerulär filtreringshastighet [GFR] < 60 ml/min/1,73 m2) utifrån antikoagulationsbehandlingens effekt och säkerhet hos patienter med cancerassocierad trombos. Studiepopulationen för denna analys omfattade 864 patienter (96 %) för vilka ett GFR-värde från ett centralt laboratorium var tillgängligt vid randomisering. Av dessa hade 131 patienter (15 %) nedsatt njurfunktion vid baslinjen (69 i tinzaparingruppen och 62 i warfaringruppen). Nedsatt njurfunktion hos patienter med cancerassocierad trombos som fick antikoagulationsbehandling associerades med en statistiskt signifikant ökning av återkommande VTE och allvarliga blödningar, men det sågs ingen signifikant ökning av kliniskt relevanta blödningar (CRB) eller dödligheten. Långtidsbehandling med tinzaparin vid full terapeutisk dos utan dosjustering hos patienter med nedsatt njurfunktion ökade inte frekvenserna av återkommande VTE, CRB, allvarliga blödningar eller dödligheten jämfört med warfarin.
En prospektiv, öppen klinisk studie (”TICAT”) omfattade 247 patienter med aktiv cancer och nydiagnostiserad DVT och/eller lungemboli. Den genomsnittliga behandlingstiden med tinzaparin (175 IU/kg subkutant en gång dagligen) var 15,6 (SD: 13,2) månader. Förekomsten av återkommande VTE minskade under studien från 4,5 % under de första 6 månaderna (95 % KI: 2,2 %–7,8 %) till 1,1 % (95 % KI: 0,1 %–3,9 %) under månad 7–12 (p = 0,08). Förekomsten av kliniskt relevant blödning var 0,9 % per patientmånad (95 % KI: 0,5 %–1,6 %) under de första 6 månaderna och 0,6 % per patientmånad (95 % KI: 0,2 %–1,4 %) under månad 7–12. En patient (0,4 %) avled på grund av återkommande lungemboli och 2 patienter (0,8 %) avled på grund av blödning.
Speciella patientgrupper
Population med nedsatt njurfunktion
Säkerhetsprofilen för tinzaparin (175 IU/kg en gång dagligen) i upp till 30 dagar undersöktes i en studie som omfattade 200 inneliggande äldre patienter med en CrCl på > 20 ml/min. Anti-Xa-aktiviteten i plasma mättes regelbundet. Medelåldern var 85,2 år (intervall: 70 till 102) och genomsnittlig CrCl var 51,2 ± 22,9 ml/min. Ett dödsfall misstänktes vara relaterat till antikoagulationsbehandlingen. Tre allvarliga blödningsepisoder (1,5 %) rapporterades. Heparininducerad trombocytopeni bekräftades hos 2 patienter (1 %). Ingen korrelation sågs mellan anti-Xa-aktivitet och CrCl eller ålder.
Farmakokinetiska egenskaper
Baserat på anti-Xa-aktiviteten efter subkutan dosering är den absoluta tillgängligheten cirka 90 % och den maximala anti-Xa-aktiviteten erhålls inom 4–6 timmar. Halveringstiden för elimination är cirka 3,7 tummar.
Tinzaparinnatrium genomgår mindre metabolisering i levern genom depolymerisering och utsöndras via njurarna i oförändrad eller nästan oförändrad form.
Speciella patientgrupper
Gravida kvinnor
Den farmakokinetiska aktiviteten för tinzaparin har studerats hos gravida kvinnor. Data från sekventiell farmakokinetisk övervakning av 55 gravida kvinnor tyder på att de farmakokinetiska egenskaperna inte skiljer sig från de farmakokinetiska egenskaperna hos icke-gravida kvinnor.
Nedsatt njurfunktion
Tinzaparin har en hög genomsnittlig molekylvikt och det finns kliniska och prekliniska bevis för signifikant icke-renal eliminering av tinzaparin.
Observerad halveringstid för en intravenös bolusinjektion som administreras till dialyspatienter är kortare än subkutan administrering till friska frivilliga (cirka 2,5 timmar mot cirka 3,7 timmar).
I en prospektiv studie undersöktes om tinzaparin (175 anti-Xa IU/kg subkutant en gång dagligen) ackumulerades vid 10 dagars behandling av 30 inlagda patienter äldre än 70 år som erhöll behandlingsdos för akut tromboembolisk sjukdom. Plasmanivåer av anti-Xa och anti-IIa såväl som aktiverad partiell tromboplastintid (APTT) fastställdes före den första injektionen, vid toppnivå, dvs. 5 timmar efter den andra injektionen (dag 2) och på dag 5, 7 och 10. Patienterna var i genomsnitt 87 år (intervall: 71–96 år), hade en kroppsvikt på 62,7 kg (intervall: 38–90 kg) och ett CrCl-medelvärde på 40,6 ± 15,3 ml/min (intervall: 20–72 ml/min). Eftersom ingen patient hade en anti-Xa-aktivitet över 1,5 IU/ml utfördes ingen dosjustering. Den genomsnittliga högsta anti-Xa-nivån var 0,66 ± 0,20 IU/ml (intervall: 0,26–1,04) på dag 2. Det fanns ingen progressiv ökning av anti-Xa- eller anti-IIa-aktiviteten efter upprepad daglig behandling med tinzaparin under 10 dagar. Ingen korrelation hittades mellan anti-Xa- och anti-IIa-aktiviteter och ålder, vikt eller CrCl. Ingen allvarlig blödning inträffade och det förekom inga tromboemboliska komplikationer eller dödsfall.
Pediatrisk population
Enligt preliminära data om användningen av tinzaparin är tinzaparinclearance snabbare hos yngre barn, inbegripet bebisar och nyfödda. Av denna orsak kan yngre barn behöva en större dos än äldre barn. Tillgängliga data är emellertid inte tillräckliga för att ge en doseringsrekommendation, se avsnitt Dosering och administreringssätt.
Prekliniska säkerhetsuppgifter
Hepariner är överlag inte väldigt toxiska och detta gäller även innohep. Detta har konstaterats i toxicitets- och mutagenicitetsförsök. Det enda betydelsefulla fyndet var lokal blödning vid injektionsstället orsakad av mycket stora subkutana doser.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Natriummetabisulfit (E223), natriumhydroxid, vatten för injektionsvätskor.
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år. Sprutorna är engångssprutor.
Särskilda förvaringsanvisningar
Det här läkemedlet förutsätter inga särskilda förvaringsförhållanden.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
INNOHEP injektioneste, liuos, kerta-annosruisku
8000 anti-Xa IU (L:ei) 10 x 0,4 ml (suojakorkki ja turvapidike) (68,99 €), 30 x 0,4 ml (30 (3 x 10) x 0,4 ml, suojakorkki ja turvapidike) (192,50 €)
10000 anti-Xa IU (L:ei) 10 x 0,5 ml (suojakorkki ja turvapidike) (85,76 €), 30 x 0,5 ml (30 (3 x 10) x 0,5 ml, suojakorkki ja turvapidike) (239,97 €)
12000 anti-Xa IU (L:ei) 10 x 0,6 ml (suojakorkki ja turvapidike) (95,14 €), 30 x 0,6 ml (30 (3 x 10) x 0,6 ml, suojakorkki ja turvapidike) (266,38 €)
14000 anti-Xa IU (L:ei) 10 x 0,7 ml (suojakorkki ja turvapidike) (109,88 €), 30 x 0,7 ml (30 (3 x 10 ) x 0,7 ml, suojakorkki ja turvapidike) (308,08 €)
16000 anti-Xa IU (L:ei) 10 x 0,8 ml (suojakorkki ja turvapidike) (116,88 €), 30 x 0,8 ml (30 (3 x 10) x 0,8 ml, suojakorkki ja turvapidike) (327,80 €)
18000 anti-Xa IU (L:ei) 10 x 0,9 ml (suojakorkki ja turvapidike) (130,65 €), 30 x 0,9 ml (30 (3 x 10) x 0,9 ml, suojakorkki ja turvapidike) (366,76 €)
PF-selosteen tieto
Förfylld spruta av glas (färglös, Ph.Eur. typ I, silikoniserad), nål 29G eller 27G, kolv av klorobutylgummi, nålens skyddshatt av styrenbutadiengummi och säkerhetshållare för den använda nålen.
Förpackningsstorlekar:
8000 anti-Xa IU förfyllda sprutor (0,4 ml):, 6×1, 10×1, 30×1, 30 (3×10) st
10 000 anti-Xa IU förfyllda sprutor (0,5 ml): 6×1, 10×1, 30×1, 30 (3×10) st
12 000 anti-Xa IU förfyllda sprutor (0,6 ml): 6×1, 10×1, 30×1, 30 (3×10) st
14 000 anti-Xa IU förfyllda sprutor (0,7 ml): 6×1, 10×1, 30×1, 30 (3×10) st
16 000 anti-Xa IU förfyllda sprutor (0,8 ml): 6×1, 10×1, 30×1, 30 (3×10) st
18 000 anti-Xa IU förfyllda sprutor (0,9 ml): 6×1, 10×1, 30×1, 30 (3×10) st
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
färglös eller halmfärgad, klar och fällningsfri vätska i förfylld spruta.
Särskilda anvisningar för destruktion och övrig hantering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
INNOHEP injektioneste, liuos, kerta-annosruisku
8000 anti-Xa IU 10 x 0,4 ml, 30 x 0,4 ml
10000 anti-Xa IU 10 x 0,5 ml, 30 x 0,5 ml
12000 anti-Xa IU 10 x 0,6 ml, 30 x 0,6 ml
14000 anti-Xa IU 10 x 0,7 ml, 30 x 0,7 ml
16000 anti-Xa IU 10 x 0,8 ml, 30 x 0,8 ml
18000 anti-Xa IU 10 x 0,9 ml, 30 x 0,9 ml
- Ylempi erityiskorvaus (100 %). Daltepariini ja tintsapariini (yli 6 kuukauden hoidossa): Aktiivisen syöpätaudin hoitoon liittyvän laskimon tromboembolian hoito ja pitkäaikainen estohoito erityisin edellytyksin (166).
- Rajoitettu ylempi erityiskorvaus reseptimerkinnällä (100 %). Rintasyöpä (115), Eturauhassyöpä (116), Leukemiat, muut pahanlaatuiset veri- ja luuydintaudit sekä pahanlaatuiset imukudostaudit (117), Gynekologiset syövät (128), Pahanlaatuiset kasvaimet, joita ei ole edellä erikseen mainittu (130). Merkintä lääkemääräyksen 'Perustelut'-kohdassa: Laskimotukos (E008) Tromboembolia (E007) Keuhkoembolia (E004).
- Peruskorvaus (40 %).
Atc-kod
B01AB10
Datum för översyn av produktresumén
15.11.2024
Yhteystiedot
Karhumäentie 3
01530 Vantaa
020 721 8440
www.leo-pharma.fi
info.fi@leo-pharma.com
