INFANRIX-POLIO+HIB pulver och suspension till injektionsvätska, suspension
Kvalitativ och kvantitativ sammansättning
En dos vaccin (0,5 ml) innehåller:
Difteritoxoid1 inte mindre än 30 internationella enheter IU (25 Lf)
Tetanustoxoid1 inte mindre än 40 internationella enheter IU (10 Lf)
Bordetella pertussis-antigener
Pertussistoxoid (PT)1 25 mikrogram
Filamentöst hemagglutinin (FHA)1 25 mikrogram
Pertaktin (PRN)1 8 mikrogram
Poliovirus (inaktiverat) (IPV)
Typ 1 (Mahoney-stam)2 40 D antigenenheter
Typ 2 (MEF-1-stam)2 8 D antigenenheter
Typ 3 (Saukett-stam)2 32 D antigenenheter
Haemophilus influenzae typ b polysackarid
(polyribosylribitolfosfat) (PRP) 10 mikrogram
konjugerat till tetanustoxoid (bärarprotein) cirka 25 mikrogram
1adsorberat till aluminiumhydroxid (hydratiserat) 0,5 mg Al3+
2odlade i VERO-celler
Detta vaccin kan innehålla spår av formaldehyd, neomycin och polymyxin som används vid tillverkningen (se avsnitt Kontraindikationer).
Hjälpämnen med känd effekt
Vaccinet innehåller <0,07 nanogram para-aminobensoesyra per dos och 0,036 mikrogram fenylalanin per dos (se avsnitt Varningar och försiktighet).
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Pulver och suspension till injektionsvätska, suspension.
Kliniska uppgifter
Terapeutiska indikationer
Infanrix-Polio+Hib är avsett för aktiv immunisering mot difteri, stelkramp, kikhosta, polio och sjukdom orsakad av Haemophilus influenzae typ b hos barn från 2 månaders ålder.
Dosering och administreringssätt
Dosering
Grundvaccinering
Grundvaccinationsschemat omfattar två eller tre doser givna enligt officiella rekommendationer. Den första dosen ges tidigast vid 2 månaders ålder. Det ska vara minst 4 veckors mellanrum mellan ytterligare doser i grundvaccinationsschemat.
Boosterdos
Efter två doser i grundvaccinationsschemat ska Infanrix-Polio+Hib ges som boosterdos minst 6 månader efter den sista dosen i grundvaccinationsschemat, helst vid 11–13 månaders ålder.
Efter en grundvaccinationsserie med tre doser ska en boosterdos ges med Hib-konjugatvaccin (monovalent- eller kombinationsvaccin). Boosterdosen av detta Hib-konjugatvaccin ges vid den tidpunkt som anges i de officiella rekommendationerna. I dessa situationer kan Infanrix-Polio+Hib-vaccinet användas som ett boostervaccin om samtidig administrering av andra antigener inte motstrider de officiella rekommendationerna.
Infanrix-Polio+Hib kan ges som en boosterdos till barn som tidigare har immuniserats med andra vacciner som innehåller DTP, polio och Hib-antigener.
Barn
Säkerhet och effekt av Infanrix-Polio+Hib har inte fastställts hos barn över 3 år. Inga data finns tillgängliga.
Administreringssätt
Infanrix-Polio+Hib ges som en injektion djupt i muskeln i den anterolaterala delen av låret.
Det rekommenderas att den extremiteten som ska injiceras vid efterföljande doser varieras.
Infanrix-Polio+Hib ska ges med försiktighet till patienter med trombocytopeni eller blödningsrubbningar, eftersom blödning kan förekomma vid intramuskulär administrering. Man ska trycka hårt på injektionsstället (utan att massera) i minst två minuter.
Infanrix-Polio+Hib ska under inga omständigheter ges intravaskulärt.
Anvisningar om beredning av läkemedlet före administrering finns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Kontraindikationer
Överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen eller formaldehyd, neomycin, polymyxin eller polysorbat 80.
Överkänslighet mot tidigare vaccin mot difteri, stelkramp, kikhosta, polio eller Hib.
Infanrix-Polio+Hib är kontraindicerat hos barn som fått encefalopati av okänd etiologi inom 7 dagar efter en tidigare vaccination som innehåller pertussiskomponent.
Liksom med andra vacciner ska administrering av Infanrix-Polio+Hib skjutas upp hos personer med akut, svår febersjukdom. En lindrig infektion är dock ingen kontraindikation.
Varningar och försiktighet
Liksom för vacciner som ska injiceras i allmänhet ska man alltid ha lämplig medicinsk beredskap och övervakning tillgänglig med avseende på en sällsynt anafylaktisk händelse till följd av vaccination.
Om något av följande har inträffat i tidsmässigt samband med vilket som helst vaccin som innehåller DTP, ska administrering av doser med pertussiskomponent övervägas noggrant.
- Feber ≥ 40,0 °C utan någon annan uppenbar orsak inom 2 dagar efter vaccinationen (rektal mätning).
- Medvetslöshet eller chockliknande tillstånd (hypoton-hyporesponsiv episod) inom 48 timmar efter vaccination.
- Ihållande, otröstlig gråt i minst 3 timmar inom 48 timmar efter vaccinationen.
- Kramper med eller utan feber inom 3 dagar efter vaccinationen.
Under vissa omständigheter, t.ex. vid riklig förekomst av kikhosta, är den potentiella nyttan större än de potentiella riskerna, särskilt då dessa händelser inte medför några bestående konsekvenser. Tillgängliga kliniska data visar att nytta-riskförhållandet för ett acellulärt pertussisvaccin är bättre än för ett helcellsvaccin.
Som med alla vacciner ska beslut om att låta vaccinera eller avstå från att vaccinera barn eller småbarn övervägas och nytta-riskförhållandet noggrant övervägas om den som vaccineras utvecklar svår neurologisk sjukdom eller skov efter sådan.
Hib-komponenten i vaccinet skyddar inte mot andra sjukdomar orsakade av någon annan typ av Haemophilus influenzae eller meningit orsakad av någon annan organism.
Tidigare feberkramper, tendens till kramper, plötslig spädbarnsdöd eller biverkningar efter vaccination med DTP, polio och/eller Hib i släkten är inte kontraindikationer för Infanrix-Polio+Hib.
HIV-infektion är inte ett hinder för Infanrix-Polio+Hib-vaccination.
Hos immunsupprimerade patienter, t.ex. patienter som får immunsuppressiv behandling, är det inte säkert att det förväntade immunologiska svaret uppnås.
Utsöndring av kapselpolysackaridantigen i urinen har beskrivits efter Hib-vaccination. Felaktiga positiva fynd av antigen kan förekomma inom 1‒2 veckor efter vaccinationen.
Infanrix-Polio+Hib-vaccination ska registreras i patientens internationella vaccinationsintyg.
Apné är en potentiell risk vid administrering av en grundvaccinationsserie till mycket prematura spädbarn (barn födda ≤ 28 graviditetsveckor). För dessa spädbarn ska övervakning av andningsfunktionen övervägas i 48‒72 timmar, särskilt om barnet har haft omogen andningsfunktion.
I denna grupp av barn är nyttan av vaccinationen hög. Därför ska man inte låta bli att ge eller skjuta upp vaccinationerna.
Svimning kan förekomma efter eller till och med före vilken som helst vaccination som ett psykogent svar på nålstick. För att undvika skador på grund av svimning ska lämplig beredskap finnas tillgänglig.
Hjälpämnen med känd effekt
Infanrix-Polio+Hib innehåller para-aminobensoesyra som kan ge allergisk reaktion (eventuellt fördröjd) och undantagsvis kramp i luftrören.
Vaccinet innehåller 0,036 mikrogram fenylalanin per dos. Fenylalanin kan vara skadligt om du har fenylketonuri (PKU), en sällsynt genetisk störning där fenylalanin byggs upp för att kroppen inte kan avlägsna det ordentligt.
Vaccinet innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill ”natriumfritt”.
Vaccinet innehåller mindre än 1 mmol (39 mg) kalium per dos, d.v.s. är näst intill ”kaliumfritt”.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Interaktioner
Om Infanrix-Polio+Hib ges samtidigt med ett annat vaccin som ska injiceras, ska vaccinerna alltid ges på olika ställen.
I likhet med andra vaccinationer uppnås inte nödvändigtvis ett adekvat svar hos patienter som får immunsuppressiv behandling eller patienter med nedsatt immunförsvar.
Fertilitet, graviditet och amning
Infanrix-Polio+Hib är inte avsett för vuxna och därför finns det inga data om vaccinets säkerhet under graviditet eller amning.
Effekter på förmågan att framföra fordon och använda maskiner
Ej relevant.
Biverkningar
Kliniska läkemedelsstudier
Sammanfattning av säkerhetsprofilen
Säkerhetsprofilen nedan baseras på data från fler än 3 500 personer.
Liksom för andra DTaP-vacciner och vacciner som innehåller DTaP har lokal reaktogenicitet och feber rapporterats mer efter en boosterdos av Infanrix-Polio+Hib än efter en grundvaccinationsserie.
Lista över biverkningar
Frekvenserna rapporteras enligt följande:
Mycket vanliga: ≥ 1/10
Vanliga: ≥ 1/100 och < 1/10
Mindre vanliga: ≥ 1/1 000 och < 1/100
Sällsynta: ≥ 1/10 000 och < 1/1 000
Mycket sällsynta: < 1/10 000
Infektioner och infestationer
Mindre vanliga: övre luftvägsinfektion
Blodet och lymfsystemet
Mindre vanliga: lymfadenopati
Metabolism och nutrition
Mycket vanliga: aptitlöshet
Psykiska störningar
Mycket vanliga: ovanlig gråt, irritabilitet, rastlöshet
Centrala och perifera nervsystemet
Mycket vanliga: dåsighet
Andningsvägar, bröstkorg och mediastinum
Mindre vanliga: bronkit, hosta, snuva
Magtarmkanalen
Vanliga: diarré, kräkningar
Hud och subkutan vävnad
Mindre vanliga: urtikaria, hudutslag
Sällsynta: klåda, dermatit
Allmänna symtom och/eller symtom vid administreringsstället
Mycket vanliga: feber (≥ 38,0 °C), reaktioner vid injektionsstället, såsom smärta och rodnad, lokal svullnad vid injektionsstället (≤ 50 mm).
Vanliga: Reaktioner vid injektionsstället inklusive förhårdnad, lokal svullnad vid injektionsstället (> 50 mm)1.
Mindre vanliga: ospecificerad svullnad i den injicerade extremiteten, ibland sträcker sig svullnaden till en närliggande led1, feber2 > 39,5 °C, utmattning.
Biverkningar som observerats efter marknadsintroduktionen
Immunsystemet
Allergiska reaktioner (inklusive anafylaktiska3 och anafylaktoida reaktioner)
Centrala och perifera nervsystemet
Kollaps eller chockliknande tillstånd (hypoton-hyporesponsiv episod), kramper (med eller utan feber)
Andningsvägar, bröstkorg och mediastinum
Apné hos mycket prematura spädbarn (barn födda ≤ 28 graviditetsveckor), se avsnitt Varningar och försiktighet.
Hud och subkutan vävnad
Angioneurotiskt ödem3
Allmänna symtom och/eller symtom vid administreringsstället
Svullnad av hela den injicerade extremiteten1, blåsor på injektionsstället3
1Barn som tidigare har fått acellulärt pertussisvaccin är efter en boosterdos mer benägna att få svullnadsreaktioner än barn som fått helcellskikhostevaccin. Dessa reaktioner försvinner i genomsnitt inom 4 dagar.
2Vanlig efter boostervaccination
3Har rapporterats hos vacciner som innehåller GlaxoSmithKline DTaP-komponenten.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta−riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Fall av överdosering har rapporterats efter marknadsintroduktionen. Biverkningar som observerades efter överdosering liknande dem som rapporterats vid administrering av Infanrix-Polio+Hib enligt rekommendationerna.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Vacciner mot bakteriella infektioner i kombination med vacciner mot virusinfektioner, ATC-kod: J07CA06.
Resultaten från kliniska läkemedelsstudier presenteras för varje komponent i tabellerna nedan.
Procentuell andel personer med antikroppstitrar ≥ sensitivitetsgränsen för analysmetoden (cut-off) efter grundvaccinationsserien med Infanrix-Polio+Hib
Antikropp (cut-off) | 3‒5 måna-der N = 86 (1 stu-die) % | 1,5‒3,5‒6 månader N = 62 (1 studie) % | 2‒3‒4 månader N = 337 (3 studier) % | 2‒4–6 månader N = 624 (6 studier) % | 3‒4–5 måna-der N = 127 (2 studier) % | 3-4,5-6 månader N = 198 (1 studie) % |
Antidifteri (0,1 IU/ml)* | 94,1 | 100 | 98,8 | 99,3 | 94,4 | 99,5 |
Antitetanus (0,1 IU/ml)* | 100,0** | 100 | 99,7 | 99,8 | 99,2 | 100 |
Anti-PT (5 EL.U/ml) | 99,5** | 100 | 99,4 | 100 | 98,4 | 100 |
Anti-FHA (5 EL.U/ml) | 99,7** | 100 | 100 | 100 | 100 | 100 |
Anti-PRN (5 EL.U/ml) | 99,0** | 100 | 100 | 100 | 100 | 100 |
Antipolio typ 1 (1/8 utspädning)* | 93,0 | ND | 99,1 | 99,5 | 100 | 100 |
Antipolio typ 2 (1/8 utspädning)* | 95,3 | ND | 95,7 | 99,0 | 99,2 | 100 |
Antipolio typ 3 (1/8 utspädning)* | 98,8 | ND | 100 | 100 | 99,2 | 99,4 |
Anti-PRP (Hib) (0,15 mikrogram/ml)* | 83,7 | 100 | 98,5 | 98,5 | 100 | 98,4 |
Anti-PRP (Hib) (1,0 mikrogram /ml) | 51,2 | 87,1 | 68,5 | 76,0 | 97,6 | 81,2 |
* cut-off godkänd som indikation på hur skyddet utvecklas
** Resultat efter 2 doser från studier med DTaP-HBV-IPV+Hib vid 3,5 och 11 månaders ålder.
N= antal försökspersoner
ND = inte fastställt
Procentuell andel personer med antikroppstitrar ≥ sensitivitetsgränsen för analysmetoden (cut-off) efter boostervaccination med Infanrix-Polio+Hib
Antikropp (cut-off) | Boosterdos vid 11 - 12 månader efter grundvaccinationen vid 3-5 månader N = 184 (1 studie) % | Boosterdos under det andra levnadsåret efter 3 grundvaccinationer N = 1326 (9 studier) % | |||
Antidifteri (0,1 IU/ml)* | 100 | 99,8 | |||
Antitetanus (0,1 IU/ml)* | 99,9** | 99,9 | |||
Anti-PT (5 EL.U/ml) | 99,9** | 99,7 | |||
Anti-FHA (5 EL.U/ml) | 99,9** | 100 | |||
Anti-PRN (5 EL.U/ml) | 99,5** | 99,9 | |||
Antipolio typ 1 (1/8 utspädning)* | 99,4 | 99,9 | |||
Antipolio typ 2 (1/8 utspädning)* | 100 | 100 | |||
Antipolio typ 3 (1/8 utspädning)* | 99,4 | 100 | |||
Anti-PRP (Hib) (0,15 mikrogr/ml)* | 100 | 100 | |||
Anti-PRP (Hib) (1,0 mikrogr/ml) | 96,7 | 99,2 |
* cut-off godkänd som indikation på hur skyddet utvecklas
** Resultat efter 3 doser från studier med DTaP-HBV-IPV+Hib vid 3,5 och 11 månaders ålder.
N= antal försökspersoner
Effekten av GlaxoSmithKline Hib-komponenten (i kombination med DTaP, DTaP-IPV eller DTaP-HBV-IPV-komponenter) har studerats och studierna fortsätter i en omfattande övervakningsstudie efter godkännandet i Tyskland. Efter 4,5 års uppföljning var effekten av DTaP+Hib eller DTaP-IPV+Hib 96,7 % efter en fullständig grundvaccinationsserie och 98,5 % efter en boosterdos (oberoende av grundvaccinationsserie). Under en sjuårig uppföljningsperiod var effekten av Hib-komponenten i två hexavalenta vacciner 89,6 % efter en fullständig grundvaccinationsserie och 100 % efter en fullständig grundvaccinationsserie och en boosterdos (oberoende av vilket Hib-vaccin som användes i grundvaccinationsserien).
Farmakokinetiska egenskaper
Inga farmakokinetiska data behövs för vacciner.
Prekliniska säkerhetsuppgifter
Normala studier på djur avseende säkerhet, specifik toxicitet och komponenternas kompatibilitet visar inte några särskilda risker för människa.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Hib-pulver:
Laktos
DTaP-IPV-suspension:
Natriumklorid
Medium 199 (stabilisator som innehåller aminosyror (inklusive fenylalanin), mineralsalter (inklusive natrium och kalium), vitaminer (inklusive para-aminobensoesyra) och andra substanser)
Vatten för injektionsvätskor
Beträffande adjuvans, se avsnitt KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING.
Inkompatibiliteter
I avsaknad av blandbarhetsstudier får Infanrix-Polio+Hib-vaccinet inte blandas med andra läkemedel.
Hållbarhet
Hållbarheten för vaccinkomponenterna före beredning är 3 år.
Efter beredning ska vaccinet injiceras omedelbart. Förvaringstiden och förvaringsförhållandena för den färdigberedda lösningen är användarens ansvar om den färdigberedda injektionsvätskan inte används omedelbart. Normalt ska förvaringstiden inte överstiga 8 timmar 2 °C - 8 °C (i kylskåp).
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C - 8 °C).
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt Hållbarhet
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
INFANRIX-POLIO+HIB injektiokuiva-aine ja suspensio, suspensiota varten
10 x 1 kpl (-)
PF-selosteen tieto
Pulver i injektionsflaska (typ I glas) innehållande 1 dos med propp (butylgummi) och
0,5 ml suspension i en förfylld spruta (typ I glas) med en kolvring (butylgummi) och ett gummiskyddslock.
Skyddslocket och gummikolvringen på den förfyllda sprutan och proppen på injektionsflaskan är av syntetiskt gummi.
Förpackningsstorlekar 1 och 10 med eller utan nålar.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Läkemedlets utseende:
Komponenten för difteri, stelkramp, kikhosta (acellulärt), poliomyelit (inaktiverat) (DTaP-IPV) är en grumlig, vit suspension.
Komponenten för det frystorkade Haemophilus influenzae typ b (Hib) är ett vitt pulver.
Särskilda anvisningar för destruktion och övrig hantering
Under förvaringen kan en vit fällning med klar supernatant uppstå i den förfyllda sprutans DTaP-Polio-suspension. Detta är inte ett tecken på försämring av kvaliteten.
Den förfyllda sprutan ska omskakas väl för att uppnå en homogen suspension. Administrering av injektionen kräver att Hib-pulvret i injektionsflaskan och DTaP-Polio-suspensionen i den förfyllda sprutan inspekteras visuellt med avseende på främmande partiklar och/eller onormalt fysikaliskt utseende före de tas i bruk samt efter beredning av DTaP-Polio+Hib-vaccinet. Vaccinet ska inte användas om någotdera observeras.
Vaccinet bereds genom att hela innehållet av DTaP-Polio-suspensionen i den förfyllda sprutan tillsätts i injektionsflaskan med Hib-pulver. Den färdigberedda lösningen ska injiceras omedelbart. Beredningen sker enligt följande:
1. Skaka om den förfyllda sprutan innehållande DTaP-Polio suspension.
2. Anslut nålen till den förfyllda sprutan med DTaP-Polio-suspension och injicera hela innehållet i den förfyllda sprutan i injektionsflaskan med Hib.
3. Ta inte bort nålen. Skaka kraftigt om injektionsflaskan med Hib och kontrollera att pulvret är fullständigt upplöst. Den beredda kombinationsinjektionsvätskan är grumligare än DTaP-Polio-suspensionen och kan innehålla små luftbubblor. Detta är normalt.
4. Dra tillbaka hela mängden färdigberedd injektionsvätska i den förfyllda sprutan.
5. Avlägsna och förstör den första nålen. Ersätt den med en annan nål som är lämplig för vaccination och injicera vaccinet.
6. Om vaccinet inte ges omedelbart, ska den färdigberedda injektionsvätskan omskakas kraftigt på nytt före injektionen.
Den förfyllda sprutan levereras antingen med en sprutspets med keramisk beläggning (CCT) eller med en sprutspets i hårdplast med luer lock-adapter (PRTC).
Instruktioner för den förfyllda sprutan
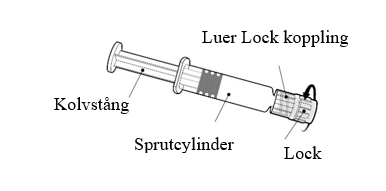
| Håll alltid i sprutcylindern, inte i kolvstången. Skruva av locket på sprutan genom att vrida den motsols. |
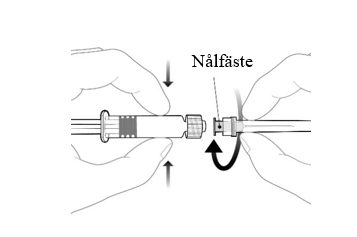
| Fäst nålen på sprutan genom att ansluta den till Luer Lock kopplingen och rotera ett kvarts varv medsols tills du känner att den låser sig. Bered vaccinet som beskrivet ovan. Dra inte ut kolvstången ur sprutcylindern, om detta sker ska vaccinet inte administreras. |
Destruktion
Ej använt vaccin och avfall ska kasseras enligt gällande anvisningar.
Atc-kod
J07CA06
Datum för översyn av produktresumén
27.06.2023
Yhteystiedot
 GLAXOSMITHKLINE OY
GLAXOSMITHKLINE OY Porkkalankatu 20 A
00180 Helsinki
010 303 030
www.glaxosmithkline.fi