TESTAVAN transdermal gel 20 mg/g
Kvalitativ och kvantitativ sammansättning
Ett gram gel innehåller 20 mg testosteron. Ett tryck på pumpen ger 1,15 g (1,25 ml) gel innehållande 23 mg testosteron.
Hjälpämne med känd effekt
Ett gram gel innehåller 0,2 g propylenglykol.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Transdermal gel.
Kliniska uppgifter
Terapeutiska indikationer
Substitutionsbehandling med testosteron mot hypogonadism hos män, när testosteronbrist har bekräftats genom kliniska symtom och laboratorieanalyser.
Dosering och administreringssätt
Dosering
Vuxna män
Den rekommenderade startdosen för Testavan är 23 mg testosteron (ett tryck på pumpen) som appliceras en gång dagligen. För att säkerställa en korrekt dosering ska testosteronnivåerna i serum mätas och dosen titreras med jämna mellanrum, för att bibehålla eugonadala serumtestosteronnivåer (se avsnitt Varningar och försiktighet).
Testosteronnivån i serum ska mätas 2–4 timmar efter dosering ungefär 14 dagar samt 35 dagar efter påbörjad behandling, eller efter dosjustering. Om testosteronkoncentrationen i serum ligger under 17,3 nmol/l (500 ng/dl), kan den dagliga Testavan-dosen ökas med ett pumptryck. Om testosteronkoncentrationen i serum överstiger 36,4 nmol/l (1 050 ng/dl), kan den dagliga Testavan-dosen minskas med ett pumptryck.
Dostitrering bör baseras på både testosteronnivåer i serum och förekomst av kliniska tecken och symtom relaterade till testosteronbrist.
Äldre
Samma dos som för vuxna. Hänsyn bör dock tas till att de fysiologiska testosteronnivåerna avtar med stigande ålder (se avsnitt Varningar och försiktighet).
Högsta, rekommenderade dos
Den högsta rekommenderade dosen är 69 mg testosteron per dag, vilket motsvarar 3 pumptryck.
Nedsatt njur- och leverfunktion
Det har inte genomförts några studier för att visa effekt och säkerhet med detta läkemedel hos patienter med nedsatt njur- eller leverfunktion. Därför ska substitutionsbehandling med testosteron användas med försiktighet hos dessa patienter (se avsnitt Varningar och försiktighet). Efter behandling med Testavan, är testosteronnivåerna liknande för patienter med mild eller måttligt nedsatt njurfunktion som hos de med normal njurfunktion (se avsnitt Farmakokinetiska egenskaper).
Kvinnlig population
Testavan är inte indicerat för användning hos kvinnor.
Pediatrisk population
Testavan är inte indicerat för användning hos barn och har inte utvärderats kliniskt hos män under 18 års ålder.
Administreringssätt
Transdermal användning.
Testavan är en gel som ska appliceras på överarm och axel med applikatorn. Patienterna bör instrueras om att inte applicera Testavan med fingrar eller händer.
Förberedelse av ny pump
För att säkerställa korrekt dosering, ska patienterna instrueras att förbereda varje ny pump innan den används för första gången, genom att trycka ner pumphuvudet helt över ett papper tills gel kommer ut. Kassera den första gel och gel från ytterligare 2 pumptryck och kassera på ett säkert sätt det använda papperet.
Administrering
Testavan ska appliceras en gång dagligen ungefär vid samma tidpunkt, helst på morgonen, på ren, torr och intakt hud på överarm och axel med hjälp av applikatorn. En lägre dos av Testavan tas upp vid administrering på mage eller lår och därför rekommenderas det inte att byta appliceringsställe (se avsnitt Farmakokinetiska egenskaper).
För att applicera gelen efter borttagning av applikatorlocket, ska pumphuvudet tryckas ner hela vägen en gång över applikatorhuvudet. Patienterna bör instrueras om att endast göra ett pumptryck till applikatorn i taget. Applikatorn ska användas för att sprida gelen jämnt över den maximala ytan på en överarm och axel och noga se till att inte få någon gel på händerna. När mer än ett pumptryck krävs för att uppnå den dagliga dosen, upprepas proceduren på den andra överarmen och axeln.
Dos | Appliceringsmetod |
23 mg | Applicera ett pumptryck på en överarm och axel. |
46 mg | Applicera ett pumptryck på en överarm och axel. Upprepa för att applicera ett pumptryck på den andra överarmen och axeln. |
69 mg | Applicera ett pumptryck på en överarm och axel. Upprepa för att applicera ett pumptryck på den andra överarmen och axeln. Upprepa igen för att applicera det tredje pumptrycket på den första överarmen och axeln. |
Rengöring av applikatorn
Efter användning ska applikatorn rengöras med ett mjukt papper och skyddslocket ska sättas tillbaka på applikatorn. Det använda papperet ska kasseras på ett säkert sätt och produkten ska förvaras säkert utom räckhåll för barn.
Efter administrering
Om gelen vidrörts med händerna under appliceringen ska patienterna instrueras att tvätta händerna med vatten och tvål omedelbart efter applicering av Testavan.
Patienterna ska rådas att låta applikationsstället torka helt innan de klär på sig.
Patienterna ska rekommenderas att vänta minst 2 timmar innan dusch, simning eller bad, för att förhindra minskad testosteronabsorption (se avsnitt Varningar och försiktighet).
Använd kläder som alltid täcker applikationsstället för att förhindra oavsiktlig överföring till andra.
Kontraindikationer
- Överkänslighet mot den aktiva substansen, propylenglykol, eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen
- Känd eller misstänkt bröst- eller prostatakarcinom.
Varningar och försiktighet
Testavan ska endast användas om manlig hypogonadism har bekräftats och om annan etiologi som ger symtom har kunnat uteslutas innan behandlingen påbörjas. Testosteronbrist måste tydligt påvisas genom kliniska symtom (regression av sekundära sexuella egenskaper, förändring av kroppssammansättning, asteni, nedsatt libido, erektil dysfunktion etc.) och denna måste bekräftas genom 2 separata blodtestosteronmätningar, innan man påbörjar substitutionsbehandling med testosteron, inbegripet Testavanbehandling.
Innan substitutionsbehandling med testosteron påbörjas måste alla patienter genomgå en grundlig undersökning för att utesluta risken för befintlig prostatacancer. Noggrann och regelbunden kontroll av prostatakörtel och bröst måste utföras i enlighet med rekommenderade metoder (digital rektalundersökning och bestämning av prostataspecifikt antigen (PSA) i serum) minst varje år hos patienter som får testosteronbehandling eller två gånger om året hos äldre patienter och riskpatienter (de med kliniska eller ärftliga faktorer).
Testosteronnivån ska kontrolleras vid behandlingsstart och med regelbundna intervaller under behandlingen. Läkaren ska justera dosen individuellt för att säkerställa att eugonadala testosteronnivåer upprätthålls. Vissa kliniska tecken, såsom irritabilitet, nervositet, viktökning, långvariga eller frekventa erektioner, kan indikera överdriven androgenexponering som kräver dosjustering.
Androgener kan påskynda utveckling av subklinisk prostatacancer och benign prostatahyperplasi.
Testavan ska användas med försiktighet hos cancerpatienter med risk för hyperkalcemi (och åtföljande hyperkalciuri) på grund av skelettmetastaser. Regelbunden kontroll av kalciumkoncentration i serum hos dessa patienter rekommenderas.
Testavan är ej indicerat för behandling av manlig sterilitet eller impotens.
Det finns begränsad erfarenhet av säkerhet och effekt vid användning av Testavan hos patienter över 65 år. För närvarande råder det inte konsensus om åldersspecifika referensvärden för testosteron. Hänsyn bör emellertid tas till att de fysiologiska testosteronhalterna i serum sjunker med stigande ålder.
Testosteron kan orsaka en ökning av blodtrycket och Testavan ska användas med försiktighet hos män med högt blodtryck.
Behandling med testosteron kan hos patienter med svår hjärt-, lever- eller njursvikt eller med ischemisk hjärtsjukdom ge upphov till svåra komplikationer kännetecknade av ödem med eller utan kronisk hjärtinsufficiens. I dessa fall måste behandligen upphöra omedelbart.
Koagulationsrubbningar:
Testosteron ska användas med försiktighet hos patienter med trombofili (benägenhet för blodproppar) eller riskfaktorer för venös tromboembolism (VTE), eftersom det har förekommit fall med trombotiska händelser (t ex djup ventrombos, lungemboli, okulartrombos) hos dessa patienter under testosteronbehandling i studier och rapporter efter marknadsföringsgodkännande. Hos trombofila patienter har fall av VTE rapporterats även under antikoagulationsbehandling och därför bör fortsatt testosteronbehandling efter den första trombotiska händelsen utvärderas noggrant. Vid fortsatt behandling bör ytterligare åtgärder vidtas för att minimera den individuella VTE-risken.
Testosteron bör användas med försiktighet till patienter med ischemisk hjärtsjukdom, epilepsi och migrän eftersom dessa tillstånd kan förvärras.
Det finns publicerade rapporter om ökad risk för sömnapné hos hypogonadala män som behandlas med testosteronestrar, i synnerhet hos de med riskfaktorer som övervikt eller kronisk lungsjukdom.
Om patienten utvecklar en allvarlig reaktion på appliceringsstället ska behandlingen omprövas och vid behov avbrytas.
Hos patienter som får långvarig androgenbehandling bör följande parametrar också övervakas regelbundet: hemoglobin, hematokrit, leverfunktionstester och lipidprofil.
Testavan ska inte användas av kvinnor på grund av de möjliga viriliserande effekterna.
Eftersom dusch eller bad efter administrering av Testavan minskar testosteronnivåerna rekommenderas patienterna att inte duscha eller bada under minst 2 timmar efter applicering av Testavan. Om patienten duschar eller badar inom 2 timmar efter gelapplikationen kan absorptionen av testosteron minska.
Testavan innehåller propylenglykol, vilket kan orsaka hudirritation.
Alkoholbaserade produkter inklusive Testavan är brandfarliga; därför ska eld, flammor eller rökning undvikas tills gelen har torkat.
Möjlig överföring
Om inga försiktighetsåtgärder vidtas, kan testosterongel överföras till andra personer vid nära hudkontakt, vilket medför förhöjda testosteronnivåer i serum och eventuella biverkningar (t ex ansikts- och/eller kroppsbehåring, akne, djupare röst, oregelbundna menstruationscykler) vid upprepad kontakt (oavsiktlig androgenisering).
Läkaren bör noga informera patienten om risken för testosteronöverföring och om säkerhetsföreskrifter (se nedan). Testavan ska inte förskrivas till patienter med stor risk för att inte följa säkerhetsföreskrifterna (t ex svår alkoholism, drogmissbruk, allvarliga psykiska rubbningar).
Överföring undviks genom att bära kläder som täcker appliceringsområdet eller genom att bada eller duscha före kontakt.
Till följd av detta rekommenderas följande försiktighetsåtgärder:
För patienten:
- använd inte händerna utan applikatorn vid administrering för att minska risken för sekundär exponering för testosteron.
- om gelen har vidrörts med händerna under appliceringen, tvätta händerna noga med tvål och vatten efter applicering av gelen.
- täck appliceringsområdet med kläder när gelen har torkat.
- bada eller duscha innan situationer där hudkontakt med andra personer kan förväntas.
För personer som inte behandlas med Testavan:
- vid kontakt med ett appliceringsområde som inte har tvättats eller täckts med kläder, tvättas det hudområde där testosteron kan ha överförts med tvål och vatten så snart som möjligt.
- rapportera om det uppstår tecken på kraftig androgenexponering, såsom akne eller förändrad behåring.
För att garantera partnerns säkerhet bör patienten rådas att till exempel bära en t-shirt som täcker appliceringsområdet vid kontakttillfället eller att duscha före sexuellt umgänge.
Dessutom rekommenderas att patienten bär en T-shirt som täcker appliceringsområdet vid kontakt med barn för att undvika risken att kontaminera barnens hud.
Gravida kvinnor måste undvika kontakt med appliceringsställen för Testavan. Om partnern blir gravid måste patienten vara extra noga med de försiktighetsåtgärder vid användning (se avsnitt Fertilitet, graviditet och amning).
Patienter ska rådas att minimera användningen av kroppslotion och solskyddsmedel på applikationsområdet, under och strax efter appliceringen av Testavan gel.
Interaktion med laboratorieanalyser: androgener kan reducera nivåerna av tyroxinbindande globulin vilket leder till en sänkning av totala tyroxin (T4) plasmakoncentrationen och ett ökat resinupptag av trijodtyronin (T3) och T4. Nivåerna av fria tyreoideahormoner förblir emellertid opåverkade och det föreligger inga kliniska tecken på sköldkörtelinsufficiens.
Interaktioner
När androgener ges samtidigt med antikoagulanter kan antikoagulanteffekten öka. Patienter som får orala antikoagulanter behöver monitoreras noga med avseende på internationell normaliserad kvot (INR), i synnerhet när androgenbehandlingen påbörjas eller avslutas.
Den samtidiga administreringen av testosteron med adrenokortikotropiskt hormon (ACTH) eller kortikosteroider kan öka risken för ödembildning; alltså bör dessa läkemedel administreras med varsamhet, i synnerhet hos patienter med hjärt-, njur- eller leversjukdom.
Förbättrad insulinkänslighet kan uppstå hos patienter som behandlas med androgener och som uppnår normala testosteronkoncentrationer i plasma på grund av substitutionsbehandling.
Interaktionsstudier med kroppslotion och solskyddsmedel har inte utförts.
Fertilitet, graviditet och amning
Testavan är endast avsett att användas av män.
Inga kliniska prövningar har utförts med Testavan för bedömning av fertilitet hos män. Testavan kan reversibelt reducera spermatogenesen (se avsnitt Prekliniska säkerhetsuppgifter).
Gravida kvinnor ska undvika hudkontakt med applikationsställen för Testavan (se avsnitt Varningar och försiktighet).
Om ett oduschat eller avklätt hudområde på vilket Testavan har applicerats kommer i direkt kontakt med huden hos en gravid kvinna, ska kontaktområdet på kvinnan omedelbart tvättas med tvål och vatten.
Testosteron kan inducera viriliserande effekter på fostret.
Effekter på förmågan att framföra fordon och använda maskiner
Testavan har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
a. Sammanfattning av säkerhetsprofilen
De vanligaste rapporterade biverkningarna i fas 2 och fas 3 kliniska studier, som varade upp till 9 månader, var reaktioner på administreringsstället (4 %) inklusive: utslag, erytem, klåda, dermatit, torrhet och hudirritation. Majoriteten av dessa biverkningar var milda till måttliga i svårighetsgrad.
b. Tabell med sammanfattning av biverkningar
Biverkningar som har rapporterats i fas 2 och fas 3 studier för Testavan är listade i tabellen nedan. Alla misstänkta biverkningar är sorterade enligt organsystemklass och följande frekvens: vanliga (> 1/100 till < 1/10); mindre vanliga (> 1/1000, 1/100).
De läkemedelsrelaterade biverkningar rapporterade i kliniska studier som utförts med Testavan (minst ett fall, N = 379).
Organsystem | Vanliga (> 1/100 till < 1/10) | Mindre vanliga (> 1/1000, < 1/100) |
Allmänna symtom och/eller symtom vid administreringsstället | Reaktioner på administreringsstället (inklusive: utslag, erytem, klåda, dermatit, torrhet och hudirritation) | |
Undersökningar | Förhöjning av triglycerider i blodet/hypertriglyceridemi, förhöjt PSA, förhöjd hematokrit | Förhöjt hemoglobin |
Blodkärl | Hypertoni | |
Centrala och perifera nervsystemet | Huvudvärk |
Enligt litteratur och spontan rapportering från testosterongeler, anges andra kända biverkningar i tabellen nedan:
Organsystem | Biverkningar – Preferred term |
Blodet och lymfsystemet | Polycytemi, anemi |
Psykiska störningar | Sömnlöshet, depression, ångest, aggression, nervositet, fientlighet |
Centrala och perifera nervsystemet | Huvudvärk, yrsel, parestesi |
Blodkärl | Värmevallningar (vasodilation), djup ventrombos |
Andningsvägar, bröstkorg och mediastinum | Dyspné, sömnapné |
Magtarmkanalen | Illamående |
Hud och subkutan vävnad | Olika hudreaktioner kan förekomma inklusive akne, seborré och skallighet (alopeci), svettning, hypertrikos |
Muskuloskeletala systemet och bindväv | Muskuloskeletal smärta, muskelkramper |
Njurar och urinvägar | Oförmåga att urinera, urinvägsobstruktion |
Reproduktionsorgan och bröstkörtel | Gynekomasti, ökad frekvens av erektioner, testikelavvikelser, oligospermi, godartad prostatahyperplasi, libidoförändringar (behandling med höga doser testosteronpreparat stoppar eller minskar vanligen reversibelt spermatogenesen, och minskar därmed testiklarnas storlek; substitutionsbehandling med testosteron mot hypogonadism kan i sällsynta fall orsaka ihållande, smärtsamma erektioner (priapism), prostataavvikelser, prostatacancer*) |
Allmänna symtom och/eller symtom vid administreringsstället | Asteni, malaise, reaktion på applikationsstället. Höga doser eller långvarig administrering av testosteron ökar ibland förekomsten av vattenretention och ödem; överkänslighetsreaktioner kan förekomma. |
Undersökningar | Viktökning, förhöjt PSA, förhöjd hematokrit, ökat antal röda blodkroppar eller förhöjt hemoglobin |
Metabolism och nutrition | Elektrolytiska rubbningar (retention av natrium, klor, kalium, kalcium, oorganiskt fosfat och vatten) vid höga doser och/eller längre behandling. |
Lever och gallvägar | Gulsot och avvikelser i leverfunktionstest. |
* Data angående risken för prostatacancer i samband med testosteronbehandling är ofullständiga.
På grund av alkoholinnehållet i produkten kan frekventa applikationer på huden orsaka irritation och torr hud.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande.
Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Inget fall av överdosering med Testavan har rapporterats i kliniska prövningar.
Symtom
Kliniska tecken som irritation, nervositet, viktökning, förlängd eller frekvent erektion kan indikera överexponering för androgen och testosteronnivåer i serum bör därför mätas.
Behandling
Behandling av överdosering består av utsättande av Testavan tillsammans med lämplig symptomatisk och stödjande vård.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: androgener
ATC-kod: G03BA03
De endogena androgenerna testosteron och dihydrotestosteron (DHT) är ansvariga för normal tillväxt och utveckling av de manliga könsorganen och för upprätthållandet av de sekundära könskaraktärerna. De påverkar tillväxt och utmognad av prostata, sädesblåsor, penis och scrotum; utveckling av manlig behåring av ansikte, bröst, axiller och pubis; förstoring av struphuvudet, förtjockning av stämbanden, förändringar i kroppsmuskulatur och fettdistribution.
Otillräcklig sekretion av testosteron till följd av underfunktion i testiklar, patologisk process i hypofysen eller brist på gonadotropin eller gonadotropinfrisättande hormon leder till manlig hypogonadism och låg testosteronkoncentration i serum. De symtom som är förenade med lågt testosteron innefattar bland annat sänkt sexuell lust med eller utan impotens, trötthet, förlorad muskelmassa, sänkt stämningsläge och tillbakabildning av de sekundära könskaraktärerna.
Om man återställer testosteronnivåerna till normalområdet kan detta med tiden leda till förbättringar av muskelmassa, sinnesstämning, sexuell lust, libido och sexuell funktion, inklusive sexuell förmåga och antalet spontana erektioner.
Under exogen administrering av testosteron till normala män kan den endogena frisättningen av testosteron minska till följd av en feedback-hämning av luteiniserande hormon (LH) från hypofysen. Vid höga doser av exogena androgener kan spermatogenesen också hämmas till följd av en hämning av follikelstimulerande hormon (FSH) från hypofysen.
Administrering av androgen framkallar retention av natrium, kväve, kalium, fosfor och sänkt urinutsöndring av kalcium. Androgener har rapporterats öka proteinanabolismen och sänka proteinkatabolismen. Kvävebalansen förbättras endast om det föreligger ett tillräckligt intag av kalorier och protein. Androgener har rapporterats stimulera bildningen av röda blodkroppar genom att öka produktionen av erytropoetin.
Farmakokinetiska egenskaper
Testavan levererar fysiologiska mängder testosteron, vilket ger en cirkulerande testosteronnivå som liknar den normala hos friska män (d v s 300–1 050 ng/dl). Testavan utvärderades i en multi-center, oblindad, 120-dagars klinisk fas 3-studie (studie 000127) hos 159 hypogonadala män i åldrarna 18 till 75 år (medelålder 54,1 år). Försökspersonerna var vita (77 %), svarta (20 %), asiatiska (2 %) och med blandat ursprung (1 %). I fas 3-studien, vid slutet av en 90-dagars behandlingsperiod (under vilken dosen av Testavan kunde titreras baserat på totala testosteronkoncentrationer) hade 76,1 % av männen genomsnittliga testosteronkoncentrationer över en 24-timmarsperiod (Cmedel) inom eugonadal-området (300–1 050 ng/dl).
Den genomsnittliga testosteronkoncentrationsprofilen på dag 90 visas i figur 1, medan de farmakokinetiska parametrarna för total testosteron på dag 90 för varje Testavandos sammanfattas i tabell 1.
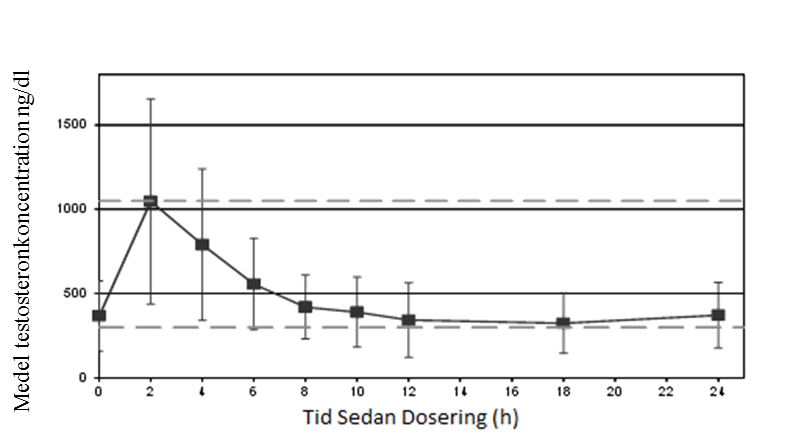
Figur 1. Medel ± SD serumkoncentrationer av testosteron på dag 90 efter titrering av Testavan
Tabell 1. Farmakokinetiska parametrar för total testosteron på dag 90 efter titrering, studie 000127 fullständig analysuppsättning
Testavandos på dag 90 | N | Cmin Medel ±SD | Cmedel Medel ±SD | Cmax Medel ±SD | Tmax Median |
23 mg | 5 | 191 ± 49 | 368 ± 121 | 721 ± 254 | 4,02 |
46 mg | 45 | 277 ± 140 | 506 ± 207 | 1228 ± 640 | 2,02 |
69 mg | 89 | 229 ± 82 | 438 ± 164 | 1099 ± 595 | 2,08 |
Cmin: minimikoncentration; Cmedel: Genomsnittlig koncentration över en 24-timmarsperiod; Cmax: maximal koncentration; Tmax: tid för maximal koncentration; SD: standardavvikelse
Absorption
Testavan levererar testosteron transdermalt, med en median Tmax på cirka 2–4 timmar efter dosering. Totala testosteronkoncentrationerna återgår till samma värden som innan dosering cirka 12 timmar efter applicering och ingen ackumulering sker efter daglig applicering under 10 dagar. Applicering av Testavan på överarmen och axeln resulterar i högre testosteronnivåer i serum än de efter applicering av produkten på magen eller insidan av låret. Genomsnittliga värden på Cmax var 926, 451 respektive 519 ng/dl samt genomsnittliga värden på Cave var 557, 372 respektive 395 ng/dl.
Fas 2 studier visar att de totala testosteronkoncentrationerna ökade med ökande dos efter daglig applicering av 23, 46 och 69 mg Testavan.
Distribution
Cirkulerande testosteron förekommer i serum främst bundet till könshormonbindande globulin (SHBG) och albumin. Den albuminbundna fraktionen av testosteron dissocierar lätt från albumin och förmodas vara biologiskt aktiv. Den andel av testosteronet som är bunden till SHBG anses ej vara biologiskt aktiv. Cirka 40 % av testosteron i plasma är bundet till SHBG, 2 % förblir obundet (fritt) och resten är bundet till albumin och andra proteiner.
Metabolism
Enligt rapporter i litteraturen varierar halveringstiden för testosteron avsevärt; den kan sträcka sig från 10 till 100 minuter.
Testosteron metaboliseras till olika 17-keto steroider via två olika metaboliseringsvägar. De huvudsakliga aktiva metaboliterna av testosteron är östradiol och dihydrotestosteron (DHT).
Eliminering
Cirka 90 % av testosteron som givits intramuskulärt utsöndras i urinen som glukuronsyra- och svavelsyrakonjugat av testosteron och dess metaboliter; cirka 6 % av en dos utsöndras i faeces, till största delen i okonjugerad form.
Effekt av dusch
Duschning 1 timme och 2 timmar efter administrering av Testavan minskade Cave med 19,2 % respektive 14,3 % jämfört med personer som inte duschade efter administrering av Testavan. Dusch 6 timmar efter administrering av Testavan resulterade inte i en minskning av Cave.
Njurfunktion
Testosteron Cave och Cmax var likande hos patienter med normal njurfunktion och de med mild eller moderat nedsatt njurfunktion. Det finns inga data för patienter med allvarligt nedsatt njurfunktion.
Prekliniska säkerhetsuppgifter
Toxikologiska studier har inte visat andra effekter än de som kan förklaras med hormonprofilen hos Testavan.
Fertilitetsstudier på gnagare och primater har visat att behandling med testosteron kan försämra manlig fertilitet genom att på ett dosberoende sätt hämma spermatogenesen.
Testosteron har in vitro visat sig vara icke-mutagen med den indirekta mutationsmetoden (Ames test) eller hamsterovarieceller. Man har funnit ett samband mellan androgenbehandling och vissa cancerformer hos försöksdjur. Experimentella data från råttor har visat ökad förekomst av prostatacancer efter behandling med testosteron.
Det är känt att könshormoner gynnar utvecklingen av vissa tumörer som induceras av kända karcinogena ämnen. Den kliniska betydelsen av denna observation är inte känd.
Miljöriskbedömning
Studier för miljöriskbedömningar har visat att Testavan kan utgöra en risk för den akvatiska miljön (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Etanol (96 %)
Vatten, renat
Propylenglykol (E 1520)
Dietylenglykolmonoetyleter
Karbomer 980
Trolamin
Dinatriumedetat
Inkompatibiliteter
Ej relevant.
Hållbarhet
3 år
Särskilda förvaringsanvisningar
Detta läkemedel har inga särskilda förvaringsanvisningar.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
TESTAVAN transdermaaligeeli
20 mg/g (L:ei) 56 annosta (applikaattori) (56,99 €), 56 annosta (53,83 €), 3 x 56 annosta (applikaattori) (150,61 €)
PF-selosteen tieto
Testavan levereras i en flerdosbehållare som består av en doseringspump med en laminatfoliepåse i en flaska och är försedd med en applikator med ett hygieniskt lock. Pumpen består av polypropen, etylenpropylendienmonomer och rostfritt stål och påsen är ett polyeten/polyetentereftalat/aluminium/polyetenlaminat inkapslat i en styv polypropenflaska.
Produkten finns tillgänglig i förpackningar med en flerdosbehållare. Varje pump innehåller 85,5 g Testavan gel och räcker till 56 uppmätta doser.
Läkemedlets utseende:
Homogen, genomskinlig till lätt opaliserande gel.
Särskilda anvisningar för destruktion och övrig hantering
Detta läkemedel kan utgöra en risk för miljön (se avsnitt Prekliniska säkerhetsuppgifter).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
TESTAVAN transdermaaligeeli
20 mg/g 56 annosta, 56 annosta, 3 x 56 annosta
- Ylempi erityiskorvaus (100 %). Aivolisäkkeen etulohkon vajaatoiminta (101), Sukurauhasten vaikea vajaatoiminta (121).
- Peruskorvaus (40 %).
Atc-kod
G03BA03
Datum för översyn av produktresumén
04.05.2021
Yhteystiedot
Ground Floor, 71 Lower Baggot Street
D02 P593 Dublin
Ireland
regulatory@simplepharma.company
