TISSEEL lösningar till vävnadslim
Kvalitativ och kvantitativ sammansättning
Komponent 1: Proteinlösning (Tisseel lösning)
humant fibrinogen (koagulerbart protein) 91 mg1/ml
aprotinin (syntetiskt) 3 000 KIE2/ml
Komponent 2: Trombinlösning
humant trombin 500 IE3/ml
kalciumkloriddihydrat 40 mikromol/ml
Dubbelkammarspruta: produkten finns i en förfylld spruta med två behållare där den ena behållaren innehåller 1 ml, 2 ml eller 5 ml proteinlösning (med syntetiskt aprotinin) och den andra behållaren 1 ml, 2 ml eller 5 ml trombinlösning (med kalciumkloriddihydrat). Sprutan innehåller totalt 2 ml, 4 ml eller 10 ml av den färdiga produkten.
eller alternativt
Ett system med två sprutor (Duo Syringe system): en hållare för två sprutor med en förfylld spruta med blåmärkt skala med 1 ml, 2 ml eller 5 ml djupfryst proteinlösning (med syntetiskt aprotinin) och en förfylld spruta med svartmärkt skala med 1 ml, 2 ml eller 5 ml djupfryst trombinlösning (med kalciumklorid). Sprutorna innehåller totalt 2 ml, 4 ml eller 10 ml av den färdiga produkten.
Efter blandning | 1 ml | 2 ml | 4 ml | 10 ml |
Komponent 1: Protein (Tisseel) lösning | ||||
humant fibrinogen (koagulerbart protein) | 45,5 mg | 91 mg | 182 mg | 455 mg |
syntetiskt aprotinin | 1500 KIE | 3000 KIE | 6000 KIE | 15000 KIE |
Komponent 2: trombinlösning | ||||
humant trombin | 250 IE | 500 IE | 1000 IE | 2500 IE |
kalciumkloriddihydrat | 20 mikromol/ml | 40 mikromol/ ml | 80 mikromol/ ml | 200 mikromol/ ml |
1 Total proteinkoncentration 96-125 mg/ml
2 1 EPU (European Pharmacopoeia) motsvarar 1 800 KIE (Kallidinogenase Inactivator Unit)
3 Trombinaktiviteten beräknas enligt den aktuella internationella WHO-standarden för trombin.
Tisseel innehåller 0,6–5 IU/ml humant koagulationsfaktor XIII, som samrenas vid rening av det humana fibrinogenet.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Lösningar till vävnadslim.
Kliniska uppgifter
Terapeutiska indikationer
Behandling när kirurgisk standardteknik inte är tillräcklig (se avsnitt Farmakodynamiska egenskaper):
- För att förbättra hemostas.
- Som vävnadslim för att främja sårläkningen eller som suturstöd vid kärlkirurgin, gastrointestinala anastomoser, neurokirurgi och vid kirurgiska ingrepp där kontakt med cerebrospinalvätskan eller dura mater (t.ex. vid öron-, näs- och halskirurgi, oftalmisk- och spinalkirurgi) kan uppstå.
- Vid limning av vävnader för att förbättra vidhäftningen av fristående vävnadsytor (t.ex. vävnadsflikar, transplantat, transplantat av tunn hud, perforerade transplantat).
Effektivitet har påvisats även hos heparinbehandlade patienter.
Dosering och administreringssätt
Tisseel får enbart användas av kirurger som har utbildats i användningen av Tisseel.
Dosering
Mängden Tisseel som appliceras och appliceringsfrekvensen ska alltid bestämmas utifrån patientens kliniska behov.
Dosen som appliceras är beroende av olika faktorer, såsom typen av kirurgiskt ingrepp, behandlingsytans storlek, applikationsmetoden och antalet appliceringar.
Dosen som ska appliceras bestäms individuellt av läkaren för varje patient. I kliniska prövningar har de de individuella doserna vanligtvis varit 4-20 ml. Vissa ingrepp (t.ex. behandling av leverskador eller stora brännskador) kan kräva större mängder.
Den inledande dosen som ska appliceras ska räcka för att täcka hela det avsedda behandlingsområdet. Appliceringen kan vid behov upprepas. Man ska dock undvika att upprepa applicering av Tisseel på ett redan tidigare polymeriserat lager Tisseel, eftersom Tisseel inte fäster på ett polymeriserat lager. Applicering av de två komponenterna separat, i följd, ska undvikas.
Vid limning av ytor, räcker en förpackning Tisseel 2 ml (dvs. 1 ml proteinlösning och 1 ml trombinlösning) till ett område på minst 10 cm2.
Vid sprayning räcker samma mängd Tisseel till ett betydligt större område, beroende på indikation och det individuella fallet.
Iakttag försiktighet när vävnadslimmet appliceras med hjälp av trycksatt gas. Instruktioner och försiktighetsåtgärder i bruksanvisningen för tillbehöret ska följas (se avsnitt Varningar och försiktighet).
Produkter som innehåller oxiderad cellulosa kan minska effekten hos Tisseel och ska inte användas som hjälpmedel vid applicering.
Applicering utanför det avsedda området ska undvikas.
För att undvika bildning av granulationsvävnad i överskott och för att säkerställa gradvis absorption av det stelnade fibrinlimmet ska Tisseel appliceras så tunt som möjligt.
Administreringssätt
För att säkerställa optimal säker användning av Tisseel genom sprayning ska följande rekommendationer följas:
För epilesionell användning.
En tryckregulator som kan ge ett tryck på högst 2,0 bar (28,5 psi) ska användas vid öppen kirurgi.
Vid minimalt invasiva/laparoskopiska ingrepp ska en tryckregulator som ger ett tryck på högst 1,5 bar (22 psi) och som endast använder koldioxidgas användas.
Innan appliceringen av Tisseel-vävnadslimm ska sårets yta torkas med standardteknik (t.ex. växelvis användning av kompresser, bomullspinnar eller suganordningar).
Använd inte trycksatt gas för torkning av sårytan.
Tisseel-vävnadslimm får endast appliceras på synliga sårytor.
Tisseel-vävnadslimmet får endast blandas och appliceras i enlighet med instruktionerna och tillsammans med de apparater som rekommenderas för denna produkt (se avsnitt Särskilda anvisningar för destruktion och övrig hantering).
Om vävnadslimmet appliceras genom sprayning, se avsnitt Varningar och försiktighet och Särskilda anvisningar för destruktion och övrig hantering för specifika rekommendationer gällande nödvändigt tryck och sprayningsavstånd för respektive kirurgiskt ingrepp samt rekommendation om längd på applikatorspetsar.
Vid kirurgiska ingrepp där minsta möjliga volym av vävnadslim ska användas bör de första dropparna av produkten kasseras.
Kontraindikationer
Tisseel får inte ensamt användas för behandling av stora och häftiga arteriella eller venösa blödningar.
Tisseel ersätter inte stygnen vid förslutningen av ett kirurgiskt sår.
Tisseel får inte appliceras intravaskulärt. Detta kan orsaka livshotande tromboemboliska biverkningar.
Överkänslighet mot de aktiva innehållsämnena eller mot något hjälpämne (se även avsnitt Varningar och försiktighet).
Varningar och försiktighet
Endast för epilesionell användning. Får inte appliceras intravaskulärt. Livshotande tromboemboliska biverkningar kan förekomma om preparatet av misstag appliceras intravaskulärt.
Applicera Tisseel i ett tunt lager. Alltför tjockt lager kan påverka produktens effektivitet och sårläkningen negativt.
Livshotande/dödliga luft- eller gasembolismer har förekommit i samband med användning av sprayset som använder en tryckregulator för att administera vävnadslim. Detta verkar vara förknippat med användning av spraysetet vid ett högre tryck än vad som rekommenderas och/eller nära vävnadsytan. Risken verkar vara större när vävnadslim sprayas med luft jämfört med CO2, och därför kan risken inte uteslutas för Tisseel när denna sprayas vid öppen kirurgi.
Vid användning av Tisseel med hjälp av ett sprayset, var noga med att använda ett tryck som rekommenderas av spraysettillverkaren (se tryck och avstånd i tabellen i avsnitt Särskilda anvisningar för destruktion och övrig hantering). Användaren varnas för användning av andra tillverkares sprayset som inte är godkända för användning med Tisseel.
Applicering av Tisseel med hjälp av ett sprayset, ska endast användas om det är möjligt att noga kunna avgöra sprayningsavståndet som rekommenderas av tillverkaren. Spraya inte på närmare avstånd än vad som rekommenderas.
Vid sprayning av Tisseel ska förändringar i blodtryck, puls, syremättnad och sluttidal CO2 övervakas med tanke på risken för luft‑ eller gasembolism (se även avsnitt Dosering och administreringssätt).
Tisseel ska generellt inte appliceras med sprayset-applikator på inneslutna kroppsytor. Tisseel får endas sprayas på synliga ytor. DuploSpray MIS applikator med regulator är enda hjälpmedlet utformat för sprayning (sprayapplicering) av Tisseel i inneslutna områden i bröst och buk. Instruktioner och varningar i bruksanvisningen för DuploSpray MIS måste följas noggrant. Innan Tisseel används ska kroppsytorna utanför behandlingsområdet skyddas, så att endast de planerade ytorna limmas.
För att säkerställa att proteinlösningen och trombinlösningen blandas fullständigt, kassera de första dropparna från applikationskanylen omedelbart innan appliceringen påbörjas.
Som med alla proteinprodukter finns en risk för allergiska reaktioner och överkänslighet.
Vaskulär applicering kan öka sannolikheten för en plötslig överkänslighetsreaktion och dess svårighetsgrad hos känsliga personer.
Överkänslighetsreaktioner och anafylaktiska reaktioner (även fatala reaktioner, såsom anafylaktisk chock) har rapporterats i samband med användningen av Tisseel. Symptom på överkänslighet kan vara vesikulobullöst utslag, utbrett eksem, tryck över bröstet, väsande andning, lågt blodtryck. Om dessa symptom uppstår, måste användningen av preparatet omedelbart avbrytas och patienten ska behandlas i enlighet med gällande rutin för chock. Preparat som har blivit kvar på appliceringsstället ska avlägsnas.
Tisseel innehåller syntetiskt protein (aprotinin). Även vid strikt lokal applicering finns en risk för anafylaktisk reaktion, på grund av förekomsten av aprotinin. Risken tycks vara högre hos patienter med tidigare exponering för produkten, även om toleransen då var god. Därför ska all användning av aprotinin eller produkter som innehåller aprotinin noteras i patientens journal.
Syntetiskt aprotinin har liknande struktur som bovint aprotinin. Användningen av Tisseel hos patienter som är allergiska mot bovina proteiner bör övervägas noggrant.
I två retrospektiva, icke-randomiserade studier av kranskärlsoperation ökade risken för död statistiskt signifikant hos patienter som behandlades med vävnadslim. Dessa studier kunde inte visa ett orsakssamband; det kan emellertid inte uteslutas att användningen av Tisseel hos dessa patienter kan öka risken. Särskild försiktighet bör iakttas för att undvika oavsiktlig applicering av preparatet intravaskulärt.
Applicering på nässlemhinnan bör undvikas eftersom tromboemboliska biverkningar kan uppstå i ögonartären.
Det finns en risk för lokal vävnadsskada när du applicerar Tisseel på mjukvävnad.
Tisseel appliceras endast i ett tunt lager. För tjockt lager kan försämra preparatets effekt och sårläkningen.
Polysorbat 80 kan orsaka lokalt begränsad hudirritation, såsom kontaktdermatit.
När läkemedel framställs av humant blod eller plasma, vidtas standardåtgärder för att förhindra att infektioner överförs till patienter. Dessa är urvalet av givare, test av individuella donationer och plasmapooler för specifika infektionsmarkörer samt tillverkningssteg som effektivt inaktiverar och eliminerar virus. Trots detta kan man inte helt utesluta eventuell överföring av patogener, när läkemedel framställda av humant blod eller plasma administreras. Detta gäller också okända eller nya virus och andra patogener. De åtgärder som vidtagits anses vara effektiva mot höljeförsedda virus som HIV-, HBV- och HCV-virus och mot det icke-höljeförsedda HAV-viruset.
Dessa åtgärder har endast liten effekt på icke-höljeförsedda virus som parvovirus B19. Parvovirus B19 kan vara allvarligt för gravida kvinnor (infektion av foster) och patienter med nedsatt immunförsvar eller ökad produktion av röda blodkroppar (t.ex. hemolytisk anemi).
Hepatit A- och B-vaccinationer bör övervägas när patienter regelbundet /upprepade gånger får vävnadslim tillverkade av human plasma.
Det är viktigt att produktens namn och satsnummer noteras i journalen varje gång en patient får Tisseel för att upprätthålla en koppling mellan patienten och produktens satsnummer.
Preparat som innehåller oxiderad cellulosa ska inte användas tillsammans med Tisseel (se avsnitt Inkompatibiliteter Inkompatibiliteter).
Pediatrisk population
Säkerhet och effekt hos barn har inte fastställts.
Interaktioner
Inga interaktionsstudier har utförts. I likhet med andra jämförbara produkter eller trombinlösningar kan produkten denatureras vid exponering för lösningar som innehåller alkohol, jod eller tungmetaller (t.ex. antiseptiska lösningar). Sådana ämnen bör i möjligaste mån avlägsnas innan produkten appliceras.
Fertilitet, graviditet och amning
Vävnadslimmets/hemostaternas säkerhet vid användning under graviditet och amning har inte fastställts i kontrollerade kliniska studier. Djurstudier är otillräckliga för att utvärdera säkerheten vad gäller fortplantning, embryonal- och fosterutveckling, förlossning samt peri- och postnatal utveckling.
Av den anledningen får produkten användas för gravida och ammande kvinnor endast om det är absolut nödvändigt.
Effekten av Tisseel på fertilitet har inte fastställts.
För information om parvovirus B19 infektion, se avsnitt Varningar och försiktighet.
Effekter på förmågan att framföra fordon och använda maskiner
Ej relevant.
Biverkningar
Överkänslighet eller allergiska reaktioner (så som angioödem, brännande och svidande känsla på applikationsstället, bradykardi, bronkospasm, frossa, andfåddhet, rodnad, utbrett eksem, huvudvärk, vesikulärt utslag, lågt blodtryck, dåsighet, illamående, klåda, rastlöshet, takykardi, tryck över bröstet, stickningar, kräkningar, väsande andning) kan i sällsynta fall uppstå hos patienter som behandlats med vävnadslim/-hemostatika.
I enskilda fall har dessa reaktioner utvecklats till allvarlig anafylaxi. Sådana reaktioner kan speciellt uppstå om preparatet appliceras upprepade gånger, eller ges till patienter som har konstaterats överkänsliga mot aprotinin (se avsnitt Varningar och försiktighet) eller någon annan av produktens beståndsdelar.
Även om toleransen vid de första behandlingsgångerna har varit god, kan de följande administreringsgångerna eller systemisk administrering av aprotinin orsaka allvarliga anafylaktiska reaktioner.
I sällsynta fall kan antikroppar mot beståndsdelarna i vävnadslimmet uppstå.
Oavsiktligt applicering i en ven eller annat blodkärl kan leda till tromboemboliska biverkningar och DIC. Det finns även en risk för anafylaktisk reaktion (se avsnitt Varningar och försiktighet).
Mer information om överförbara patogener, se avsnitt Varningar och försiktighet.
Biverkningarna i detta avsnitt har rapporterats från kliniska prövningar som undersökt effekt och säkerhet hos Tisseel, och från marknadserfarenheter av vävnadslim från Baxter. I de kliniska studierna användes Tisseel för att förbättra hemostas vid hjärt-, kärl- och höftledsprotesoperationer, vid lever- och mjältkirurgi; och för limning av lymfkärl hos patienter med bortopererade axillära lymfkörtlar, i kolonanastamos och i dura i fossa posterior. Eftersom frekvensen av erfarenheterna efter marknadsföring inte kan beräknas har det övre 95 % konfidensintervallet för ”okänd” prevalens beräknats med metoden”regel av tre” när så är möjligt enligt följande: 3/1146 = 0,0026 eller 0,26 % (”1146” är det totala antalet patienter som har behandlats med Tisseel i kliniska prövningar, från vilka informationen har inkluderats i läkemedelsresumén).
Mycket vanlig (≥ 1/10)
Vanlig (≥ 1/100, < 1/10)
Mindre vanlig (≥ 1/1 000, < 1/100)
Sällsynt (≥ 1/10 000, < 1/1 000)
Mycket sällsynt (< 1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
Organklass | Biverkningar | Frekvens |
Infektioner och infestationer | infektion i operationssåret | vanlig |
Immunsystemet | överkänslighetsreaktioner* | ingen känd frekvens |
anafylaktiska reaktioner* | ingen känd frekvens | |
anafylaktisk chock* | ingen känd frekvens | |
Centrala och perifera nervsystemet | sensoriska störningar | vanlig |
parestesi | ingen känd frekvens | |
Hjärtat | bradykardi | ingen känd frekvens |
takykardi | ingen känd frekvens | |
Blodkärl | axillära venhinder** | vanlig |
lågt blodtryck | sällsynt | |
hematom NOS | ingen känd frekvens | |
blodpropp | ingen känd frekvens | |
luft-/gasembolism*** | ingen känd frekvens | |
trombos i hjärnartären | ingen känd frekvens | |
hjärninfarkt** | ingen känd frekvens | |
Andningsvägar, bröstkorg och mediastinum | andfåddhet | ingen känd frekvens |
bronkospasm | ingen känd frekvens | |
väsande andning | ingen känd frekvens | |
Magtarmkanalen | illamående | mindre vanlig |
tarmobstruktion | ingen känd frekvens | |
Hud och subkutan vävnad | nässelutslag | ingen känd frekvens |
eksem | vanlig | |
klåda | ingen känd frekvens | |
erytematösa utslag | ingen känd frekvens | |
nedsatt läkningsförmåga | ingen känd frekvens | |
angioödem | ingen känd frekvens | |
Muskuloskeletala systemet och bindväv | värk i extremiteterna | vanlig |
Allmänna symptom och symtom vid administreringsstället | smärta orsakad av ingreppet | mindre vanlig |
smärta | vanlig | |
feber | vanlig | |
rodnad | ingen känd frekvens | |
svullnad | ingen känd frekvens | |
Skador och förgiftningar | serom | mycket vanlig |
Undersökningar | ökad mängd nedbrytningsprodukter från fibrin | mindre vanlig |
ökning av D-dimerer i fibrin | mindre vanlig |
* anafylaktiska reaktioner, anafylaktisk chock har i vissa fall varit fatala
** resultat av intravaskulär administrering i sinus petrosus superior
***i likhet med andra vävnadslim har livshotande/dödliga luft- eller gasembolismer förekommit i samband med applicering med sprayset utrustade med tryckregulator. Detta verkar vara förknippat med felaktig användning av sprayset (t.ex. högre tryck än vad som rekommenderas och/eller nära vävnadsytan).
Biverkningar med klassen vävnadslim
Andra biverkning som associerats med klassen vävnadslim är: överkänslighetsreaktioner, irritation på applikationsstället, tryck över bröstet, frossa, huvudvärk, dåsighet, rastlöshet och kräkningar.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Överdosering
Inga fall av överdosering har rapporterats.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: lokala hemostatika, ATC-kod: B02BC30 (kombinationer); vävnadslim, ATC-kod: V03AK
Vävnadslimmet efterliknar den sista fasen vid fysiologisk blodkoagulation. Omvandlingen av fibrinogen till fibrin sker genom att fibrinogen delas i fibrinmonomerer och fibrinpeptider. Fibrinmonomererna aggregerar och bildar ett fibrinkoagel. Faktor XIIIa, som aktiveras från faktor XIII av trombin i närvaro av kalciumjoner, stabiliserar fibrinkoaglet genom att bilda ett nät i fibrinfibrerna.
Allt eftersom sårläkningsprocessen fortskrider ökar plasmin den fibrinolytiska aktiviteten och dekompositionen av fibrin till fibrinnedbrytningsprodukter inleds. Proteolytisk nedbrytning av fibrin hämmas av antifibrinolytika. Aprotinin används i Tisseel som en antifibrinolyt som förhindrar koagulationens för tidiga nedbrytning.
För att påvisa effekt, genomfördes fyra in vivo djurmodellstudier, i vilka man noggrant efterliknade situationen hos patienter. Tisseel visade sig vara effektivt vid primär och sekundär hemostas samt vid sårläkning.
Kliniska studier avseende hemostas och sutur inkluderade 213 patienter som genomgick kärlkirurgi med en ePTFE-transplantation (120 behandlades med Tisseel och 93 med jämförelseläkemedel), 70 patienter som genomgick leverresektion (35 behandlades med Tisseel och 35 med jämförelseläkemedel) och 317 patienter som genomgick kranskärlsoperation och sternotomi (157 behandlades med Tisseel och 160 med jämförelseläkemedel tillverkat i enlighet med tidigare singel virusaktiveringsfas).
Den kliniska effekten av Tisseel vid utförande av kolonanastomos hos traumapatienter (tillfällig slutning av kolostomi) utöver sedvanliga kirurgitekniker, har visats i en randomiserad, kontrollerad, prospektiv, monocentrisk studie. Studien genomfördes år 1986 och involverade 120 patienter, varav 61 behandlades med Tisseel och 59 med jämförelseläkemedel.
Farmakokinetiska egenskaper
Tisseel är enbart avsett för epilesionell användning. Får inte administreras intravaskulärt. Till följd av detta har intravaskulära farmakokinetiska studier på människa inte utförts.
Farmakokinetiken har inte studerats på laboratoriedjur av olika arter.
Vävnadslim/-hemostatika metaboliseras på samma sätt som endogent fibrin, dvs. genom fibrinolys och fagocytos.
Prekliniska säkerhetsuppgifter
Det finns inga prekliniska säkerhetsuppgifter tillgängliga för Tisseel vad gäller långvarig toxicitet, karcinogenicitet, reproduktions- och utvecklingstoxicitet eller immunstimulering. Detta beror på produktens egenskaper, speciella appliceringsmetod (vanligen engångsadministrering, endast i sällsynta fall en upprepad administrering med några milliliter) och verkningsmekanismen (lokal verkan utan systemisk effekt eller distribution till andra organ eller vävnader).
Tisseel har inte visat akut toxicitet i en enkeldosstudie på råttor och kaniner. Proteinlösningen (Tisseel-lösning) tolererades väl in vitro, i human fibroblastkultur och den visade sig vara kompatibel med celler och var inte cytotoxisk. Även en noggrann genomgång av litteratur avslöjade inga negativa efftekter eller toxicitet på grund av S/D-resterna i Tisseel.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Komponent 1: proteinlösning (Tisseel-lösning)
humant albumin
L-histidin
niacinamid
polysorbat 80 (Tween 80)
natriumcitratdihydrat
vatten för injektionsvätskor
Komponent 2: trombinlösning
humant albumin
natriumklorid
vatten för injektionsvätskor
Inkompatibiliteter
Detta läkemedel får inte blandas med andra läkemedel förutom de lämpliga lösningar som nämns i avsnitt Särskilda anvisningar för destruktion och övrig hantering.
Produkter som innehåller oxiderad cellulosa kan minska effekten av Tisseel och ska inte användas som hjälpmedel vid applicering.
Hållbarhet
2 år.
Särskilda förvaringsanvisningar
Förvaras och transporteras i djupfryst tillstånd (minst -20 °C) före användningen.
Förvaras i originalförpackningen. Ljuskänsligt.
Oöppnade påsar som tinats i under 25 °C kan förvaras i upp till 72 timmar i rumstemperatur (under 25 °C). Om läkemedlet inte har använts inom 72 timmar efter tiningen, ska det kasseras.
Får ej frysas på nytt eller förvaras kallt efter upptining.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
TISSEEL liuokset kudosliimaa varten
2 ml (Prima-ruisku (1 ml+1 ml)) (193,02 €), 4 ml (Prima-ruisku (2 ml+2 ml)) (334,10 €)
PF-selosteen tieto
PRIMA-spruta:
- 1 ml, 2 ml eller 5 ml proteinlösning (Tisseel-lösning) och 1 ml, 2 ml eller 5 ml trombinlösning i förfylld dubbelkammarspruta (polypropen), med skyddskapsel på sprutspetsen, förpackad i två påsar
- ett set bestående av 2 huvudmunstycken och 4 applikationskanyler.
Eller
Dubbelkammarspruta:
- 1 ml, 2 ml eller 5 ml fryst proteinlösning (Tisseel-lösning) (innehållande syntetiskt aprotinin) och trombinlösning i en förfylld dubbelkammarspruta av polypropylen för engångsbruk, med skyddskapsel på sprutspetsen, förpackad i en plastpåse
- tillbehör i en annan påse: 1 Duo-set (dubbelkammarsprutans kolv, 2 huvudmunstycken och 4 applikationskanyler).
Eller
System med två sprutor (Duo Syringe System):
- 1 ml, 2 ml eller 5 ml fryst proteinlösning (Tisseel-lösning) och trombinlösning i två förfyllda sprutor av polypropylen för engångsbruk, med skyddskapsel på sprutspetsarna. Sprutorna finns i Duploject-spruthållare förpackade i plastpåse.
- applikationstillbehör (2 huvudmunstycken, 4 applikationskanyler).
Förpackningsstorlekar:
1 x 2 ml (1 ml + 1 ml), 10 x 2 ml, 1 x 4 ml (2 ml + 2 ml), 10 x 4 ml, 1 x 10 ml (5 ml + 5 ml), 10 x 10 ml.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Andra för produkten lämpliga tillbehör tillhandahålls av Baxter.
Läkemedlets utseende:
De frysta lösningarna är färglösa eller ljusgula och opalescenta. Efter upptining är lösningarna färglösa eller ljusgula.
Särskilda anvisningar för destruktion och övrig hantering
Allmänt
- Före applicering av Tisseel ska de delar av kroppen som inte ska behandlas täckas för att förhindra vävnadslimning i oönskade områden.
- För att säkerställa att proteinlösningen och trombinlösningen blandas fullständigt, kassera de första dropparna från applikationkanylen precis innan applicering.
- Fukta handskarna och instrumenten med natriumkloridlösning, så att Tisseel inte fastnar i dem.
- Vid limning av ytor räcker 2 ml förpackning av Tisseel (dvs. 1 ml proteinlösning och 1 ml trombinlösning) till ett minst 10 cm2 stort område.
- Den exakta dosen är beroende av hur stor yta som ska behandlas.
- Tisseel-komponenterna får INTE appliceras separat. Båda komponenterna måste appliceras samtidigt.
- Tisseel får INTE utsättas för högre temperaturer än 37 °C. Värm INTE produkten i mikrovågsugn.
- Tina INTE produkten genom att hålla den i händerna.
- Tisseel får INTE användas förrän produkten har tinat helt och värmts upp till 33 °C–37 °C.
- Ta inte av skyddskapseln från sprutan förrän produkten har tinats och värmts upp. PRIMA-spruta: sprutspetsens skyddskapsel lossnar lättare om den vrids fram och tillbaka, innan den dras av från sprutan.
- Tryck ut all luft från sprutan och koppla sedan huvudmunstycket och applikationskanylen.
Anvisningar för hantering och beredning
Både proteinlösningen (Tisseel-lösningen) och trombinlösningen tillhandahålls i en dubbelkammarspruta som är färdig att användas. Dubbelkammarsprutans spets är skyddad med en skyddskapsel och båda kamrarna är slutna med en silikonpropp i ena änden. Sprutan är aseptiskt förpackad i två sterila påsar. Den inre påsen och dess innehåll förblir sterila så länge den yttre påsen inte har skadats. Flytta över den sterila innerpåsen och dess innehåll till sterilt område genom att använda steril teknik.
Den förfyllda sprutan kan tinas OCH värmas på något av följande sätt:
1. Snabb tining/värmning (i sterilt vattenbad) – rekommenderad metod
2. Tining/värmning i ett icke-sterilt vattenbad
3. Tining/värmning i incubator
4. Den förfyllda sprutan kan också tinas och förvaras i rumstemperatur (högst 25 °C) i upp till 72 timmar. Produkten måste värmas innan användning.
1. Snabb tining/värmning (i sterilt vattenbad) – rekommenderad metod
Det rekommenderas att tina och värma vävnadslimkomponenterna i ett sterilt vattenbad med en temperatur på 33 °C–37 °C. Vattenbadet får vara högst 37 °C. För att kontrollera det angivna temperaturintervallet ska vattentemperaturen övervakas med termometer och vattnet ska bytas vid behov. Om ett sterilt vattenbad används för tining och värmning ska den förfyllda sprutan tas ut ur påsarna innan produkten placeras i vattenbadet.
Instruktioner:
Sprutans skyddskapsel får inte tas bort förrän tiningen är klar och applikationskanylen ska sättas på. Använd inte Tisseel förrän det är helt tinat och uppvärmt.
Flytta kolv och innerpåse till ett sterilt område, ta ut den förfyllda sprutan ur innerpåsen och placera den direkt i det sterila vattenbadet. Kontrollera att allt innehåll i den förfyllda sprutan är helt nedsänkt under vattenytan.
Tabell 1: Minimitider för tining och värmning i sterilt vattenbad
Förpacknings-storlek | Minimitider för tining/värmning 33 °C–37 °C, sterilt vattenbad Produkten har tagits ur påsen | ||
PRIMA-spruta | Dubbelkammarspruta | Systemet med två sprutor (Duo Syringe System) | |
2 ml | 5 minuter | 5 minuter | 8 minuter |
4 ml | 5 minuter | 5 minuter | 9 minuter |
10 ml | 10 minuter | 12 minuter | 13 minuter |
2. Tining/värmning i ett icke-sterilt vattenbad
Instruktioner:
Låt den förfyllda sprutan vara kvar i sina påsar och placera den i ett vattenbad utanför det sterila området under så lång tid som behövs (se tabell 2).
Säkerställ att påsarna förblir nedsänkta i vattnet under hela upptiningstiden. Efter upptining ska påsarna tas bort från vattenbadet, ytterpåsen torkas av och innerpåsen med de förfyllda sprutorna och kolven flyttas till ett sterilt område.
Tabell 2: Minimitider för tining och värmning i icke-sterilt vattenbad
Förpacknings-storlek | Minimitider för tining/värmning 33 °C–37 °C, icke-sterilt vattenbad Produkten kvar i påsarna | ||
PRIMA-spruta | Dubbelkammarspruta | Systemet med två sprutor (Duo Syringe System) | |
2 ml | 15 minuter | 30 minuter | 31 minuter |
4 ml | 20 minuter | 40 minuter | 46 minuter |
10 ml | 35 minuter | 80 minuter | 64 minuter |
3. Tining/värmning i inkubator
Instruktioner:
Låt den förfyllda sprutan vara kvar i sina påsar och placera den i en inkubator utanför det sterila området under så lång tid som behövs (se tabell 3). Efter tining/värmning ska påsarna tas ut ur inkubatorn. Ta av den yttre påsen och flytta över innerpåsen med den förfyllda sprutan till ett sterilt område.
Tabell 3: Minimitider för tining/värmning i inkubator
Förpacknings-storlek | Minimitider för tining/värmning 33 °C–37 °C, inkubator Produkt kvar i påsen | ||
PRIMA-spruta | Dubbelkammarspruta | Systemet med två sprutor (Duo Syringe System) | |
2 ml | 40 minuter | 40 minuter | 62 minuter |
4 ml | 50 minuter | 85 minuter | 77 minuter |
10 ml | 90 minuter | 105 minuter | 114 minuter |
4. Tining i rumstemperatur (högst 25 °C) FÖRE värmning
Instruktioner:
Låt den förfyllda sprutan vara kvar i sina påsar och låt den tina i rumstemperatur utanför det sterila området under så lång tid som behövs (se tabell 4). När produkten har tinats värms den upp i sin ytterpåse i en inkubator tills den är klar för användning.
Tabell 4: Minimitider för tining i rumstemperatur utanför det sterila området samt värmningstid i inkubator vid 33 °C–37 °C temperatur
För-packnings-storlek | Minimitid för tining av produkten vid rumstemperatur (vid högst 25 °C) och uppvärmningstid före användning i 33 °C–37 °C i inkubator, när produkten har tinats i rumstemperatur Produkt i påsar | |||||
PRIMA-spruta | Dubbelkammarspruta | Systemet med två sprutor (Duo Syringe System) | ||||
Tining i rums-temperatur (högst 25 °C) | Värmning i inkubator (33 °C–37 °C) | Tining i rums-temperatur (högst 25 °C) | Värmning i inkubator (33 °C–37 °C) | Tining i rums-temperatur (högst 25 °C) | Värmning i inkubator (33 °C–37 °C) | |
2 ml | 80 minuter | +11 minuter | 60 minuter | +15 minuter | 82 minuter | +28 minuter |
4 ml | 90 minuter | +13 minuter | 110 minuter | +25 minuter | 117 minuter | +30 minuter |
10 ml | 160 minuter | +25 minuter | 160 minuter | +35 minuter | 167 minuter | +44 minuter |
Efter tining vid rumstemperatur måste produkten användas inom 72 timmar efter att den först tagits ut ur frysen.
Hållbarhetstid efter upptining
Efter tining och värmning (i 33 °C–37 °C, med metod 1, 2 eller 3) har kemisk och fysikalisk hållbarhet påvisats för produkten i 12 timmar vid 33 °C–37 °C.
För produkter som tinats vid rumstemperatur i oöppnad påse (metod 4) har kemisk och fysikalisk hållbarhet påvisats för produkten i 72 timmar vid högst 25 °C. Värm till 33 °C–37 °C strax före användning.
Ur en mikrobiologisk synvinkel bör produkten användas omedelbart efter värmning till 33 °C–37 °C, såvida inte metoden för öppning av förpackningen eller tiningen utesluter risken för mikrobiell kontamination. Om produkten inte används omedelbart är förvaringstider och förvaringsförhållanden användarens ansvar.
Produkten får inte frysas på nytt eller placeras i kylskåp efter att tining har påbörjats.
Hantering efter upptining/innan applicering
För att uppnå optimal blandning av de två lösningarna och bästa möjliga solidifiering av vävnadslimmet ska de två limkomponenterna förvaras vid 33 °C–37 °C tills de appliceras. (Överskrid inte 37 °C.) Tisseel får inte värmas i mikrovågsugn.
Protein- och trombinlösningarna ska vara klara eller något opaliserande. Använd inte grumliga lösningar eller lösningar som innehåller fällningar. Den tinade produkten ska granskas visuellt för partiklar och färgförändringar eller för eventuella andra förändringar innan administrering. Om något av dessa observeras ska produkten kasseras.
Den tinade proteinlösningen ska vara en aning viskös vätska. Om lösningens konsistens liknar en fast gel måste det antas att den blivit denaturerad (t.ex. på grund av avbruten kylkedja eller överdriven uppvärmning under upphettning). Tisseel får då INTE användas.
- Ta sprutan ur påsarna strax före användning.
- Använd inte Tisseel innan preparatet är helt upptinat och uppvärmt (för att lösningens sammansättning ska vara jämn).
- Ta av skyddskapseln strax före användning. PRIMA-spruta: sprutspetsens skyddskapsel lossnar lättare om den vrids fram och tillbaka, innan den dras av från sprutan.
Administrering med PRIMA-sprutan:
Inför applicering ska den förfyllda dubbelkammarsprutan med protein- och trombinlösning kopplas till huvudmunstycket och applikationskanylen, som medföljer förpackningen. Den gemensamma kolven på den förfyllda dubbelkammarsprutan säkerställer att lika stora volymer av de två vävnadslimskomponenterna pressas genom huvudmunstycket. Komponenterna blandas i applikationskanylen före appliceringen.
Bruksanvisning för PRIMA-sprutan:
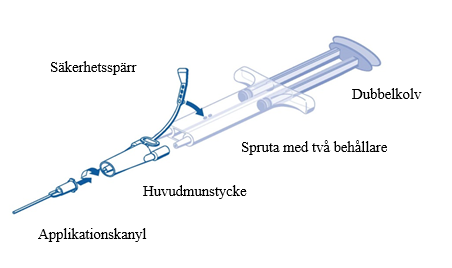
- Tryck ut all luft från sprutan innan den kopplas till någon applikationsdel.
- Placera huvudmunstycket och säkerhetsspärren på sidan av sprutan så att hålet i säkerhetsspärren hamnar rätt.
- Koppla samman huvudmunstycket med spetsarna på sprutans munstycken och säkerställ att de sitter fast ordentligt.
- Fäst huvudmunstycket i den förfyllda sprutan med två behållare med hjälp av säkerhetsspärren.
- Om säkerhetsspärren går sönder ska det medföljande reservmunstycket användas.
- Om det inte finns något extra munstycke tillgängligt kan produkten fortfarande användas, om du säkerställer att munstycket sitter fast för att förhindra läckage.
- Tryck INTE ut den luft som finns kvar inuti huvudmunstycket.
- Fäst en applikationskanyl på huvudmunstycket.
- Tryck INTE ut den luft som finns kvar i huvudmunstycket och i applikationskanylen förrän appliceringen inleds, eftersom det kan göra att applikationskanylen täpps till.
Applicering
Innan appliceringen av Tisseel ska sårets yta torkas med standardteknik (t.ex. växelvis användning av kompresser, bomullspinnar eller suganordningar).
Använd inte tryckluft eller -gas för torkning av ytan.
- Applicera den blandade protein- och trombinlösningen på mottagarytan eller ytorna på de områden som ska behandlas genom att långsamt trycka ned den gemensamma kolven.
- Vid kirurgiska ingrepp där minsta möjliga volym av vävnadslim ska användas bör de första dropparna av produkten kasseras.
- När Tisseel har applicerats, låt minst 2 minuter passera för att uppnå tillräcklig polymerisering.
Eller
Dosering med dubbelkammarspruta:
För appliceringen ska dubbelkammarsprutan med protein- och trombinlösning sammanfogas med huvudmunstycket och applikationskanylen som medföljer förpackningen. Tack vare den gemensamma kolven (medföljer förpackningen) på den förfyllda dubbelkammarsprutan doserar sprutan samma mängd av båda lösningarna genom huvudmunstycket. Lösningarna blandas i applikationskanylen före appliceringen i vävnaden.
Bruksanvisning för dubbelkammarsprutan:
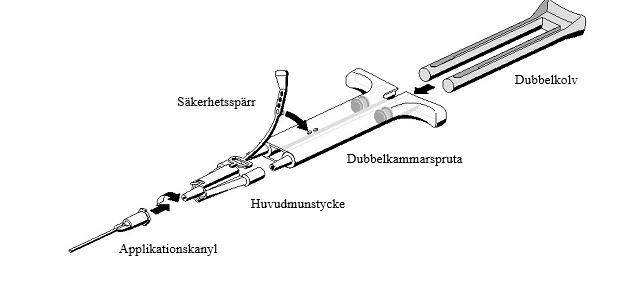
- Tryck ut all luft från sprutan innan den kopplas till någon applikationsdel.
- Placera huvudmunstycket och säkerhetsspärren på sidan av sprutan så att hålet i säkerhetsspärren hamnar rätt.
- Koppla samman huvudmunstycket med spetsarna på sprutans munstycken och säkerställ att de sitter fast ordentligt.
-
Säkra huvudmunstycket genom att fästa säkerhetsspärren på sprutan.
- Om säkerhetsspärren går sönder ska det medföljande reservmunstycket användas.
- Om det inte finns något extra munstycke tillgängligt kan produkten fortfarande användas, men säkerställ att huvudmunstycket sitter fast för att förhindra läckage.
- Tryck INTE ut den luft som finns kvar inuti huvudmunstycket.
-
Fäst applikationskanylen på huvudmunstycket.
- Tryck INTE ut den luft som finns kvar i huvudmunstycket eller i applikationskanylen innan appliceringen inleds eftersom det kan göra att applikationskanylen täpps till.
Applicering
Innan appliceringen av Tisseel ska sårets yta torkas med standardteknik (t.ex. växelvis användning av kompresser, bomullspinnar eller suganordningar).
Använd inte tryckluft eller -gas för torkning av ytan.
- Applicera den blandade protein- och trombinlösningen på mottagarytan eller ytorna på de områden som ska behandlas genom att långsamt trycka den gemensamma kolven.
- Vid kirurgiska ingrepp där minsta möjliga volym av vävnadslimmet behövs rekommenderas att de första dropparna av produkten kasseras.
- När Tissseel har applicerats, låt minst 2 minuter passera för att uppnå tillräcklig polymerisering.
Eller
Dosering med systemet med två sprutor (Duo Syringe System):
Vid applicering ska Duploject-hållaren och engångssprutorna innehållande Tisseel-lösning och trombinlösning kopplas till huvudmunstycket och applikationskanylen som finns bland de medföljande tillbehören. Den gemensamma kolven på Duploject-hållaren säkerställer att lika stora volymer av de båda lösningarna pressas genom huvudmunstycket. Lösningarna blandas i applikationskanylen innan dosering i vävnaden.
Bruksanvisning för systemet med två sprutor:
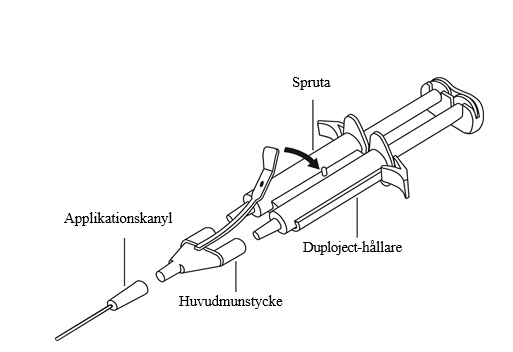
- Tryck ut all luft från sprutan innan den kopplas till någon applikationdel.
- Placera huvudmunstycket och säkerhetsspärren på sidan av sprutan så att hålet i säkerhetsspärren hamnar rätt.
-
Koppla samman huvudmunstycket med Duo Syringe System -sprutornas spetsar och säkerställ att de sitter fast ordentligt.
- Fäst huvudmunstycket med hjälp av säkerhetsspärren på Duploject-hållaren.
- Om huvudmunstyckets säkerhetsspärr skulle gå sönder använd reservmunstycket som medföljer förpackningen.
- Om det inte finns något extra huvudmunstycke tillgängligt, kan produkten fortfarande användas om du säkerställer att huvudmunstycket sitter fast för att förhindra läckage.
- Tryck INTE ut den luft som finns kvar inuti huvudmunstycket.
-
Fäst applikationskanylen på huvudmunstycket.
- Tryck INTE ut den luft som finns kvar i huvudmunstycket eller i applikationskanylen innan den appliceringen inleds, eftersom det kan göra att applikationskanylen täpps till.
Applicering
Innan appliceringen av Tisseel ska sårets yta torkas med standardteknik (t.ex. växelvis användning av kompresser, bomullspinnar eller suganordningar).
Använd inte tryckluft eller -gas för torkning av ytan.
- Applicera den blandade protein- och trombinlösningen på mottagarytan eller ytorna på de områden som ska behandlas genom att långsamt trycka den gemensamma kolven.
- Vid kirurgiska ingrepp där minsta möjliga volym av vävnadslimmet behövs rekommenderas att de första dropparna av produkten kasseras.
- När Tissseel har applicerats, låt minst 2 minuter passera för att uppnå tillräcklig polymerisering.
Observera: Om appliceringen av vävnadslimkomponenterna avbryts kan applikationskanylen täppas till. Byt då ut applikationskanylen till en ny precis innan appliceringens fortsätter. Om öppningarna i huvudmunstycket täpps till, använd reservhuvudmunstycket som medföljer förpackningen.
När vävnadslimkomponenterna har blivit sammanblandade börjar vävnadslimmet stelna på några sekunder på grund av dess höga trombininnehåll (500 IE/ml).
Vävnadslimmet kan också appliceras med andra Baxter-instrument lämpliga för t.e.x. endoskopiskanvändning, minimalt invasiv kirurgi eller för applicering på stora eller svåråtkomliga ytor. När sådana appliceringsinstrument används ska deras bruksanvisning följas noggrant.
I vissa tillämpningar kan ett biomaterial såsom kollagenfilt användas som basmaterial eller bärare.
Applicering genom sprayning
Vid applicering av Tisseel-vävnadslim med hjälp av ett sprayset var noga med att använda ett tryck och ett avstånd från vävnaden som rekommenderas av tillverkaren.
I öppen kirurgi ska en tryckregulator som ger ett maximalt tryck på 2,0 bar (28,5 psi) användas.
Vid minimalt invasiva/laparoskopiska ingrepp ska en tryckregulator som ger ett maximalt tryck på 1,5 bar (22 psi) användas och endast koldioxidgas får användas.
Rekommenderat tryck, avstånd och anordning för applicering av Tisseel | ||||||
Typ av operation | Sprayset som ska användas | Applikationsspetsar som ska användas | Tryckregulator som ska användas | Rekommenderat avstånd från målvävnaden | Rekommenderat spraytryck | |
Öppna sår | Tisseel/Artiss Spray Set | Saknas. | EasySpray | 10–15 cm | 1,5–2,0 bar (21,5–28,5 psi). | |
Tisseel/Artiss Spray Set 10 pack | Saknas. | EasySpray | ||||
Laparoskopiska/ minimalt invasiva ingrepp | Saknas. | Duplospray MIS Applicator 20 cm | Duplospray MIS Regulator 1,5 bar | 2–5 cm | 1,2–1,5 bar (18–22 psi) | |
Duplospray MIS Applicator 30 cm | ||||||
Duplospray MIS Applicator 40 cm | ||||||
Spray Set 360 endoskopisk applikator med Snap Lock-fästning | ||||||
Spray Set 360 endoskopisk applikator med Snap Lock-fästning | ||||||
Utbytbar spets | ||||||
När Tisseel sprayas på ska förändringar i blodtryck, puls, syremättnad och sluttidal CO 2 övervakas med tanke på risken för luft‑ eller gasembolism (se även avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Om Tisseel appliceras på inneslutna områden på bröst eller buk rekommenderas användning av DuploSpray MIS applikator och en tryckregulator. Läs igenom bruksanvisningen för DuploSpray MIS.
Destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Ersättning
TISSEEL liuokset kudosliimaa varten
2 ml, 4 ml
- Ei korvausta.
Atc-kod
B02BC30
Datum för översyn av produktresumén
18.06.2021
Yhteystiedot
Karhumäentie 3
01530 Vantaa
09 862 1111
