ZOLADEX implantat 10,8 mg
Kvalitativ och kvantitativ sammansättning
Goserelinacetat motsvarande 10,8 mg goserelin.
För fullständig förteckning över hjälpämnen, se avsnitt Förteckning över hjälpämnen.
Läkemedelsform
Implantat.
Kliniska uppgifter
Terapeutiska indikationer
Behandling av prostatacancer i följande fall (se även avsnitt Farmakodynamiska egenskaper):
- Vid behandling av metastatisk prostatacancer (se avsnitt Farmakodynamiska egenskaper)
- Vid behandling av lokalt avancerad prostatacancer som alternativ till kirurgisk kastrering (se avsnitt Farmakodynamiska egenskaper)
- Som adjuvant behandling till strålbehandling hos patienter med prostatacancer av högrisktyp eller lokalt avancerad prostatacancer (se avsnitt Farmakodynamiska egenskaper)
- Som neoadjuvant behandling före strålbehandling hos patienter med lokaliserad prostatacancer av högrisktyp eller lokalt avancerad prostatacancer (se avsnitt Farmakodynamiska egenskaper)
- Som adjuvant behandling till radikal prostatektomi hos patienter med lokalt avancerad prostatacancer med hög risk för sjukdomsprogression (se avsnitt Farmakodynamiska egenskaper)
Endometrios: Lindring av symtom på endometrios, såsom smärta, vid behandling utan avbrott under högst sex månader. Uterusmyom: Preoperativ behandling under högst tre månader. Rekommendation: Användning rekommenderas enbart vid behandling under övervakning av specialistläkare i urologi, cancersjukdomar eller kvinnosjukdomar.
Dosering och administreringssätt
Dosering
Män: Ett Zoladex implantat 10,8 mg injiceras subkutant i främre bukväggen var 3:e månad.
Kvinnor: Ett Zoladex 10,8 mg implantat injiceras subkutant i främre bukväggen var 12:e vecka.
Nedsatt lever- och njurfunktion: Ingen dosjustering behövs för patienter med nedsatt njur- och/eller leverfunktion.
Barn: Ej indicerat för användning till barn.
Administreringssätt
För korrekt administrering av Zoladex, följ instruktionerna i bruksanvisningskortet.
Försiktighet ska iakttas när nålen i Zoladex-injektionssprutan sätts in i främre abdominalvägg på grund av närheten av underliggande nedre epigastrisk artär och dess förgreningar. Var extra försiktig vid administrering av Zoladex till patienter med låg BMI och/eller som får fullskalig antikoagulationsbehandling (se avsnitt Varningar och försiktighet).
Kontraindikationer
Känd allvarlig överkänslighet mot den aktiva substansen eller mot något hjälpämne.
Graviditet och amning, se avsnitt Fertilitet, graviditet och amning.
Varningar och försiktighet
Zoladex 10,8 mg implantat är inte indicerat för användning till barn, eftersom säkerhet och effekt inte har fastställts i denna patientgrupp.
Reaktioner vid injektionsstället har rapporterats vid användning av Zoladex inklusive fall av smärta, hematom, blödning och vaskulära skador. Berörda patienter ska övervakas för tecken eller symtom av abdominalblödning. I mycket sällsynta fall har misstag vid administrering lett till vaskulär skada och blödningschock som har krävt blodtransfusion och ett kirurgiskt ingrepp. Extra försiktighet ska utövas vid administrering av Zoladex till patienter med lågt BMI och/eller som får fullskalig antikoagulationsbehandling (se avsnitt Dosering och administreringssätt).
Patienter med känd depression och patienter med hypertoni måste följas noga.
Det finns en ökad risk för depression (som kan vara allvarlig) för patienter som behandlas med GnRH-agonister, som goserelin. Patienterna bör informeras om detta och behandlas på lämpligt sätt om symtom uppkommer.
Androgen deprivationsterapi kan förlänga QT-intervallet
För patienter med QT-förlängning i anamnesen eller med riskfaktorer för QT-förlängning samt för patienter som samtidigt behandlas med andra läkemedel som kan förlänga QT-intervallet (se avsnitt Interaktioner), bör förskrivare bedöma nytta/risk-balansen inklusive risken för torsade de pointes, innan behandling med Zoladex påbörjas.
Användning av Zoladex kan ge ett positivt resultat i dopingtest.
Det finns inga uppgifter beträffande borttagande eller upplösning av implantatet.
Män
Användning av Zoladex 10,8 mg implantat hos män som löper särskild risk att utveckla uretärobstruktion eller ryggmärgskompression måste noga övervägas och patienterna noggrant övervakas under den första behandlingsmånaden. Man bör överväga att initialt använda ett antiandrogen (t.ex. cyproteronacetat 300 mg dagligen i tre dagar före och tre veckor efter påbörjad behandling med Zoladex) när behandling med en LHRH-analog inleds, eftersom detta har rapporterats förhindra de möjliga följderna av den initiala förhöjningen av serumtestosteron. Om ryggmärgskompression eller nedsatt njurfunktion på grund av uretärobstruktion förekommer eller utvecklas ska man sätta in specifik behandling mot dessa komplikationer.
Användning av LHRH-agonister kan orsaka reduktion av bentätheten. Hos män tyder data på att användning av ett bisfosfonat i kombination med en LHRH-agonist kan reducera bentäthetsförlusten.
Särskild försiktighet krävs hos patienter med ytterligare riskfaktorer för osteoporos (t.ex. kroniskt alkoholmissbruk, rökning, långtidsterapi med antiepileptika eller kortikoider, osteoporos i släkten).
Reducerad glukostolerans har observerats hos män som får LHRH-agonister. Detta kan manifesteras som diabetes eller förlust av glykemisk kontroll hos patienter som har diabetes mellitus. Därför bör monitorering av blodglukosnivåerna övervägas.
Hjärtsvikt och hjärtinfarkt är observerade i en farmakoepidemiologisk studie av LHRH-agonister vid behandling av prostatacancer. Risken tycks öka vid användning i kombination med antiandrogener.
Kvinnor
Hos kvinnor är Zoladex 10,8 mg enbart avsett för behandling av endometrios och myom. Kvinnliga patienter som behöver behandling med goserelin av andra orsaker, se produktresumén för Zoladex 3,6 mg implantat.
Reduktion av bentäthet
Användning av LHRH-agonister kan troligen ge upphov till en minskning av bentätheten på i genomsnitt 1 % per månad under en sexmånaders behandlingsperiod. Varje 10-procentig minskning av bentätheten är förenad med en cirka två till tre gånger ökad frakturrisk. Hos de flesta kvinnor tyder nuvarande data på att en återhämtning av benförlusten sker efter avslutad behandling.
Hos patienter som får Zoladex 3,6 mg för behandling av endometrios har tillägg av hormonersättningsbehandling visats minska förlusten av bentäthet och de vasomotoriska symtomen. Det finns ingen erfarenhet av användning av hormonersättningsbehandling hos kvinnor som får Zoladex 10,8 mg.
Det finns inte några specifika data för patienter med etablerad osteoporos eller med riskfaktorer för osteoporos (t.ex. kroniskt alkoholmissbruk, rökning, långtidsbehandling med läkemedel som minskar bentätheten, t.ex. antiepileptika eller kortikoider, osteoporos eller undernäring, t.ex. anorexia nervosa, i släkten). Eftersom minskad bentäthet troligen är mer skadlig hos dessa patienter bör man överväga behandling med Zoladex på individuell basis och bara initiera den om man efter en mycket noggrann bedömning finner att fördelarna med behandlingen överväger riskerna. Man bör beakta om det finns ytterligare åtgärder att vidta för att motverka förlusten av bentäthet.
Bortfallsblödning
Under tidig behandling med Zoladex kan en del kvinnor drabbas av vaginal blödning av varierande varaktighet och intensitet. Om vaginal blödning inträffar är det oftast under den första månaden efter behandlingsstart. En sådan blödning är troligtvis blödning på grund av avslutad östrogenbehandling och kan förväntas upphöra spontant. Om blödningen fortsätter måste orsaken undersökas.
Efter behandling med Zoladex 10,8 mg kan det ta en längre tid att menstruationen återkommer hos vissa kvinnor (efter behandling med Zoladex 10,8 mg implantat uteblir menstruationen i genomsnitt under 7‑8 månader). Om det är viktigt att menstruationen återkommer snabbt, rekommenderas användning av Zoladex 3,6 mg implantat.
Användning av Zoladex kan öka motståndet i cervix, så försiktighet ska iakttas vid dilatation av cervix.
Kliniska data om effekten av Zoladex vid behandling av godartade gynekologiska sjukdomar finns enbart från 6 månaders behandlingsperioder.
Kvinnor i fertil ålder bör använda icke-hormonella preventivmetoder under behandling med Zoladex och till dess menstruationen återkommit efter avslutad behandling med Zoladex.
Interaktioner
Eftersom androgen deprivationsterapi kan förlänga QT-intervallet, bör en noggrann övervägning göras av samtidig användning av Zoladex med läkemedel som förlänger QT-intervallet, eller med läkemedel som kan framkalla torsade de pointes såsom klass IA antiarytmika (t.ex. kinidin, disopyramid) eller klass III antiarytmika (t.ex. amiodaron, sotalol, dofetilid, ibutilid), metadon, moxifloxacin, antipsykotika m.fl. (se avsnitt Varningar och försiktighet).
Fertilitet, graviditet och amning
Graviditet
Zoladex 10,8 mg implantat ska inte användas under graviditet, eftersom användning av LHRH-agonister under graviditet är förknippad med en teoretisk risk för abort och fetala anomalier. Före behandling ska kvinnor i fertil ålder noga undersökas för att utesluta graviditet. Icke-hormonella preventivmetoder ska användas under behandlingen till dess att menstruationen återkommer (se även varning gällande tid för menstruationsåterkomst i avsnitt Varningar och försiktighet).
Amning
Användning av Zoladex 10,8 mg implantat under amning rekommenderas ej.
Effekter på förmågan att framföra fordon och använda maskiner
Evidens saknas för att Zoladex 10,8 mg försämrar förmågan att framföra fordon och använda maskiner.
Biverkningar
Beräkningen av frekvenserna nedan är baserad på biverkningsrapporter från kliniska studier och erfarenhet efter lansering samt spontana rapporter. De vanligaste biverkningarna är förändringar i libido, värmevallningar, svettning och nedsatt potens.
Följande konvention har använts för klassificering av frekvens: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell: Biverkningar av Zoladex 10,8 mg implantat enligt MedDRA-databasen om klassificering av organsystem
Organsystem | Frekvens | Män | Kvinnor |
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) | Mycket sällsynta | Hypofystumör | Hypofystumör |
Ingen känd frekvens | Ej relevant | Degeneration av uterusmyom hos kvinnor med uterusmyom | |
Immunsystemet | Mindre vanliga | Överkänslighet mot läkemedlet | Överkänslighet mot läkemedlet |
Sällsynta | Anafylaktisk reaktion | Anafylaktisk reaktion | |
Endokrina systemet | Mycket sällsynta | Hypofysapoplexi | Hypofysapoplexi |
Metabolism och nutrition | Vanliga | Nedsatt glukostoleransa | Ej relevant |
Psykiska störningar | Mycket vanliga | Minskad libidob | Minskad libidob |
Vanliga | Humörförändringar, depression | Humörförändringar, depression | |
Mycket sällsynta | Psykotiska störningar | Psykotiska störningar | |
Centrala och perifera nervsystemet | Vanliga | Parestesi | Parestesi |
Ryggmärgskompression | Ej relevant | ||
Ej relevant | Huvudvärk | ||
Hjärtat | Vanliga | Hjärtsviktf, hjärtinfarktf | Ej relevant |
Ingen känd frekvens | QT-förlängning (se avsnitt Varningar och försiktighet och Interaktioner) | ||
Blodkärl | Mycket vanliga | Värmevallningarb | Värmevallningarb |
Vanliga | Onormalt blodtryckc | Onormalt blodtryckc | |
Hud och subkutan vävnad | Mycket vanliga | Hyperhidrosb | Hyperhidrosb, aknei |
Vanliga | Utslagd | Utslagd, alopecig | |
Ingen känd frekvens | Alopecih | se Vanliga | |
Muskuloskeletala systemet och bindväv | Vanliga | Skelettsmärtae | Ej relevant |
se Mindre vanliga | Artralgi | ||
Mindre vanliga | Artralgi | se Vanliga | |
Njurar och urinvägar | Mindre vanliga | Uretärobstruktion | Ej relevant |
Reproduktionsorgan och bröstkörtel | Mycket vanliga | Erektil dysfunktion | Ej relevant |
Ej relevant | Torrhet i slidan, förstorade bröst | ||
Vanliga | Gynekomasti | Ej relevant | |
Mindre vanliga | Ömhet i brösten | Ej relevant | |
Sällsynta | Ej relevant | Äggstockscysta | |
Ingen känd frekvens | Ej relevant | Bortfallsblödning (se avsnitt Varningar och försiktighet) | |
Allmänna symtom och/eller symtom vid administreringsstället | Mycket vanliga | se Vanliga | Reaktioner på injektionsstället (t.ex. rodnad, smärta, svullnad, blödning) (se avsnitt Varningar och försiktighet) |
Vanliga | Reaktioner på injektionsstället (t.ex. rodnad, smärta, svullnad, blödning) (se avsnitt Varningar och försiktighet) | se Mycket vanliga | |
Undersökningar | Vanliga | Reduktion av bentäthet (se avsnitt Varningar och försiktighet), viktökning | Reduktion av bentäthet (se avsnitt Varningar och försiktighet), viktökning |
a Minskad glukostolerans har observerats hos män som får LHRH-agonister. Detta kan manifestera sig som diabetes eller förlust av glykemisk kontroll hos patienter som redan har diabetes mellitus
b Detta är farmakologiska effekter som sällan kräver utsättning av behandling. Hyperhidros och värmevallningar kan fortsätta efter avslutad behandling med Zoladex.
c Dessa kan manifestera sig som hypotoni eller hypertoni, och har emellanåt observerats hos patienter som fått Zoladex. Förändringarna är vanligen övergående, avklingar antingen under fortsatt terapi eller efter utsättning av behandling med Zoladex. I sällsynta fall har dessa förändringar krävt medicinska åtgärder, inklusive utsättning av Zoladex-behandling.
d Dessa symtom är i allmänhet milda, och återgår oftast utan utsättning av behandlingen.
e Till en början kan patienter med prostatacancer uppleva en temporärt ökad skelettsmärta, som kan behandlas symtomatiskt.
f Observerat i en farmakoepidemiologisk studie av LHRH-agonister vid behandling av prostatacancer. Risken tycks öka vid användning i kombination med antiandrogener.
g Förlust av huvudhår har rapporterats hos kvinnor, även hos unga patienter som behandlats för godartade tillstånd. Detta är vanligtvis lindrigt, men kan ibland vara svårartat.
h Särskilt förlust av kroppshår, en förväntad effekt av sänkta androgennivåer.
i I de flesta fall rapporterades akne inom en månad efter att behandling med Zoladex påbörjats.
Erfarenhet efter lansering
Ett litet antal fall av förändringar i blodstatus, leverdysfunktion, lungemboli och interstitiell pneumoni har rapporterats i samband med Zoladex.
Initialt kan bröstcancerpatienter uppleva temporär tumörrelaterad smärta, som kan behandlas symtomatiskt.
Några fall av hyperkalcemi har rapporterats hos kvinnor som behandlas på grund av endometrios och/eller myom. När symtom förekommer som tyder på hyperkalcemi (t.ex. törst), måste hyperkalcemi uteslutas.
I sällsynta fall kan en del kvinnor komma in i menopaus under behandling med LHRH-analoger och inte återfå menstruationen efter avslutad behandling. Om detta är en effekt av behandlingen med Zoladex eller en återspegling av deras gynekologiska tillstånd är okänt.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet
Biverkningsregistret
PB 55
FI-00034 Fimea
Överdosering
Det finns ringa erfarenhet av överdosering hos människor. I de fall där Zoladex har givits före den planerade tiden för administrering, eller där en större dos Zoladex givits än ursprungligen planerats, har man inte observerat några kliniskt signifikanta oönskade effekter. Djurförsök tyder på att ingen annan effekt än de avsedda terapeutiska effekterna på könshormonkoncentrationerna och på reproduktionssystemet kommer att märkas med högre doser Zoladex. I fall av överdosering ska tillståndet behandlas symtomatiskt.
Farmakologiska egenskaper
Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Endokrinterapi / Gonadotropinfrisättande hormonanaloger.
ATC-kod: L02AE03.
Zoladex (goserelin) är en syntetisk analog av naturligt LHRH (gonadotropinfrisättande hormon). Vid långvarig användning förhindrar Zoladex 10,8 mg LH-utsöndringen från hypofysen, vilket leder till minskad testosteronnivå i serum hos män och till minskad östradiolnivå i serum hos kvinnor. Initialt kan Zoladex 10,8 mg, liksom andra LHRH-agonister, orsaka en övergående förhöjning av testosteronnivån i serum hos män och östradiolnivån i serum hos kvinnor.
Hos män minskar nivån av testosteron i serum efter cirka 21 dagars behandling till kastrationsvärden efter insättning av det första implantatet. Dessa nivåer kvarstår vid kontinuerlig behandling vid subkutan injektion av implantat var 3:e månad.
Data visar att hos en majoritet av patienterna bibehölls kastrationsnivåer av testosteron upp till 16 veckor om en injektion av ett implantat undantagsvis inte sker med tre månaders mellanrum.
Vid behandling av patienter med metastatisk prostatacancer i jämförande kliniska studier har Zoladex visat sig ge överlevnadsutfall som liknar de som erhålls med kirurgisk kastrering.
I en kombinerad analys av två randomiserade, kontrollerade studier som jämför bikalutamid 150 mg i monoterapi med kastrering (främst i form av Zoladex) fanns ingen signifikant skillnad i total överlevnad mellan bikalutamidbehandlade patienter och kastrationsbehandlade patienter [riskkvot (HR) = 1,05; KI 0,81 till 1,36] med lokalt avancerad prostatacancer. De två behandlingarnas ekvivalens kunde dock inte visas statistiskt.
I jämförande studier har Zoladex visat sig förbättra sjukdomsfri överlevnad och total överlevnad när det används som adjuvant behandling till strålbehandling hos patienter med lokaliserad prostatacancer av högrisktyp (T1–T2 och PSA på minst 10 ng/ml eller en Gleason-poäng på minst 7) eller lokalt avancerad (T3–T4) prostatacancer. Den optimala längden av adjuvantbehandling har inte fastställts; en jämförande studie har visat att 3 års adjuvantbehandling med Zoladex ger signifikant förbättrad överlevnad jämfört med enbart strålbehandling. Neoadjuvant Zoladex-behandling före strålbehandling har visat sig förbättra sjukdomsfri överlevnad hos patienter med lokaliserad prostatacancer av högrisktyp eller lokalt avancerad prostatacancer.
Efter prostatektomi hos patienter som visar sig ha tumörspridning utanför prostatan kan adjuvant Zoladex-behandling förbättra sjukdomsfri överlevnad, men det föreligger ingen signifikant förbättrad överlevnad om patienterna inte har tecken på nodalt engagemang vid tidpunkten för operation. Patienter med patologiskt fastställt lokalt avancerad sjukdom ska ha ytterligare riskfaktorer, såsom PSA på minst 10 ng/ml eller en Gleason-poäng på minst 7, innan adjuvant Zoladex ska övervägas. Det finns inga belägg för förbättrade kliniska resultat vid användning av neoadjuvant Zoladex före radikal prostatektomi.
Hos kvinnor sjunker östradiolnivåerna inom cirka 4 veckor efter insättning av det första implantatet och hålls på en låg nivå fram till slutet av behandlingsperioden. Hos patienter hos vilka utsöndringen av östradiol redan har supprimerats med LHRH-analoger, bibehålls suppressionen vid övergång till Zoladex 10,8 mg. Suppressionen av östradiolutsöndring följs av ett svar vid endometrios och uterusmyom, och hos största delen av patienterna leder detta till amenorré.
Initialt vid behandling med Zoladex kan vissa kvinnor få vaginala blödningar av varierande längd och intensitet. Blödningen är sannolikt bortfallsblödning som beror på minskat östrogen och upphör sannolikt spontant.
Under LHRH-analogbehandling kan vissa kvinnor få naturlig menopaus.
Det är dock sällsynt att menstruationen inte återkommer efter avslutad behandling.
Farmakokinetiska egenskaper
Administrering av Zoladex 10,8 mg implantat enligt doseringsrekommendationerna ger ett kontinuerligt frisättande utan kliniskt signifikant ackumulation av goserelin.
Zoladex har en låg proteinbindningsgrad och en halveringstid för eliminering i serum på 2‑4 timmar hos patienter med normal njurfunktion. Halveringstiden är förlängd hos patienter med nedsatt njurfunktion. Vid administrering av 10,8 mg i långverkande form enligt rekommendationerna orsakar denna förändring inte ackumulering. Därför är dosjustering inte nödvändig för patienter med nedsatt njurfunktion. Det finns ingen signifikant skillnad i farmakokinetiken hos patienter med leversjukdom.
Prekliniska säkerhetsuppgifter
Vid långvarig, upprepad behandling med Zoladex har en ökad incidens av benigna hypofystumörer observerats hos hanråttor. Denna observation har även tidigare gjorts hos råttor efter kirurgisk kastration, men liknande fynd har inte kunnat påvisas hos människa.
Vid långtidsstudier med upprepade doser som har varit mångfaldiga jämfört med doser för människa, har histologiska förändringar observerats i vissa delar av digestionskanalen hos möss. Dessa förändringar uppträder som hyperplasi i Langerhanska cellöarna i bukspottskörteln eller som ett benignt proliferativt tillstånd i området kring nedre magmunnen. Det senare har rapporterats som spontan förändring hos möss. Den kliniska relevansen av dessa fynd är oklar.
Farmaceutiska uppgifter
Förteckning över hjälpämnen
Laktid-/glykolidsampolymer (blandning av hög- och lågmolekylära sampolymerer).
Inkompatibiliteter
Inga kända.
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 25 ºC.
Förpackningstyp och innehåll
Markkinoilla olevat pakkaukset
Resepti
ZOLADEX implantaatti
10,8 mg (L:ei) 1 kpl (346,32 €)
PF-selosteen tieto
1 x 10,8 mg implantat i förfylld spruta, i en sluten påse med torkmedel.
Läkemedlets utseende:
Läkemedlets utseende: Steril, vitaktig 17 mm lång och 1,5 mm tjock stav i en förfylld spruta.
Särskilda anvisningar för destruktion och övrig hantering
Används endast om aluminiumpåsen är oskadad. Används genast när aluminiumpåsen är öppnad.
Försiktighet ska iakttas vid injektion av Zoladex-implantat i främre abdominalvägg på grund av närheten av underliggande nedre epigastrisk artär och dess förgreningar. Extra försiktighet ska utövas vid administrering av Zoladex till patienter med lågt BMI och/eller som får fullskalig antikoagulationsbehandling.
Zoladex-sprutan kan inte användas för att aspirera. Om den hypodermiska nålen penetrerar ett större blodkärl kommer blod omedelbart synas i sprutans kammare. Om ett blodkärl penetrerats ska nålen omedelbart dras bort och resulterande blödning ska omedelbart kontrolleras och hanteras. Patienten ska övervakas för tecken eller symtom för abdominalblödning. Efter att man säkerställt att patienten är hemodynamiskt stabil kan ett nytt Zoladex implantat injiceras på ett annat ställe.
Bruksanvisningar för sprutan:
1. Patienten bör ligga med överkroppen i lätt upprest läge. Desinficera injektionsstället nedanför naveln.
2. Kontrollera att aluminiumförpackningen eller sprutan inte är skadad. Öppna folieförpackningen och håll sprutan i en liten vinkel snett uppåt mot ljuset för att kontrollera att implantatet är synligt (figur 1).
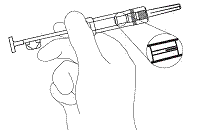
bild 1
3. Fatta tag i och avlägsna den blå säkerhetsklämman (figur 2). Till skillnad från injektionsvätskor behöver inte luftbubblor avlägsnas. Försök till att göra detta kan förskjuta implantatet.
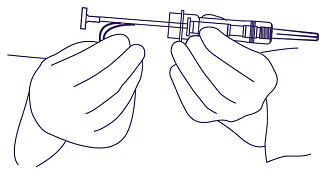
bild 2
4. Avlägsna kanylhylsan. Håll med fingrarna runt skyddshylsan, håll ett löst tag om hudvecket med aseptisk teknik och för in nålen i en liten nästan parallell vinkel (30 till 45 grader) mot huden. Tryck in implantatet i den främre delen av bukvävnaden nedanför naveln tills skyddshylsan nuddar patientens hud (figur 3).
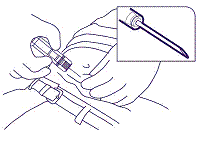
bild 3
5. Penetrera inte muskeln eller bukhinnan. Felaktigt grepp och vinkel visas i figur 4.
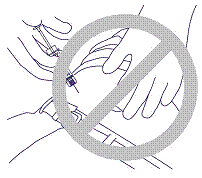
bild 4
6. Injicera implantatet samt aktivera skyddshylsan genom att trycka in kolven helt, tills den inte går att trycka in längre. Det kan höras ett klick och skyddshylsan börjar automatiskt glida för att täcka över nålen. Om kolven inte trycks in så långt det går aktiveras inte skyddshylsan.
7. Håll sprutan som visas i figur 5 och dra ut nålen. Låt skyddshylsan glida och täcka över nålen. Släng sprutan i riskavfallsbehållare (för vassa föremål).

bild 5
Ersättning
ZOLADEX implantaatti
10,8 mg 1 kpl
- Ylempi erityiskorvaus (100 %). Rintasyöpä (115), Eturauhassyöpä (116).
- Peruskorvaus (40 %).
Atc-kod
L02AE03
Datum för översyn av produktresumén
21.04.2023
Yhteystiedot
Keilaranta 18
02150 Espoo
010 23 010
www.astrazeneca.fi
