ACARIZAX kylmäkuivattu tabletti kielen alle 12 SQ-HDM
Vaikuttavat aineet ja niiden määrät
Huonepölypunkeista Dermatophagoides pteronyssinus ja Dermatophagoides farinae standardisoitu allergeeniuute, 12 SQ-HDM* yhtä kylmäkuivattua tablettia kohden.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
* [SQ-HDM on Acarizax-valmisteen annosyksikkö. SQ on vakiointimenetelmä, joka perustuu valmisteen biologisen vaikutuksen, pääallergeenin määrän ja allergeeniuutteen kompleksisuuden määrittämiseen. HDM on huonepölypunkkeja (house dust mite) tarkoittava lyhenne.]
Lääkemuoto
Kylmäkuivattu tabletti kielen alle (kylmäkuivattu tabletti)
Kliiniset tiedot
Käyttöaiheet
Acarizax on tarkoitettu aikuisille (18–65-vuotiaat) potilaille, joilla on todettu esitietojen ja huonepölypunkeille herkistämisen yhteydessä (ihopistokokeessa ja/tai erityisessä IgE-testissä) saadun positiivisen tuloksen perusteella ainakin yksi seuraavista tiloista:
- sitkeä kohtalainen tai vaikea huonepölypunkkien aiheuttama allerginen nuha, joka jatkuu oireita lievittävästä lääkityksestä huolimatta
- huonepölypunkeista johtuva allerginen astma, jota ei ole saatu hyvään hoitotasapainoon inhaloitavilla kortikosteroideilla ja johon liittyy lievä, kohtalainen tai vaikea huonepölypunkeista johtuva allerginen nuha. Potilaiden astman status on arvioitava huolellisesti ennen hoidon aloittamista (ks. kohta Vasta-aiheet).
Acarizax on tarkoitettu lapsille (5–17-vuotiaat), joilla on todettu esitietojen ja huonepölypunkeille herkistämisen yhteydessä (ihopistokokeessa ja/tai spesifisessä IgE-testissä) saadun positiivisen tuloksen perusteella sitkeä kohtalainen tai vaikea huonepölypunkkien aiheuttama allerginen nuha, joka jatkuu oireita lievittävästä lääkityksestä huolimatta.
Ehto
Hoito tulee aloittaa allergioiden hoitoon perehtyneen erikoislääkärin toimesta.
Annostus ja antotapa
Annostus
Suositeltu annos lapsille ja aikuisille (5–65-vuotiaat) on yksi kylmäkuivattu tabletti kielen alle (12 SQ-HDM) päivittäin.
Kliinisen vaikutuksen odotetaan alkavan 8–14 viikon kuluttua hoidon aloittamisesta. Kansainvälisten hoitosuositusten mukaan allergian siedätyshoitoon tarvitaan 3 vuoden hoitojakso, jotta sairaudessa saavutettaisiin muutosta. Tehoa mittaavia tuloksia on saatavana 18 kuukauden Acarizax-hoidosta aikuisilla: kolmen vuoden hoidosta ei ole tuloksia (ks. kohta Farmakodynamiikka). Jos ensimmäisen Acarizax-hoitovuoden aikana ei havaita lainkaan paranemista, hoitoa ei ole aihetta jatkaa.
Pediatriset potilaat
Allerginen nuha: Annostus on sama lapsille (5–17-vuotiaat) ja aikuisille. Acarizax-valmisteen käytöstä ei ole kliinistä kokemusta alle 5-vuotiaiden lasten allergisen nuhan hoidossa. Acarizax-valmistetta ei ole tarkoitettu alle 5-vuotiaiden lasten allergisen nuhan hoitoon. Saatavissa oleva tieto on kuvattu kohdissa Haittavaikutukset ja Farmakodynamiikka.
Allerginen astma: Acarizax-valmisteen tehoa alle 18-vuotiaiden lasten allergisen astman hoidossa ei ole varmistettu. Acarizax-valmistetta ei ole tarkoitettu alle 18-vuotiaiden lasten allergisen astman hoitoon. Saatavissa oleva tieto on kuvattu kohdissa Haittavaikutukset ja Farmakodynamiikka.
Iäkkäät potilaat
Acarizax-valmisteen käytöstä ei ole kliinistä kokemusta yli 65-vuotiailla siedätyshoidossa. Acarizax-valmistetta ei ole tarkoitettu yli 65-vuotiaiden hoitoon (ks. kohta Farmakodynamiikka).
Antotapa
Acarizax-hoidon saa aloittaa allergisten sairauksien hoitoon perehtynyt lääkäri.
Ensimmäinen kylmäkuivattu tabletti kielen alle on otettava lääkärin vastaanotolla, ja potilasta on tarkkailtava vähintään puolen tunnin ajan. Tällöin on mahdollisuus keskusteluun ja mahdollisten välittömien haittavaikutusten hoitamiseen.
Acarizax on kielen alle asetettava kylmäkuivattu tabletti. Kylmäkuivattu tabletti otetaan ulos läpipainopakkauksesta kuivin sormin heti läpipainopakkauksen avaamisen jälkeen. Tabletti asetetaan kielen alle, missä se sulaa. Nielemistä pitää välttää noin yhden minuutin ajan. Ruuan ja juoman nauttiminen on kielletty seuraavien 5 minuutin ajan.
Jos Acarizax-hoito keskeytyy enintään 7 vuorokauden ajaksi, potilas voi jatkaa hoitoa omalla päätöksellään. Jos hoito keskeytyy yli 7 vuorokauden ajaksi, on suositeltavaa ottaa yhteyttä lääkäriin ennen hoidon jatkamista.
Vasta-aiheet
Yliherkkyys apuaineille(täydellinen apuaineluettelo, ks. kohta Apuaineet).
Potilaat, joilla FEV1 on < 70 % viitearvosta (riittävän farmakologisen hoidon jälkeen) hoidon alussa.
Potilaat, joilla on ilmennyt vaikea astman pahenemisvaihe kolmen viime kuukauden aikana.
Akuuttia hengitystieinfektiota sairastavilla astmapotilailla Acarizax-hoidon aloittamista on siirrettävä, kunnes infektio on ohi.
Potilaat, joilla on kliinisesti relevantti aktiivinen tai huonossa hoitotasapainossa oleva autoimmuunisairaus, immuunijärjestelmän puutteita, immuunivajavuuksia, immunosuppressiota tai pahanlaatuisia neoplastisia sairauksia.
Potilaat, joilla on akuutti vaikea suun tulehdus tai suun haavaumia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Varoitukset ja käyttöön liittyvät varotoimet
Astma
Astma on tunnettu vaikeiden systeemisten allergisten haittavaikutusten riskitekijä.
Potilaita on neuvottava, että Acarizax ei ole tarkoitettu astman akuuttien pahenemisvaiheiden hoitoon. Jos astma pahenee äkillisesti, on käytettävä lyhytvaikutteista bronkodilaattoria. Jos potilaan mielestä hoito lyhytvaikutteisella bronkodilaattorilla ei tehoa tai jos sitä on inhaloitava tavallista enemmän, hänen on hakeuduttava lääkärin hoitoon.
Potilaille on kerrottava, että heidän on hakeuduttava välittömästi lääkärin hoitoon, jos astma pahenee äkillisesti.
Acarizax-valmistetta pitää aluksi käyttää lisähoitona eikä sillä pidä korvata jo käytössä olevaa astmahoitoa. Astman ylläpitohoidon äkillinen keskeyttäminen Acarizax-hoidon aloittamisen jälkeen ei ole suositeltavaa. Astman ylläpitohoidon vähentäminen on tehtävä asteittain lääkärin valvonnassa astman hoitosuositusten mukaisesti.
Voimakas systeeminen allerginen reaktio
Hoito on lopetettava ja otettava välittömästi yhteyttä lääkäriin,jos esiintyy voimakkaita systeemisiä allergisia reaktioita, astman vaikeaa pahenemista, angioedeemaa, nielemisvaikeuksia, hengitysvaikeuksia, äänen muutoksia, hypotensiota tai täysinäisyyden tunnetta nielussa. Systeemisten oireiden ilmaantumisvaiheessa voi esiintyä punoitusta, kutinaa, kuumuuden tunnetta, yleistä huonoa oloa ja agitaatiota/ahdistuneisuutta.
Yksi vaihtoehto voimakkaiden systeemisten allergisten reaktioiden hoidossa on adrenaliini. Potilailla, joita hoidetaan trisyklisillä masennuslääkkeillä, monoamiinioksidaasin estäjillä (MAO:n estäjillä) ja/tai COMT-entsyymin estäjillä, adrenaliinin vaikutukset saattavat voimistua mahdollisin fataalein seurauksin. Adrenaliinin vaikutukset voivat heikentyä potilailla, joita hoidetaan beetasalpaajilla.
Sydäntautipotilaille systeemisten allergisten reaktioiden ilmaantuminen saattaa aiheuttaa suuremman vaaran. Kliinistä kokemusta sydäntautipotilaiden Acarizax-hoidosta on vain vähän.
Tämä on otettava huomioon ennen allergian siedätyshoidon aloittamista.
Potilailla, joilla on aiemmin esiintynyt systeeminen allerginen reaktio ihon alle annettua huonepölypunkkisiedätyshoitoa vastaan, Acarizax-hoidon aloittamista on harkittava huolellisesti, ja toimenpiteisiin mahdollisten reaktioiden varalta on varauduttava. Tämä perustuu heinän siitepölyallergian siedätyshoidossa käytetystä vastaavasta resoribletistä markkinoilletulon jälkeen saatuihin kokemuksiin, jotka osoittavat, että voimakkaan allergisen reaktion riski voi olla suurentunut potilailla, joilla on aiemmin esiintynyt systeeminen allerginen reaktio ihon alle annettavaa heinän siitepölyallergian siedätyshoitoa vastaan.
Suun tulehdus
Potilaille, joilla on vaikea suun tulehdus (esim. suun jäkälätauti, suun haavaumia tai sammas), haavoja suussa tai joille on äskettäin tehty suun kirurgisia toimenpiteitä, mukaan lukien hampaanpoisto, tai jotka ovat äskettäin menettäneet hampaan, Acarizax-hoidon aloittamista on lykättävä ja meneillään oleva hoito on keskeytettävä siksi aikaa, että suuontelo voi parantua.
Paikalliset allergiset reaktiot
Acarizax-hoidon yhteydessä potilas altistuu allergeenille, joka aiheuttaa allergiset oireet. Siksi paikallisia allergisia reaktioita on odotettavissa hoitojakson aikana. Nämä reaktiot ovat yleensä lieviä tai kohtalaisia, mutta vaikeampiakin suunielun reaktioita voi esiintyä. Jos potilaalla ilmenee hoidon johdosta huomattavia paikallisia haittavaikutuksia, on harkittava allergialääkitystä (esim. antihistamiineja).
Eosinofiilinen ruokatorvitulehdus
Acarizax-hoidon yhteydessä on ilmoitettu eosinofiilista esofagiittia. Potilaiden, joilla on vaikeita tai pitkittyneitä gastroesofageaalisia oireita, kuten dysfagiaa tai dyspepsiaa, on syytä keskeyttää Acarizax-valmisteen käyttö ja hakeutua lääkärin hoitoon.
Remissiossa olevat autoimmuunisairaudet
Allergian siedätyshoidon annosta potilaille, joilla on remissioissa oleva autoimmuunisairaus, on vain vähän tietoa. Acarizax-valmisteen määräämisessä tällaisille potilaille tulee noudattaa varovaisuutta.
Ruoka-allergia
Acarizax-valmisteessa voi olla kalaproteiinijäämiä. Saatavissa olevat tiedot eivät ole viitanneet suurentuneeseen allergisten reaktioiden riskiin potilailla, joilla on kala-allergia.
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos, eli sen voidaan sanoa olevan ”natriumiton”.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ihmisillä ei ole tehty eikä potentiaalisia lääkeyhteisvaikutuksia ole tunnistettu mistään lähteestä. Samanaikainen hoito oireenmukaisilla allergialääkkeillä voi lisätä potilaan toleranssia siedätyshoidolle. Tämä on otettava huomioon tällaista lääkitystä lopetettaessa.
Raskaus ja imetys
Raskaus
Acarizax-valmisteen käytöstä raskaana oleville naisille ei ole kliinistä kokemusta. Eläintutkimukset eivät osoita lisääntynyttä riskiä sikiölle. Acarizax-hoitoa ei pidä aloittaa raskauden aikana. Jos potilas tulee raskaaksi hoidon aikana, hoitoa voidaan jatkaa, kun potilaan yleinen terveydentila (mukaan lukien keuhkojen toiminta) ja aikaisemmat reaktiot Acarizax-valmisteelle on arvioitu. Astmapotilaiden tilaa raskauden aikana suositellaan seurattavan tarkoin.
Imetys
Acarizax-valmisteen käytöstä imettäville naisille ei ole saatavilla kliinistä tietoa. Rintaruokintaa saaville lapsille ei ole odotettavissa mitään vaikutuksia.
Hedelmällisyys
Saatavana ei ole kliinisiä tutkimustietoja Acarizax-valmisteen käytön vaikutuksista hedelmällisyyteen. Hiirillä tehdyssä toistuvien annosten toksisuustutkimuksessa ei havaittu mitään vaikutuksia kummankaan sukupuolen lisääntymiselimiin.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Acarizax-hoidolla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Yhteenveto turvallisuusprofiilista
Acarizax-valmistetta käyttävät potilaat voivat ensisijaisesti odottaa lieviä tai kohtalaisia paikallisia allergisia reaktioita, joita esiintyy muutaman ensimmäisen päivän aikana ja jotka lievenevät jälleen hoidon jatkuessa (1‑3 kuukautta) (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Kun tällainen reaktio esiintyy, useimmiten se alkaa 5 minuutin kuluessa Acarizax-valmisteen ottamisesta ja laantuu muutaman minuutin tai tunnin kuluessa. Vaikeampia suunielun allergisia reaktioita voi esiintyä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
On ilmoitettu yksittäisiä tapauksia, joissa astmaoireet ovat pahentuneet voimakkaasti ja äkillisesti. Potilaiden, joilla on tiedossa olevia riskitekijöitä, ei pidä aloittaa Acarizax-hoitoa (ks. kohta Vasta-aiheet).
Taulukoitu yhteenveto haittavaikutuksista
Seuraava taulukko haittavaikutuksista perustuu plasebo-kontrolloituihin, kliinisiin tutkimuksiin Acarizax-valmisteen käytöstä aikuisille ja nuorille (yli 2 100 Acarizax-valmisteella hoidettua potilasta), joilla on huonepölypunkin aiheuttama allerginen nuha ja/tai allerginen astma, sekä spontaaneihin ilmoituksiin.
Haittavaikutukset on ryhmitelty MedDRA:n määrittelemien esiintymistiheyksien mukaan: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1000, < 1/100), harvinainen (≥ 1/10000, < 1/1000), hyvin harvinainen (< 1/10000).
| Elinjärjestelmä | Yleisyys | Haittavaikutus |
| Infektiot | Hyvin yleinen | Nenänielun tulehdus |
| Yleinen | Keuhkoputkitulehdus, nielutulehdus, nuha, sivuonteloiden tulehdus | |
| Melko harvinainen | Kurkunpäätulehdus | |
| Immuunijärjestelmä | Melko harvinainen | Anafylaktinen reaktio |
| Hermosto | Yleinen | Makuhäiriö |
| Melko harvinainen | Huimaus, tuntoaistimushäiriö | |
| Silmät | Yleinen | Silmien kutina |
| Melko harvinainen | Allerginen sidekalvotulehdus | |
| Kuulo ja tasapainoelin | Hyvin yleinen | Korvien kutina |
| Melko harvinainen | Epämiellyttävä tunne korvissa | |
| Sydän | Melko harvinainen | Sydämentykytys |
| Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | Nielun ärsytys |
| Yleinen | Astma, yskä*, ääntöhäiriö, hengenahdistus, suunielun kipu, nielun turvotus | |
| Melko harvinainen | Nenän kongestio, epämiellyttävä tunne nenässä, nenän turvotus, nielun punoitus, rinorrea, aivastelu, kurkun ahtaus, nielurisojen liikakasvu | |
| Harvinainen | Kurkunpään turvotus, nenän tukkoisuus, henkitorven turvotus | |
| Ruuansulatuselimistö | Hyvin yleinen | Huulten turvotus, suun turvotus, suun kutina |
| Yleinen | Vatsakipu, ripuli, dysfagia, dyspepsia, gastroesofageaalinen refluksitauti, glossodynia, kielitulehdus, huulten kutina, suun haavaumat, suukipu, kielen kutina, pahoinvointi, epämiellyttävä tunne suussa, suun limakalvon punoitus, suun parestesia, suutulehdus, kielen turvotus, oksentelu | |
| Melko harvinainen | Suun kuivuminen, huulikipu, huulten haavaumat, ruokatorven ärtyminen, suun limakalvon rakkulat, sylkirauhasten suureneminen, sylkirauhasten liikaeritys | |
| Harvinainen | Eosinofiilinen ruokatorvitulehdus | |
| Iho ja ihonalainen kudos | Yleinen | Kutina, nokkosihottuma |
| Melko harvinainen | Punoitus | |
| Harvinainen | Angioedeema | |
| Yleisoireet ja antopaikassa todettavat haitat | Yleinen | Epämiellyttävä tunne rintakehässä, väsymys |
| Melko harvinainen | Sairauden tunne, vierasainetuntemus |
Valikoitujen haittavaikutusten kuvaus
Jos potilaalla ilmenee hoidon johdosta huomattavia haittavaikutuksia, on harkittava allergialääkitystä.
Vakavia systeemisiä allergisia reaktioita, mukaan lukien anafylaksia, on ilmoitettu myyntiluvan myöntämisen jälkeen. Tämän vuoksi lääkärin valvonta ensimmäisen kylmäkuivatun tabletin ottokerralla on tärkeä varotoimenpide (ks. kohta Annostus ja antotapa). Vakavia systeemisiä allergisia reaktioita on kuitenkin ilmennyt myös ensimmäistä annosta seuraavilla annoksilla.
Lääkäriin on otettava välittömästi yhteys, jos ilmenee astmaoireiden tai vaikeiden systeemisten allergisten reaktioiden äkillistä pahenemista, angioedeemaa, nielemisvaikeuksia, hengitysvaikeuksia, äänenmuutoksia, hypotensiota tai täyteläisyyden tunnetta nielussa. Hengitysvaikeutta seuraavaa verenpainekriisiä on raportoitu pian Acarizax-valmisteen ottamisen jälkeen. Näissä tapauksissa hoito pitää keskeyttää pysyvästi tai kunnes lääkäri toisin neuvoo.
* Kliinisissä tutkimuksissa yskää havaittiin yhtä usein Acarizax-valmistetta ja lumelääkettä saaneilla potilailla.
Pediatriset potilaat
12–17-vuotiaat nuoret
Nuorilla raportoidut haittavaikutukset ovat olleet toistumistiheyden, laadun ja vakavuuden suhteen samankaltaisia kuin aikuisilla.
5–11-vuotiaat lapset
Acarizax-valmisteella hoidettujen lasten turvallisuusprofiili oli kaiken kaikkiaan samankaltainen kuin nuorilla ja aikuisilla. Suurin osa haittavaikutuksista oli vaikeusasteeltaan lieviä tai kohtalaisia, ja niiden esiintymistiheydet olivat samankaltaiset kuin nuorilla/aikuisilla. Astmaa sairastavilla lapsilla yleinen turvallisuusprofiili oli samankaltainen kuin lapsilla, joilla ei ole astmaa. Acarizax-valmisteen turvallisuusprofiili lapsilla perustuu ensisijaisesti tietoihin, jotka on saatu kaksoissokkoutetuista, lumekontrolloiduista, monikansallisista kliinisistä tutkimuksista (noin 900 Acarizax-valmisteella hoidettua lasta), joissa pyydettiin aktiivisesti ilmoittamaan etukäteen määritellyt paikalliset haittavaikutukset hoidon 28 ensimmäisen päivän ajalta.
Seuraavia haittavaikutuksia havaittiin lapsia koskeneissa tutkimuksissa useammin kuin nuoria ja aikuisia koskeneissa tutkimuksissa:
Vatsakipu, ripuli, makuhäiriö, glossodynia, suun haavaumat, pahoinvointi, nielun turvotus ja kielen turvotus olivat esiintymistiheydeltään hyvin yleisiä (≥ 1/10). Kaikki nämä haittavaikutukset kuuluivat etukäteen määritettyihin haittavaikutuksiin, joita pyydettiin ilmoittamaan.
Allergisen sidekalvotulehduksen oireita ilmoitettiin yleisesti (esiintymistiheys ≥ 1/100, < 1/10).
Angioedeemaa ja eosinofiilista ruokatorvitulehdusta ilmoitettiin melko harvoin (esiintymistiheys ≥ 1/1 000, < 1/100).
Alle 5-vuotiaat lapset
Acarizax-hoidosta alle 5-vuotiailla lapsilla ei ole tietoja.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Faasin I tutkimuksissa aikuiset huonepölypunkkiallergikot altistettiin saamaan enintään 32 SQ-HDM:n annoksia. Tietoa lasten (5–17-vuotiaiden) altistamisesta päivittäisen suositusannoksen (12 SQ-HDM) ylittäville annoksille ei ole saatavilla.
Jos käytetään suositeltuja päiväannoksia suurempia annoksia, haittavaikutusten, mukaan lukien systeemisten allergisten reaktioiden tai vaikeiden paikallisten allergisten reaktioiden, riski lisääntyy. Välitöntä lääkärin arviota tarvitaan, jos potilaalla ilmenee vaikeita reaktioita, kuten angioedeemaa, nielemisvaikeuksia, hengitysvaikeuksia, äänenmuutoksia tai tunnetta nielun turpoamisesta. Nämä reaktiot pitää hoitaa asiaankuuluvalla, oireenmukaisella lääkehoidolla.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: allergeeniuutteet, huonepölypunkki
ATC-koodi: V01AA03
Vaikutusmekanismi
Acarizax on immunoterapiavalmiste eli siedätyshoitovalmiste allergiaan. Siedätyshoito allergeenituotteilla tarkoittaa allergeenien toistettua antoa allergisille henkilöille tarkoituksena muuttaa immunologista vastetta allergeenille.
Allergian siedätyshoidon farmakodynaaminen vaikutuskohde on immuunijärjestelmä, mutta hoidon kliinisen vaikutuksen täydellistä ja täsmällistä vaikutusmekanismia ei täysin tunneta. Acarizax-hoidon on osoitettu indusoivan huonepölypunkki-spesifisen IgG4:n lisääntymistä ja indusoivan systeemisen vasta-ainevasteen, joka pystyy kilpailemaan IgE:n kanssa huonepölypunkin allergeenien sitomisessa. Tämä vaikutus havaitaan jo 4 viikon hoidon jälkeen.
Acarizax‑valmisteen vaikutus kohdistuu huonepölypunkkien aiheuttaman allergisen hengitystiesairauden syyhyn, ja kliininen vaikutus on hoidon aikana todettu sekä ylä- että alahengitysteissä. Acarizax‑valmisteen antama suoja johtaa sairauden parempaan hoitotasapainoon ja elämänlaadun paranemiseen, jotka ilmenevät oireiden lievittymisenä, muun lääkityksen tarpeen vähenemisenä ja oireiden pahenemisriskin pienentymisenä.
Kliininen teho aikuisilla
Acarizax 12 SQ-HDM -hoidon tehoa huonepölypunkkien aiheuttamassa allergisessa hengitystiesairaudessa tutkittiin kahdessa kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa tutkimuksessa, joissa oli eri päätetapahtumia ja eri väestöryhmiä. 2/3 tutkimushenkilöistä oli herkistynyt useammalle allergeenille kuin pelkästään huonepölypunkille. Herkistyminen pelkästään huonepölypunkille tai huonepölypunkille ja yhdelle tai useammalle muulle allergeenille ei vaikuttanut tutkimuksen tuloksiin. Tukea antavaa näyttöä on saatu myös allergeenialtistuskammiokokeesta sekä pienemmillä annoksilla tehdystä tutkimuksesta.
Allerginen nuha (riniitti)
MERIT-tutkimus (MT-06)
- MERIT-tutkimukseen osallistui 992 aikuista, joilla oli kohtalainen tai vaikea huonepölypunkkien aiheuttama allerginen nuha huolimatta nuhalääkkeiden käytöstä. Tutkimushenkilöt satunnaistettiin saamaan noin 1 vuoden ajan päivittäistä hoitoa valmisteilla 12 SQ-HDM, 6 SQ-HDM tai lumelääkettä. He saivat vapaasti käyttää tavanomaisia nuhalääkkeitä. Tutkimushenkilöt kävivät erikoislääkärin vastaanotolla noin kahden kuukauden välein koko tutkimuksen ajan.
-
Ensisijainen päätetapahtuma oli keskimääräinen päivittäinen nuhan yhdistetty kokonaispistemäärä (total combined rhinitis score, TCRS), joka arvioitiin 8 viimeisen hoitoviikon aikana.
- TCRS oli nuhaoirepisteiden ja nuhalääkepisteiden summa. Nuhaoirepisteet saatiin arvioimalla 4:ää nenään liittyvää oiretta (vuotava nenä, tukkeutunut nenä, kutiseva nenä, aivastelu) päivittäin asteikolla 0–3 (ei oireita, lieviä, kohtalaisia, vaikeita oireita), toisin sanoen pistemäärän vaihteluväli on 0–12. Nuhalääkepisteet muodostuivat sieraimeen annosteltujen steroidilääkkeiden (2 pistettä/painallus, maks. 4 painallusta/vrk) ja suun kautta otettavien antihistamiinien käytöstä (4 pistettä/tabletti, maks. 1 tabletti/vrk), käytön summasta, eli vaihteluväli oli 0‑12. Täten TCRS-pistemäärän vaihteluväli on 0‑24.
- Ylimääräiset etukäteen määritetyt tärkeät toissijaiset päätetapahtumat olivat rinokonjunktiviitin yhdistetty kokonaispistemäärä ja rinokonjunktiviitti-elämänlaatu (RQLQ).
-
Niiltä päiviltä, jolloin nuha paheni, tehtiin myös post-hoc-analyysit, joiden avulla pyrittiin saamaan lisätietoa tulosten kliinisestä merkityksestä.
- Nuhan pahenemispäiviksi määriteltiin päivät, jolloin tutkimushenkilön oireet palautuivat samalle tasolle, joka oli tutkimuksen sisäänottokriteerinä: nuhaoirepisteitä piti olla vähintään 6 tai, jos yksi oireista oli arvioitu vaikeaksi, vähintään 5.
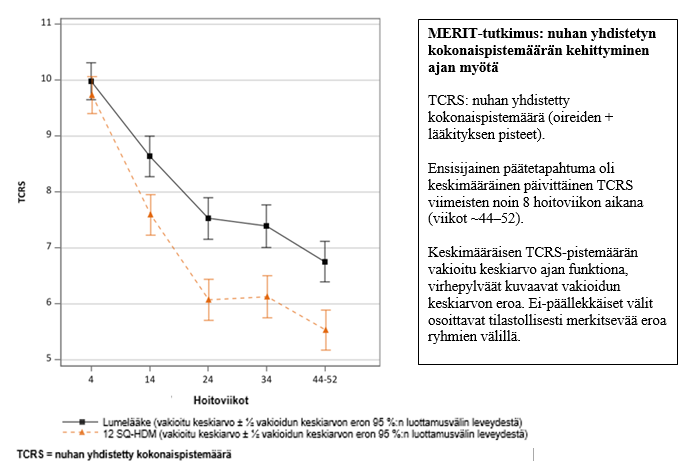
| MERIT-tutkimuksen tulokset | 12 SQ-HDM | Lumelääke | Hoidon vaikutus | ||||
| Ensisijainen päätetapahtuma | N | Piste-määrä | N | Piste-määrä | Absoluutt. eroc | Suhteell. erod | p-arvo |
| Nuhan yhdistetty kokonaispistemäärä | |||||||
| FAS-MIa (vakioitu keskiarvo) | 318 | 5,71 | 338 | 6,81 | 1,09 [0,35; 1,84] | - | 0,004 |
| FASb (vakioitu keskiarvo) | 284 | 5,53 | 298 | 6,76 | 1,22 [0,49; 1,96] | 18 % | 0,001 |
| FASb (mediaani) | 284 | 5,88 | 298 | 7,54 | 1,66 | 22 % | - |
| Etukäteen määritetyt tärkeimmät toissijaiset päätetapahtumat | N | Piste-määrä | N | Piste-määrä | Absoluutt. eroc | Suhteell. erod | p-arvo |
| Nuhaoirepisteet | |||||||
| FASb (vakioitu keskiarvo) | 284 | 2,76 | 298 | 3,30 | 0,54 [0,18; 0,89] | 16 % | 0,003 |
| FASb (mediaani) | 284 | 2,98 | 298 | 3,98 | 1,00 | 25 % | - |
| Nuhan lääkehoitopisteet | |||||||
| FASb (vakioitu keskiarvo) | 284 | 2,22 | 298 | 2,83 | 0,60 [0,08; 1,13] | 21 % | 0,024 |
| FASb (mediaani) | 284 | 2,83 | 298 | 4,00 | 1,17 | 29 % | - |
| Rinokonjunktiviitin yhdistetty kokonaispistemäärä | |||||||
| FASb (vakioitu keskiarvo) | 241 | 7,91 | 257 | 9,12 | 1,21 [0,13; 2,28] | 13 % | 0,029 |
| FASb (mediaani) | 241 | 8,38 | 257 | 10,05 | 1,67 | 17 % | - |
| Rinokonjunktiviitti-elämänlaatukyselyn (RQLQ(S)) pisteet | |||||||
| FASb (vakioitu keskiarvo) | 229 | 1,38 | 240 | 1,58 | 0,19e [0,02; 0,37] | 12 % | 0,031 |
| FASb (mediaani) | 229 | 1,25 | 240 | 1,46 | 0,21 | 14 % | - |
| Post-hoc-päätetapahtumat | N | Osuus | N | Osuus | (Kerroinsuhde (OR)f [95 %:n CL] | p-arvo | |
| Sellaisen päivän todennäköisyys, jolloin nuha pahenee | |||||||
| FAS (arvio)b | 284 | 5,33 % | 298 | 11,14 % | 0,45 [0,28; 0,72] | 0,001 | |
| Sellaisen päivän todennäköisyys, jolloin nuha pahenee nuhalääkkeiden käytöstä huolimatta | |||||||
| FAS (arvio)b | 284 | 3,43 % | 298 | 6,50 % | 0,51 [0,32; 0,81] | 0,005 | |
| N: niiden hoitoryhmässä olleiden tutkimushenkilöiden määrä, joista oli analyysia varten dataa saatavissa. CL: luottamusvälit a FAS-MI: täydellinen analyysisarja, jossa useita paikkauksia. Henkilöt, jotka keskeyttivät tutkimukseen osallistumisen ennen tehon arviontijaksoa, katsotaan analyysissa lumelääkepotilaiksi. Ensisijaista analyysia (FAS-MI) varten vain absoluuttinen ero oli määritetty etukäteen. b FAS: täydellinen analyysisarja (full analysis set). Kaikki saatavissa ollut data käytettiin täydellisesti, t.s. tehon arviointijakson aikana tutkimushenkilöiltä saatavissa ollut data. c Absoluuttinen ero: lumelääke miinus 12 SQ-HDM, 95 %:n luottamusrajat. d Suhteellinen ero lumelääkkeeseen: lumelääke miinus 12 SQ-HDM jaettuna lumelääkkeellä. e Eroa 12 SQ-HDM -valmisteen ja lumelääkkeen välillä syntyi ensisijaisesti kolmella alueella: univaikeudet, käytännön ongelmat ja nenään liittyvät oireet. f Kerroinsuhde (odds ratio, OR) nuhan pahenemiselle: 12 SQ-HDM lumelääkkeeseen nähden. | |||||||
Tukea antavaa näyttöä – allerginen nuha
Satunnaistettu kaksoissokkoutettu lumelääkekontrolloitu faasin II tutkimus suoritettiin allergeenien altistuskammiossa 124 aikuisella, joilla oli huonepölypunkin aiheuttama allerginen nuha. Ennen jokaista allergeenialtistusta tutkimuspotilaat olivat lopettaneet allergialääkityksen käytön niin, että sen vaikutus oli poistunut elimistöstä. Tutkimuksen lopussa, sen jälkeen, kun tutkimushenkilöt olivat saaneet 24 viikkoa 12 SQ-HDM-, 6 SQ-HDM- tai lumelääkehoitoa, suoritettiin allergeenialtistus, jossa keskimääräiset nuhaoirepisteet olivat 7,45 [6,57; 8,33] lumelääkeryhmässä ja 3,83 [2,94; 4,72] 12 SQ-HDM -ryhmässä, ja vastaava absoluuttinen ero oli 3,62 ja suhteellinen ero 49 % (95 %:n luottamusväli [35 %; 60 %], p < 0,001). 12 SQ-HDM -valmisteen ja lumelääkkeen välinen ero oli myös tilastollisesti merkitsevä 16. viikon kohdalla (keskimääräiset pistemäärät 4,82 ja 6,90; ero 2,08, joka vastaa 30 %:n suhteellista eroa, 95 %:n CI [17 %;42 %], p < 0,001) ja 8. viikon kohdalla (keskimääräiset pistemäärät 5,34 ja 6,71; ero 1,37 joka vastaa 20 %:n suhteellista eroa, 95 %:n CI [7 %;33 %], p = 0,007).
Allerginen astma
MITRA-tutkimus (MT-04)
MITRA-tutkimukseen otettiin 834 aikuista, joilla oli huonepölypunkkien aiheuttama allerginen astma, jota ei ollut saatu hyvään hoitotasapainoon päivittäin inhaloitavilla, 400–1 200 µg budesonidia vastaavilla kortikosteroideilla. Kaikki tutkittavat saivat inhaloitavan kortikosteroidin ja lyhytvaikutteisen beeta-agonistin lisäksi 7–12 kuukautta 12 SQ-HDM-, 6 SQ-HDM- tai lumelääkehoitoa ennen inhaloitavan kortikosteroidin vähentämistä. Ennen satunnaistamista ei toteutettu titraamisvaihetta inhaloitavan kortikosteroidin pienimmän ylläpitoannoksen selvittämiseksi. Tehoa arvioitiin sen ajan mukaan, joka kului ensimmäiseen kohtalaiseen tai vaikeaan astman pahenemisvaiheeseen inhaloitavien kortikosteroidien vähentämisen aikana viimeisten 6 kuukauden kuluessa, kun hoito kesti 13–18 kuukautta.
-
Kohtalaisen astman pahenemisvaiheen määritelmä täyttyi, jos tutkimushenkilöllä esiintyi yksi tai useampi alla mainituista kriteereistä, ja se johti muutokseen hoidossa.
- Yöllä tapahtunut herääminen tai oireiden lisääntyminen: yöllinen herääminen astman vuoksi, joka vaati lyhytvaikutteisia β2-agonisteja (SABA) kahtena peräkkäisenä yönä tai päivittäisen oirepistemäärän kohoaminen ≥ 0,75 lähtötilanteesta kahtena peräkkäisenä päivänä.
- Lisääntynyt lyhytvaikutteisten beeta-agonistien (SABA) käyttö: lyhytvaikutteisten beeta‑agonistien (SABA) käyttökertojen lisääntyminen verrattuna lähtötilanteeseen kahtena peräkkäisenä päivänä (minimilisäys: 4 painallusta/vrk).
- Heikkeneminen keuhkojen toiminnassa: PEF-arvon pieneneminen ≥ 20 %:lla lähtötilanteeseen verrattuna vähintään kahtena peräkkäisenä aamuna/iltana tai FEV1-arvon pieneneminen ≥ 20 %:lla lähtötilanteeseen verrattuna.
- Hoitokäynti: käynti ensiavussa/tutkimuspaikalla astman sellaisen hoidon vuoksi, joka ei vaatinut systeemisiä kortikosteroideja.
-
Vaikea astman paheneminen määriteltiin sellaiseksi, jossa ilmeni vähintään toinen näistä kahdesta:
- systeemisten kortikosteroidien tarve ≥ 3 päivän ajan
- ensiapukäynti, joka vaati systeemisiä kortikosteroideja tai sairaalahoitoa ≥ 12 tunnin ajan.
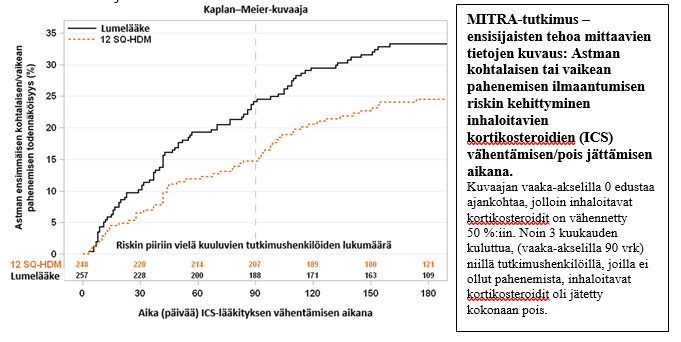
| MITRA-tulokset | 12 SQ-HDM | Lumelääke | Teho 12 SQ-HDM lumelääkkeeseen nähden | p-arvo | |||
| N | n (%) | N | n (%) | Riskisuhde (HR) [95 %:n CL] | Riskin pieneneminena | ||
| Ensisijainen päätetapahtuma | |||||||
| Paheneminen, kohtalainen tai vaikea (FAS-MI)b | 282 | 59 (21 %) | 277 | 83 (30 %) | 0,69 [0,50; 0,96] | 31 % | 0,027 |
| Paheneminen, kohtalainen tai vaikea (FAS)c | 248 | 59 (24 %) | 257 | 83 (32 %) | 0,66 [0,47; 0,93] | 34 % | 0,017 |
| Ensisijaisen päätetapahtuman komponenttien etukäteen määritetyt analyysit | |||||||
| Yöllinen herääminen tai oireiden lisääntyminenc | 248 | 39 (16 %) | 257 | 57 (22 %) | 0,64 [0,42; 0,96] | 36 % | 0,031 |
| Lyhytvaikutteisten β2-agonistien (SABA) lisääntynyt käyttöc | 248 | 18 (7 %) | 257 | 32 (12 %) | 0,52 [0,29; 0,94] | 48 % | 0,029 |
| Heikkeneminen keuhkojen toiminnassac | 248 | 30 (12 %) | 257 | 45 (18 %) | 0,58 [0,36; 0,93] | 42 % | 0,022 |
| Vaikea paheneminenc | 248 | 10 (4 %) | 257 | 18 (7 %) | 0,49 [0,23; 1,08] | 51 % | 0,076 |
| N: niiden hoitoryhmässä olleiden tutkimushenkilöiden määrä, joista oli analyysia varten tietoja saatavissa n (%): hoitoryhmässä olevien, kriteerit täyttävien tutkimushenkilöiden lukumäärä ja prosenttiosuus CL: luottamusrajat (confidence limits) a Arvioitu riskisuhteen (HR, hazard ratio) mukaan a FAS-MI: täydellinen analyysisarja, jossa useita paikkauksia. Ne tutkimushenkilöt, jotka keskeyttivät tutkimuksen ennen tehon arviointijaksoa, katsotaan tässä analyysissa lumelääkettä käyttäneiksi tutkimushenkilöiksi. c FAS: täydellinen analyysisarja (full analysis set). Kaikki saatavissa ollut data käytettiin täydellisesti, t.s. tehon arviointijakson aikana tutkimushenkilöiltä saatavissa ollut data. | |||||||
Lisäksi tehtiin post-hoc-analyysejä, joissa tarkasteltiin astmaoireita ja oireenmukaisen lääkityksen käyttöä hoitojakson 4 viimeisen viikon aikana ennen inhaloitavien kortikosteroidien käytön vähentämistä. Tarkoituksena oli Acarizax-valmisteen vaikutuksen tutkiminen inhaloitavan kortikosteroidin lisälääkkeenä. Analyyseissa tarkasteltiin päivällä ja yöllä esiintyneiden astmaoireiden pistemääriä, yöllisiä heräämisiä ja lyhytvaikutteisten beeta-agonistien käyttöä. Post-hoc‑analyyseissa ilmeni kaikkien parametrien osalta johdonmukaisesti numeerisia eroja 12 SQ-HDM -valmisteen eduksi lumelääkkeeseen verrattuna kaikkien viimeisten 4 viikon aikana, ennen inhaloitavien kortikosteroidien vähentämistä. Erot olivat tilastollisesti merkitseviä vain astman päiväaikaisten oireiden pistemäärän (p = 0,0450) ja ”ei yöllisiä heräämisiä” -todennäköisyyden (p = 0,0409) osalta.
Tukea antavaa näyttöä – allerginen astma
Kaksoissokkoutetussa, satunnaistetussa lumelääkekontrolloidussa faasin II tutkimuksessa satunnaistettiin 604 tutkimushenkilöä, jotka olivat iältään 14‑vuotiaita tai vanhempia ja joilla oli huonepölypunkkien aiheuttama allerginen astma, jota kontrolloitiin inhaloitavilla kortikosteroideilla (100-800 µg budesonidia) ja joilla oli aiemmin todettu huonepölypunkkien aiheuttama allerginen nuha, hoidettavaksi noin yhden vuoden ajan 1 SQ-HDM-, 3 SQ-HDM- tai 6 SQ-HDM-valmisteella tai lumelääkkeellä. 4 viikkoa kestäneessä tutkimuksen loppuvaiheen tehon arviointijaksossa päivittäisen inhaloitavan kortikosteroidiannoksen keskimääräinen muutos lähtötilanteesta oli 207,6 µg budesonidia 6 SQ-HDM-ryhmässä ja 126,3 µg lumelääkeryhmässä, eli absoluuttinen ero on 81 µg budesonidia/päivä (95 %:n luottamusväli [27; 136], p = 0,004. Suhteellinen keskimääräinen inhaloitavien kortikosteroidien väheneminen verrattuna lähtötilanteeseen oli 42 % ja mediaani 50 % 6 SQ-HDM -valmisteella ja vastaavasti 15 % ja 25 % lumelääkkeellä. Eräällä alaryhmällä (N = 108, heikompi astman hoitotasapaino, ICS-hoito ≥ 400 µg budesonidia) suoritetussa post-hoc-analyysissa keskimääräinen muutos inhaloitavien kortikosteroidien päivittäisessä annoksessa lähtötilanteesta oli 384,4 µg budesonidia 6 SQ-HDM -ryhmässä ja 57,8 µg lumelääkeryhmässä, eli absoluuttinen ero 6 SQ-HDM -valmisteen ja lumelääkkeen välillä oli 327 µg budesonidia päivässä (95 %:n CI [182; 471], p < 0,0001, post hoc -analyysi).
Pediatriset potilaat
Kliininen teho lapsilla
Acarizax 12 SQ-HDM -hoidon tehoa huonepölypunkkien aiheuttamassa allergisessa hengitystiesairaudessa lapsilla tutkittiin kahdessa kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa tutkimuksessa. Tutkimusten ensisijaisena tavoitteena oli tutkia tehoa allergiseen nuhaan (MT-12-tutkimus) sekä tehoa allergiseen astmaan (MT-11-tutkimus).
Allerginen nuha
5–11-vuotiaat lapset
MATIC-tutkimus (MT-12)
Acarizax 12 SQ-HDM -hoidon tehoa huonepölypunkkien aiheuttamassa allergisessa nuhassa 5–11‑vuotiailla lapsilla tutkittiin kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa tutkimuksessa (MATIC-tutkimus, MT-12).
- MATIC-tutkimukseen (MT-12) osallistui 1 458 lasta (5–11‑vuotiaita), joilla oli huonepölypunkkien aiheuttama kohtalainen tai vaikea allerginen nuha / rinokonjunktiviitti (nuhan yhdistetyn kokonaispistemäärän [total combined rhinitis score, TCRS] keskiarvo lähtötilanteessa 18,3). Noin 40 %:lla tutkimushenkilöistä oli astma tutkimuksen lähtötilanteessa. Tutkimushenkilöt satunnaistettiin saamaan noin 1 vuoden ajan päivittäistä hoitoa 12 SQ-HDM -valmisteella tai lumelääkkeellä. He saivat vapaasti käyttää tavanomaisia nuha- ja sidekalvotulehduslääkkeitä.
-
Ensisijainen päätetapahtuma oli keskimääräinen päivittäinen nuhan yhdistetty kokonaispistemäärä (TCRS), joka arvioitiin 8 viimeisen hoitoviikon ajalta.
- Päivittäinen TCRS on nuhan päivittäisten oirepisteiden (daily symptom score, DSS) ja nuhan päivittäisten lääkepisteiden (daily medication score, DMS) summa. Nuhaoirepisteet saatiin arvioimalla 4:ää nenään liittyvää oiretta (vuotava nenä, tukkeutunut nenä, aivastelu, kutiseva nenä) päivittäin asteikolla 0–3 (ei oireita, lieviä, kohtalaisia, vaikeita oireita), toisin sanoen pistemäärän vaihteluväli oli 0–12. Nuhalääkepisteet muodostuivat sieraimeen annosteltujen steroidilääkkeiden (maks. 8 pistettä/vrk) ja suun kautta otettavien antihistamiinien käytöstä (maks. 4 pistettä/vrk), eli vaihteluväli oli 0–12. Täten TCRS-pistemäärän vaihteluväli oli 0–24.
- Vuoden kestäneen 12 SQ-HDM -hoidon jälkeen vakioidun keskiarvon absoluuttinen ero oli 0,97 (95 %:n luottamusväli [0,50; 1,44]) ja suhteellinen ero 22 % (p < 0,0001) lumelääkkeeseen verrattuna. Hoidon teho voi vaihdella potilaiden välillä allergisen sairauden statuksen mukaan.
- Kliinisen vaikutuksen alkaminen havaittiin, kun hoito oli jatkunut 8 viikkoa (p = 0,01).
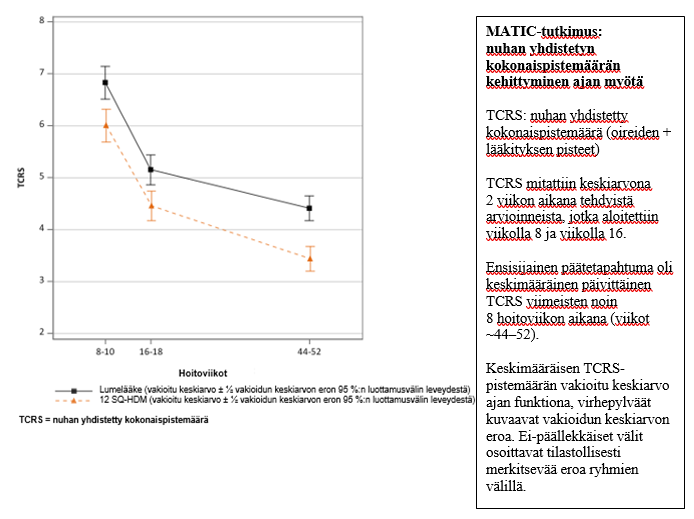
| MATIC-tutkimuksen tulokset | 12 SQ-HDM | Lumelääke | Hoidon vaikutus | ||||
|---|---|---|---|---|---|---|---|
| Ensisijainen päätetapahtuma | N | Pistemäärä | N | Pistemäärä | Absoluutt. erob | Suhteell. eroc | p-arvo |
| Nuhan yhdistetty kokonaispistemäärä | |||||||
| FASa (vakioitu keskiarvo) | 693 | 3,44 | 706 | 4,41 | 0,97 [0,50; 1,44] | 22,0 % | < 0,0001 |
| Herkkyysestimaattori 1e | 727f | 3,45 | 731f | 4,42 | 0,97 [0,49; 1,44] | 21,9 % | < 0,0001 |
| Etukäteen määritetyt tärkeimmät toissijaiset päätetapahtumat | N | Pistemäärä | N | Pistemäärä | Absoluutt. erob | Suhteell. eroc | p-arvo |
| Nuhaoirepisteet | |||||||
| FAS (vakioitu keskiarvo) | 693 | 1,50 | 706 | 1,92 | 0,43 [0,23; 0,62] | 22,2 % | < 0,0001 |
| Nuhalääkepisteet | |||||||
| FAS (vakioitu keskiarvo) | 693 | 1,44 | 706 | 1,94 | 0,49 [0,18; 0,80] | 25,3 % | 0,0016 |
| Rinokonjunktiviitin yhdistetty kokonaispistemäärä | |||||||
| FAS (vakioitu keskiarvo) | 693 | 4,01 | 706 | 5,16 | 1,15 [0,58; 1,71] | 22,2 % | < 0,0001 |
| Etukäteen määritetyt toissijaiset päätetapahtumat | N | Pistemäärä | N | Pistemäärä | Absoluutt. erob | Suhteell. eroc | p-arvo |
| Lasten rinokonjunktiviittia koskevan elämänlaatukyselyn (PRQLQ) pisteet | |||||||
| FAS (vakioitu keskiarvo) | 695 | 0,84 | 690 | 1,01 | 0,17 [0,08; 0,25] | 16,6 % | < 0,0001 |
| Etukäteen määritetyt toissijaiset päätetapahtumat | N | Osuus | N | Osuus | Kerroinsuhde (OR)d [95 %:n CL] | p-arvo | |
| Päivät, jolloin nuha paheni | |||||||
| FAS (arvio) | 693 | 0,025 | 706 | 0,044 | 0,56 [0,42; 0,74] | < 0,0001 | |
| Päivät, jolloin nuha oli lievää | |||||||
| FAS (arvio) | 693 | 0,318 | 706 | 0,209 | 1,77 [1,27; 2,47] | 0,0008 | |
| Etukäteen määritetyt eksploratiiviset päätetapahtumat | N | Osuus | N | Osuus | Kerroinsuhde (OR)d [95 %:n CL] | p-arvo | |
| Päivät ilman nuhaoireita | |||||||
| FAS (arvio) | 693 | 0,200 | 706 | 0,116 | 1,90 [1,37; 2,66] | 0,0002 | |
N: niiden hoitoryhmässä olleiden tutkimushenkilöiden määrä, joista oli analyysia varten dataa saatavissa. CL: luottamusvälit
a FAS: täydellinen analyysisarja (full analysis set). Kaikki saatavissa ollut data käytettiin täydellisesti, t.s. tehon arviointijakson aikana tutkimushenkilöiltä saatavissa ollut data.
b Absoluuttinen ero: lumelääke miinus 12 SQ-HDM, 95 %:n luottamusväli.
c Suhteellinen ero lumelääkkeeseen: lumelääke miinus 12 SQ-HDM jaettuna lumelääkkeellä.
d Kerroinsuhde (odds ratio, OR) nuhan pahenemiselle, päiville, jolloin nuha oli lievää, ja päiville, jolloin nuhaoireita ei ollut: 12 SQ-HDM lumelääkkeeseen nähden. Päivät, jolloin nuha paheni (päivät, jolloin nuhan oirepisteet (DSS) olivat 6 tai 5, ja yhden yksittäisen oireen pisteet 3 (oiretta on vaikea sietää ja oire häiritsee päivittäistä toimintaa ja/tai unta)).
e Tutkimusvalmisteen estimoitava parametri: Niille tutkimushenkilöille, jotka keskeyttivät tutkimuksen hoidon tehon puutteen tai hoitoon liittyvien haittavaikutusten vuoksi, puuttuvat päätetapahtumat imputoitiin lumelääkeryhmästä. Niille tutkimushenkilöille, jotka keskeyttivät tutkimuksen jostakin muusta syystä, puuttuvat päätetapahtuvat imputoitiin tutkimushenkilöiden omasta tutkimusryhmästä.
f Herkkyysestimaattori 1: N sisältää tutkimushenkilöt, joiden havainnot on imputoitu.
Ensisijaisen päätetapahtuman (TCRS) lähtötilanteen astmastatuksen mukainen alaryhmäanalyysi osoitti, että vakioidun keskiarvon absoluuttinen ero oli 1,26 (95 %:n luottamusväli [0,46; 2,06]) lapsilla, joilla oli samanaikainen astma, ja 0,77 (95 %:n luottamusväli [0,19; 1,36]) lapsilla, joilla ei ollut samanaikaista astmaa. TCRS:n yhdistetty analyysi viidestä faasin III tutkimuksesta potilailla, joilla oli huonepölypunkkien aiheuttama allerginen nuha ja jotka saivat 12 SQ-HDM- tai lumelääkehoitoa, osoitti, että vakioidun keskiarvon absoluuttinen ero oli 1,27 (95 %:n luottamusväli [0,82; 1,72]) potilailla, joilla oli samanaikainen astma (N = 1 450), ja 0,81 (95 %:n luottamusväli [0,49; 1,13]) potilailla, joilla ei ollut samanaikaista astmaa (N = 2 595).
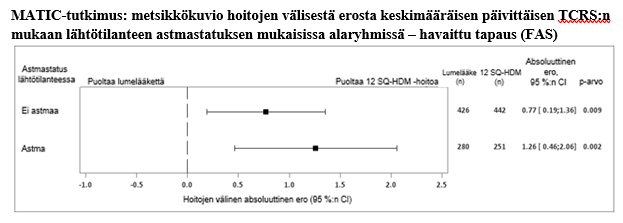
CI = luottamusväli, FAS = täydellinen analyysisarja (full analysis set), n = niiden hoitoryhmässä olleiden tutkimushenkilöiden määrä, joista oli analyysia varten dataa saatavissa, TCRS = nuhan yhdistetty kokonaispistemäärä
Etukäteen määritellyissä astmaan liittyvien päätetapahtumien analyyseissä arvioitiin astman päivittäisiä oirepisteitä, lyhytvaikutteisten beeta-agonistien (SABA) käyttöä, päiviä ilman lyhytvaikutteisten beeta-agonistien käyttöä sekä yöllisiä heräämisiä, jotka vaativat lyhytvaikutteisten beeta-agonistien käyttöä. Tulokset osoittivat johdonmukaisesti numeerisia eroja 12 SQ-HDM -hoidon eduksi lumelääkkeeseen nähden kaikilla neljällä parametrilla mitattuna. Erot olivat tilastollisesti merkitseviä astman päivittäisten oirepisteiden (p = 0,0259) ja lyhytvaikutteisia beeta-agonisteja vaativien yöllisten heräämisten (p = 0,0279) suhteen.
5–17-vuotiaat lapset
MAPIT-tutkimus (MT-11)
Tutkimuksen ensisijaisena tavoitteena oli osoittaa Acarizax 12 SQ-HDM -hoidon teho lumelääkkeeseen verrattuna 5–17-vuotiailla lapsilla ja nuorilla, joilla oli huonepölypunkkien aiheuttama allerginen astma, kliinisesti merkittävien astman pahenemisvaiheiden perusteella vähintään 4 kuukauden hoidon jälkeen. Acarizax 12 SQ-HDM annettiin lisälääkkeenä astman taustahoidolle (pieniannoksinen inhaloitava kortikosteroidi (ICS) ja pitkävaikutteinen beeta-2-agonisti (LABA) tai inhaloitava kortikosteroidi keskisuurella tai suurella annoksella ilman pitkävaikutteista beeta-2-agonistia tai sen kanssa). Lisäksi tutkimusväestöllä oli esitiedoissa huonepölypunkkien aiheuttama allerginen nuha (kaikki vaikeusasteet; nuhan yhdistetty kokonaispistemäärä [TCRS] > 0 lähtötilanteessa; lähtötilanteen TCRS-keskiarvo 9,0). MT-11-tutkimuksen tarkoituksena ei ollut arvioida kliinistä tehoa allergisen nuhan hoidossa. Nuhan päätetapahtumien eli nuhan yhdistetyn kokonaispistemäärän (TCRS), nuhan päivittäisten oirepisteiden (DSS) ja nuhan päivittäisten lääkepisteiden (DMS) tulokset esitetään seuraavassa taulukossa.
| MAPIT-tutkimuksen tulokset | 12 SQ‑HDM | Lumelääke | Hoidon vaikutus | ||||
|---|---|---|---|---|---|---|---|
| Etukäteen määritetyt ylimääräiset toissijaiset päätetapahtumata | N | Pistemäärä | N | Pistemäärä | Absoluutt. erob | Suhteell. eroc | p-arvod |
| Nuhan yhdistetty kokonaispistemäärä | |||||||
| FASe (vakioitu keskiarvo) | 253 | 2,16 | 259 | 2,46 | 0,30 [-0,22; 0,81] | 12,1 % | 0,2597 |
| Nuhaoirepisteet | |||||||
| FAS (vakioitu keskiarvo) | 253 | 0,55 | 259 | 0,67 | 0,12 [-0,04; 0,28] | 18,2 % | 0,1349 |
| Nuhan lääkehoitopisteet | |||||||
| FAS (vakioitu keskiarvo) | 253 | 1,27 | 259 | 1,40 | 0,12 [-0,24; 0,48] | 8,8 % | 0,5071 |
FAS: täydellinen analyysisarja (full analysis set). N: niiden hoitoryhmässä olleiden tutkimushenkilöiden määrä, joista oli analyysia varten dataa saatavissa.
a Nuhan päätetapahtumat
b Absoluuttinen ero: lumelääke miinus 12 SQ-HDM, 95 %:n luottamusväli.
c Suhteellinen ero lumelääkkeeseen: lumelääke miinus 12 SQ-HDM jaettuna lumelääkkeellä.
d p‑arvoja ei korjattu kertautuvuuden suhteen. Tämän vuoksi analyyseja on pidettävä havainnollistavina.
e Kaikki saatavissa ollut data käytettiin täydellisesti, t.s. tehon arviointijakson aikana tutkimushenkilöiltä saatavissa ollut data.
12–17-vuotiaat nuoret
Acarizax 12 SQ-HDM-hoidon tehoa huonepölyn aiheuttamaan allergiseen nuhaan tutkittiin nuorilla kahdessa satunnaistetussa, lumekontrolloidussa kaksoissokkotutkimuksessa (P001 ja TO-203-3-2). Näissä tutkimuksissa osa tutkittavista oli nuoria.
-
Tutkimukseen P001 osallistui 189 nuorta (1 482 satunnaistetun osallistujan kokonaismäärästä), joilla oli kohtalainen tai vaikea huonepölyn aiheuttama allerginen nuha/rinokonjunktiviitti astman kanssa tai ilman astmaa. Osallistujat jaettiin satunnaisesti saamaan noin vuoden ajan päivittäin 12 SQ-HDM-hoitoa tai lumelääkettä, ja he saivat vapaasti käyttää standardoitua lääkehoitoa allergiseen nuhaan.
Ensisijainen päätetapahtuma oli keskimääräinen päivittäinen nuhan yhdistetty kokonaispistemäärä (TCRS), jota arvioitiin 8 viimeisen hoitoviikon aikana.
Vuoden kestäneen 12 SQ-HDM-hoidon jälkeen nuorten ryhmässä todettiin lumelääkkeseen verrattuna absoluuttinen ero mediaanilla 1,0 (95 %:n luottamusväli [0,1; 2,0]) ja 22 % suhteellinen ero (p = 0,024).
-
Tutkimukseen TO-203-3-2 osallistui 278 nuorta (851 satunnaistetun osallistujan kokonaismäärästä), joilla oli kohtalainen tai vaikea, sitkeä huonepölyn aiheuttama allerginen nuha. Osallistujat jaettiin satunnaisesti saamaan noin vuoden ajan päivittäin joko 12 SQ-HDM-hoitoa, 6 SQ-HDM-hoitoa tai lumelääkettä, ja he saivat vapaasti käyttää standardoitua lääkehoitoa allergiseen nuhaan.
Ensisijainen päätetapahtuma oli keskimääräinen päivittäinen TCRS, jota arvioitiin 8 viimeisen hoitoviikon aikana.
Tutkimuksen lopussa, vuoden mittaisen 12 SQ-HDM-hoidon jälkeen nuorten ryhmässä todettiin lumelääkkeeseen verrattuna absoluuttinen ero keskiarvolla 1,0 (95 %:n luottamusväli [0,1; 1,9], p = 0,037) ja 20 % suhteellinen ero.
| Nuorten alaryhmät | 12 SQ-HDM | Lumelääke | Hoitovaikutus | ||||
|---|---|---|---|---|---|---|---|
| Ensisijainen päätetapahtuma: TCRS | N | Pisteet | N | Pisteet | Absoluuttinen ero | Suhteellinen erod | p-arvo |
| P001 | |||||||
| FAS(vakioitu keskiarvo) | 76 | 3,6 | 84 | 4,8 | 1,2 a [0,1;2,3] | 25 % | < 0,05 |
| FAS (mediaani) | 76 | 3,3 | 84 | 4,3 | 1,0 b [0,1;2,0] | 22 % | 0,024 |
| TO-203-3-2 | |||||||
| FAS(vakioitu keskiarvo) | 99 | 4,1 | 92 | 5,1 | 1,0 c [0,1;1,9] | 20 % | 0,037 |
| FAS(mediaani) | 99 | 4,2 | 92 | 5,2 | 1,0 | 19 % | - |
TCRS: total combined rhinitis score, nuhan yhdistetty kokonaispistemäärä a: ANCOVA | |||||||
Allerginen astma
Lapset (5–17-vuotiaat)
MAPIT-tutkimukseen (MT-11) osallistui 533 lasta ja nuorta (5–17-vuotiaita), joilla oli huonepölypunkeista johtuva allerginen astma. Tutkimushenkilöiden astma oli pahentunut hiljattain astman ylläpitohoidosta huolimatta (pieniannoksinen inhaloitava kortikosteroidi (ICS) ja pitkävaikutteinen beeta-2-agonisti (LABA) tai inhaloitava kortikosteroidi keskisuurella tai suurella annoksella ilman pitkävaikutteista beeta-2-agonistia tai sen kanssa). Tutkimushenkilöt satunnaistettiin saamaan päivittäistä 12 SQ-HDM -hoitoa tai lumelääkettä noin 24–30 kuukauden ajan astman ylläpitohoidon lisälääkkeenä. Ensisijainen päätetapahtuma oli kliinisesti merkittävien astman pahenemisten vuosittainen osuus eli pahenemisten määrä vuodessa tutkimushenkilöä kohden tehon arviointijakson aikana.
Vakioitu esiintyvyyssuhde (12 SQ-HDM jaettuna lumelääkkeellä) oli 12 SQ-HDM ‑hoidon eduksi, mutta hoidon tehossa ei ollut tilastollisesti merkitsevää eroa hoitoryhmien välillä (esiintyvyyssuhde = 0,89, 95 %:n luottamusväli [0,60; 1,31], p = 0,54).
MAPIT-tutkimukseen (MT-11) osallistuneilla tutkimushenkilöillä astman pahenemisen osuus oli yleisesti ottaen pieni molemmissa hoitoryhmissä tutkimuksen aikana, ja se pieneni noin 67 %:lla COVID-19-pandemian aikana verrattuna tasoon ennen COVID-19-pandemiaa. Tällä saattoi olla vaikutusta siihen, että tilastollisesti merkitsevän eron havaitseminen ei ollut mahdollista (ks. tietoa valmisteen käytöstä lapsille kohdasta Annostus ja antotapa).
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Acarizax‑valmisteen käytöstä alle 5-vuotiaiden lasten hoidossa huonepölypunkin aiheuttamissa hengitystieallergioissa (allergisen nuhan hoito, astman hoito) (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Iäkkäät potilaat
Acarizax-valmistetta ei ole tarkoitettu yli 65-vuotiaille potilaille (ks. kohta Annostus ja antotapa). Yli 65-vuotiaiden potilaiden osalta on olemassa suppeita turvallisuus- ja siedettävyystietoja.
Pitkäaikainen käyttö
Kansainväliset hoitosuositukset viittaavat allergian siedätyshoidossa kolmen vuoden hoitoaikaan, jotta saavutetaan muutoksia sairaudessa. MITRA-tutkimuksesta on saatavissa tehoa mittaavat tulokset 18 kuukauden Acarizax-hoidosta. Pitkäaikaistehoa ei ole osoitettu.
Farmakokinetiikka
Kliinisiä tutkimuksia Acarizax-valmisteen farmakokineettisestä profiilista tai metaboliasta ei ole tehty. Allergian immuunihoidon vaikutus välittyy immunologisten mekanismien kautta, ja farmakokineettisistä ominaisuuksista on vain vähän tietoa saatavissa.
Allergeeniuutteen aktiiviset molekyylit koostuvat pääasiassa proteiineista. Kielen alle annettavien allergian immuunihoitovalmisteiden tutkimukset ovat osoittaneet, että allergeenin passiivista imeytymistä suun limakalvon läpi ei tapahdu. Näyttö viittaa siihen, että allergeeni siirtyy suun limakalvon läpi dendriittisolujen, varsinkin Langerhansin solujen, toimesta. Sellaisen allergeenin, joka ei imeydy tällä tavalla, odotetaan hydrolysoituvan aminohapoiksi ja pieniksi polypeptideiksi ruuansulatuskanavan ontelossa. Ei ole näyttöä, joka viittaisi siihen, että Acarizax-valmisteessa esiintyvät allergeenit imeytyisivät verenkiertoon merkittävässä määrin sen jälkeen, kun valmiste on asetettu kielen alle.
Prekliiniset tiedot turvallisuudesta
Hiirillä tehtyjen yleisten toksikologisten ja lisääntymistoksisuutta koskevien konventionaalisten tutkimusten tulokset eivät viittaa erityiseen vaaraan ihmisille.
Farmaseuttiset tiedot
Apuaineet
Liivate (kalaperäinen)
Mannitoli
Natriumhydroksidi (pH:n säätämiseen)
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
4 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
ACARIZAX kylmäkuivattu tabletti kielen alle
12 SQ-HDM (L:ei) 30 fol (111,76 €), 90 fol (317,94 €)
PF-selosteen tieto
Alumiini/alumiiniläpipainolevyt ulkopakkauksessa. Yhdessä läpipainolevyssä on 10 kielen alle asetettavaa kylmäkuivattua tablettia.
Pakkauskoot: 10, 30 ja 90
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Valkoinen tai melkein valkoinen, pyöreä kylmäkuivattu tabletti kielen alle. Tabletissa on kaiverrus.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
ACARIZAX kylmäkuivattu tabletti kielen alle
12 SQ-HDM 30 fol
- Peruskorvaus (40 %).
ACARIZAX kylmäkuivattu tabletti kielen alle
12 SQ-HDM 90 fol
- Ei korvausta.
ATC-koodi
V01AA03
Valmisteyhteenvedon muuttamispäivämäärä
16.12.2024
Yhteystiedot
Linnoitustie 4
02600 Espoo
09 5842 2120
www.alk.fi
infofi@alk.net
