GAMUNEX infuusioneste, liuos 100 mg/ml
Vaikuttavat aineet ja niiden määrät
Ihmisen normaali immunoglobuliini (IVIg)
Yksi ml sisältää:
ihmisen normaalia immunoglobuliinia ...................................................100 mg
(puhtaus vähintään 98 % IgG)
Yksi 10 ml:n injektiopullo sisältää: 1 g ihmisen normaalia immunoglobuliinia
Yksi 50 ml:n injektiopullo sisältää: 5 g ihmisen normaalia immunoglobuliinia
Yksi 100 ml:n injektiopullo sisältää: 10 g ihmisen normaalia immunoglobuliinia
Yksi 200 ml:n injektiopullo sisältää: 20 g ihmisen normaalia immunoglobuliinia
Yksi 400 ml:n injektiopullo sisältää: 40 g ihmisen normaalia immunoglobuliinia
IgG-alaluokat jakautuvat seuraavasti (likimääräiset arvot):
IgG1 .................... 62,8 %
IgG2 .................... 29,7 %
IgG3 ...................... 4,8 %
IgG4 .......................2,7 %
Tuhkarokon IgG-vasta-aineen minimitaso on 9 IU/ml.
IgA-sisältö enintään 84 mikrogrammaa/ml.
Tehty ihmisten luovuttamasta plasmasta.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusioneste, liuos
Kliiniset tiedot
Käyttöaiheet
Aikuisten, lasten ja nuorten (0–18 vuotta) korvaushoito:
- Primaariset immuunipuutosoireyhtymät (PID), joihin liittyy vasta-aineiden tuoton häiriö.
- Sekundaariset immuunipuutokset (SID) potilailla, joilla on vaikeita tai toistuvia infektioita ja joilla mikrobilääkehoito ei ole tehonnut ja joilla on joko todennettu spesifin vasta-aineen toimimattomuus (PSAF)* tai seerumin IgG-pitoisuus < 4 g/l.
* PSAF = pneumokokkipolysakkaridi- ja polypeptidiantigeenirokotteet eivät suurenna IgG-vasta-ainetitteriä vähintään kaksinkertaiseksi.
Tuhkarokkoaltistusta edeltävä/altistuksen jälkeinen estohoito taudille alttiille aikuisille, lapsille ja nuorille (0-18-vuotiaille), joille aktiivinen immunisaatio on vasta-aiheista tai sitä ei suositella.
On myös otettava huomioon viralliset suositukset suonensisäisestä ihmisen immunoglobuliinin käytöstä tuhkarokkoaltistusta edeltävässä/altistuksen jälkeisessä estohoidossa ja aktiivisessa immunisaatiossa.
Aikuisten, lasten ja nuorten (0–18 vuotta) immuunivasteen säätely:
- Idiopaattinen trombosytopeeninen purppura (ITP) potilailla, joilla on suuri vuotoriski, tai joiden trombosyyttimäärä on korjattava ennen leikkaustoimenpidettä.
- Guillain-Barrén oireyhtymä.
- Kawasakin tauti (yhdessä asetyylisalisyylihapon kanssa; ks. kohta Annostus ja antotapa).
- Krooninen tulehduksellinen demyelinoiva polyradikuloneuropatia (CIDP).
- Multifokaalinen motorinen neuropatia (MMN).
Aikuisten (≥ 18 vuotta) immuunivasteen muuntaminen:
- Myasthenia gravisin vaikeat akuutit pahenemisvaiheet.
Annostus ja antotapa
Immuunijärjestelmän häiriöiden hoitoon perehtyneen lääkärin tulee aloittaa ja seurata IVIg-hoitoa.
Annostus
Annos sekä infuusioiden välinen aika riippuvat lääkkeen käyttöaiheesta.
Annostus sovitetaan yksilöllisesti kunkin potilaan kliinisen vasteen mukaan. Painoon perustuvan annoksen muuttaminen saattaa olla tarpeen ali- tai ylipainoisille potilaille.
Seuraavassa esitetään ohjeellisia annossuosituksia.
Korvaushoito primaarisessa immuunipuutosoireyhtymässä
Annos tulee sovittaa niin, että pienin IgG-pitoisuus (mitattuna ennen seuraavaa infuusiota) on vähintään 6 g/l tai ikäryhmän mukaisella viitealueella. Tasapainon (vakaan tilan IgG-pitoisuuden) saavuttamiseen kuluu 3–6 kuukautta hoidon alusta. Suositeltu alkuannos on 0,4–0,8 g/kg kerran annettuna. Tämän jälkeen annos on vähintään 0,2 g/kg ja antoväli on 3–4 viikkoa.
Tarvittava annos, jolla pienin IgG-pitoisuus on 6 g/l, on n. 0,2–0,8 g/kg/kuukausi. Vakaan tilan saavuttamisen jälkeen annosten väli on 3–4 viikkoa.
Infektioiden yhteydessä pienimmät IgG-pitoisuudet tulee mitata ja arvioida. Annoksen suurentaminen ja korkeampien minimipitoisuuksien saavuttaminen voi olla tarpeen bakteeri-infektioiden määrän vähentämiseksi.
Korvaushoito sekundaarisissa immuunipuutoksissa (kohdassa Käyttöaiheet määritellyn mukaisesti)
Suositusannos on 0,2–0,4 g/kg 3–4 viikon välein.
Infektioiden yhteydessä pienimmät IgG-pitoisuudet tulee mitata ja arvioida. Annosta pitää tarvittaessa muuttaa siten, että saavutetaan paras mahdollinen suoja infektioita vastaan. Annoksen suurentaminen saattaa olla tarpeen potilaille, joilla on sitkeä infektio. Annoksen pienentämistä voidaan harkita, kun potilaalla ei enää ole infektioita.
Tuhkarokon estohoito ennen altistusta/altistuksen jälkeen
Altistuksen jälkeinen estohoito
Jos taudille altis potilas on altistunut tuhkarokolle, mahdollisimman pian ja 6 päivän kuluessa altistumisesta annetun 0,4 g/kg annoksen pitäisi tuottaa tuhkarokon vasta-aineet seerumissa tasolle > 240 mIU/ml vähintään kahdeksi viikoksi. Seerumin pitoisuudet pitää tarkistaa ja dokumentoida kahden viikon jälkeen. Mahdollisesti kahden viikon jälkeen kerran annettava lisäannos 0,4 g/kg voi olla tarpeen, jotta pitoisuus seerumissa säilyy > 240 mIU/ml.
Jos PID/SID-potilas on altistunut tuhkarokolle ja saa säännöllisesti IVIg-infuusioita, ylimääräisen IVIg-annoksen antamista on harkittava mahdollisimman pian ja 6 päivän kuluessa altistumisesta. Annoksen 0,4 g/kg pitäisi tuottaa tuhkarokon vasta-aineiden pitoisuuden seerumissa tasolle > 240 mIU/ml vähintään kahden viikon ajaksi.
Estohoito ennen altistumista
Jos PID/SID-potilaalla on vaara altistua tulevaisuudessa tuhkarokolle ja hän saa alle 0,53 g/kg IVIg-annoksen 3–4 viikon välein, se pitää kerran suurentaa annokseen 0,53 g/kg. Tämän pitäisi tuottaa tuhkarokon vasta-aineiden pitoisuuden seerumissa tasolle > 240 mIU/ml vähintään 22 päiväksi infuusion jälkeen.
Immunomodulaatio seuraavissa sairauksissa:
Idiopaattinen trombosytopeeninen purppura
Kaksi vaihtoehtoista hoito-ohjetta:
- 0,8–1 g/kg ensimmäisenä päivänä; annos voidaan toistaa kerran kolmen päivän kuluessa
- 0,4 g/kg päivittäin 2–5 päivänä. Hoito voidaan uusia, jos verihiutalepitoisuus pienenee uudelleen.
Guillain-Barrén oireyhtymä
0,4 g/kg/vrk 5 päivän ajan (voidaan toistaa, jos potilaalla ilmenee relapsi).
Kawasakin tauti
2,0 g/kg kerta-annoksena. Potilaiden pitää saada samanaikaisesti asetyylisalisyylihappoa.
Krooninen tulehduksellinen demyelinoiva polyradikuloneuropatia(CIPD)
Aloitusannos: 2 g/kg jaettuna 2–5 peräkkäiselle päivälle.
Ylläpitoannos: 1 g/kg jaettuna 1–2 peräkkäisen päivän aikana 3 viikon välein.
Hoidon teho pitää arvioida jokaisen hoitojakson jälkeen; jos hoidosta ei ole todettu tehoa 6 kuukauden jälkeen, hoito on lopetettava.
Jos hoito tehoaa, pitkäaikaisen hoidon pitää perustua potilaan vastetta ja ylläpitovastetta koskevaan lääkärin arvioon. Annosta ja annosten väliä voi olla tarpeen muuttaa taudin yksilöllisen kulun mukaan.
Multifokaalinen motorinen neuropatia (MMN)
Aloitusannos: 2 g/kg jaettuna 2–5 peräkkäiselle päivälle.
Ylläpitoannos: 1 g/kg 2–4 viikon välein tai 2 g/kg 4–8 viikon välein.
Hoidon teho pitää arvioida jokaisen hoitojakson jälkeen; jos hoidosta ei ole todettu tehoa 6 kuukauden jälkeen, hoito on lopetettava.
Jos hoito tehoaa, pitkäaikaisen hoidon pitää perustua potilaan vastetta ja ylläpitovastetta koskevaan lääkärin arvioon. Annosta ja annosten väliä voi olla tarpeen muuttaa taudin yksilöllisen kulun mukaan.
Myasthenia gravisin vaikeat akuutit pahenemisvaiheet
2 g/kg jaettuna 2 peräkkäiselle päivälle (1 g/kg/vrk).
Gamunex 100 mg/ml ‑valmisteella tehtyihin kliinisiin tutkimuksiin ei osallistunut riittävästi vähintään 65-vuotiaita tutkittavia, jotta täsmällistä hoitovaikutusta olisi voitu määrittää
Annossuositusten yhteenveto on seuraavassa taulukossa:
Käyttöaihe | Annos | Infuusioiden antoväli | ||
Korvaushoito | ||||
Primaariset immuunipuutosoireyhtymät | Aloitusannos: 0,4-0,8 g/kg | |||
Ylläpitoannos: 0,2–0,8 g/kg | 3–4 viikon välein | |||
Sekundaariset immuunipuutokset (kohdassa Käyttöaiheet määritellyn mukaisesti) | 0,2–0,4 g/kg | 3–4 viikon välein | ||
| Tuhkarokon estohoito ennen altistusta/altistuksen jälkeen: | ||||
| Estohoito altistuksen jälkeen herkillä potilailla | 0,4 g/kg | Mahdollisimman pian ja 6 päivän kuluessa, mahdollisesti toistetaan kerran 2 viikon jälkeen, jotta tuhkarokon vasta-aineiden pitoisuus seerumissa säilyy tasolla > 240 mIU/ml | ||
| Altistuksen jälkeinen estohoito PID/SID-potilailla | 0,4 g/kg | Ylläpitohoidon lisäksi, ylimääräisenä annoksena 6 päivän kuluessa altistuksesta | ||
| Altistusta edeltävä estohoito PID/SID-potilailla | 0,53 g/kg | Jos potilaan ylläpitoannos on alle 0,53 g/kg 3-4 viikon välein, kyseinen annos pitää kerran suurentaa vähintään annokseen 0,53 g/kg | ||
Immuunivasteen säätely: | ||||
Idiopaattinen trombosytopeeninen purppura | 0,8–1 g/kg tai | päivänä 1, voidaan tarvittaessa toistaa kerran 3 päivän kuluessa | ||
0,4 g/kg/vrk | 2–5 päivän ajan | |||
Guillain-Barrén oireyhtymä | 0,4 g/kg/vrk | 5 päivän ajan | ||
Kawasakin tauti | 2 g/kg | yhtenä annoksena yhdessä asetyylisalisyylihapon kanssa | ||
| Krooninen tulehduksellinen demyelinoiva polyradikuloneuropatia (CIDP) | Aloitusannos: 2 g/kg | jaettuina annoksina 2–5 päivän aikana | ||
Ylläpitoannos: 1 g/kg | 3 viikon välein jaettuina annoksina 1–2 päivän aikana | |||
Multifokaalinen motorinen neuropatia (MMN) | Aloitusannos: 2 g/kg | jaettuina annoksina 2–5 peräkkäisen päivän aikana | ||
Ylläpitoannos: 1 g/kg tai | 2–4 viikon välein tai | |||
2 g/kg | 4–8 viikon välein jaettuina annoksina 2–5 päivän aikana | |||
| Myasthenia gravisin vaikeat akuutit pahenemisvaiheet | 2 g/kg | 2 peräkkäisen päivän aikana (1 g/kg/vrk) | ||
Pediatriset potilaat
Lasten ja nuorten (0–18 vuotta) annostus ei eroa aikuisten annostusohjeista, koska annoksen tulee määräytyä kussakin käyttöaiheessa painon ja kliinisen vasteen mukaan.
Maksan vajaatoiminta
Ei ole olemassa näyttöä annoksen muuttamisen tarpeesta.
Munuaisten vajaatoiminta
Annosta ei pidä muuttaa, ellei se ole kliinisesti aiheellista. Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Iäkkäät potilaat
Annosta ei pidä muuttaa, ellei se ole kliinisesti aiheellista. Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Antotapa
Laskimoon.
Ihmisen normaalin immunoglobuliinin infuusionopeus on aluksi 0,6–1,2 ml/kg/h puolen tunnin ajan. Ks. kohta Varoitukset ja käyttöön liittyvät varotoimet. Jos haittavaikutuksia ilmaantuu, infuusionopeutta on hidastettava tai infuusio on keskeytettävä. Jos potilas sietää infuusion hyvin, infuusionopeutta voi asteittain suurentaa korkeintaan nopeuteen 4,8–8,4 ml/kg/h.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle (ihmisen immunoglobuliineille) tai apuaineille (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Apuaineet).
IgA:n vasta-aineiden kehittyminen potilaalle, jolla on selektiivinen IgA-puutos, sillä IgA:ta sisältävän valmisteen anto saattaa johtaa anafylaksiaan.
Varoitukset ja käyttöön liittyvät varotoimet
Kaikkia potilaita on seurattava tarkoin, kun käytetään suuria infuusionopeuksia (8,4 ml/kg/h). Lapsille tai potilaille, joilla on munuaisten vajaatoiminnan riski, korkein sallittu infuusionopeus on 4,8 ml/kg/h.
Gamunex 100 mg/ml ‑valmistetta ei saa sekoittaa muihin infuusioliuoksiin (esim. keittosuolaliuokseen) eikä muihin lääkkeisiin. Jos valmistetta on laimennettava ennen infuusiota, voidaan laimentamiseen käyttää 50 mg/ml glukoosiliuosta. Kuitenkin, jos potilaalla on piilevä diabetes (missä voi esiintyä ohimenevästi sokeria virtsassa) tai jos potilaan ruokavaliossa on glukoosirajoitus, 50 mg/ml glukoosiliuoksen vaikutusta on seurattava tarkoin. Katso myös akuuttia munuaisten vajaatoimintaa koskeva varoitus jäljempänä.
Gamunex 100 mg/ml ‑valmistetta ja hepariinia ei saa antaa saman infuusiojärjestelmän kautta.
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Käyttöön liittyvät varotoimet
Mahdollisia komplikaatioita voidaan usein välttää seuraavasti:
-
on varmistettava, että potilas ei ole yliherkkä ihmisen normaalille immunoglobuliinille. Tämä tapahtuu antamalla valmistetta alkuun hitaasti (0,6-1,2 ml/kg/h). Potilaille, joilla on suurempi yliherkkyysreaktion mahdollisuus (esimerkiksi vaihtaminen toisesta IVIg:sta tai aikaisempi allerginen reaktio), voi harkita infuusion aloitusta nopeudella 0,1 ml/kg/h.
-
on varmistettava, että potilasta seurataan tarkoin koko infuusion ajan mahdollisten oireiden varalta. On erityisesti tarkkailtava potilaita, jotka saavat ihmisen immunoglobuliinia ensimmäistä kertaa tai jos kyseessä on eri immunoglobuliinivalmiste kuin aiemmalla infuusiokerralla tai jos potilas ei ole saanut immunoglobuliinia pitkään aikaan. Näissä tapauksissa potilaan tilaa on seurattava koko ensimmäisen infuusion ajan ja vielä tunti sen päätyttyä valvotussa terveydenhuollon yksikössä mahdollisten haittavaikutusten varalta ja sen varmistamiseksi, että ensihoito voidaan aloittaa välittömästi, jos ongelmia esiintyy. Kaikkia muita potilaita pitää seurata vähintään 20 minuutin ajan infuusion päättymisen jälkeen.
Laskimoon annettavien immunoglobuliinihoitojen yhteydessä kaikilla potilailla
- on turvattava ennen immunoglobuliinihoitoa riittävä nesteytys
- on seurattava virtsaneritystä
- on seurattava seerumin kreatiniinipitoisuutta
- on vältettävä samanaikaista loop-diureettien käyttöä (ks. kohta Yhteisvaikutukset).
Jos haittavaikutuksia ilmaantuu, infuusionopeutta on hidastettava tai infuusio on keskeytettävä. Tarvittava hoito riippuu haittavaikutusten luonteesta ja oireiden vaikeusasteesta.
Infuusioon liittyvä reaktio
Tietyt haittavaikutukset (esim. päänsärky, kasvojen punoitus, vilunväristykset, lihaskipu, hengityksen vinkuna, takykardia, alaselkäkipu, pahoinvointi ja hypotensio) voivat liittyä infuusionopeuteen. Kohdassa Annostus ja antotapa mainittuja suositeltuja infuusionopeuksia tulee noudattaa tarkoin. Potilaita tulee seurata tarkoin ja tarkkailla huolellisesti oireiden havaitsemiseksi koko infuusion ajan.
Haittavaikutuksia voi ilmaantua tavallista useammin
- jos potilas saa ihmisen normaalia immunoglobuliinia ensimmäistä kertaa tai harvinaisissa tapauksissa vaihdettaessa immunoglobuliinivalmiste toiseen tai jos hoitojen välillä on ollut pitkä aika
- jos potilaalla on aktiivinen infektio tai perussairautena krooninen tulehdus.
Yliherkkyys
Yliherkkyysreaktiot ovat harvinaisia.
Anafylaksia voi kehittyä potilaille
- joilla IgA:ta ei ole havaittavissa ja joilla on IgA:n vasta-aineita
- jotka ovat aiemmin sietäneet hoidon ihmisen normaalilla immunoglobuliinilla.
Sokin yhteydessä potilaalle on annettava tavanomaista sokin hoitoa.
Tromboembolia
On kliinistä näyttöä siitä, että IVIg:n annon ja tromboembolisten tapahtumien välillä on yhteys. Näitä tapahtumia ovat sydäninfarkti, aivoverisuonitapahtumat (myös aivohalvaus), keuhkoembolia ja syvät laskimotukokset, joiden oletetaan liittyvän lisääntyneen immunoglobuliinin aiheuttamaan veren viskositeetin suhteelliseen lisääntymiseen riskipotilailla. Varovaisuutta tulee noudattaa määrättäessä ja infusoitaessa IVIg:a ylipainoisille potilaille ja potilaille, joilla on jo ennestään tukosriskiä lisääviä tekijöitä (kuten korkea ikä, verenpainetauti, diabetes mellitus, aikaisempia verisuonisairauksia tai aikaisempia tukoksia, hankittuja tai perinnöllisiä hyytymishäiriöitä, pitkittynyt vuodelepo, vaikea hypovolemia tai veren viskositeettia lisääviä sairauksia).
Potilaille, joilla on tromboembolisten haittojen vaara, IVIg-valmisteita tulee antaa pienimmällä mahdollisella infuusionopeudella ja soveltuvalla annoksella.
Akuutti munuaisten vajaatoiminta
Akuutteja munuaisten vajaatoimintatapauksia on kuvattu IVIg-hoitoa saaneilla potilailla. Useimmissa tapauksissa on havaittu vaaratekijöitä, kuten jo olemassa oleva munuaisten vajaatoiminta, diabetes mellitus, hypovolemia, ylipaino, muut samanaikaiset munuaistoksiset lääkkeet tai yli 65 vuoden ikä.
Munuaisarvot on tutkittava ennen IVIg-infuusiota, etenkin potilailta, joilla katsotaan olevan mahdollisesti suurentunut akuutin munuaisten vajaatoiminnan kehittymisen riski, sekä asianmukaisin väliajoin infuusion jälkeen. Potilaille, joilla on akuutin munuaisten vajaatoiminnan riski, IVIg-valmisteet pitää antaa pienimmällä mahdollisella infuusionopeudella ja soveltuvalla annoksella. Jos potilaalle ilmaantuu munuaisten vajaatoimintaa, on harkittava laskimoon annettavan immunoglobuliinihoidon keskeyttämistä.
Vaikka potilailla on todettu munuaisten toimintahäiriöitä ja akuuttia munuaisten vajaatoimintaa useiden myyntiluvallisten erilaisia apuaineita, kuten sakkaroosia, glukoosia ja maltoosia, sisältävien IVIg-valmisteiden käytön yhteydessä, näitä ongelmia on esiintynyt sakkaroosia stabilointiaineena sisältävien valmisteiden käytön yhteydessä suhteessa enemmän. Jos potilaalla on suurentunut munuaisten vajaatoiminnan riski, käyttöön on syytä harkita IVIg-valmisteita, jotka eivät sisällä edellä mainittuja aineita. Gamunex 100 mg/ml ei sisällä sakkaroosia, maltoosia tai glukoosia.
Aseptinen meningiitti -oireyhtymä (AMS)
Aseptinen meningiitti -oireyhtymää on raportoitu IVIg-hoidon yhteydessä. Oireyhtymä alkaa tavallisesti muutamien tuntien – kahden päivän kuluessa IVIg-hoidosta. Likvorissa on usein nähtävissä runsaasti soluja, jopa useita tuhansia soluja/mm3, etenkin granulosyyttejä, ja kohonneita proteiinipitoisuuksia jopa useita satoja milligrammoja/dl. AMS saattaa esiintyä useammin suuriannoksisen (2 g/kg) IVIg-hoidon yhteydessä.
Potilaille, joilla on tällaisia oireita ja löydöksiä, on tehtävä perusteellinen neurologinen tutkimus, mukaan lukien likvoritutkimukset, jotta suljetaan pois muut meningiitin syyt.
IVIg-hoidon lopettaminen on saanut AMS:n remissioon muutamassa päivässä ilman jälkiseurauksia.
Hemolyyttinen anemia
IVIg-valmisteet voivat sisältää veriryhmien vasta-aineita, jotka voivat toimia hemolysiineinä ja aiheuttaa in vivo immunoglobuliinien tarttumisen veren punasolujen pintaan, mikä aiheuttaa positiivisen suoran antiglobuliinireaktion (Coombsin testi) ja harvoin hemolyysin. Hemolyyttinen anemia voi kehittyä IVIg-hoidon seurauksena lisääntyneestä punasolujen sekvestraatiosta johtuen. IVIg-hoitoa saavia tulee tarkkailla hemolyysin kliinisten löydösten ja oireiden havaitsemiseksi (ks. kohta Haittavaikutukset).
Hemolyysin kehittymiseen liittyy seuraavia riskitekijöitä: suuret annokset riippumatta siitä, annetaanko ne kerta-annoksena vai usealle päivälle jaettuna, muu kuin O-veriryhmä, tulehduksellinen tila perussairautena. Jos potilas, jonka veriryhmä on muu kuin O, saa valmistetta suurina annoksina muuhun käyttöaiheeseen kuin primaariseen immuunipuutosoireyhtymään, potilaan tiheämpää tarkkailua suositellaan. Hemolyysiä on raportoitu harvoin valmistetta primaariseen immuunipuutosoireyhtymään korvaushoitona saaneilla potilailla.
Hemolyysiin liittyvä munuaisten toimintahäiriö/munuaisten vajaatoiminta on yksittäisissä tapauksissa johtanut potilaan kuolemaan.
Neutropenia/leukopenia
Neutrofiilimäärän ohimenevää laskua ja/tai neutropeniaepisodeja, jotka ovat joskus olleet vaikeita, on raportoitu IVIg-hoidon jälkeen. Ne ilmaantuvat tyypillisesti tuntien tai päivien kuluessa IVIg-valmisteen annosta ja häviävät itsestään 7–14 vuorokauden kuluessa.
Keuhkojen äkillinen verensiirtovaurio (TRALI-reaktio)
IVIg-hoitoa saavilla potilailla on joissakin tapauksissa raportoitu akuuttia ei-sydänperäistä keuhkoedeemaa (keuhkojen äkillinen verensiirtovaurio [TRALI-reaktio]). TRALI-reaktiolle on tyypillistä vaikea hypoksia, hengenahdistus, takypnea, syanoosi, kuume ja hypotensio. TRALI-reaktion oireet kehittyvät tyypillisesti verensiirron aikana tai 6 tunnin kuluessa siitä, usein 1–2 tunnin kuluessa. Siksi IVIg-hoitoa saavia potilaita on seurattava keuhkoihin kohdistuvien haittavaikutusten varalta, ja IVIg-infuusio keskeytettävä heti, jos tällaisia haittavaikutuksia havaitaan. TRALI-reaktio on mahdollisesti hengenvaarallinen tila, joka edellyttää välitöntä tehohoitoa.
Serologisten testien häiriintyminen
Immunoglobuliinin annon aiheuttama erilaisten passiivisesti siirtyneiden vasta-aineiden tilapäinen lisääntyminen potilaan veressä voi aiheuttaa vääriä positiivisia tuloksia serologisissa testeissä. Punasoluantigeenien, esim. A, B, D, passiivinen siirtyminen voi häiritä serologisia punasoluvasta-ainetestejä, esimerkiksi suoraa antiglobuliinitestiä (DAT, suora Coombsin testi).
Tarttuvat taudinaiheuttajat
Kun valmistetaan lääkkeitä ihmisen verestä tai plasmasta, tietyt turvatoimenpiteet ovat välttämättömiä. Näitä toimenpiteitä ovat veren ja plasman luovuttajien valinta, kunkin luovutetun veri- tai plasmayksikön testaaminen ja lisäksi varmistus yksiköitä yhdistettäessä, ettei ole merkkejä viruksista taikka infektioista. Varotoimenpiteitä virusten poistamiseksi tai inaktivoimiseksi noudatetaan myös veren tai plasman käsittelyprosessin aikana. Valmistettaessa lääkkeitä ihmisen verestä tai plasmasta ei näistä turvatoimista huolimatta voida aivan kokonaan poistaa siirtyvän infektion mahdollisuutta. Tämä koskee myös nykyisellään tuntemattomia ja kehittymässä olevia viruksia sekä muita patogeenejä.
Mainitut turvatoimet ovat yleisen näkemyksen mukaan riittävän tehokkaita poistamaan vaipallisia viruksia, kuten ihmisen immuunikatovirus (HIV), hepatiitti B -virus (HBV) ja hepatiitti C -virus (HCV). Turvatoimet saattavat kuitenkin olla riittämättömät vaipattomia viruksia, kuten hepatiitti A -virusta ja parvovirus B19:ää, vastaan.
Kliininen kokemus on kuitenkin siinä mielessä rohkaisevaa, että immunoglobuliinihoitoihin ei ole liittynyt hepatiitti A:n eikä parvovirus B19:n siirtymistä potilaisiin, mikä saattaa johtua siitä, että itse valmisteessa on vasta-aineita näitä infektioita vastaan ja tämä voi osaltaan lisätä valmisteen virusturvallisuutta.
Aina, kun Gamunex 100 mg/ml ‑valmistetta annetaan potilaalle, lääkkeen nimi ja eränumero on merkittävä potilasasiakirjoihin. Tällä tavoin voidaan yhdistää potilas hänen saamansa lääkkeen lääke-erään.
Pediatriset potilaat
Vaikka tietoja on vähän, samojen varoitusten, varotoimien ja riskitekijöiden oletetaan koskevan pediatrisia potilaita. Valmisteen markkinoille tulon jälkeen on havaittu, että suuria IVIg-annoksia edellyttäviin käyttöaiheisiin lapsille, etenkin Kawasakin taudin hoitoon, on liittynyt hemolyyttisiä reaktioita koskevien raporttien lisääntymistä verrattuna IVIg-valmisteen muihin lapsia koskeviin käyttöaiheisiin.
Jos hemolyysiä epäillään, lääkärin on harkittava vakavasti hemoglobiiniarvojen seuraamista 24−48 tuntia IVIg-valmisteen annon jälkeen. Jos uusintahoito on tarpeen, hemoglobiiniarvoja kehotetaan vakavasti seuraamaan viikon ajan uuden IVIg-annoksen annon jälkeen, jos hemolyysiä epäillään. Perhettä on kehotettava palaamaan lapsen kanssa takaisin hoitopaikkaan, jos hemolyysin oireita ilmaantuu. Oireita ovat mm. kalpeus, letargia, tumma virtsa, hengenahdistus tai sydämentykytys.
Natriumpitoisuus
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per kerta-annos (enintään 2 g/kg) eli sen voidaan sanoa olevan olennaisesti ”natriumiton”.
Yhteisvaikutukset
Elävät heikennetyt rokotteet
Immunoglobuliinien anto saattaa heikentää eläviä heikennettyjä viruksia, kuten tuhkarokko-, vihurirokko-, sikotauti- ja vesirokkoviruksia, sisältävien rokotteiden tehoa. Tehon heikentyminen kestää kuudesta viikosta kolmeen kuukauteen. Siksi eläviä heikennettyjä viruksia sisältäviä rokotteita ei tule käyttää kolmeen kuukauteen tämän lääkevalmisteen annon jälkeen. Tuhkarokkorokotteen teho saattaa olla heikentynyt jopa 1 vuoden ajan. Siksi tuhkarokkorokotuksen saaneiden potilaiden vasta-ainepitoisuus on syytä tarkistaa.
Loop-diureetit
Loop-diureettien samanaikaista käyttöä on vältettävä.
Pediatriset potilaat
Vaikka pediatrisilla potilailla ei ole tehty erityisiä yhteisvaikutustutkimuksia, aikuisten ja lasten välillä ei oletettavasti ole eroja.
Raskaus ja imetys
Raskaus
Tämän lääkevalmisteen turvallisuutta raskauden aikana ei ole osoitettu kontrolloiduissa kliinisissä tutkimuksissa ja siksi sitä tulee antaa varoen raskaana oleville naisille. IVIg-valmisteiden on osoitettu läpäisevän istukan, etenkin kolmannella raskauskolmanneksella. Kliiniset kokemukset immunoglobuliinien käytöstä viittaavat siihen, ettei haitallisia vaikutuksia raskauden kulkuun tai sikiöön ja vastasyntyneeseen oletettavasti esiinny.
Imetys
Tämän lääkevalmisteen turvallisuutta käytettynä imettäville naisille ei ole osoitettu kontrolloiduissa kliinisissä tutkimuksissa ja siksi sitä tulee antaa varoen imettäville naisille.
Immunoglobuliinit erittyvät ihmisen rintamaitoon. Haitallisia vaikutuksia vastasyntyneisiin tai imeväisiin ei oleteta ilmenevän.
Hedelmällisyys
Kliiniset kokemukset immunoglobuliinien käytöstä viittaavat siihen, ettei haitallisia vaikutuksia hedelmällisyyteen oletettavasti esiinny.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Gamunex 100 mg/ml -valmisteella ei ole haitallista vaikutusta tai on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilaiden, joilla esiintyy haittavaikutuksia hoidon aikana, tulee kuitenkin odottaa niiden häviämistä ennen ajamista tai koneiden käyttöä.
Haittavaikutukset
Yhteenveto turvallisuudesta
Ihmisen normaalien immunoglobuliinien aiheuttamia haittavaikutuksia (yleisyyden mukaan alenevassa järjestyksessä) ovat (ks. myös kohta Varoitukset ja käyttöön liittyvät varotoimet)
- vilunväristykset, päänsärky, huimaus, kuume, oksentelu, allergiset reaktiot, pahoinvointi, nivelkipu, matala verenpaine ja kohtalainen alaselkäkipu
- korjautuvat hemolyyttiset reaktiot, etenkin potilailla, joiden veriryhmä on A, B tai AB, ja (harvinaisissa tapauksissa) verensiirtoa vaativa hemolyyttinen anemia
- (harvinaisissa tapauksissa) äkillinen verenpaineen lasku ja (yksittäisissä tapauksissa) anafylaktinen sokki, vaikka potilaalla ei olisi aikaisempina antokertoina havaittu yliherkkyyttä
- (harvinaisissa tapauksissa) ohimenevät ihoreaktiot (mukaan lukien ihon punahukka [lupus erythematosus], jonka yleisyys on tuntematon)
- (hyvin harvinaisissa tapauksissa) tromboemboliset reaktiot, kuten sydäninfarkti, aivohalvaus, keuhkoembolia ja syvät laskimotromboosit
- korjautuva aseptinen meningiitti
- kohonnut seerumin kreatiniinipitoisuus ja/tai akuutti munuaisten vajaatoiminta
- keuhkojen äkillinen verensiirtovaurio (TRALI-reaktio).
Haittavaikutustaulukko
Haittavaikutukset on luokiteltu MedDRA-elinjärjestelmän mukaisesti. Esiintymistiheys on arvioitu seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Turvallisuustietokanta käsittää tiedot kliinisistä tutkimuksista, joissa yhteensä 703 potilasta altistui Gamunex 100 mg/ml -valmisteelle (yhteensä 4 378 infuusiota)
MedDRA-elinjärjestelmäluokka | Haittavaikutus | Yleisyys /potilas | Yleisyys /infuusio |
Infektiot | Nielutulehdus | Melko harvinainen | Melko harvinainen |
Sinuiitti, virtsaputkitulehdus, viruksen aiheuttama ylähengitystieinfektio | Melko harvinainen | Harvinainen | |
Veri ja imukudos | Hemolyyttinen anemia, lymfosytoosi | Melko harvinainen | Harvinainen |
Immuunijärjestelmä | Yliherkkyys | Melko harvinainen | Harvinainen |
Psyykkiset häiriöt | Ahdistuneisuus | Melko harvinainen | Harvinainen |
Hermosto | Päänsärky | Hyvin yleinen | Yleinen |
Huimaus | Melko harvinainen | Melko harvinainen | |
Afonia | Melko harvinainen | Harvinainen | |
Silmät | Silmien valonarkuus | Melko harvinainen | Harvinainen |
Verisuonisto | Hypertensio | Yleinen | Melko harvinainen |
Hypertensiivinen kriisi, hypotensio, kasvojen punoitus, hyperemia | Melko harvinainen | Harvinainen | |
Hengityselimet, rintakehä ja välikarsina | Hengityksen vinkuna, yskä, nenän tukkoisuus | Melko harvinainen | Melko harvinainen |
Hengenahdistus | Melko harvinainen | Harvinainen | |
Ruoansulatuselimistö | Pahoinvointi, oksentelu | Yleinen | Melko harvinainen |
Vatsakipu, ripuli, ruoansulatusvaivat | Melko harvinainen | Harvinainen | |
Iho ja ihonalainen kudos | Ihottuma, kutina, urtikaria | Yleinen | Melko harvinainen |
Ihon kuoriutuminen, dermatiitti, kosketusihottuma, kämmenten punoitus | Melko harvinainen | Harvinainen | |
Luusto, lihakset ja sidekudos | Nivelkipu, selkäkipu | Yleinen | Melko harvinainen |
Lihaskipu | Melko harvinainen | Melko harvinainen | |
Tuki- ja liikuntaelinten kipu, tuki- ja liikuntaelinten jäykkyys, niskakipu | Melko harvinainen | Harvinainen | |
Munuaiset ja virtsatiet | Hemoglobinuria | Melko harvinainen | Harvinainen |
Yleisoireet ja antopaikassa todettavat haitat | Kuume | Yleinen | Yleinen |
Influenssan kaltainen sairaus, vilunväristykset, väsymys | Yleinen | Melko harvinainen | |
Voimattomuus | Melko harvinainen | Melko harvinainen | |
Rintakipu, pistoskohdan reaktio, huonovointisuus | Melko harvinainen | Harvinainen | |
Tutkimukset | Kohonnut verenpaine, pienentynyt veren valkosolumäärä, pienentynyt hemoglobiinipitoisuus, vapaan hemoglobiinin esiintyminen, suurentunut laskoarvo | Melko harvinainen | Harvinainen |
Vammat, myrkytykset ja hoitokomplikaatiot | Ruhjevamma | Melko harvinainen | Harvinainen |
Pediatriset potilaat
Haittavaikutusten yleisyys, laatu ja vaikeus ovat oletettavasti samat kuin aikuisilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yliannostus voi aiheuttaa hypervolemiaa ja hyperviskositeettioireyhtymän, erityisesti riskiryhmän potilaille, mukaan lukien lapset ja iäkkäät potilaat, sekä potilaille, joiden sydämen ja munuaisten toiminta on heikentynyt (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Immunoseerumit ja immunoglobuliinit, Ihmisen normaali immunoglobuliini intravaskulaariseen käyttöön, ATC-koodi: J06BA02.
Ihmisen normaali immunoglobuliini sisältää pääasiassa immunoglobuliini G:tä (IgG), joka sisältää laajan kirjon vasta-aineita infektioiden aiheuttajia vastaan.
Ihmisen normaali immunoglobuliini sisältää IgG-vasta-aineita, joita on normaaliväestössä. Sen valmistukseen käytetään yleensä yhdistettyä plasmaa vähintään tuhannelta luovuttajalta. Valmisteen immunoglobuliini-G-alaluokkajakauma vastaa ihmisplasman alaluokkajakaumaa. Tällä valmisteella voidaan sopivaa annostusta käyttäen palauttaa potilaan poikkeavan pieni IgG-pitoisuus viitealueelle. Valmisteen vaikutusmekanismia muiden käyttöaiheiden osalta kuin korvaushoidon osalta ei vielä ole tutkittu perusteellisesti.
Gamunex 100 mg/ml -valmisteen pH on säädetty heikosti happamaksi. Koska Gamunex 100 mg/ml ‑valmisteessa ei ole mainittavasti puskurointikapasiteettia, valmiste neutraloituu infuusion aikana nopeasti veressä. Suurinakaan annoksina Gamunex 100 mg/ml -valmisteen ei ole todettu aiheuttaneen pH-muutoksia vereen. Valmisteen osmolaliteetti on 258 mOsmol/kg, mikä vastaa suunnilleen ihmisen normaalia veren osmolaliteettia (285–295 mOsmol/kg).
Kliiniset tutkimukset, joissa kroonista tulehduksellista demyelinoivaa polyradikuloneuropatiaa (CIDP) on hoidettu Gamunex 100 mg/ml -valmisteella:
Valmisteen tehoa koskenut IVIg-C CIDP ‑tutkimus (ICE-tutkimus), kaksoissokkoutettu, satunnaistettu, lumekontrolloitu tutkimus selvitti Gamunex 100 mg/ml -valmisteen tehoa ja turvallisuutta CIDP:n hoidossa. Kaikkiaan 117 CIDP-potilasta satunnaistettiin saamaan joko Gamunex 100 mg/ml -valmistetta tai lumetta kolmen viikon välein. Kyllästysannos oli 2 g/kg; ylläpitoannos oli 1 g/kg.
Vaste (paraneminen toimintakykyä mittaavalla INCAT-asteikolla ja ≥ 1 yksikön paranemisen säilyminen 24 viikon tehoa koskeneen jakson ajan) saavutettiin merkitsevästi useammin Gamunex 100 mg/ml -ryhmässä (54 %) kuin lumeryhmässä (21 %, p = 0,0002). Lihasvoima, mitattuna MRC-asteikolla ja puristusvoimalla, samoin kuin ISS-asteikolla mitattu tuntokyky, paranivat merkitsevästi enemmän Gamunex 100 mg/ml -ryhmässä kuin lumeryhmässä.
Koska ≥ 65-vuotiaita oli tutkimuksessa vain vähän, hoitovaikutusta INCAT-asteikolla mitattuna ei voitu määrittää tarkasti, mutta puristusvoima parani tilastollisesti merkitsevästi enemmän Gamunex 100 mg/ml ‑ryhmässä.
Hoitovasteen saaneista alle puolet sai vasteen jo kyllästysannoksen jälkeen (viikkoon 3 mennessä), mutta useimmilla vaste havaittiin toisen annoksen jälkeen (viikkoon 6 mennessä). Ne, jotka eivät saaneet hoitovastetta, siirrettiin vaihtoehtoiseen, jälleen korkeintaan 24 viikkoa jatkuvaan hoitoon.
Kaikki hoitovasteen saaneet satunnaistettiin uudelleen tutkimuksen jatko-osaan seuraavat 6 kuukautta jatkuvaan ylläpitohoitoon joko Gamunex 100 mg/ml -valmisteella tai lumeella. Aiemmin Gamunex 100 mg/ml ‑valmisteella hoitovasteen saaneiden joukossa relapsien määrä oli merkittävästi suurempi lumeryhmään (42 %) satunnaistetuilla kuin Gamunex 100 mg/ml ‑hoitoa saavilla (13 %, p = 0,012).
ICE-tutkimus osoitti Gamunex 100 mg/ml -valmisteen tehon CIDP:n hoitoon sekä lyhyt- että pitkäaikaisessa käytössä. Tulokset on koottu seuraavaan taulukkoon.
Ensisijaiset päätetapahtumat ja muut ICE-tutkimuksen tulokset
Gamunex 100 mg/ml | Lume | p | |
Hoitovasteen saaneiden määrä tehoa koskeneen jakson aikana (ensisijainen päätetapahtuma) | 54 % | 21 % | 0,0002 |
Relapsin todennäköisyys jatkotutkimuksen aikana | 13 % | 45 % | 0,013 |
Puristusvoima (kPA)1 (muutos lähtötasosta) | |||
Dominoiva käsi | 13,2 | 1,5 | 0,0008 |
Ei-dominoiva käsi | 13,3 | 4,3 | 0,005 |
Lihasvoima (MRC3 summa)1 (muutos lähtötasosta) | 3,3 | 0,2 | 0,001 |
Tuntoherkkyys (ISS4-asteikko)2 (muutos lähtötasosta) | -1,2 | 0,2 | 0,021 |
1 Positiivinen luku osoittaa paranemista
2 Negatiivinen luku osoittaa paranemista
3 MRC: Medical Research Council
4 ISS: INCAT-tuntoaistiasteikon summa
Kliiniset tutkimukset, joissa myasthenia gravisin pahenemisvaiheita on hoidettu Gamunex 100 mg/ml -valmisteella:
Zinman et al. (2007) tekivät satunnaistetun, kaksoissokkoutetun, lumekontrolloidun tutkimuksen, johon osallistui 51 potilasta ja jossa arvioitiin Gamunex 100 mg/ml -valmisteen kahdelle peräkkäiselle päivälle jaettua 2 g/kg:n annosta myasthenia gravisin pahenemisvaiheiden hoidossa. Ensisijainen tehon päätetapahtuma oli QMG (Quantitative Myasthenia Gravis) -pisteiden muutos lähtötasolta päivään 14. QMG-pisteiden keskimääräinen muutos päivänä 14 oli -2,54 (p = 0,047). Kliinisesti merkityksellinen vaikutus myasthenia gravisin pahenemisvaiheisiin todettiin vain eksploratiivisessa osajoukossa, johon kuuluvilla potilailla oli lähtötilanteessa keskivaikea tai vaikea myasthenia gravis (QMG-pistemäärä > 10,5). Keskimääräinen muutos tässä joukossa oli -3,39 (p = 0,010).
Lisänäyttöä on saatu prospektiivisesta, avoimesta, kontrolloimattomasta kliinisestä monikeskustutkimuksesta, jossa myös selvitettiin Gamunex 100 mg/ml -valmisteen tehoa ja turvallisuutta myasthenia gravisin pahenemisvaiheiden hoidossa. Kliiniseen tutkimukseen otettiin yhteensä 49 potilasta, joille annettiin yksi 2 g/kg:n Gamunex 100 mg/ml -kokonaisannos jaettuna kahdelle peräkkäiselle päivälle (1 g/kg/vrk). Tutkimukseen ei osallistunut potilaita, joilla olisi ollut lihasspesifisen kinaasin (MuSK) vasta-aineita.
Ensisijainen tehon päätetapahtuma oli QMG (Quantitative Myasthenia Gravis) -pisteiden muutos lähtötasolta (päivä 0) päivään 14. QMG-pisteiden keskimääräinen muutos oli arviointikelpoisessa joukossa 6,4 ja turvallisuuspopulaatiossa -6,7. Toissijaisten ja eksploratiivisten tehon päätetapahtumien tulosten analyysi (arvio perustui QMG-, MG-ADL- ja MGC-pisteisiin) tuki ensisijaisen tehon päätetapahtuman tuloksia.
Farmakokinetiikka
Imeytyminen
Laskimoon antamisen jälkeen ihmisen normaali immunoglobuliini on heti ja kokonaan hyödynnettävissä potilaan verenkierrossa.
Jakautuminen
Valmiste jakautuu plasman ja ekstravaskulaarinesteen kesken melko nopeasti; noin 3–5 vuorokauden kuluttua on saavutettu tasapaino intravaskulaarisen ja ekstravaskulaarisen tilan välille.
Eliminaatio
Ihmisen normaalin immunoglobuliinin puoliintumisaika on noin 35 vuorokautta potilailla, joilla on primaarinen vasta-ainepuutosoireyhtymä. Tämä ylittää siis kirjallisuudessa mainitun terveiden henkilöiden puoliintumisajan, 21 vuorokautta. Puoliintumisaika saattaa vaihdella potilaasta toiseen, mutta vaihtelu koskee eritoten potilaita, joilla on primaarinen immuunipuutosoireyhtymä.
Immunoglobuliinit ja IgG-kompleksit hajoavat mononukleaaristen fagosyyttien järjestelmässä.
Pediatriset potilaat
Valmisteen farmakokineettisissä ominaisuuksissa ei pediatrisilla potilailla oletettavasti ole eroavuuksia.
Tuhkarokon estohoito ennen altistusta/altistuksen jälkeen
Taudille alttiilla potilailla ei ole tehty kliinisiä tutkimuksia tuhkarokon estohoidosta ennen altistusta/altistuksen jälkeen.
Gamunex 100 mg/ml -valmiste täyttää tuhkarokon vasta-aineiden tehokkuuden vähimmäismäärän, joka on 0,36 x CBER:n (Center for Biologics Evaluation and Research) standardi. Annostus perustuu farmakokineettisiin laskelmiin, joissa otetaan huomioon kehon paino, veritilavuus ja immunoglobuliinien puoliintumisaika. Näiden laskelmien mukaan:
- Seerumin tiitteri 13,5 päivän kohdalla = 270 mIU/ml (annos: 0,4 g/kg). Tämä on yli kaksi kertaa WHO:n suojaava tiitteri, 120 mIU/ml
- Seerumin tiitteri 22 päivän kohdalla (t1/2) = 180 mIU/ml (annos: 0,4 g/kg)
- Seerumin tiitteri 22 päivän kohdalla (t1/2) = 238,5 mIU/ml (annos: 0,53 g/kg – estohoito ennen altistusta)
Prekliiniset tiedot turvallisuudesta
Immunoglobuliinit ovat osa normaalia ihmiselimistöä. Prekliiniset tiedot turvallisuudesta ovat vähäisiä, koska immunoglobuliinien anto eläinkokeissa voi johtaa vasta-aineiden muodostumiseen. Akuuteissa ja subakuuteissa eläinkokeissa Gamunex 100 mg/ml -valmisteen ei todettu aiheuttavan riskiä ihmisille.
Farmaseuttiset tiedot
Apuaineet
Glysiini, injektionesteisiin käytettävä vesi.
Yhteensopimattomuudet
Lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
3 vuotta.
Säilytys
Säilytä jääkaapissa (2 °C - 8 °C). Ei saa jäätyä. Pidä ulkopakkauksessa.
Lääkkeen voi säilyttää ulkopakkauksessaan enintään 6 kuukauden ajan huoneenlämmössä (alle 25 °C). Valmisteen kestoaika päättyy tämän 6 kuukauden jälkeen. Uusi viimeinen käyttöpäivämäärä on merkittävä ulkopakkaukseen. Uusi viimeinen käyttöpäivä ei voi olla pakkauksiin painettua viimeistä käyttöpäivää myöhäisempi päivämäärä. Valmiste on joko käytettävä ennen viimeistä käyttöpäivää tai hävitettävä. Valmistetta ei enää tämän jälkeen saa säilyttää jääkaapissa eikä pakastaa.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
GAMUNEX infuusioneste, liuos
100 mg/ml (L:ei) 50 ml (452,09 €), 100 ml (877,95 €), 200 ml (1711,49 €), 400 ml (3267,80 €)
PF-selosteen tieto
Liuos laskimoon annettavaa infuusiota varten tyypin I tai II lasisissa injektiopulloissa, joissa klooributyylitulpat.
Pakkauskoot:
Yksi 10 ml:n injektiopullo sisältää: 1 g ihmisen normaalia immunoglobuliinia
Yksi 50 ml:n injektiopullo sisältää: 5 g ihmisen normaalia immunoglobuliinia
Yksi 100 ml:n injektiopullo sisältää: 10 g ihmisen normaalia immunoglobuliinia
Yksi 200 ml:n injektiopullo sisältää: 20 g ihmisen normaalia immunoglobuliinia
Yksi 400 ml:n injektiopullo sisältää: 40 g ihmisen normaalia immunoglobuliinia
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Liuos on kirkas tai hieman opalisoiva ja väritön tai vaaleankeltainen.
Käyttö- ja käsittelyohjeet
Valmiste pitää ennen käyttöä lämmittää huoneenlämpöön tai kehon lämpötilaan. Liuoksen tulee olla kirkasta tai hieman opalisoivaa ja väritöntä tai vaaleankeltaista. Sameaa tai sakkautumia sisältävää liuosta ei tule käyttää.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti. Pakkauksen avaamisen jälkeen valmiste on käytettävä heti. Tämän jälkeen valmistetta ei saa säilyttää jääkaapissakaan mahdollisen mikrobikontaminaation vuoksi.
Jos laimentaminen ennen infuusiota on tarpeen, voidaan tähän tarkoitukseen käyttää 50 mg/ml glukoosiliuosta. Älä laimenna keittosuolaliuokseen.
Gamunex 100 mg/ml -valmistetta ja hepariinia ei saa antaa saman infuusiojärjestelmän kautta.
Infuusioletkut voidaan huuhdella 50 mg/ml glukoosiliuoksella tai natriumkloridiliuoksella (9 mg/ml) eikä niitä saa huuhdella hepariinilla.
Heparin Lock, jonka kautta Gamunex 100 mg/ml on annettu, tulee huuhdella 50 mg/ml glukoosiliuoksella tai natriumkloridiliuoksella (9 mg/ml) eikä sitä saa huuhdella hepariinilla.
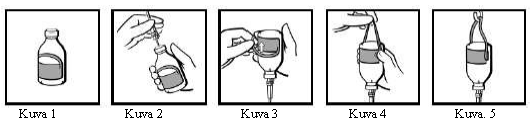
Injektiopullojen käyttöohje (koskee vain 50 ml:n, 100 ml:n, 200 ml:n ja 400 ml:n pulloja)
Injektiopullossa on sen ripustamiseen soveltuva etiketti (kuva 1). Kiinnitä infuusiolaite (kuva 2), käännä injektiopullo ylösalaisin, ja taita etiketin ripustinosa taaksepäin (kuva 3). Purista sorminvoimakkaasti niin, että kohtaan, jossa ripustinosa kiinnittyy etiketin muuhun osaan, muodostuu taite (kuva 4). Ripusta tämän jälkeen injektiopullo ripustinsilmukasta infuusiotelineeseen (kuva 5).
Korvattavuus
GAMUNEX infuusioneste, liuos
100 mg/ml 50 ml, 100 ml, 200 ml, 400 ml
- Ei korvausta.
ATC-koodi
J06BA02
Valmisteyhteenvedon muuttamispäivämäärä
24.10.2022
Yhteystiedot
Sveavägen 166
SE-113 46 Stockholm
Sverige
+46 8 441 89 50
www.grifols.com
infonordic@grifols.com
