VYXEOS LIPOSOMAL kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 44/100 mg
Vaikuttavat aineet ja niiden määrät
Yksi injektiopullo kuiva-ainetta välikonsentraatiksi infuusionestettä varten sisältää 44 mg daunorubisiinia ja 100 mg sytarabiinia.
Käyttövalmiiksi saattamisen jälkeen liuos sisältää 2,2 mg/ml daunorubisiinia ja 5 mg/ml sytarabiinia liposomeihin kapseloituna kiinteänä yhdisteenä molaarisessa suhteessa 1:5.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kuiva‑aine välikonsentraatiksi infuusionestettä varten, liuos
Kliiniset tiedot
Käyttöaiheet
Vyxeos liposomal on tarkoitettu käytettäväksi aikuispotilaille, joilla on äskettäin diagnosoitu aiempaan hoitoon liittyvä akuutti myelooinen leukemia (t‑AML) tai joilla on AML yhdessä myelodysplasiaan liittyvien muutosten kanssa (AML‑MRC).
Ehto
Hoito aloitetaan ja toteutetaan kemoterapiaan perehtyneen lääkärin toimesta.
Annostus ja antotapa
Vyxeos liposomal ‑hoidon saa aloittaa ja sen kulkua pitää seurata kemoterapeuttisten lääkevalmisteiden käytöstä kokemusta saaneen lääkärin valvonnan alaisena.
Vyxeos liposomal ‑valmistetta käytettäessä annostus on erilainen kuin daunorubisiini‑ ja sytarabiini‑injektiota käytettäessä eikä sitä saa vaihtaa muihin daunorubisiinia ja/tai sytarabiinia sisältäviin valmisteihin (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annostus
Vyxeos liposomal ‑valmisteen annostus perustuu potilaan kehon pinta‑alaan seuraavan annostusohjelman mukaisesti:
Taulukko 1 Vyxeos liposomal -annos ja -annostusohjelma
Hoito | Annostusohjelma |
Ensimmäinen induktiohoito | daunorubisiini 44 mg/m2 ja sytarabiini 100 mg/m2 päivinä 1, 3 ja 5 |
Toinen induktiohoito | daunorubisiini 44 mg/m2 ja sytarabiini 100 mg/m2 päivinä 1 ja 3 |
Konsolidaatiohoito | daunorubisiini 29 mg/m2 ja sytarabiini 65 mg/m2 päivinä 1 ja 3 |
Suositeltu annostusohjelma remission induktiovaiheessa
Vyxeos liposomal 44 mg/100 mg/m2 ‑valmisteen suositettu annostusohjelma annettaessa laskimoon 90 minuutin pituisena infuusiona:
- Päivinä 1, 3 ja 5 induktiohoidon ensimmäisenä hoitokuurina.
- Päivinä 1 ja 3 induktiohoidon seuraavina kuureina tarpeen mukaan.
Seuraava induktiohoito voidaan antaa potilaille, joilla ei havaita sairauden etenemistä tai toksisuutta, joka ei ole hyväksyttävissä. Useampi kuin yksi induktiohoito voidaan tarvita normaalilta näyttävän luuytimen saavuttamiseksi. Edellisen induktiohoidon jälkeisen toipumisen jälkeen tehtävällä luuydinnäytteen arvioinnilla päätetään, tarvitaanko toinen induktiohoito. Hoitoa on jatkettava niin kauan kuin potilas siitä hyötyy tai kunnes sairaus etenee, enintään kuitenkin 2 induktiohoidon ajan.
Suositeltu annostusohjelma konsolidaatiovaiheessa
Ensimmäinen konsolidaatiosykli on annettava 5–8 viikkoa viimeisen induktion aloittamisesta.
Vyxeos liposomal ‑valmisteen suositeltu annostusohjelma on 29 mg/65 mg/m2 annettaessa laskimoon 90 minuutin pituisena infuusiona:
- Päivinä 1 ja 3 konsolidaatiohoidon seuraavina kuureina tarpeen mukaan.
Konsolidaatiohoitoa suositellaan potilaille, jotka saavuttavat remission ja joiden absoluuttinen neutrofiilimäärä (ANC) on > 500/µl ja verihiutalemäärä on suurempi kuin 50 000/µl ja kun ei hyväksyttävissä olevaa toksisuutta ei esiinny. Seuraava konsolidaatiohoitokuuri voidaan antaa potilaille, joilla sairaus ei ole edennyt tai ei hyväksyttävissä olevaa toksisuutta ei ole ilmaantunut 5–8 viikon ajanjakson kuluessa ensimmäisen konsolidaatiohoidon aloittamisesta. Hoitoa on jatkettava niin kauan kuin potilas hyötyy siitä tai niin kauan kuin sairaus etenee, enintään kuitenkin 2 konsolidaatiohoidon ajan.
Suositellut annosmuutokset hoidon aikana
Potilaita on seurattava hematologisen vaikutuksen ja toksisuuksien varalta.
Antoa on lykättävä myöhemmäksi tai se on tarpeen mukaan lopetettava pysyvästi alla esitetyn mukaisesti.
Potilaille voidaan antaa esilääkitystä pahoinvointiin ja oksenteluun. Antihyperurikemiahoitoa on harkittava (esim. allopurinoli) ennen Vyxeos liposomal ‑hoidon aloittamista.
Yliherkkyys
Lievien yliherkkyysoireiden (esim. lievä punoitus, ihottuma, kutina) ilmaantuessa hoito on lopetettava ja potilasta on valvottava tärkeiden elintoimintojen merkkejä seuraten. Hoito on aloitettava hitaasti uudelleen kun oireet ovat hävinneet puolittamalla infuusionopeus, ja potilaalle on annettava difenhydramiinia (20‑25 mg) laskimoon sekä deksametasonia (10 mg) samoin laskimoon.
Keskivaikeiden yliherkkyysreaktioiden ilmaantuessa (esim. keskivaikea ihottuma, punoitus, lievä dyspnea, rintavaivat) hoito on lopetettava. Difenhydramiinia (20–25 mg tai vastaava) ja deksametasonia (10 mg) on annettava laskimoon. Infuusiota ei saa aloittaa uudelleen. Kun potilasta hoidetaan uudelleen, Vyxeos liposomal ‑valmistetta on annettava samaa annosta ja annosnopeutta käyttämällä, ja lisäksi on annettava esilääkitys.
Vaikeiden hengenvaarallisten yliherkkyysoireiden tapauksessa (esim. vasopressiohoitoa edellyttävä hypotensio, angioedeema, bronkodilaatiota edellyttävä hengitysvaikeus, yleistynyt urtikaria) hoito on lopetettava. Difenhydramiinia (20–25 mg) ja deksametasonia (10 mg) on annettava laskimoon, ja hoitoon on tarpeen mukaan liitettävä epinefriini (adrenaliini) tai bronkodilataattoreita. Infuusiota ei saa aloittaa uudelleen eikä hoitoa saa enää antaa. Vyxeos liposomal ‑hoito on pysyvästi lopetettava. Potilaita on seurattava kunnes oireet parantuvat (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Haittavaikutukset).
Kardiotoksisuus
Sydämen toiminnan arviointia suositellaan ennen hoidon aloittamista, etenkin potilaille, joilla on suuri riskikardiotoksisuudelle. Vyxeos liposomal ‑hoito on lopetettava potilailla, joille ilmaantuu kardiomyopatian merkkejä tai oireita elleivät hyödyt ole riskejä suuremmat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Unohtunut annos
Jos suunniteltu Vyxeos liposomal ‑annos jää väliin, annos on annettava mahdollisimman pian ja annosohjelmaa on muutettava sen mukaisesti hoitoväliä ylläpitäen.
Erityisryhmät
Munuaisten vajaatoiminta
Annoksen muuttaminen ei ole tarpeen potilaille, joilla on lievä (kreatiniinipuhdistuma [CrCL] 60 ml/min–89 ml/min Cockcroft Gault [C‑G] ‑kaavan mukaan), keskivaikea (CrCL 30 ml/min–59 ml/min) tai vaikea (CrCL < 30 ml/min) munuaisten vajaatoiminta. Vyxeos liposomal ‑valmisteen käytöstä potilaille, joilla on dialyysihoitoa vaativa loppuvaiheen munuaissairaus, ei ole tietoa (ks. kohta Farmakokinetiikka).
Maksan vajaatoiminta
Annosta ei tarvitse muuttaa potilaille, joiden bilirubiinitaso on alle 50 µmol/l tai sitä vastaava. Vyxeos liposomal ‑valmisteen käytöstä potilaille, joiden maksan vajaatoiminta aikaansaa yli 50 µmol/l:n bilirubiinitason, ei ole kokemusta. Vyxeos liposomal ‑hoitoa saa antaa vaikeaa maksan vajaatoimintaa sairastaville ainoastaan jos siitä saatavat hyödyt ovat riskejä suuremmat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Iäkkäät
Annosta ei tarvitse muuttaa iäkkäille potilaille (≥ 65-vuotiaat) (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Hyväksytyistä käyttöaiheista poikkeavassa käytössä Vyxeos liposomal -valmistetta on tutkittu 1–21 vuoden ikäisillä pediatrisilla potilailla ja nuorilla aikuispotilailla, joilla on uusiutunut AML. Näiden tutkimusten rajallisen koon vuoksi ei voida päätellä, että käytöstä saatavat hyödyt olisivat riskejä suuremmat. Saatavissa olevan tiedon perusteella, joka on kuvattu kohdissa Farmakodynamiikka ja Farmakokinetiikka, ei voida antaa suosituksia annostuksesta.
Antotapa
Vyxeos liposomal on tarkoitettu annettavaksi vain laskimoon. Ei saa antaa lihakseen, intratekaalisesti eikä ihon alle.
Vyxeos liposomal annetaan 90 minuutin kestoisena infuusiona laskimoon. On huolehdittava siitä, ettei ekstravasaatiota pääse tapahtumaan kudosnekroosin riskin välttämiseksi.
Katso. kohdasta Käyttö- ja käsittelyohjeet ohjeet lääkevalmisteen käyttövalmiiksi saattamisesta ja laimentamisesta ennen lääkkeen antoa.
Vasta-aiheet
Aikaisempi vakava yliherkkyys vaikuttaville aineille tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Muut daunorubisiinia ja/tai sytarabiinia sisältävät valmisteet
Vyxeos liposomal -valmistetta ei tule korvata tai vaihtaa muiden daunorubisiinin ja / tai sytarabiinipitoisten tuotteiden kanssa. Merkittävien farmakokineettisten parametrien erojen vuoksi Vyxeos liposomal ‑valmisteen annos‑ ja annostusohjelman suositukset eroavat suosituksista, jotka on annettu daunorubisiinihydrokloridi‑, sytarabiini‑, daunorubisiinisitraatti‑liposomi‑ ja sytarabiini‑liposomi‑injektion annosta. Lääkevalmisteen nimi ja annos on varmistettava ennen antoa annostusvirheiden välttämiseksi.
Vaikea myelosuppressio
Vaikeaa myelosuppressiota (ml. kuolemaan johtaneita infektioita ja verenvuototapahtumia) on ilmoitettu tapahtuneen potilailla Vyxeos liposomal ‑valmisteen terapeuttisen annoksen annon jälkeen. Vakavia tai kuolemaan johtaneita trombosytopeniaan liittyneitä verenvuototapauksia, ml. kuolemaan johtaneita keskushermostoverenvuotoja on esiintynyt Vyxeos liposomal ‑hoitoa saaneilla potilailla. Verenkuvan analyysi lähtötilanteessa on tehtävä ja potilaita on seurattava huolellisesi Vyxeos liposomal ‑hoidon aikana myelosuppressiosta johtuvien mahdollisten kliinisten komplikaatioiden varalta. Vyxeos liposomal ‑valmisteen pitkästä plasman puoliintumisajasta johtuen absoluuttisen neutrofiilimäärän (ANC) ja verihiutaleiden palautumisaika saattaa pitkittyä ja vaatia lisäseurantaa.
Infektiolääkkeitä (bakteeri‑, virus‑ ja sienilääkkeet mukaan lukien) voidaan käyttää ennaltaehkäisevästi vakavan neutropenian aikana kunnes absoluuttinen neutrofiilimäärä palaa vähintään arvoon > 0.5 E9/l (> 500/µl). Jos myelosuppressiivisia komplikaatioita ilmenee, on ryhdyttävä asianmukaisiin tukitoimenpiteisiin, on annettava esim. infektiolääkkeitä, kantasoluja stimuloivia kasvutekijöitä ja suoritettava verensiirto. Verenkuvaa on seurattava säännöllisesti kunnes potilas on toipunut (ks. kohta Haittavaikutukset).
Kardiotoksisuus
Antrasykliinihoitoon liittyvä tunnettu riski on kardiotoksisuus. Aikaisempi antrasykliinihoito (ml. potilaat, jotka ovat aikaisemmin saaneet suositettuja doksorubisiini‑ tai daunorubisiinihydrokloridin kumulatiivisia maksimiannoksia), taustalla oleva sydänsairaus (ml. sydämen vajaatoiminta), aikaisemmin saatu välikarsinan sädehoito tai kardiotoksisten valmisteiden samanaikainen käyttö saattaa lisätä daunorubisiinin aiheuttamaa kardiotoksisuutta.
Sydänhäiriöitä (mukaan lukien sinustakykardiaa, QT-ajan pidentymistä ja ejektiofraktion pienenemistä) todettiin kahdessa yhdellä hoitoryhmällä tehdyssä tutkimuksessa, joihin osallistuneille, uusiutunutta tai hoitoresistenttiä AML:ää sairastaville, antrasykliiniä esilääkityksenä saaneille 65 lapselle annettiin yksi induktiosykli (sykli 1) Vyxeos liposomal -valmistetta. Useat muut pitkäaikaistutkimukset, joissa antrasykliini-/antrakinonihoitoa on annettu lapsille, viittaavat siihen, että kongestiivista kardiomyopatiaa voi esiintyä antrasykliini-/antrakinonihoidon jälkeen monen vuoden viiveellä (ks. kohta Haittavaikutukset).
Ei‑liposomaalisen daunorubisiinin 550 mg/m2:n ylittäviin kumulatiivisiin annoksiin on liittynyt hoidon aiheuttaman kongestiivisen sydämen vajaatoiminnan lisääntynyttä esiintyvyyttä. Tämä raja vaikuttaa olevan alhaisempi (400 mg/m2) potilailla, jotka olivat saaneet välikarsinan sädehoitoa. Kumulatiivisten Vyxeos liposomal ‑annosten ja kardiotoksisuuden riskin välistä suhdetta ei ole määritetty. Kumulatiivinen kokonaisaltistuminen daunorubisiinille on kuvattu alla olevassa taulukossa.
Taulukko 2 Kumulatiivinen altistuminen daunorubisiinille yhtä Vyxeos liposomal ‑valmisteen hoitokuuria kohden
Hoito | Daunorubisiinia annosta kohden | Annosten lukumäärä hoitokuuria kohden | Daunorubisiinia hoitokuuria kohden |
Ensimmäinen induktio | 44 mg/m2 | 3 | 132 mg/m2 |
Seuraava induktio | 44 mg/m2 | 2 | 88 mg/m2 |
Jokainen konsolidaatio | 29 mg/m2 | 2 | 58 mg/m2 |
Lähtötilanteen sydämen toiminnan arviointia EKG:llä ja monivaiheista radionuklidiangiografia (MUGA) ‑tutkimusta tai ekkokardiografia (ECHO) suositellaan, etenkin potilaille, joilla on lisääntynyt riski kardiotoksisuudelle. Sydämen toimintaa on seurattava tiukasti.
Vyxeos liposomal ‑hoito on lopetettava potilailla, joilla sydämen toimintakyky on heikentynyt ellei hoidon jatkamisesta saatava hyöty ole suurempi kuin siihen liittyvät riskit (ks. kohdat Yhteisvaikutukset ja Haittavaikutukset).
Ehkäisy ja raskaus
Potilaita on neuvottava välttämään raskaaksi tuloa Vyxeos liposomal ‑hoidon aikana. Mies- ja naispotilaiden, jotka voivat saada lapsia, on käytettävä tehokasta ehkäisyä hoidon aikana ja vielä 6 kuukauden ajan viimeisen Vyxeos liposomal ‑annoksen jälkeen (ks. kohta Raskaus ja imetys).
Yliherkkyysreaktiot
Vakavia yliherkkyysreaktioita, ml. anafylaktisia reaktioita, on raportoitu daunorubisiinin ja sytarabiinin käytössä.
Keskivaikeiden yliherkkyysreaktioiden ilmaantuessa (esim. keskivaikea ihottuma, punoitus, lievä dyspnea, rintavaivat) hoito on lopetettava. Difenhydramiinia (20–25 mg tai vastaava) ja deksametasonia (10 mg) on annettava laskimoon. Infuusiota ei saa aloittaa uudelleen. Kun potilasta hoidetaan uudelleen, Vyxeos liposomal ‑valmistetta on annettava samaa annosta ja annosnopeutta käyttämällä, ja lisäksi on annettava esilääkitys.
Vaikeiden hengenvaarallisten yliherkkyysoireiden tapauksessa (esim. vasopressiohoitoa edellyttävä hypotensio, angioedeema, bronkodilaatiota edellyttävä hengitysvaikeus, yleistynyt urtikaria) hoito on lopetettava. Difenhydramiinia (20–25 mg) ja deksametasonia (10 mg) on annettava laskimoon, ja hoitoon on tarpeen mukaan liitettävä epinefriini (adrenaliini) tai bronkodilataattoreita. Infuusiota ei saa aloittaa uudelleen eikä hoidon uusimista saa yrittää. Vyxeos liposomal ‑hoito on pysyvästi lopetettava. Potilaita on seurattava, kunnes oireet paranevat (ks. kohdat Annostus ja antotapa ja Haittavaikutukset).
Kudosnekroosi
Daunorubisiinin käyttöön on liittynyt paikallista kudosnekroosia lääkevalmisteen ekstravasaation paikalla. Kliinisissä tutkimuksissa Vyxeos liposomal ‑valmisteella esiintyi yksi ekstravasaation tapahtuma, mutta nekroosia ei havaittu. On huolehdittava siitä, ettei lääkevalmisteen ekstravasaatiota pääse tapahtumaan Vyxeos liposomal ‑valmistetta annettaessa. Vyxeos liposomal on annettava laskimoon ainoastaan. Ei saa antaa lihakseen, intratekaalisesti tai ihon alle (ks. kohta Annostus ja antotapa).
Maksan ja munuaisten toiminnan arvioiminen
Maksan vajaatoiminta saattaa lisätä daunorubisiiniin ja sytarabiiniin liittyvän toksisuuden riskiä. Maksan toiminnan arviota tavanomaisia kliinisiä laboratoriokokeita käyttämällä suositellaan ennen Vyxeos liposomal ‑valmisteen antoa ja ajoittain hoidon aikana. Vyxeos liposomal ‑valmisteen käytöstä potilaille, joiden lähtötilanteen seerumin bilirubiini on suurempi kuin 50 µmol/l tai joilla on dialyysihoitoa vaativa loppuvaiheen munuaissairaus, ei ole kokemusta. Vyxeos liposomal ‑valmistetta on käytettävä vaikeaa maksan vajaatoimintaa sairastaville ainoastaan siinä tapauksessa, että hoidosta saatavat hyödyt ovat suuremmat kuin hoitoon liittyvät riskit (ks. kohta Annostus ja antotapa).
Laboratoriokokeet
Vyxeos liposomal saattaa aiheuttaa hyperurikemiaa leukemiasolujen nopean lyysin jälkeen. Veren virtsahappotasoja on seurattava ja asianmukainen hoito aloitettava, jos hyperurikemia kehittyy.
Aikaisemmin sairastettu Wilsonin tauti tai muu kupariin liittyvä sairaus
Yksi injektiopullo sisältää 100 mg kupariglukonaattia, joka vastaa 14 mg puhdasta kuparia. Vyxeos liposomal ‑valmistetta on käytettävä aikaisemmin Wilsonin tautia tai muita kupariin liittyviä sairauksia poteneille potilaille ainoastaan siinä tapauksessa, että hoidosta saatavat hyödyt ovat suuremmat kuin hoitoon liittyvät riskit (ks. kohta Apuaineet). Vyxeos liposomal ‑hoito on lopetettava potilaille, joille ilmaantuu akuutin kuparimyrkytyksen merkkejä tai oireita.
Immunosuppressiiviset vaikutukset / infektioherkkyyden lisääntyminen
Elävien tai heikennettyjen rokotteiden antaminen potilaille, joiden immuniteetti on heikentynyt solunsalpaajahoidon vuoksi, saattaa aiheuttaa vakavia tai kuolemaan johtavia infektioita. Elävien rokotteiden käyttöä Vyxeos liposomal ‑hoitoa saaville potilaille on vältettävä. Tapettuja tai heikennettyjä taudinaiheuttajia sisältäviä rokotteita voidaan käyttää, mutta vaste tällaisiin rokotteisiin saattaa olla heikentynyt.
Maha‑suolikanavan limakalvojen tulehdus ja ripuli
On otettava huomioon, että samanaikaisesti suun kautta otettavien lääkevalmisteiden imeytymiseen saattavat suuresti vaikuttaa maha‑suolikanavan limakalvojen tulehdus ja/tai ripuli, joita usein esiintyy intensiiviseen solunsalpaajahoitoon liittyen.
Yhteisvaikutukset
Yhteisvaikutustutkimuksia ei ole tehty Vyxeos liposomal ‑valmisteella. Vyxeos liposomal ‑valmisteen liposomaalisesta muodosta saatavien daunorubisiinin ja sytarabiinin odotetaan vähentävän yhteisvaikutusten mahdollisuutta, koska daunorubisiinin ja sytarabiinin systeemiset vapaat pitoisuudet ovat hyvin paljon alhaisemmat kuin jos niitä annettaisiin ei‑liposomaalisessa muodossa.
Kardiotoksiset aineet
Kardiotoksisten aineiden samanaikainen käyttö saattaa lisätä kardiotoksisuuden riskiä. Vyxeos liposomal ‑valmisteen käyttö potilaille, jotka ovat aikaisemmin saaneet doksorubiinia, lisää kardiotoksisuuden riskiä (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Vyxeos liposomal ‑valmistetta ei saa antaa yhdessä muiden kardiotoksisten aineiden kanssa ellei potilaan sydämen toimintaa seurata tiukasti.
Hepatotoksiset aineet
Hepatotoksiset lääkevalmisteet saattavat heikentää maksan toimintaa ja lisätä toksisuutta. Koska daunorubisiini metaboloituu maksan kautta, samanaikaisten hoitojen aiheuttamat maksan toiminnan muutokset saattavat vaikuttaa Vyxeos liposomal ‑valmisteen metaboliaan, farmakokinetiikkaan, terapeuttiseen tehoon ja/tai toksisuuteen (ks. kohta Farmakokinetiikka). Maksan toimintaa on seurattava useammin kun Vyxeos liposomal ‑valmistetta annetaan yhdessä hepatotoksisten aineiden kanssa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / Ehkäisy miehille ja naisille
Raskauden poissulkemiseksi naisille, jotka voivat tulla raskaaksi, on tehtävä raskaustesti ennen Vyxeos liposomal -hoidon aloittamista. Sekä miespotilaiden, joiden kumppani voi tulla raskaaksi, että naispotilaiden on käytettävä tehokasta ehkäisyä Vyxeos liposomal -hoidon aikana ja 6 kuukautta viimeisen annoksen jälkeen.
Raskaus
Ei ole olemassa tietoja Vyxeos liposomal ‑valmisteen käytöstä raskaana oleville naisille. Eläinkokeista saatujen tulosten ja lääkkeen vaikutusmekanismin perusteella Vyxeos liposomal ‑valmistetta ei saa käyttää raskauden aikana, ellei naisen kliininen tila edellytä ja oikeuta hoitoa sikiölle koituvasta mahdollisesta riskistä huolimatta (ks. kohta Prekliiniset tiedot turvallisuudesta).
Jos lääkevalmistetta käytetään raskauden aikana tai potilas tulee raskaaksi Vyxeos liposomal ‑hoitoa saadessaan, naista on informoitava sikiöön mahdollisesti kohdistuvasta vaarasta. Kardiologista tutkimusta ja verenkuvaa suositetaan joka tapauksessa hoitoa raskauden aikana saaneiden äitien sikiöille ja vastasyntyneille.
Imetys
Ei tiedetä, erittyykö Vyxeos liposomal ihmisen rintamaitoon. Koska Vyxeos liposomal ‑valmiste mahdollisesti aiheuttaa vakavia haittavaikutuksia imetettäville lapsille, naisia on kehotettava olemaan imettämättä Vyxeos liposomal ‑hoidon aikana.
Hedelmällisyys
Eläinkokeiden perusteella Vyxeos liposomal ‑hoito saattaa vaikuttaa heikentävästi miehen hedelmällisyyteen (ks. kohta Prekliiniset tiedot turvallisuudesta).
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Vyxeos liposomal ‑valmisteella on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Vyxeos liposomal ‑valmisteen käytössä on ilmoitettu uupumista ja heitehuimausta. Varovaisuutta on sen vuoksi noudatettava ajaessa ja koneita käytettäessä.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Yleisimmin esiintyviä haittavaikutuksia (ADR) olivat yliherkkyys ml. ihottuma (66,9 %), kuumeinen neutropenia (63,5 %), edeema (52,3 %), ripuli/koliitti (49,9 %), mukosiitti (49,9 %), uupumus (46,4 %), lihas‑ ja luukipu (44,5 %), vatsakipu (36,3 %), ruokahalun väheneminen (33,9 %), yskä (33,9 %), päänsärky (32,3 %), vilunväreet (31,2 %), rytmihäiriöt (30,4 %), kuume (29,6 %), univaikeudet (25,1 %) ja hypotensio (23,7 %).
Vakavimpia ja useimmin esiintyviä haittavaikutuksia olivat infektio (58,7 %), kardiotoksisuus (18,7 %) ja verenvuoto (13,1 %).
Haittavaikutustaulukko
Haittavaikutukset on lueteltu asianmukaisessa luokassa alla olevassa taulukossa pääasiallisissa kliinisissä tutkimuksissa havaittujen esiintymistiheyksien mukaan yleisimmistä alkaen.
Yleisyys on määritelty seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuusasteen mukaan alenevassa järjestyksessä. Haittavaikutusten luokituksesta asteikolla 3–5 on täydellinen luettelo saatavissa, ks. Yhdysvaltojen kansallisen syöpäinstituutin (National Cancer Institute, NCI, Yhdysvallat) turvallisuusluokitus (CTCAE). Toksisuus luokitellaan lieväksi (aste 1), keskivaikeaksi (aste 2), vaikeaksi (aste 3) tai hengenvaaralliseksi (aste 4), tiettyine parametreineen kulloisenkin elinjärjestelmäluokan mukaan. Kuolemaa (aste 5) käytetään joissakin kriteereissä kuvaamaan fataalisuutta.
Taulukko 3 Kliinisissä tutkimuksissa Vyxeos liposomal ‑valmistetta saaneilla potilailla ilmoitetut haittavaikutukset (n=375)
Elinjärjestelmä | Haittavaikutukset /esiintymistiheys (%) | Asteen 3–5 haittavaikutukset /esiintymistiheys (%) |
Infektiot | Hyvin yleinen | Hyvin yleinen |
Veri ja imukudos | Hyvin yleinen Yleinen | Hyvin yleinen Yleinen |
Immuunijärjestelmä | Hyvin yleinen | Yleinen |
Aineenvaihdunta ja ravitsemus | Yleinen | Yleinen |
Psyykkiset häiriöt | Hyvin yleinen | Yleinen Melko harvinainen |
Hermosto | Hyvin yleinen | Yleinen Melko harvinainen |
Silmät | Hyvin yleinen | Melko harvinainen |
Sydän | Hyvin yleinen | Hyvin yleinen Yleinen |
Verisuonisto | Hyvin yleinen | Hyvin yleinen Yleinen |
Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | Hyvin yleinen Melko harvinainen |
Ruoansulatuselimistö | Hyvin yleinen Yleinen | Yleinen Melko harvinainen |
Iho ja ihonalainen kudos | Hyvin yleinen Yleinen Melko harvinainen | Melko harvinainen |
Luusto, lihakset ja sidekudos | Hyvin yleinen | Yleinen |
Munuaiset ja virtsatiet | Hyvin yleinen | Yleinen |
Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Hyvin yleinen Yleinen Melko harvinainen |
a Rytmihäiriöiden ryhmään kuuluvat eteisvärinä, bradykardia, ja yleisimmin ilmoitettu rytmihäiriö oli takykardia.
Tiettyjen haittavaikutusten kuvaus
Infektiot
Vyxeos liposomal ‑valmisteeseen liittyvän neutropenian vuoksi erityyppiset infektiot olivat hyvin yleisiä haittavaikutuksia. Keuhkokuume, sepsis ja bakteremia olivat kliinisessä tutkimusväestössä yleisimmin esiintyneitä vakavia infektiohaittavaikutuksia. Infektiotapahtumien ilmaantuvuus oli 78,1 %; ei‑vakavien infektiotapahtumien ilmaantuvuus oli 73,1 %, vakavien infektiotapahtumien ilmaantuvuus oli 28,5 %; hoidon lopettamiseen johtaneiden infektioiden ilmaantuvuus oli 0,5 %. Kuolemaan johtaneiden infektioiden ilmaantuvuus oli 6,9 %. Esiintyneitä kuolemaan johtaneita infektioita olivat sepsis ja keuhkokuume (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Verenvuoto
Vyxeos liposomal ‑valmisteen käyttöön liittyneen trombosytopenian vuoksi kliinisissä tutkimuksissa esiintyi erilaisia verenvuototapahtumia. Yleisin verenvuototapahtuma oli nenäverenvuoto, ja useimmat näistä eivät olleet vakavia (29,1 %). Verenvuototapahtumien ilmaantuvuus oli 69,1 %; ei‑vakavien verenvuototapahtumien ilmaantuvuus oli 67,2 %; vakavien verenvuototapahtumien ilmaantuvuus on 5,6 %; hoidon lopettamiseen johtaneiden verenvuotojen ilmaantuvuus on 0. Kuolemaan johtaneiden verenvuotojen ilmaantuvuus oli 2,1 %. Vyxeos liposomal ‑hoitoa saaneilla potilailla todettiin vakavia tai kuoleman johtaneita verenvuototapahtumia, ml. kuolemaan johtaneita keskushermostoverenvuotoja, joihin liittyi vaikea trombosytopenia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kardiotoksisuus
Vyxeos liposomal ‑valmisteen kliinisissä tutkimuksissa todettiin kardiotoksisuus‑tapauksia. Useimmin ilmoitettuja vakavia haittavaikutuksia olivat ejektiofraktion pieneneminen ja kongestiivinen sydämen vajaatoiminta. Kardiotoksisuus on antrasykliinihoitoon liittyvä tunnettu riski. Kaikkien kardiotoksisuustapahtumien ilmaantuvuus oli 72,0 %; ei‑vakavien kardiotoksisuustapahtumien ilmaantuvuus oli 68,5 %; vakavien kardiotoksisuustapahtumien ilmaantuvuus oli 9,1 %; hoidon lopettamiseen johtaneen kardiotoksisuuden ilmaantuvuus on 0,5 %. Kuolemaan johtaneiden kardiotoksisuustapahtumien ilmaantuvuus on 0,5 %. Sydämenpysähdys ilmoitettiin kuolemaan johtaneena tapahtumana: potilaalla esiintyi trombosytopenia ja neutropenia, mikä oli osasyynä sydämenpysähdykseen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Yliherkkyys
Yliherkkyysreaktiot olivat hyvin yleisiä haittavaikutuksia Vyxeos liposomal ‑valmisteen kliinisissä tutkimuksissa. Yleisimmin ilmoitettu yliherkkyysreaktio oli ihottuma, ja useimmat näistä eivät olleet vakavia (38,9 %). Kaikkien yliherkkyystapahtumien ilmaantuvuus oli 66,9 %; ei‑vakavien yliherkkyystapahtumien ilmaantuvuus oli 66,4 % joista 38,9 % olivat ihottumia; vakavien yliherkkyystapahtumien ilmaantuvuus on 1,1 %; hoidon lopettamiseen johtaneen yliherkkyyden ilmaantuvuus on 0. Kuolemaan johtavien yliherkkyystapahtuminen esiintymistiheys oli 0 (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Tutkimuksessa AAML1421 Vyxeos liposomal -valmisteen turvallisuusprofiili 38 pediatrisella potilaalla, joilla oli uusiutunut AML, vaikutti yleisesti ottaen samankaltaiselta kuin hyväksytyssä käyttöaiheessa aikuisilla, jotka olivat äskettäin saaneet Vyxeos liposomal -valmistetta AML:n hoitoon (ks. kohta Annostus ja antotapa). Pediatrisilla potilailla tutkimuksessa AAML 1421 todettuihin haittavaikutuksiin, jotka erosivat aikuisilla todetuista haittatapahtumista tai olivat niitä vaikea-asteisempia (tutkimusten ristikkäisvertailun rajoitukset huomioiden), sisältyivät makulopapulaarinen ihottuma (47,4 %), QT-ajan pidentyminen EKG-tutkimuksissa (28,9 %), kardiotoksisuuden (määriteltiin > 10 %:n laskuksi LVEF-arvossa siten, että lopullinen LVEF oli < 50 %; 21,0 %) ilmeneminen varhaisessa vaiheessa, vaikea hypokalemia (13,2 %), hyperglykemia (7,9 %) ja ALAT-arvon nousu (7,9 %). Hypertensiota todettiin 18,2 %:lla näistä pediatrisista potilaista.
Pediatrisista potilaista ei ole saatavana pitkäaikaisia turvallisuustietoja tutkimuksen keston (26 viikkoa) ylittävältä ajalta. Siten pediatrisista potilaista ei ole turvallisuustietoja, joiden perusteella voitaisiin arvioida Vyxeos liposomal -valmisteen pitkäaikaista kardiotoksisuutta, mukaan lukien pitkäaikainen kardiotoksisuus tilanteissa, joissa sitä käytetään maksimaalisen elinaikaisen kumulatiivisen antrasykliiniannoksen ylittävinä annoksina. Vyxeos liposomal -hoidon vaikutuksista kasvuun ja kypsymiseen ei ole tietoja.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‑haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Erityistä kokemusta yliannostuksen hoidosta potilaille ei ole. Jos yliannostus tapahtuu, Vyxeos liposomal ‑valmisteeseen liittyvien haittavaikutusten paheneminen on odotettavissa ja on valmistauduttava antamaan tukihoitoa (ml. infektiolääkkeet, veri‑ ja verihiutalesiirrot, kantasoluryhmiä stimuloivien kasvutekijöiden anto ja tehohoito tarpeen mukaan) kunnes potilaan tila palautuu ennalleen. Potilasta on seurattava huolellisesti ajoittain kardiotoksisuuden oireiden varalta ja tukihoitoa on annettava kliinisen tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: muut antineoplastiset lääkeaineet, yhdistelmävalmisteet, sytarabiini ja daunorubisiini. ATC‑koodi: L01XY01
Vaikutusmekanismi
Vyxeos liposomal on liposomeihin kapseloituna kiinteänä daunorubisiinin ja sytarabiinin yhdisteenä molaarisessa suhteessa 1:5. Molaarinen suhde 1:5 on osoitettu sekä in vitro että in vivo synergistisen antituumorivaikutuksen maksimoimiseksi akuutissa myelooisessa leukemiassa.
Daunorubisiinilla on antimitoottinen ja sytotoksinen aktiviteetti, joka saavutetaan muodostamalla komplekseja yhdessä DNA:n kanssa, estämällä topoisomeraasi II:n aktiviteettia, estämällä DNA‑polymeraasin aktiviteettia, säätäen geeniekspressiota ja tuottaen DNA:ta vaurioittavia vapaita radikaaleja.
Sytarabiini on solusyklifaasi‑spesifinen antineoplastinen aine, vaikuttaen soluihin ainoastaan solun jakautumisen S‑vaiheessa. Solunsisäisesti sytarabiini muuttuu sytarabiini‑5‑trifosfaatiksi (ara‑CTP), joka on sen aktiivinen metaboliitti. Vaikutusmekanismia ei täysin tunneta, mutta vaikuttaa siltä, että ara‑CTP vaikuttaa pääasiassa DNA‑synteesiä estämällä. Yhdistäminen DNA:han ja RNA:han saattaa myös olla osasyynä sytarabiinin sytotoksisuuteen. Sytarabiini on sytotoksinen proliferoiville nisäkässoluille soluviljelmissä.
Vyxeos liposomal ‑valmisteen liposomeilla on pidentynyt plasman puoliintumisaika laskimoon annetun infuusion jälkeen, ja yli 99 % daunorubisiinista ja sytarabiinista plasmassa pysyy kapseloituna liposomeihin. Vyxeos liposomal ‑valmisteesta saatu synerginen yhdistelmä daunorubisiinia ja sytarabiinia vaikuttaa leukemiasoluihin pitkän ajanjakson ajan. Eläinkokeista saatujen tietojen mukaan Vyxeos liposomal ‑valmisteen liposomit kerääntyvät ja pysyvät suurina pitoisuuksina luuytimessä, josta leukemiasolut poimivat ne ensisijaisesti muuttumattomina suuren aktiivisen prosessin aikana. Leukemiaa sairastavilla hiirillä leukemiasolut poimivat liposomeja suuremmassa määrin kuin normaalit luuydinsolut. Luuytimessä Vyxeos liposomal ‑valmisteen liposomit pilkkoutuvat ja vapauttavat daunorubisiinia ja sytarabiinia solun sisäiseen ympäristöön mahdollistaen siten lääkevalmisteiden synergistisen antineoplastisen aktiviteetin.
Kliininen teho ja turvallisuus
Vyxeos liposomal ‑valmisteen tehoa äskettäin diagnosoitua akuuttia myelooista leukemiaa (AML) sairastavien aikuisten hoidossa arvioitiin yhdessä kontrolloidussa kliinisessä tutkimuksessa (tutkimus 301), ja Vyxeos liposomal -valmisteen tehoa uusiutunutta AML:ää sairastavien pediatristen potilaiden hoidossa arvioitiin yhdessä kliinisessä tutkimuksessa AAML 1421.
Tutkimus 301 tehtiin potilaille, joilla oli aiemmin hoitamaton suuren riskin akuutti myelooisen leukemia (AML)
Tutkimus 301 oli Faasin 3 satunnaistettu, monikeskus‑, avoin, rinnakkaisryhmä‑, paremmuustutkimus, jossa arvioitiin Vyxeos liposomal ‑valmistetta vs. tavanomaista sytarabiinin ja daunorubisiinin yhdistelmää (7+3) 309:lla potilaalla, jotka olivat iältään 60–75 vuotta ja joilla oli aiemmin hoitamaton suuren riskin AML. Tutkimukseen otettiin mukaan seuraaviin AML:n alaryhmiin kuuluvia potilaita: hoitoon liittyvä AML (t‑AML), myelodysplastinen syndrooma AML (MDS AML) ja krooninen myelomonosyyttinen leukemia AML (CMMoL AML), aikaisemmin sairastettu MDS tai CMMoL oli dokumentoitu ennen muuttumista akuutiksi myelooiseksi leukemiaksi (AML) ja de novo AML‑potilaat, joilla oli myelodysplasialle luonteenomaisia karyotyyppisiä muutoksia (2008 WHO ‑kriteerien mukaan).
Tutkimukseen kuului 2 vaihetta, 1) hoitovaihe, jonka aikana potilaat saivat enintään 2 induktio‑ ja 2 konsolidaatiohoitokuuria, ja 2) seurantavaihe, joka aloitettiin 30 vuorokauden kuluttua viimeisestä induktio‑ tai konsolidaatiohoitokuurista ja jatkui enintään 5 vuoden ajan satunnaistamisen jälkeen. Induktio‑ ja konsolidaatiohoitojen lukumäärä määräytyi täydellisen vasteen (CR) tai täydellisen vasteen ilman täydellistä parantumista (CRi) mukaan, mikä varmistettiin luuydinanalyysilla. Kliinisissä tutkimuksissa annettiin Vyxeos liposomal ‑valmistetta 100 yksikköä/m2 /vuorokausi (vastaten 44 mg/100mg/m2:aa) laskimoon 90 minuutin pituisena infuusiona päivinä 1, 3 ja 5 ensimmäisenä induktiohoitona ja päivinä 1 ja 3 potilaille, jotka tarvitsivat toisen induktiohoidon. Toista induktiohoitoa suositeltiin vahvasti sellaisille potilaille, jotka eivät saavuttaneet täydellistä vastetta (CR) tai täydellistä vastetta ilman täydellistä parantumista (CRi) ensimmäisen induktiohoitokuurin aikana ja se oli pakollinen potilaille, joilla blastien prosentuaalinen aleneminen oli yli 50 %. Remission jälkeinen hoito hematopoieettisella kantasolusiirrolla (HSCT) oli luvallista joko konsolidaatiohoidon sijaan tai sen jälkeen. Kliinisissä tutkimuksissa konsolidaatiohoitokuureina annettua Vyxeos liposomal ‑annosta vähennettiin 65 yksikköön/m2 /vuorokausi (vastaten 29 mg/65 mg/m2:aa) päivinä 1 ja 3. Ensimmäinen induktio 7+3 ‑hoitoryhmässä sisälsi sytarabiinia 100 mg/m2/vuorokausi päivinä 1–7 jatkuvana infuusiona, ja daunorubisiinia 60 mg/m2/vuorokausi päivinä 1, 2 ja 3, kun sen sijaan sytarabiinin toinen induktio ja konsolidaatio annettiin päivinä 1–5 ja daunorubisiinin päivinä 1 ja 2.
Potilaista 153 satunnaistettiin saamaan Vyxeos liposomal ‑valmistetta ja 156 satunnaistettiin 7+3 ‑verrokkiryhmään. Satunnaistettujen potilaiden mediaani‑ikä oli 68 vuotta (väliltä 60–75 vuotta), 61 % oli miehiä ja 88 %:lla oli ECOG‑toimintakykyluokituksen status 0–1. Lähtötilanteen potilaista 20 %:lla oli t‑AML, 54 %:lla oli AML yhdessä aiemman hematologisen sairauden kanssa ja 25 %:lla oli de novo AML yhdessä myelodysplasiaan liittyvien sytogeneettisten epämuodostumien kanssa. Potilaista 34 % oli saanut hypometylaatiohoitoa aikaisemmin MDS:n hoidossa. Potilaista 54 %:lla oli poikkeava karyotyyppi. Demograafiset ja lähtökohtaiset piirteet olivat yleensä tasaisia toisiinsa verrattuina eri potilasryhmissä. FLT3‑mutaatiota tunnistettiin 15 %:lla (43/279) tarkastetuista potilaista ja NPM1‑mutaatio tunnistettiin 9 %:lla (25/283) tarkastetuista potilaista.
Ensisijainen päätetapahtuma oli kokonaiselossaoloaika, joka mitattiin satunnaistamisen päivämäärästä kuolemaan mistä tahansa syystä. Vyxeos liposomal ‑valmisteella osoitettiin paremmuus kokonaiselossaoloajassa ITT‑populaatiossa verrattuna 7+3 ‑verrokkihoitoon (Kuva 1). Mediaani elossaoloaika Vyxeos liposomal ‑hoitoryhmässä oli 9,56 kuukautta verrattuna 5,95 kuukauteen, joka saavutettiin 7+3 ‑hoitoryhmässä (riskisuhde = 0,69, 95 % lv = 0,52, 0,90, kaksitahoinen log rank ‑testi p‑arvo = 0,005).
Hematopoieettisten kantasolusiirtojen (HSCT) kokonaismäärä oli 34 % (52/153) Vyxeos liposomal ‑hoitoa saaneessa ryhmässä ja 25 % (39/156) verrokkiryhmässä.
Kuva 1 Kokonaiselossaoloajan Kaplan–Meier‑käyrä, ITT‑populaatio
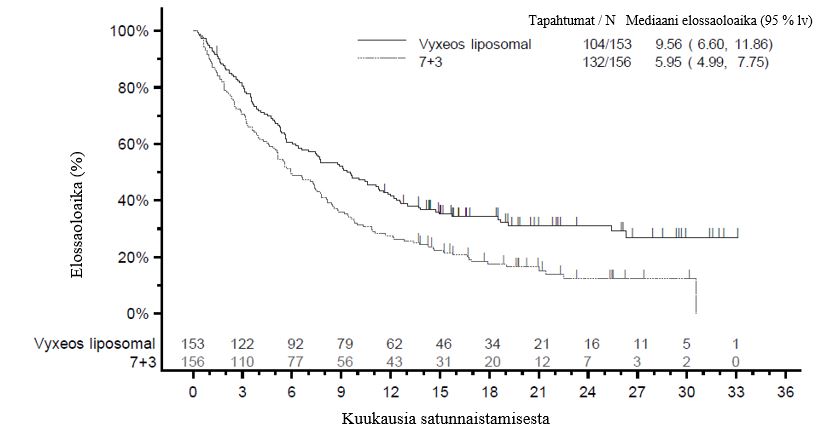
Taulukko 4 Tutkimuksen 301 tehon arviointitulokset
Vyxeos liposomal N=153 | 7+3 N=156 | ||
Kokonaiselossaoloaika | |||
Kokonaiselossaoloajan mediaani kuukausina (95 % lv) | 9,56 (6,60, 11,86) | 5,95 (4,99, 7,75) | |
Riskisuhde, HR (95 % lv) | 0,69 (0,52, 0,90) | ||
p–arvo (2‑tahoinen) a | 0,005 | ||
Tapahtumavapaa elossaoloaika (EFS) | |||
EFS mediaani kuukausina (95 % lv) | 2,53 (2,07, 4,99) | 1,31 (1,08, 1,64) | |
Riskisuhde, HR (95 % lv) | 0,74 (0,58, 0,96) | ||
p‑arvo (2‑tahoinen) a | 0,021 | ||
Kokonaisvasteprosentti | |||
Kokonaisvasteprosentti, n (%) | 57 (37) | 40 (26) | |
Kerroinsuhde (95 % lv) | 1,69 (1,03, 2,78) | ||
p‑arvo (2‑tahoinen) b | 0,040 | ||
CR + CRi, n (%) | 73 (48) | 52 (33) | |
Kerroinsuhde (95 % lv) | 1,77 (1,11, 2,81) | ||
p‑arvo (2‑tahoinen) b | 0,016 | ||
Lyhenteet: lv = luottamusväli; CR= Complete Response (täydellinen vaste); CRi= Complete Response with incomplete recovery (täydellinen vaste ilman täydellistä parantumista)
a p‑arvo stratifioidusta log rank ‑testistä, stratifiointi iän ja AML:n alatyypin mukaan
b p‑arvo stratifioidusta Cochran‑Mantel‑Haenszel ‑testistä, stratifiointi iän ja AML:n alatyypin mukaan
60 kuukauden seuranta
60 kuukauden kokonaiselossaolon osuus oli suurempi Vyxeos liposomal -hoitoryhmässä (18 %) verrattuna 7+3-hoitoryhmään (8 %); riskitiheyssuhde oli 0,70, 95 % lv = 0,55; 0,91.
Pediatriset potilaat
Uusiutunut AML
Ainoana lääkkeenä käytetyn Vyxeos liposomal -valmisteen tehoa arvioitiin yhdellä hoitoryhmällä toteutetussa faasin 1/2 tutkimuksessa (AAML 1421), jonka tavoitteena oli arvioida Vyxeos liposomal -valmisteen turvallisuutta ja tehoa 38:lla iältään 1–21-vuotiaalla pediatrisella potilaalla ja nuorella aikuispotilaalla, joiden AML oli uusiutunut ensimmäisen kerran. Tutkimushoitona oli yksi induktiosykli Vyxeos liposomal -valmistetta annoksena 59 mg/135 mg/m2, joka annettiin laskimoon 90 minuutin pituisena infuusiona päivinä 1, 3 ja 5, minkä jälkeen potilaat saivat fludarabiinia, sytarabiinia ja G CSF:ää (FLAG) syklin 2 ajan. Potilaiden mediaani-ikä oli 11 vuotta (vaihteluväli 1–21 vuotta). Kahdeksan potilasta (21 %) oli 18–21-vuotiaita. Potilaat, jotka saivat > 450 mg/m2 daunorubisiiniekvivalentteja, suljettiin pois tutkimuksesta.
Ensisijainen päätetapahtuma oli kokonaisvasteprosentti (määritelmä: CR tai CRp) Vyxeos liposomal -syklin (syklin 1) ja sitä seuraavan FLAG:n (syklin 2) jälkeen. Kokonaisvasteprosentti oli 68 % (90 % Clopper-Pearsonin lv: 53–80 %). Syklin 1 jälkeen 16 potilasta (43 %) oli saavuttanut hoitovasteen CR + CRp; näistä 14 potilasta (38 %) oli saavuttanut CR-vasteen. CR-vasteen mediaanikesto oli 284 vuorokautta 7 potilaasta saatavilla olevien uusiutumistietojen perusteella.
Farmakokinetiikka
Daunorubisiinin ja sytarabiinin farmakokinetiikkaa tutkittiin Vyxeos liposomal ‑valmisteen antamisen kautta aikuisille potilaille, jotka saivat daunorubisiinia 44 mg/m2 ja sytarabiinia 100 mg/m2 90 minuutin pituisena infuusiona laskimoon päivinä 1, 3 ja 5. Kunkin lääkevalmisteen farmakokinetiikka perustui kokonaispitoisuuksiin plasmassa (so. kapseloituna sekä vapaana lääkevalmisteena). Päivänä 5 annetun annoksen jälkeen daunorubisiinin keskimääräinen (% variaatiokerroin [CV]) maksimipitoisuus plasmassa (Cmax) oli 26,0 (32,7 %) mikrogrammaa/ml ja sytarabiinin 62,2 (33,7 %) mikrogrammaa/ml. Keskimääräinen (% variaatiokerroin, CV) käyrän alla oleva pinta‑ala (AUC) daunorubisiinin yhden annosteluvälin aikana oli 637 (38,4 %) mikrogrammaa/ml ja sytarabiinin 1 900 (44,3 %) mikrogrammaa/ml.
Kun daunorubisiinia ja sytarabiinia annetaan Vyxeos liposomal ‑valmisteen komponentteina, liposomit vaikuttavat hallitsevan kudosten jakautumista ja eliminaationopeutta. Siksi on havaittavissa, että ei‑liposomaalisten lääkevalmisteiden huomattavasti erilaisesta puhdistumasta (CL), jakautumistilavuudesta (V) ja terminaalisesta puoliintumisajasta (t1/2) huolimatta Vyxeos liposomal aiheuttaa näiden farmakokineettisten ominaisuuksien lähentymisen toisiinsa.
Daunorubisiinin kertymissuhde oli 1,3 ja sytarabiinin 1,4. Todisteita ei havaittu ajasta riippuvasta kinetiikasta eikä annossuhteellisuuden suurista poikkeavuuksista 1,3 mg/3 mg per m2:n ja 59 mg/134 mg per m2:n välillä (0,03–1,3‑kertainen hyväksyttyyn suositeltuun annokseen verrattuna).
Jakautuminen
Daunorubisiinin jakautumistilavuus (% CV) on 6,6 l (36,8 %) ja sytarabiinin 7,1 l (49,2 %). Sitoutumista plasman proteiineihin ei arvioitu.
Metabolia ja biotransformaatio
Samoin kuin ei‑liposomaaliset daunorubisiini ja sytarabiini, Vyxeos liposomal ‑valmisteen liposomeista vapautumisen jälkeen sekä daunorubisiini että sytarabiini metaboloituvat laajasti elimistöön. Daunorubisiini katalysoituu etupäässä maksan ja muun kuin maksan aldo‑keto‑reduktaasin ja karbonyylireduktaasin kautta aktiiviksi metaboliitiksi, daunorubisinoliksi. Sytarabiini metaboloituu sytidiinideaminaasin kautta inaktiiviksi metaboliitiksi, 1‑β (beeta)‑D‑arabinofuranosyyliurasiiliksi (AraU). Toisin kuin ei‑liposomaaliset daunorubisiini ja sytarabiini, jotka metaboloituvat nopeasti omiksi metaboliiteikseen, daunorubisiini ja sytarabiini Vyxeos liposomal ‑valmisteen annon jälkeen ovat liposomeihin kapseloituja vapaita emäksiä. Plasman pitoisuus‑aika‑profiilit, jotka saatiin 13–26 potilaalta, joille annettiin Vyxeos liposomal ‑valmistetta 100 yksikköä/m2 (vastaten 44 mg/m2 daunorubisiinia ja 100 mg/m2 sytarabiinia) päivinä 1, 3 ja 5, osoittavat daunorubisinolin ja AraU:n keskimääräistä AUClast metaboliitti:kanta‑aine‑suhdetta, so. daunorubisiinin 1,79 %, ja sytarabiinin 3,22 %, jotka ovat alhaisempia kuin yleensä ei‑liposomaalisilla valmisteilla ilmoitetut, daunorubisinoli:daunorubisiini ‑suhteen ~40–60 % ja AraU:sytarabiini ‑suhteen ~80 %. Metaboliitti‑kanta‑aine ‑suhteiden alemmat prosentuaaliset määrät Vyxeos liposomal ‑valmisteen annon jälkeen on osoitus siitä, että suurin osa daunorubisiinin ja sytarabiinin kokonaismäärästä on jumiutunut Vyxeos liposomal ‑valmisteen liposomien sisälle, jossa ne eivät ole lääkeaineita metaboloivien entsyymien tavoitettavissa.
Eliminaatio
Vyxeos liposomal ‑valmisteella on pidentynyt puoliintumisaika (% CV), daunorubisiinin kohdalla 31,5 h (28,5 %) ja sytarabiinin kohdalla 40,4 h (24,2 %), ja yli 99 % plasmassa olevista daunorubisiinista ja sytarabiinista pysyy kapseloituina liposomeihin. Daunorubisiinin puhdistuma (% CV) on 0,16 l/h (53,3 %) ja sytarabiinin 0,13 l/h (60,2 %).
Daunorubisiinin ja daunorubisinolin erittyminen virtsaan on 9 % annetusta daunorubisiiniannoksesta, ja sytarabiinin ja AraU:n erittyminen virtsaan on 71 % annetusta sytarabiiniannoksesta.
Erityisryhmät
Väestön farmakokineettisessä analyysissa iän (1–81 vuotta), sukupuolen, rodun, kehon painon, painoindeksin ja valkosolumäärän ei todettu vaikuttavan kliinisesti merkittävästi daunorubisiinin ja sytarabiinin puhdistumaan ja tilavuusparametreihin.
Pediatriset potilaat
Pediatrisilla potilailla (annos 59 mg/135 mg/m2) todetut daunorubisiinin ja sytarabiinin annoksen mukaan normalisoidut keskimääräiset kokonaisaltistukset olivat samaa luokkaa kuin aikuisilla, jotka saivat annosta 44 mg/100 mg/m2.
Ikääntyneet potilaat
Vyxeos liposomal ‑valmisteen farmakokinetiikkaa yli 85‑vuotiailla potilailla ei ole vielä arvioitu. Tietoja ei ole saatavissa.
Munuaisten vajaatoiminta
Erään tutkimuksen mukaan, jossa arvioitiin nimenomaisesti vaikeusasteeltaan keskivaikeasta vaikeaan vaihtelevan munuaisten vajaatoiminnan vaikutusta Vyxeos liposomal -valmisteen farmakokinetiikkaan, sekä väestön farmakokineettisen analyysin mukaan ja käyttämällä kliinisten tutkimusten tietoja lievää ja keskivaikeaa munuaisten vajaatoimintaa sairastavista potilaista, voidaan todeta, ettei daunorubisiinin tai sytarabiinin puhdistumissa ollut merkitsevää eroa potilailla, joilla oli entuudestaan lievä, keskivaikea tai vaikea munuaisten vajaatoiminta, verrattuna potilaisiin, joiden lähtötilanteen munuaistoiminta oli normaali. Dialyysihoitoa vaativan loppuvaiheen munuaissairauden mahdollisia vaikutuksia Vyxeos liposomal ‑valmisteen muodossa annettavien daunorubisiinin ja sytarabiinin farmakokinetiikkaan ei tunneta (ks. kohta Annostus ja antotapa).
Maksan vajaatoiminta
Daunorubisiinin ja sytarabiinin kokonaismäärien farmakokinetiikka ei muuttunut potilailla, joiden bilirubiini oli ≤ 50 µmol/l. Farmakokinetiikkaa potilailla, joiden bilirubiini on yli 50 µmol/l, ei tunneta.
Prekliiniset tiedot turvallisuudesta
Toistuvien annosten toksisuutta tutkittiin Vyxeos liposomal ‑valmisteella kahdessa syklisessä laskimoon annettavassa infuusion toksisuustutkimuksessa, joissa oli 28 vuorokauden toipumisajanjaksot ja jotka tehtiin rotalle ja koiralle. Vyxeos liposomal ‑valmisteeseen liittyviä haittavaikutuksia esiintyi kaikilla annostasoilla (turvallisuusmarginaalin ollessa alhaisesta tasosta nollaan, systeemiseen altistukseen perustuen) ja ne olivat yleensä yhdenmukaisia haittavaikutusten kanssa, joita on dokumentoitu ei‑liposomaalisen daunorubisiinin ja/tai sytarabiinin yhteydessä, koostuen pääasiassa gastrointestinaalisista ja hematologisista löydöksistä. Vaikka keskushermoston ja kardiovaskulaarisen järjestelmän parametrit sisältyivät näihin tutkimuksiin, ottaen huomioon havaitut sairastuvuus‑ ja kuolleisuusluvut, tiedot olivat riittämättömiä yhtenäisen arvion tekemiseen Vyxeos liposomal ‑valmisteen turvallisuusfarmakologiasta.
Tutkimuksia Vyxeos liposomal -valmisteen aiheuttamasta genotoksisuudesta, karsinogeenisuudesta ja lisääntymis- ja kehitystoksisuudesta ei ole tehty. Yksittäisillä lääkeaineilla tehtyjä tutkimuksia on kuitenkin saatavilla.
Genotoksisuus
Sytarabiini tai sen aktiivinen metaboliitti Ara-C oli mutageeninen (bakteerimutageenisuustesti) ja klastogeeninen in vitro (kromosomipoikkeavuus- ja sisarkromatidivaihdostestit [SCE] ihmisen leukosyyteillä) ja in vivo (kromosomipoikkeavuus- ja SCE-testit jyrsijöillä). Sytarabiini aiheutti muutoksia hamsterin alkiosolu- ja rotan H43-solutesteissä in vitro ja oli klastogeeninen meioottisissa soluissa. Daunorubisiini oli mutagaaninen (bakteerimutageenisuustesti, hamsterin V79-solutesti) ja klastogeeninen in vitro (CCRF-CEM ihmisen lymfoblastit) ja in vivo (SCE-testi hiiren luuytimellä).
Karsinogeenisuus
Sytarabiinitutkimuksia ei ole identifioitu. Sytarabiinin aktiivisesta Ara-C-metaboliitista julkaistuista tiedoista ei ole saatu näyttöä karsinogeenisuudesta. Daunorubisiinista julkaistut tiedot viittaavat mahdolliseen tuumorigeeniseen vaikutukseen rotilla 5 mg/kg tai 10 mg/kg kerta-annosten (0,68–1,4-kertainen annos ihmisille suositeltuun mg/m2-annokseen verrattuna) jälkeen. IARC-työryhmä (IARC 2000) on luokitellut daunorubisiinin luokkaan 2B kuuluvaksi eli mahdollisesti ihmiselle syöpää aiheuttavaksi aineeksi.
Lisääntymis- ja kehitystoksisuus
Sytarabiini oli alkiotoksinen hiirillä ja teratogeeninen hiirillä ja rotilla, kun sitä annettiin organogeneesin aikana. Sytarabiini aiheutti myös siittiön pään epämuodostumia hiirillä ja spermatogeneesin heikentymistä rotilla. Rotille annettu sytarabiinin kerta-annos tiineyden 14. päivänä pienensi prenataalista ja postnataalista aivojen kokoa ja aiheutti oppimiskyvyn pysyvää heikkenemistä. Daunorubisiini oli alkiotoksinen ja aiheutti sikiöiden epämuodostumia, kun sitä annettiin organogeneesin aikana rotille. Daunorubisiini aiheutti kivesten atrofiaa ja täydellistä spermatosyyttien aplasiaa siementiehyissä koirilla.
Ympäristöön kohdistuvien riskien arviointi
Ympäristöön kohdistuvien riskien arviointi on osoittanut, että Vyxeos liposomal ‑valmisteella ei odoteta olevan potentiaalia pysyvään, bioakkumulatiiviseen tai toksiseen vaikutukseen ympäristölle.
Farmaseuttiset tiedot
Apuaineet
Distearyylifosfatidyylikoliini, distearyylifosfatidyyliglyseroli, kolesteroli, kupariglukonaatti, trolamiini (pH:n säätöön), sakkaroosi.
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa, lukuun ottamatta niitä, jotka mainitaan kohdassa Käyttö- ja käsittelyohjeet.
Kestoaika
Avaamattomat injektiopullot
4 vuotta
Käyttövalmiiksi saatetun suspension säilyvyys injektiopullossa
Käytön aikaisen kemiallisen ja fysikaalisen säilyvyyden on osoitettu olevan 4 tuntia 2 °C–8 °C:ssa kun injektiopullo pidetään pystyasennossa. Mikrobiologisista syistä valmiste on käytettävä välittömästi, elleivät avaamisen/käyttövalmiiksi saattamisen/laimentamisen menetelmät sulje pois mikrobisaastumisen riskiä.
Jos valmistetta ei käytetä välittömästi, käytön aikaisen säilytyksen pituus ja olosuhteet ovat käyttäjän vastuulla.
Laimennetun infuusion säilyvyys
Käytön aikaisen kemiallisen ja fysikaalisen säilyvyyden on osoitettu olevan 4 tuntia 2 °C–8 °C:ssa.
Mikrobiologisista syistä valmiste on käytettävä välittömästi, elleivät avaamisen/käyttövalmiiksi saattamisen/laimentamisen menetelmät sulje pois mikrobisaastumisen riskiä. Jos valmistetta ei käytetä välittömästi, käytön aikaisen säilytyksen pituus ja olosuhteet ovat käyttäjän vastuulla.
Injektiopullossa olevan, käyttövalmiiksi saatetun valmisteen sekä infuusiopussiin laimennetun, käyttövalmiiksi saatetun valmisteen pisin sallittu säilytysaika on yhteensä enintään 4 tuntia 2 °C–8 °C:ssa.
Säilytys
Säilytä jääkaapissa (2 °C–8 °C).
Pidä injektiopullo alkuperäispakkauksessa. Herkkä valolle. Säilytä pystyasennossa.
Käyttökuntoon saatetun ja laimennetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
VYXEOS LIPOSOMAL kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
44/100 mg (L:ei) 1 kpl (6377,70 €)
PF-selosteen tieto
50 ml:n injektiopullo (tyypin 1 lasista valmistettu), jossa on (klorobutyylikumi)korkki ja (alumiini) sinetti ja joka sisältää 44 mg daunorubisiinia ja 100 mg sytarabiinia.
Yksi pakkaus sisältää joko 1, 2 tai 5 injektiopulloa. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Violetti, kylmäkuivattu kakku.
Käyttö- ja käsittelyohjeet
Vyxeos liposomal on sytotoksinen lääkevalmiste. Asianmukaisia erityisiä käsittely‑ ja hävittämismenetelmiä on noudatettava. Valmiste on tarkoitettu ainoastaan kertakäyttöön.
Valmistusohjeet
- Määritä annos ja tarvittava Vyxeos liposomal ‑injektiopullojen lukumäärä potilaan kehon pinta‑alan mukaan kohdassa Annostus ja antotapa esitetyn mukaisesti.
- Ota jääkaapista tarvittava määrä Vyxeos liposomal ‑injektiopulloja ja anna niiden tasaantua huoneenlämpötilaan (15 °C–30 °C) 30 minuutin ajan.
- Valmista sitten kukin injektiopullo lisäämällä 19 ml steriiliä injektionesteisiin käytettävää vettä käyttäen 20 ml:n ruiskua. Käynnistä välittömästi 5 minuutin ajastin.
- Pyörittele injektiopullon sisältöä varovasti 5 minuutin ajan ja käännä pullo hellävaraisesti ylösalaisin 30 sekunnin välein.
- Älä kuumenna, älä käytä vortex‑sekoittajaa, älä ravistele voimakkaasti.
- Anna liuoksen seisoa 15 minuutin ajan käyttövalmiiksi saattamisen jälkeen.
- Käyttövalmiiksi saatetun valmisteen pitää olla läpinäkymätön, violetti, tasainen dispersio, eikä siinä saa näkyä hiukkasia.
- Jos käyttövalmiiksi saatettua valmistetta ei laimenneta infuusiopussiin välittömästi, säilytä sitä jääkaapissa (2 ºC–8 ºC) enintään 4 tunnin ajan.
-
Kun käyttövalmiiksi saatettua valmistetta on säilytetty injektiopullossa pystyasennossa 2 ºC–8 ºC:ssa enintään 4 tunnin ajan, se on laimennettava välittömästi infuusioliuokseksi ja annettava 90 minuutin kestoisena infuusiona.
- Käyttövalmiiksi saatetun, injektiopullossa olevan valmisteen ja käyttövalmiiksi saatetun, infuusioliuokseksi laimennetun valmisteen pisin sallittu säilytysaika on yhteensä enintään 4 tuntia 2 ºC–8 ºC:ssa. Käyttövalmiiksi saatettu valmiste säilyy injektiopullossa 4 tuntia. Tämän jälkeen valmistetta ei voi enää säilyttää uutta neljän tunnin ajanjaksoa, kun käyttövalmiiksi saatetusta injektiopullosta otettu asianmukainen annos on laimennettu infuusioliuokseksi.
- Käyttövalmiiksi saatetun, infuusiopussiin laimennetun valmisteen 4 tunnin säilyvyysaika 2 ºC–8 ºC:ssa ei sisällä käyttövalmiiksi saattamiseen tarvittavaa aikaa eikä 90 minuutin infuusioaikaa.
- Kun enintään 4 tunnin säilyvyysaika on päättynyt, laimennettu infuusioliuos on annettava välittömästi 90 minuutin kestoisena infuusiona.
- Laske tarvittava määrä käyttövalmiiksi saatettua Vyxeos liposomal ‑liuosta seuraavaa kaavaa käyttämällä: [tarvittava määrä (ml) = daunorubisiinin annos (mg/m2) x potilaan kehon pinta‑ala (m2)/2,2 (mg/ml)]. Käyttövalmiiksi saatetun liuoksen pitoisuus on 44 mg/20 ml (2,2 mg/ml) daunorubisiinia ja 100 mg/20 ml (5 mg/ml) sytarabiinia.
- Käännä jokainen injektiopullo varovasti ylösalaisin 5 kertaa ennen kuin vedät konsentraatin ruiskuun laimentamista varten.
- Vedä aseptista menetelmää käyttäen laskettu määrä käyttövalmiiksi saatettua Vyxeos liposomal ‑liuosta injektiopullosta (injektiopulloista) steriilillä ruiskulla ja siirrä liuos infuusiopussiin, joka sisältää 500 ml natriumkloridiliuosta 9 mg/ml (0,9 %) tai 5‑prosenttista glukoosiliuosta injektiota varten. Injektiopullossa saattaa olla valmistetta jäljellä. Hävitä käyttämätön liuos.
- Käännä infuusiopussia varovasti ylösalaisin liuoksen sekoittamiseksi. Laimennettu liuos on lopulta syvän violetti, läpikuultava ja tasainen dispersio.
- Jos laimennettua infuusioliuosta ei käytetä välittömästi, säilytä sitä jääkaapissa (2 °C–8 °C) enintään 4 tunnin ajan.
- Käännä pussi varovasti ylösalaisin liuoksen sekoittamiseksi jääkaapissa säilytyksen jälkeen.
Anto‑ohjeet
- Älä sekoita Vyxeos liposomal ‑valmistetta muiden lääkevalmisteiden kanssa. Älä anna sitä infuusiona muiden lääkevalmisteiden kanssa.
- Anna Vyxeos liposomal ‑valmiste jatkuvana 90 minuutin kestoisena infuusiona laskimoon infuusiopumppua käyttämällä keskuslaskimokatetrin tai perifeerisesti asennetun keskuskatetrin läpi. Laskimonsisäisen Vyxeos liposomal -infuusion antamiseen voidaan käyttää in-line-kalvosuodatinta, kunhan suodattimen huokosten minimiläpimitta on vähintään 15 µm.
- Huuhtele letku annon jälkeen injektiota varten tarkoitetulla natriumkloridiliuoksella 9 mg/ml (0,9 %).
Tämä lääkevalmiste voi mahdollisesti olla ympäristöriski sen sytotoksisen ja antimitoottisen vaikutuksen vuoksi, jotka voivat aikaansaada mahdollisia lisääntymiseen kohdistuvia vaikutuksia. Kaikki laimentamiseen ja antoon käytetyt materiaalit on hävitettävä paikallisten, antineoplastisten aineiden hävittämistä koskevien vaatimusten mukaisesti. Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten sytotoksisia aineita koskevien vaatimusten mukaisesti.
Korvattavuus
VYXEOS LIPOSOMAL kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
44/100 mg 1 kpl
- Ei korvausta.
ATC-koodi
L01XY01
Valmisteyhteenvedon muuttamispäivämäärä
01.04.2024
Yhteystiedot
 Jazz Pharmaceuticals Denmark Aps
Jazz Pharmaceuticals Denmark Aps Gammel Kongevej 1
DK-1650 Copenhagen
Tanska
+44 845 030 5089
www.jazzpharma.com
medinfo-int@jazzpharma.com
