NORDITROPIN NORDIFLEX injektioneste, liuos, esitäytetty kynä 5 mg/1,5 ml, 10 mg/1,5 ml, 15 mg/1,5 ml
Vaikuttavat aineet ja niiden määrät
Norditropin NordiFlex: 5 mg/1,5 ml
1 ml liuosta sisältää 3,3 mg somatropiinia
Norditropin NordiFlex: 10 mg/1,5 ml
1 ml liuosta sisältää 6,7 mg somatropiinia
Norditropin NordiFlex: 15 mg/1,5 ml
1 ml liuosta sisältää 10 mg somatropiinia
somatropiini (valmistettu yhdistelmä-DNA-tekniikalla, tuotettu E. coli -bakteerissa)
1 mg somatropiinia vastaa 3 IU (kansainvälinen yksikkö) somatropiinia
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos esitäytetyssä kynässä
Kliiniset tiedot
Käyttöaiheet
Lapset:
Kasvuhormonin vajauksesta johtuva kasvun hidastuminen (GHD)
Gonadaalisesta dysgenesiasta johtuva tyttöjen kasvun hidastuminen (Turnerin oireyhtymä)
Kroonisesta munuaistaudista johtuva lasten kasvun hidastuminen ennen murrosikää
Kasvuhäiriö (nykyinen suhteellinen pituus (SDS) < -2,5 ja vanhempien pituuteen sovellettu suhteellinen pituus (SDS) < -1) lyhyillä lapsilla, jotka ovat gestaatioikään nähden syntyneet pienikokoisina (SGA). Näillä lapsilla syntymäpaino ja/tai -pituus ovat alle -2 SD, eikä kiinniottokasvua (HV SDS < 0 viimeisen vuoden aikana) ole ollut neljänteen ikävuoteen mennessä tai myöhemmin.
Noonanin oireyhtymästä johtuva kasvun hidastuminen.
Aikuiset:
Lapsuusiässä alkanut kasvuhormonin vajaus:
Potilailta, joilla on lapsuusiässä alkanut GHD, tulee pituuskasvun päätyttyä määrittää kasvuhormonin erityskyky uudelleen. Määritystä ei tarvitse tehdä silloin kun potilaalla on useamman kuin kolmen aivolisäkkeen erittämän hormonin puutos, vakava perinnöllinen GHD, hypotalamuksen tai aivolisäkkeen rakenteellisista poikkeamista, keskushermoston kasvaimesta tai kalloon kohdistuneesta korkeasta säteilyannoksesta johtuva GHD, tai jos tila johtuu aivolisäkkeen/hypotalamuksen sairaudesta tai tapahtumasta ja jos seerumin insuliininkaltaisen kasvutekijä 1:n (IGF-1) pitoisuus on < -2 SDS, kun kasvuhormonihoito on ollut keskeytettynä vähintään neljän viikon ajan.
Kaikille muille potilaille on tehtävä IGF-1-pitoisuuden määritys ja yksi kasvuhormonin stimulaatiokoe.
Aikuisiässä alkanut kasvuhormonin vajaus:
Potilaille, joiden ilmeinen kasvuhormonin puutos johtuu hypotalamus-aivolisäkeakselin sairaudesta, kalloon kohdistuneesta säteilyannoksesta tai traumaperäisestä aivovauriosta. Kasvuhormonin puutokseen tulee liittyä jonkin muun aivolisäkkeen säätelemän hormonin puutos, ei kuitenkaan prolaktiinin. Kasvuhormonin vajaus tulee osoittaa yhdellä stimulaatiotestillä sen jälkeen kun tarvittava muiden aivolisäkkeen säätelemien hormonien korvaushoito on aloitettu.
Aikuisille insuliinihypoglykemiakoe on ensisijainen. Jos se on vasta-aiheinen, käytetään muita vaihtoehtoisia stimulaatiokokeita. Tällöin suositellaan yhdistettyä arginiini-kasvuhormoninvapauttajahormonikoetta. Arginiini- tai glukagonitestiä voidaan myös harkita; näiden stimulaatiokokeiden diagnostinen arvo ei kuitenkaan ole yhtä vakiintunut kuin insuliinihypoglykemiakokeen.
Ehto
Vain lastennefrologian, lastenendokrinologian ja/tai endokrinologian erikoislääkäreiden määräyksellä.
Annostus ja antotapa
Vain lastennefrologian, lastenendokrinologian ja/tai endokrinologian erikoislääkäreiden määräyksellä.
Annostus
Annostus on yksilöllinen ja säädettävä aina potilaan yksilöllisen hoitovasteen mukaan.
Suositeltavat annostukset:
Pediatriset potilaat:
Kasvuhormonin vajaus
0,025–0,035 mg/kg/vrk tai 0,7–1,0 mg/m2/vrk
Jos lapsuusiässä alkanut GHD jatkuu pituuskasvun päätyttyä, kasvuhormonihoitoa on jatkettava täyden somaattisen kehityksen, kuten kehon painon ja luuston mineraalikoostumuksen saavuttamiseksi (annosohjeet, katso Aikuisten korvaushoito).
Turnerin oireyhtymä
0,045–0,067 mg/kg/vrk tai 1,3–2,0 mg/m2/vrk
Krooninen munuaistauti
0,050 mg/kg/vrk tai 1,4 mg/m2/vrk (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
Gestaatioikään nähden pienikokoiset lapset (SGA)
0,035 mg/kg/vrk tai 1,0 mg/m2/vrk
Annosta 0,035 mg/kg/vrk yleensä suositellaan siihen saakka, kunnes loppupituus on saavutettu (ks. kohta Farmakodynamiikka).
Hoito tulee lopettaa ensimmäisen hoitovuoden jälkeen, jos kasvunopeus on alle +1 SDS.
Hoito tulee lopettaa myös, jos pituuskasvunopeus on < 2 cm/vuosi, ja jos asia halutaan varmentaa, luustoiän tulee olla > 14 vuotta (tytöt) tai > 16 vuotta (pojat), vastaten ikää, jolloin pitkien luiden kasvulevyt sulkeutuvat.
Noonanin oireyhtymä:
Suositeltu annos on 0,066 mg/kg/vrk, mutta joissakin tapauksissa 0,033 mg/kg/vrk saattaa olla riittävä annos (ks. kohta Farmakodynamiikka).
Hoito pitää lopettaa, kun kasvulevyt sulkeutuvat (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Aikuiset:
Aikuisten korvaushoito
Annos on säädettävä potilaan yksilöllisen tarpeen mukaan.
Potilailla, jotka jatkavat kasvuhormonin korvaushoitoa lapsuusiässä alkaneen kasvuhormonivajauksen jälkeen, suositellaan hoidon uudelleen aloittamiseen annosta 0,2–0,5 mg/vrk. Annosta säädetään IGF-1-pitoisuuden perusteella.
Potilailla, joilla kasvuhormonin vajaus on alkanut aikuisiässä, on suositeltavaa aloittaa hoito pienellä annoksella 0,1–0,3 mg/vrk. Suositusten mukaan annosta nostetaan asteittain kuukauden välein kliinisen vasteen ja potilaan kokemien haittatapahtumien mukaan. Seerumin IGF-1-pitoisuutta voidaan käyttää ohjeellisena arvona annosta määritettäessä. Naispotilas voi tarvita suurempia annoksia kuin miespotilas, sillä miehillä esiintyy lisääntyvää IGF-1-herkkyyttä ajan myötä. Tämä merkitsee riskiä, että naiset, erityisesti suun kautta estrogeenikorvaushoitoa saavat naiset, ovat alihoidettuja, kun taas miehet ovat ylihoidettuja.
Tarvittava annos pienenee iän myötä. Ylläpitoannos vaihtelee huomattavasti henkilöstä toiseen, mutta ylittää harvoin 1,0 mg/vrk.
Antotapa
Yleensä suositellaan päivittäistä ihonalaista, illalla annettavaa injektiota. Injektiokohtaa tulee vaihdella lipoatrofian estämiseksi.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Somatropiinia ei saa käyttää, jos on joitain merkkejä kasvainten aktiivisuudesta. Kallonsisäisten kasvainten pitää olla inaktiivisia ja kasvainten hoidon päättynyt ennen kasvuhormonihoidon aloittamista. Hoito pitää lopettaa, jos esiintyy merkkejä kasvaimen kasvamisesta.
Somatropiinia ei saa käyttää pituuskasvun edistämiseen lapsille, joiden kasvulevyt ovat sulkeutuneet.
Somatropiinia ei saa antaa potilaille, joilla on akuutteja, tehohoitoa vaativia komplikaatioita, jotka johtuvat avosydänleikkauksesta, vatsan alueen leikkauksesta, tapaturmaisesta monivammasta, akuutista hengitysvajauksesta tai muista vastaavista tiloista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Kroonista munuaistautia sairastavien lasten Norditropin NordiFlex -hoito pitää lopettaa munuaissiirron yhteydessä.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Lasten kasvuun erikoistuneen lääkärin tulee säännöllisesti tutkia lapset, joita hoidetaan somatropiinilla. Somatropiinihoito tulee käynnistää vain kasvuhormonin vajaukseen ja sen hoitoon erikoistuneen lääkärin aloitteesta. Tämä rajoitus koskee myös Turnerin oireyhtymän, kroonisen munuaistaudin, SGA:n ja Noonanin oireyhtymän hoitoa. Norditropin-hoitoa saaneiden lasten loppupituustietoja on Noonanin oireyhtymää sairastavien lasten osalta niukasti, ja kroonista munuaistautia sairastavien lasten osalta loppupituustietoja ei ole saatavilla.
Suositeltua päivittäistä enimmäisannosta ei saa ylittää (ks. kohta Annostus ja antotapa).
Pituuskasvun nopeutumisen mahdollisuus päättyy kasvulevyjen sulkeuduttua.
Lapset
Kasvuhormonivajauksen hoito potilailla, joilla on Prader-Willin oireyhtymä
Somatropiinihoidon aloittamisen jälkeen on raportoitu äkkikuolemia Prader-Willin oireyhtymää sairastavilla potilailla, joilla oli yksi tai useampi seuraavista riskitekijöistä: vaikea liikalihavuus, aikaisempi ylempien hengitysteiden ahtautuminen tai uniapnea, tai tunnistamaton hengitystieinfektio.
SGA
Lyhyillä lapsilla, jotka ovat syntyneet gestaatioikään nähden pienikokoisina (SGA), tulee muut lääketieteelliset syyt tai hoidot, jotka voisivat selittää kasvuhäiriön, sulkea pois ennen hoidon aloittamista.
Kokemuksia hoidon aloittamisesta lähellä murrosiän alkamista olevilla SGA-potilailla on rajoitetusti. Sen vuoksi hoidon aloittamista puberteetin alkamisen lähettyvillä ei suositella.
Kokemuksia potilailla, joilla on Silver-Russellin oireyhtymä, on rajoitetusti.
Turnerin oireyhtymä
Turnerin oireyhtymää sairastavien potilaiden käsien ja jalkojen kasvun seuraamista suositellaan somatropiinihoidon aikana. Jos havaitaan lisääntynyttä kasvua, tulee harkita annoksen pienentämistä annosalueen alarajalle.
Turnerin oireyhtymää sairastavilla tytöillä on yleisesti lisääntynyt riski sairastua välikorvatulehdukseen, jonka vuoksi korvat suositellaan tutkittavaksi vähintään kerran vuodessa.
Krooninen munuaistauti
Kroonista munuaistautia sairastaville lapsille annostus on yksilöllinen ja se on säädettävä potilaan yksilöllisen hoitovasteen mukaan (ks. kohta Annostus ja antotapa). Kasvuhäiriö tulee kiistatta varmistaa ennen somatropiinihoidon aloittamista seuraamalla optimaalisesti hoidetun, munuaisten vajaatoimintaa sairastavan lapsen kasvua vähintään yhden vuoden ajan. Uremian konservatiiviseen hoitoon liittyvää tavanomaista lääkitystä ja tarvittaessa dialyysiä tulee jatkaa somatropiinihoidon aikana.
Kroonista munuaistautia sairastavien potilaiden munuaisten toiminta yleensä heikkenee taudin luonnollisen etenemisen seurauksena. Somatropiinihoidon aikana on kuitenkin varotoimena tarkkailtava munuaisten toiminnan liiallista vähenemistä tai glomerulaarisen filtraation nopeutumista (joka saattaa viitata hyperfiltraatioon).
Skolioosi
Skolioosin tiedetään olevan yleisempi joillakin potilasryhmillä, joita hoidetaan somatropiinilla, esimerkiksi Turnerin oireyhtymässä ja Noonanin oireyhtymässä. Lisäksi nopea kasvukausi kenellä tahansa lapsella saattaa aiheuttaa skolioosin etenemistä. Somatropiinin ei ole osoitettu lisäävän skolioositapauksia tai skolioosin vaikeusastetta. Skolioosin merkkejä on tarkkailtava hoidon aikana.
Verenglukoosi ja insuliini
Turner- ja SGA-lapsilta on suositeltavaa mitata insuliinin ja verenglukoosin paastoarvot ennen hoidon aloittamista ja vuosittain sen jälkeen. Potilaille, joilla on lisääntynyt riski sairastua diabetes mellitukseen (esim. lähisuvussa esiintynyt diabetes, liikalihavuus, vaikea insuliiniresistenssi, acanthosis nigricans), pitää tehdä oraalinen sokerirasituskoe (OGTT). Jos todetaan selkeä diabetes, somatropiinia ei pidä antaa.
Potilaiden glukoosin sietoa on tarkkailtava, koska somatropiini vaikuttaa hiilihydraattiaineenvaihduntaan.
IGF-1
Turner- ja SGA-lapsilta suositellaan mitattavaksi IGF-1-pitoisuus ennen hoidon aloittamista ja kaksi kertaa vuodessa sen jälkeen. Jos IGF-1-pitoisuus toistuvissa mittauksissa ylittää +2 SD verrattuna vastaavaan ikään ja puberteettiasteeseen, annosta on pienennettävä, jotta saavutetaan normaali IGF-1-taso.
Osa pituuskasvulisäyksestä, joka saavutetaan hoidettaessa lyhyitä SGA-lapsia kasvuhormonilla, saattaa hävitä, jos hoito lopetetaan ennen kuin loppupituus on saavutettu.
Aikuiset
Kasvuhormonin vajaus aikuisilla
Aikuisten kasvuhormonin vajaus on elinikäinen tauti ja hoitotarve on sen mukainen, mutta kokemuksia yli 60-vuotiaiden potilaiden hoidosta ja yli viisi vuotta jatkuneesta hoidosta on yhä rajoitetusti.
Aikuiset ja lapset
Pankreatiitti
Somatropiinilla hoidetuilla potilailla, joilla on vatsakipua, tulisi ottaa huomioon pankreatiitin mahdollisuus, vaikka sen esiintyminen on harvinaista. Tämä koskee erityisesti lapsia.
Yleistä
Kasvaimet
Uusien primaarisyöpien riskin lisääntymisestä somatropiinilla hoidetuilla lapsilla tai aikuisilla ei ole näyttöä.
Kasvaimesta tai pahanlaatuisesta sairaudesta täysin parantuneiden potilaiden somatropiinihoitoon ei ole liittynyt lisääntynyttä taudin uusiutumista.
Toiseen kasvaimeen sairastumisen vähäistä lisääntymistä yleisellä tasolla on havaittu lapsuudenaikaisesta syövästä parantuneilla, joita on hoidettu kasvuhormonilla, yleisimmin tämä on koskenut kallonsisäisiä kasvaimia. Tärkein riskitekijä toiselle kasvaimelle näyttää olevan aiempi altistuminen sädetykselle.
Pahanlaatuisesta sairaudesta täysin parantuneita potilaita on taudin mahdollisen uusiutumisen takia seurattava tarkasti sen jälkeen, kun somatropiinihoito on aloitettu.
Leukemia
Kasvuhormonin vajausta sairastavista potilaista pieni osa on sairastunut leukemiaan. Joitakin näistä potilaista on hoidettu somatropiinilla. Ei kuitenkaan ole näyttöä siitä, että leukemioiden määrä olisi lisääntynyt somatropiinia saavilla potilailla, joilla ei ole altistavia tekijöitä.
Hyvänlaatuinen kallonsisäisen paineen nousu
Jos potilaalla on vaikeaa tai toistuvaa päänsärkyä, näköhäiriöitä, pahoinvointia ja/tai oksentelua, suositellaan silmänpohjien tutkimusta papillaturvotuksen poissulkemiseksi. Jos papillaturvotus todetaan, hyvänlaatuisen intrakraniaalisen hypertension mahdollisuus tulee ottaa huomioon ja somatropiinihoito tulee tarvittaessa keskeyttää.
Toistaiseksi ei ole riittävää kokemusta ohjaamaan kliinistä päätöksentekoa hoidettaessa potilaita, joiden intrakraniaalinen hypertensio on hoidettu. Jos somatropiinihoito aloitetaan uudestaan, on välttämätöntä tarkkailla mahdollisia intrakraniaalisen hypertension oireita.
Potilaita, joiden kasvuhormonin vajaus on seuraus kallonsisäisestä leesiosta, tulee tutkia toistuvasti perussairauden etenemisen tai uusiutumisen poissulkemiseksi.
Kilpirauhasen toiminta
Somatropiini lisää kilpirauhasen ulkopuolisen T4:n muuttumista T3:ksi ja saattaa siten peittää alkavan kilpirauhasen vajaatoiminnan. Kilpirauhasen toimintaa on siksi tarkkailtava kaikilla potilailla. Aivolisäkkeen etulohkon vajaatoimintaa sairastavien potilaiden normaalia korvaushoitoa pitää seurata huolellisesti somatropiinihoidon aikana.
Potilaille, joilla on etenevä aivolisäkkeen sairaus, saattaa kehittyä hypotyreoosi.
Turnerin oireyhtymää sairastavilla potilailla on lisääntynyt riski saada primaarinen hypotyreoosi, johon liittyy kilpirauhasvasta-aineita. Koska hypotyreoosi vaikuttaa somatropiinin hoitovasteeseen, tulee potilaiden kilpirauhasen toiminta tutkia säännöllisin väliajoin ja tarvittaessa aloittaa kilpirauhashormonin korvaushoito.
Insuliiniherkkyys
Somatropiini voi vähentää insuliiniherkkyyttä, joten potilaita tulee tarkkailla glukoosi-intoleranssin varalta (ks. kohta Yhteisvaikutukset). Diabetes mellitusta sairastavilla potilailla insuliiniannosta voidaan joutua säätämään somatropiinihoidon aloittamisen jälkeen. Diabetesta tai glukoosi-intoleranssia sairastavia potilaita tulee tarkkailla huolellisesti somatropiinihoidon aikana.
Vasta-aineet
Kuten kaikilla somatropiinia sisältävillä valmisteilla, pienellä osalla potilaista voi kehittyä vasta-aineita somatropiinia kohtaan. Näiden vasta-aineiden sitoutumiskyky on heikko eikä niillä ole vaikutusta kasvuun. Jokaiselta potilaalta, jonka hoitovaste on puutteellinen, tulee tarkistaa somatropiinin vasta-aineet.
Akuutti lisämunuaisen vajaatoiminta
Somatropiinihoidon aloitus voi johtaa 11βHSD-1-estoon ja pienentyneeseen seerumin kortisolipitoisuuteen. Somatropiinilla hoidetuilla potilailla voi paljastua aikaisemmin havaitsematon sentraalinen (sekundaarinen) lisämunuaisen kuorikerroksen vajaatoiminta, joka vaatii glukokortikoidikorvaushoitoa. Lisäksi aiemmin todetun lisämunuaisen kuorikerroksen vajaatoiminnan vuoksi glukokortikoideilla hoidetut potilaat saattavat tarvita ylläpito- tai stressitilanneannoksen suurentamista somatropiinihoidon aloittamisen jälkeen (ks. kohta Yhteisvaikutukset).
Käyttö oraalisen estrogeenihoidon kanssa
Jos somatropiinia käyttävä nainen aloittaa oraalisen estrogeenihoidon, somatropiinin annosta saatetaan joutua suurentamaan, jotta seerumin IGF-1-pitoisuuden normaali iänmukainen vaihteluväli säilyy. Somatropiiniannosta voidaan sitä vastoin joutua pienentämään, jos somatropiinia käyttävä nainen lopettaa oraalisen estrogeenihoidon, jotta vältetään liian suuri kasvuhormonipitoisuus ja/tai haittavaikutukset (ks. kohta Yhteisvaikutukset).
Reisiluun pään epifysiolyysi
Reisiluun pään (lonkan) epifysiolyysiä saattaa esiintyä muuta väestöä useammin potilailla, joilla on umpierityksen häiriö mukaan lukien kasvuhormonin vajaus. Lääkärin pitää tutkia somatropiinilla hoidettu potilas, joka alkaa ontua tai valittaa lonkka- tai polvikipua.
Kokemukset kliinisistä tutkimuksista
Kahdessa lumelääkekontrolloidussa kliinisessä tutkimuksessa havaittiin lisääntynyttä kuolleisuutta potilailla, joilla oli akuutteja, tehohoitoa vaativia komplikaatioita, jotka johtuivat avosydänleikkauksesta, vatsan alueen leikkauksesta, tapaturmaisesta monivammasta tai akuutista hengitysvajauksesta. Näissä kahdessa tutkimuksessa tutkittiin tehohoitoyksikköjen potilaita, joita hoidettiin suurilla somatropiiniannoksilla (5,3–8 mg/vrk). Somatropiinihoidon jatkamisen turvallisuutta ei ole osoitettu potilailla, joille samanaikaisesti kehittyi näitä sairauksia heidän saadessaan hormonia korvaavia hoitoannoksia hyväksyttyihin indikaatioihin. Sen vuoksi somatropiinihoidon jatkamisesta saatava mahdollinen hyöty on punnittava mahdollisiin riskeihin nähden potilailla, joilla on akuutti, tehohoitoa vaativa tila.
Yhdessä avoimessa, satunnaistetussa kliinisessä tutkimuksessa (annosalue 0,045–0,090 mg/kg/vrk) Turnerin oireyhtymää sairastavilla potilailla todettiin viitteitä lisääntyneestä riskistä saada ulko- ja välikorvatulehdus. Riski oli annoksesta riippuvainen eikä korvatulehdusten lisääntyminen johtanut useampiin korvien toimenpiteisiin/tärykalvoputkien laittoon kuin tutkimuksen matalampiannoksisella ryhmälläkään.
Apuaineet
Norditropin sisältää alle 1 mmol (23 mg) natriumia per 1,5 ml eli sen voidaan sanoa olevan ”natriumiton”
Yhteisvaikutukset
Samanaikainen glukokortikoidihoito heikentää Norditropin-valmisteen kasvua edistävää vaikutusta. ACTH-puutoksesta kärsivien potilaiden korvaushoidon glukokortikoidiannostus tulisi säätää huolellisesti kasvua heikentävän vaikutuksen välttämiseksi.
Kasvuhormoni vähentää kortisonin muuttumista kortisoliksi ja saattaa paljastaa aikaisemmin havaitsemattoman sentraalisen lisämunuaisen kuorikerroksen vajaatoiminnan tai johtaa pienten glukokortikoidikorvaushoidon annosten tehottomuuteen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Oraalista estrogeenikorvaushoitoa käyttävät naiset saattavat tarvita suuremman kasvuhormoniannoksen, jotta hoidon tavoite saavutetaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Tulokset yhteisvaikutustutkimuksesta, johon osallistui kasvuhormonin vajausta sairastavia aikuisia, viittaavat siihen, että somatropiinin anto voi lisätä tunnetusti sytokromi P450-isoentsyymien kautta metaboloituvien yhdisteiden puhdistumaa. Erityisesti sytokromi P450 3A4 -entsyymin kautta metaboloituvien yhdisteiden (esim. sukupuolisteroidit, kortikosteroidit, kouristuslääkkeet ja siklosporiini) puhdistuma voi suurentua ja siten niiden pitoisuus plasmassa voi pienentyä. Kliinistä merkitystä ei tiedetä.
Somatropiinin tehoon loppupituuden suhteen voi myös vaikuttaa muu samanaikainen hormonihoito, esim. gonadotropiini, anaboliset steroidit, estrogeeni ja kilpirauhashormoni.
Diabeetikon insuliiniannosta voidaan joutua säätämään sen jälkeen kun somatropiinihoito on aloitettu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Raskaus
Riittäviä eläinkokeita vaikutuksista raskauteen, alkion- ja sikiönkehitykseen, synnytykseen tai syntymänjälkeiseen kehitykseen ei ole tehty. Kliinistä tietoa altistuksesta raskauden aikana ei ole. Sen vuoksi somatropiinivalmisteita ei suositella käytettäväksi raskauden aikana eikä hedelmällisessä iässä oleville naisille, jotka eivät käytä ehkäisyä.
Imetys
Kliinisiä tutkimuksia somatropiinivalmisteiden käytöstä imettävillä naisilla ei ole tehty. Ei tiedetä erittyykö somatropiini ihmisen rintamaitoon. Sen vuoksi on noudatettava varovaisuutta kun somatropiinivalmisteita annetaan imettäville naisille.
Hedelmällisyys
Norditropin-valmisteiden vaikutuksia hedelmällisyyteen ei ole tutkittu.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Norditropin NordiFlex -valmisteella ei ole haitallista vaikutusta tai on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Kasvuhormonin vajausta sairastaville potilaille on tyypillistä solun ulkoisen tilavuuden vajaus. Tämä vajaus korjaantuu kun somatropiinihoito aloitetaan. Nesteen kertymistä ja tästä johtuvaa perifeeristä turvotusta saattaa esiintyä varsinkin aikuisilla. Rannekanavaoireyhtymä on epätavallinen, mutta saattaa tulla aikuisille. Oireet ovat yleensä ohimeneviä ja annoksesta riippuvia, ja saattavat vaatia väliaikaista annoksen pienentämistä. Myös lievää nivelkipua, lihaskipua ja parestesiaa saattaa esiintyä, mutta ne ovat yleensä itsestään ohimeneviä.
Lapsilla haittavaikutukset ovat melko harvinaisia tai harvinaisia.
Kliinisistä tutkimuksista saadut tiedot:
Elinjärjestelmät | Hyvin yleinen (≥ 1/10) | Yleinen (≥ 1/100, ˂ 1/10) | Melko harvinainen (≥ 1/1 000, ˂ 1/100) | Harvinainen (≥ 1/10 000, ˂ 1/1 000) |
Aineenvaihdunta ja ravitsemus | Aikuisilla diabetes mellitus tyyppi 2 | |||
Hermosto | Aikuisilla päänsärky ja parestesia | Aikuisilla rannekanavaoireyhtymä. | ||
Iho ja ihonalainen kudos | Aikuisilla pruritus | Lapsilla ihottuma | ||
Luusto, lihakset ja sidekudos | Aikuisilla nivelkipu, niveljäykkyys ja lihaskipu | Aikuisilla lihasjäykkyys | Lapsilla nivel- ja lihaskipu | |
| Sukupuolielimet ja rinnat | Aikuisilla ja lapsilla gynekomastia | |||
Yleisoireet ja antopaikassa todettavat haitat | Aikuisilla perifeerinen turvotus (ks. edellä) | Aikuisilla ja lapsilla kipu pistoskohdassa. | Lapsilla perifeerinen turvotus |
Turnerin oireyhtymää sairastavilla lapsilla on somatropiinihoidon aikana raportoitu lisääntynyttä käsien ja jalkojen kasvua.
Yhdessä avoimessa, satunnaistetussa kliinisessä tutkimuksessa Turner-potilailla, joita hoidettiin isoilla Norditropin-annoksilla, todettiin viitteitä lisääntyneistä välikorvatulehduksista. Korvatulehdusten lisääntyminen ei kuitenkaan johtanut useampiin korvatoimenpiteisiin/tärykalvoputken laittoihin kuin matalampiannoksisessa ryhmässäkään.
Kauppaantuonnin jälkeiset kokemukset:
Edellämainittujen haittavaikutuksen lisäksi alla on spontaanisti raportoituja haittavaikutuksia, joiden voidaan yleisesti katsoa mahdollisesti liittyvän Norditropin-hoitoon. Saatavissa oleva tieto ei riitä näiden haittavaikutusten yleisyyden arviointiin:
- Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit): Leukemiaa on raportoitu muutamilla kasvuhormonin vajausta sairastavilla potilailla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Immuunijärjestelmä: Yliherkkyys (ks. kohta Vasta-aiheet). Vasta-aineiden muodostuminen somatropiinia vastaan. Näiden vasta-aineiden tiitterit ja sitoutumiskyky ovat olleet hyvin alhaisia eivätkä ne ole vaikuttaneet Norditropin-hoidon aikaansaamaan pituuskasvuun
- Umpieritys: Kilpirauhasen vajaatoiminta. Seerumin tyroksiinipitoisuuden lasku (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Aineenvaihdunta: Hyperglykemia (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Hermosto: Hyvänlaatuinen kallonsisäisen paineen nousu (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Luusto, lihakset ja sidekudos: Legg-Calvé-Perthesin tauti. Legg-Calvé-Perthesin tautia saattaa esiintyä useammin lyhytkasvuisilla potilailla
- Tutkimukset: Veren alkalisen fosfataasin nousu.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty‐haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www‐sivusto: www.fimea.fi
Lääkealan turvallisuus‐ ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 Fimea
Yliannostus
Akuutti yliannostus voi aluksi aiheuttaa alentuneita verenglukoosipitoisuuksia ja myöhemmin kohonneita verenglukoosipitoisuuksia. Alentuneet verenglukoosipitoisuudet on todettu biokemiallisesti, mutta hypoglykemian kliinisiä merkkejä ei ole havaittu. Pitkäaikainen yliannostus voi aiheuttaa ihmisen kasvuhormonin ylituotannon yhteydessä esiintyviä merkkejä ja oireita.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Somatropiini ja somatropiiniagonistit. ATC: H01AC01.
Vaikutusmekanismi
Norditropin NordiFlex sisältää somatropiinia, joka on yhdistelmä-DNA-tekniikalla valmistettua ihmisen kasvuhormonia. Se on anabolinen peptidi, jossa on 191 aminohappoa. Aminohappoja stabiloi kaksi disulfidisiltaa. Kasvuhormonin molekyylipaino on noin 22 000 Daltonia.
Somatropiinin tärkeimpiä vaikutustapoja ovat luuston ja somaattisen kasvun stimulointi ja selvä vaikutus kehon aineenvaihduntaan.
Farmakodynaamiset vaikutukset
Kasvuhormonin vajausta hoidettaessa lihasmassan ja rasvakudoksen määrät normalisoituvat eli lihasmassa lisääntyy ja rasvakudos vähentyy.
Suurin osa somatropiinin vaikutuksista välittyy insuliininkaltaisen kasvutekijä 1:n (IGF-1) kautta. IGF-1:tä syntyy kaikissa kudoksissa, eniten maksassa.
Enemmän kuin 90 % IGF-1:stä sitoutuu sitojaproteiineihin (IGFBP), joista IGFBP-3 on tärkein.
Hormonin lipolyyttinen ja proteiineja säästävä vaikutus on erityisen tärkeää elimistön rasitustiloissa.
Somatropiini nopeuttaa luukudoksen uudelleenmuodostumista nostaen edelleen biokemiallisten merkkiaineiden pitoisuutta seerumissa. Aikuisten luun tiheys pienenee hieman somatropiinihoidon ensimmäisten kuukausien aikana lisääntyneen luun resorption seurauksena, pitkäaikainen hoito kuitenkin lisää luun tiheyttä.
Kliininen teho ja turvallisuus
Kliinisissä tutkimuksissa lyhyiden lasten, jotka ovat syntyneet gestaatioikään nähden pienikokoisina, hoidossa käytettiin annoksia 0,033 ja 0,067 mg/kg/vrk, kunnes loppupituus saavutettiin. Jatkuvassa hoidossa olleilla 56 potilaalla, jotka saavuttivat (lähes) loppupituuden, keskimääräinen muutos pituudessa verrattuna pituuteen hoidon alussa oli +1,90 SDS (0,033 mg/kg/vrk) ja +2,19 SDS (0,067 mg/kg/vrk). Kirjallisuustiedoissa sellaisilla SGA-lapsilla, joilla ei ole aikaista spontaania kiinniottokasvua ja joita ei ole hoidettu, arvioidaan 0,5 SDS myöhäiskasvua. Pitkäaikaistietoja turvallisuudesta on vielä rajoitetusti.
Kasvua edistävä vaikutus havaittiin 104 viikon (ensisijainen päätemuuttuja) ja 208 viikon hoidon jälkeen, kun Norditropin-valmistetta annettiin kerran vuorokaudessa 0,033 mg/kg/vrk ja 0,066 mg/kg/vrk 51 lapselle, jotka olivat 3 – < 11‑vuotiaita ja Noonanin oireyhtymän vuoksi lyhytkasvuisia.
Keskimääräisen pituuden SDS:n havaittiin suurentuneen lähtötilanteeseen verrattuna tilastollisesti merkitsevästi 104 viikon kohdalla (ensisijainen päätemuuttuja) käytettäessä annoksia 0,033 mg/kg/vrk (0,84 SDS) ja 0,066 mg/kg/vrk (1,47 SDS). Ryhmien välillä 104 viikon kohdalla havaittu keskimääräinen ero oli 0,63 SDS [95 %:n luottamusväli: 0,38; 0,88]. Ero oli suurempi 208 viikon kuluttua, jolloin keskimääräinen ero oli 0,99 SDS [95 %:n luottamusväli: 0,62; 1,36] (kuva 1).
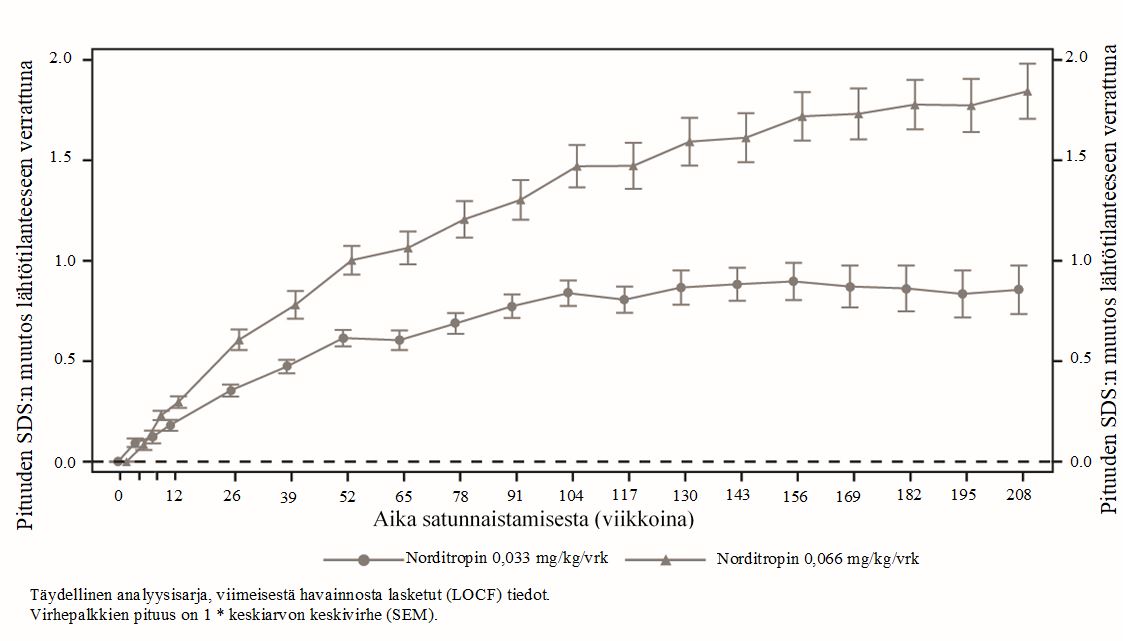
Kuva 1 Pituuden SDS:n (kansallinen) muutos lähtötilanteesta viikkoon 208
Keskimääräinen kasvunopeus ja kasvunopeuden SDS suurenivat huomattavasti lähtötilanteesta ensimmäisen hoitovuoden aikana, ja ne suurenivat enemmän käytettäessä annosta 0,066 mg/kg/vrk kuin annosta 0,033 mg/kg/vrk. Keskimääräisen kasvunopeuden SDS oli edelleen yli 0 molemmissa ryhmissä kahden vuoden hoidon jälkeen ja myös neljän vuoden hoidon jälkeen ryhmässä, jossa annos oli 0,066 mg/kg/vrk. Kasvunopeuden SDS oli suurempi käytettäessä annosta 0,066 mg/kg/vrk kuin annosta 0,033 mg/kg/vrk koko tutkimusjakson ajan (kuva 2).
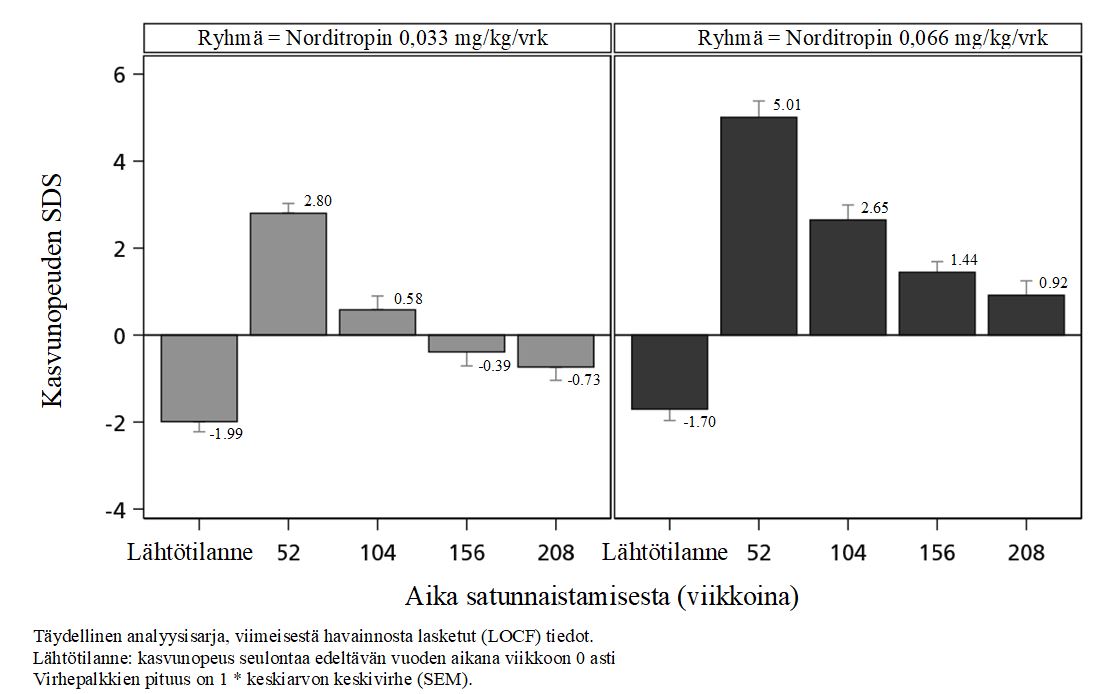
Kuva 2 Kasvunopeuden SDS (kansallinen) lähtötilanteesta viikkoon 208
Loppupituustiedot saatiin 24 lapsipotilaasta (18 osallistui kahden vuoden mittaiseen prospektiiviseen, avoimeen, satunnaistettuun, rinnakkaisryhmillä toteutettuun tutkimukseen ja kuusi oli noudattanut tutkimussuunnitelmaa ilman satunnaistamista). Kahden vuoden mittaisen prospektiivisen tutkimuksen jälkeen Norditropin-hoitoa jatkettiin loppupituuden saavuttamiseen asti. Hoidon päätyttyä suurin osa tutkittavista (16/24) oli saavuttanut loppupituuden, joka oli normaalin pituuden kansallisella viitealueella (> 2 SDS).
Farmakokinetiikka
Norditropin-valmisteen i.v.-infuusiota (33 ng/kg/min 3 tunnin ajan) seurattiin yhdeksältä kasvuhormonin vajausta sairastavalta potilaalta seuraavin tuloksin: Seerumin puoliintumisaika oli 21,1 ± 1,7 min, metabolinen puhdistuma oli 2,33 ± 0,58 ml/kg/min ja jakautumistila 67,6 ± 14,6 ml/kg.
Norditropin SimpleXx -valmisteen (Norditropin SimpleXx on Norditropin NordiFlex -valmisteen injektionestettä sisältävä sylinteriampulli) s.c.-injektiota (2,5 mg/m2) seurattiin 31 terveeltä koehenkilöltä (endogeenisen somatropiinin vaikutus estettiin jatkuvalla somatostatiinin infuusiolla) seuraavin tuloksin: Ihmisen kasvuhormonin huippupitoisuus (42–46 ng/ml) saavutettiin noin 4 tunnin kuluttua. Sen jälkeen ihmisen kasvuhormonin pitoisuus laski ja puoliintumisaika oli noin 2,6 tuntia. Lisäksi, kun kasvuhormonia annettiin terveille koehenkilöille ihonalaisena injektiona, Norditropin SimpleXx -valmisteen eri vahvuuksien osoitettiin olevan biologisesti samanarvoisia keskenään ja käyttökuntoon saatettavan Norditropin-valmisteen kanssa.
Prekliiniset tiedot turvallisuudesta
Norditropin SimpleXx -valmisteen yleisiä farmakologisia vaikutuksia hiirien ja rottien keskushermostoon, sydän- ja verenkiertojärjestelmään ja hengityselimistöön tutkittiin tuotteen nopeutetun tai normaalin hajoamisen yhteydessä. Myös munuaisten toimintaa tutkittiin. Hajoamistuotteen, Norditropin SimpleXx- ja Norditropin-valmisteen vaikutuksissa ei ollut eroja. Kaikki kolme vähensivät virtsan määrää ja natrium- ja kloridi-ionien kertymistä ja tämä väheneminen riippui odotetusti annoksen suuruudesta.
Norditropin SimpleXx- ja Norditropin-valmisteiden samanlainen farmakokinetiikka on osoitettu rotilla tehdyissä tutkimuksissa. Myös Norditropin SimpleXx -valmisteen hajoamistuote ja Norditropin SimpleXx olivat biologisesti samanarvoisia.
Norditropin SimpleXx -valmisteen ja hajoamistuotteen kerta-annoksella ja toistuvalla annoksella suoritetuissa toksisuuskokeissa sekä paikallista siedettävyyttä määrittävissä kokeissa ei todettu toksista vaikutusta tai lihaskudosvaurioita.
Poloksameeri 188 -apuaineen toksisuus on tutkittu hiirillä, rotilla, kaniineilla ja koirilla, eikä toksikologisesti merkittäviä vaikutuksia todettu.
Poloksameeri 188 imeytyi nopeasti pistoskohdasta eikä annoksen merkittävää kerääntymistä pistoskohtaan havaittu. Poloksameeri 188 erittyi pääosin virtsan kautta.
Norditropin SimpleXx on Norditropin NordiFlex-valmisteen injektionestettä sisältävä sylinteriampulli.
Farmaseuttiset tiedot
Apuaineet
Mannitoli, histidiini, poloksameeri 188, fenoli, injektionesteisiin käytettävä vesi, kloorivetyhappo pH:n säätöön, natriumhydroksidi pH:n säätöön
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
2 vuotta.
Ensimmäisen avaamisen jälkeen: säilytä enintään 4 viikkoa jääkaapissa (2 °C - 8 °C).
Vaihtoehtoisesti valmistetta voidaan säilyttää enintään 3 viikkoa alle 25 °C:ssa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C) ulkopakkauksessa. Herkkä valolle. Ei saa jäätyä. Älä säilytä lähellä pakastelokeroa tai takaseinän kylmälevyä.
Avatun lääkevalmisteen säilytys, ks. kohta Kestoaika. Ei saa jäätyä.
Käyttöönoton jälkeen laita kynän suojus aina pistoksen jälkeen paikoilleen Norditropin NordiFlex esitäytettyyn kynään. Käytä jokaisella pistoskerralla aina uutta neulaa.
Neula ei saa olla kiinnitettynä kynään, kun kynä ei ole käytössä.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
NORDITROPIN NORDIFLEX injektioneste, liuos, esitäytetty kynä
5 mg/1,5 ml 1,5 ml (132,83 €)
10 mg/1,5 ml 1,5 ml (251,63 €)
15 mg/1,5 ml 1,5 ml (369,88 €)
PF-selosteen tieto
Norditropin NordiFlex 5 mg/1,5 ml on kertakäyttöinen, esitäytetty moniannoskynä. Muovisen annostelukynän sisällä on pysyvästi kynään kiinnitetty sylinteriampulli (tyypin I väritöntä lasia). Sylinteriampulli on pohjasta suljettu männäksi muotoillulla tulpalla (tyypin I kumisuljin) ja päältä pyöreällä, levymäisellä, laminoidulla tulpalla (tyypin I kumisuljin). Sylinteriampulli on sinetöity alumiinisuojuksella. Annostelukynän painonuppi on oranssi. Pakkauskoot: 1 esitäytetty kynä, kerrannaispakkaus 5 x 1 esitäytettyä kynää ja kerrannaispakkaus 10 x 1 esitäytettyä kynää. Kaikkia pakkauksia ei välttämättä ole myynnissä.
Norditropin NordiFlex 10 mg/1,5 ml on kertakäyttöinen, esitäytetty moniannoskynä. Muovisen annostelukynän sisällä on pysyvästi kynään kiinnitetty sylinteriampulli (tyypin I väritöntä lasia). Sylinteriampulli on pohjasta suljettu männäksi muotoillulla tulpalla (tyypin I kumisuljin) ja päältä pyöreällä, levymäisellä, laminoidulla tulpalla (tyypin I kumisuljin). Sylinteriampulli on sinetöity alumiinisuojuksella. Annostelukynän painonuppi on sininen. Pakkauskoot: 1 esitäytetty kynä, kerrannaispakkaus 5 x 1 esitäytettyä kynää ja kerrannaispakkaus 10 x 1 esitäytettyä kynää. Kaikkia pakkauksia ei välttämättä ole myynnissä.
Norditropin NordiFlex 15 mg/1,5 ml on kertakäyttöinen, esitäytetty moniannoskynä. Muovisen annostelukynän sisällä on pysyvästi kynään kiinnitetty sylinteriampulli (tyypin I väritöntä lasia). Sylinteriampulli on pohjasta suljettu männäksi muotoillulla tulpalla (tyypin I kumisuljin) ja päältä pyöreällä, levymäisellä, laminoidulla tulpalla (tyypin I kumisuljin). Sylinteriampulli on sinetöity alumiinisuojuksella. Annostelukynän painonuppi on vihreä. Pakkauskoot: 1 esitäytetty kynä, kerrannaispakkaus 5 x 1 esitäytettyä kynää ja kerrannaispakkaus 10 x 1 esitäytettyä kynää. Kaikkia pakkauksia ei välttämättä ole myynnissä.
Esitäytetty kynä on pakattu pahvikoteloon.
Valmisteen kuvaus:
Kirkas, väritön liuos
Käyttö- ja käsittelyohjeet
Norditropin NordiFlex on esitäytetty kynä, joka on suunniteltu käytettäväksi enintään 8 mm pituisten NovoFine- tai NovoTwist-kertakäyttöneulojen kanssa.
Norditropin NordiFlex 5 mg/1,5 ml annostelee enintään 1,5 mg somatropiinia annosta kohden ja annokset voidaan valita 0,025 mg välein.
Norditropin NordiFlex 10 mg/1,5 ml annostelee enintään 3,0 mg somatropiinia annosta kohden ja annokset voidaan valita 0,050 mg välein.
Norditropin NordiFlex 15 mg/1,5 ml annostelee enintään 4,5 mg somatropiinia annosta kohden ja annokset voidaan valita 0,075 mg välein.
Oikean annostuksen varmistamiseksi ja jotta vältettäisiin pistämästä ilmaa, kasvuhormonin ulosvirtaus on tarkistettava ennen ensimmäistä pistosta. Norditropin NordiFlex -kynää ei saa käyttää, jos neulan kärkeen ei ilmesty kasvuhormonipisaraa. Annos valitaan kääntämällä annosvalitsinta, kunnes haluttu annos näkyy annoksen näyttöikkunassa. Jos valitaan väärä annos, se voidaan korjata kääntämällä annosvalitsinta vastakkaiseen suuntaan. Annos pistetään painamalla painonuppia.
Norditropin NordiFlex-valmistetta ei saa ravistella voimakkaasti missään vaiheessa.
Norditropin NordiFlex-valmistetta ei saa käyttää, jos kasvuhormoniliuos on sameaa tai värjäytynyt. Tarkista tämä kääntämällä kynä ylösalaisin kerran tai kahdesti.
Käyttämätön valmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
NORDITROPIN NORDIFLEX injektioneste, liuos, esitäytetty kynä
5 mg/1,5 ml 1,5 ml
10 mg/1,5 ml 1,5 ml
15 mg/1,5 ml 1,5 ml
- Ylempi erityiskorvaus (100 %). Kasvuhormoni: Lapsille kasvuiässä aivolisäkkeen etulohkon vajaatoiminnassa sekä munuaisten vajaatoimintaan liittyvän kasvuhäiriön hoito erityisin edellytyksin (186).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Kasvuhormoni: Lasten vaikeat kasvuhäiriöt ja aikuisten vaikea kasvuhormonin puute erityisin edellytyksin (301).
ATC-koodi
H01AC01
Valmisteyhteenvedon muuttamispäivämäärä
25.02.2022
Yhteystiedot
 NOVO NORDISK FARMA OY
NOVO NORDISK FARMA OY Linnoitustie 6
02600 Espoo
020 762 5300
www.novonordisk.fi
