TAFINLAR kapseli, kova 50 mg, 75 mg
Vaikuttavat aineet ja niiden määrät
Tafinlar 50 mg kovat kapselit
Yksi kova kapseli sisältää dabrafenibimesilaattia määrän, joka vastaa 50 mg dabrafenibia.
Tafinlar 75 mg kovat kapselit
Yksi kova kapseli sisältää dabrafenibimesilaattia määrän, joka vastaa 75 mg dabrafenibia.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Kova kapseli (kapseli).
Kliiniset tiedot
Käyttöaiheet
Melanooma
Dabrafenibi on tarkoitettu käytettäväksi joko ainoana lääkkeenä tai yhdessä trametinibin kanssa BRAF V600 mutaatiopositiivisen melanooman hoitoon aikuispotilaille, joiden tauti on metastasoitunut tai jos kasvain ei ole kirurgisesti poistettavissa (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Melanooman liitännäishoito
Dabrafenibi on tarkoitettu yhdessä trametinibin kanssa kirurgisesti kokonaan poistetun asteen III BRAF V600 mutaatiopositiivisen melanooman liitännäishoitoon aikuispotilaille.
Ei‑pienisoluinen keuhkosyöpä
Dabrafenibi on tarkoitettu yhdessä trametinibin kanssa edenneen BRAF V600 mutaatiopositiivisen ei‑pienisoluisen keuhkosyövän hoitoon aikuispotilaille.
Ehto
Hoidon aloittavan ja hoitoa seuraavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön.
Annostus ja antotapa
Syövän hoitoon perehtyneen lääkärin on aloitettava dabrafenibihoito ja valvottava sen toteuttamista.
Kasvaimen BRAF V600 ‑mutaatio on vahvistettava validoidulla testillä ennen dabrafenibihoidon aloittamista.
Dabrafenibin tehoa ja turvallisuutta ei ole varmistettu villityypin BRAF‑geeniä ilmentävän melanooman eikä villityypin BRAF‑geeniä ilmentävän ei‑pienisoluisen keuhkosyövän hoidossa. Dabrafenibiä ei pidä käyttää, jos potilaalla on villityypin BRAF‑geeniä ilmentävä melanooma tai villityypin BRAF‑geeniä ilmentävä ei‑pienisoluinen keuhkosyöpä (ks. kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Farmakodynamiikka).
Annostus
Suositeltu dabrafenibiannos, käytettäessä joko ainoana lääkkeenä tai yhdessä trametinibin kanssa, on 150 mg (kaksi 75 mg:n kapselia) kahdesti vuorokaudessa (mikä vastaa 300 mg:n kokonaisvuorokausiannosta). Suositeltu trametinibiannos yhdistelmähoidossa dabrafenibin kanssa on 2 mg kerran vuorokaudessa.
Hoidon kesto
Hoitoa jatketaan, kunnes potilas ei enää hyödy hoidosta tai ilmaantuu kestämättömiä haittavaikutuksia (ks. taulukko 2). Melanooman liitännäishoidossa hoidon kesto on 12 kuukautta, jollei tauti puhkea uudelleen tai jollei ilmaannu ei-hyväksyttäviä haittavaikutuksia.
Annoksen unohtuminen
Jos dabrafenibiannos unohtuu, sitä ei pidä ottaa, jos seuraavaan aikataulun mukaiseen annokseen on alle 6 tuntia.
Jos trametinibiannos unohtuu, kun dabrafenibia käytetään yhdessä trametinibin kanssa, trametinibiannos voidaan ottaa vain, jos seuraavaan aikataulun mukaiseen annokseen on yli 12 tuntia.
Annoksen sovittaminen
Dabrafenibikapseleista on saatavana kaksi vahvuutta, 50 mg ja 75 mg, joiden avulla annosta voidaan tarvittaessa sovittaa tehokkaasti.
Haittavaikutukset saattavat vaatia hoidon keskeyttämistä, annoksen pienentämistä tai hoidon lopettamista (ks. taulukot 1 ja 2).
Annoksen sovittamista tai hoidon keskeyttämistä ei suositella, jos potilaalle ilmaantuu haittavaikutuksena ihon okasolusyöpä (ihon levyepiteelikarsinooma) tai uusi primaarimelanooma (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Annoksen sovittaminen ei ole tarpeen uveiitin hoidossa, mikäli paikallishoidot ovat riittäviä hillitsemään silmätulehdusta. Mikäli silmän paikallishoidolla ei saada riittävää vastetta uveiitin hoidolle, dabrafenibi‑hoito keskeytetään kunnes silmätulehdusoireet ovat hävinneet. Dabrafenibi‑hoitoa voidaan tällöin jatkaa yhden annostason laskulla (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Suositellut annosmuutokset ja annoksen sovittamista koskeva ohjeistus ovat taulukoissa 1 ja 2.
Taulukko 1 Suositellut pienennetyt annostasot
Annostaso | Dabrafenibiannos Käytettäessä ainoana lääkkeenä tai yhdessä trametinibin kanssa | Trametinibiannos* Vain käytettäessä yhdessä dabrafenibin kanssa |
Aloitusannos | 150 mg kahdesti vuorokaudessa | 2 mg kerran vuorokaudessa |
1. pienennetty annos | 100 mg kahdesti vuorokaudessa | 1,5 mg kerran vuorokaudessa |
2. pienennetty annos | 75 mg kahdesti vuorokaudessa | 1 mg kerran vuorokaudessa |
3. pienennetty annos | 50 mg kahdesti vuorokaudessa | 1 mg kerran vuorokaudessa |
Dabrafenibiannoksen pienentämistä alle 50 mg:aan kahdesti vuorokaudessa ei suositella riippumatta siitä, käytetäänkö sitä ainoana lääkkeenä vai yhdessä trametinibin kanssa. Trametinibiannoksen pienentämistä alle 1 mg:aan kerran vuorokaudessa ei suositella, kun lääkettä käytetään yhdessä dabrafenibin kanssa. *Trametinibimonoterapian annosteluohjeet, ks. trametinibin valmisteyhteenveto, Annostus ja Antotapa. | ||
Taulukko 2 Annoksen sovittaminen haittavaikutusten vaikeusasteen mukaan (kuumetta lukuun ottamatta)
Vaikeusaste (CTCAE)* | Suositeltu dabrafenibiannoksen sovittaminen Käytettäessä ainoana lääkkeenä tai yhdessä trametinibin kanssa |
1. tai 2. aste (siedettävissä) | Hoitoa jatketaan ja potilaan tilaa seurataan kliinisen tilanteen mukaan. |
2. aste (kestämätön) tai 3. aste | Hoito keskeytetään, kunnes vaikeusaste on laskenut tasolle 0–1. Hoitoa jatketaan yhtä annostasoa pienemmällä annoksella. |
4. aste | Hoito lopetetaan pysyvästi tai keskeytetään, kunnes vaikeusaste on laskenut tasolle 0–1. Hoitoa jatketaan yhtä annostasoa pienemmällä annoksella. |
*Kliinisten haittavaikutusten vaikeusaste on määritetty CTCAE‑kriteerien (Common Terminology Criteria for Adverse Events) mukaan. | |
Kun potilaan haittavaikutukset on saatu tehokkaasti hallintaan, voidaan harkita annoksen nostamista uudelleen samojen annostasojen kautta kuin annosta pienennettäessä. Dabrafenibiannostus ei saa ylittää tasoa 150 mg kahdesti vuorokaudessa.
Kuume
Hoito on keskeytettävä, jos potilaan ruumiinlämpö on ≥38 °C (dabrafenibin monoterapia ja molemmat dabrafenibi ja trametinibi yhdistelmähoidon yhteydessä). Kuumeilun toistuessa, hoito voidaan keskeyttää myös ensimmäisten kuumeen oireiden ilmaannuttua. Hoito kuumelääkkeillä, kuten ibuprofeenilla tai parasetamolilla on aloitettava. Oraalisten kortikosteroidien käyttöä on harkittava tapauksissa, joissa kuumelääkkeet ovat riittämättömiä. Potilaan infektio‑oireet ja ‑löydökset on arvioitava ja tarvittaessa hoidettava paikallisten hoitokäytäntöjen mukaan (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Dabrafenibin monoterapia tai dabrafenibin ja trametinibin yhdistelmähoito on aloitettava uudelleen kun potilas on ollut oireeton vähintään 24 tunnin ajan joko (1) samalla annoksella, tai (2) yhtä pienemmällä annoksella, jos kuume oli toistuvaa ja/tai siihen liittyi muita vaikeita oireita kuten nestehukka, verenpaineen lasku tai munuaisten vajaatoiminta.
Jos dabrafenibin ja trametinibin yhdistelmän käytön aikana esiintyy hoitoon liittyviä haittoja, molempien annosta on pienennettävä samanaikaisesti tai hoidot on keskeytettävä tai lopetettava. Poikkeustapaukset, joissa vain toisen valmisteen annoksen muuttaminen on tarpeen, on esitetty jäljempänä seuraavien haittojen yhteydessä: uveiitti, muut RAS‑mutaatiopositiiviset syövät kuin ihosyöpä (liittyy ensisijaisesti dabrafenibiin), vasemman kammion ejektiofraktion pieneneminen, verkkokalvon laskimotukos, verkkokalvon pigmenttiepiteelin irtauma ja interstitiaalinen keuhkosairaus/pneumoniitti (liittyy ensisijaisesti trametinibiin).
Annosmuutoksia koskevat poikkeukset (kun vain toisen valmisteen annosta pienennetään) valikoitujen haittavaikutusten osalta
Uveiitti
Annosta ei tarvitse muuttaa uveiitin takia, jos silmätulehdus saadaan pidettyä hallinnassa tehokkailla paikallishoidoilla. Jos uveiitti ei reagoi silmän paikalliseen hoitoon, dabrafenibihoito on tauotettava, kunnes silmätulehdus on parantunut, ja aloitettava uudelleen yhtä annostasoa pienemmällä annoksella. Trametinibin annosta ei tarvitse muuttaa yhdistelmähoidossa dabrafenibin kanssa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Muut RAS‑mutaatiopositiiviset syövät kuin ihosyöpä
Hyötyjä ja riskejä on punnittava ennen dabrafenibihoidon jatkamista, jos potilaalla on muu RAS‑mutaatiopositiivinen syöpä kuin ihosyöpä. Trametinibin annosta ei ole tarpeen muuttaa yhdistelmähoidossa dabrafenibin kanssa.
Vasemman kammion ejektiofraktion (LVEF) pieneneminen / vasemman kammion toimintahäiriö
Jos dabrafenibia käytetään yhdistelmähoitona trametinibin kanssa ja jos potilaalla todetaan oireeton, > 10 %:n absoluuttinen vasemman kammion ejektiofraktion lasku lähtötasoon verrattuna ja ejektiofraktio alittaa hoitolaitoskohtaisen viitealueen alarajan, katso trametinibin annosmuutosohjeet trametinibin valmisteyhteenvedosta (ks. kohta Annostus ja antotapa). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa.
Verkkokalvon laskimotukos ja verkkokalvon pigmenttiepiteelin irtauma
Jos potilas ilmoittaa uusista näköhäiriöistä, kuten keskeisen näön heikkenemisestä, näön hämärtymisestä tai näön menetyksestä, milloin tahansa dabrafenibin ja trametinibin yhdistelmähoidon aikana, katso trametinibin annosmuutosohjeet trametinibin valmisteyhteenvedosta (ks. kohta Annostus ja antotapa). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa vahvistetun verkkokalvon laskimotukoksen tai verkkokalvon pigmenttiepiteelin irtauman takia.
Interstitiaalinen keuhkosairaus/pneumoniitti
Jos dabrafenibia ja trametinibia yhdistelmähoitona saavalla potilaalla epäillään kliinisten tutkimusten aikana interstitiaalista keuhkosairautta tai pneumoniittia ja myös jos potilaalla on uusia tai eteneviä keuhko‑oireita ja ‑löydöksiä, kuten yskää, hengenahdistusta, hypoksiaa, nestettä keuhkopussissa tai infiltraatteja, katso trametinibin annosmuutosohjeet trametinibin valmisteyhteenvedosta (ks. kohta Annostus ja antotapa). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa interstitiaalisen keuhkosairauden tai pneumoniitin takia.
Erityisryhmät
Munuaisten vajaatoiminta
Annosta ei tarvitse sovittaa lievässä tai keskivaikeassa munuaisten vajaatoiminnassa. Vaikeasta munuaisten vajaatoiminnasta ei ole kliinistä tutkimustietoa, joten annoksen sovittamisen tarvetta ei voida arvioida (ks. kohta Farmakokinetiikka). Dabrafenibin käytössä on noudatettava varovaisuutta vaikeassa munuaisten vajaatoiminnassa, kun valmistetta käytetään ainoana lääkkeenä tai yhdessä trametinibin kanssa.
Maksan vajaatoiminta
Annosta ei tarvitse sovittaa lievässä maksan vajaatoiminnassa. Keskivaikeasta tai vaikeasta maksan vajaatoiminnasta ei ole kliinistä tutkimustietoa, joten annoksen sovittamisen tarvetta ei voida arvioida (ks. kohta Farmakokinetiikka). Dabrafenibi ja sen metaboliitit poistuvat elimistöstä ensisijaisesti metaboloitumalla maksassa ja erittymällä sappeen, joten keskivaikea ja vaikea maksan vajaatoiminta voivat suurentaa lääkeainealtistusta. Dabrafenibin käytössä on noudatettava varovaisuutta keskivaikeassa tai vaikeassa maksan vajaatoiminnassa, kun valmistetta käytetään ainoana lääkkeenä tai yhdessä trametinibin kanssa.
Muut kuin kaukasialaista syntyperää olevat potilaat
Dabrafenibin turvallisuudesta ja tehosta muiden kuin kaukasialaista syntyperää olevien potilaiden hoidossa on vain rajoitetusti tietoa. Populaatiofarmakokineettisessä analyysissä ei havaittu merkittäviä eroja dabrafenibin farmakokinetiikassa aasialaisten ja kaukasialaista syntyperää olevien potilaiden välillä. Dabrafenibin annosta ei tarvitse muuttaa aasialaisille potilaille.
Iäkkäät
Aloitusannosta ei tarvitse sovittaa yli 65‑vuotiaita potilaita hoidettaessa.
Pediatriset potilaat
Dabrafenibikapselien turvallisuutta ja tehoa lasten ja nuorten (alle 18‑vuotiaiden) hoidossa ei ole vielä varmistettu. Kliinisiä tietoja ei ole saatavilla. Eläinkokeissa, joissa dabrafenibiä on annettu nuorille eläimille, on tullut esiin haittavaikutuksia, joita ei ole havaittu täysikasvuisilla eläimillä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Antotapa
Tafinlaria käytetään suun kautta. Kapselit on nieltävä kokonaisina veden kera. Niitä ei saa pureskella eikä avata eikä sekoittaa ruokaan tai juomiin dabrafenibin kemiallisen epästabiiliuden vuoksi.
On suositeltavaa, että dabrafenibiannokset otetaan joka päivä samaan aikaan noin 12 tunnin välein. Kun dabrafenibia ja trametinibia käytetään yhdistelmähoitona, kerran vuorokaudessa otettava trametinibiannos on otettava samaan aikaan joka päivä joko dabrafenibin aamuannoksen tai ilta‑annoksen yhteydessä.
Dabrafenibiannos on otettava vähintään tuntia ennen ateriaa tai vähintään kaksi tuntia aterian jälkeen.
Jos potilas oksentaa, kun hän on ottanut dabrafenibiannoksen, hänen ei pidä ottaa annosta uudelleen, ja seuraava annos on otettava normaaliin aikaan.
Tiedot trametinibin antotavasta yhdistelmähoidossa dabrafenibin kanssa, ks. trametinibin valmisteyhteenveto.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Kun dabrafenibia annetaan yhdessä trametinibin kanssa, trametinibin valmisteyhteenvetoon on perehdyttävä ennen hoidon aloittamista. Lisätiedot trametinibihoitoon liittyvistä varoituksista ja varotoimista, ks. trametinibin valmisteyhteenveto.
BRAF V600 ‑testaus
Dabrafenibin tehoa ja turvallisuutta ei ole varmistettu villityypin BRAF‑geeniä ilmentävän melanooman eikä villityypin BRAF‑geeniä ilmentävän ei‑pienisoluisen keuhkosyövän hoidossa. Dabrafenibiä ei pidä käyttää, jos potilaalla on villityypin BRAF‑geeniä ilmentävä melanooma tai villityypin BRAF‑geeniä ilmentävä ei‑pienisoluinen keuhkosyöpä (ks. kohdat Annostus ja antotapa ja Farmakodynamiikka).
Dabrafenibin ja trametinibin yhdistelmähoito melanoomapotilailla, joiden tauti on edennyt BRAF‑estäjähoidon aikana
Tietoja on rajallisesti potilaista, jotka käyttävät dabrafenibin ja trametinibin yhdistelmää ja joiden tauti on edennyt aiemman BRAF‑estäjähoidon aikana. Nämä tiedot osoittavat yhdistelmähoidon tehon olevan heikompi tässä potilasryhmässä (ks. kohta Farmakodynamiikka). Tämän vuoksi on harkittava muita hoitovaihtoehtoja ennen yhdistelmähoidon käyttämistä aiemmin BRAF‑estäjähoitoa saaneessa populaatiossa. Hoitojen eri järjestyksiä BRAF‑estäjähoidon aikana tapahtuneen etenemisen jälkeen ei ole tutkittu.
Uudet maligniteetit
Uusia maligniteetteja (ihomaligniteetteja ja muita maligniteetteja) saattaa esiintyä, kun dabrafenibia käytetään ainoana hoitona tai yhdessä trametinibin kanssa.
Ihomaligniteetit
Ihon okasolusyöpä
Ihon okasolusyöpää (mukaan lukien keratoakantooma) on raportoitu potilailla, jotka ovat saaneet dabrafenibia ainoana hoitona tai yhdessä trametinibin kanssa (ks. kohta Haittavaikutukset). Vaiheen III kliinisissä tutkimuksissa MEK115306 ja MEK116513 leikkaukseen soveltumatonta tai metastasoitunutta melanoomaa sairastavilla potilailla ihon okasolusyöpää esiintyi 10 %:lla (22/211) dabrafenibia monoterapiana saaneista potilaista ja 18 %:lla (63/349) vemurafenibia monoterapiana saaneista potilaista. Yhdistetyssä turvallisuuspopulaatiossa melanoomaa tai edennyttä ei‑pienisoluista keuhkosyöpää sairastavilla potilailla ihon okasolusyöpää esiintyi 2 %:lla (19/1 076) dabrafenibia ja trametinibia yhdistelmähoitona saaneista potilaista. MEK115306‑tutkimuksessa keskimääräinen aika ihon okasolusyövän ensimerkeistä diagnoosiin oli yhdistelmähoitoa saaneiden ryhmässä 223 vuorokautta (vaihteluväli 56–510 vuorokautta) ja dabrafenibia ainoana hoitona saaneiden ryhmässä 60 vuorokautta (vaihteluväli 9–653 vuorokautta). Melanooman liitännäishoitoa koskeneen vaiheen III tutkimuksen BRF115532 (COMBI-AD) ensisijaisen analyysin ajankohtana ihon okasolusyöpä oli ilmaantunut 1 %:lle (6/435) dabrafenibia ja trametinibia yhdistelmähoitona saaneista potilaista, ja 1 %:lle (5/432) lumelääkettä saaneista potilaista. Lisäksi hoidon lopettaneiden potilaiden pitkäaikaisseurannassa (aina 10 vuoteen saakka) kummassakin hoitoryhmässä 2 potilasta raportoi saaneensa okasolusyövän. Mediaaniaika ihon okasolusyövän ensimmäiseen ilmaantumiseen oli liitännäishoitotutkimuksen yhdistelmähoitoryhmässä noin 21 viikkoa ja lumelääkeryhmässä 34 viikkoa.
Dermatologinen tutkimus tulisi tehdä ennen dabrafenibihoidon aloittamista ja kuukausittain hoidon aikana sekä kuuden kuukauden ajan ihon okasolusyövän hoidon jälkeen. Seurantaa on jatkettava kuuden kuukauden ajan dabrafenibihoidon lopettamisen jälkeen tai kunnes aloitetaan jokin muu syöpälääkitys.
Ihon okasolusyöpä poistetaan. Dabrafenibihoitoa tai dabrafenibin ja trametinibin yhdistelmähoitoa jatketaan annostusta muuttamatta. Potilaita on kehotettava ottamaan heti yhteys lääkäriin, jos uusia ihomuutoksia ilmaantuu.
Uusi primaarimelanooma
Uusia primaarimelanoomia on raportoitu kliinisissä tutkimuksissa dabrafenibihoitoa saaneilla potilailla. Leikkaukseen soveltumatonta tai metastasoitunutta melanoomaa koskevissa kliinisissä tutkimuksessa nämä tapaukset todettiin viiden ensimmäisen dabrafenibimonoterapiakuukauden aikana. Uusi primaarimelanooma voidaan poistaa leikkauksella eikä hoidon muuttamista vaadita. Ihomuutoksia on seurattava samalla tavoin kuin ihon okasolusyövän yhteydessä on kuvattu.
Muut syöpäsairaudet kuin ihosyöpä
In vitro ‑tutkimuksissa on havaittu mitogeenien aktivoiman proteiinikinaasin (MAP‑kinaasin) signaloinnin paradoksaalista aktivoitumista villityypin BRAF‑geeniä ilmentävissä soluissa, joissa oli RAS‑mutaatioita, kun solut altistettiin BRAF:n estäjille. Tämä voi lisätä muiden syöpien kuin ihosyöpien riskiä dabrafenibialtistuksen yhteydessä (ks. kohta Haittavaikutukset), kun potilaalla on RAS‑mutaatioita. RAS‑mutaatioihin liittyviä syöpäsairauksia on raportoitu kliinisissä tutkimuksissa toisen BRAF:n estäjän käytön yhteydessä (kroonista myelomonosyyttistä leukemiaa ja muualla kuin iholla esiintyvää levyepiteelikarsinoomaa pään ja kaulan alueella), käytettäessä dabrafenibia yksinään (haiman adenokarsinooma, sappiteiden adenokarsinooma) sekä dabrafenibin ja MEK:n estäjän, trametinibin, yhdistelmäkäytössä (kolorektaalisyöpä, haimasyöpä).
Ennen hoidon aloittamista potilaalle on tehtävä pään ja kaulan alueen tutkimus, johon kuuluu ainakin suun limakalvon silmämääräinen tarkastelu ja imusolmukkeiden tunnustelu, sekä rintakehän/vatsan alueen tietokonetomografiatutkimus (TT). Hoidon aikana potilaita on seurattava kliinisen tilan mukaan. Kolmen kuukauden välein tehtävä pään ja kaulan tutkimus ja kuuden kuukauden välein tehtävä rintakehän/vatsan alueen tietokonetomografiatutkimus saattavat olla tarpeen. Peräaukon tutkimus sekä gynekologinen sisätutkimus tulisi tehdä ennen hoidon aloittamista, hoidon päättyessä tai aina, kun se on kliinisesti perusteltua. Täydellinen verenkuva ja veren kemiallisettutkimukset tulee määrittää kliinisen tilan mukaan.
Dabrafenibihoidon hyötyjä ja riskejä on arvioitava ennen hoidon aloittamista potilailla, joilla on aiemmin ollut tai joilla parhaillaan on RAS‑mutaatioihin liittyvä syöpä. Trametinibin annosta ei tarvitse muuttaa yhdistelmähoidossa dabrafenibin kanssa.
Kun dabrafenibihoito lopetetaan, muiden kuin ihon sekundaaristen/uusiutuvien pahanlaatuisten kasvaimien ilmaantumista on seurattava 6 kuukauden ajan tai kunnes toinen anti‑neoplastinen hoito aloitetaan. Poikkeavat löydökset on hoidettava hoitokäytännön mukaisesti.
Verenvuoto
Dabrafenibia yhdessä trametinibin kanssa käyttäneillä potilailla on esiintynyt verenvuototapahtumia, joihin on kuulunut myös merkittäviä verenvuototapahtumia ja kuolemaan johtaneita verenvuotoja (ks. kohta Haittavaikutukset). Lisätiedot, ks. trametinibin valmisteyhteenveto (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Näön heikkeneminen
Kliinisissä tutkimuksissa silmäoireita, kuten uveiittia, iridosykliittiä ja iriittiä, on raportoitu potilailla, jotka ovat saaneet dabrafenibia ainoana hoitona ja yhdessä trametinibin kanssa. Mahdollisten silmäoireiden (kuten näön muutosten, valonarkuuden ja silmäkivun) esiintymistä on tarkkailtava rutiinimaisesti hoidon aikana.
Annoksen sovittaminen ei ole tarpeen uveiitin hoidossa, mikäli paikallishoidot ovat riittäviä hillitsemään silmätulehdusta. Mikäli silmän paikallishoidolla ei saada riittävää vastetta uveiitin hoidossa, dabrafenibihoito keskeytetään kunnes silmätulehdusoireet ovat hävinneet. Dabrafenibihoitoa voidaan tällöin jatkaa yhtä annostasoa pienemmällä annoksella. Trametinibin annosta ei tarvitse muuttaa yhdistelmähoidossa dabrafenibin kanssa uveiittidiagnoosin jälkeen.
Vogt-Koyanagi-Haradan oireyhtymään viittaavia biokulaarista panuveiittia tai biokulaarista iridosykliittiä on raportoitu dabrafenibia trametinibin kanssa yhdistelmähoitona saaneilla potilailla. Dabrafenibihoito on keskeytettävä, kunnes silmätulehdusoireet ovat hävinneet, ja harkittava silmälääkärin puoleen kääntymistä. Systeeminen kortikosteroidihoito voi olla tarpeen.
Verkkokalvon laskimotukoksia ja verkkokalvon pigmenttiepiteelin irtaumia saattaa esiintyä dabrafenibin ja trametinibin yhdistelmähoidossa. Ks. trametinibin valmisteyhteenveto (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa verkkokalvon laskimotukos‑ tai verkkokalvon pigmenttiepiteelin irtaumadiagnoosin jälkeen.
Kuume
Kliinisissä tutkimuksissa on ilmoitettu kuumetta, kun dabrafenibia on käytetty ainoana hoitona tai yhdessä trametinibin kanssa (ks. kohta Haittavaikutukset). Kliinisissä tutkimuksissa dabrafenibia ainoana hoitona saaneista potilaista 1 %:lla esiintyi vakavia kuumetapahtumia, joihin ei liittynyt infektiota. Tällaisiksi tapahtumiksi todettiin kuume, johon liittyi voimakkaita vilunväristyksiä, nestehukkaa, verenpaineen laskua ja/tai prerenaalisen syyn aiheuttamaa akuuttia munuaisten vajaatoimintaa potilailla, joiden munuaiset olivat toimineet normaalisti lähtötilanteessa (ks. kohta Haittavaikutukset). Nämä vakavat kuumetapahtumat, joihin ei liittynyt infektiota, ilmaantuivat yleensä ensimmäisen dabrafenibihoitokuukauden aikana. Potilaat, joilla vakavia ei‑infektioperäisiä kuumetapahtumia esiintyi, reagoivat hyvin hoidon keskeyttämiseen ja/tai annoksen pienentämiseen ja tukihoitotoimenpiteisiin.
Kuumeen ilmaantuvuus ja vaikeusaste ovat suurempia yhdistelmähoidossa. Leikkaukseen soveltumatonta tai metastasoitunutta melanoomaa sairastavilla potilailla MEK115306‑tutkimuksen yhdistelmähoitoryhmässä kuumetta ilmoitettiin 57 %:lla (119/209) potilaista, ja 7 %:lla kyseessä oli 3. vaikeusaste. Dabrafenibia ainoana hoitona saaneiden ryhmässä kuumetta ilmoitettiin 33 %:lla (69/211) potilaista, ja 2 %:lla kyseessä oli 3. vaikeusaste. Vaiheen II tutkimuksessa BRF113928 potilailla, jotka sairastivat edennyttä ei‑pienisoluista keuhkosyöpää, kuumeen ilmaantuvuus ja vaikeusaste kasvoivat hieman kun dabrafenibia käytettiin yhdistelmähoitona trametinibin kanssa (48 %, 3 %:lla 3. vaikeusaste) verrattuna dabrafenibin käyttöön ainoana lääkkeenä (39 %, 2 %:lla 3. vaikeusaste). Melanooman liitännäishoitoa koskeneessa vaiheen III tutkimuksessa BRF115532 dabrafenibia ja trametinibia yhdistelmähoitona saaneille potilaille kuumetta ilmaantui useammin ja se oli vaikeampaa (67 %; 6 %:lla 3./4. vaikeusaste) kuin lumelääkettä saaneilla potilailla (15 %; < 1 %:lla 3. vaikeusaste).
Dabrafenibia yhdistelmähoitona trametinibin kanssa saaneilla leikkaukseen soveltumatonta tai metastasoitunutta melanoomaa sairastavilla potilailla, joille ilmaantui kuumetta, noin puolet kuumetapahtumista ilmaantui ensimmäisen hoitokuukauden aikana ja noin kolmasosalla tapahtumia oli vähintään kolme.
Hoito (dabrafenibin monoterapia ja molemmat dabrafenibi ja trametinibi yhdistelmähoidon yhteydessä) on keskeytettävä, jos potilaan ruumiinlämpö on ≥ 38 °C (ks. kohta Farmakodynamiikka). Toistuvassa kuumeilussa hoito voidaan keskeyttää myös ensimmäisten kuumeen oireiden ilmaannuttua. Hoito kuumelääkkeillä, kuten ibuprofeenilla tai parasetamolilla on aloitettava. Oraalisten kortikosteroidien käyttöä on harkittava tapauksissa, joissa kuumelääkkeet ovat riittämättömiä. Potilaan infektio‑oireet ja ‑löydökset on arvioitava. Hoito voidaan aloittaa uudelleen kuumeen laskettua. Jos kuumeeseen liittyy muita vaikeita oireita tai löydöksiä, hoitoa on jatkettava kuumeen laskettua pienemmällä annoksella ja kun se on kliinisesti tarkoituksenmukaista (ks. kohta Annostus ja antotapa).
Vasemman kammion ejektiofraktion (LVEF) pieneneminen / vasemman kammion toimintahäiriö
Dabrafenibin ja trametinibin yhdistelmähoidon on todettu pienentävän vasemman kammion ejektiofraktiota (ks. kohta Haittavaikutukset). Lisätiedot, ks. trametinibin valmisteyhteenveto (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Dabrafenibin annosta ei tarvitse muuttaa yhdistelmähoidossa trametinibin kanssa.
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa on todettu < 1 %:lla dabrafenibilla hoidetuista potilaista ja ≤ 1 %:lla dabrafenibia trametibinin kanssa yhdistelmähoitona saaneista potilaista. Tapauksiin liittyi yleensä kuumetta ja nestehukkaa ja potilaat reagoivat hyvin hoidon keskeyttämiseen ja tavanomaisiin tukitoimenpiteisiin. Granulomatoottista nefriittiä on raportoitu (ks. kohta Haittavaikutukset). Potilaan seerumin kreatiniinia on säännöllisesti seurattava hoidon aikana. Jos kreatiniiniarvo nousee, potilaan kliininen tila saattaa vaatia dabrafenibihoidon keskeyttämistä. Dabrafenibia ei ole tutkittu munuaisten vajaatoiminnassa (kreatiniini > 1,5 x ULN), joten varovaisuutta on noudatettava näillä potilailla (ks. kohta Farmakokinetiikka).
Maksaan liittyvät tapahtumat
Kliinisissä tutkimuksissa on raportoitu maksaan kohdistuvia haittatapahtumia, kun dabrafenibia on käytetty yhdessä trametinibin kanssa (ks. kohta Haittavaikutukset). Dabrafenibia yhdessä trametinibin kanssa saavien potilaiden maksan toimintaa suositellaan seurattavan neljän viikon välein kuuden kuukauden ajan trametinibihoidon aloittamisen jälkeen. Maksa‑arvojen seurantaa voidaan jatkaa myös tämän jälkeen kliinisen tarpeen mukaan. Lisätiedot, ks. trametinibin valmisteyhteenveto.
Hypertensio
Verenpaineen nousua on raportoitu dabrafenibin ja trametinibin yhdistelmähoidon aikana sekä potilailla, joilla on aiemmin ollut kohonnut verenpaine, että potilailla, joiden verenpaine on ollut normaali (ks. kohta Haittavaikutukset). Lisätiedot, ks. trametinibin valmisteyhteenveto.
Interstitiaalinen keuhkosairaus/pneumoniitti
Kliinisissä tutkimuksissa on raportoitu interstitiaalista keuhkosairautta ja pneumoniittia, kun dabrafenibia on käytetty yhdessä trametinibin kanssa. Lisätiedot, ks. trametinibin valmisteyhteenvedon kohta Varoitukset ja käyttöön liittyvät varotoimet. Jos dabrafenibia käytetään yhdessä trametinibin kanssa, dabrafenibihoitoa voidaan jatkaa samalla annoksella.
Ihottuma
Kliinisissä tutkimuksissa on havaittu ihottumaa noin 24 %:lla potilaista, kun dabrafenibia on käytetty yhdessä trametinibin kanssa (ks. kohta Haittavaikutukset). Suurimmassa osassa näistä tapauksista ihottuman vaikeusaste oli 1 tai 2, eikä se vaatinut hoidon keskeyttämistä eikä annoksen pienentämistä. Lisätiedot, ks. trametinibin valmisteyhteenvedon kohta Varoitukset ja käyttöön liittyvät varotoimet.
Rabdomyolyysi
Rabdomyolyysia on raportoitu potilailla, jotka ovat käyttäneet dabrafenibia yhdessä trametinibin kanssa (ks. kohta Haittavaikutukset). Lisätiedot, ks. trametinibin valmisteyhteenvedon kohta Varoitukset ja käyttöön liittyvät varotoimet.
Haimatulehdus
Haimatulehdusta on raportoitu < 1 %:lla dabrafenibia ainoana hoitona tai trametinibin kanssa yhdistelmähoitona saaneista leikkaukseen soveltumatonta tai metastasoitunutta melanoomaa koskevien kliinisten tutkimusten potilaista ja noin 4 %:lla potilaista jotka saivat dabrafenibia yhdistelmähoitona trametinibin kanssa ei‑pienisoluista keuhkosyöpää koskevassa kliinisessä tutkimuksessa. Yksi näistä tapahtumista ilmaantui metastasoitunutta melanoomaa sairastavan potilaan ensimmäisenä dabrafenibihoitopäivänä ja uusiutui, kun hoito aloitettiin uudelleen pienemmällä annoksella. Melanooman liitännäishoitoa koskevassa tutkimuksessa haimatulehdusta ilmoitettiin < 1 %:lla (1/435) dabrafenibia ja trametinibia yhdistelmähoitona saaneista potilaista, eikä yhdelläkään lumelääkettä saaneella potilaalla. Selittämätön vatsakipu on tutkittava heti, ja seerumin amylaasi‑ ja lipaasiarvot on tarkistettava. Potilaan tilaa on seurattava tarkoin, kun dabrafenibihoito aloitetaan uudelleen haimatulehdusepisodin jälkeen.
Syvä laskimotukos/keuhkoembolia
Keuhkoembolioita tai syviä laskimotukoksia saattaa esiintyä, kun dabrafenibia käytetään yhdessä trametinibin kanssa. Jos potilaalla ilmenee keuhkoembolian tai syvän laskimotukoksen oireita, kuten hengenahdistusta, rintakipua tai käsivarren tai jalan turvotusta, hänen on hakeuduttava välittömästi lääkärin hoitoon. Trametinibi‑ ja dabrafenibihoito on lopetettava pysyvästi, jos potilaalla on henkeä uhkaava keuhkoembolia.
Vaikeat ihoon kohdistuvat haittavaikutukset
Dabrafenibin ja trametinibin yhdistelmähoidon aikana on ilmoitettu vaikeita ihoon kohdistuneita haittavaikutuksia, mukaan lukien Stevens–Johnsonin oireyhtymää ja DRESS-reaktioita (lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita), jotka voivat olla henkeä uhkaavia tai johtaa kuolemaan. Ennen hoidon aloitusta potilaille on kerrottava ihoreaktioiden oireista ja löydöksistä, ja heitä on seurattava niiden varalta tarkoin. Jos vaikeisiin ihoon kohdistuviin haittavaikutuksiin viittaavia oireita ja löydöksiä esiintyy, dabrafenibin ja trametinibin käyttö on lopetettava.
Ruoansulatuselimistö
Koliittia ja ruoansulatuskanavan perforaatioita (myös kuolemaan johtaneita tapauksia) on raportoitu dabrafenibia yhdessä trametinibin kanssa käyttäneillä potilailla (ks. kohta Haittavaikutukset). Lisätiedot, ks. trametinibin valmisteyhteenveto (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Sarkoidoosi
Dabrafenibin ja trametinibin yhdistelmällä hoidetuilta potilailta on ilmoitettu sarkoidoositapauksia. Haittavaikutukset ovat kohdistuneet pääasiassa ihoon, keuhkoihin, silmiin ja imusolmukkeisiin. Suurimmassa osassa tapauksia dabrafenibi- ja trametinibihoitoa jatkettiin. Sarkoidoosidiagnoosin yhteydessä on harkittava asianmukaista hoitoa. On tärkeää, ettei sarkoidoosia tulkita virheellisesti sairauden etenemiseksi.
Hemofagosyyttinen lymfohistiosytoosi
Myyntiluvan myöntämisen jälkeen dabrafenibia ja trametinibia yhdistelmähoitona saavilla potilailla on havaittu hemofagosyyttista lymfohistiosytoosia (HLH). Käytettäessä dabrafenibia yhdessä trametinibin kanssa on noudatettava varovaisuutta. Jos potilaalla on vahvistettu HLH, on lopetettava dabrafenibin ja trametinibin yhdistelmähoidon antaminen ja aloitettava HLH:n hoito.
Tuumorilyysioireyhtymä
Dabrafenibin ja trametinibin yhdistelmähoidon käyttöön on liittynyt tuumorilyysioireyhtymää, joka voi johtaa kuolemaan (ks. kohta Haittavaikutukset). Tuumorilyysioireyhtymän riskitekijöitä ovat suuri kasvaintaakka, olemassa oleva krooninen munuaisten vajaatoiminta, oliguria, nestehukka, hypotensio ja hapan virtsa. Potilaita, joilla on tuumorilyysioireyhtymän riskitekijöitä, on seurattava huolellisesti ja profylaktista nesteytystä on harkittava. Tuumorilyysioireyhtymä on hoidettava viipymättä kliinisen tarpeen mukaan.
Muiden lääkkeiden vaikutukset dabrafenibiin
Dabrafenibi on CYP2C8:n ja CYP3A4:n substraatti. Näiden entsyymien voimakkaiden induktoreiden käyttöä on vältettävä, mikäli mahdollista, sillä ne voivat heikentää dabrafenibin tehoa (ks. kohta Yhteisvaikutukset).
Dabrafenibin vaikutukset muihin lääkkeisiin
Dabrafenibi on metaboloivien entsyymien induktori, mikä saattaa heikentää monien yleisesti käytettyjen lääkeaineiden tehoa (ks. esimerkkejä kohdasta Yhteisvaikutukset). Siksi on välttämätöntä tehdä lääkitysarvio dabrafenibihoitoa aloitettaessa. Dabrafenibin yhteiskäyttöä on yleensä syytä välttää sellaisten lääkeaineiden kanssa, jotka ovat tiettyjen metaboloivien entsyymien tai kuljetusproteiinien (ks. kohta Yhteisvaikutukset) herkkiä substraatteja, ellei tehon seuranta ja annoksen sovittaminen ole mahdollista.
Dabrafenibin anto samanaikaisesti varfariinin kanssa vähentää altistumista varfariinille. Varovaisuutta on syytä noudattaa ja ylimääräisiä INR (International Normalised Ratio) ‑määrityksiä suositellaan, kun dabrafenibia käytetään samanaikaisesti varfariinin kanssa ja kun dabrafenibihoito lopetetaan (ks. kohta Yhteisvaikutukset).
Dabrafenibin anto samanaikaisesti digoksiinin kanssa saattaa vähentää altistumista digoksiinille. Varovaisuutta on noudatettava ja digoksiinin lisäseurantaa suositellaan, kun digoksiinia (kuljetussubstraatti) käytetään samanaikaisesti dabrafenibin kanssa ja kun dabrafenibihoito lopetetaan (ks. kohta Yhteisvaikutukset).
Yhteisvaikutukset
Muiden lääkkeiden vaikutus dabrafenibiin
Dabrafenibi on metaboloivien CYP2C8‑ ja CYP3A4‑entsyymien substraatti, ja sen aktiiviset metaboliitit, hydroksidabrafenibi ja desmetyylidabrafenibi, ovat CYP3A4‑entsyymin substraatteja. Siksi lääkeaineet, jotka ovat CYP2C8:n tai CYP3A4:n voimakkaita estäjiä, todennäköisesti suurentavat dabrafenibipitoisuuksia, ja näiden entsyymien voimakkaat induktorit puolestaan pienentävät dabrafenibipitoisuutta. Dabrafenibihoidon aikana on harkittava vaihtoehtoisten lääkkeiden käyttöä, mikäli mahdollista. Dabrafenibin käytössä on noudatettava varovaisuutta, jos voimakkaita estäjiä (esim. ketokonatsolia, gemfibrotsiilia, nefatsodonia, klaritromysiiniä, ritonaviiria, sakinaviiria, telitromysiiniä, itrakonatsolia, vorikonatsolia, posakonatsolia, atatsanaviiria) annetaan dabrafenibihoidon aikana. Dabrafenibin ja CYP2C8:n tai CYP3A4:n voimakkaiden induktoreiden (esim. rifampisiinin, fenytoiinin, karbamatsepiinin, fenobarbitaalin tai mäkikuisman (Hypericum perforatum)) yhteiskäyttöä on vältettävä.
Ketokonatsoli (CYP3A4:n estäjä) 400 mg kerran päivässä annettuna samanaikaisesti dabrafenibin kanssa suurensi dabrafenibin AUC‑arvoa 71 % ja Cmax‑arvoa 33 %, kun dabrafenibin annostus oli 75 mg kahdesti päivässä, verrattuna tilanteeseen, kun dabrafenibia annettaan yksinään annostuksella 75 mg kahdesti päivässä. Näiden lääkkeiden samanaikainen anto suurensi hydroksidabrafenibin AUC‑arvoa 82 % ja desmetyylidabrafenibin AUC‑arvoa 68 %. Karboksidabrafenibin AUC‑arvo pieneni 16 %.
Gemfibrotsiili (CYP2C8:n estäjä) 600 mg kahdesti päivässä annettuna dabrafenibin kanssa suurensi dabrafenibin AUC‑arvoa 47 %, kun dabrafenibin annostus oli 75 mg kahdesti päivässä, verrattuna tilanteeseen, kun dabrafenibia annettiin yksinään annostuksella 75 mg kahdesti päivässä. Dabrafenibin Cmax‑arvo ei muuttunut samanaikaisessa annossa. Altistuminen dabrafenibin metaboliiteille ei muuttunut kliinisesti merkittävästi (≤ 13 %) gemfibrotsiilin vaikutuksesta.
Rifampisiini (CYP3A4:n/CYP2C8:n induktori) 600 mg kerran päivässä annettuna yhdessä dabrafenibin 150 mg kahdesti päivässä kanssa aiheutti toistuvasti annetun dabrafenibin Cmax‑arvon (27%) ja AUC‑arvon (34%) alenemisen. Hydroksidabrafenibin kohdalla ei havaittu merkittävää muutosta AUC‑arvossa. Karboksidabrafenibin kohdalla AUC‑arvo suureni 73% ja desmetyylidabrafenibin kohdalla AUC‑arvo aleni 30%.
Toistuvasti annettu dabrafenibi 150 mg kahdesti päivässä, yhteiskäytössä pH‑arvoa nostavan rabepratsolin 40 mg kerran päivässä kanssa aiheutti 3%:n suurenemisen AUC‑arvossa ja 12%:n alenemisen dabrafenibin Cmax‑ arvossa. Näiden muutosten dabrafenibin AUC‑ ja Cmax‑arvoissa ei katsota olevan kliinisesti merkittäviä. Lääkevalmisteiden, jotka muuttavat pH‑arvoa ruoansulatuskanavan ylemmässä osassa (esim. protonipumpun estäjät, H2‑reseptorisalpaajat, antasidit), ei odoteta vähentävän dabrafenibin hyötyosuutta.
Dabrafenibin vaikutus muihin lääkkeisiin
Dabrafenibi on entsyymi‑induktori, ja se lisää lääkeaineita metaboloivien entsyymien, kuten CYP3A4:n, CYP2C‑entsyymien ja CYP2B6:n, ja mahdollisesti myös kuljetusproteiinien synteesiä. Tämä pienentää näiden entsyymien metaboloimien lääkeaineiden pitoisuuksia plasmassa ja saattaa vaikuttaa myös joihinkin kuljetusproteiinien kuljettamiin lääkeaineisiin. Plasman pitoisuuksien pieneneminen voi heikentää näiden lääkeaineiden tehoa tai tehdä ne tehottomiksi. Näiden lääkeaineiden aktiivisten metaboliittien muodostuminen saattaa myös lisääntyä. Mahdollisia indusoituvia entsyymejä ovat CYP3A maksassa ja suolistossa, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ja UGTt (glukuronidien konjugaatiosta vastaavat entsyymit). Kuljetusproteiini P-gp ja myös muut kuljetusproteiinit, kuten MRP‑2, saattavat indusoitua. Rosuvastatiinilla tehdyn kliinisen tutkimuksen havaintojen perusteella OATP1B1/1B3‑ ja BCRP‑kuljetusproteiinien indusoituminen ei ole todennäköistä.
Dabrafenibi lisäsi CYP2B6‑ ja CYP3A4‑entsyymien määrää annoksesta riippuvasti in vitro. Kliinisessä lääkeaineiden yhteisvaikutustutkimuksessa suun kautta otetun midatsolaamin (CYP3A4:n substraatti) Cmax‑arvo pieneni 47 % ja AUC‑arvo 65 %, kun sitä annettiin samanaikaisesti toistuvien dabrafenibiannosten kanssa.
Dabrafenibi annettuna 150 mg kahdesti päivässä yhdessä varfariinin kanssa pienensi S‑varfariinin AUC‑arvoa 37 % ja R‑varfariinin AUC‑arvoa 33 % verrattuna tilanteeseen, kun varfariinia annettiin yksinään. S‑varfariinin Cmax‑arvo suureni 18 % ja R‑varfariinin Cmax‑arvo suureni 19 %.
Yhteisvaikutukset monien metaboloitumalla tai aktiivisen kuljetuksen kautta eliminoituvien lääkeaineiden kanssa ovat todennäköisiä. Näiden lääkkeiden käyttöä on vältettävä tai niiden käytössä on noudatettava varovaisuutta, jos niiden terapeuttinen teho on potilaalle erittäin tärkeää eikä annoksen sovittamista ole helppo toteuttaa tehoa ja plasman lääkeainepitoisuuksia seuraamalla. Parasetamoliin liittyvien maksavaurioiden riskin epäillään suurenevan, jos potilaat saavat samanaikaisesti entsyymi‑induktoreita.
Yhteisvaikutuksia voi todennäköisesti esiintyä hyvin monien lääkeaineiden kanssa, mutta niiden voimakkuus vaihtelee. Lääkeaineryhmiä, joihin dabrafenibi voi vaikuttaa, ovat muun muassa:
- Analgeetit (esim. fentanyyli, metadoni)
- Antibiootit (esim. klaritromysiini, doksisykliini)
- Syöpälääkkeet (esim. kabatsitakseli)
- Antikoagulantit (esim. asenokumaroli, varfariini, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Epilepsialääkkeet (esim. karbamatsepiini, fenytoiini, primidoni, valproiinihappo)
- Psykoosilääkkeet (esim. haloperidoli)
- Kalsiumkanavan salpaajat (esim. diltiatseemi, felodipiini, nikardipiini, nifedipiini, verapamiili)
- Sydänglykosidit (esim. digoksiini, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet)
- Kortikosteroidit (esim. deksametasoni, metyyliprednisoloni)
- HIV‑lääkkeet (esim. amprenaviiri, atatsanaviiri, darunaviiri, delavirdiini, efavirentsi, fosamprenaviiri, indinaviiri, lopinaviiri, nelfinaviiri, sakinaviiri, tipranaviiri)
- Hormonaaliset ehkäisyvalmisteet (ks. kohta Raskaus ja imetys)
- Rauhoittavat lääkkeet (esim. diatsepaami, midatsolaami, tsolpideemi)
- Immunosuppressantit (esim. siklosporiini, takrolimuusi, sirolimuusi)
- CYP3A4‑entsyymin välityksellä metaboloituvat statiinit (esim. atorvastatiini, simvastatiini).
Induktio alkaa todennäköisesti, kun dabrafenibia on annettua toistuvina annoksina 3 vuorokauden ajan. Dabrafenibihoidon lopettamisen jälkeen induktiovaikutus häviää vähitellen, jolloin CYP3A4:n, CYP2B6:n, CYP2C8:n, CYP2C9:n ja CYP2C19:n, UDP‑glukuronosyylitransferaasin (UGT) ja kuljetusproteiinien herkkien substraattien (esim. P-gp ja MRP‑2) pitoisuudet saattavat suurentua. Potilaiden tilaa on seurattava haittavaikutusten varalta, ja näiden lääkeaineiden annosta voidaan joutua sovittamaan.
Dabrafenibi on vaikutusmekanisminsa perusteella CYP3A4:n estäjä in vitro. Ensimmäisinä hoitopäivinä saatetaan sen vuoksi havaita ohimenevä CYP3A4:n toiminnan estyminen.
Dabrafenibin vaikutukset muiden aineiden kuljetusjärjestelmiin
Dabrafenibi on ihmisen orgaanisten anionien kuljettajapolypeptidien (OATP) 1B1 (OATP1B1), OATP1B3 ja BCRP estäjä in vitro. Kun 16 potilaalle annettiin kerta‑annos rosuvastatiinia (kuljettajapolypeptidien OATP1B1, OATP1B3 ja BCRP substraatti) samanaikaisesti toistuvien dabrafenibiannosten (150 mg kahdesti vuorokaudessa) kanssa, nousi rosuvastatiinin Cmax‑arvo 2,6‑kertaiseksi, kun taas AUC‑arvo muuttui vain minimaalisesti (7 %:n nousu). Rosuvastatiinin Cmax‑arvon nousulla ei todennäköisesti ole kliinistä merkitystä.
Käyttö yhdessä trametinibin kanssa
Trametinibin (2 mg kerran vuorokaudessa) ja dabrafenibin (150 mg kahdesti vuorokaudessa) toistuva yhteiskäyttö ei aiheuttanut kliinisesti merkitseviä muutoksia trametinibin ja dabrafenibin Cmax‑ ja AUC‑arvoissa; dabrafenibin Cmax‑arvo nousi 16 % ja AUC‑arvo nousi 23 %. Väestöfarmakokineettinen analyysi osoitti, että trametinibin biologisessa hyötyosuudessa havaittiin pieni lasku (mikä vastaa AUC‑arvon 12 %:n laskua), käytettäessä trametinibia yhdessä dabrafenibin eli CYP3A4‑entsyymin indusoijan kanssa.
Dabrafenibin käyttö yhdessä trametinibin kanssa, ks. dabrafenibin ja trametinibin valmisteyhteenvedoista lääkevalmisteiden yhteisvaikutuksia koskevat kohdat Varoitukset ja käyttöön liittyvät varotoimet ja Yhteisvaikutukset.
Ruoan vaikutus dabrafenibiin
Potilaiden on otettava ainoana hoitona tai yhdessä trametinibin kanssa käytettävä dabrafenibi vähintään tunti ennen ateriaa tai kaksi tuntia aterian jälkeen, sillä ruoka vaikuttaa dabrafenibin imeytymiseen (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Yhteisvaikutuksia on tutkittu vain aikuisille tehdyissä tutkimuksissa.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / Raskauden ehkäisy naisilla
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 2 viikkoa dabrafenibihoidon päättymisen jälkeen ja 16 viikon ajan viimeisen trametinibiannoksen jälkeen, kun trametinibia käytetään yhdessä dabrafenibin kanssa. Dabrafenibi saattaa heikentää suun kautta tai systeemisesti otettujen hormonaalisten ehkäisyvalmisteiden tehoa, joten tehokasta vaihtoehtoista ehkäisymenetelmää on käytettävä (ks. kohta Yhteisvaikutukset).
Raskaus
Ei ole olemassa tietoja dabrafenibin käytöstä raskaana oleville naisille. Eläinkokeissa on havaittu lisääntymistoksisuutta ja alkion‑ ja sikiönkehitykseen kohdistuvia, myös epämuodostumia aiheuttavia, vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Dabrafenibia ei pidä antaa raskaana oleville naisille, paitsi jos hoidon odotettu hyöty äidille on suurempi kuin mahdollinen sikiölle aiheutuva riski. Jos potilas tulee raskaaksi dabrafenibihoidon aikana, hänelle on kerrottava mahdollisesta sikiöön kohdistuvasta vaarasta. Dabrafenibin ja trametinibin yhteiskäyttö, ks. trametinibin valmisteyhteenveto (ks. kohta Raskaus ja imetys).
Imetys
Ei tiedetä, erittyykö dabrafenibi ihmisen rintamaitoon. Monet lääkeaineet erittyvät ihmisen rintamaitoon, joten imetettävään lapseen kohdistuvia riskejä ei voida poissulkea. On päätettävä lopetetaanko rintaruokinta vai lopetetaanko dabrafenibihoito ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Ihmistä koskevia tietoja ei ole dabrafenibin käytöstä ainoana hoitona tai yhdistelmähoitona trametinibin kanssa. Dabrafenibi saattaa heikentää miehen ja naisen hedelmällisyyttä, sillä eläinkokeissa on havaittu urosten ja naaraiden sukupuolielimiin kohdistuvia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta). Dabrafenibia ainoana hoitona tai yhdessä trametinibin kanssa käyttäville miespotilaille on kerrottava mahdollisesta siittiötuotannon vähenemisestä, joka voi olla pysyvää. Katso lisätietoja trametinibin valmisteyhteenvedosta (kohta Raskaus ja imetys) kun dabrafenibiä käytetään yhdessä trametinibin kanssa.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Dabrafenibilla on vähäinen vaikutus ajokykyyn ja koneidenkäyttökykyyn. Potilaan kliininen tila ja dabrafenibin haittavaikutusprofiili on otettava huomioon, kun arvioidaan potilaan kykyä selviytyä harkintakykyä ja motorisia tai kognitiivisia taitoja vaativista tehtävistä. Potilaille on kerrottava, että mahdollinen väsymys ja silmäoireet voivat vaikuttaa näihin toimintoihin.
Haittavaikutukset
Yhteenveto turvallisuustiedoista
Dabrafenibimonoterapian turvallisuus perustuu viiteen kliiniseen tutkimukseen (BRF113683 [BREAK-3], BRF113929 [BREAK-MB], BRF113710 [BREAK-2], BRF113220 ja BRF112680) osallistuneiden 578 potilaan yhdistettyyn turvallisuuspopulaatioon. BRAF V600 mutatoitunutta leikkaukseen soveltumatonta tai metastasoitunutta melanoomaa sairastavat potilaat saivat dabrafenibia 150 mg kahdesti vuorokaudessa. Yleisimpiä (esiintymistiheys ≥ 15 %) dabrafenibin haittavaikutuksia olivat hyperkeratoosi, päänsärky, kuume, nivelkipu, väsymys, pahoinvointi, papillooma, hiustenlähtö, ihottuma ja oksentelu.
Dabrafenibin ja trametinibin yhdistelmän turvallisuutta on arvioitu 1 076 potilaan yhdistettyjen turvallisuustietojen perusteella. Potilaat saivat 150 mg dabrafenibia kahdesti vuorokaudessa ja 2 mg trametinibia kerran vuorokaudessa BRAF V600 mutatoituneen leikkaukseen soveltumattoman tai metastasoituneen melanooman, tai leikkauksella kokonaan poistetun asteen III BRAF V600 mutatoituneen melanooman (liitännäishoito), tai edenneen ei‑pienisoluisen keuhkosyövän hoitoon. Näistä 559 potilasta sai yllä mainittua yhdistelmähoitoa BRAF V600 mutatoituneen melanooman hoitoon kahdessa satunnaistetussa vaiheen III kliinisessä tutkimuksessa MEK115306 (COMBI‑d) ja MEK116513 (COMBI‑v). 435 potilasta sai yllä mainittua yhdistelmähoitoa leikkauksella kokonaan poistetun asteen III BRAF V600 mutatoituneen melanooman liitännäishoitoon satunnaistetussa vaiheen III tutkimuksessa BRF115532 (COMBI-AD), ja 82 potilasta BRAF V600 mutatoituneen ei‑pienisoluisen keuhkosyövän hoitoon monikohorttisessa, ei‑satunnaistetussa vaiheen II tutkimuksessa BRF113928 (ks. kohta Farmakodynamiikka).
Yleisimpiä haittavaikutuksia (esiintymistiheys ≥ 20 %) dabrafenibin ja trametinibin yhdistelmähoidossa olivat: kuume, väsymys, pahoinvointi, vilunväristykset, päänsärky, ripuli, oksentelu, nivelkipu ja ihottuma.
Haittavaikutustaulukko
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisessä valvonnassa havaitut dabrafenibiin liittyvät haittavaikutukset on esitetty jäljempänä dabrafenibimonoterapian (taulukko 3) sekä dabrafenibin ja trametinibin yhdistelmähoidon (taulukko 4) osalta. Haittavaikutukset on järjestetty elinjärjestelmäluokituksen mukaisesti ja esiintymistiheyden mukaan yleisimmistä alkaen seuraavasti: hyvin yleinen (≥ 1/10); yleinen (≥ 1/100, < 1/10); melko harvinainen (≥ 1/1 000, < 1/100); harvinainen (≥ 1/10 000, < 1/1 000); hyvin harvinainen (< 1/10 000) ja tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 3 Dabrafenibia ainoana lääkkeenä saaneilla potilailla raportoidut haittavaikutukset
| Elinjärjestelmä | Yleisyys (kaikki vaikeusasteet) | Haittavaikutukset |
| Hyvän‑ ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Hyvin yleinen | Papillooma |
| Yleinen | Ihon okasolusyöpä | |
| Seborrooinen keratoosi | ||
| Akrokordoni (ihopolyyppi) | ||
| Tyvisolusyöpä | ||
| Melko harvinainen | Uusi primaarimelanooma | |
| Immuunijärjestelmä | Melko harvinainen | Yliherkkyys |
| Aineenvaihdunta ja ravitsemus | Hyvin yleinen | Heikentynyt ruokahalu |
| Yleinen | Hypofosfatemia | |
| Hyperglykemia | ||
| Hermosto | Hyvin yleinen | Päänsärky |
| Yleinen | Perifeerinen neuropatia (mukaan lukien sensorinen ja motorinen neuropatia) | |
| Silmät | Melko harvinainen | Uveiitti |
| Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | Yskä |
| Ruoansulatuselimistö | Hyvin yleinen | Pahoinvointi |
| Oksentelu | ||
| Ripuli | ||
| Yleinen | Ummetus | |
| Melko harvinainen | Haimatulehdus | |
| Iho ja ihonalainen kudos | Hyvin yleinen | Hyperkeratoosi |
| Hiustenlähtö | ||
| Ihottuma | ||
| Kämmenten ja jalkapohjien erytrodysestesia | ||
| Yleinen | Kuiva iho | |
| Kutina | ||
| Aktiininen keratoosi | ||
| Ihomuutokset | ||
| Punoitus | ||
| Valoherkkyys | ||
| Melko harvinainen | Akuutti kuumeinen neutrofiilinen dermatoosi | |
| Pannikuliitti | ||
| Luusto, lihakset ja sidekudos | Hyvin yleinen | Nivelkipu |
| Lihaskipu | ||
| Raajakipu | ||
| Munuaiset ja virtsatiet | Melko harvinainen | Munuaisten vajaatoiminta, akuutti munuaisten vajaatoiminta |
| Munuaistulehdus | ||
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Kuume |
| Väsymys | ||
| Vilunväristykset | ||
| Voimattomuus | ||
| Yleinen | Influenssan kaltainen sairaus |
Taulukko 4 Dabrafenibia ja trametinibia yhdistelmähoitona saaneilla potilailla raportoidut haittavaikutukset
| Elinjärjestelmä | Yleisyys (kaikki vaikeusasteet) | Haittavaikutukset |
| Infektiot | Hyvin yleinen | Nenänielutulehdus |
| Yleinen | Virtsatieinfektio | |
| Selluliitti | ||
| Karvatupen tulehdus | ||
| Kynnenvierustulehdus | ||
| Märkärakkulainen ihottuma | ||
| Hyvän‑ ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | Yleinen | Ihon okasolusyöpäa |
| Papilloomab | ||
| Seborrooinen keratoosi | ||
| Melko harvinainen | Uusi primaarimelanoomac | |
| Ihopolyypit | ||
| Veri ja imukudos | Yleinen | Neutropenia |
| Anemia | ||
| Trombosytopenia | ||
| Leukopenia | ||
| Immuunijärjestelmä | Melko harvinainen | Yliherkkyysd |
| Sarkoidoosi | ||
| Harvinainen | Hemofagosyyttinen lymfohistiosytoosi | |
| Aineenvaihdunta ja ravitsemus | Hyvin yleinen | Ruokahalun heikentyminen |
| Yleinen | Nestehukka | |
| Hyponatremia | ||
| Hypofosfatemia | ||
| Hyperglykemia | ||
| Tuntematon | Tuumorilyysioireyhtymä | |
| Hermosto | Hyvin yleinen | Päänsärky |
| Huimaus | ||
| Yleinen | Perifeerinen neuropatia (mukaan lukien sensorinen ja motorinen neuropatia) | |
| Silmät | Yleinen | Näön hämärtyminen |
| Näön heikkeneminen | ||
| Uveiittie | ||
| Melko harvinainen | Korioretinopatia | |
| Verkkokalvon irtauma | ||
| Turvotus silmäkuopan ympärillä | ||
| Sydän | Yleinen | Ejektiofraktion pieneneminen |
| Eteis-kammiokatkosf | ||
| Melko harvinainen | Bradykardia | |
| Tuntematon | Myokardiitti | |
| Verisuonisto | Hyvin yleinen | Hypertensio |
| Verenvuotog | ||
| Yleinen | Hypotensio | |
| Lymfedeema | ||
| Hengityselimet, rintakehä ja välikarsina | Hyvin yleinen | Yskä |
| Yleinen | Hengenahdistus | |
| Melko harvinainen | Pneumoniitti | |
| Ruoansulatuselimistö | Hyvin yleinen | Vatsakipuh |
| Ummetus | ||
| Ripuli | ||
| Pahoinvointi | ||
| Oksentelu | ||
| Yleinen | Suun kuivuus | |
| Suutulehdus | ||
| Melko harvinainen | Haimatulehdus | |
| Koliitti | ||
| Harvinainen | Ruoansulatuskanavan perforaatio | |
| Iho ja ihonalainen kudos | Hyvin yleinen | Ihon kuivuus |
| Kutina | ||
| Ihottuma | ||
| Punoitusi | ||
| Yleinen | Aknetyyppinen ihottuma | |
| Aktiininen keratoosi | ||
| Yöhikoilu | ||
| Hyperkeratoosi | ||
| Hiustenlähtö | ||
| Kämmenten ja jalkapohjien erytrodysestesia | ||
| Ihomuutokset | ||
| Voimakas hikoilu | ||
| Pannikuliitti | ||
| Ihon fissuurat | ||
| Valoherkkyys | ||
| Melko harvinainen | Akuutti kuumeinen neutrofiilinen dermatoosi | |
| Tuntematon | Stevens–Johnsonin oireyhtymä | |
| DRESS-reaktio (lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita) | ||
| Yleistynyt eksfoliatiivinen dermatiitti | ||
| Tatuointeihin liittyvät ihoreaktiot | ||
| Luusto, lihakset ja sidekudos | Hyvin yleinen | Nivelkipu |
| Lihaskipu | ||
| Raajakipu | ||
| Lihasspasmitj | ||
| Munuaiset ja virtsatiet | Melko harvinainen | Munuaisten vajaatoiminta |
| Munuaistulehdus | ||
| Yleisoireet ja antopaikassa todettavat haitat | Hyvin yleinen | Väsymys |
| Vilunväristykset | ||
| Voimattomuus | ||
| Perifeerinen edeema | ||
| Kuume | ||
| Influenssan kaltainen sairaus | ||
| Yleinen | Limakalvotulehdus | |
| Kasvojen turvotus | ||
| Tutkimukset | Hyvin yleinen | Kohonnut ALAT‑arvo |
| Kohonnut ASAT‑arvo | ||
| Yleinen | Kohonnut AFOS‑arvo | |
| Kohonnut GGT‑arvo | ||
| Kohonnut veren kreatiinikinaasiarvo | ||
MEK116513-tutkimuksen turvallisuusprofiili on yleisesti samanlainen kuin MEK115306-tutkimuksen, seuraavin poikkeuksin: 1) Seuraavilla haittavaikutuksilla on korkeampi yleisyysluokka kuin MEK115306-tutkimuksessa: lihasspasmit (hyvin yleinen), munuaisten vajaatoiminta ja lymfedeema (yleinen), akuutti munuaisten vajaatoiminta (melko harvinainen); 2) Seuraavia haittavaikutuksia on esiintynyt MEK116513-tutkimuksessa mutta ei MEK115306-tutkimuksessa: sydämen vajaatoiminta, vasemman kammion toimintahäiriö, interstitiaalinen keuhkosairaus (melko harvinainen); 3) Seuraavia haittavaikutuksia on esiintynyt MEK116513- ja BRF115532-tutkimuksessa mutta ei MEK115306- ja BRF113928-tutkimuksessa: rabdomyolyysi (melko harvinainen). a Ihon okasolusyöpä: Okasolusyöpä, ihon okasolusyöpä, okasolusyöpä in situ (Bowenin tauti) ja keratoakantooma b Papillooma, ihon papillooma c Pahanlaatuinen melanooma, metastasoitunut pahanlaatuinen melanooma, ja pinnallisesti leviävä asteen III melanooma d Sisältää lääkeyliherkkyyden e Sisältää Vogt-Koyanagi-Haradan oireyhtymään viittaavat biokulaarisen panuveiitin tai biokulaarisen iridosykliitin tapaukset f Eteis-kammiokatkos, ensimmäisen asteen eteis-kammiokatkos, toisen asteen eteis-kammiokatkos, täydellinen eteis-kammiokatkos g Eri alueiden verenvuodot, mukaan lukien kallonsisäinen verenvuoto ja kuolemaan johtava verenvuoto h Ylävatsakipu ja alavatsakipu i Eryteema, yleistynyt eryteema j Lihasspasmit, lihasten ja luuston jäykkyys | ||
Tärkeimpien haittavaikutusten kuvaus
Ihon okasolusyöpä
MEK115306‑tutkimuksessa havaittiin, että ihon okasolusyöpää (mukaan lukien keratoakantooma tai sekamuotoisen keratoakantooman alatyyppi) esiintyi 10 %:lla dabrafenibia ainoana hoitona saaneista potilaista ja noin 70 % näistä tapahtumista ilmaantui 12 ensimmäisen hoitoviikon aikana, mediaaniajan ollessa 8 viikkoa. Yhdistetyssä turvallisuuspopulaatiossa ihon okasolusyöpää esiintyi 2 %:lla dabrafenibia ja trametinibia yhdistelmähoitona saaneista potilaista ja tapahtumat ilmaantuivat myöhemmin kuin dabrafenibia ainoana hoitona saaneilla potilailla: mediaaniaika oli 18-31 viikkoa. Kaikki dabrafenibia ainoana hoitona saaneet potilaat ja kaikki yhdistelmähoitoa saaneet potilaat, joille ihon okasolusyöpä kehittyi, jatkoivat hoitoa ilman annosmuutoksia.
Uusi primaarimelanooma
Melanoomaa koskevissa kliinisissä tutkimuksissa on raportoitu uusia primaarimelanoomia, kun dabrafenibia on käytetty ainoana hoitona tai yhdessä trametinibin kanssa. Nämä hoidettiin poistamalla kasvain kirurgisesti, eivätkä ne vaatineet annostuksen muuttamista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Ei‑pienisoluista keuhkosyöpää koskevassa vaiheen II tutkimuksessa (BRF113928) ei raportoitu uusia primaarimelanoomia.
Muu syöpäsairaus kuin ihosyöpä
MAP‑kinaasisignaloinnin aktivoituminen BRAF:n estäjille altistuneissa villityypin BRAF‑soluissa voi lisätä muiden syöpien kuin ihosyövän riskiä, myös sellaisten, joissa esiintyy RAS‑mutaatioita (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Muita syöpiä kuin ihosyöpää esiintyi 1 %:lla (6/586) dabrafenibihoitoa saaneista yhdistetyn turvallisuuspopulaation potilaista ja < 1 %:lla (8/1 076) dabrafenibin ja trametinibin yhdistelmähoitoa saaneista yhdistetyn turvallisuuspopulaation potilaista. Melanooman liitännäishoitoa koskeneessa vaiheen III tutkimuksessa BRF115532 (COMBI-AD) 1 %:lle (5/435) dabrafenibin ja trametinibin yhdistelmähoitoa saaneista potilaista ja < 1 %:lle (3/432) lumelääkettä saaneista potilaista kehittyi muu syöpä kuin ihosyöpä. Lisäksi hoidon lopettaneiden potilaiden pitkäaikaisseurannassa (aina 10 vuoteen saakka) 9 potilasta yhdistelmähoitoryhmässä ja 4 potilasta lumelääkeryhmässä raportoivat saaneensa muun syövän kuin ihosyövän. Dabrafenibihoidon ja dabrafenibin ja trametinibin yhdistelmähoidon yhteydessä on esiintynyt RAS‑välitteisiä syöpäsairauksia. Potilaiden tilaa on seurattava kliinisen tarpeen mukaan.
Verenvuoto
Dabrafenibia yhdessä trametinibin kanssa saaneilla potilailla on esiintynyt verenvuototapahtumia, joihin on kuulunut myös merkittäviä verenvuototapahtumia ja kuolemaan johtaneita verenvuotoja. Ks. trametinibin valmisteyhteenveto.
Vasemman kammion ejektiofraktion (LVEF) pieneneminen/vasemman kammion toimintahäiriö
Vasemman kammion ejektiofraktion pienenemistä raportoitiin 6 %:lla (65/1 076) dabrafenibin ja trametinibin yhdistelmähoitoa saaneista yhdistetyn turvallisuuspopulaation potilaista. Useimmat tapaukset olivat oireettomia ja korjautuvia. Dabrafenibin kliinisiin tutkimuksiin ei otettu mukaan potilaita, joiden LVEF oli tutkimuskeskuksen oman viitealueen alarajan alapuolella. Dabrafenibia on käytettävä trametinibin kanssa varoen potilailla, joilla on sairauksia, jotka voivat heikentää vasemman kammion toimintaa. Ks. trametinibin valmisteyhteenveto.
Kuume
Kliinisissä tutkimuksissa on ilmoitettu kuumetta, kun dabrafenibia on käytetty ainoana hoitona tai yhdessä trametinibin kanssa; kuumeen ilmaantuvuus ja vaikeusaste ovat suurempia yhdistelmähoidossa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Dabrafenibia yhdistelmähoitona trametinibin kanssa saaneilla kuumepotilailla noin puolet kuumetapahtumista ilmaantui ensimmäisen hoitokuukauden aikana ja noin kolmasosalla tapahtumia oli vähintään kolme. Yhdistetyssä turvallisuuspopulaatiossa 1 %:lla dabrafenibia ainoana hoitona saaneista potilaista esiintyi vakavia kuumetapahtumia, joihin ei liittynyt infektiota. Tällaisiksi tapahtumiksi todettiin kuume, johon liittyi voimakkaita vilunväristyksiä, nestehukkaa, verenpaineen laskua ja/tai prerenaalisen syyn aiheuttamaa akuuttia munuaisten vajaatoimintaa potilailla, joiden munuaiset olivat toimineet normaalisti lähtötilanteessa. Nämä vakavat kuumetapahtumat, joihin ei liittynyt infektiota, ilmaantuivat yleensä ensimmäisen hoitokuukauden aikana. Potilaat, joilla vakavia ei‑infektioperäisiä kuumetapahtumia esiintyi, reagoivat hyvin hoidon keskeyttämiseen ja/tai annoksen pienentämiseen ja tukihoitotoimenpiteisiin (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Maksaan liittyvät tapahtumat
Kliinisissä tutkimuksissa on raportoitu maksaan liittyviä haittatapahtumia, kun dabrafenibia on käytetty yhdessä trametinibin kanssa. Ks. trametinibin valmisteyhteenveto.
Hypertensio
Verenpaineen nousua on raportoitu dabrafenibin ja trametinibin yhteiskäytön aikana sekä potilailla, joilla on aiemmin ollut kohonnut verenpaine, että potilailla, joiden verenpaine on ollut normaali. Verenpaine on mitattava hoitoa aloitettaessa, ja sitä on seurattava hoidon aikana, ja tarvittaessa hypertensio on pidettävä hallinnassa tavanomaisella hoidolla.
Nivelkipu
Nivelkipua raportoitiin hyvin yleisesti yhdistetyn turvallisuuspopulaation potilailla, jotka saivat dabrafenibia ainoana hoitona (25 %) sekä potilailla, jotka saivat dabrafenibia yhdessä trametinibin kanssa (25 %). Nivelkivun vaikeusasteluokka oli yleensä 1 tai 2, ja 3. asteen tapaukset olivat melko harvinaisia (< 1 %) eikä 4. asteen tapauksia raportoitu lainkaan.
Hypofosfatemia
Hypofosfatemiaa on raportoitu yleisesti dabrafenibia ainoana hoitona saaneilla yhdistetyn turvallisuuspopulaation potilailla (7 %) ja dabrafenibin ja trametinibin yhdistelmähoitoa saaneilla potilailla (4 %). Noin puolet dabrafenibihoitoon liittyvistä tapauksista (4 %) ja 1 % dabrafenibin ja trametinibin yhdistelmähoitoon liittyvistä tapauksista kuului vaikeusasteluokkaan 3.
Haimatulehdus
Dabrafenibihoitoa ja dabrafenibia yhdistelmähoitona trametinibin kanssa saaneilla potilailla on raportoitu haimatulehdusta. Selittämätön vatsakipu on tutkittava heti, ja seerumin amylaasi‑ ja lipaasiarvot on tarkistettava. Potilaan tilaa on seurattava tarkoin, kun dabrafenibihoito aloitetaan uudelleen haimatulehdusepisodin jälkeen (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Munuaisten vajaatoiminta
Kuumeeseen liittyvän prerenaalisen atsotemian aiheuttamaa munuaisten vajaatoimintaa tai granulomatoottista nefriittiä esiintyi melko harvoin. Dabrafenibia ei kuitenkaan ole tutkittu potilailla, joilla oli munuaisten vajaatoimintaa (kreatiniini > 1,5 x viitearvojen yläraja). Tällaisissa tapauksissa on noudatettava varovaisuutta (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Erityisryhmät
Iäkkäät
Dabrafenibia ainoana hoitona saaneista yhdistetyn turvallisuuspopulaation potilaista (n = 578) 22 % oli vähintään 65‑vuotiaita ja 6 % oli vähintään 75‑vuotiaita. Yli 65‑vuotiailla potilailla esiintyi useammin haittavaikutuksia, jotka johtivat tutkimuslääkkeen annoksen pienentämiseen (22 %) tai hoidon keskeyttämiseen (39 %) kuin nuoremmilla (< 65‑vuotiailla) potilailla (12 % ja 27 %). Lisäksi iäkkäillä potilailla esiintyi enemmän vakavia haittavaikutuksia (41 %) kuin nuoremmilla potilailla (22 %). Yleisesti hoidon tehossa ei havaittu eroja tämän ikäryhmän ja nuorempien potilaiden välillä.
Dabrafenibin ja trametinibin yhdistelmää saaneiden potilaiden yhdistetyssä turvallisuuspopulaatiossa (n = 1 076) 265 potilasta (25 %) oli ≥ 65‑vuotiaita ja 62 potilasta (6 %) ≥ 75‑vuotiaita. Haittatapahtuman kokeneiden potilaiden osuus oli kaikissa kliinisissä tutkimuksissa samaa luokkaa < 65 vuoden ikäisillä ja ≥ 65 vuoden ikäisillä. Vakavia haittatapahtumia ja lääkevalmisteen käytön pysyvään lopettamiseen, annoksen pienentämiseen ja hoidon keskeyttämiseen johtavia haittatapahtumia esiintyi todennäköisemmin ≥ 65‑vuotiailla potilailla kuin < 65‑vuotiailla.
Dabrafenibin ja trametinibin yhdistelmähoito potilailla, joilla on aivometastaaseja
Dabrafenibin ja trametinibin yhdistelmän tehoa ja turvallisuutta on arvioitu avoimessa vaiheen II monikohorttitutkimuksessa potilailla, joilla on BRAF V600 ‑mutatoitunut, aivometastaaseja aiheuttanut melanooma. Näillä potilailla havaittu turvallisuusprofiili vaikuttaa yhdenmukaiselta tämän yhdistelmän yhdistetyn turvallisuusprofiilin kanssa.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Dabrafenibin yliannostukseen ei ole spesifistä hoitoa. Yliannostustapauksissa on annettava asianmukaista tukihoitoa ja potilaan tilaa on seurattava tarpeen mukaan.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: antineoplastiset lääkeaineet, proteiinikinaasin estäjät, B-Raf seriini-treoniinikinaasin (BRAF) estäjät, ATC‑koodi: L01EC02
Vaikutusmekanismi
Dabrafenibi on RAF‑kinaasien estäjä. BRAF:n onkogeeniset mutaatiot johtavat RAS/RAF/MEK/ERK‑reitin konstitutiiviseen aktivaatioon. BRAF‑mutaatioita on todettu hyvin usein spesifisissä syöpätyypeissä, myös noin 50 %:ssa melanoomista. Yleisin BRAF‑mutaatio on V600E, jonka osuus melanoomaan liittyvistä BRAF‑mutaatioista on noin 90 %.
Biokemiallisissa analyyseissä saadut prekliiniset tiedot osoittivat, että dabrafenibi estää BRAF‑kinaaseja, joissa on aktivoivia mutaatioita kodonissa 600 (taulukko 5).
Taulukko 5 Dabrafenibin eri RAF‑kinaaseja estävä teho
| Kinaasi | Estävä pitoisuus (IC50) (nM) |
| BRAF V600E | 0,65 |
| BRAF V600K | 0,50 |
| BRAF V600D | 1,8 |
| BRAF WT | 3,2 |
| CRAF WT | 5,0 |
Dabrafenibin osoitettiin estävän BRAF:sta alavirtaan toimivaa farmakodynaamista biomarkkeria (fosforyloitunutta ERK:ta), ja se esti solujen kasvua BRAF V600 ‑mutatoituneissa melanoomasolulinjoissa in vitro ja eläinkoemalleissa.
Potilailla, joilla oli BRAF V600 ‑mutaatiopositiivinen melanooma, dabrafenibi esti kasvaimen ERK:in fosforyloitumista lähtötilanteeseen verrattuna.
Käyttö yhdessä trametinibin kanssa
Trametinibi on palautuva, erittäin selektiivinen, mitogeenin aktivoiman solunulkoisen signaalin säätelykinaasi 1:n (MEK1:n) ja MEK2:n aktivaation ja kinaasiaktiivisuuden allosteerinen estäjä. MEK‑proteiinit ovat ERK‑kinaasin signalointireitin osia.
Trametinibi ja dabrafenibi estävät siis kahta tämän reitin kinaasia (MEK ja RAF), ja tästä syystä yhdistelmä estää reittiä samanaikaisesti. Trametinibin ja dabrafenibin yhdistelmän on osoitettu rajoittavan kasvua BRAF V600 ‑mutaatiopositiivisissa melanoomasolulinjoissa in vitro ja viivästyttävän resistenssin kehittymistä in vivo BRAF V600 ‑mutaatiopositiivisissa melanoomaksenografteissa.
BRAF‑mutaatiostatuksen määrittäminen
Ennen dabrafenibihoidon tai dabrafenibin ja trametinibin yhdistelmähoidon aloittamista BRAF V600 ‑mutaation esiintyminen kasvaimessa on vahvistettava validoidulla testillä. Toisen ja kolmannen vaiheen kliinisiin tutkimuksiin valitut potilaat seulottiin määrittämällä kasvaimen BRAF V600 ‑mutaatiostatus keskitetysti BRAF‑mutaatioanalyysillä viimeisimmästä käytettävissä olevasta kasvainnäytteestä. Primaarikasvain tai etäpesäkekohdan kasvain testattiin pelkästään tutkimuskäyttöön tarkoitetulla analyysillä. Tämä on alleelispesifinen polymeraasiketjureaktiotekniikkaan (PCR) perustuva testi, ja se tehdään DNA:sta, joka on eristetty formaliinifiksoidusta parafiiniin valetusta (FFPE) kasvainkudoksesta. Testi on kehitetty erityisesti erottamaan V600E‑ ja V600K‑mutaatiot toisistaan. Tutkimukseen valittiin vain potilaita, joilla oli BRAF V600E‑ tai V600K‑mutaatiopositiivinen kasvain.
Kaikki potilasnäytteet testattiin myöhemmin uudelleen käyttäen bioMerieux’n (bMx) validoitua THxID BRAF ‑testiä, jolla on CE‑hyväksyntä. Tämä bMx:n THxID BRAF ‑testi on alleelispesifinen PCR, ja se tehdään DNA:sta, joka on eristetty formaliinilla kiinnitetystä parafiiniin valetusta (FFPE) kasvainkudoksesta. Testi on kehitetty tunnistamaan BRAF V600E ja V600K ‑mutaatiot erittäin suurella herkkyydellä (jopa 5 %:n V600E‑ ja V600K‑sekvenssiä villityypin taustasekvenssistä, kun käytetään FFPE‑kudoksesta eristettyä DNA:ta). Prekliinisissä ja kliinisissä tutkimuksissa, joissa on käytetty retrospektiivisiä kaksisuuntaisia Sangerin sekvensointimenetelmiä, on osoitettu, että testi tunnistaa matalammalla herkkyydellä myös harvinaisemmat BRAF V600D‑ ja V600E/K601E‑mutaatiot. Prekliinisten ja kliinisten tutkimusten näytteet (n = 876), jotka oli THxID BRAF ‑testillä todettu mutaatiopositiivisiksi, sekvensoitiin myöhemmin vertailumenetelmällä, ja testin spesifisyys oli 94 %.
Kliininen teho ja turvallisuus
Leikkaukseen soveltumaton tai metastasoitunut melanooma
- Dabrafenibi yhdessä trametinibin kanssa
Potilaat, jotka eivät olleet aiemmin saaneet hoitoa
Trametinibin (2 mg kerran vuorokaudessa) ja dabrafenibin (150 mg kahdesti vuorokaudessa) yhdistelmän suositusannosten tehoa ja turvallisuutta tutkittiin kahdessa vaiheen III tutkimuksessa ja yhdessä vaiheen I/II lisätutkimuksessa aikuispotilailla, joilla oli leikkauskelvoton tai metastasoitunut BRAF V600 ‑mutaatiopositiivinen melanooma.
MEK115306 (COMBI‑d):
MEK115306 oli vaiheen III satunnaistettu, kaksoissokkoutettu tutkimus, jossa verrattiin dabrafenibin ja trametinibin yhdistelmää dabrafenibiin ja lumeeseen ensilinjan hoidossa tutkittavilla, joilla oli leikkauskelvoton (aste IIIC) tai metastasoitunut (aste IV) BRAF V600E/K ‑mutaatiopositiivinen ihomelanooma. Tutkimuksen ensisijainen päätetapahtuma oli etenemisvapaa elinaika ja tärkeä toissijainen päätetapahtuma oli kokonaiselinaika. Tutkittavat stratifioitiin laktaattidehydrogenaasiarvon (LDH) perusteella (> viitealueen yläraja [ULN] vs ≤ ULN) ja BRAF‑mutaation perusteella (V600E vs V600K).
Yhteensä 423 tutkittavaa satunnaistettiin suhteessa 1:1 saamaan joko yhdistelmähoitoa (N = 211) tai dabrafenibia (N = 212). Valtaosa tutkittavista oli kaukasialaista syntyperää (> 99 %) ja miehiä (53 %). Iän mediaani oli 56 vuotta (28 % oli ≥ 65‑vuotiaita). Valtaosalla tutkittavista oli asteen IVM1c tauti (67 %). Lähtötilanteessa valtaosalla tutkittavista LDH‑arvo oli ≤ ULN (65 %), Eastern Cooperative Oncology Group (ECOG) ‑toimintakykyluokka 0 (72 %) ja sisäelimet olivat affisioituneet (73 %). Valtaosalla tutkittavista oli BRAF V600E ‑mutaatio (85 %). Tutkimukseen ei otettu tutkittavia, joilla oli aivometastaaseja.
Kokonaiselinajan (OS) mediaani ja arvioidut 1 v, 2 v, 3 v, 4 v ja 5 v elossaolo-osuudet esitetään taulukossa 6. Viiden vuoden kohdalla tehdyssä OS-analyysissä kokonaiselinajan mediaani oli yhdistelmäryhmässä noin 7 kk pidempi kuin dabrafenibimonoterapiaryhmässä (25,8 kk vs 18,7 kk), ja 5 v elossaolo-osuus oli yhdistelmäryhmässä 32 %, kun taas dabrafenibimonoterapiaryhmän luku oli 27 % (taulukko 6, kuva 1). Kokonaiselinajan Kaplan–Meier-kuvaaja näyttää tasaantuvan 3 vuoden ja 5 vuoden välillä (ks. kuva 1). Potilailla, joiden lähtötilanteen laktaattidehydrogenaasiarvo oli normaali, 5 vuoden kokonaiselossaolo-osuus oli yhdistelmäryhmässä 40 % (95 % lv: 31,2–48,4) ja dabrafenibimonoterapiaryhmässä 33 % (95 % lv: 25,0–41,0). Potilailla, joiden lähtötilanteen laktaattidehydrogenaasiarvo oli koholla, luku puolestaan oli yhdistelmäryhmässä 16 % (95 % lv: 8,4–26,0) ja dabrafenibimonoterapiaryhmässä 14 % (95 % lv: 6,8–23,1).
Taulukko 6 Kokonaiselinajan tulokset, tutkimus MEK115306 (COMBI‑d)
OS-analyysi (tiedonkeruun katkaisu: 12.1.2015) | 5 vuoden OS-analyysi (tiedonkeruun katkaisu: 10.12.2018) | |||
| Dabrafenibi + trametinibi (n = 211) | Dabrafenibi + lumelääke (n = 212) | Dabrafenibi + trametinibi (n = 211) | Dabrafenibi + lumelääke (n = 212) | |
| Potilasmäärä | ||||
| Kuolemantapaukset (tapahtumat), n (%) | 99 (47) | 123 (58) | 135 (64) | 151 (71) |
| OS-estimaatit (kk) | ||||
| Mediaani (95 % lv) | 25,1 (19,2–NR) | 18,7 (15,2–23,7) | 25,8 (19,2–38,2) | 18,7 (15,2–23,1) |
| Riskitiheyssuhde (95 % lv) | 0,71 (0,55–0,92) | 0,80 (0,63–1,01) | ||
| p-arvo | 0,011 | NA | ||
| Kokonaiselinajan estimaatti, % (95 % lv) | Dabrafenibi + trametinibi (n = 211) | Dabrafenibi + lumelääke (n = 212) | ||
| 1 vuoden kohdalla | 74 (66,8–79,0) | 68 (60,8–73,5) | ||
| 2 vuoden kohdalla | 52 (44,7–58,6) | 42 (35,4–48,9) | ||
| 3 vuoden kohdalla | 43 (36,2–50,1) | 31 (25,1–37,9) | ||
| 4 vuoden kohdalla | 35 (28,2–41,8) | 29 (22,7–35,2) | ||
| 5 vuoden kohdalla | 32 (25,1–38,3) | 27 (20,7–33,0) | ||
| NR = ei saavutettu, NA = ei oleellinen | ||||
Kuva 1 Kaplan–Meier‑kuvaajat kokonaiselinajasta MEK115306‑tutkimuksessa (ITT‑populaatio)
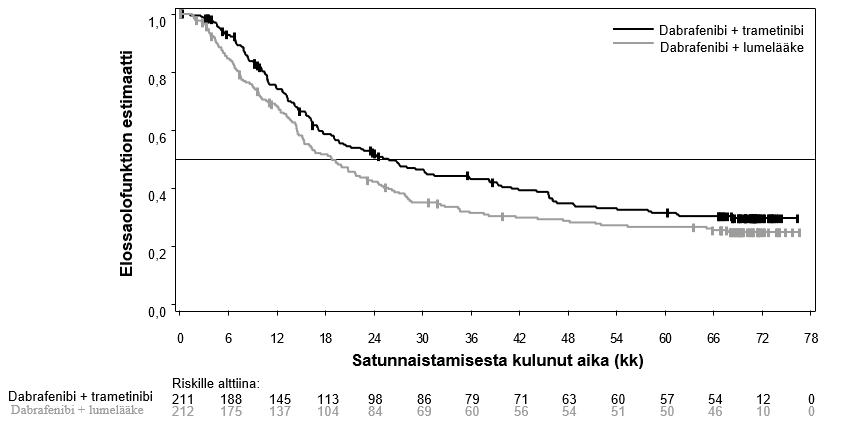
Ensisijaisen päätetapahtuman (etenemisvapaa elinaika) paremmuus yhdistelmäryhmässä verrattuna dabrafenibimonoterapiaan säilyi 5 vuoden ajan. Myös kokonaisvasteprosentissa havaittiin kohenemista ja vasteen kesto oli pidempi yhdistelmäryhmässä verrattuna dabrafenibimonoterapiaan (taulukko 7).
Taulukko 7 MEK115306‑tutkimuksen tehoa osoittavat tulokset (COMBI‑d)
| Ensisijainen analyysi (tiedonkeruun katkaisu: 26.8.2013) | Päivitetty analyysi (tiedonkeruun katkaisu: 12.1.2015) | 5 vuoden analyysi (tiedonkeruun katkaisu: 10.12.2018) | ||||
| Päätetapahtuma | Dabrafenibi + trametinibi (n = 211) | Dabrafenibi + lumelääke (n = 212) | Dabrafenibi + trametinibi (n = 211) | Dabrafenibi + lumelääke (n= 212) | Dabrafenibi + trametinibi (n = 211) | Dabrafenibi + lumelääke (n = 212) |
| Etenemisvapaa elinaika (PFS)a | ||||||
| Etenevä tauti tai kuolema, n (%) | 102 (48) | 109 (51) | 139 (66) | 162 (76) | 160 (76) | 166 (78) |
| PFS‑mediaani (kk) (95 % lv) | 9,3 (7,7–11,1) | 8,8 (5,9–10,9) | 11,0 (8,0–13,9) | 8,8 (5,9–9,3) | 10,2 (8,1–12,8) | 8,8 (5,9–9,3) |
Riskitiheyssuhde (95 % lv) | 0,75 (0,57–0,99) | 0,67 (0,53–0,84) | 0,73 (0,59–0,91) | |||
| p‑arvo | 0,035 | < 0,001f | NA | |||
Kokonaisvaste-prosenttib % (95 % lv) | 67 (59,9–73,0) | 51 (44,5–58,4) | 69 (61,8–74,8) | 53 (46,3–60,2) | 69 (62,5–75,4) | 54 (46,8–60,6) |
Kokonaisvaste-prosenttien ero (95 % lv) | 15e (5,9–24,5) | 15e (6,0–24,5) | NA | |||
| p‑arvo | 0,0015 | 0,0014f | NA | |||
Vasteen kestoc (kk) Mediaani (95 % lv) | 9,2d (7,4–NR) | 10,2d (7,5–NR) | 12,9 (9,4–19,5) | 10,6 (9,1–13,8) | 12,9 (9,3–18,4) | 10,2 (8,3–13,8) |
a Etenemisvapaa elossaolo (tutkijan arvioima) b Kokonaisvasteprosentti = täydellinen vaste + osittainen vaste c Vasteen kesto d Ilmoitusajankohtana valtaosa (≥ 59 %) tutkijan arvioimista vasteista jatkui yhä e Kokonaisvasteprosenttien ero laskettiin pyöristämättömien kokonaisvasteprosenttitulosten perusteella f Päivitetty analyysi ei ollut ennalta suunniteltu, eikä p-arvoa mukautettu useampaan testaamiseen NR = Ei saavutettu NA = Ei oleellinen | ||||||
MEK116513 (COMBI‑v):
MEK116513 oli kaksiryhmäinen, satunnaistettu, avoin vaiheen III tutkimus, jossa verrattiin dabrafenibin ja trametinibin yhdistelmää pelkkään vemurafenibiin BRAF V600 ‑mutaatiopositiivisessa leikkaukseen soveltumattomassa tai metastasoituneessa melanoomassa. Tutkimuksen ensisijainen päätetapahtuma oli kokonaiselinaika ja tärkeä toissijainen päätetapahtuma etenemisvapaa elinaika. Tutkittavat stratifioitiin laktaattidehydrogenaasiarvon (LDH) perusteella (> viitealueen yläraja [ULN] vs ≤ ULN) ja BRAF‑mutaation perusteella (V600E vs V600K).
Yhteensä 704 tutkittavaa satunnaistettiin suhteessa 1:1 saamaan joko yhdistelmähoitoa tai vemurafenibia. Valtaosa tutkittavista oli kaukasialaista syntyperää (> 96 %) ja miehiä (55 %). Iän mediaani oli 55 vuotta (24 % oli ≥ 65‑vuotiaita). Valtaosalla tutkittavista oli asteen IVM1c tauti (yhteensä 61 %). Lähtötilanteessa valtaosalla tutkittavista LDH‑arvo oli ≤ ULN (67 %), ECOG‑toimintakykyluokka 0 (70 %) ja sisäelimet olivat affisioituneet (78 %). Kaiken kaikkiaan 54 %:lla tutkittavista oli lähtötilanteessa < 3 tautialuetta. Valtaosalla tutkittavista oli BRAF V600E ‑mutaatiopositiivinen melanooma (89 %). Tutkimukseen ei otettu tutkittavia, joilla oli aivometastaaseja.
Kokonaiselinajan (OS) mediaani ja arvioidut 1 v, 2 v, 3 v, 4 v ja 5 v elossaolo-osuudet esitetään taulukossa 8. Viiden vuoden kohdalla tehdyssä OS-analyysissä kokonaiselinajan mediaani oli yhdistelmäryhmässä noin 8 kk pidempi kuin vemurafenibimonoterapiaryhmässä (26,0 kk vs 17,8 kk), ja 5 v elossaolo-osuus oli yhdistelmäryhmässä 36 %, kun taas vemurafenibimonoterapiaryhmän luku oli 23 % (taulukko 8, kuva 2). Kokonaiselinajan Kaplan–Meier-kuvaaja näyttää tasaantuvan 3 vuoden ja 5 vuoden välillä (ks. kuva 2). Potilailla, joiden lähtötilanteen laktaattidehydrogenaasiarvo oli normaali, 5 vuoden kokonaiselossaolo-osuus oli yhdistelmäryhmässä 46 % (95 % lv: 38,8–52,0) ja vemurafenibimonoterapiaryhmässä 28 % (95 % lv: 22,5–34,6). Potilailla, joiden lähtötilanteen laktaattidehydrogenaasiarvo oli koholla, luku puolestaan oli yhdistelmäryhmässä 16 % (95 % lv: 9,3–23,3) ja vemurafenibimonoterapiaryhmässä 10 % (95 % lv: 5,1–17,4).
Taulukko 8 Kokonaiselinajan tulokset, tutkimus MEK116513 (COMBI‑v)
OS-analyysi (tiedonkeruun katkaisu: 13.3.2015) | 5 vuoden OS-analyysi (tiedonkeruun katkaisu: 8.10.2018) | |||
Dabrafenibi + trametinibi (n = 352) | Vemurafenibi (n = 352) | Dabrafenibi + trametinibi (n = 352) | Vemurafenibi (n = 352) | |
| Potilasmäärä | ||||
| Kuolemantapaukset (tapahtumat), n (%) | 155 (44) | 194 (55) | 216 (61) | 246 (70) |
| OS-estimaatit (kk) | ||||
| Mediaani (95 % lv) | 25,6 (22,6–NR) | 18,0 (15,6–20,7) | 26,0 (22,1–33,8) | 17,8 (15,6–20,7) |
| Korjattu riskitiheyssuhde (95 % lv) | 0,66 (0,53–0,81) | 0,70 (0,58–0,84) | ||
| p-arvo | < 0,001 | NA | ||
| Kokonaiselinajan estimaatti, % (95 % lv) | Dabrafenibi + trametinibi (n = 352) | Vemurafenibi (n = 352) | ||
| 1 vuoden kohdalla | 72 (67–77) | 65 (59–70) | ||
| 2 vuoden kohdalla | 53 (47,1–57,8) | 39 (33,8–44,5) | ||
| 3 vuoden kohdalla | 44 (38,8–49,4) | 31 (25,9–36,2) | ||
| 4 vuoden kohdalla | 39 (33,4–44,0) | 26 (21,3–31,0) | ||
| 5 vuoden kohdalla | 36 (30,5–40,9) | 23 (18,1–27,4) | ||
| NR = Ei saavutettu, NA = Ei oleellinen | ||||
Kuva 2 Kaplan–Meier‑kuvaajat MEK116513‑tutkimuksen kokonaiselinajan analyysistä
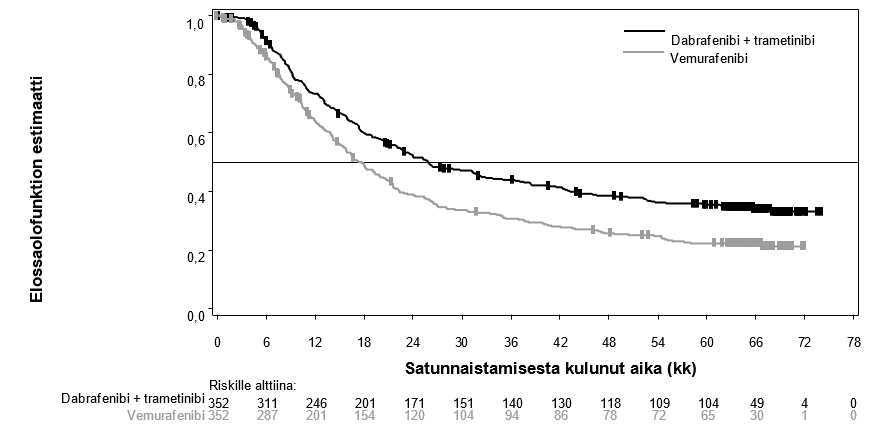
Toissijaisen päätetapahtuman (etenemisvapaa elinaika) paremmuus säilyi 5 vuoden ajan yhdistelmäryhmässä verrattuna vemurafenibimonoterapiaan. Kohenemista havaittiin myös kokonaisvasteprosentissa, ja vasteen kesto oli pidempi yhdistelmäryhmässä verrattuna vemurafenibimonoterapiaan (taulukko 9).
Taulukko 9 MEK116513‑tutkimuksen tehoa osoittavat tulokset (COMBI‑v)
| Ensisijainen analyysi (tiedonkeruun katkaisu: 17.4.2014) | 5 vuoden analyysi (tiedonkeruun katkaisu: 8.10.2018) | |||
| Päätetapahtuma | Dabrafenibi + trametinibi (n = 352) | Vemurafenibi (n = 352) | Dabrafenibi + trametinibi (n = 352) | Vemurafenibi (n = 352) |
| Etenemisvapaa elinaika (PFS)a | ||||
Etenevä tauti tai kuolema, n (%) | 166 (47) | 217 (62) | 257 (73) | 259 (74) |
PFS‑mediaani (kk) (95 % lv) | 11,4 (9,9–14,9) | 7,3 (5,8–7,8) | 12,1 (9,7–14,7) | 7,3 (6,0–8,1) |
Riskitiheyssuhde (95 % lv) | 0,56 (0,46–0,69) | 0,62 (0,52–0,74) | ||
| p‑arvo | < 0,001 | NA | ||
Kokonaisvasteprosenttib % (95 % lv) | 64 (59,1–69,4) | 51 (46,1–56,8) | 67 (62,2–72,2) | 53 (47,2–57,9) |
Kokonaisvasteprosenttien ero (95 % lv) | 13 (5,7–20,2) | NA | ||
| p‑arvo | 0,0005 | NA | ||
Vasteen kestoc (kk) Mediaani (95 % lv) | 13,8d (11,0–NR) | 7,5d (7,3–9,3) | 13,8 (11,3–18,6) | 8,5 (7,4–9,3) |
a Etenemisvapaa elossaolo (tutkijan arvioima) b Kokonaisvasteprosentti = täydellinen vaste + osittainen vaste c Vasteen kesto d Ilmoitusajankohtana valtaosa (dabrafenibi + trametinibiryhmässä 59 % ja vemurafenibiryhmässä 42 %) tutkijan arvioimista hoitovasteista jatkui yhä NR = Ei saavutettu NA = Ei oleellinen | ||||
Aikaisempi BRAF‑estäjähoito
Tietoja on rajallisesti potilaista, jotka käyttävät dabrafenibin ja trametinibin yhdistelmää ja joiden tauti on edennyt aiemman BRAF‑estäjähoidon aikana.
BRF113220‑tutkimuksen B‑osaan kuului kohortti, jonka 26 potilaalla tauti oli edennyt BRAF‑estäjähoidon aikana. Trametinibin (2 mg kerran vuorokaudessa) ja dabrafenibin (150 mg kahdesti vuorokaudessa) yhdistelmällä oli rajallisesti kliinistä aktiivisuutta potilailla, joiden tauti oli edennyt BRAF‑estäjähoidon aikana. Tutkijan arvioima vahvistettu vasteprosentti oli 15 % (95 % lv: 4,4–34,9) ja etenemisvapaan elinajan mediaani 3,6 kuukautta (95 % lv: 1,9–5,2). Samankaltaisia tuloksia todettiin 45 potilaalla, jotka siirtyivät pelkästä dabrafenibista trametinibin (2 mg kerran vuorokaudessa) ja dabrafenibin (150 mg kahdesti vuorokaudessa) yhdistelmään tutkimuksen C‑osassa. Näillä potilailla vahvistettu vasteprosentti oli 13 % (95 % lv: 5,0–27,0) ja etenemisvapaan elinajan mediaani 3,6 kuukautta (95 % lv: 2–4).
Potilaat, joilla on aivometastaaseja
Dabrafenibin ja trametinibin yhdistelmän tehoa ja turvallisuutta on arvioitu ei‑satunnaistetussa avoimessa vaiheen II monikeskustutkimuksessa (COMBI-MB-tutkimus) potilailla, joilla on BRAF‑mutaatiopositiivinen, aivometastaaseja aiheuttanut melanooma. Yhteensä 125 potilasta otettiin mukaan neljään kohorttiin:
- Kohortti A: potilaat, joilla oli BRAFV600E-mutatoitunut melanooma, oireettomia aivometastaaseja, ei aiempaa paikallista aivoihin kohdistuvaa hoitoa ja ECOG-toimintakykyluokka 0 tai 1.
- Kohortti B: potilaat, joilla oli BRAFV600E-mutatoitunut melanooma, oireettomia aivometastaaseja, saaneet aiempaa paikallista aivoihin kohdistuvaa hoitoa ja ECOG-toimintakykyluokka 0 tai 1.
- Kohortti C: potilaat, joilla oli BRAFV600D/K/R-mutatoitunut melanooma, oireettomia aivometastaaseja, joko olivat tai eivät olleet saaneet aiempaa paikallista aivoihin kohdistuvaa hoitoa ja ECOG-toimintakykyluokka 0 tai 1.
- Kohortti D: potilaat, joilla oli BRAFV600D/E/K/R-mutatoitunut melanooma, oireisia aivometastaaseja, joko olivat tai eivät olleet saaneet aiempaa paikallista aivoihin kohdistuvaa hoitoa ja ECOG-toimintakykyluokka 0 tai 1 tai 2.
Tutkimuksen ensisijainen päätetapahtuma oli intrakraniaalinen vaste kohortissa A. Sen määritelmä oli prosenttiosuus potilaista, joilla oli vahvistettu tutkijan arvioima intrakraniaalinen vaste ‘modified Response Evaluation Criteria In Solid Tumors’ (RECIST) version 1.1 ‑kriteerejä käyttäen. Tutkijan arvioima intrakraniaalinen vaste kohorteissa B, C ja D olivat tutkimuksen toissijaisia päätetapahtumia. Leveän 95 % luottamusvälin kuvastaman pienen otoskoon vuoksi kohorttien B, C ja D tuloksia on tulkittava varovaisesti. Tehoa osoittavat tulokset on esitetty yhteenvetona taulukossa 10.
Taulukko 10 Tutkijan arvioon perustuvat tiedot tehosta COMBI-MB-tutkimuksessa
| Kaikkien hoidettujen potilaiden ryhmä | ||||
| Päätetapahtumat/ arvio | Kohortti A N = 76 | Kohortti B N = 16 | Kohortti C N = 16 | Kohortti D N = 17 |
| Intrakraniaalisen vasteen osuus, % (95 % lv) | ||||
59 % (47,3–70,4) | 56 % (29,9–80,2) | 44 % (19,8–70,1) | 59 % (32,9–81,6) | |
| Intrakraniaalisen vasteen kesto, mediaani (kk) (95 % lv) | ||||
6,5 (4,9–8,6) | 7,3 (3,6–12,6) | 8,3 (1,3–15,0) | 4,5 (2,8–5,9) | |
| Kokonaisvasteprosentti, % (95 % lv) | ||||
59 % (47,3–70,4) | 56 % (29,9–80,2) | 44 % (19,8–70,1) | 65 % (38,3–85,8) | |
| Etenemisvapaa elinaika, mediaani (kk) (95 % lv) | ||||
5,7 (5,3–7,3) | 7,2 (4,7–14,6) | 3,7 (1,7–6,5) | 5,5 (3,7–11,6) | |
| Kokonaiselinaika, mediaani (kk) (95 % lv) | ||||
10,8 (8,7–17,9) | 24,3 (7,9–NR) | 10,1 (4,6–17,6) | 11,5 (6,8–22,4) | |
| lv = luottamusväli, NR = ei saavutettu | ||||
- Dabrafenibi ainoana hoitona
Dabrafenibin tehoa aikuisilla potilailla leikkaukseen soveltumattoman tai metastasoituneen BRAF V600 ‑mutaatiopositiivisen melanooman hoidossa arvioitiin kolmessa kliinisessä tutkimuksessa (BRF113683 [BREAK‑3], BRF113929 [BREAK‑MB] ja BRF113710 [BREAK‑2]) potilailla, joiden kasvaimessa oli todettu BRAF V600E‑ ja/tai V600K‑mutaatio.
Näissä kliinisissä tutkimuksissa yhteensä 402 potilaalla todettiin BRAF V600E‑ ja 49 potilaalla BRAF V600K‑mutaatio. Melanoomapotilaat, joilla oli jokin muu kuin BRAF‑mutaatio kuin V600E‑mutaatio suljettiin pois vahvistustutkimuksesta. Yhden hoitohaaran kliinisissä tutkimuksissa dabrafenibin aktiviteetti näyttää matalammalta V600K kasvaimissa kuin V600E kasvaimilla.
Käytettävissä ei ole tutkimustietoa melanoomapotilaista, joilla olisi todettu jokin muu BRAF V600 ‑mutaatio kuin V600E tai V600K. Dabrafenibin tehoa ei ole tutkittu sellaisten potilaiden hoidossa, jotka ovat aikaisemmin saaneet jotakin proteiinikinaasin estäjää.
Aikaisemmin hoitamattomat potilaat (kolmannen vaiheen tutkimuksen [BREAK‑3] tulokset)
Dabrafenibin tehoa ja turvallisuutta arvioitiin satunnaistetussa avoimessa kolmannen vaiheen tutkimuksessa [BREAK 3], jossa dabrafenibia verrattiin dakarbatsiiniin (DTIC) aikaisemmin hoitamattomilla potilailla, joilla oli BRAF V600E ‑mutaatiopositiivinen levinnyt (leikkaukseen soveltumaton asteen III) tai metastasoitunut (asteen IV) melanooma. Potilaat, joiden kasvaimessa oli muu kuin BRAF V600E‑mutaatio, suljettiin pois tutkimuksesta.
Tämän tutkimuksen ensisijainen tavoite oli arvioida dabrafenibin tehoa verrattuna DTIC‑hoitoon käyttäen kriteerinä tutkijan arvioon perustuvaa etenemisvapaata elinaikaa (PFS). DTIC‑hoitohaaran potilaat saivat vaihtaa hoidon dabrafenibiin, kun taudin eteneminen oli vahvistettu riippumattomassa radiologisessa arvioinnissa. Potilaiden ominaisuudet lähtötilanteessa olivat samanlaiset kummassakin hoitoryhmässä. Potilaista 60 % oli miehiä ja 99,6 % oli kaukasialaista syntyperää. Mediaani‑ikä oli 52 vuotta ja 21 % potilaista oli ≥ 65‑vuotiaita, 98,4 %:lla ECOG‑toimintakykyluokka oli 0 tai 1 ja 97 %:lla oli metastasoitunut tauti.
Etukäteen määritetyssä analyysissä, jonka tiedonkeräyksen katkaisukohta (data cut) oli 19.12.2011, havaittiin merkitsevää paranemista etenemisvapaassa elinajassa, joka oli ensisijainen päätetapahtuma (HR = 0,30; 95 %:n lv: 0,18–0,51; p < 0,0001). Taulukossa 11 on tiivistelmä primaarianalyysiin ja 6 kuukauden lisäseurannan jälkeen tehtyyn post hoc ‑analyysiin perustuvista tehoa mittaavista tuloksista. Kuvassa 3 on esitetty kokonaiselinajan tiedot post hoc ‑lisäanalyysistä tiedonkeräyksen katkaisukohdassa 18.12.2012.
Taulukko 11 Teho aikaisemmin hoitamattomilla potilailla (BREAK‑3‑tutkimus, 25.6.2012)
Tiedot 19.12.2011 asti | Tiedot 25.6.2012 asti | |||
Dabrafenibi N = 187 | DTIC N = 63 | Dabrafenibi N = 187 | DTIC N = 63 | |
| Etenemisvapaa elinaika (PFS) | ||||
| Mediaani, kk (95 % lv) | 5,1 (4,9–6,9) | 2,7 (1,5–3,2) | 6,9 (5,2–9,0) | 2,7 (1,5–3,2) |
| HR (95 % lv) | 0,30 (0,18–0,51) P < 0,0001 | 0,37 (0,24–0,58) P < 0,0001 | ||
| Kokonaisvastea | ||||
| % (95 % lv) | 53 (45,5–60,3) | 19 (10,2–30,9) | 59 (51,4–66,0) | 24 (14–36,2) |
| Vasteen kesto | ||||
| Mediaani, kk (95 % lv) | N = 99 5,6 (4,8–NR) | N = 12 NR (5,0–NR) | N = 110 8,0 (6,6–11,5) | N = 15 7,6 (5,0–9,7) |
Lyhenteet: lv: luottamusväli; DTIC: dakarbatsiini; HR: riskitiheyssuhde; NR: ei saavutettu a Vahvistettu täydellinen + osittainen vaste. | ||||
Tiedonkeräyksen katkaisukohdassa 25.6.2012 DTIC‑ryhmään satunnaistetuista 63 potilaasta 35 (55,6 %) oli siirtynyt dabrafenibihoitoon, ja dabrafenibiryhmään satunnaistetuista potilaista 63 % ja DTIC‑ryhmään satunnaistetuista 79 % oli kuollut tai heidän tautinsa oli edennyt. Etenemisvapaan elinajan mediaani oli 4,4 kuukautta hoidon vaihtamisen jälkeen.
Taulukko 12 Elossaolotiedot primaarisesta analyysistä ja post hoc ‑analyyseistä
| Katkaisukohta | Hoito | Kuolemantapauksia (%) | Riskitiheyssuhde (95 % lv) |
| 19.12.2011 | DTIC | 9 (14 %) | 0,61 (0,25–1,48) (a) |
| dabrafenibi | 21 (11 %) | ||
| 25.6.2012 | DTIC | 21 (33 %) | 0,75 (0,44–1,29) (a) |
| dabrafenibi | 55 (29 %) | ||
| 18.12.2012 | DTIC | 28 (44 %) | 0,76 (0,48–1.21) (a) |
| dabrafenibi | 78 (42 %) | ||
| (a) Potilaita ei sensuroitu hoidon vaihtamisen ajankohtana | |||
Kokonaiselinajan tiedot toisesta post hoc ‑analyysistä, jonka tiedonkeräyksen katkaisukohta oli 18.12.2012, osoittivat, että 12 kuukauden elossaolo‑osuus oli dabrafenibihoitoa saaneessa ryhmässä 70 % ja DTIC‑ryhmässä 63 %.
Kuva 3 Kokonaiselinajan Kaplan–Meier‑kuvaajat (BREAK‑3) (18.12.2012)
Potilaat, joilla oli aivometastaaseja (toisen vaiheen tutkimuksen (BREAK‑MB) tulokset)
BREAK‑MB oli toisen vaiheen avoin, kahden kohortin monikeskustutkimus, jonka tarkoituksena oli arvioida kallonsisäistä dabrafenibivastetta potilailla, joilla oli histologisesti vahvistettu (levinneisyysasteen IV) aivoihin metastasoitunut BRAF‑mutaatiopositiivinen (V600E tai V600K) melanooma. Potilaat otettiin kohorttiin A (potilaat, jotka eivät olleet aikaisemmin saaneet paikallishoitoa aivometastaaseihin) tai kohorttiin B (potilaat, jotka olivat saaneet paikallishoitoa aivometastaaseihin).
Tutkimuksen ensisijainen päätetapahtuma oli tutkijan arvioon perustuva kallonsisäinen kokonaisvaste (overall intracranial response rate (OIRR)) V600E‑potilasjoukossa. Vahvistettu OIRR ja muut tutkijan arvioon perustuvat tehoa mittaavat tulokset on esitetty taulukossa 13.
Taulukko 13 Tehoa mittaavat tulokset potilailla, joilla oli aivometastaaseja (BREAK‑MB‑tutkimus)
| Kaikki hoitoa saaneet potilaat | ||||
| BRAF V600E (ensisijainen) | BRAF V600K | |||
Kohortti A N = 74 | Kohortti B N = 65 | Kohortti A N = 15 | Kohortti B N = 18 | |
| Kallonsisäinen kokonaisvaste (OIRR), % (95 % lv)a | ||||
39 % (28,0–51,2) P < 0,001b | 31 % (19,9–43,4) P < 0,001b | 7 % (0,2–31,9) | 22 % (6,4–47,6) | |
| Kallonsisäisen vasteen kesto, mediaani, kuukautta (95 % lv) | ||||
N = 29 4,6 (2,8–NR) | N = 20 6,5 (4,6–6,5) | N = 1 2,9 (NR–NR) | N = 4 3,8 (NR–NR) | |
| Kokonaisvaste, % (95 % lv)a | ||||
| 38 % (26,8–49,9) | 31 % (19,9–43,4) | 0 (0–21,8) | 28 % (9,7–53,5) | |
| Vasteen kesto, mediaani, kuukautta (95 % lv) | ||||
N = 28 5,1 (3,7–NR) | N = 20 4,6 (4,6–6,5) | NA | N = 5 3,1 (2,8–NR) | |
| Etenemisvapaa elinaika, mediaani, kuukautta (95 % lv) | ||||
| 3,7 (3,6–5,0) | 3,8 (3,6–5,5) | 1,9 (0,7–3,7) | 3,6 (1,8–5,2) | |
| Kokonaiselinaika, mediaani, kuukautta (95 % lv) | ||||
| Mediaani, kk | 7,6 (5,9–NR) | 7,2 (5,9–NR) | 3,7 (1,6–5,2) | 5,0 (3,5–NR) |
Lyhenteet: lv: luottamusväli; NR: ei saavutettu; NA: ei oleellinen a Vahvistettu vaste. b Tämän tutkimusasetelman tarkoituksena oli vahvistaa nollahypoteesi OIRR ≤ 10 % (perustuu aikaisempiin tuloksiin) tai hylätä se vaihtoehtoisen hypoteesin OIRR ≥ 30 % hyväksi BRAF V600E ‑mutaatiopositiivisilla potilailla. | ||||
Aikaisemmin hoitamattomat potilaat tai potilaat, joiden vähintään yksi aikaisempi systeeminen hoito oli osoittautunut tehottomaksi (toisen vaiheen tutkimuksen [BREAK‑2] tulokset)
BRF113710 (BREAK‑2) oli yhden hoitohaaran monikeskustutkimus, johon otetuilla 92 potilaalla oli metastasoitunut (levinneisyysaste IV) vahvistettu BRAF V600E‑ tai V600K‑mutaatiopositiivinen melanooma.
Tutkijan arvioon perustuva vahvistettu vasteosuus potilailla, joilla oli metastasoitunut BRAF V600E ‑melanooma (n = 76), oli 59 % (95 % lv: 48,2–70,3) ja vasteen keston mediaani oli 5,2 kuukautta (95 % lv: 3,9–ei laskettavissa) keskimäärin 6,5 kuukauden (mediaani) seuranta‑ajan perusteella. Potilailla, joilla oli metastasoitunut BRAF V600K ‑mutaatiopositiivinen melanooma (n = 16), vasteosuus oli 13 % (95 % lv: 0,0–28,7) ja vasteen keston mediaani oli 5,3 kuukautta (95 % lv: 3,7–6,8). Vaikka rajoittavana tekijänä on pieni potilasmäärä, kokonaiselinajan mediaani näyttää vastaavan niiden potilaiden tuloksia, joilla oli BRAF V600E ‑mutaatiopositiivisia kasvaimia.
Asteen III melanooman liitännäishoito
BRF115532 (COMBI-AD)
Dabrafenibin ja trametinibin yhdistelmähoidon tehoa ja turvallisuutta tutkittiin vaiheen III satunnaistetussa, kaksoissokkoutetussa, lumelääke-kontrolloidussa monikeskustutkimuksessa, johon osallistui asteen III (aste IIIA [imusolmukemetastaasi > 1 mm], IIIB tai IIIC) BRAF V600 E/K mutaatiopositiivista ihomelanoomaa sairastavia potilaita, joiden kasvain oli kokonaan poistettu leikkauksella.
Potilaat satunnaistettiin 1:1 suhteessa saamaan joko yhdistelmähoitoa (150 mg dabrafenibia kahdesti vuorokaudessa ja 2 mg trametinibia kerran vuorkaudessa) tai kahta lumelääkettä 12 kuukauden ajan. Tutkimukseen otettiin potilaita, joilta melanooma oli kokonaan poistettu leikkauksella ja joille oli tehty imusolmukkeidenpoistoleikkaus satunnaistamista edeltävien 12 viikon aikana. Mitään aikaisempaa systeemistä syöpähoitoa, mukaanlukien sädehoito, ei sallittu.. Potilaat, joilla oli aikaisemmin ollut pahanlaatuinen kasvain, olivat soveltuvia tutkimukseen, jos tautivapaan ajan pituus oli vähintään 5 vuotta. Potilaat, joilla oli todettu pahanlaatuinen kasvain ja siinä aktivoiva RAS-mutaatio, eivät olleet soveltuvia tutkimukseen. Potilaat stratifioitiin BRAF mutaation tyypin (V600E vs. V600K) ja leikkausta edeltäneen taudin asteen (asteen III alaryhmät, osoittaen eriasteisia imusolmukemetastasointeja sekä primaarikasvaimen kokoa ja ulseraatiota) perusteella. Taudin aste määriteltiin American Joint Committee on Cancer (AJCC) 7th edition Melanoma Staging System ‑kriteerien avulla. Ensisijainen päätetapahtuma oli tutkijan arvioima uusiutumisvapaa elinaika (RFS), joka määriteltiin satunnaistamisesta taudin uusiutumiseen tai mistä tahansa syystä johtuneeseen kuolemaan kuluneeksi ajaksi. Kasvain arvioitiin radiologisesti 3 kuukauden välein ensimmäisten kahden vuoden aikana, ja 6 kuukauden välein sen jälkeen, kunnes havaittiin ensimmäisen kerran taudin uusiutuminen. Toissijaisia päätetapahtumia olivat kokonaiselinaika (OS; tärkeä toissijainen päätetapahtuma), taudin uusiutumattomuus (freedom from recurrence = FFR) ja kaukoetäpesäkkeistä vapaa elinaika (DMFS).
870 potilasta satunnaistettiin yhdistelmähoitoryhmään (n = 438) ja lumelääkeryhmään (n = 432). Suurin osa potilaista oli kaukasialaista alkuperää (99 %) ja miehiä (55 %), ja potilaiden mediaani-ikä oli 51 vuotta (18 % oli ≥ 65-vuotiaita). Tutkimus sisälsi potilaita kaikista asteen III alaryhmistä (taudin aste ennen kasvaimen poistamista leikkauksella); 18 %:lla potilaista oli ainoastaan mikroskooppisesti havaittava imusolmukemetastasointi eikä primaarikasvaimeen liittynyt ulseraatiota. Suurimmalla osalla potilaista oli BRAF V600E mutaatio (91 %).
Seuranta-ajan mediaani primaarianalyysin ajankohtana oli 2,83 vuotta dabrafenibin ja trametinibin yhdistelmähoidon ryhmässä ja 2,75 vuotta lumelääkeryhmässä.
Uusiutumisvapaan elinajan primaarianalyysin tulokset esitetään taulukossa 14. Tutkimus osoitti, että hoitoryhmien välillä oli tilastollisesti merkitsevä ero tutkijan arvioimassa uusiutumisvapaassa elinajassa, joka oli tutkimuksen ensisijainen vastemuuttuja. Uusiutumisvapaan elinajan mediaani oli lumelääkeryhmässä 16,6 kuukautta, ja yhdistelmähoitoryhmässä sitä ei ole vielä saavutettu (HR = 0,47; 95 % lv: 0,39–0.58; p = 1,53×10-14). Hyöty uusiutumisvapaassa elinajassa osoitettiin johdonmukaisesti eri potilasryhmissä mukaanlukien ikä, sukupuoli ja rotu. Tulokset olivat johdonmukaiset myös, kun huomioitiin taudin asteeseen ja BRAF V600 mutaation tyyppiin liittyvät stratifikaatioperusteet.
Taulukko 14 Tutkijan arvioimat uusiutumisvapaan elinajan tulokset BRF115532 (COMBI-AD primaarianalyysi) -tutkimuksessa
| Dabrafenibi + Trametinibi | Lumelääke | |
| RFS parametri | N = 438 | N = 432 |
Tapahtumien lukumäärä, n (%) Taudin uusiutuminen Uusiutuminen johon liittyy kaukoetäpesäke Kuolema | 166 (38 %) 163 (37 %) 103 (24 %) 3 (< 1 %) | 248 (57 %) 247 (57 %) 133 (31 %) 1 (< 1 %) |
Mediaani (kk) (95 % lv) | Ei arvioitavissa (44,5–Ei arvioitavissa) | 16,6 (12,7–22,1) |
Riskitiheyssuhde[1] (95 % lv) p-arvo[2] | 0,47 (0,39–0,58) 1,53 × 10-14 | |
| Osuus 1 vuoden kohdalla (95 % lv) | 0,88 (0,85–0,91) | 0,56 (0,51–0,61) |
| Osuus 2 vuoden kohdalla (95 % lv) | 0,67 (0,63–0,72) | 0,44 (0,40–0,49) |
| Osuus 3 vuoden kohdalla (95 % lv) | 0,58 (0,54–0,64) | 0,39 (0,35–0,44) |
[1] Riskitiheyssuhde saatiin stratifioidusta Pike -mallista. [2] P-arvo saatiin kaksipuolisesta stratifioidusta logrank -testistä (stratifiointitekijöitä olivat taudin aste IIIA vs. IIIB vs. IIIC – ja BRAF V600 mutaation tyyppi – V600E vs. V600K) | ||
Kun verrattiin päivitettyjä 29 kuukautta pidempään kestäneen seurannan tietoja ja primaarianalyysin (seurannan kesto vähintään 59 kuukautta) tietoja, havaittiin, että RFS-hyöty säilyi ja arvioitu HR oli 0,51 (95 % lv: 0,42–0,61 (Kuva 4). 5 vuoden RFS-lukema oli 52 % (95 % lv: 48, 58) yhdistelmähoitoryhmässä ja 36 % (95 % lv: 32, 41) lumelääkeryhmässä.
Kuva 4 Kaplan-Meier-kuvaajat uusiutumisvapaasta elinajasta BRF115532-tutkimuksessa (ITT-populaatio, päivitetyt tulokset)
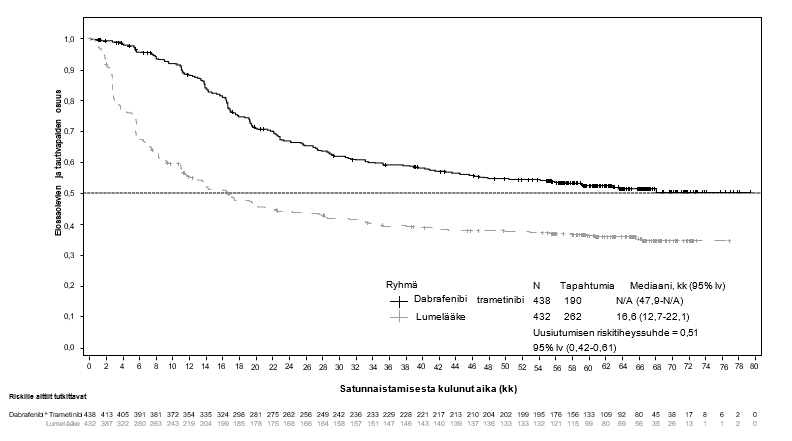
Lopullista kokonaiselinaikaa analysoitaessa seuranta-ajan mediaani oli yhdistelmähoitoryhmässä 8,3 vuotta ja lumelääkeryhmässä 6,9 vuotta. Kokonaiselinajassa havaittu ero ei ollut tilastollisesti merkitsevä (HR: 0,80; 95 % lv: 0,62–1,01). Yhdistelmähoitoryhmässä oli 125 tapahtumaa (29 %) ja lumelääkeryhmässä 136 tapahtumaa (31 %). Arvioitu kokonaiselossaolo-osuus 5 vuoden kohdalla oli yhdistelmähoitoryhmässä 79 % ja lumelääkeryhmässä 70 %, ja 10 vuoden kohdalla yhdistelmähoitoryhmässä 66 % ja lumelääkeryhmässä 63 %.
Ei‑pienisoluinen keuhkosyöpä
Tutkimus BRF113928
Dabrafenibin ja trametinibin ja yhdistelmähoidon tehoa ja turvallisuutta tutkittiin vaiheen II avoimessa kolmen kohortin ei‑satunnaistetussa monikeskustutkimuksessa. Tutkimukseen otettiin potilaita, joilla oli IV asteen BRAF V600E mutatoitunut ei‑pienisoluinen keuhkosyöpä. Ensisijainen päätetapahtuma oli tutkijan arvioima kokonaisvasteprosentti (ORR) RECIST 1.1 ‑kriteerejä käyttäen. Toissijaisia päätetapahtumia olivat vasteen kesto (DoR), etenemisvapaa elinaika (PFS), kokonaiselinaika (OS), turvallisuus ja populaatiofarmakokinetiikka. Myös riippumaton arviointikomitea (Independent Review Committee [IRC]) arvioi kokonaiselinaikaa, vasteen kestoa ja etenemisvapaata elinaikaa herkkyysanalyysina.
Kohortit otettiin tutkimukseen peräkkäisessä järjestyksessä:
- Kohortti A: Monoterapia (150 mg dabrafenibia kahdesti vuorokaudessa), 84 potilasta. 78 potilasta oli aiemmin saanut systeemistä hoitoa metastasoituneeseen sairauteensa.
- Kohortti B: Yhdistelmähoito (150 mg dabrafenibia kahdesti vuorokaudessa ja 2 mg trametinibia kerran vuorokaudessa), 59 potilasta. 57 potilasta oli saanut 1‑3 linjassa aikaisempaa systeemistä hoitoa metastasoituneeseen sairauteensa. 2 potilasta ei ollut aikaisemmin saanut systeemistä hoitoa ja nämä potilaat sisällytettiin kohorttin C otettujen potilaiden kanssa samaan analyysiin.
- Kohortti C: Yhdistelmähoito (150 mg dabrafenibia kahdesti vuorokaudessa ja 2 mg trametinibia kerran vuorokaudessa), 34 potilasta. Kaikki potilaat saivat tutkimuslääkettä ensilinjan hoitona metastasoituneen sairauden hoitoon.
Yhdistelmähoitokohortteihin B ja C otetuista 93 potilaasta enemmistö oli kaukasialaista syntyperää (> 90 %), ja potilaissa oli enemmän naisia (54 %) kuin miehiä (46 %). Toisen tai myöhäisemmän linjan hoitoa saaneiden potilaiden mediaani‑ikä oli 64 vuotta ja ensilinjan hoitoa saaneiden potilaiden 68 vuotta. Suurimmalla osalla (94 %) yhdistelmähoitokohorttien potilaista ECOG‑toimintakykyluokka oli 0 tai 1. 26 (28 %) potilasta ei ollut koskaan tupakoinut. Suurimmalla osalla potilaista oli ei‑epiteliaalinen histologia. Aikaisempaa hoitoa saaneessa populaatiossa 38 potilasta (67 %) oli saanut yhdessä linjassa systeemistä syöpähoitoa metastasoituneeseen sairauteen.
Primäärianalyysin ajankohtana ensisijainen päätetapahtuma, tutkijan arvioima kokonaisvasteprosentti (ORR), oli ensilinjan populaatiossa 61,1 % (95 % lv: 43,5 %–76,9 %) ja aikaisempaa hoitoa saaneessa populaatiossa 66,7 % (95 % lv: 52,9 %–78,6 %). Nämä tulokset olivat tilastollisesti merkittäviä ja niiden perusteella hylättiin oletus (null hypothesis), että dabrafenibin ja trametibinin yhdistelmähoidossa kokonaisvasteprosentti (ORR) olisi 30 % tai vähemmän. Riippumattoman komitean (IRC) arvio kokonaisvasteprosenttituloksista (ORR) oli yhtenevä tutkija‑arvion kanssa. Kohortti A:han epäsuorasti verrattuna yhdistelmähoito trametinibin kanssa oli teholtaan parempi kuin dabrafenibi ainoana hoitona. Lopullinen tehoanalyysi, joka tehtiin 5 vuotta sen jälkeen kun viimeinen potilas oli saanut ensimmäisen annoksensa, on esitetty taulukossa 15.
Taulukko 15 Yhteenveto tehosta yhdistelmähoitokohorteissa tutkijan arvioon ja riippumattomaan radiologiseen arvioon perustuen
| Päätetapahtuma | Analyysi | Yhdistelmähoito 1. linja N = 361 | Yhdistelmähoito 2. tai myöhäisempi linja N = 571 |
Kokonaisvaste, varmistettu n (%) (95 % lv) | Tutkija IRC | 23 (63,9 %) (46,2–79,2) 23 (63,9 %) (46,2–79,2) | 39 (68,4 %) (54,8–80,1) 36 (63,2 %) (49,3–75,6) |
DoR mediaani kk (95 % lv) | Tutkija IRC | 10.2 (8,3–15,2) 15,2 (7,8–23,5) | 9,8 (6,9–18,3) 12,6 (5,8–26,2) |
PFS mediaani kk (95 % lv) | Tutkija IRC | 10,8 (7,0-14,5) 14,6 (7,0-22,1) | 10,2 (6,9–16,7) 8,6 (5,2–16,8) |
OS mediaani kk (95 % lv) | ‑ | 17,3 (12,3–40,2) | 18,2 (14,3–28,6) |
| 1 Tietojen katkaisupiste: 7. tammikuuta 2021 | |||
QT‑ajan piteneminen
Vaikea‑asteisin > 60 millisekunnin (ms) QTc‑ajan piteneminen todettiin 3 %:lla dabrafenibihoitoa saaneista potilaista (yhdellä > 500 ms turvallisuustutkimusten yhdistetyssä potilasjoukossa). Vaiheen III MEK115306‑tutkimuksessa kenelläkään trametinibia ja dabrafenibia yhdistelmähoitona saaneista potilaista ei esiintynyt vaikea‑asteisinta > 500 ms QTcB‑ajan pitenemistä; QTcB‑aika piteni yli 60 ms lähtötilanteesta 1 %:lla (3/209) potilaista. Vaiheen III MEK116513‑tutkimuksessa neljällä (1 %) trametinibia ja dabrafenibia yhdistelmähoitona saaneista potilaista esiintyi 3. vaikeusasteen QTcB‑ajan pitenemistä (> 500 ms). Kahdella näistä potilaista muutos lähtötilanteesta oli lisäksi yli 60 ms.
Dabrafenibin mahdollista vaikutusta QT‑ajan pitenemiseen arvioitiin erityisessä QT moniannostutkimuksessa. 32 potilaalle joilla oli BRAF V600‑mutaatiopositiivinen kasvain, annettiin hoitoannosta suurempi 300 mg dabrafenibiannos kahdesti vuorokaudessa. Dabrafenibilla tai sen metaboliiteilla ei havaittu olevan kliinisesti merkityksellistä vaikutusta QTc aikaan.
Muut tutkimukset – kuumeen hallinnan analyysi
Tutkimukset CPDR001F2301 (COMBI‑i) ja CDRB436F2410 (COMBI‑Aplus)
Kohonnutta ruumiin lämpöä havaittiin dabrafenibi-trametinibiyhdistelmähoitoa saaneilla potilailla. Ensimmäisissä yhdistelmähoidon rekisteröintitutkimusten asetelmissa, joissa kasvain oli leikkaukseen soveltumaton tai melanooma oli metastoitunut (COMBI-d ja COMBI-v; N=559 yhteensä) ja melanooman liitännäishoito (COMBI-AD, N=435) suositeltiin vain dabrafenibi hoidon keskeyttämistä ruumiin lämpötilan noustessa (kuume ≥38,5 °C). Kahden myöhemmän tutkimuksen asetelmissa, joissa kasvain oli leikkaukseen soveltumaton tai melanooma oli metastoitunut (COMBI-i control arm, N=264) ja melanooman liitännäishoito (COMBI-Aplus, N=552), molempien lääkevalmisteiden hoidon kesteyttämistä suositeltiin kun potilaan ruumiinlämpö oli ≥38 °C (COMBI-Aplus) tai ensimmäisten kuumeoireiden ilmetessä (COMBI-i; COMBI-Aplus uusiutunut lämmön nousu). Tutkimuksissa COMBI-i ja COMBI-Aplus ilmaantui vähemmän asteen 3/4 kuumetta, komplisoitunutta kuumetta, vakavia kuumeen aiheuttamia sairaalahoitoa vaatineita erityisen mielenkiinnon kohteena olevia haittatapahtumia (AESI), kuumeen kestoa (AESI) ja kuumeesta johtuvia pysyviä molempien lääkevalmisteiden hoidon lopettamispäätöksiä (AESI) (viimeksi mainittu vain liitännäishoidon yhteydessä) verrattuna tutkimuksiin COMBI-d, COMBI-v ja COMBI-AD. Ensisijainen päätetapahtuma, kuumeiden yhdistetty määrä 8,0 %, saavutettiin COMBI-Aplus-tutkimuksessa (lv 95 %: 5,9-10,6) 3/4 asteen kuume, kuumeen aiheuttama sairaalahoitoon joutuminen tai kuumeesta johtuvaa pysyvä hoidon keskeyttäminen verrattuna aiemman kontrollitutkimuksen (COMBI-AD) 20,0 % (lv 95 %: 16,3-24,1).
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt lykkäyksen velvoitteelle toimittaa tutkimustulokset dabrafenibin käytöstä melanooman ja kiinteiden pahanlaatuisten kasvainten hoidossa yhdessä tai useammassa pediatrisessa potilasryhmässä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Imeytyminen
Suun kautta otettu dabrafenibi imeytyy ja saavuttaa huippupitoisuuden plasmassa 2 tunnin (mediaani) kuluttua annoksesta. Suun kautta otetun dabrafenibin absoluuttinen hyötyosuus on 95 % (keskiarvo; 90 %:n lv: 81–110 %). Dabrafenibialtistus (Cmax ja AUC) suureni suorassa suhteessa annokseen 12–300 mg:n kerta‑annosten jälkeen, mutta kaksi kertaa vuorokaudessa annettujen toistuvien annosten jälkeen altistus suureni vähemmän kuin suhteessa annokseen. Toistuvien annosten aikana havaittiin altistuksen pienenemistä, mikä johtui todennäköisesti siitä, että lääkeaine indusoi omaa metaboliaansa. Kumuloitumissuhde eli 18. päivän ja 1. päivän AUC‑arvojen suhde oli 0,73 (keskiarvo). Kun dabrafenibia annettiin 150 mg kahdesti vuorokaudessa, Cmax‑arvojen geometrinen keskiarvo oli 1 478 ng/ml, AUC(0‑τ) oli 4 341 ng*h/ml ja annosta edeltävä pitoisuus (Cτ) oli 26 ng/ml.
Kun dabrafenibikapselit annettiin ruoan kanssa, hyötyosuus pieneni (Cmax pieneni 51 % ja AUC 31 %) ja imeytyminen dabrafenibikapseleista hidastui verrattuna tyhjään mahaan annettujen annosten jälkeen mitattuihin arvoihin.
Jakautuminen
Dabrafenibi sitoutuu ihmisen plasman proteiiniin ja sitoutumisaste on 99,7 %. Vakaan tilan aikainen jakautumistilavuus laskimoon annetun mikroannoksen jälkeen on 46 litraa.
Biotransformaatio
Dabrafenibi metaboloituu pääasiassa CYP2C8:n ja CYP3A4:n välityksellä hydroksidabrafenibiksi, joka hapettuu edelleen CYP3A4:n välityksellä karboksidabrafenibiksi. Karboksidabrafenibi voi dekarboksyloitua muiden kuin entsymaattisten prosessien kautta desmetyylidabrafenibiksi. Karboksidabrafenibi erittyy sappeen ja virtsaan. Desmetyylidabrafenibia saattaa muodostua myös suolistossa ja se voi imeytyä takaisin. Desmetyylidabrafenibi metaboloituu CYP3A4:n välityksellä oksidatiivisiksi metaboliiteiksi. Hydroksidabrafenibin terminaalinen puoliintumisaika vastaa lähtöaineen puoliintumisaikaa, joka on 10 tuntia, mutta karboksi‑ ja desmetyylimetaboliittien puoliintumisajat olivat pitempiä (21–22 tuntia). Metaboliitin ja lähtöaineen AUC‑arvojen suhde (keskiarvo) oli toistuvien annosten jälkeen hydroksidabrafenibin osalta 0,9, karboksidabrafenibin osalta 11 ja desmetyylidabrafenibin osalta 0,7. Altistuksen, suhteellisen voimakkuuden ja farmakokineettisten ominaisuuksien perusteella sekä hydroksi‑ että desmetyylidabrafenibi myötävaikuttavat todennäköisesti dabrafenibin kliiniseen tehoon, mutta karboksidabrafenibilla ei todennäköisesti ole merkittävää vaikutusta.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa
Muiden lääkevalmisteiden vaikutukset dabrafenibiin
Dabrafenibi on ihmisen P‑glykoproteiinin (P-gp:n) ja ihmisen BCRP:n substraatti in vitro. Näillä kuljetusproteiineilla on hyvin vähäinen vaikutus suun kautta otetun dabrafenibin hyötyosuuteen ja eliminoitumiseen, ja kliinisesti merkittävien yhteisvaikutusten riski P-gp:n tai BCRP:n estäjien kanssa on vähäinen. Dabrafenibin tai sen kolmen päämetaboliitin ei osoitettu olevan P-gp:n estäjiä in vitro.
Dabrafenibin vaikutus muihin lääkevalmisteisiin
Vaikka dabrafenibi ja sen metaboliitit hydroksidabrafenibi, karboksidabrafenibi ja desmetyylidabrafenibi olivat ihmisen orgaanisten anionien kuljettajien (OAT) 1 ja OAT3 estäjiä in vitro, ja dabrafenibin ja sen desmetyylimetaboliitin havaittiin olevan orgaanisten kationien kuljettaja 2:n (OCT2:n) estäjä in vitro, on näihin kuljettajiin liittyvä lääkeaineyhteisvaikutusten riski minimaalinen dabrafenibin ja metaboliittien kliinisen altistuksen perusteella.
Eliminaatio
Dabrafenibin terminaalinen puoliintumisaika laskimoon annetun yksittäisen mikroannoksen jälkeen on 2,6 tuntia. Dabrafenibin suun kautta otetun kerta‑annoksen terminaalinen puoliintumisaika on 8 tuntia, mikä johtuu imeytymisen rajoittamasta eliminoitumisesta, kun annos otetaan suun kautta (flip‑flop‑farmakokinetiikka). Plasmapuhdistuma on laskimoon annetun annoksen jälkeen 12 l/h.
Dabrafenibi eliminoituu suun kautta otetun annoksen jälkeen pääasiassa metaboloitumalla CYP3A4‑ ja CYP2C8‑entsyymien välityksellä. Dabrafenibista peräisin oleva materiaali erittyy pääasiassa ulosteeseen. 71 % suun kautta otetusta annoksesta erittyy ulosteeseen ja 23 % annoksesta erittyy ainoastaan metaboliitteina virtsaan.
Erityisryhmät
Maksan vajaatoiminta
Populaatiofarmakokineettinen analyysi osoittaa, että lievästi koholla olevat bilirubiini‑ ja/tai ASAT‑arvot (NCI‑ [National Cancer Institute] ‑luokituksen mukaan) eivät vaikuta merkittävästi suun kautta otetun dabrafenibin puhdistumaan. Bilirubiini‑ ja ASAT‑arvoihin perustuva lievä maksan vajaatoiminta ei vaikuttanut merkittävästi myöskään dabrafenibimetaboliittien pitoisuuteen plasmassa. Keskivaikeaa tai vaikeaa maksan vajaatoimintaa sairastavista potilaista ei ole tutkimustietoa. Koska dabrafenibi ja sen metaboliitit eliminoituvat ensisijaisesti metaboloitumalla maksassa ja erittymällä sappeen, dabrafenibin käytössä on noudatettava varovaisuutta, jos potilaalla on keskivaikea tai vaikea maksan vajaatoiminta (ks. kohta Annostus ja antotapa).
Munuaisten vajaatoiminta
Populaatiofarmakokineettinen analyysi viittaa siihen, ettei lievä munuaisten vajaatoiminta vaikuta suun kautta otetun dabrafenibin puhdistumaan. Vaikka tiedot keskivaikeasta munuaisten vajaatoiminnasta ovat vähäiset, niiden perusteella näyttäisi siltä, ettei kliinisesti merkityksellistä vaikutusta ole. Vaikeaa munuaisten vajaatoimintaa sairastavista potilaista ei ole tutkimustietoa (ks. kohta Annostus ja antotapa).
Iäkkäät potilaat
Populaatiofarmakokineettisen analyysin perusteella iällä ei ollut merkittävää vaikutusta dabrafenibin farmakokinetiikkaan. Yli 75 vuoden ikä vaikutti huomattavasti karboksi‑ ja desmetyylidabrafenibin pitoisuuksiin plasmassa, ja 75 vuotta täyttäneiden potilaiden altistus oli 40 % suurempi kuin alle 75‑vuotiaiden.
Paino ja sukupuoli
Populaatiofarmakokineettisen analyysin perusteella sukupuoli ja paino vaikuttivat suun kautta otetun dabrafenibin puhdistumaan. Paino vaikutti myös suun kautta otetun annoksen jakautumistilavuuteen ja jakautumisesta riippuvaan puhdistumaan. Näitä farmakokineettisiä eroja ei pidetty kliinisesti merkityksellisinä.
Etninen tausta
Populaatiofarmakokineettisessä analyysissä ei havaittu merkittäviä eroja dabrafenibin farmakokinetiikassa aasialaisten ja valkoihoisten potilaiden välillä. Tietoja ei ole riittävästi, jotta muiden etnisten taustojen mahdollista vaikutusta dabrafenibin farmakokinetiikkaan voitaisiin arvioida.
Pediatriset potilaat
Nuorten potilaiden farmakokineettiset dabrafenibialtistukset suositelluilla painon mukaisilla annoksilla asettuivat aikuisilla havaittujen altistusten vaihteluvälille.
Prekliiniset tiedot turvallisuudesta
Dabrafenibilla ei ole tehty karsinogeenisuustutkimuksia. Dabrafenibi ei ollut mutageeninen eikä klastogeeninen bakteereissa ja viljellyissä nisäkässoluissa tehdyissä in vitro ‑testeissä eikä jyrsijöiden mikrotumatestissä in vivo.
Rotilla tehdyissä naaraiden hedelmällisyyttä, varhaista alkionkehitystä sekä alkion‑ ja sikiönkehitystä selvittelevissä yhdistetyissä tutkimuksissa tiineiden naaraiden munasarjojen keltarauhasten määrät pienenivät annostuksen ollessa 300 mg/kg/vrk (noin 3‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella), mutta kiimakiertoon, paritteluun tai hedelmällisyysindekseihin kohdistuvia vaikutuksia ei havaittu. Yksilönkehitykseen kohdistuvaa toksisuutta, kuten alkiokuolleisuutta ja kammioväliseinän vaurioita ja muutoksia kateenkorvan muodossa havaittiin annostasolla 300 mg/kg/vrk ja luuston kehityksen viivästymistä sekä sikiön painon laskua annostasolla ≥ 20 mg/kg/vrk (≥ 0,5‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella).
Dabrafenibin vaikutuksia urosten hedelmällisyyteen ei ole tutkittu. Toistuvilla annoksilla tehdyissä tutkimuksissa havaittiin kuitenkin rottien ja koirien kivesten degeneraatiota/depleetiota (altistuksen ollessa ≥ 0,2‑kertainen verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella). Rottien ja koirien kivesmuutokset olivat havaittavissa vielä 4 viikon toipumisjakson jälkeen (ks. kohta Raskaus ja imetys).
Sydän‑ ja verisuonivaikutuksia, kuten sepelvaltimoiden degeneraatiota/nekroosia ja/tai verenvuotoa, sydämen eteis‑kammioläppien hypertrofiaa/verenvuotoa ja eteisten fibrovaskulaarista proliferaatiota havaittiin koirilla (altistuksen ollessa ≥ 2‑kertainen verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella). Fokaalista valtimoiden/perifeeristen verisuonten tulehdusta havaittiin hiirillä eri kudoksissa (altistuksen ollessa ≥ 0,6‑kertainen ihmisen kliiniseen altistukseen verrattuna). Rotilla havaittiin maksavaltimoiden degeneraation ja spontaanin sydänlihassolujen degeneraation ja tulehduksen (spontaanin kardiomyopatian) ilmaantuvuuden lisääntymistä (altistuksen ollessa ≥ 0,5‑kertainen ihmisen kliiniseen altistukseen verrattuna). Maksaan kohdistuvia vaikutuksia, mukaan lukien hepatosellulaarinen nekroosi ja tulehdus, havaittiin hiirillä (altistuksen ollessa ≥ 0,6‑kertainen ihmisen kliiniseen altistukseen verrattuna). Keuhkojen bronkoalveolaarinen tulehdus havaittiin useilla koirilla annostasolla ≥ 20 mg/kg/vrk (≥ 9‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella), ja siihen liittyi pinnallinen ja/tai vaikeutunut hengitys.
Dabrafenibia saaneilla koirilla ja rotilla on havaittu korjautuvia hematologisia vaikutuksia. Enintään 13 viikkoa kestäneissä tutkimuksissa havaittiin koirilla ja rotilla retikulosyyttien ja/tai punasolumassan vähenemistä (kun altistus oli koirilla ≥ 10‑kertainen ja rotilla 1,4‑kertainen ihmisen kliiniseen altistukseen verrattuna).
Rotilla tehdyissä nuorten eläinten toksisuustutkimuksissa havaittiin kasvuun kohdistuvia vaikutuksia (pitkien luiden lyhenemistä), munuaistoksisuutta (kertymiä tubuluksissa, munuaiskuoren kystien ja tubulusten basofilian ilmaantuvuuden lisääntymistä sekä korjautuvaa urea‑ ja/tai kreatiniinipitoisuuden suurenemista) sekä kivestoksisuutta (degeneraatiota ja siementiehyiden laajenemista) (≥ 0,2 ‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen AUC‑arvon perusteella).
Dabrafenibi oli fototoksista in vitro hiirten 3T3 fibroblastien NRU‑testissä (Neutral Red Uptake) ja in vivo suun kautta otetuilla ≥ 100 mg/kg annoksilla (> 44‑kertainen altistus verrattuna ihmisen kliiniseen altistukseen Cmax‑arvon perusteella) karvattomilla hiirillä tehdyssä fototoksisuustutkimuksessa.
Käyttö yhdessä trametinibin kanssa
Kun koirille annettiin tutkimuksessa trametinibin ja dabrafenibin yhdistelmää 4 viikon ajan, niillä havaittiin maha‑suolikanavan haittojen ja kateenkorvan imukudoksen solukkuuden vähenemisen merkkejä, kun altistukset olivat pienempiä kuin pelkkää trametinibia saaneilla koirilla. Muutoin havaittiin samankaltaisia haittoja kuin vertailukelpoisissa monoterapiatutkimuksissa.
Farmaseuttiset tiedot
Apuaineet
Kapselin sisältö
Mikrokiteinen selluloosa
Magnesiumstearaatti
Kolloidinen piidioksidi
Kapselin kuori
Punainen rautaoksidi (E172)
Titaanidioksidi (E171)
Hypromelloosi (E464)
Painoväri
Musta rautaoksidi (E172)
Shellakka
Propyleeniglykoli
Yhteensopimattomuudet
Ei oleellinen.
Kestoaika
3 vuotta.
Säilytys
Tämä lääkevalmiste ei vaadi erityisiä säilytysolosuhteita.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
TAFINLAR kapseli, kova
50 mg (L:ei) 28 kpl (1131,33 €), 120 kpl (4210,78 €)
75 mg (L:ei) 28 kpl (1674,84 €), 120 kpl (6225,88 €)
PF-selosteen tieto
Läpinäkymätön valkoinen polyetyleenipurkki (HDPE), jossa on polypropyleenistä valmistettu kierrekorkki ja silikageeliä kuivatusaineena.
Yksi purkki sisältää 28 tai 120 kovaa kapselia
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Tafinlar 50 mg kovat kapselit
Läpinäkymättömiä, tummanpunaisia, noin 18 mm pitkiä kapseleita, joiden kuoressa ovat merkinnät ”GS TEW” ja ”50 mg”.
Tafinlar 75 mg kovat kapselit
Läpinäkymättömiä, voimakkaan vaaleanpunaisia, noin 19 mm pitkiä kapseleita, joiden kuoressa ovat merkinnät ”GS LHF” ja ”75 mg”.
Käyttö- ja käsittelyohjeet
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
TAFINLAR kapseli, kova
50 mg 28 kpl, 120 kpl
75 mg 28 kpl, 120 kpl
- Ylempi erityiskorvaus (100 %). Dabrafenibi ja trametinibi: Melanooman, gliooman ja keuhkosyövän hoito erityisin edellytyksin (1509).
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Dabrafenibi ja trametinibi: Dabrafenibin ja trametinibin yhdistelmähoito aikuisille, kun kyseessä BRAF V600 - mutaatiopositiivisen melanooman hoito erityisin edellytyksin (3024).
ATC-koodi
L01EC02
Valmisteyhteenvedon muuttamispäivämäärä
03.11.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
