YESCARTA infuusioneste, dispersio 0,4 - 2 x 100 000 000 solua
 Lääketurva
Lääketurva
Riskienminimointimateriaalit
Potilas
Tärkeitä muistutuksia potilaille ja tietoa terveydenhuollon ammattilaisille.
Terveydenhuollon ammattilainen
Tärkeää turvallisuustietoa terveydenhuollon ammattilaisille seuraavista riskeistä: -sytokiinioireyhtymä -vakavat neurologiset haittavaikutukset -T-soluperäiset sekundaariset syövät
Huomioitavaa
▼ Tähän lääkevalmisteeseen kohdistuu lisäseuranta. Tällä tavalla voidaan havaita nopeasti turvallisuutta koskevaa uutta tietoa. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan epäillyistä lääkkeen haittavaikutuksista. Ks. kohdasta Haittavaikutukset, miten haittavaikutuksista ilmoitetaan.
Vaikuttavat aineet ja niiden määrät
Yescarta (aksikabtageenisiloleuseeli) on muuntogeeninen autologinen solupohjainen valmiste. Se sisältää T-soluja, jotka on transdusoitu ex vivo käyttäen retrovirusvektoria ja jotka ilmentävät kimeeristä anti-CD19-antigeenireseptoria (CAR). Tämä reseptori koostuu hiiren yksiketjuisesta variaabelista anti-CD19‑fragmentista (ScFv), johon on liitetty kostimulatorinen CD28-domeeni ja signaloiva CD3-zeeta-domeeni.
Jokainen potilaskohtainen Yescarta-infuusiopussi sisältää aksikabtageenisiloleuseelia, jossa on tietty eräkohtainen pitoisuus autologisia, geneettisen muuntelun vuoksi kimeeristä anti-CD19-antigeenireseptoria ilmentäviä T-soluja (CAR-positiivisia, elinkykyisiä T-soluja). Lääkevalmiste on pakattu yhteen infuusiopussiin, joka sisältää infuusiona annettavaksi tarkoitettuna soludispersiona tavoiteannoksella yhteensä 2 × 106 anti-CD19-CAR-positiivista, elinkykyistä T-solua painokiloa kohti (vaihtelualue: 1 × 106 − 2 ×106 solua/kg), kuitenkin enintään 2 × 108 anti-CD19-CAR-positiivista, elinkykyistä T-solua, suspendoituna pakastusliuokseen.
Kukin infuusiopussi sisältää noin 68 ml infuusiodispersiota.
Apuaineet, joiden vaikutus tunnetaan
Yksi infuusiopussi Yescarta-valmistetta sisältää 300 mg natriumia ja 3,4 ml dimetyylisulfoksidia (DMSO). Yescarta saattaa sisältää gentamisiinijäämiä.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Infuusioneste, dispersio.
Kliiniset tiedot
Käyttöaiheet
Yescarta on tarkoitettu aikuisille potilaille diffuusin suurisoluisen B-solulymfooman (DLBCL) ja korkean maligniteettiasteen B-solulymfooman (HGBL) hoitoon, kun tauti on uusiutunut 12 kuukauden kuluessa ensilinjan kemoimmunoterapian päättymisestä tai ei reagoi ensilinjan kemoimmunoterapiaan.
Yescarta on tarkoitettu aikuisille potilaille uusiutuneen tai hoitoon reagoimattoman diffuusin suurisoluisen B-solulymfooman (DLBCL) ja primaarisen välikarsinan suurisoluisen B-solulymfooman (PMBCL) hoitoon kahden tai useamman systeemistä hoitoa sisältäneen hoitolinjan jälkeen.
Yescarta on tarkoitettu aikuisille potilaille uusiutuneen tai hoitoon reagoimattoman follikulaarisen lymfooman (FL) hoitoon kolmen tai useamman systeemistä hoitoa sisältäneen hoitolinjan jälkeen.
Ehto
CAR-T-soluhoito annetaan kvalifioidussa hoitokeskuksessa hematologisten syöpien hoitoon perehtyneen ja CAR-T-soluhoitojen antamiseen koulutetun lääkärin ohjauksessa ja valvonnassa.
Annostus ja antotapa
Yescarta on annettava pätevässä hoitokeskuksessa. Antajan täytyy olla lääkäri, jolla on kokemusta hematologisten syöpien hoidosta ja joka on saanut koulutuksen kyseisen lääkevalmisteen antamiseen ja sillä hoidettujen potilaiden hoitamiseen.
Ennen infusointia on oltava käytettävissä ainakin yksi annos tosilitsumabia ja ensihoitovälineistö sytokiinioireyhtymän (CRS) varalta. Pätevällä hoitokeskuksella on oltava mahdollisuus saada tosilitsumabin lisäannos 8 tunnin kuluessa edellisen annoksen antamisesta. Poikkeustapauksessa, jossa tosilitsumabia ei ole saatavilla Euroopan lääkeviraston saatavuushäiriöluettelossa mainitun saatavuushäiriön takia, ennen infusointia on oltava käytettävissä sopivia vaihtoehtoisia keinoja sytokiinioireyhtymän hoitoon tosilitsumabin sijaan.
Annostus
Yescarta on tarkoitettu autologiseen käyttöön (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Hoito koostuu yhdestä infuusioannoksesta. Yksi annos on CAR-positiivisia, elinkykyisiä T-soluja sisältävä infuusiodispersio, joka on yhdessä infuusiopussissa. Tavoiteannos on 2 × 106 CAR-positiivista elinkykyistä T-solua painokiloa kohti (vaihtelualue on 1 × 106 – 2 × 106 solua/kg), enintään 2 × 108 CAR-positiivista, elinkykyistä T-solua vähintään 100 kg painaville potilaille.
Yescarta-valmisteen saatavuus (eli valmisteen mahdollinen toimituspäivämäärä) täytyy varmistaa ennen lymfosyyttejä vähentävää hoitoa.
Esihoito (lymfosyyttejä vähentävä kemoterapia)
- Lymfosyyttejä vähentävä kemoterapia, jonka muodostavat syklofosfamidi 500 mg/m2 laskimoon ja fludarabiini 30 mg/m2 laskimoon, on annettava ennen Yescarta-infuusiota. Suositeltavat päivät ovat 5., 4. ja 3. päivä ennen Yescarta-infuusiota.
Esilääkitys
- On suositeltavaa, että esilääkitys parasetamolilla (500–1 000 mg suun kautta) ja difenhydramiinilla (12,5–25 mg laskimoon tai suun kautta) tai vastaavilla lääkevalmisteilla annetaan noin 1 tunti ennen Yescarta‑valmisteen infusointia. Näin vähennetään infuusioreaktion todennäköisyyttä.
- Systeemisten kortikosteroidien profylaktista käyttöä ei suositella (ks. kohta Yhteisvaikutukset).
Seuranta
- Potilasta on tarkkailtava infuusion jälkeen päivittäin vähintään ensimmäisten 7 vuorokauden ajan mahdollisen sytokiinioireyhtymän, neurologisten tapahtumien ja muiden toksisuuksien merkkien ja oireiden varalta. Lääkäri voi harkita sairaalahoidon tarvetta 7 vuorokauden ajaksi tai sytokiinioireyhtymän ja/tai neurologisten tapahtumien ensimmäisten merkkien tai oireiden ilmaantuessa.
- Infuusion jälkeisten 7 vuorokauden jälkeen potilasta on tarkkailtava lääkärin harkinnan mukaan.
- Potilaan on pysyteltävä pätevän kliinisen hoitoyksikön läheisyydessä vähintään 4 viikon ajan infuusion jälkeen.
Erityisryhmät
Potilaat, joilla on ihmisen immuunikatovirus (HIV)-, hepatiitti B -virus (HBV)- tai hepatiitti C -virus (HCV)-infektio
On vain vähän kliinistä kokemusta potilaista, joilla on aktiivinen HIV-, HBV- tai HCV-infektio.
Iäkkäät potilaat
Annoksen muuttaminen ei ole tarpeen vähintään 65-vuotiaille potilaille.
Pediatriset potilaat
Yescarta-valmisteen turvallisuutta ja tehoa lasten ja alle 18 vuoden ikäisten nuorten hoidossa ei ole vielä varmistettu. Tietoja ei ole saatavilla.
Antotapa
Yescarta-valmiste annetaan laskimoinfuusiona.
Yescarta-valmistetta ei saa säteilyttää. Valkosoluja poistavaa suodatinta ei saa käyttää.
Ennen antamista on varmistettava, että potilaan henkilöllisyys vastaa Yescarta-infuusiopussissa ja metallikotelossa ilmoitettuja yksilöllisiä potilastietoja.
Antaminen
- Valkosoluja poistavaa suodatinta ei saa käyttää.
- Tosilitsumabin ja ensihoitovälineistön on oltava käytettävissä ennen infusointia ja seurantajakson aikana. Poikkeustapauksessa, jossa tosilitsumabia ei ole saatavilla Euroopan lääkeviraston saatavuushäiriöluettelossa mainitun saatavuushäiriön takia, ennen infusointia on oltava käytettävissä sopivia vaihtoehtoisia keinoja sytokiinioireyhtymän hoitoon tosilitsumabin sijaan.
- Yescarta on tarkoitettu vain autologiseen käyttöön. On varmistettava, että potilaan henkilöllisyys vastaa Yescarta-infuusiopussin potilastunnisteita.
- Kun infuusioletku on valmisteltu, Yescarta-infuusiopussin koko sisältö on infusoitava 30 minuutin kuluessa joko painovoiman avulla tai peristalttisella pumpulla.
Yksityiskohtaiset ohjeet, jotka koskevat valmistelua ja antamista sekä vahinkoaltistumisen tapahduttua tai Yescarta-valmistetta hävittäessä tehtäviä toimenpiteitä, on esitetty kohdassa Käyttö- ja käsittelyohjeet.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille tai gentamisiinille (mahdollinen jäämä).
Lymfosyyttejä vähentävän kemoterapian vasta-aiheet täytyy ottaa huomioon.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Jäljitettävyysvaatimuksia, jotka koskevat solupohjaisia pitkälle kehitetyissä hoidoissa käytettäviä lääkkeitä, on noudatettava. Jäljitettävyyden varmistamiseksi valmisteen nimeä, eränumeroa ja hoidetun potilaan nimeä on säilytettävä 30 vuoden ajan valmisteen viimeisen käyttöpäivän jälkeen.
Autologinen käyttö
Yescarta on tarkoitettu ainoastaan autologiseen käyttöön, eikä sitä saa missään tapauksessa antaa muille potilaille. Ennen infuusiota on varmistettava, että potilaan henkilöllisyys vastaa Yescarta-infuusiopussissa ja metallikotelossa olevia potilastunnisteita. Yescarta-valmistetta ei saa antaa, jos potilaskohtaisen infuusiopussin ja metallikotelon merkinnöissä olevat tiedot eivät vastaa potilaan henkilötietoja.
Yleistä
Lymfosyyttejä vähentävään kemoterapiaan liittyvät varoitukset ja varotoimet on huomioitava.
Hoidon lykkäämisen syyt
Yescarta-hoitoon liittyvien riskien vuoksi infuusiota on lykättävä, jos potilaalla on jokin seuraavista tiloista:
- korjautumattomat vakavat haittavaikutukset (etenkin keuhkoihin tai sydämeen liittyvät reaktiot tai matala verenpaine), mukaan lukien aiemmista kemoterapioista johtuvat reaktiot
- aktiivinen hallitsematon infektio
- aktiivinen käänteishyljintä (GvHD).
Joissain tapauksissa hoitoa voidaan lykätä lymfosyyttejä vähentävän kemoterapian annon jälkeen. Jos infuusio viivästyy enemmän kuin kaksi viikkoa potilaan saaman lymfosyyttejä vähentävän kemoterapian jälkeen, lymfosyyttejä vähentävä kemoterapia on annettava uudelleen (ks. kohta Annostus ja antotapa).
Seuranta infuusion jälkeen
Potilasta on tarkkailtava infuusion jälkeen päivittäin ensimmäisten 7 vuorokauden ajan mahdollisen sytokiinioireyhtymän, neurologisten tapahtumien ja muiden toksisuuksien merkkien ja oireiden varalta. Lääkäri voi harkita sairaalahoidon tarvetta 7 vuorokauden ajaksi tai sytokiinioireyhtymän ja/tai neurologisten tapahtumien ensimmäisten merkkien tai oireiden ilmaantuessa. Infuusion jälkeisten 7 vuorokauden jälkeen potilasta on tarkkailtava lääkärin harkinnan mukaan.
Potilaiden on pysyttävä pätevän hoitokeskuksen läheisyydessä vähintään 4 viikon ajan infuusion jälkeen ja hakeuduttava välittömästi lääkärin hoitoon, jos heillä ilmenee sytokiinioireyhtymän tai neurologisten haittavaikutusten merkkejä tai oireita. Peruselintoimintoja ja elinten toimintaa on tarkkailtava reaktion vaikeusasteen mukaan.
Taudinaiheuttajien siirtyminen
Vaikka testeillä tarkistetaan, että Yescarta on steriili eikä sisällä mykoplasmaa, tartunnanaiheuttajien siirtymisen vaara on olemassa. Tämän vuoksi Yescarta-valmistetta antavien terveydenhuollon ammattilaisten on tarkkailtava potilaita hoidon jälkeen infektio-oireiden varalta ja tarvittaessa annettava asianmukainen hoito.
Serologiset tutkimukset
HBV‑, HCV‑ ja HIV‑seulonta on tehtävä ennen solujen keräämistä Yescarta-valmisteen valmistusta varten (ks. kohta Annostus ja antotapa).
Veren, elinten, kudosten ja solujen luovutus
Yescarta-hoitoa saaneet potilaat eivät saa luovuttaa verta eivätkä elimiä, kudoksia tai soluja transplantaatiota varten.
Samanaikaiset sairaudet
Potilaat, joilla on aktiivinen keskushermostoon liittyvä häiriö tai riittämätön munuaisten, maksan, keuhkojen tai sydämen toiminta, ovat todennäköisesti alttiimpia jäljempänä kuvatuille haittavaikutuksille ja tarvitsevat erityishuomiota.
Primaarinen keskushermoston lymfooma
Yescarta-valmisteen käytöstä ei ole kokemusta potilailla, joilla on primaarinen keskushermoston lymfooma. Näin ollen Yescarta-valmisteen riski-hyötyprofiilia ei ole varmistettu tässä potilasjoukossa.
Sytokiinioireyhtymä
Lähes kaikilla potilailla ilmeni jonkinasteinen sytokiinioireyhtymä. Vaikeaa sytokiinioireyhtymää, mukaan lukien hengenvaarallisia ja kuolemaan johtaneita reaktioita, havaittiin hyvin yleisesti Yescarta-hoidon yhteydessä, ja se ilmeni 1−12 vuorokauden kuluessa ZUMA-1- ja ZUMA-7-tutkimuksissa ja 1−11 vuorokauden kuluessa ZUMA-5-tutkimuksessa (ks. kohta Haittavaikutukset).
Sytokiinioireyhtymän diagnoosi edellyttää systeemisen tulehdusreaktion vaihtoehtoisten aiheuttajien, kuten infektioiden, poissulkemista.
Yescarta-valmisteeseen liittyvän sytokiinioireyhtymän hoito
Ennen Yescarta-valmisteen infusointia hoitokeskuksessa on oltava käytettävissä potilasta kohti ainakin yksi annos tosilitsumabia, joka on interleukiini 6 (IL-6) -reseptorin estäjä. Pätevällä hoitokeskuksella on oltava mahdollisuus saada tosilitsumabin lisäannos 8 tunnin kuluessa edellisen annoksen antamisesta. Poikkeustapauksessa, jossa tosilitsumabia ei ole saatavilla Euroopan lääkeviraston saatavuushäiriöluettelossa mainitun saatavuushäiriön takia, hoitokeskuksella on oltava käytettävissä sopivia vaihtoehtoisia keinoja sytokiinioireyhtymän hoitoon tosilitsumabin sijaan.
Potilaita on hoidettava kunkin potilaan kliinisten oireiden perusteella sekä sovellettavien paikallisten hoitolaitoksessa noudatettavien ja/tai kansallisten tai eurooppalaisten/kansainvälisten hoitosuositusten mukaan. Lääkäreitä kehotetaan huomioimaan nämä standardit kliinisessä päätöksenteossaan.
Yescarta-valmistetta ei saa antaa potilaalle, jolla on aktiivinen infektio tai tulehdussairaus, ennen kuin tämä sairaus on parantunut.
Sytokiinioireyhtymän tiedetään liittyvän pääte-elinten (kuten maksan, munuaisten, sydämen ja keuhkojen) toimintahäiriöihin. Lisäksi sytokiinioireyhtymän yhteydessä voi esiintyä eri elimiin liittyvien perussairauksien pahenemista. Potilasta, jolla on lääketieteellisesti merkittävä sydämen toimintahäiriö, on hoidettava tehohoitostandardien ja -toimenpiteiden mukaisesti. Mm. sydämen kaikukuvausta on harkittava.
Hemofagosyyttisen lymfohistiosytoosin / makrofagiaktivaatio-oireyhtymän (HLH/MAS) tutkimista on harkittava potilailla, joilla on vaikea tai hoitoihin reagoimaton sytokiinioireyhtymä. Hemofagosyyttistä lymfohistiosytoosia / makrofagiaktivaatio-oireyhtymää on hoidettava paikallisten hoitolaitoksessa noudatettavien ja/tai kansallisten tai eurooppalaisten/kansainvälisten hoitosuositusten mukaan.
Yescarta monistuu ja säilyy elimistössä tosilitsumabin ja kortikosteroidien annon jälkeen. Tuumorinekroositekijän (TNF) antagonisteja ei suositella Yescarta-valmisteeseen liittyvän sytokiinioireyhtymän hoidossa.
Neurologiset haittavaikutukset
Yescarta-hoitoa saaneilla potilailla on havaittu hyvin yleisesti vaikeita neurologisia haittavaikutuksia, jotka tunnetaan myös nimellä immuuniefektorisoluihin liittyvä neurotoksisuusoireyhtymä (ICAN-oireyhtymä) ja jotka voivat olla hengenvaarallisia tai johtaa kuolemaan. Mediaaniaika niiden ilmaantumiseen Yescarta-infuusion jälkeen oli 6 vuorokautta (vaihteluväli: 1–133 vuorokautta) ZUMA-1- ja ZUMA-7-tutkimuksissa ja 7 vuorokautta (vaihteluväli: 1–177 vuorokautta) ZUMA-5-tutkimuksessa (ks. kohta Haittavaikutukset). Potilailla, joilla on ollut aiemmin keskushermostoon liittyviä häiriöitä, kuten kouristuskohtauksia tai serebrovaskulaarinen iskemia, saattaa olla kohonnut riski. Kuolemaan johtaneita ja vakavia aivoedeematapauksia on raportoitu potilailla, jotka ovat saaneet Yescarta-valmistetta.
Potilaita on hoidettava kunkin potilaan kliinisten oireiden perusteella sekä sovellettavien paikallisten hoitolaitoksessa noudatettavien ja/tai kansallisten tai eurooppalaisten/kansainvälisten hoitosuositusten mukaan. Lääkäreitä kehotetaan huomioimaan nämä standardit kliinisessä päätöksenteossaan.
Infektiot ja kuumeinen neutropenia
Vakavia infektioita on havaittu hyvin yleisesti Yescarta-hoidon yhteydessä (ks. kohta Haittavaikutukset). Immunosuppressiopotilailla on raportoitu hengenvaarallisia tai kuolemaan johtaneita opportunistisia infektioita, kuten disseminoituneita sieni-infektioita.
Potilaita on tarkkailtava infektion merkkien ja oireiden varalta ennen Yescarta-infuusiota, sen aikana ja sen jälkeen ja hoidettava asianmukaisesti. Profylaktisia mikrobilääkkeitä annetaan hoitolaitoksen tavanomaisten ohjeiden mukaisesti.
Kuumeista neutropeniaa on havaittu potilailla Yescarta-infuusion jälkeen (ks. kohta Haittavaikutukset), ja sitä voi ilmetä samanaikaisesti sytokiinioireyhtymän kanssa. Kuumeisen neutropenian tapauksessa infektion mahdollisuus on otettava huomioon, ja potilasta on hoidettava laajakirjoisilla antibiooteilla, nesteillä ja muulla tukihoidolla potilaan voinnin edellyttämällä tavalla.
Viruksen uudelleen aktivoituminen
Hepatiitti B ‑virus voi aktivoitua uudelleen potilailla, joita hoidetaan B-soluja vastaan kohdistetuilla lääkkeillä, ja aktivoituminen voi joissakin tapauksissa johtaa fulminanttiin hepatiittiin, maksan vajaatoimintaan ja kuolemaan.
John Cunningham -viruksen (JC-viruksen) uudelleenaktivoitumista, joka johtaa progressiiviseen multifokaaliseen leukoenkefalopatiaan (PML:ään), on ilmoitettu potilailla, joita on hoidettu Yescarta-valmisteella ja jotka ovat saaneet aiempaa hoitoa myös muilla immunosuppressiivisilla lääkkeillä. Ilmoituksia on saatu kuolemaan johtaneista tapauksista. PML:n mahdollisuus on otettava huomioon immunosuppressiopotilailla, joilla on uusia tai pahenevia neurologisia oireita, ja asianmukaiset diagnostiset arvioinnit on tehtävä.
Muita hengenvaarallisia tai kuolemaan johtaneita tapauksia on ilmoitettu HHV-6-viruksen uudelleenaktivoitumisen yhteydessä.
Pitkittyneet sytopeniat
Potilailla saattaa ilmetä sytopenioita useiden viikkojen ajan lymfosyyttejä vähentävän kemoterapian ja Yescarta-infuusion jälkeen, ja ne on hoidettava normaalien hoito-ohjeiden mukaisesti. Yescarta-infuusion jälkeen ilmeni hyvin yleisesti vähintään vaikeusasteen 3 pitkittyneitä sytopenioita, kuten trombosytopeniaa, neutropeniaa ja anemiaa. Potilaan veriarvoja on tarkkailtava Yescarta-infuusion jälkeen.
Hypogammaglobulinemia
Yescarta-hoitoa saaneilla potilailla voi ilmetä hypogammaglobulinemiaan johtavaa B-soluaplasiaa. Yescarta-valmistetta saaneilla potilailla on havaittu hyvin yleisesti hypogammaglobulinemiaa (ks. kohta Haittavaikutukset). Hypogammaglobulinemia altistaa potilaat infektioille. Immunoglobuliinipitoisuuksia on tarkkailtava Yescarta-hoidon jälkeen ja infektioita ehkäiseviä varotoimia, antibioottiprofylaksia ja immunoglobuliinikorvaushoitoa on käytettävä uusiutuvien infektioiden yhteydessä ja annettava normaalien hoito-ohjeiden mukaisesti.
Yliherkkyysreaktiot
Allergisia reaktioita saattaa ilmetä Yescarta-infuusion yhteydessä. Vakavia yliherkkyysreaktioita, kuten anafylaksiaa, saattaa aiheutua Yescarta-valmisteen sisältämästä DMSO:sta tai gentamisiinijäännöksestä.
Sekundaariset syövät, mukaan luettuina T-soluperäiset ja myelooiset sekundaariset syövät
Yescarta-hoitoa saaneille potilaille saattaa kehittyä sekundaarisia syöpiä. T-soluperäisiä syöpiä on raportoitu sen jälkeen, kun hematologisia syöpiä on hoidettu BCMA- tai CD19-kohdennetulla CAR-T-soluhoidolla, kuten Yescarta-valmisteella. T-soluperäisiä syöpiä, myös CAR-positiivisia syöpiä, on raportoitu viikkoja ja jopa useita vuosia BCMA- tai CD19-kohdennetun CAR-T-soluhoidon jälkeen. Kuolemaan johtaneita tapauksia on esiintynyt. Jos potilaalle ilmaantuu T‑soluperäinen sekundaarinen syöpä, lääkeyritykseen on otettava yhteyttä ohjeiden saamiseksi siitä, miten potilaalta otetaan näytteet.
Yescarta-hoitoa saaneilla potilailla on esiintynyt myelodysplastista oireyhtymää ja akuuttia myelooista leukemiaa, mukaan lukien kuolemaan johtaneita tapauksia.
Potilaita on seurattava elinikäisesti sekundaaristen syöpien varalta.
Tuumorilyysioireyhtymä
Tuumorilyysioireyhtymää, joka saattaa olla vaikea-asteinen, on toisinaan havaittu. Tuumorilyysioireyhtymän riskin minimoimiseksi potilaiden, joiden virtsahappoarvo on koholla tai joilla on korkea kasvainkuorma, on saatava allopurinolia tai vaihtoehtoista profylaksia ennen Yescarta-infuusiota. Potilasta on tarkkailtava tuumorilyysioireyhtymän merkkien ja oireiden varalta ja tapahtumia on hoidettava normaalien hoito-ohjeiden mukaisesti.
CD19-negatiivinen sairaus
Yescarta-valmisteen käytöstä on vain vähän kokemuksia potilailla, jotka ovat saaneet aiempaa CD19:ään kohdennettua hoitoa. Yescarta-valmisteen käyttöä ei suositella, jos potilaan CD19-negatiivinen sairaus on uusiutunut aiemman CD19-vasta-ainehoidon jälkeen.
Yescarta-hoitoa saaneista CD19-negatiivisista potilaista on saatavilla vain vähän tietoa, ja on mahdollista, että CD19-negatiiviset potilaat hyötyvät hoidosta vähemmän kuin CD19-positiiviset potilaat. Potilaat, joilla on immunohistokemiallisesti CD19-negatiivinen status, saattavat silti ilmentää CD19:ää, ja heidän on osoitettu hyötyvän Yescarta-hoidosta. CD19-negatiivisten potilaiden Yescarta-hoitoon liittyvät mahdolliset riskit ja hyödyt on punnittava.
Pitkäaikainen seuranta
Potilaiden odotetaan kirjautuvan rekisteriin, jotta voidaan selvittää paremmin Yescarta-valmisteen turvallisuutta ja tehoa pitkällä aikavälillä.
Apuaineet (natrium)
Tämä lääkevalmiste sisältää 300 mg natriumia per infuusiopussi, mikä vastaa 15 %:a WHO:n suosittelemasta natriumin 2 g:n päivittäisestä enimmäissaannista aikuisille.
Yhteisvaikutukset
Yescarta-valmisteella ei ole tehty yhteisvaikutustutkimuksia.
Profylaktinen systeemisten kortikosteroidien käyttö voi haitata Yescarta-valmisteen vaikutusta. Siksi profylaktisten systeemisten kortikosteroidien käyttöä ei suositella ennen infuusiota (ks. kohta Annostus ja antotapa).
Kortikosteroidien anto toksisuuden hoito-ohjeiden mukaisesti ei vaikuta CAR-T-solujen monistumiseen ja säilymiseen.
Eläviä taudinaiheuttajia sisältävät rokotteet
Eläviä viruksia sisältävien rokotteiden käytön turvallisuutta Yescarta-hoidon aikana tai sen jälkeen ei ole tutkittu. Varotoimenpiteenä suositellaan, että eläviä taudinaiheuttajia sisältäviä rokotteita ei anneta vähintään 6 viikkoon ennen lymfosyyttejä vähentävän kemoterapian aloittamista, Yescarta-hoidon aikana eikä ennen kuin immuniteetti on elpynyt hoidon jälkeen.
Raskaus ja imetys
Naiset, jotka voivat tulla raskaaksi / raskauden ehkäisy miehillä ja naisilla
Naisten, jotka voivat tulla raskaaksi, täytyy tehdä raskaustesti mahdollisen raskauden selvittämiseksi ennen Yescarta-hoidon aloittamista.
Katso lymfosyyttejä vähentävään kemoterapiaan kuuluvien valmisteiden tuotetiedoista tietoa tehokkaan ehkäisyn tarpeesta potilailla, jotka saavat lymfosyyttejä vähentävää kemoterapiaa.
Ei ole riittävästi altistusta koskevia tietoja, jotta voitaisiin antaa ehkäisyn kestoa koskevia suosituksia Yescarta-hoidon jälkeen.
Raskaus
Ei ole olemassa tietoja Yescarta-valmisteen käytöstä raskaana oleville naisille. Ei ole tutkittu lisääntymis- ja kehitystoksisuutta koskevilla eläinkokeilla, voiko Yescarta-valmisteen antaminen raskaana olevalle naiselle vahingoittaa sikiötä (ks. kohta Prekliiniset tiedot turvallisuudesta).
Ei tiedetä, voiko Yescarta-valmiste siirtyä sikiöön. Jos transdusoidut solut läpäisevät istukan, ne saattavat vaikutusmekanismin perusteella aiheuttaa sikiötoksisuutta, kuten B-lymfosytopeniaa. Siksi Yescarta-valmistetta ei suositella raskaana oleville naisille eikä naisille, jotka voivat tulla raskaaksi eivätkä käytä ehkäisyä. Raskaana oleville naisille on kerrottava mahdollisista sikiöön kohdistuvista riskeistä. Raskaudesta Yescarta-hoidon antamisen jälkeen on keskusteltava hoitavan lääkärin kanssa.
Yescarta-hoitoa saaneen äidin vastasyntyneen lapsen immunoglobuliinipitoisuuksien ja B-solujen arviointia on harkittava.
Imetys
Ei tiedetä, erittyykö Yescarta ihmisen rintamaitoon tai siirtyykö se imetettävään lapseen. Imetettävään imeväiseen kohdistuvia riskejä ei voida poissulkea. Imettävälle naiselle on kerrottava imetettävään lapseen mahdollisesti kohdistuvasta riskistä. On päätettävä, lopetetaanko rintaruokinta vai lopetetaanko Yescarta-hoito, ottaen huomioon rintaruokinnasta aiheutuvat hyödyt lapselle ja hoidosta koituvat hyödyt äidille.
Hedelmällisyys
Yescarta-valmisteen vaikutuksesta hedelmällisyyteen ei ole saatavilla kliinistä tietoa. Vaikutuksia miehen ja naisen hedelmällisyyteen ei ole tutkittu eläinkokeilla.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Yescarta-valmisteella on huomattava vaikutus ajokykyyn ja koneidenkäyttökykyyn.
Neurologisten tapahtumien mahdollisuuden vuoksi, mukaan lukien psyykkisen tilan muutokset tai kouristuskohtaukset, potilaan on vältettävä ajamista tai raskaiden tai mahdollisesti vaarallisten koneiden käyttöä vähintään 8 viikon ajan infuusion jälkeen tai kunnes neurologiset haittavaikutukset ovat hävinneet.
Haittavaikutukset
Turvallisuusprofiilin yhteenveto
Tässä kohdassa kuvatut turvallisuustiedot perustuvat tietoihin yhteensä 397 aikuisesta potilaasta, joita hoidettiin Yescarta-valmisteella kolmessa keskeisessä kliinisessä monikeskustutkimuksessa (ZUMA-1, ZUMA-5 ja ZUMA‑7), sekä myyntiluvan myöntämisen jälkeiseen kokemukseen. Haittavaikutukset ovat keskeisten kliinisten tutkimusten aikana ja myyntiluvan myöntämisen jälkeen havaittuja haittatapahtumia, joiden on lääketieteellisesti arvioitu johtuvan kohtuullisen todennäköisesti aksikabtageenisiloleuseelista.
Uusiutunut tai hoitoon reagoimaton DLBCL, PMBCL ja follikulaarisesta lymfoomasta alkunsa saanut DLBCL kahden tai useamman systeemistä hoitoa sisältäneen hoitolinjan jälkeen
ZUMA‑1-tutkimuksesta saadut turvallisuustiedot perustuvat Yescarta-altistukseen vaiheen 1/2 tutkimuksessa, jossa 108 potilasta sai painoon perustuvan suositellun annoksen CAR-positiivisia T-soluja. Tässä kuvatut tiedot perustuvat 54 kuukauden seurannan analyysiin, jossa seurannan todellinen mediaanikesto oli 23,5 kuukautta (vaihteluväli: 0,3–68,2 kuukautta).
Merkittävimpiä ja useimmin ilmenneitä haittavaikutuksia olivat sytokiinioireyhtymä (93 %), enkefalopatia (60 %) ja infektiot (40 %).
Vakavia haittavaikutuksia ilmeni 51 %:lla potilaista. Yleisimpiä (≥ 5 %) vakavia haittavaikutuksia olivat enkefalopatia (22 %), tarkemmin määrittelemättömien patogeenien aiheuttamat infektiot (15 %), bakteeri-infektiot (6 %), virusinfektiot (6 %), kuumeinen neutropenia (5 %) ja kuume (5 %).
Yleisimpiä (≥ 5 %) vähintään vaikeusasteen 3 ei-hematologisia haittavaikutuksia olivat enkefalopatia (31 %), tarkemmin määrittelemättömien patogeenien aiheuttamat infektiot (19 %), sytokiinioireyhtymä (11 %), bakteeri-infektio (9 %), delirium (6 %), hypertensio (6 %), hypotensio (6 %), transaminaasipitoisuuksien suureneminen (6 %) ja virusinfektio (6 %). Yleisimpiä vähintään vaikeusasteen 3 hematologisia haittavaikutuksia olivat lymfopenia (99 %), leukopenia (96 %), neutropenia (94 %), anemia (65 %) ja trombosytopenia (56 %).
DLBCL ja HGBL, joka on uusiutunut 12 kuukauden kuluessa ensilinjan kemoimmunoterapian päättymisestä tai ei reagoi ensilinjan kemoimmunoterapiaan
ZUMA‑7-tutkimuksesta saadut turvallisuustiedot perustuvat Yescarta-altistukseen vaiheen 3 tutkimuksessa, jossa 170 potilasta sai painoon perustuvan suositellun annoksen CAR-positiivisia T-soluja. Kuvatut tiedot perustuvat analyysiin, jossa seurannan todellinen mediaanikesto oli 23,2 kuukautta (vaihteluväli: 1,5–41,3 kuukautta).
Merkittävimpiä ja useimmin ilmenneitä haittavaikutuksia olivat sytokiinioireyhtymä (92 %), enkefalopatia (49 %) ja infektiot (45 %).
Vakavia haittavaikutuksia ilmeni 54 %:lla potilaista. Yleisimpiä (≥ 5 %) vakavia haittavaikutuksia olivat sytokiinioireyhtymä (17 %), enkefalopatia (16 %), tarkemmin määrittelemättömien patogeenien aiheuttamat infektiot (8 %), kuume (6 %) ja virusinfektio (5 %).
Yleisimpiä (≥ 5 %) vähintään vaikeusasteen 3 ei-hematologisia haittavaikutuksia olivat enkefalopatia (19 %), tarkemmin määrittelemättömien patogeenien aiheuttamat infektiot (8 %), sytokiinioireyhtymä (6 %) ja bakteeri-infektio (5 %). Yleisimpiä vähintään vaikeusasteen 3 hematologisia haittavaikutuksia olivat lymfopenia (99 %), leukopenia (95 %), neutropenia (94 %), anemia (41 %) ja trombosytopenia (26 %).
Follikulaarinen lymfooma kolmen tai useamman systeemistä hoitoa sisältäneen hoitolinjan jälkeen
ZUMA‑5-tutkimuksesta saadut turvallisuustiedot perustuvat Yescarta-altistukseen vaiheen 2 tutkimuksessa, jossa 119 potilasta, joilla oli uusiutunut tai hoitoon reagoimaton follikulaarinen lymfooma, sai painoon perustuvan suositellun annoksen CAR-positiivisia T-soluja. Tässä kuvatut tiedot perustuvat 24 kuukauden seurannan analyysiin, jossa seurannan todellinen mediaanikesto oli 25,9 kuukautta (vaihteluväli: 0,3–44,3 kuukautta).
Merkittävimpiä ja useimmin ilmenneitä haittavaikutuksia olivat sytokiinioireyhtymä (77 %), infektiot (59 %) ja enkefalopatia (47 %).
Vakavia haittavaikutuksia ilmeni 45 %:lla potilaista. Yleisimpiä (≥ 5 %) vakavia haittavaikutuksia olivat enkefalopatia (16 %), tarkemmin määrittelemättömien patogeenien aiheuttamat infektiot (12 %), sytokiinioireyhtymä (12 %) ja bakteeri-infektio (5 %).
Yleisimpiä (≥ 5 %) vähintään vaikeusasteen 3 ei-hematologisia haittavaikutuksia olivat enkefalopatia (14 %), tarkemmin määrittelemättömien patogeenien aiheuttamat infektiot (11 %), sytokiinioireyhtymä (6 %) ja bakteeri-infektio (5 %). Yleisimpiä vähintään vaikeusasteen 3 hematologisia haittavaikutuksia olivat lymfopenia (99 %), leukopenia (94 %), neutropenia (92 %), trombosytopenia (34 %) ja anemia (33 %).
Taulukkomuotoinen luettelo haittavaikutuksista
Tässä kohdassa kuvatut haittavaikutukset todettiin potilailla, jotka altistuivat Yescarta-valmisteelle ZUMA-1-tutkimuksessa (n = 108), ZUMA-5-tutkimuksessa (n = 119) tai ZUMA-7-tutkimuksessa (n = 170), tai raportoitiin myyntiluvan myöntämisen jälkeen. Haittavaikutukset on esitetty elinjärjestelmän ja esiintyvyyden mukaan. Esiintymistiheydet on määritelty seuraavasti: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000). Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä.
Taulukko 1: Yescarta-hoidon yhteydessä todetut lääkkeen haittavaikutukset
| Elinjärjestelmä | Yleisyys | Haittavaikutukset |
|---|---|---|
| Infektiot | ||
| Hyvin yleinen | Tarkemmin määrittelemättömien patogeenien aiheuttamat infektiot Virusinfektio Bakteeri-infektio | |
| Yleinen | Sieni-infektio | |
| Hyvän- ja pahanlaatuiset kasvaimet (mukaan lukien kystat ja polyypit) | ||
| Melko harvinainen | T-soluperäinen sekundaarinen syöpä | |
| Veri ja imukudos | ||
| Hyvin yleinen | Kuumeinen neutropenia# Neutropenia# Lymfopenia# Leukopenia# Anemia# Trombosytopenia# | |
| Yleinen | Koagulopatiaa | |
| Immuunijärjestelmä | ||
| Hyvin yleinen | Sytokiinioireyhtymä Immunoglobuliinien väheneminenb | |
| Yleinen | Yliherkkyys | |
| Melko harvinainen | Hemofagosyyttinen lymfohistiosytoosi* | |
| Aineenvaihdunta ja ravitsemus | ||
| Hyvin yleinen | Hyponatremia# Hypofosfatemia# Hyperurikemia#** Hyperglykemia# Heikentynyt ruokahaluc | |
| Yleinen | Hypokalemia# Hypokalsemia# Hypoalbuminemia# Dehydraatiod Painon lasku | |
| Psyykkiset häiriöt | ||
| Hyvin yleinen | Deliriume Unettomuus | |
| Yleinen | Ahdistuneisuus Affektiivinen häiriöf | |
| Hermosto | ||
| Hyvin yleinen | Enkefalopatiag Vapinah Päänsärkyi Heitehuimausj | |
| Yleinen | Ataksiak Kouristuskohtaus, status epilepticus mukaan lukien Hemipareesi Kasvohermohalvausl Perifeerinen neuropatiam Myoklonus | |
| Melko harvinainen | Neliraajahalvaus Selkäytimen turvotus Myeliitti Dyskalkulia | |
| Silmät | ||
| Yleinen | Näköhäiriötn | |
| Sydän | ||
| Hyvin yleinen | Takykardiao Rytmihäiriöp | |
| Yleinen | Sydämenpysähdys Sydämen vajaatoimintaq | |
| Verisuonisto | ||
| Hyvin yleinen | Hypotensior Hypertensio | |
| Yleinen | Tromboosis Verenvuotot | |
| Hengityselimet, rintakehä ja välikarsina | ||
| Hyvin yleinen | Yskäu | |
Yleinen
| Hengitysvajausv Hypoksiaw Pleuraeffuusio Keuhkoedeema Dyspneax Nenätulehdusy | |
| Ruoansulatuselimistö | ||
| Hyvin yleinen | Oksentelu Ripuliz Ummetus Vatsakipuaa Pahoinvointi | |
| Yleinen | Dysfagia*** Suun kuivuminenbb | |
| Maksa ja sappi | ||
| Hyvin yleinen | Kohonneet transaminaasiarvotcc | |
| Yleinen | Hyperbilirubinemiadd | |
| Iho ja ihonalainen kudos | ||
| Hyvin yleinen | Ihottumaee | |
| Luusto, lihakset ja sidekudos | ||
| Hyvin yleinen | Motorinen häiriöff Tuki- ja liikuntaelinten kipugg | |
| Melko harvinainen | Rabdomyolyysi | |
| Munuaiset ja virtsatiet | ||
| Yleinen | Munuaisten vajaatoimintahh | |
| Yleisoireet ja antopaikassa todettavat haitat | ||
| Hyvin yleinen | Kuumeii Turvotusjj Uupumuskk Vilunväristykset | |
| Yleinen | Infuusioon liittyvä reaktio Kipu | |
| Melko harvinainen | Monielinvaurio-oireyhtymä | |
* Hemofagosyyttista lymfohistiosytoosia on ilmoitettu sytokiinioireyhtymän yhteydessä
** Hyperurikemia todettiin yhdistetyssä analyysissä, jossa oli mukana 227 aikuista potilasta, jotka saivat Yescarta-valmistetta ZUMA‑1 ja ZUMA‑5-tutkimuksissa
*** Dysfagiaa on raportoitu neurologisen toksisuuden ja enkefalopatian yhteydessä
# Yleisyys perustuu vähintään vaikeusasteen 3 laboratoriotulokseen
a. Koagulopatiaan sisältyy koagulopatia, pienentynyt veren fibrinogeenipitoisuus, suurentunut veren fibrinogeenipitoisuus, disseminoitunut intravaskulaarinen koagulaatio, hypofibrinogenemia, suurentunut INR, pienentynyt protrombiinipitoisuus, pidentynyt protrombiiniaika.
b. Immunoglobuliinien vähenemiseen sisältyy veren immunoglobuliini G:n väheneminen, hypogammaglobulinemia.
c. Ruokahalun heikentymiseen sisältyy ruokahalun heikentyminen, hypofagia.
d. Dehydraatioon sisältyy dehydraatio, hypovolemia.
e. Deliriumiin sisältyy delirium, agitaatio, harhaluulo, desorientaatio, hallusinaatio, levottomuus.
f. Affektiiviseen häiriöön sisältyy impulsiivinen käytös, mielialan muutos, masennus, paniikkikohtaus.
g. Enkefalopatiaan sisältyy enkefalopatia, agrafia, tajunnan tason muutos, amnesia, afasia, afonia, apraksia, kognitiivinen häiriö, sekavuus, tajunnan alentuminen, tarkkaavaisuushäiriö, dysartria, dysgrafia, dyskinesia, dyspraksia, hypersomnia, immuuniefektorisoluihin liittyvä neurotoksisuusoireyhtymä (ICAN-oireyhtymä), letargia, leukoenkefalopatia, tajunnan menetys, muistihäiriö, psyykkisten toimintojen häiriö, mielentilan muutokset, metabolinen enkefalopatia, neurotoksisuus, puheen hitaus, uneliaisuus, puhehäiriö, horros, toksinen enkefalopatia.
h. Vapinaan sisältyy vapina, pään vapina.
i. Päänsärkyyn sisältyy päänsärky, epämiellyttävä tuntemus päässä, jännityspäänsärky.
j. Heitehuimaukseen sisältyy heitehuimaus, asentohuimaus, presynkopee, pyörtyminen, kiertohuimaus.
k. Ataksiaan sisältyy ataksia, tasapainohäiriö, kävelyhäiriö.
l. Kasvohermohalvaukseen sisältyy kasvohermohalvaus, kasvohalvaus.
m. Perifeeriseen neuropatiaan sisältyy perifeerinen neuropatia, allodynia, servikaalinen radikulopatia, hyperestesia, hypestesia, lumbaalinen radikulopatia, parestesia, perifeerinen sensorinen neuropatia, pohjehermon halvaus.
n. Näköhäiriöihin sisältyy näköhäiriö, hemianopsia, näön hämärtyminen, alentunut näöntarkkuus.
o. Takykardiaan sisältyy takykardia, posturaalinen takykardiaoireyhtymä, sinustakykardia.
p. Rytmihäiriöön sisältyy rytmihäiriö, eteisvärinä, eteislepatus, eteis-kammiokatkos, bradykardia, oikean puolen haarakatkos, EKG:n pidentynyt QT, lisälyönnit, kohonnut sydämen syke, epäsäännöllinen sydämen syke, sinusbradykardia, supraventrikulaariset lisälyönnit, supraventrikulaarinen takykardia, kammioiden rytmihäiriöt, kammiolisälyönnit, kammiotakykardia.
q. Sydämen vajaatoimintaan sisältyy sydämen vajaatoiminta, akuutti vasemman kammion vajaatoiminta, alentunut ejektiofraktio, stressikardiomyopatia.
r. Hypotensioon sisältyy hypotensio, hiussuonivuoto-oireyhtymä, diastolinen hypotensio, hypoperfuusio, ortostaattinen hypotensio.
s. Tromboosiin sisältyy tromboosi, kainalolaskimotukos, käsivarren ja pään laskimon tukos, syvä laskimotromboosi, laitteen. tukkeutuminen, embolia, kaulalaskimotukos, perifeerinen embolia, perifeerinen iskemia, keuhkoembolia, pernalaskimon tukos, tukos laitteessa.
t. Verenvuotoon sisältyy vakavat ja mahdollisesti kuolemaan johtavat verenvuototapahtumat, kuten ruoansulatuskanavan verenvuoto, keuhkoverenvuoto ja kallonsisäinen verenvuoto.
u. Yskään sisältyy yskä, limainen yskä, ylähengitysteiden yskäoireyhtymä.
v. Hengitysvajaukseen sisältyy hengitysvajaus, akuutti hengitysvajaus.
w. Hypoksiaan sisältyy hypoksia, happisaturaation aleneminen.
x. Dyspneaan sisältyy dyspnea, rasitushengenahdistus.
y. Nenätulehdukseen sisältyy allerginen nuha, nenän vuotaminen.
z. Ripuliin sisältyy ripuli, koliitti, enteriitti.
aa. Vatsakipuun sisältyy vatsakipu, vatsavaivat, alavatsakipu, ylävatsakipu, vatsan arkuus, dyspepsia, ylävatsavaivat.
bb. Suun kuivumiseen sisältyy suun kuivuminen, huulten kuivuminen.
cc. Kohonneisiin transaminaasiarvoihin sisältyy transaminaasiarvojen kohoaminen, alaniiniaminotransferaasiarvojen kohoaminen, aspartaattiaminotransferaasiarvojen kohoaminen, maksaentsyymiarvojen kohoaminen, hypertransaminasemia.
dd. Hyperbilirubinemiaan sisältyy hyperbilirubinemia, veren bilirubiinin kohoaminen.
ee. Ihottumaan sisältyy ihottuma, antopaikan ihottuma, dermatiitti, allerginen ihottuma, rakkulainen ihottuma, eryteema, kutina, punoittava ihottuma, makulaarinen ihottuma, makulopapulaarinen ihottuma, kutiava ihottuma, pustulaarinen ihottuma, urtikaria.
ff. Motoriseen häiriöön sisältyy motorinen häiriö, tahattomat lihassupistukset, lihasjäykkyys, lihasspasmit, lihasten spastisuus, lihasvenähdys, lihasten kireys, lihasnykäykset, lihasheikkous.
gg. Tuki- ja liikuntaelinten kipuun sisältyy tuki- ja liikuntaelinten kipu, nivelkipu, niveltulehdus, selkäkipu, luukipu, kylkikipu, nivuskipu, rintakehän luusto- ja lihaskipu, lihaskipu, niskakipu, osteoartriitti, raajakipu.
hh. Munuaisten vajaatoimintaan sisältyy akuutti munuaisvaurio, veren kreatiniiniarvon kohoaminen, munuaisten vajaatoiminta.
ii. Kuumeeseen sisältyy hypertermia, pyreksia.
jj. Turvotukseen sisältyy edeema, kasvojen turvotus, yleistynyt turvotus, paikallinen turvotus, sukuelinten turvotus, perifeerinen edeema, perifeerinen turvotus, turvotus.
kk. Uupumukseen sisältyy uupumus, astenia, vähentynyt aktiivisuus, huonovointisuus.
Valikoitujen haittavaikutusten kuvaus
Sytokiinioireyhtymä
Sytokiinioireyhtymää ilmeni 92 %:lla potilaista ZUMA-1- ja ZUMA-7-tutkimuksissa. Kahdeksalla prosentilla (8 %) oli vähintään vaikeusasteen 3 (vaikea, hengenvaarallinen tai kuolemaan johtanut) sytokiinioireyhtymä. Mediaaniaika sen ilmaantumiseen oli 3 vuorokautta (vaihteluväli: 1−12 vuorokautta) ja mediaanikesto oli 7 vuorokautta (vaihteluväli: 2−58 vuorokautta). Yhdeksänkymmentäyhdeksän prosenttia (99 %) potilaista toipui sytokiinioireyhtymästä. Sytokiinioireyhtymää ei raportoitu normaalin hoitokäytännön mukaista hoitoa ZUMA-7-tutkimuksessa saaneilla potilailla.
Sytokiinioireyhtymää ilmeni 77 %:lla potilaista ZUMA-5-tutkimuksessa. Kuudella prosentilla (6 %) oli vähintään vaikeusasteen 3 (vaikea, hengenvaarallinen tai kuolemaan johtanut) sytokiinioireyhtymä. Mediaaniaika sen ilmaantumiseen oli 4 vuorokautta (vaihteluväli: 1−11 vuorokautta) ja mediaanikesto oli 6 vuorokautta (vaihteluväli: 1−27 vuorokautta). Yhdeksänkymmentäyhdeksän prosenttia (99 %) potilaista toipui sytokiinioireyhtymästä.
Yleisimpiä haittavaikutuksia (≥ 20 %), jotka saattavat liittyä sytokiinioireyhtymään, olivat kuume (89 %), hypotensio (50 %), takykardia (47 %), vilunväristykset (30 %) ja hypoksia (24 %). Vakavia haittavaikutuksia, jotka saattavat liittyä sytokiinioireyhtymään, olivat kuume (12 %), hypotensio (5 %), hypoksia (3 %), rytmihäiriö (3 %), sydämen vajaatoiminta (2 %), uupumus (2 %), päänsärky (2 %), takykardia (2 %), sydänpysähdys (1 %), dyspnea (1 %) ja takypnea (1 %). Ks. tarkkailu- ja hoito-ohjeet kohdasta Varoitukset ja käyttöön liittyvät varotoimet.
Neurologiset haittavaikutukset
Neurologisia haittavaikutuksia ilmeni 63 %:lla potilaista ZUMA-1- ja ZUMA-7-tutkimuksissa. Kahdellakymmenelläviidellä prosentilla (25 %) potilaista todettiin vähintään vaikeusasteen 3 (vaikeita tai hengenvaarallisia) haittavaikutuksia. Neurologista toksisuutta esiintyi 7 vuorokauden kuluessa infuusiosta 75 %:lla potilaista. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 6 vuorokautta (vaihteluväli: 1−133 vuorokautta). Mediaanikesto oli 10 vuorokautta, ja 66 % potilaista toipui kolmen viikon kuluessa infuusiosta.
Neurologisia haittavaikutuksia ilmeni 57 %:lla potilaista ZUMA-5-tutkimuksessa. Kuudellatoista prosentilla (16 %) potilaista todettiin vähintään vaikeusasteen 3 (vaikeita tai hengenvaarallisia) haittavaikutuksia. Neurologista toksisuutta esiintyi 7 vuorokauden kuluessa infuusiosta 65 %:lla potilaista. Mediaaniaika haittavaikutuksen ilmaantumiseen oli 7 vuorokautta (vaihteluväli: 1−177 vuorokautta). Mediaanikesto oli 14 vuorokautta, ja 60 % potilaista toipui kolmen viikon kuluessa infuusiosta.
Yleisimpiä (≥ 5 %) neurologisia haittavaikutuksia olivat enkefalopatia (51 %), vapina (28 %) ja delirium (14 %). Potilailla ilmoitettuja vakavia neurologisia haittavaikutuksia olivat enkefalopatia (18 %), vapina (2 %), delirium (2 %), hemipareesi (1 %) ja kouristukset (1 %). ZUMA-7-tutkimuksessa enkefalopatiaa raportoitiin 49 %:lla Yescarta-hoitoa saaneista ja 8 %:lla normaalin hoitokäytännön mukaista hoitoa saaneista potilaista ja vapinaa 25 %:lla Yescarta-hoitoa saaneista ja 1 %:lla normaalin hoitokäytännön mukaista hoitoa saaneista potilaista.
Muita neurologisia haittavaikutuksia on raportoitu harvemmin kliinisissä tutkimuksissa, ja niitä ovat olleet mm. dysfagia (3 %), myeliitti (0,2 %) ja neliraajahalvaus (0,1 %).
Ks. tarkkailu- ja hoito-ohjeet kohdasta Varoitukset ja käyttöön liittyvät varotoimet.
Kuumeinen neutropenia ja infektiot
Kuumeista neutropeniaa on havaittu 10 %:lla potilaista Yescarta-infuusion jälkeen. Infektioita ilmeni 48 %:lla potilaista. Vähintään vaikeusasteen 3 (vaikeita, hengenvaarallisia tai kuolemaan johtaneita) infektioita ilmeni 19 %:lla potilaista. Vähintään vaikeusasteen 3 infektioita ilmeni 12 %:lla (aiheuttaja tarkemmin määrittelemätön patogeeni), 6 %:lla (aiheuttaja bakteeri) ja 5 %:lla (aiheuttaja virus) potilaista. Yleisimmin määrittelemättömän patogeenin aiheuttama infektio oli hengitysteissä. ZUMA-7-tutkimuksessa kuumeista neutropeniaa raportoitiin 2 %:lla Yescarta-hoitoa saaneista ja 27 %:lla normaalin hoitokäytännön mukaista hoitoa saaneista potilaista ja virusinfektioita 16 %:lla Yescarta-hoitoa saaneista ja 5 %:lla normaalin hoitokäytännön mukaista hoitoa saaneista potilaista. Ks. tarkkailu- ja hoito-ohjeet kohdasta Varoitukset ja käyttöön liittyvät varotoimet.
Pitkittyneet sytopeniat
Vähintään vaikeusasteen 3 neutropeniaa (mukaan lukien kuumeinen neutropenia) ilmeni 68 %:lla, anemiaa 31 %:lla ja trombosytopeniaa 23 %:lla potilaista. Pitkittynyttä (edelleen päivänä 30 ilmenevää tai päivänä 30 tai sen jälkeen alkanutta) vähintään vaikeusasteen 3 neutropeniaa ilmeni 26 %:lla, trombosytopeniaa 12 %:lla ja anemiaa 6 %:lla potilaista. Päivän 93 jälkeen ilmenevää vähintään vaikeusasteen 3 neutropeniaa todettiin 24 kuukauden seurannan analyysin kohdalla 11 %:lla, trombosytopeniaa 7 %:lla ja anemiaa 3 %:lla potilaista ZUMA-1-tutkimuksessa. ZUMA-7-tutkimuksessa raportoitiin vähintään vaikeusasteen 3 neutropeniaa 94 %:lla Yescarta-hoitoa saaneista ja 51 %:lla normaalin hoitokäytännön mukaista hoitoa saaneista potilaista ja vähintään vaikeusasteen 3 trombosytopeniaa 26 %:lla Yescarta-hoitoa saaneista ja 63 %:lla normaalin hoitokäytännön mukaista hoitoa saaneista potilaista. Ks. hoito-ohjeet kohdasta Varoitukset ja käyttöön liittyvät varotoimet.
Hypogammaglobulinemia
Hypogammaglobulinemiaa ilmoitettiin 15 %:lla Yescarta-valmisteella hoidetuista potilaista. Kumulatiivisesti ZUMA-1-tutkimuksessa 36 potilasta 108:sta (33 %) oli saanut laskimonsisäistä immunoglobuliinihoitoa 54 kuukauden analyysin kohdalla, ZUMA‑7-tutkimuksessa 28 (16 %) potilasta 170:stä oli saanut laskimonsisäistä immunoglobuliinihoitoa 23,2 kuukauden analyysin kohdalla ja ZUMA-5-tutkimuksessa 33 tutkittavaa 119:stä (28 %) oli saanut laskimonsisäistä immunoglobuliinihoitoa 24 kuukauden seurannan analyysin kohdalla. ZUMA-7-tutkimuksessa raportoitiin immunoglobuliinien vähenemistä 11 %:lla Yescarta-hoitoa saaneista ja 1 %:lla normaalin hoitokäytännön mukaista hoitoa saaneista potilaista. Ks. hoito-ohjeet kohdasta Varoitukset ja käyttöön liittyvät varotoimet.
Immunogeenisuus
Yescarta-valmisteen immunogeenisuutta on arvioitu käyttämällä entsyymivälitteistä immunosorbenttimääritystä (ELISA) FMC63:een sitoutuvien vasta-aineiden havaitsemiseen. FMC63 on vasta-aine, josta anti-CD19-CAR on peräisin. ZUMA-1- ja ZUMA-7-tutkimuksissa yhdellätoista potilaalla 278:sta (4 %) oli positiivinen FMC63-vasta-ainetulos ennen Yescarta‑hoitoa, ja ZUMA-7-tutkimuksessa yksi potilas (1 %), jolla oli ennen hoitoa negatiivinen tulos, sai ELISA-seulontatestissä positiivisen tuloksen hoidon jälkeen. Varmistavan solupohjaisen määrityksen tulokset, joissa hyödynnettiin CAR:n asianmukaisesti laskostettua ja ilmennettyä solunulkoista osaa (ScFV, sarana ja linkkeri), osoittivat, että kaikki Yescarta-hoitoa saaneet potilaat, jotka saivat positiivisen tuloksen ELISA-seulontatestissä, olivat vasta-aineen suhteen negatiivisia kaikkina testiajankohtina. Ei ole näyttöä siitä, että Yescarta-valmisteen alkuvaiheen monistumisen tai säilymisen kinetiikka tai Yescarta-valmisteen teho tai turvallisuus olisi muuttunut näillä potilailla. ZUMA-5-tutkimuksessa 13 potilasta 116:sta (11 %) sai ELISA-seulontatestissä positiivisen tuloksen vasta-aineiden suhteen ennen Yescarta‑hoitoa, ja kaksi tutkittavaa, jotka saivat ennen hoitoa negatiivisen tuloksen, sai positiivisen tuloksen hoidon jälkeen. Varmistavan solupohjaisen testin tulokset osoittivat, että kaikki Yescarta-valmisteella hoidetut potilaat, joilla oli ollut ELISA-testissä positiivinen tulos, olivat vasta-ainenegatiivisia ennen hoitoa, sen aikana ja sen jälkeen.
Erityinen potilasjoukko
On olemassa vain vähän kokemusta Yescarta-valmisteen käytöstä vähintään 75-vuotiaille potilaille. Yleisesti turvallisuus ja teho olivat samanlaisia vähintään 65-vuotiailla ja alle 65-vuotiailla potilailla, jotka saivat Yescarta-hoitoa. Hoitotulokset olivat samanlaisia potilailla, joiden Eastern Cooperative Oncology Group (ECOG) -toimintakykyluokka oli 0 tai 1, sekä eri sukupuolilla.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista seuraavalle taholle:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Yescarta-valmisteen yliannostuksesta ei ole saatavilla kliinisistä tutkimuksista peräisin olevia tietoja.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: Antineoplastiset lääkeaineet, muut antineoplastiset lääkeaineet, antineoplastinen solu- ja geeniterapia, ATC-koodi: L01XL03
Vaikutusmekanismi
Yescarta, geneettisesti muunneltuja autologisia T-soluja sisältävä immuunihoitovalmiste, sitoutuu CD19-antigeeniä ilmentäviin syöpäsoluihin ja normaaleihin B-soluihin. Kun anti-CD19-CAR-T-solut tarttuvat CD19-antigeeniä ilmentäviin kohdesoluihin, kostimulatoriset CD28- ja CD3-zeeta-domeenit aktivoivat alavirran puoleiset signaalikaskadit, jotka saavat T-solut aktivoitumaan, proliferoitumaan, erilaistumaan efektorisoluiksi ja erittämään tulehdussytokiineja ja kemokiineja. Tämä tapahtumasarja johtaa CD19-antigeeniä ilmentävien kohdesolujen apoptoosiin ja nekroosiin.
Farmakodynaamiset vaikutukset
Yescarta-infuusion jälkeen arvioitiin farmakodynaamisia vasteita mittaamalla sytokiinien, kemokiinien ja muiden veren molekyylien pitoisuuksien tilapäistä suurenemista 4 viikon aikana. Sytokiinien ja kemokiinien, kuten IL‑6:n, IL‑8:n, IL‑10:n, IL‑15:n, TNF‑α:n, IFN‑γ:n ja IL2Rα:n, pitoisuudet analysoitiin. Huippupitoisuus havaittiin ensimmäisten 14 vuorokauden aikana infuusion jälkeen, ja pitoisuudet palautuivat lähtötasolle yleensä 28 vuorokauden kuluessa.
Analyysit, joita tehtiin sytokiinipitoisuuksien ja sytokiinioireyhtymän tai neurologisten tapahtumien ilmaantuvuuden välisen yhteyden tunnistamiseksi, osoittivat, että useiden immunomoduloivien ja proinflammatoristen analyyttien suurentuneet infuusion jälkeiset pitoisuudet (huippupitoisuus ja AUC 1 kuukauden kohdalla) olivat yhteydessä vähintään vaikeusasteen 3 neurologisiin haittavaikutuksiin ja vähintään vaikeusasteen 3 sytokiinioireyhtymään ZUMA-1-, ZUMA-7- ja ZUMA-5-tutkimuksissa.
Yescarta-valmisteella on liioitellun voimakkaita ja haitallisia farmakologisia muihin kuin kasvainsoluihin kohdistuvia vaikutuksia kohdesoluissa, joten tilapäistä B-soluaplasiaa on odotettavissa hoidon jälkeen.
Niistä 73:sta ZUMA-1-tutkimuksen potilaasta, joista oli arvioitavissa olevia näytteitä lähtötilanteessa, 40 %:lla oli havaittavissa B‑soluja; suurimmalla osalla potilaista lähtötilanteessa havaittu B‑soluaplasia johtui aiemmista hoidoista. Yescarta-hoidon jälkeen niiden potilaiden osuus, joilla oli havaittavissa B‑soluja, oli pienentynyt: 20 %:lla oli havaittavissa B‑soluja kuukauden 3 kohdalla ja 22 %:lla oli havaittavissa B‑soluja kuukauden 6 kohdalla. B‑solujen palautumisen alkaminen havaittiin ensin kuukauden 9 kohdalla, kun 56 %:lla potilaista oli havaittavissa B‑soluja. Tämä suuntaus B‑solujen palautumiseen jatkui ajan myötä siten, että 64 %:lla potilaista oli havaittavissa B‑soluja kuukauden 18 kohdalla ja 77 %:lla potilaista oli havaittavissa B‑soluja kuukauden 24 kohdalla. ZUMA-7-tutkimuksessa niistä 141 potilaasta, joista oli arvioitavissa oleva näytteitä lähtötilanteessa, 57 %:lla oli havaittavissa B-soluja. Yescarta-hoidon jälkeen niiden potilaiden osuus, joilla oli havaittavissa B‑soluja, oli pienentynyt: 38 %:lla oli havaittavissa B‑soluja kuukauden 3 kohdalla ja 41 %:lla oli havaittavissa B‑soluja kuukauden 6 kohdalla. B‑solujen palautumisen alkaminen havaittiin kuukauden 9 kohdalla, kun 58 %:lla potilaista oli havaittavissa B‑soluja. Tämä suuntaus B-solujen palautumisessa jatkui ajan myötä siten, että 64 %:lla potilaista oli havaittavissa B-soluja kuukauden 18 kohdalla ja 84 %:lla potilaista oli havaittavissa B-soluja kuukauden 24 kohdalla. Niistä 113:sta FL-potilaasta, joista oli arvioitavissa olevia näytteitä lähtötilanteessa ZUMA-5-tutkimuksessa, 75 %:lla oli havaittavissa B-soluja. Yescarta-hoidon jälkeen niiden potilaiden osuus, joilla oli havaittavissa B‑soluja, oli pienentynyt: 40 %:lla oli havaittavissa B‑soluja kuukauden 3 kohdalla. Ajan myötä todettiin B-solujen palautumista, ja 61 %:lla oli havaittavissa B‑soluja kuukauden 24 kohdalla. Potilaiden seurantaa ei vaadittu sairauden etenemisen jälkeen. Näin ollen suurin osa potilaista, joista oli arvioitavissa olevia näytteitä, sai vasteen.
Kliininen teho ja turvallisuus
Uusiutunut tai hoitoon reagoimaton DLBCL, PMBCL ja follikulaarisesta lymfoomasta alkunsa saanut DLBCL kahden tai useamman systeemistä hoitoa sisältäneen hoitolinjan jälkeen (ZUMA-1-tutkimus)
Yhteensä 108 potilasta hoidettiin Yescarta-valmisteella vaiheen 1/2 avoimessa yksihaaraisessa monikeskustutkimuksessa potilailla, joilla oli uusiutunut tai hoitoon reagoimaton aggressiivinen B‑solujen non-Hodgkin-lymfooma (NHL). Teho perustui 101 potilaan vaiheen 2 tuloksiin, mukaan lukien histologisesti vahvistettu diffuusi suurisoluinen B-solulymfooma (N = 77), primaarinen välikarsinan suurisoluinen B-solulymfooma (N = 8) ja follikulaarisesta lymfoomasta alkunsa saanut diffuusi suurisoluinen B-solulymfooma (N = 16), WHO:n vuoden 2008 luokituksen perusteella. ZUMA‑1-tutkimukseen osallistuneilla potilailla oli tarkemmin määrittelemätöntä diffuusia suurisoluista B-solulymfoomaa, muita diffuusin suurisoluisen B-solulymfooman alatyyppejä ja korkean maligniteettiasteen B-solulymfoomaa (HGBL), WHO:n vuoden 2016 luokituksen perusteella. 47 potilaalta arvioitiin MYC-, BCL-2- ja BCL-6 -proteiinien status. 30 potilaalla havaittiin kaksinkertaisesti ilmentyvä diffuusi suurisoluinen B-solulymfooma (sekä MYC- että BCL2-proteiinin yli-ilmentymistä), viidellä havaittiin korkean maligniteettiasteen B-solulymfooma, johon liittyi MYC-, BCL-2- tai BCL-6-geenin uudelleenjärjestymä (kaksois- ja kolmoisosuma), ja kahdella havaittiin korkean maligniteettiasteen tarkemmin määrittelemätön B-solulymfooma. 66 potilasta oli arvioitavissa solualkuperäluokkien (itukeskussoluperäinen [GCB] tai aktivoituneen B-solun tyyppinen [ABC]) osalta. Näistä potilaista 49:llä oli GCB-tyyppi ja 17 potilaalla ABC-tyyppi.
Tutkimukseen soveltuvat potilaat olivat vähintään 18 vuoden ikäisiä ja heillä oli hoitoon reagoimaton sairaus, joka määriteltiin eteneväksi taudiksi tai vakaaksi taudiksi viimeisen hoitolinjan parhaan vasteen perusteella, tai sairauden etenemiseksi 12 kuukauden kuluessa autologisen kantasolusiirron (ASCT) jälkeen. Potilaat, joiden sairaus reagoi huonosti kemoterapiaan tai joiden sairaus uusiutui kahden tai useamman systeemistä hoitoa sisältävän hoitolinjan jälkeen, eivät yleensä soveltuneet saamaan hematopoieettista kantasolusiirtoa. Potilaiden oli täytynyt saada aiemmin ainakin CD20-vasta-ainehoitoa ja antrasykliiniä sisältävää hoitoa. Potilaat, joilla oli keskushermoston lymfooma tai jotka olivat aiemmin saaneet allogeenisen kantasolusiirron tai anti-CD19-CAR-hoitoa tai muuta muuntogeenisiin T-soluihin perustuvaa hoitoa, suljettiin pois tutkimuksesta. Tutkimukseen eivät soveltuneet potilaat, joilla oli ollut aiemmin keskushermostoon liittyviä häiriöitä (kuten kouristuskohtauksia tai serebrovaskulaarinen iskemia) tai joiden sydämen ejektiofraktio oli alle 50 % tai joiden happisaturaatio huoneilmassa oli alle 92 % tai joilla oli systeemistä immunosuppressiota edellyttävä autoimmuunisairaus. Seurannan mediaanikesto oli 63,1 kuukautta (jatkuu edelleen). Yhteenveto potilaiden demografisista tiedoista on esitetty taulukossa 2.
Taulukko 2: Yhteenveto tutkimuksen ZUMA-1 vaiheen 2 demografisista tiedoista (12 kuukauden analyysi)
| Kategoria | Kaikki potilaat, joille tehtiin leukafereesi (ITT-populaatio) Kohortti 1 + 2 (N = 111) | Kaikki hoidetut potilaat (mITT-populaatio) Kohortti 1 + 2 (N = 101) | |
| Ikä (vuotta) | |||
| Mediaani (minimi, maksimi) | 58 (23, 76) | 58 (23, 76) | |
| ≥ 65 | 23 % | 24 % | |
| Miessukupuoli | 69 % | 67 % | |
| Rotu | |||
| Valkoihoinen | 85 % | 86 % | |
| Aasialainen | 4 % | 3 % | |
| Mustaihoinen | 4 % | 4 % | |
| ECOG-toimintakykyluokka | |||
| ECOG 0 | 41 % | 42 % | |
| ECOG 1 | 59 % | 58 % | |
| Aiempien hoitojen mediaanimäärä (minimi, maksimi) | 3 (1, 10) | 3 (1, 10) | |
| Potilaat, joilla oli hoitoon reagoimaton tauti ja jotka olivat saaneet ≥ 2 aiempaa hoitolinjaa | 77 % | 76 % | |
| Potilaat, joiden tauti oli uusiutunut 1 vuoden sisällä autologisesta kantasolusiirrosta | 20 % | 21 % | |
| Potilaat, joiden International Prognostic Index -ennusteluokitus oli 3/4 | 46 % | 46 % | |
| Potilaat, joilla taudin levinneisyysaste oli III/IV | 85 % | 85 % | |
ECOG, Eastern Cooperative Oncology Group; ITT, hoitoaie; mITT, muokattu hoitoaie.
Yescarta-valmistetta annettiin yhtenä infuusiona tavoiteannoksena 2 × 106 anti-CD19-CAR-T-solua/kg lymfosyyttejä vähentävän kemoterapian jälkeen, jonka muodostivat 500 mg/m2 syklofosfamidia laskimoon ja 30 mg/m2 fludarabiinia laskimoon 5., 4. ja 3. päivänä ennen Yescarta-hoitoa. Leukafereesin ja lymfosyyttejä vähentävän kemoterapian välinen siltakemoterapia ei ollut sallittu. Kaikki potilaat otettiin sairaalahoitoon tarkkailua varten vähintään 7 vuorokauden ajaksi Yescarta-infuusion jälkeen.
Niistä 111 potilaasta, joille tehtiin leukafereesi, 101 sai Yescarta-valmistetta. Yhdeksän potilasta ei saanut hoitoa, pääasiassa etenevän taudin tai vakavien haittatapahtumien vuoksi tutkimukseen mukaanoton jälkeen ja ennen solujen antamista. Yksi potilas 111:stä ei saanut valmistetta valmistuksen epäonnistumisen vuoksi. Mediaaniaika leukafereesistä valmisteen antamiseen oli 17 vuorokautta (vaihteluväli: 14−51 vuorokautta), ja mediaaniaika leukafereesistä infuusioon oli 24 vuorokautta (vaihteluväli: 16−73 vuorokautta). Mediaaniannos oli 2,0 × 106 anti-CD19-CAR-T-solua/kg. Hoitoaiepopulaatioksi (ITT-populaatioksi) määritettiin kaikki potilaat, joille tehtiin leukafereesi; muokatuksi hoitoaiepopulaatioksi (mITT-populaatioksi) määritettiin kaikki Yescarta-hoitoa saaneet potilaat.
Ensisijainen päätetapahtuma oli objektiivisen hoitovasteen saavuttavien potilaiden osuus (ORR). Toissijaiset päätetapahtumat olivat vasteen kesto (DOR), kokonaiselinaika (OS) ja haittatapahtumien vaikeusaste. ORR määriteltiin ennalta tutkittavaksi ensimmäisillä 92:lla hoitoa saaneella potilaalla, ja se oli merkitsevästi suurempi kuin ennalta määritelty 20 % (p < 0,0001).
Primaarianalyysissä, joka perustui muokattuun hoitoaiepopulaatioon (mITT-populaatioon (vähintään 6 kuukauden pituinen seuranta), ORR oli 72 % ja täydellisen hoitovasteen saavuttaneiden (CR) osuus oli 51 % riippumattoman arviointiryhmän arvioimana. 12 kuukauden seuranta-analyysissä (taulukko 3) ORR oli 72 % ja CR-osuus 51 %. Mediaaniaika vasteeseen oli 1,0 kuukautta (vaihteluväli: 0,8−6,3 kuukautta). Vasteen kesto (DOR) oli pidempi potilailla, jotka saavuttivat täydellisen hoitovasteen, verrattuna potilaisiin, joiden paras vaste oli osittainen vaste (PR). Niistä 52 potilaasta, jotka saavuttivat täydellisen hoitovasteen, 7 potilaalla oli vakaa tauti ja 9 potilaalla todettiin aluksi kasvaimen arvioinnissa osittainen hoitovaste, joka muuttui täydelliseksi hoitovasteeksi vasta 6,5 kuukauden kuluttua. Molempien alatyyppien, primaarisen välikarsinan B-solulymfooman ja follikulaarisesta lymfoomasta alkunsa saaneen diffuusin suurisoluisen B-solulymfooman, ORR-tulos oli 88 % ja CR-osuus oli edellisellä alatyypillä 75 % ja jälkimmäisellä 56 %. Hoitoaiepopulaation 111 potilaalla ORR oli 66 % ja CR 47 %. Muut tulokset olivat yhdenmukaisia muokatun hoitoaiepopulaation tulosten kanssa.
24 kuukauden seuranta-analyysissä, joka perustui muokattuun hoitoaiepopulaatioon (tulokset riippumattomalta arviointiryhmältä), ORR-osuus oli 74 % ja CR-osuus 54 %. Mediaaniaika vasteeseen oli 1,0 kuukautta (vaihteluväli: 0,8−12,2 kuukautta). Vasteen kesto oli pidempi potilailla, jotka saavuttivat täydellisen hoitovasteen, verrattuna potilaisiin, joiden paras vaste oli osittainen vaste (taulukko 3). Niistä 55 potilaasta, jotka saavuttivat täydellisen hoitovasteen, 7 potilaalla oli vakaa tauti ja 10 potilaalla todettiin aluksi kasvaimen arvioinnissa osittainen hoitovaste, joka muuttui täydelliseksi hoitovasteeksi vasta 12 kuukautta Yescarta-infuusion jälkeen. Vasteen keston mediaania ja kokonaiselinajan mediaania ei saavutettu (taulukko 3). 36 kuukauden analyysissä (seuranta-ajan mediaani tutkimuksessa 39,1 kuukautta) kokonaiselinajan mediaani oli 25,8 kuukautta, ja 47 potilasta (47 %*) oli edelleen elossa. 48 kuukauden analyysissä (seuranta-ajan mediaani tutkimuksessa 51,1 kuukautta) kokonaiselinajan mediaani oli 25,8 kuukautta, ja 43 potilasta (44 %*) oli edelleen elossa. 60 kuukauden analyysissä (seuranta-ajan mediaani tutkimuksessa 63,1 kuukautta) kokonaiselinajan mediaani oli 25,8 kuukautta, ja 42 potilasta (43 %*) oli edelleen elossa.
* Kaplan–Meier-estimaatit olivat 3 vuoden elossaololuvulle 47 %, 4 vuoden elossaololuvulle 44 % ja 5 vuoden elossaololuvulle 43 %.
ZUMA-1-tutkimuksen vaiheessa 1 hoidettiin 7 potilasta. Viisi potilasta sai hoitovasteen, mukaan lukien 4 täydellistä hoitovastetta. 12 kuukauden seuranta-analyysissä 3 potilaalla oli edelleen täydellinen hoitovaste 24 kuukautta Yescarta-infuusion jälkeen. 24 kuukauden seuranta‑analyysissä näillä 3 potilaalla oli edelleen täydellinen hoitovaste 30–35 kuukautta Yescarta-infuusion jälkeen.
Taulukko 3: Yhteenveto tehoa koskevista tuloksista ZUMA-1-tutkimuksen vaiheesta 2
| Luokka | Kaikki potilaat, joille tehtiin leukafereesi (ITT-populaatio) Kohortti 1 + 2 (N = 111) | Kaikki hoidetut potilaat (mITT-populaatio) Kohortti 1 + 2 (N = 101) | ||
| 12 kuukauden analyysi | 24 kuukauden analyysi | 12 kuukauden analyysi | 24 kuukauden analyysi | |
| ORR (%) [95 %:n luottamusväli] | 66 (56, 75) | 68 (58, 76) | 72 (62, 81) | 74 (65, 82) |
| CR (%) | 47 | 50 | 51 | 54 |
| Vasteen kestoa, mediaani (vaihteluväli) kuukausina | 14,0 (0,0, 17,3) | NE (0,0, 29,5) | 14,0 (0,0, 17,3) | NE (0,0, 29,5) |
| Vasteen kestoa, CR, mediaani (vaihteluväli) kuukausina | NE (0,4, 17,3) | NE (0,4, 29,5) | NE (0,4, 17,3) | NE (0,4, 29,5) |
| OS, mediaani (kuukautta) [95 %:n luottamusväli] | 17,4 (11,6, NE) | 17,4 (11,6, NE) | NE (12,8; NE) | NE (12,8, NE) |
| 6 kuukauden OS (%) [95 %:n luottamusväli] | 81,1 (72,5, 87,2) | 81,1 (72,5, 87,2) | 79,2 (69,9, 85,9) | 79,2 (69,9, 85,9) |
| 9 kuukauden OS (%) [95 %:n luottamusväli] | 69,4 (59,9, 77,0) | 69,4 (59,9, 77,0) | 69,3 (59,3, 77,3) | 69,3 (59,3, 77,3) |
| 12 kuukauden OS (%) [95 %:n luottamusväli] | 59,3 (49,6, 67,8) | 59,5 (49,7, 67,9) | 60,4 (50,2, 69,2) | 60,4 (50,2, 69,2) |
| 24 kuukauden OS (%) [95 %:n luottamusväli] | Ei oleellinen | 47,7 (38,2, 56,7) | Ei oleellinen | 50,5 (40,4, 59,7) |
CR, täydellinen hoitovaste; ITT, hoitoaie; mITT, muokattu hoitoaie; NE = ei arvioitavissa (ei saavutettu); ORR, objektiivisen hoitovasteen saavuttavien potilaiden osuus; OS, kokonaiselinaika.
a. Vasteen kesto sensuroitiin kantasolusiirron hetkellä niiltä potilailta, joilla oli vaste kantasolusiirron saadessaan
Huomautus: 12 kuukauden analyysin mediaaniseuranta-aika oli 15,1 kuukautta. 24 kuukauden analyysin mediaaniseuranta-aika oli 27,1 kuukautta. Kokonaiselinaika viittaa aikaan leukafereesipäivästä (ITT) tai Yescarta-infuusiosta (mITT) kuolemaan mistä tahansa syystä.
SCHOLAR-1
Retrospektiivinen, potilastason yhdistetty lopputulostapahtumien analyysi hoitoon reagoimatonta aggressiivista non-Hodgkin-lymfoomaa sairastavilla potilailla (N = 636) (Crump ym. 2017) toteutettiin ennalta määritellyn 20 %:n vertailuvasteosuuden ja ZUMA-1-tutkimuksen tulosten tulkinnan historiallisen kontekstin vahvistamiseksi. Analyysi sisälsi potilaat, jotka eivät olleet saaneet vastetta (vakaa tauti tai etenevä tauti) viimeiseen hoitolinjaan tai joilla sairaus oli uusiutunut 12 kuukauden kuluessa autologisesta kantasolusiirrosta. Vaste ja elossaolo normaalin hoitokäytännön mukaisen hoidon jälkeen arvioitiin. Objektiivisen hoitovasteen saavuttaneiden osuus oli 26 % (95 %:n luottamusväli [21, 31]) ja täydellisen hoitovasteen saavuttaneiden osuus oli 7 % (95 %:n luottamusväli [3, 15]), ja kokonaiselinajan mediaani oli 6,3 kuukautta.
DLBCL ja HGBL, kun tauti on uusiutunut 12 kuukauden kuluessa ensilinjan kemoimmunoterapian päättymisestä tai ei reagoi ensilinjan kemoimmunoterapiaan (ZUMA‑7)
Yescarta-valmisteen teho ja turvallisuus aikuisilla potilailla, joilla oli uusiutunut tai hoitoon reagoimaton suurisoluinen B-solulymfooma (LBCL), osoitettiin vaiheen 3 satunnaistetussa, avoimessa monikeskustutkimuksessa (ZUMA-7). Tutkimukseen osallistuneilla potilailla oli pääasiassa todettu DLBCL:n ja HGBL:n alatyyppejä WHO:n vuoden 2016 luokituksen mukaisesti, ja kaikki potilaat olivat saaneet ensilinjan hoitona rituksimabia ja antrasykliinipohjaista kemoterapiaa. Yhteensä 359 potilasta satunnaistettiin suhteessa 1:1 saamaan kertainfuusio Yescarta-valmistetta tai normaalin hoitokäytännön mukaista hoitoa (määritelty seuraavasti: 2 tai 3 sykliä normaalin hoitokäytännön mukaista kemoimmunoterapiaa [R-ICE, R-DHAP tai R-DHAX, R‑ESHAP tai R-GDP], jota seurasi suuriannoksinen hoito ja autologinen kantasolusiirto potilailla, joilla oli saavutettu vaste). Satunnaistaminen ositettiin ensilinjan hoidon vasteen (primaaristi hoitoon vastaamaton vs. uusiutuminen ≤ 6 kuukauden kuluessa ensilinjan hoidosta vs. uusiutuminen > 6 ja ≤ 12 kuukauden kuluessa ensilinjan hoidosta) ja seulontahetkellä arvioidun toisen linjan hoidon ikäkorjatun IPI-pistemäärän (International Prognostic Index; 0–1 vs. 2–3) mukaan. Tutkimuksesta suljettiin pois potilaat, joille oli aiemmin tehty hematologisten kantasolujen siirto, joilla oli havaittavia pahanlaatuisia soluja selkäydinnesteessä tai aivometastaaseja, joiden Eastern Cooperative Oncology Group ‑toimintakykyluokka (ECOG) oli vähintään 2 tai joiden anamneesissa oli keskushermoston lymfooma. Potilaat, joilla oli aktiivisia tai vakavia infektioita, suljettiin pois. Potilaat, joilla oli yksinkertainen virtsatieinfektio tai komplisoitumaton bakteeriperäinen nielutulehdus, voitiin ottaa mukaan tutkimukseen, jos he vastasivat aktiiviseen hoitoon.
Yescarta annettiin lymfosyyttejä vähentävän kemoterapian jälkeen laskimoon kertainfuusiona tavoiteannoksena 2 × 106 anti-CD19-CAR-T-solua/kg (enimmäisannos: 2 × 108 solua). Lymfosyyttejä vähentävän kemoterapian muodostivat 500 mg/m2 syklofosfamidia laskimoon ja 30 mg/m2 fludarabiinia laskimoon, ja molemmat näistä annettiin 5., 4. ja 3. päivänä ennen Yescarta-hoitoa. Leukafereesin ja lymfosyyttejä vähentävän kemoterapian välissä voitiin antaa tautiprosessiin vaikuttamattomana siltahoitona vain kortikosteroideja potilaille, joiden tautitaakka oli suuri seulonnan yhteydessä.
Koko tutkimuspopulaatiossa mediaani-ikä oli 59 vuotta (vaihteluväli: 21–81 vuotta); 66 % oli miehiä ja 83 % valkoihoisia. Seitsemälläkymmenelläneljällä prosentilla potilaista oli primaarinen hoitoon vastaamaton LBCL ja 26 %:lla potilaista tauti oli uusiutunut 12 kuukauden kuluessa ensilinjan hoidosta. Potilailla toisen linjan hoidon ikävakioitu IPI-pistemäärä oli 0–1 (55 %) tai 2–3 (45 %) ja ECOG-toimintakykyluokka 0 (54 %) tai 1 (46 %).
Yescarta-haaran ja normaalin hoitokäytännön mukaista hoitoa saaneiden haaran potilaat luokiteltiin seuraavasti: DLBCL, tarkemmin määrittelemätön / tarkempi luokittelu ei mahdollinen (Yescarta: 126 potilasta, normaalin hoitokäytännön mukainen hoito: 120 potilasta); follikulaarisesta lymfoomasta alkunsa saanut DLBCL (Yescarta: 19 potilasta, normaalin hoitokäytännön mukainen hoito: 27 potilasta); korkean maligniteettiasteen B-solulymfooma, johon liittyi MYC-, BCL‑2- tai BCL‑6-geenin uudelleenjärjestymä (kaksois- ja kolmoisosuma) (Yescarta: 31 potilasta, normaalin hoitokäytännön mukainen hoito: 25 potilasta) tai määrittelemätön korkean maligniteettiasteen B-solulymfooma (1 potilas normaalin hoitokäytännön mukaista hoitoa saaneessa haarassa); muut tutkittavat luokiteltiin ryhmiin ”ei vahvistettu”, ”puuttuu” tai ”muu”.
Yescarta-hoitoon satunnaistetuista 180 potilaasta 178:lle tehtiin leukafereesi ja 170:lle annettiin Yescarta-hoitoa. Hoidetuista potilaista 60 (33 %) sai siltahoitona kortikosteroidihoitoa. Valmistus ei epäonnistunut yhdessäkään tapauksessa. Kahdeksan potilasta (4 %) jätettiin hoitamatta leukafereesin jälkeen, mikä johtui pääasiassa taudin etenemisestä, vakavista haittatapahtumista tai kuolemasta. Mediaaniaika leukafereesistä valmisteen vapauttamiseen oli 13 vuorokautta (vaihteluväli: 10–24 vuorokautta) ja leukafereesistä Yescarta-infuusioon 26 vuorokautta (vaihteluväli: 16–52 vuorokautta). Mediaaniannos oli 2,0 × 106 anti-CD19-CAR-T-solua/kg. Kaikkia 170:tä Yescartaa saanutta potilasta seurattiin terveydenhuollon hoitoyksikössä vähintään 7 päivän ajan. Normaalin hoitokäytännön mukaiseen hoitoon satunnaistetuista 179 potilaasta 64 potilasta (36 %) sai suuriannoksista hoitoa ja autologisen kantasolusiirron.
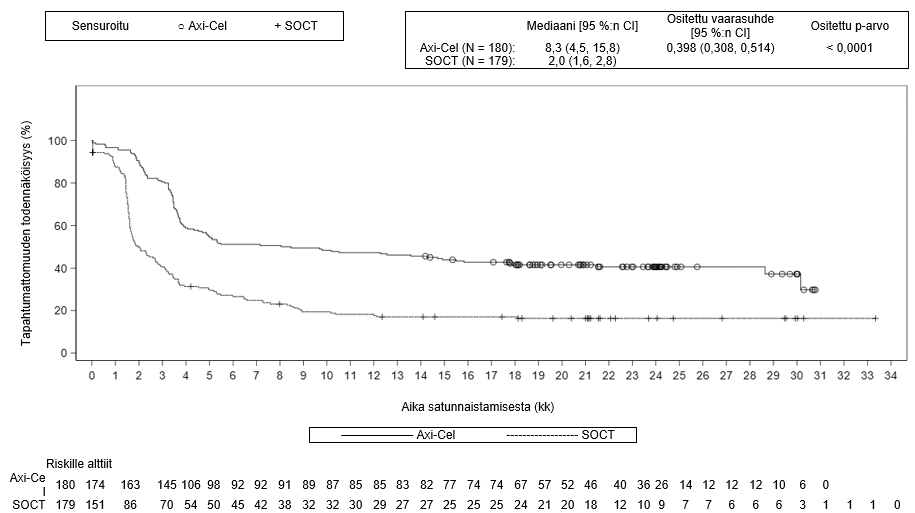
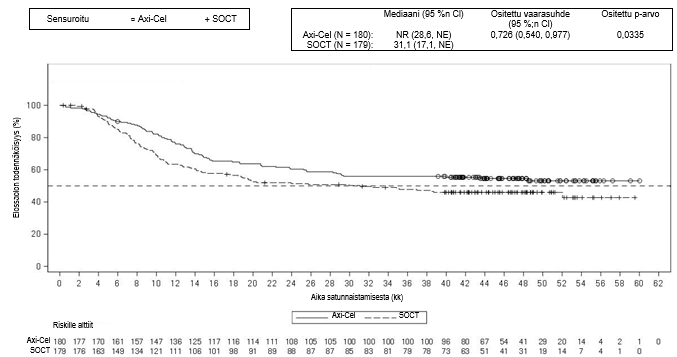
Ensisijainen päätetapahtuma oli tapahtumavapaa elossaolo (EFS), joka määritettiin sokkoutetun keskitetyn arvioinnin perusteella. Keskeiset toissijaiset päätetapahtumat olivat objektiivisen hoitovasteen saavuttavien potilaiden osuus (ORR) ja kokonaiselinaika (OS). Taulukossa 4 on esitetty yhteenveto tehoa koskevista tuloksista koko populaatiossa, ja kuvassa 1 on esitetty EFS-tuloksia ja kuvassa 2 OS-tuloksia koskeva Kaplan–Meier-käyrä. 24 kuukauden kohdalla EFS oli 40,5 % [95 %:n luottamusväli: 33,2, 47,7] Yescarta-haarassa ja 16,3 % (95 %:n luottamusväli: 11,1, 22,2] normaalin hoitokäytännön mukaista hoitoa saaneiden haarassa. EFS-tulosten primaarianalyysin ajankohtana keskitetysti arvioidun etenemättömyysajan (PFS) mediaani Yescarta-haarassa oli 14,7 kuukautta (95 %:n luottamusväli: 5,4, ei arvioitavissa) verrattuna 3,7 kuukauteen (95 %:n luottamusväli: 2,9, 5,3) normaalin hoitokäytännön mukaista hoitoa saaneiden haarassa (vaarasuhde: 0,490 [95 %:n luottamusväli: 0,368, 0,652]). Tutkimuksen keston mediaani oli 24,9 kuukautta EFS-tulosten primaarianalyysin ajankohtana ja 47,2 kuukautta OS-tulosten primaarianalyysin ajankohtana. OS-tulosten primaarianalyysi tehtiin tutkimussuunnitelman mukaisena ajankohtana 5 vuoden kuluttua ensimmäisen tutkittavan tutkimukseen ottamisesta. Yescarta-hoidon todettiin parantavan kokonaiselinaikaa tilastollisesti merkitsevästi (ks. taulukko 4). Arvioidut 48 kuukauden kokonaiselossaololuvut olivat 54,6 % Yescarta-haarassa ja 46,0 % normaalin hoitokäytännön mukaista hoitoa saaneiden haarassa. 57 % potilaista sai solupohjaista immuunihoitoa sen jälkeen, kun normaalin hoitokäytännön mukaiseen hoitoon satunnaistamisen jälkeen ei saatu vastetta tai tauti uusiutui.
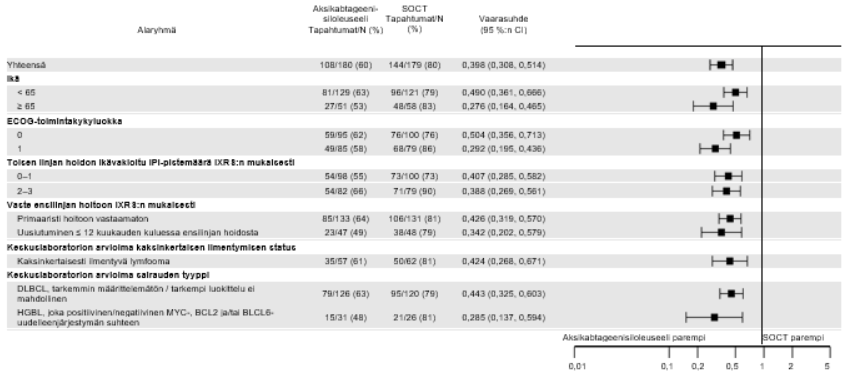
Yescarta-hoidon yhteydessä todettiin yhdenmukaisesti parempi teho yleisesti kaikissa valituissa alaryhmissä, joiden muodostamisperusteisiin kuuluivat vaste ensilinjan hoitoon, toisen linjan hoidon ikävakioitu IPI-pistemäärä, ECOG-toimintakykyluokka, ikä, lymfooman status kaksinkertaisen ilmentymisen suhteen ja korkean maligniteettiasteen B-solulymfooman alatyyppi (ks. kuva 3). Potilailla, joilla oli keskuslaboratorion mukaan korkean maligniteettiasteen B-solulymfooma, Yescarta paransi EFS-tuloksia verrattuna normaalin hoitokäytännön mukaiseen hoitoon (vaarasuhde: 0,285 [95 %:n luottamusväli: 0,137, 0,594]). Yescarta-hoitoa saaneiden potilaiden ORR-osuus oli 81 % (95 %:n luottamusväli: 62,5 %, 92,5 %) ja CR-osuus oli 68 % (95 %:n luottamusväli: 48,6 %, 83,3 %), kun vastaavat osuudet normaalin hoitokäytännön mukaista hoitoa saaneiden haarassa olivat 42 % (95 %:n luottamusväli: 23,4 %, 63,1 %) ja 23 % (95 %:n luottamusväli: 9,0 %, 43,6 %). Kokonaiselinajan vaarasuhde Yescarta-hoitoa saaneiden ja normaalin hoitokäytännön mukaista hoitoa saaneiden potilaiden välillä oli 0,735 (95 %:n luottamusväli: 0,338, 1,600) potilailla, joilla oli keskuslaboratorion mukaan korkean maligniteettiasteen B-solulymfooma.
Taulukko 4. Yhteenveto ZUMA-7-tutkimuksen tehoa koskevista tuloksista
Yescarta N = 180 | Normaalin hoitokäytännön mukainenhoito N = 179 | |
| EFSa | ||
| Tapahtumien lukumäärä (%) | 108 (60) | 144 (80) |
| Mediaani, kuukausia [95 %:n CI]b | 8,3 [4,5, 15,8] | 20 [1,6, 2,8] |
| Ositettu vaarasuhde [95 %:n CI] | 0,398 [0,308, 0,514] | |
| Ositettu log-rank-testin p‑arvoc | < 0,0001 | |
| ORR (%) [95 %:n CI]a | 83 [77,1, 88,5] | 50 [42,7, 57,8] |
| Kerroinsuhde [95 %:n CI] | 5,31 [3,08, 8,90] | |
| Ositettu CMH-testin p‑arvoc | < 0,0001 | |
| Täydellinen vaste (%) | 65 [57,6, 71,9] | 32 [25,6, 39,8] |
| Osittainen vaste (%) | 18 [13,0, 24,8] | 18 [12,6, 24,3] |
| OSd | ||
| Tapahtumien lukumäärä (%) | 82 (46) | 95 (53) |
| OS-mediaani, kuukautta (95 %:n CI)b | NR (28,6, NE) | 31,1 (17,1, NE) |
| Ositettu vaarasuhde (95 %:n CI) | 0,726 (0,540, 0,977) | |
| Ositettu log-rank-testin p-arvoc,e | 0,0335 | |
CI, luottamusväli; CMH, Cochran–Mantel–Haenszel; EFS, tapahtumavapaa elossaoloaika; NE, ei arvioitavissa; NR, ei saavutettu; ORR, objektiivisen hoitovasteen saavuttavien potilaiden osuus; OS, kokonaiselinaika.
a. EFS-tulosten primaarianalyysin ajankohtana tehdyn keskitetyn arvioinnin mukaan
b. Kaplan–Meier-menetelmä
c. p-arvot ovat kaksisuuntaisia. Ositettu log-rank-testi tai ositettu CMH, joka on korjattu ensilinjan hoitoon saadun vasteen suhteen (primaaristi hoitoon vastaamaton vs. uusiutuminen ≤ 6 kuukauden kuluessa ensilinjan hoidosta vs. uusiutuminen > 6 ja ≤ 12 kuukauden kuluessa ensilinjan hoidosta) ja toisen linjan ikäkorjatun IPI-pistemäärän (International Prognostic Index) suhteen (0–1 vs. 2–3)
d. OS-tulosten primaarianalyysin ajankohtana (viiden vuoden kuluttua ensimmäisen tutkittavan tutkimukseen ottamisesta) tehdyn arvioinnin mukaan
e. p-arvoa on verrattu arvoon 0,0482, joka on kaksisuuntainen tehon raja (merkitsevyystaso) OS-tulosten primaarianalyysille
Kuva 1. Kaplan–Meier-kuvaaja tapahtumavapaasta elossaolosta ZUMA-7-tutkimuksessa
Axi-Cel, aksikabtageenisiloleuseeli; CI, luottamusväli; SOCT, normaalin hoitokäytännön mukainen hoito.
Kuva 2. Kaplan–Meier-kuvaaja kokonaiselinajasta ZUMA-7-tutkimuksessa
Axi-Cel, aksikabtageenisiloleuseeli; CI, luottamusväli; NE, ei arvioitavissa; SOCT, normaalin hoitokäytännön mukainen hoito.
Huomautus: Tutkittavat, jotka eivät saaneet vastetta normaalin hoitokäytännön mukaiseen hoitoon, saattoivat saada tutkimussuunnitelman vaatimuksiin kuulumatonta myöhempää lymfooman hoitoa, johon kuului anti-CD19-CAR-T-soluhoito.
Kuva 3. ZUMA-7-tutkimuksen valittujen alaryhmien tapahtumavapaan elossaolon metsikkökuvio
CI, luottamusväli; IXRS, interaktiivinen ääni-/verkkopohjainen vastausjärjestelmä; SOCT, normaalin hoitokäytännön mukainen hoito.
Huomautus: EFS-tulosten primaarianalyysin ajankohtana keskuslaboratorio vahvisti tautityypin 303 potilaalla 359:stä. Muut potilaat keskuslaboratorio luokitteli seuraavasti: ”ei vahvistettu”, ”puuttuu” tai ”muu”.
Yescarta-hoidolla saavutettava hyöty kokonaiselinajan suhteen on yhdenmukainen kaikissa kliinisesti oleellisissa alaryhmissä.
Uusiutunut tai hoitoon reagoimaton follikulaarinen lymfooma kolmen tai useamman systeemistä hoitoa sisältäneen hoitolinjan jälkeen (ZUMA-5-tutkimus)
Yescarta-valmisteen tehoa ja turvallisuutta follikulaarista lymfoomaa sairastavilla aikuisilla potilailla tutkittiin vaiheen 2 yksihaaraisessa avoimessa monikeskustutkimuksessa potilailla, joilla oli uusiutunut tai hoitoon reagoimaton follikulaarinen lymfooma WHO:n vuoden 2016 luokituksen perusteella.
Tutkimukseen soveltuvat potilaat olivat vähintään 18-vuotiaita ja heillä oli hoitoon reagoimaton tauti vähintään kahden aikaisemman hoitolinjan jälkeen. Aikaisempaan hoitoon oli täytynyt kuulua monoklonaalinen CD20-vasta-aine yhdessä alkyloivan aineen kanssa (pelkkää CD20-vasta-ainehoitoa ei otettu huomioon soveltuvuuteen riittäviä hoitolinjoja laskettaessa). Potilaat, joilla oli vakaa tauti (SD) ilman relapsia > 1 vuoden kuluttua viimeisimmän hoidon päättymisestä, eivät soveltuneet tutkimukseen. Potilaat, joilla oli keskushermoston lymfooma tai jotka olivat aiemmin saaneet allogeenisen kantasolusiirron tai anti-CD19-CAR-hoitoa tai muuta muuntogeenisiin T-soluihin perustuvaa hoitoa, suljettiin pois tutkimuksesta. Tutkimukseen eivät soveltuneet potilaat, joilla oli ollut aiemmin keskushermostoon liittyviä häiriöitä (kuten kouristuskohtauksia tai serebrovaskulaarinen iskemia) tai joiden vasemman kammion ejektiofraktio oli alle 50 % tai joiden happisaturaatio huoneilmassa oli alle 92 % tai joilla oli systeemistä immunosuppressiota edellyttävä autoimmuunisairaus. Tutkimuksesta suljettiin pois potilaat, joilla oli aktiivinen tai vakava infektio ja potilaat, joilla oli maligniteettiasteen 3b follikulaarinen lymfooma. Seurannan todellinen mediaanikesto oli 25,9 kuukautta (vaihteluväli 0,3–44,3 kuukautta, jatkuu edelleen). Yhteenveto potilaiden demografisista tiedoista on esitetty taulukossa 5.
Primaarianalyysin ajankohtana tutkimukseen oli otettu yhteensä 122 FL-potilasta (joille leukafereesi oli tehty), mukaan lukien 75 potilasta, jotka olivat saaneet vähintään kolme aikaisempaa hoitolinjaa. Primaarianalyysin tiedonkeruun katkaisupäivän ja 24 kuukauden seurannan tiedonkeruun katkaisupäivän välisenä aikana uusia follikulaarista lymfoomaa sairastavia potilaita ei otettu tutkimukseen eikä hoidettu Yescarta-valmisteella.
Taulukko 5: Yhteenveto ZUMA-5-tutkimuksen follikulaarista lymfoomaa sairastavien potilaiden demografisista tiedoista (24 kuukauden analyysi)
| Luokka | Kaikki potilaat, joille oli tehty leukafereesi (N = 122) | Kaikki potilaat, joille oli tehty leukafereesi ja joille oli annettu vähintään 3 hoitolinjaa (N = 75*) |
| Ikä (vuotta) | ||
| Mediaani (minimi, maksimi) | 60 (34, 79) | 60 (34, 79) |
| ≥ 65 | 30 % | 31 % |
| Miessukupuoli | 60 % | 63 % |
| Rotu | ||
| Valkoihoinen | 93 % | 93 % |
| Aasialainen | 2 % | 4 % |
| Mustaihoinen | 2 % | 1 % |
| ECOG-toimintakykyluokka | ||
| 0 | 63 % | 59 % |
| 1 | 37 % | 41 % |
| Suuri tuumorimassa GELF-kriteereillä arvioituna | 52 % | 57 % |
| Aikaisempien hoitojen mediaanimäärä (minimi, maksimi) | 3 (1, 10) | 4 (3, 10) |
| Potilaat, joilla oli hoitoon reagoimaton tauti ja jotka olivat saaneet ≥ 2 aikaisempaa hoitolinjaa | 30 % | 24 % |
| Potilaat, joilla taudin levinneisyysaste oli III/IV | 86 % | 86 % |
| Potilaat, joille oli aiemmin tehty autologinen kantasolusiirto | 25 % | 29 % |
| Aikaisempi hoito PI3K-estäjällä | 26 % | 40 % |
| Aika ensimmäisestä CD20-vasta-aineen ja kemoterapian yhdistelmähoidosta relapsiin < 24 kuukautta | 54 % | 51 % |
ECOG, Eastern Cooperative Oncology Group; GELF, Groupe d’Etude des Lymphomes Folliculaires.
* Kaikki potilaat, joilla oli paikallisesti vahvistettu diagnoosi, mukaan lukien 60 potilasta, joilla oli keskitetysti vahvistettu diagnoosi. Niiden potilaiden määrät, joille oli tehty leukafereesi (n = 75) ja jotka oli hoidettu (n = 73).
Yescarta annettiin laskimoon kertainfuusiona tavoiteannoksena 2 × 106 anti-CD19-CAR-T-solua/kg lymfosyyttejä vähentävän kemoterapian jälkeen. Lymfosyyttejä vähentävän kemoterapian muodostivat 500 mg/m2 syklofosfamidia laskimoon ja 30 mg/m2 fludarabiinia laskimoon, ja molemmat näistä annettiin 5., 4. ja 3. päivänä ennen Yescarta-hoitoa. Kaikki potilaat olivat sairaalassa tarkkailua varten vähintään 7 päivää Yescarta-infuusion jälkeen. Yescarta-hoidon anto ja seuranta olivat samanlaiset ZUMA-5- ja ZUMA-1-tutkimuksissa.
Primaarianalyysi tehtiin, kun vähintään 80:n peräkkäin mukaan otetun FL-potilaan seuranta oli kestänyt vähintään 12 kuukautta ensimmäisestä vasteen arviosta. Ensisijainen päätetapahtuma oli objektiivisen hoitovasteen saavuttavien potilaiden osuus (ORR). Toissijaiset päätetapahtumat olivat täydellisen hoitovasteen (CR) saavuttaneiden osuus, ORR ja CR potilailla, jotka olivat saaneet vähintään 3 aikaisempaa hoitolinjaa, vasteen kesto (DOR), kokonaiselinaika (OS), etenemättömyysaika (PFS) ja haittatapahtumien ilmaantuvuus. Kolmea niistä 122:sta FL-potilaasta, jotka olivat tutkimuksessa mukana primaarianalyysin aikana, ei hoidettu, pääasiassa tutkimukseen soveltumattomuuden takia tai koska ennen hoitoa joko potilaalla todettiin täydellinen vaste tai potilas kuoli.
24 kuukauden seurannan analyysi tehtiin, kun vähintään 80:tä FL-potilasta oli seurattu vähintään 24 kuukautta infuusion jälkeen.
24 kuukauden seurannan analyysiin mennessä tutkimuksessa ei enää ollut tehty leukafereesiä eikä annettu Yescarta-hoitoa uusille potilaille. Valmistuksessa ei tapahtunut epäonnistumisia. Mediaaniaika leukafereesistä valmisteen antamiseen oli 12 vuorokautta (vaihteluväli: 10–37 vuorokautta), leukafereesistä valmisteen toimitukseen 17 vuorokautta (vaihteluväli: 13–72 vuorokautta) ja leukafereesistä Yescarta-infuusioon 27 vuorokautta (vaihteluväli: 19–330 vuorokautta). Mediaaniannos oli 2,0 × 106 anti-CD19-CAR-T-solua/kg.
Primaarianalyysin tiedonkeruun katkaisupäivän kohdalla tutkimukseen oli otettu 122 FL-potilasta. Niillä 75:llä mukaan otetulla FL-potilaalla, joille oli annettu vähintään kolme aikaisempaa hoitolinjaa, ORR oli 91 % ja CR-vasteiden osuus oli 77 %.
24 kuukauden seurannan analyysissä olivat mukana tutkimukseen otetut 122 FL-potilasta, joista 119:ää hoidettiin Yescarta-valmisteella. Tutkimukseen otetuista 122 potilaasta 75 oli saanut vähintään kolme aikaisempaa hoitolinjaa, ja heillä ORR oli 91 % ja CR-vasteiden osuus 77 %. Mediaaniaika vasteeseen oli 1 kuukausi (vaihteluväli: 0,8–3,1 kuukautta), vasteen keston (DOR) mediaani oli 38,6 kuukautta, ja kuukauden 24 kohdalla vaste oli säilynyt 62 %:lla vasteen saaneista. Niistä 75:stä FL-potilaasta, jotka olivat saaneet vähintään kolme aikaisempaa hoitolinjaa, 29 saavutti aluksi osittaisen vasteen (PR), ja heistä 19 saavutti myöhemmin täydellisen vasteen (CR). Alaryhmäanalyysiin kuului ORR potilailla, joilla oli hoitoon reagoimaton tauti (88 %), FLIPI-pisteet ≥ 3 (94 %), suuri kasvaintaakka (91 %), taudin etenemistä 24 kuukauden kuluessa ensimmäisestä immunoterapiasta (89 %) ja taustalla aikaisempi hoito PI3K-estäjällä (90 %). Taulukossa 6 on yhteenveto tärkeimmistä tehoa koskevista tuloksista FL-potilailla, joille oli annettu vähintään 3 aikaisempaa hoitolinjaa.
Taulukko 6. Yhteenveto tehoa koskevista tuloksista kaikilla ZUMA-5-tutkimukseen otetuilla FL-potilailla, joille oli annettu vähintään 3 aikaisempaa hoitolinjaa (24 kuukauden analyysi)
| Luokka | Kaikki potilaat, joille oli tehty leukafereesi (ITT) N = 75* |
ORRa, (%) [95 %:n luottamusväli] | 91 % (82, 96) |
| CR, (%) | 77 % |
| PR, (%) | 13 % |
Vasteen kestob, mediaani kuukausina [95 %:n luottamusväli] (vaihteluväli) | 38,6 (24,7, ei arvioitavissa) (0,0, 38,6) |
| Jatkuva vaste (n) | 42 |
Jatkuvien vasteiden osuusb, % [95 %:n luottamusväli] 12 kuukautta 18 kuukautta 24 kuukautta | 79,5 (67,2, 87,6) 75,5 (62,5, 84,6) 67,6 (52,7, 78,7) |
ORR, objektiivinen vaste; CR, täydellinen vaste; ITT, hoitoaie; PR, osittainen vaste
a. International Working Group Lugano Classification (Cheson 2014) -luokituksen mukaan, riippumattoman radiologian arviointikomitean arvioimana
b. Mitattu ensimmäisen objektiivisen vasteen päivämäärästä taudin etenemisen tai kuoleman päivämäärään
* Kaikki potilaat, joilla oli paikallisesti vahvistettu diagnoosi, mukaan lukien 60 potilasta, joilla oli keskitetysti vahvistettu diagnoosi. Niiden potilaiden määrät, joille oli tehty leukafereesi (n = 75) ja jotka oli hoidettu (n = 73).
Kuva 4.Kaplan–Meier-kuvaaja vasteen kestosta kaikilla potilailla, joille tehtiin leukafereesi; potilaat, joilla oli objektiivinen hoitovaste (FL-potilaat, joille oli annettu vähintään 3 aikaisempaa hoitolinjaa, 24 kuukauden analyysi, riippumaton arviointiryhmä)
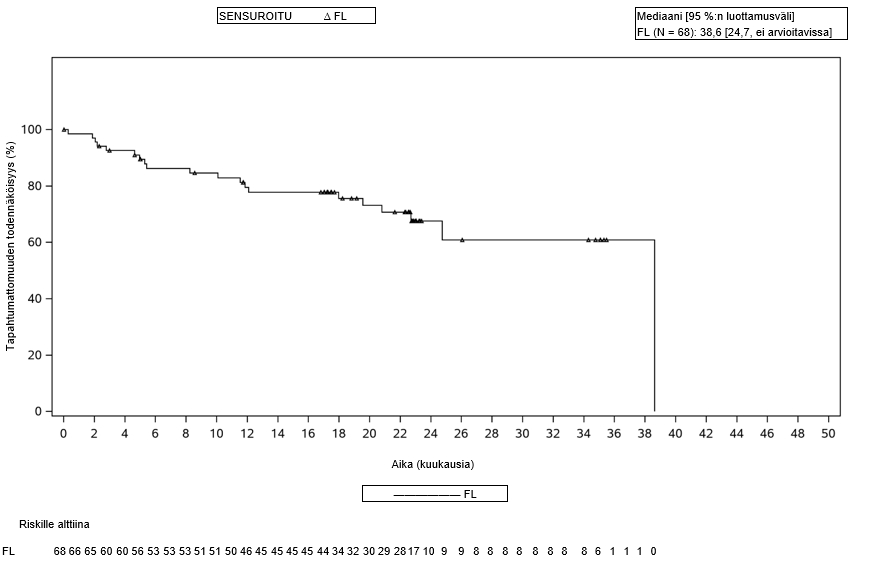
Pediatriset potilaat
Euroopan lääkevirasto on myöntänyt vapautuksen velvoitteesta toimittaa tutkimustulokset Yescarta-valmisteen käytöstä kypsien B-solukasvainten hoidossa kaikissa pediatrisissa potilasryhmissä (ks. kohdasta Annostus ja antotapa ohjeet käytöstä pediatristen potilaiden hoidossa).
Farmakokinetiikka
Yescarta-valmiste koostuu ihmisen autologisista T-soluista. Odotettavissa olevat aineenvaihduntatuotteet ovat normaaleilla mekanismeilla syntyviä tyypillisiä solujen hajoamistuotteita. Näin ollen infuusiona annettujen CAR-T-solujen odotetaan poistuvan ajan myötä.
Solukinetiikka
Yescarta-infuusion jälkeen anti-CD19-CAR-T-solut monistuivat aluksi nopeasti, minkä jälkeen niiden määrä aleni lähelle lähtötasoa 3 kuukaudessa. Anti-CD19-CAR-T-solujen huippupitoisuudet esiintyivät ensimmäisten 7−14 vuorokauden kuluessa Yescarta-infuusion jälkeen. Iällä (vaihteluväli: 21–80 vuotta) ja sukupuolella ei ollut merkittävää vaikutusta Yescarta-valmisteen AUC-arvoihin ja huippupitoisuuksiin.
ZUMA‑1-tutkimuksen potilailla anti-CD19-CAR-T-solujen huippupitoisuuden mediaani veressä oli 38,3 solua/µl (vaihteluväli: 0,8 − 1 513,7 solua/μl). Yhden (1) kuukauden kuluttua pitoisuuden mediaani oli laskenut tasolle 2,1 solua/µl (vaihteluväli: 0−167,4 solua/μl) ja kolmen (3) kuukauden kuluttua tasolle 0,4 solua/µl (vaihteluväli: 0−28,4 solua/μl) Yescarta-infuusion jälkeen. ZUMA‑7-tutkimuksen potilailla anti-CD19-CAR-T-solujen huippupitoisuuden mediaani veressä oli 25,84 solua/μl (vaihteluväli: 0,04 − 1 173,25 solua/μl), ja solujen määrä pieneni arvioitavissa olevilla potilailla lähes lähtötasolle 3 kuukaudessa (0,35 solua/μl; vaihteluväli: 0,00−28,44 solua/μl), mutta soluja oli edelleen havaittavissa 12 potilaalla 30:stä arvioitavissa olevasta potilaasta 24 kuukautta hoidon jälkeen.
ZUMA‑5-tutkimuksen potilailla, joilla oli follikulaarinen lymfooma, anti-CD19-CAR-T-solujen huippupitoisuuden mediaani veressä oli 37,6 solua/µl (vaihteluväli: 0,5 –1 415,4 solua/μl). Mediaaniaika anti-CD19-CAR-T-solujen huippupitoisuuteen veressä oli 8 vuorokautta infuusion jälkeen (vaihteluväli: 8–371 vuorokautta). Anti-CD19-CAR-T-solujen pitoisuudet laskivat kuukauteen 3 mennessä lähelle taustapitoisuuksia siten, että mediaani oli 0,3 solua/µl (vaihteluväli: 0–15,8 solua/μl).
ZUMA‑1-tutkimuksen potilailla anti-CD19-CAR-T-solujen lukumäärä veressä korreloi objektiiviseen hoitovasteeseen (täydellinen tai osittainen vaste). Anti-CD19-CAR-T-solujen huippupitoisuuden mediaani oli vasteen saaneilla (N = 71) 216 % suurempi verrattuna vastaavaan pitoisuuden mediaaniin potilailla, jotka eivät saaneet vastetta (N = 25) (43,6 solua/μl vs. 20,2 solua/μl). AUC0–28-arvon mediaani oli vasteen saaneilla potilailla (N = 71) 253 % vastaavasta tasosta potilailla, jotka eivät saaneet vastetta (N = 25) (562 vrk × solua/μl vs. 222 vrk × solua/μl).
ZUMA‑7-tutkimuksen potilailla anti-CD19-CAR-T‑solujen lukumäärä veressä korreloi objektiiviseen hoitovasteeseen (täydellinen tai osittainen vaste). Anti-CD19-CAR-T‑solujen huippupitoisuuden mediaani oli vasteen saaneilla (n = 142) noin 275 % suurempi verrattuna vastaavaan pitoisuuden mediaaniin potilailla, jotka eivät saaneet vastetta (n = 20) (28,9 solua/μl vs. 10,5 solua/μl). AUC0–28-arvon mediaani oli vasteen saaneilla potilailla (n = 142) noin 417 % suurempi verrattuna vastaavaan tasoon potilailla, jotka eivät saaneet vastetta (n = 20) (292,9 vrk × solua/μl vs. 70,1 vrk × solua/μl).
ZUMA‑5-tutkimuksen potilailla, joilla oli follikulaarinen lymfooma, anti-CD19-CAR-T-solujen lukumäärän huippupitoisuuksien mediaani vasteen saaneilla (n = 112) oli 38,0 solua/μl ja niillä, jotka eivät saaneet vastetta (n = 5), 31,3 solua/μl. AUC0–28-arvon mediaani oli 454,8 solua/μl • vrk vasteen saaneilla ja 247,1 solua/μl • vrk niillä, jotka eivät saaneet vastetta.
Tutkimuksia Yescarta-valmisteen käytöstä potilaille, joilla on maksan tai munuaisten vajaatoiminta, ei ole tehty.
Prekliiniset tiedot turvallisuudesta
Yescarta-valmiste koostuu geneettisesti muunnelluista ihmisen T-soluista, eikä siksi ole olemassa edustavia määrityksiä in vitro tai malleja ex vivo tai in vivo, jotka voisivat täsmällisesti kuvata tämän ihmisperäisen valmisteen toksikologisia piirteitä. Siksi ei ole tehty konventionaalisia lääkekehityksessä käytettäviä toksisuutta koskevia tutkimuksia.
Yescarta-valmisteella ei ole tehty karsinogeenisuutta tai genotoksisuutta koskevia tutkimuksia.
Yescarta-valmisteella ei ole tehty tutkimuksia, joilla arvioitaisiin sen vaikutuksia hedelmällisyyteen, lisääntymiseen ja kehitykseen.
Farmaseuttiset tiedot
Apuaineet
Cryostor CS10 (sisältää DMSO:ta)
Natriumkloridi
Ihmisen albumiini
Yhteensopimattomuudet
Koska yhteensopivuustutkimuksia ei ole tehty, tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
1 vuosi
Yescarta-valmiste säilyy sulatuksen päätyttyä enintään 3 tuntia huoneenlämpötilassa (20–25 °C). Yescarta-infuusio on kuitenkin aloitettava 30 minuutin kuluessa sulatuksen päättymisestä, eikä kokonaisinfuusioaika saa ylittää 30 minuuttia.
Säilytys
Yescarta-valmistetta on säilytettävä nestetypen höyryfaasissa (≤ 150 °C), ja valmisteen on pysyttävä jäätyneenä, kunnes potilas on valmis hoitoon. Näin varmistetaan, että potilaalle on käytettävissä elinkykyisiä eläviä autologisia soluja.
Yescarta-valmistetta voidaan yhden kerran säilyttää ‑80 °C:ssa (± 10 °C) enintään 90 päivän ajan. Jos valmistetta on säilytetty ‑80 °C:ssa (± 10 °C), se on käytettävä joko kyseisen 90 päivän jakson päättymiseen tai pakkaukseen merkittyyn viimeiseen käyttöpäivämäärään mennessä sen mukaan, kumpi näistä toteutuu ensin. Näiden ajankohtien jälkeen valmistetta ei saa enää käyttää, vaan se on hävitettävä.
Sulanutta lääkevalmistetta ei saa pakastaa uudelleen.
Sulatetun lääkevalmisteen säilytys, ks. kohta Kestoaika.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
YESCARTA infuusioneste, dispersio
0,4 - 2 x 100 000 000 solua (L:ei) 1 kpl (68 ml) (371325,60 €)
PF-selosteen tieto
Etyleeni-vinyyliasetaattikryosäilytyspussi, jossa on sulkimella varustettu lisäysletku ja kaksi käytettävissä olevaa läpäistävää porttia. Pussi sisältää noin 68 ml soludispersiota.
Yksi kryosäilytyspussi on yksittäispakattu kuljetuskoteloon.
Valmisteen kuvaus:
Kirkas tai läpinäkymätön, valkoinen tai punainen dispersio.
Käyttö- ja käsittelyohjeet
Säteilytys saattaa inaktivoida valmisteen.
Ennen lääkevalmisteen käsittelyä tai antamista tehtävät varotoimet
Yescarta on kuljetettava hoitopaikan sisällä suljetuissa, hajoamattomissa ja vuotamattomissa pakkauksissa.
Tämä lääkevalmiste sisältää ihmisen verisoluja. Yescarta-valmistetta käsittelevien terveydenhuollon ammattilaisten on noudatettava asianmukaisia varotoimia (käytettävä käsineitä ja silmiensuojaimia), jotta vältetään infektiotautien mahdollinen tarttuminen.
Valmistelu ennen antamista
- Varmista, että potilaan henkilöllisyys (tunniste) vastaa Yescarta-metallikotelon potilastunnisteita.
- Yescarta-infuusiopussia ei saa poistaa metallikotelosta, jos potilaskohtaisen etiketin tiedot eivät vastaa sen potilaan tietoja, jolle hoito on tarkoitus antaa.
- Kun potilaan tunniste on vahvistettu, poista Yescarta-infuusiopussi metallikotelosta.
- Tarkista, että metallikotelon etiketin potilastiedot vastaavat infuusiopussin etiketin tietoja.
- Tarkasta ennen valmisteen sulattamista, ettei infuusiopussi ole rikkoutunut. Jos infuusiopussi ei ole ehjä, noudata ihmisperäistä materiaalia sisältävän jätteen käsittelyä koskevia paikallisia ohjeita (tai ota välittömästi yhteyttä Kiteen).
Sulatus
- Pakkaa infuusiopussi toisen pussin sisään.
- Sulata Yescarta-valmistetta noin 37 °C:ssa joko vesihauteessa tai kuivasulatusmenetelmällä, kunnes infuusiopussissa ei näy enää jäätä. Sekoita infuusiopussin sisältöä varovasti paakkuuntuneen soluaineksen hajottamiseksi. Jos näkyviä solupaakkuja on jäljellä, jatka infuusiopussin sisällön varovaista sekoittamista. Pienten soluainespaakkujen pitäisi hajota varovaisella manuaalisella sekoituksella. Yescarta-valmistetta ei saa pestä, sentrifugoida eikä suspendoida uudelleen uuteen väliaineeseen ennen infuusiota. Sulattaminen kestää noin 3−5 minuuttia.
-
Sulattamisen jälkeen Yescarta-valmiste säilyy huoneenlämmössä (20−25 °C) enintään 3 tuntia.
Yescarta-infuusio on kuitenkin aloitettava 30 minuutin kuluessa siitä, kun valmiste on täysin sulanut.
Antaminen
- Valkosoluja poistavaa suodatinta ei saa käyttää.
- Tosilitsumabin ja ensihoitovälineistön on oltava käytettävissä ennen infusointia ja seurantajakson aikana. Poikkeustapauksessa, jossa tosilitsumabia ei ole saatavilla Euroopan lääkeviraston saatavuushäiriöluettelossa mainitun saatavuushäiriön takia, ennen infusointia on oltava käytettävissä sopivia vaihtoehtoisia keinoja sytokiinioireyhtymän hoitoon tosilitsumabin sijaan.
- Yescarta on tarkoitettu vain autologiseen käyttöön.
- Potilaan henkilöllisyyden on vastattava Yescarta-infuusiopussissa olevia potilastunnisteita.
- Yescarta-valmisteen antamiseen suositellaan keskuslaskimoyhteyttä.
- Infuusioletku on täytettävä steriilillä natriumkloridi-injektioliuoksella (9 mg/ml, 0,9 %, 0,154 mmol natriumia millilitrassa) ennen infuusiota.
- Yescarta-infuusiopussin koko sisältö on annettava infuusiona 30 minuutin kuluessa joko painovoiman avulla tai peristalttisella pumpulla.
- Sekoittele infuusiopussia varovasti Yescarta-infuusion aikana solujen paakkuuntumisen estämiseksi.
- Kun infuusiopussin koko sisältö on infusoitu, infuusiopussi ja letku on huuhdeltava samalla infuusionopeudella 10–30 ml:lla natriumkloridi-injektioliuosta (9 mg/ml, 0,9 %) (jälkihuuhtelu), jotta varmistetaan, että potilas on saanut Yescarta-pussin koko sisällön.
Toimenpiteet vahinkoaltistumisen tapahtuessa
Vahinkoaltistumisen tapahduttua on noudatettava ihmisperäisen materiaalin käsittelyä koskevia paikallisia ohjeita. Työtasot ja materiaalit, jotka ovat mahdollisesti joutuneet kosketuksiin Yescarta-valmisteen kanssa, on dekontaminoitava asianmukaisella desinfiointiaineella.
Lääkevalmisteen hävittämiseen liittyvät varotoimet
Käyttämätön lääkevalmiste ja kaikki materiaalit, jotka ovat olleet kosketuksissa Yescarta-valmisteen kanssa (kiinteä ja nestemäinen jäte), on käsiteltävä ja hävitettävä mahdollisesti tartuntavaarallisena jätteenä ihmisperäistä materiaalia sisältävän jätteen käsittelyä koskevien paikallisten ohjeiden mukaisesti.
Korvattavuus
YESCARTA infuusioneste, dispersio
0,4 - 2 x 100 000 000 solua 1 kpl
- Ei korvausta.
ATC-koodi
L01XL03
Valmisteyhteenvedon muuttamispäivämäärä
13.11.2025
Yhteystiedot
Karhumäentie 3
01530 Vantaa
Suomi
09 42726918
www.gilead.se/utility/contact
nordics.medinfo@gilead.com
