XOLAIR injektioneste, liuos, esitäytetty kynä 300 mg, injektioneste, liuos, esitäytetty ruisku 150 mg
Vaikuttavat aineet ja niiden määrät
Xolair 150 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 150 mg omalitsumabia* 1 ml:ssa liuosta (omalizumab).
Xolair 300 mg injektioneste, liuos, esitäytetty ruisku
Yksi esitäytetty ruisku sisältää 300 mg omalitsumabia* 2 ml:ssa liuosta (omalizumab).
Xolair 150 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 150 mg omalitsumabia* 1 ml:ssa liuosta (omalizumab).
Xolair 300 mg injektioneste, liuos, esitäytetty kynä
Yksi esitäytetty kynä sisältää 300 mg omalitsumabia* 2 ml:ssa liuosta (omalizumab).
*Omalitsumabi on humanisoitu monoklonaalinen vasta-aine, joka tuotetaan kiinanhamsterin munasarjan (CHO) nisäkässolulinjassa yhdistelmä-DNA-tekniikalla.
Täydellinen apuaineluettelo, ks. kohta Apuaineet.
Lääkemuoto
Injektioneste, liuos (injektioneste)
Kliiniset tiedot
Käyttöaiheet
Allerginen astma
Xolair on tarkoitettu aikuisten, nuorten ja lasten (6‑12-vuotiaiden) hoitoon.
Xolair-hoitoa tulisi harkita vain potilaille, joilla on todistettavasti IgE (immunoglobuliini E) -välitteinen astma (ks. kohta Annostus ja antotapa).
Aikuiset ja nuoret (12-vuotiaat ja vanhemmat)
Xolair on tarkoitettu lisälääkkeeksi vaikean, jatkuvan allergisen astman oirekontrollin parantamiseksi potilaille, joilla on positiivinen ihotesti tai in vitro ‑reaktiivisuus ympärivuotiselle aeroallergeenille, heikentynyt keuhkojen toiminta (FEV1 <80 %), toistuvia päiväaikaisia oireita tai yöaikaisia heräämisiä, ja joilla on useita dokumentoituja vaikeita astman pahenemisvaiheita päivittäisestä suuriannoksisesta inhaloitavasta kortikosteroidihoidosta ja pitkävaikutteisesta inhaloitavasta beeta2-agonistista huolimatta.
Lapset (6‑12-vuotiaat)
Xolair on tarkoitettu lisälääkkeeksi vaikean, jatkuvan allergisen astman oirekontrollin parantamiseksi potilaille, joilla on positiivinen ihotesti tai in vitro ‑reaktiivisuus ympärivuotiselle aeroallergeenille ja usein esiintyviä päiväaikaisia oireita tai heräilyä öisin ja joilla on useita dokumentoituja vaikeita astman pahenemisvaiheita päivittäisestä suuriannoksisesta inhaloitavasta kortikosteroidihoidosta ja pitkävaikutteisesta inhaloitavasta beeta2-agonistista huolimatta.
Krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Xolair on tarkoitettu lisähoidoksi nenään annettavan kortikosteroidin kanssa vaikeaan krooniseen rinosinuiittiin, johon liittyy nenäpolyyppeja, aikuisille (18-vuotiaille ja sitä vanhemmille), joiden tauti ei ole riittävästi hallinnassa nenään annettavalla kortikosteroidihoidolla.
Krooninen spontaani urtikaria
Xolair on tarkoitettu lisälääkkeeksi kroonisen spontaanin urtikarian hoitoon aikuisille ja nuorille (vähintään 12‑vuotiaille), kun vaste H1-antihistamiinihoidolle ei ole riittävä.
Ehto
Valmisteen käyttöaiheissa mainittujen sairauksien diagnosointiin ja hoitoon perehtyneen lääkärin on aloitettava hoito.
Annostus ja antotapa
Hoidon saa aloittaa vain vaikean ja jatkuvan astman, kroonisen rinosinuiitin, johon liittyy nenäpolyyppeja, tai kroonisen spontaanin urtikarian diagnosointiin ja hoitoon perehtynyt lääkäri.
Annostus
Allerginen astma ja krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Allergisen astman ja kroonisen rinosinuiitin, johon liittyy nenäpolyyppeja, annostukset noudattavat samoja periaatteita. Omalitsumabin sopiva annos ja antoväli näihin sairauksiin määräytyvät ennen hoidon aloittamista mitatun lähtötason IgE-arvon (IU/ml) ja potilaan painon (kg) perusteella. Sopivan annoksen löytämiseksi tulee potilaan IgE-taso mitata millä tahansa kaupallisesti saatavana olevalla seerumin kokonais-IgE-testillä ennen ensimmäisen annoksen antoa. Näiden määritysten perusteella jokaisena antokertana voidaan tarvita 75‒600 mg omalitsumabia 1‒4 injektiona.
Allergista astmaa sairastavien potilaiden, joiden lähtötason IgE-arvo on alle 76 IU/ml, todennäköisyys saada hoidosta hyötyä oli pienempi (ks. kohta Farmakodynamiikka). Jos aikuisen tai nuoren potilaan IgE on alle 76 IU/ml ja lapsen (6‒12-vuotiaan) IgE alle 200 IU/ml, lääkettä määräävän lääkärin tulee varmistaa ennen hoidon aloittamista, että potilaalla on in vitro ‑reaktiviteetti (RAST-testi) jollekin ympärivuotiselle allergeenille.
Muuntotaulukko, ks. taulukko 1. Annoksen määrittäminen aikuisille, ks. taulukot 2 ja 3.
Omalitsumabia ei tule antaa potilaille, joiden lähtötason IgE-arvo tai paino ovat annostaulukossa annettujen arvojen ulkopuolella.
Suurin suositeltu annos on 600 mg omalitsumabia joka toinen viikko.
Taulukko 1 Annoksen muuntaminen esitäytettyjen ruiskujen/kynien* lukumääräksi, injektioiden lukumääräksi** ja injektioiden kokonaistilavuudeksi yhtä antokertaa kohti
Annos (mg) | Ruiskujen/kynien lukumäärä* | Injektioiden lukumäärä | Injektioiden kokonaistilavuus (ml) | ||
75 mg | 150 mg | 300 mg* | |||
75 | 1 | 0 | 0 | 1 | 0,5 |
150 | 0 | 1 | 0 | 1 | 1,0 |
225 | 1 | 1 | 0 | 2 | 1,5 |
300 | 0 | 0 | 1 | 1 | 2,0 |
375 | 1 | 0 | 1 | 2 | 2,5 |
450 | 0 | 1 | 1 | 2 | 3,0 |
525 | 1 | 1 | 1 | 3 | 3,5 |
600 | 0 | 0 | 2 | 2 | 4,0 |
*Xolair esitäytettyä ruiskua (300 mg) ja Xolair esitäytettyä kynää (kaikki vahvuudet) ei ole tarkoitettu käytettäväksi alle 12‑vuotiaille potilaille.
**Tässä taulukossa kerrotaan potilaalle annettavien injektioiden vähimmäismäärät, mutta halutun annoksen saavuttamiseksi voidaan sekä ruiskun että kynän osalta käyttää muitakin annosteluyhdistelmiä.
Taulukko 2 LÄÄKKEEN ANTO 4 VIIKON VÄLEIN. Ihonalaisena injektiona 4 viikon välein annettavat omalitsumabiannokset (milligrammoina yhtä annosta kohti)
Potilaan paino (kg) | ||||||||||
IgE-lähtö-arvo (IU/ml) | ≥20‒ 25* | >25‒ 30* | >30‒ 40 | >40‒ 50 | >50‒ 60 | >60‒ 70 | >70‒ 80 | >80‒ 90 | >90‒ 125 | >125‒150 |
≥30‒100 | 75 | 75 | 75 | 150 | 150 | 150 | 150 | 150 | 300 | 300 |
>100-200 | 150 | 150 | 150 | 300 | 300 | 300 | 300 | 300 | 450 | 600 |
>200-300 | 150 | 150 | 225 | 300 | 300 | 450 | 450 | 450 | 600 | |
>300-400 | 225 | 225 | 300 | 450 | 450 | 450 | 600 | 600 | ||
>400-500 | 225 | 300 | 450 | 450 | 600 | 600 | ||||
>500-600 | 300 | 300 | 450 | 600 | 600 | |||||
>600-700 | 300 | 450 | 600 | |||||||
>700-800 | ||||||||||
>800-900 | LÄÄKKEEN ANTO 2 VIIKON VÄLEIN KS. TAULUKKO 3 | |||||||||
>900-1 000 | ||||||||||
>1 000-1 100 | ||||||||||
*Kroonista rinosinuiittia, johon liittyy nenäpolyyppeja, koskevissa päätutkimuksissa ei tutkittu potilaita, joiden paino oli alle 30 kg.
Taulukko 3 LÄÄKKEEN ANTO 2 VIIKON VÄLEIN. Ihonalaisena injektiona 2 viikon välein annettavat omalitsumabiannokset (milligrammoina yhtä annosta kohti)
Potilaan paino (kg) | ||||||||||
IgE-lähtö-arvo (IU/ml) | ≥20‒ 25* | >25‒ 30* | >30‒ 40 | >40‒ 50 | >50‒ 60 | >60‒ 70 | >70‒ 80 | >80‒ 90 | >90‒ 125 | >125‒150 |
≥30‒100 | LÄÄKKEEN ANTO 4 VIIKON VÄLEIN KS. TAULUKKO 2 | |||||||||
>100-200 | ||||||||||
>200-300 | 375 | |||||||||
>300-400 | 450 | 525 | ||||||||
>400-500 | 375 | 375 | 525 | 600 | ||||||
>500-600 | 375 | 450 | 450 | 600 | ||||||
>600-700 | 225 | 375 | 450 | 450 | 525 | |||||
>700-800 | 225 | 225 | 300 | 375 | 450 | 450 | 525 | 600 | ||
>800-900 | 225 | 225 | 300 | 375 | 450 | 525 | 600 | |||
>900-1 000 | 225 | 300 | 375 | 450 | 525 | 600 | ||||
>1 000-1 100 | 225 | 300 | 375 | 450 | 600 | |||||
>1 100-1 200 | 300 | 300 | 450 | 525 | 600 | Tiedot eivät riitä annossuositusten antamiseen | ||||
>1 200-1 300 | 300 | 375 | 450 | 525 | ||||||
>1 300-1 500 | 300 | 375 | 525 | 600 | ||||||
*Kroonista rinosinuiittia, johon liittyy nenäpolyyppeja, koskevissa päätutkimuksissa ei tutkittu potilaita, joiden paino oli alle 30 kg.
Hoidon kesto, seuranta ja annoksen muuttaminen
Allerginen astma
Xolair on tarkoitettu pitkäaikaishoitoon. Kliiniset tutkimukset ovat osoittaneet, että hoidon tehon ilmenemiseen kuluu vähintään 12‒16 viikkoa. Kun Xolair-hoitoa on jatkettu 16 viikkoa, lääkärin tulee arvioida hoidon tehokkuus ennen lisäinjektioiden antamista. Kun 16 viikkoa on kulunut, tai milloin tahansa myöhemmässä vaiheessa hoitoa, tulee hoidon jatkamispäätöksen perustua siihen, onko potilaan astma pysynyt huomattavasti paremmin hallinnassa vai ei (ks. kohta Farmakodynamiikka; lääkärin yleisarvio hoidon tehokkuudesta).
Krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Kroonista rinosinuiittia, johon liittyy nenäpolyyppeja, koskevissa kliinisissä tutkimuksissa havaittiin muutoksia nenäpolyyppipisteytyksessä (nasal polyps score, NPS) ja nenän tukkoisuuspisteytyksessä (nasal congestion score, NCS) neljässä viikossa. Jatkohoidon tarve täytyy uudelleenarvioida säännöllisesti potilaan taudin vakavuuden ja oireiden hallinnassa pysymisen perusteella.
Allerginen astma ja krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Hoidon lopettaminen johtaa yleensä vapaana olevan IgE:n määrän suurenemiseen ja siihen liittyviin oireisiin. Kokonais-IgE-taso nousee hoidon aikana ja pysyy koholla jopa vuoden ajan hoidon lopettamisen jälkeen. Siksi IgE-tason uudelleenmäärityksiä ei voida käyttää apuna annoksen määrittämisessä hoidon aikana. Jos hoito aloitetaan uudelleen alle 1 vuoden tauon jälkeen, annos tulee määrittää ennen ensimmäistä hoitokertaa määritetyn seerumin IgE-arvon perusteella. Jos hoito aloitetaan uudelleen vuoden tai pidemmän tauon jälkeen, annos voidaan määrittää seerumin kokonais-IgE-arvon uusintamäärityksen perusteella.
Annosta tulee sovittaa, jos potilaan painossa tapahtuu merkitseviä muutoksia (ks. taulukot 2 ja 3).
Krooninen spontaani urtikaria
Suositeltu annos on 300 mg injektiona ihon alle neljän viikon välein. Jokainen 300 mg annos annetaan yhtenä 300 mg injektiona ihon alle tai kahtena 150 mg injektiona ihon alle.
Lääkärin on arvioitava säännöllisesti hoidon jatkamisen tarve.
Kliinisistä tutkimuksista saatua kokemusta pitkäaikaishoidosta tässä käyttöaiheessa on kuvattu kohdassa Farmakodynamiikka.
Erityispotilasryhmät
Iäkkäät potilaat (65-vuotiaat tai vanhemmat)
Omalitsumabin käytöstä yli 65-vuotiaiden potilaiden hoitoon on niukasti tietoa, mutta ei ole näyttöä siitä, että iäkkäät potilaat tarvitsisivat eri annoksen kuin nuoremmat aikuispotilaat.
Munuaisten tai maksan vajaatoimintaa sairastavat
Munuaisten tai maksan vajaatoiminnan vaikutusta omalitsumabin farmakokinetiikkaan ei ole tutkittu. Koska kliinisinä annoksina annetun omalitsumabin puhdistumaa säätelee pääasiassa retikuloendoteliaalinen järjestelmä (RES), munuaisten tai maksan vajaatoiminta eivät todennäköisesti muuta sitä. Vaikka erityisiä suosituksia annoksen muuttamisesta ei ole annettu, tulee omalitsumabia antaa varoen tälle potilasryhmälle (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Pediatriset potilaat
Omalitsumabin turvallisuutta ja tehoa alle 6 vuoden ikäisten potilaiden allergisen astman hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Omalitsumabin turvallisuutta ja tehoa alle 18 vuoden ikäisten potilaiden kroonisen rinosinuiitin, johon liittyy nenäpolyyppeja, hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Omalitsumabin turvallisuutta ja tehoa alle 12 vuoden ikäisten potilaiden kroonisen spontaanin urtikarian hoidossa ei ole varmistettu. Tietoja ei ole saatavilla.
Antotapa
Vain ihon alle tapahtuvaan antoon. Omalitsumabia ei saa antaa laskimoon eikä lihakseen.
Xolair esitäytettyä ruiskua (300 mg) ja Xolair esitäytettyä kynää (kaikki vahvuudet) ei ole tarkoitettu käytettäväksi alle 12‑vuotiaille lapsille. Xolair 75 mg esitäytettyä ruiskua ja Xolair 150 mg esitäytettyä ruiskua voidaan käyttää allergista astmaa sairastaville 6–11‑vuotiaille lapsille.
Jos vaadittavaan annokseen tarvitaan useampi kuin yksi injektio, injektiot jaetaan kahteen tai useampaan injektiokohtaan (taulukko 1).
Jos potilaalla ei tiedetä esiintyneen aiemmin anafylaksia, potilas voi pistää Xolairin itse tai hänen hoitajansa voi pistää sen neljännestä annoksesta alkaen, mikäli lääkäri katsoo tämän olevan asianmukaista (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet). Potilaalle tai hänen hoitajalleen on opetettava oikea pistostekniikka, ja heidät on opetettava tunnistamaan vakavien allergisten reaktioiden varhaisoireet ja ‑löydökset.
Potilaita ja heidän hoitajiaan on kehotettava pistämään koko Xolair-määrä pakkausselosteen käyttöohjeiden mukaisesti.
Vasta-aiheet
Yliherkkyys vaikuttavalle aineelle tai kohdassa Apuaineet mainituille apuaineille.
Varoitukset ja käyttöön liittyvät varotoimet
Jäljitettävyys
Biologisten lääkevalmisteiden jäljitettävyyden parantamiseksi on annetun valmisteen nimi ja eränumero dokumentoitava selkeästi.
Yleiset
Omalitsumabia ei ole tarkoitettu astman akuuttien pahenemisvaiheiden, akuutin bronkospasmin eikä status asthmaticuksen hoitoon.
Omalitsumabia ei ole tutkittu potilailla, joilla on hyperimmunoglobuliini E -oireyhtymä tai allerginen bronkopulmonaalinen aspergilloosi. Sitä ei ole myöskään tutkittu anafylaktisten reaktioiden (mukaan lukien ruoka-aineallergioiden aiheuttamat) ehkäisyssä, atooppisessa ekseemassa tai allergisessa nuhassa. Omalitsumabia ei ole tarkoitettu tällaisten tilojen hoitoon.
Omalitsumabihoitoa ei ole tutkittu potilailla, joilla on autoimmuunisairaus, immuunikompleksivälitteinen tila tai munuaisten tai maksan vajaatoiminta (ks. kohta Annostus ja antotapa). Varovaisuutta tulee noudattaa annettaessa omalitsumabia näille potilasryhmille.
Allergiseen astmaan tai krooniseen rinosinuiittiin, johon liittyy nenäpolyyppeja, tarkoitetun omalitsumabihoidon aloittamisen jälkeen ei suositeta äkillistä systeemisten tai inhaloitujen kortikosteroidihoitojen keskeyttämistä. Kortikosteroidien vähentäminen tulee tehdä lääkärin valvonnassa ja se voidaan joutua tekemään asteittain.
Immuunijärjestelmän häiriöt
Tyypin I allergiset reaktiot
Paikallisia tai systeemisiä tyypin I allergisia reaktioita (myös anafylaksia ja anafylaktinen shokki) voi esiintyä omalitsumabin käytön yhteydessä myös pitkään jatkuneen hoidon jälkeen. Useimmat reaktioista kuitenkin ilmenivät joko kahden tunnin kuluessa ensimmäisestä tai seuraavista omalitsumabi-injektioista, mutta osa niistä esiintyi kahden tunnin jälkeen tai jopa yli 24 tunnin kuluttua. Valtaosa anafylaktisista reaktioista kehittyi ensimmäisten kolmen omalitsumabiannoksen yhteydessä. Tämän takia ensimmäiset kolme annosta on annettava terveydenhuollon ammattilaisen pistämänä tai terveydenhuollon ammattilaisen valvonnassa. Aikaisempi, ei omalitsumabiin liittynyt anafylaksia saattaa olla riskitekijä omalitsumabin annostelun jälkeen ilmaantuvalle anafylaksialle. Jos potilaalla on anamneesissa anafylaksia, terveydenhuollon ammattilaisen on aina pistettävä omalitsumabi, ja anafylaktisten reaktioiden hoitoon sopivia lääkkeitä on oltava aina kyseisten ammattilaisten saatavilla välittömästi omalitsumabin annon jälkeen. Jos anafylaktinen reaktio tai muu vakava allerginen reaktio kehittyy, omalitsumabin anto on lopetettava heti ja asianmukainen hoito on aloitettava. Potilaille tulee kertoa tällaisten reaktioiden mahdollisuudesta, ja heitä tulee neuvoa ottamaan välittömästi yhteyttä lääkäriin, jos heille kehittyy allerginen reaktio.
Kliinisissä tutkimuksissa on pienellä potilasmäärällä todettu vasta-aineita omalitsumabille (ks. kohta Haittavaikutukset). Anti-omalitsumabi-vasta-aineiden kliinistä merkitystä ei tunneta kovin hyvin.
Seerumitauti
Humanisoiduilla, monoklonaalisilla vasta-aineilla (myös omalitsumabilla) hoidetuissa potilaissa on ilmennyt seerumitautia ja seerumitaudin tyyppisiä reaktioita, eli viivästyneitä tyypin III allergisia reaktioita. Taustalla olevaan, mahdolliseen patofysiologiseen mekanismiin kuuluu omalitsumabivasta-ainemuodostuksesta johtuva immunokompleksien muodostuminen ja kertyminen. Oireiden alkamisajankohta on useimmiten ollut 1‒5 vuorokautta ensimmäisen tai myöhempien injektioiden antamisesta, ja reaktioita on ilmennyt myös pitkään jatkuneen hoidon jälkeen. Seerumitautiin viittaavia oireita ovat mm. artriitti/nivelkivut, ihottuma (nokkosihottuma tai muunlainen ihottuma), kuume ja lymfadenopatia. Antihistamiinit ja kortikosteroidit saattavat olla hyödyksi tällaisten häiriöiden ennaltaehkäisyssä ja hoidossa, ja potilaita on ohjeistettava ilmoittamaan kaikista mahdollisista epäillyistä oireistaan.
Churg‒Straussin oireyhtymä ja hypereosinofiilinen oireyhtymä
Vaikeaa astmaa sairastavilla potilailla esiintyy harvoin hypereosinofiilistä oireyhtymää tai allergista granulomatoottista verisuonitulehdusta (Churg‒Straussin oireyhtymä), joita molempia hoidetaan tavallisesti systeemisellä kortikosteroidilla.
Joskus harvoin astmalääkevalmisteita (mukaan lukien omalitsumabi) käyttävälle potilaalle voi kehittyä systeeminen eosinofilia ja verisuonitulehdus. Nämä tapahtumat ovat tavallisesti liittyneet suun kautta otettavan kortikosteroidilääkityksen vähentämiseen.
Näiden potilaiden hoidossa tulee lääkärin tarkkailla merkittävän eosinofilian, vaskuliittisen ihottuman, voimistuvien keuhko-oireiden, nenän sivuontelopoikkeavuuksien, sydänkomplikaatioiden ja/tai neuropatian kehittymistä.
Omalitsumabihoidon lopettamista olisi harkittava kaikissa edellä mainituissa tapauksissa, kun immuunijärjestelmän häiriö on vaikea-asteinen.
Parasiitti-infektiot (loisinfektiot)
IgE saattaa osallistua joidenkin loisinfektioiden aikaansaamaan immunologiseen vasteeseen. Plasebokontrolloitu tutkimus allergiapotilailla, joilla oli krooninen loisinfektioriski, osoitti, että tartuntojen määrä nousi omalitsumabihoidon yhteydessä hieman, mutta infektion kulku, vaikeusaste ja potilaan hoitovaste eivät muuttuneet. Loisinfektioiden esiintyvyys koko kliinisessä ohjelmassa, jota ei suunniteltu havaitsemaan kyseisiä infektioita, oli alle 1/1 000. Varovaisuus saattaa olla tarpeen hoidettaessa potilaita, joilla on suuri loisinfektioriski erityisesti matkustettaessa alueille, joilla esiintyy endeemisiä loisinfektioita. Omalitsumabihoidon lopettamista tulee harkita, jos suositusten mukainen loishäätöhoito ei tehoa.
Lateksille yliherkät henkilöt (esitäytetty ruisku)
Esitäytetyn ruiskun irrotettava neulansuojus sisältää luonnonkumilateksin johdannaista. Tähän mennessä luonnonkumilateksia ei ole todettu irrotettavassa neulansuojuksessa. Xolair injektioneste, liuos esitäytetyssä ruiskussa –valmisteen käyttöä ei ole kuitenkaan tutkittu lateksille yliherkillä henkilöillä ja siten yliherkkyysreaktioiden mahdollista riskiä ei voida täysin poissulkea.
Yhteisvaikutukset
Koska IgE saattaa osallistua joidenkin loisinfektioiden aikaansaamaan immunologiseen vasteeseen, omalitsumabi voi heikentää epäsuorasti loismatojen tai muiden loisinfektioiden hoitoon käytettävien lääkevalmisteiden tehoa (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Sytokromi P450-entsyymit, efflux-pumput ja proteiiniinsitoutumismekanismit eivät osallistu omalitsumabin puhdistumaan, joten interaktioiden todennäköisyys on pieni. Omalitsumabilla ei ole tehty lääke- tai rokoteinteraktiotutkimuksia. Ei ole farmakologista syytä olettaa, että astman, kroonisen rinosinuiitin, johon liittyy nenäpolyyppeja, tai kroonisen spontaanin urtikarian hoitoon yleisesti määrättävillä lääkkeillä olisi yhteisvaikutuksia omalitsumabin kanssa.
Allerginen astma
Kliinisissä tutkimuksissa omalitsumabia käytettiin yleisesti yhdessä inhaloitavien ja suun kautta otettavien kortikosteroidien, inhaloitavien lyhytvaikutteisten ja pitkävaikutteisten beeta-agonistien, leukotrieeninsalpaajien, teofylliinien ja suun kautta otettavien antihistamiinien kanssa. Mikään ei viitannut siihen, että nämä yleisesti käytettävät astmalääkevalmisteet heikentäisivät omalitsumabin turvallisuutta. Omalitsumabin käytöstä samanaikaisesti spesifisen immunoterapian (siedätyshoidon) kanssa on niukasti tietoa. Yhdessä kliinisessä tutkimuksessa, jossa omalitsumabia annettiin yhdessä immunoterapian kanssa, omalitsumabin ja spesifisen immunoterapian yhteiskäytön turvallisuudessa ja tehossa ei todettu eroja verrattuna omalitsumabihoitoon yksinään.
Krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Kliinisissä tutkimuksissa omalitsumabia käytettiin protokollan mukaisesti yhdessä nenään annettavan mometasonisuihkeen kanssa. Muita yleisiä samanaikaisesti käytettyjä lääkevalmisteita olivat muut nenään annettavat kortikosteroidit, keuhkoputkia laajentavat lääkevalmisteet, antihistamiinit, leukotrieenireseptorin estäjät, adrenergit/sympatomimeetit ja nenän paikallispuudutteet. Tutkimuksissa ei havaittu viitteitä siitä, että näiden yleisesti käytettyjen lääkevalmisteiden samanaikaisella käytöllä olisi ollut vaikutusta omalitsumabin turvallisuuteen.
Krooninen spontaani urtikaria
Kliinisissä tutkimuksissa omalitsumabia käytettiin kroonisen spontaanin urtikarian hoitoon yhdessä antihistamiinien (anti-H1, anti-H2) ja leukotrieenireseptorin salpaajien kanssa. Omalitsumabin turvallisuudessa ei havaittu muutoksia suhteessa sen tunnettuun turvallisuusprofiiliin allergisen astman hoidossa, kun omalitsumabia käytettiin yhdessä näiden lääkevalmisteiden kanssa. Populaatiofarmakokineettisen analyysin perusteella H2-antihistamiinit ja leukotrieenireseptorin salpaajat eivät myöskään vaikuttaneet merkittävästi omalitsumabin farmakokinetiikkaan (ks. kohta Farmakokinetiikka).
Pediatriset potilaat
Kroonisen spontaanin urtikarian kliinisiin tutkimuksiin osallistui myös 12–17-vuotiaita potilaita, jotka käyttivät omalitsumabia yhdessä antihistamiinien (anti-H1, anti-H2) ja leukotrieenireseptoriantagonistien kanssa. Alle 12-vuotiaille lapsille ei ole tehty tutkimuksia.
Raskaus ja imetys
Raskaus
Kohtalaisen laajat raskausrekisteriin ja kauppaantulon jälkeisiin spontaaniraportteihin perustuvat tiedot (300–1 000 raskaudesta) käytöstä raskaana olevien naisten hoidossa eivät viittaa epämuodostumia aiheuttavaan, fetaaliseen tai neonataaliseen toksisuuteen. Prospektiiviseen raskausrekisteritutkimukseen (EXPECT) otettiin 250 raskaana olevaa naista, joilla oli astma ja jotka käyttivät omalitsumabia. Tutkimuksessa todettiin, että merkittävien synnynnäisten poikkeavuuksien vallitsevuus oli EXPECT‑rekisterin tutkittavilla samaa luokkaa kuin taudin suhteen kaltaistetuilla (keskivaikeaa tai vaikeaa astmaa sairastavilla) potilailla (vallitsevuus 8,1 % EXPECT-rekisterin tutkittavilla vs. 8,9 % taudin suhteen kaltaistetuilla). Tutkimuksen metodologiset rajoitukset (mm. pieni otoskoko ja ei-satunnaistettu tutkimusasetelma) voivat vaikuttaa tietojen tulkintaan.
Omalitsumabi läpäisee veri-istukkaesteen. Eläinkokeissa ei ole kuitenkaan havaittu suoria tai epäsuoria lisääntymistoksisia vaikutuksia (ks. kohta Prekliiniset tiedot turvallisuudesta).
Omalitsumabi on aiheuttanut ikäriippuvaista verihiutaleiden määrän vähenemistä kädellisille, ja suhteellinen herkkyys oli nuorilla eläimillä suurempi (ks. kohta Prekliiniset tiedot turvallisuudesta).
Omalitsumabin käyttöä raskauden aikana voi harkita, jos se on kliinisesti tarpeen.
Imetys
Ihmisen rintamaidossa esiintyy immunoglobuliini G:tä (IgG), joten omalitsumabia oletettavasti esiintyy ihmisen rintamaidossa. Olemassa olevat tiedot ovat osoittaneet omalitsumabin erittyvän kädellisten maitoon (ks. kohta Prekliiniset tiedot turvallisuudesta).
EXPECT‑tutkimus, jossa 154 imeväistä oli altistunut omalitsumabille raskauden aikana tai imetyksen kautta, ei osoittanut haittavaikutuksia rintaruokituilla imeväisillä. Tutkimuksen metodologiset rajoitukset (mm. pieni otoskoko ja ei-satunnaistettu tutkimusasetelma) voivat vaikuttaa tietojen tulkintaan.
Oraalisesti annosteltuna immunoglobuliini G -proteiinit läpikäyvät suolessa proteolyysin ja niillä on huono biologinen hyötyosuus. Vaikutuksia rintaruokittuihin vastasyntyneisiin/imeväisiin ei ole odotettavissa. Näin ollen omalitsumabin käyttöä imetyksen aikana voi harkita, jos se on kliinisesti tarpeen.
Hedelmällisyys
Ihmisten fertiliteettiä koskevia tietoja omalitsumabista ei ole. Erityisissä prekliinisissä kädellisillä tehdyissä fertiliteettitutkimuksissa, parittelututkimukset mukaan lukien, ei naarailla tai uroksilla todettu fertiliteettiä heikentäviä vaikutuksia, kun annettiin toistuvia annoksia omalitsumabia 75 mg/kg annoksiin asti. Lisäksi erillisessä prekliinisessä genotoksisuustutkimuksessa ei havaittu genotoksisia vaikutuksia.
Vaikutus ajokykyyn ja koneiden käyttökykyyn
Omalitsumabilla ei ole haitallista vaikutusta ajokykyyn ja koneidenkäyttökykyyn.
Haittavaikutukset
Allerginen astma ja krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Yhteenveto turvallisuusprofiilista
Aikuisille ja vähintään 12-vuotiaille nuorille tehdyissä allergisen astman kliinisissä tutkimuksissa yleisimmin ilmoitettuja haittavaikutuksia olivat päänsäryt ja pistokohdan reaktiot, kuten pistokohdan kipu, turvotus, punoitus ja kutina. 6‒12-vuotiaille lapsille tehdyissä kliinisissä tutkimuksissa yleisimmin ilmoitettuja haittavaikutuksia olivat päänsärky, kuume ja ylävatsakipu. Useimmat vaikutukset olivat vaikeusasteeltaan lieviä tai keskivaikeita. Kroonisen rinosinuiitin, johon liittyy nenäpolyyppeja, kliinisissä tutkimuksissa 18-vuotiailla ja sitä vanhemmilla potilailla yleisimmin ilmoitettuja haittavaikutuksia olivat päänsärky, heitehuimaus, nivelkipu, ylävatsakipu ja pistoskohdan reaktiot.
Haittavaikutustaulukko
Taulukossa 4 on esitetty kliinisissä tutkimuksissa koko Xolair-hoitoa saaneessa allergisen astman ja kroonisen rinosinuiitin, johon liittyy nenäpolyyppeja, turvallisuuspopulaatiossa havaitut haittavaikutukset MedDRAn mukaisen elinjärjestelmän ja esiintymistiheyden mukaan. Haittavaikutukset on esitetty kussakin yleisyysluokassa haittavaikutuksen vakavuuden mukaan alenevassa järjestyksessä. Yleisyysluokitukset ovat: hyvin yleinen (≥ 1/10), yleinen (≥ 1/100, < 1/10), melko harvinainen (≥ 1/1 000, < 1/100), harvinainen (≥ 1/10 000, < 1/1 000) ja hyvin harvinainen (< 1/10 000). Myyntiluvan saamisen jälkeiseen käyttökokemukseen liittyvät haittavaikutukset on ilmoitettu esiintymistiheydellä tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 4 Haittavaikutukset allergisen astman ja kroonisen rinosinuiitin, johon liittyy nenäpolyyppeja, hoidossa
| Infektiot | |
| Melko harvinaiset | Faryngiitti |
| Harvinaiset | Loisinfektio |
| Veri ja imukudos | |
| Tuntematon | Idiopaattinen trombosytopenia, vakavat tapaukset mukaan lukien |
| Immuunijärjestelmä | |
| Harvinainen | Anafylaktinen reaktio, muut vakavat allergiset tilat, anti-omalitsumabivasta-aineiden muodostus |
| Tuntematon | Seerumitauti, johon voi kuulua kuumetta ja lymfadenopatiaa |
| Hermosto | |
| Yleinen | Päänsärky* |
| Melko harvinainen | Pyörtyminen, parestesiat, uneliaisuus, heitehuimaus# |
| Verisuonisto | |
| Melko harvinainen | Posturaalinen hypotensio, kasvojen punoitus |
| Hengityselimet, rintakehä ja välikarsina | |
| Melko harvinainen | Allerginen bronkospasmi, yskä |
| Harvinainen | Laryngoedeema |
| Tuntematon | Allerginen granulomatoottinen vaskuliitti (eli Churg‒Straussin oireyhtymä) |
| Ruoansulatuselimistö | |
| Yleinen | Ylävatsakipu**# |
| Melko harvinainen | Ylävatsavaivat, ripuli, pahoinvointi |
| Iho ja ihonalainen kudos | |
| Melko harvinainen | Valoyliherkkyys, nokkosihottuma, ihottuma, kutina |
| Harvinainen | Angioedeema |
| Tuntematon | Alopesia |
| Luusto, lihakset ja sidekudos | |
| Yleinen | Nivelkipu† |
| Harvinainen | Systeeminen lupus erythematosus (SLE/LED) |
| Tuntematon | Lihaskipu, nivelturvotus |
| Yleisoireet ja antopaikassa todettavat haitat | |
| Hyvin yleinen | Kuume** |
| Yleinen | Pistokohdan reaktiot, kuten turvotus, punoitus, kipu, kutina |
| Melko harvinainen | Influenssan kaltaiset oireet, käsivarsien turvotus, painonnousu, uupumus |
*: Hyvin yleinen 6‒12-vuotiailla lapsilla
**: 6‒12-vuotiailla lapsilla
#: Yleinen nenäpolyyppitutkimuksissa
†: Tuntematon allergisen astman tutkimuksissa
Krooninen spontaani urtikaria
Yhteenveto turvallisuusprofiilista
Omalitsumabin (75 mg, 150 mg ja 300 mg neljän viikon välein) turvallisuutta ja siedettävyyttä tutkittiin 975:llä kroonista spontaania urtikariaa sairastavalla potilaalla, joista 242 sai lumelääkettä. Kaiken kaikkiaan 733 potilasta sai omalitsumabihoitoa enintään 12 viikon ajan ja 490 potilasta enintään 24 viikon ajan. Näistä 412 potilasta sai 300 mg annoksia enintään 12 viikon ajan ja 333 potilasta enintään 24 viikon ajan.
Haittavaikutustaulukko
Erillisessä taulukossa (taulukossa 5) ovat kroonisen spontaanin urtikarian hoitoa koskevat, eri annosten ja hoitopopulaatioiden yhteydessä havaitut haittavaikutukset (merkitsevästi erilaiset riskitekijät, liitännäissairaudet, samanaikaiset lääkkeet ja iät [esim. astmatutkimuksiin osallistui 6–12-vuotiaita lapsia]).
Taulukossa 5 luetellaan haittavaikutukset (tapahtumat, joita esiintyi ≥1 %:lla potilaista hoitoryhmästä riippumatta ja ≥2 % useammin kaikissa omalitsumabihoitoryhmissä kuin lumehoidossa lääketieteellisen arvioinnin jälkeen), joita on ilmoitettu 300 mg annoksia käytettäessä kolmessa yhdistetyssä vaiheen III tutkimuksessa. Haittavaikutukset on jaettu kahteen ryhmään: 12 viikon hoitojakson aikana ilmenneisiin ja 24 viikon hoitojakson aikana ilmenneisiin.
Haittavaikutukset luetellaan MedDRA-elinjärjestelmäluokkien mukaisesti. Haittavaikutukset on luokiteltu kussakin elinjärjestelmäluokassa niiden yleisyyden mukaan yleisimmistä alkaen. Kunkin haittavaikutuksen kohdalla mainittava yleisyysluokka perustuu seuraavaan käytäntöön: hyvin yleiset (≥ 1/10), yleiset (≥ 1/100, < 1/10), melko harvinaiset (≥ 1/1 000, < 1/100), harvinaiset (≥ 1/10 000, < 1/1 000), hyvin harvinaiset (< 1/10 000) ja yleisyys tuntematon (koska saatavissa oleva tieto ei riitä esiintyvyyden arviointiin).
Taulukko 5 Haittavaikutukset kroonisen spontaanin urtikarian omalitsumabihoitoa (300 mg) koskevasta yhdistetystä turvallisuustietokannasta (päivä 1 – viikko 24)
| 12 viikkoa | Omalitsumabitutkimukset 1, 2 ja 3, yhdistetty | Yleisyysluokka | ||
| Lume N=242 | 300 mg N=412 | |||
| Infektiot | ||||
| Sivuontelotulehdus | 5 (2,1 %) | 20 (4,9 %) | Yleiset | |
| Hermosto | ||||
| Päänsärky | 7 (2,9 %) | 25 (6,1 %) | Yleiset | |
| Luusto, lihakset ja sidekudos | ||||
| Nivelkipu | 1 (0,4 %) | 12 (2,9 %) | Yleiset | |
| Yleisoireet ja antopaikassa todettavat haitat | ||||
| Injektiokohdan reaktio* | 2 (0,8 %) | 11 (2,7 %) | Yleiset | |
| 24 viikkoa | Omalitsumabitutkimukset 1 ja 3, poolattu | Yleisyysluokka | ||
| Lume N=163 | 300 mg N=333 | |||
| Infektiot | ||||
| Ylähengitystieinfektio | 5 (3,1 %) | 19 (5,7 %) | Yleiset | |
* Injektiokohdan reaktiot otettiin mukaan huolimatta siitä, että ero lumeeseen ei ollut 2 %, sillä kaikilla tapauksilla arvioitiin olevan syy-yhteys tutkimushoitoon.
48 viikon pituisessa tutkimuksessa 81 kroonista spontaania urtikariaa sairastavaa potilasta sai 300 mg omalitsumabia joka 4. viikko (ks. kohta Farmakodynamiikka). Pitkäaikaisen käytön turvallisuusprofiili oli samankaltainen kuin kroonista spontaania urtikariaa koskeneissa 24 viikon pituisissa tutkimuksissa havaittu turvallisuusprofiili.
Tiettyjen haittavaikutusten kuvaus
Immuunijärjestelmä
Tarkemmat tiedot, ks. kohta Varoitukset ja käyttöön liittyvät varotoimet.
Anafylaksia
Anafylaktiset reaktiot olivat kliinisissä tutkimuksissa harvinaisia. Myyntiluvan myöntämisen jälkeisten tietojen osalta turvallisuustietokannasta tehdyllä kumulatiivisella haulla löytyi kuitenkin yhteensä 898 anafylaksiatapausta. Tämä tarkoittaa noin 0,2 % raportointitiheyttä, kun arvioitu altistuminen on 566 923 potilashoitovuotta.
Valtimotromboemboliset tapahtumat (ATE)
Kontrolloiduissa kliinisissä tutkimuksissa ja ei-kokeellisen tutkimuksen välianalyysissä on havaittu numeerista epätasapainoa ATE:n suhteen. Seuraavien valtimotromboembolisten päätetapahtumien ilmaantuvuudesta kerättiin tietoa analyysia varten: aivohalvaukset, ohimenevät aivojen verenkiertohäiriöt, sydäninfarktit, epävakaa rasitusrintakipu ja kardiovaskulaarisista syistä johtuvat kuolemantapaukset (mukaan lukien tuntemattomasta syystä johtuvat kuolemantapaukset). Ei-kokeellisen tutkimuksen loppuanalyysissä, ATE:n ilmaantuvuus 1 000 potilasvuotta kohden oli 7,25 (115/15 286 potilasvuotta) Xolairilla saaneilla potilailla ja 5,12 (51/9 963 potilasvuotta) potilailla, jotka eivät saaneet Xolairia. Lähtötason kardiovaskulaaririskitekijöitä kontrolloivassa monimuuttuja-analyysissä riskisuhde oli 1,32 (95 % luottamusväli 0,91‑1,91). Erillisessä yhdistettyjen tutkimusten analyysissä, johon otettiin mukaan kaikki vähintään 8 viikkoa kestäneet satunnaistetut, kaksoissokkoutetut ja lumekontrolloidut kliiniset tutkimukset, ATE:n ilmaantuvuus 1 000 potilasta kohden oli 2,69 (5/1 856 potilasvuotta) Xolairilla hoidettujen potilaiden ryhmässä ja 2,28 (4/1 680 potilasvuotta) lumelääkettä saaneiden potilaiden ryhmässä (esiintymissuhde 1,13, 95 % luottamusväli 0,24‒5,71).
Trombosyytit
Kliinisissä tutkimuksissa joidenkin potilaiden trombosyyttiarvot olivat normaalien laboratorioarvojen vaihteluvälin alapuolella. Myyntiluvan saamisen jälkeen on raportoitu idiopaattista trombosytopeniaa yksittäisinä tapauksina, vakavat tapaukset mukaan lukien.
Loisinfektiot
Lievä, mutta tilastollisesti ei-merkitsevä infektioriskin suureneminen osoitettiin plasebokontrolloidussa tutkimuksessa, joka tehtiin omalitsumabilla allergiapotilaille, joilla oli krooninen loisinfektioriski. Infektioiden kulku, vaikeusaste ja potilaan infektion hoitovaste eivät muuttuneet (ks. kohta Varoitukset ja käyttöön liittyvät varotoimet).
Systeeminen lupus erythematosus
Kliinisissä tutkimuksissa ja valmisteen markkinoilletulon jälkeen on ilmoitettu systeemistä lupus erythematosusta (SLE/LED) potilailla, joilla on keskivaikea tai vaikea astma tai krooninen spontaani urtikaria. SLE:n patogeneesia ei tunneta hyvin.
Epäillyistä haittavaikutuksista ilmoittaminen
On tärkeää ilmoittaa myyntiluvan myöntämisen jälkeisistä lääkevalmisteen epäillyistä haittavaikutuksista. Se mahdollistaa lääkevalmisteen hyöty-haittatasapainon jatkuvan arvioinnin. Terveydenhuollon ammattilaisia pyydetään ilmoittamaan kaikista epäillyistä haittavaikutuksista kansallisen ilmoitusjärjestelmän kautta.
www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Yliannostus
Suurinta siedettyä Xolair-annosta ei ole määritetty. Potilaille on annettu kerta-annoksena laskimoon jopa 4 000 mg ilman merkkejä annosta rajoittavasta toksisuudesta. Suurin potilaille annettu kumulatiivinen annos oli 44 000 mg 20 viikon aikana, eikä tämä annos aiheuttanut odottamattomia akuutteja haittavaikutuksia.
Jos yliannostusta epäillään, on potilaan tilaa seurattava mahdollisten poikkeavien merkkien tai oireiden varalta. Potilaan on hakeuduttava lääkärin hoitoon, ja asianmukaisiin hoitotoimiin on ryhdyttävä.
Farmakologiset ominaisuudet
Farmakodynamiikka
Farmakoterapeuttinen ryhmä: ahtauttavien hengitystiesairauksien lääkkeet, muut systeemisesti käytettävät ahtauttavien hengitystiesairauksien lääkkeet, ATC-koodi: R03DX05
Allerginen astma ja krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Vaikutusmekanismi
Omalitsumabi on yhdistelmä-DNA-tekniikalla tuotettu humanisoitu monoklonaalinen vasta-aine, joka sitoutuu selektiivisesti ihmisen immunoglobuliini E:hen (IgE) ja estää IgE:tä sitoutumasta basofiilien ja syöttösolujen suuren affiniteetin IgE-reseptoreihin (FcεRI). Siten se vähentää vapaata IgE:tä, joka voisi laukaista allergisen reaktion. Kyseessä on IgG1-kappavasta-aine, jossa on ihmiseltä peräisin oleva kantaosa ja hiiriperäisestä, IgE:hen sitoutuvasta vasta-aineesta peräisin olevat täydennys- ja määriteosat.
Omalitsumabihoito aiheutti atooppisissa henkilöissä basofiilien FcεRI-reseptorien huomattavaa vaimennussäätelyä. Omalitsumabi estää IgE-välitteistä tulehdusreaktiota. Tätä osoittavat vähentynyt veren ja kudoksen eosinofiilimäärä ja vähentynyt määrä tulehdusvälittäjäaineita, mukaan lukien IL-4, IL-5 ja IL-13, joita tuottavat synnynnäisen immuniteetin, adaptiivisen immuniteetin ja immuunipuolustukseen liittymättömät solut.
Farmakodynaamiset vaikutukset
Allerginen astma
Histamiinin vapautuminen omalitsumabihoitoa saaneilta henkilöiltä eristetyistä basofiileista in vitro allergeenistimulaation jälkeen väheni noin 90 % hoitoa edeltäneisiin lukuihin verrattuna.
Kliinisissä tutkimuksissa allergista astmaa sairastavilla potilailla seerumin vapaan IgE:n pitoisuus väheni annosriippuvaisesti tunnin sisällä ensimmäisen annoksen antamisesta, ja vaikutus säilyi antojen välillä. Vuoden kuluttua omalitsumabihoidon lopettamisesta IgE-pitoisuudet olivat palanneet hoitoa edeltäneelle tasolle, eikä niissä havaittu rebound-vaikutusta lääkityksen lopettamisvaiheen jälkeen.
Krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Kliinisissä tutkimuksissa kroonista rinosinuiittia, johon liittyy nenäpolyyppeja, sairastavilla potilailla omalitsumabihoito vähensi seerumin vapaan IgE:n pitoisuutta (n. 95 %) ja kohotti seerumin kokonais-IgE-arvoja vastaavissa määrin kuin allergista astmaa sairastavilla potilailla. Seerumin kokonais-IgE-arvot kasvoivat, sillä muodostuneen omalitsumabi-IgE-kompleksin eliminaationopeus on alhaisempi kuin vapaan IgE:n.
Krooninen spontaani urtikaria
Vaikutusmekanismi
Omalitsumabi on yhdistelmä-DNA-tekniikalla tuotettu humanisoitu monoklonaalinen vasta-aine, joka sitoutuu selektiivisesti ihmisen immunoglobuliini E:hen (IgE) ja pienentää vapaan IgE:n pitoisuutta. Kyseessä on IgG1-kappavasta-aine, jossa on ihmiseltä peräisin oleva kantaosa ja hiiriperäisestä, IgE:hen sitoutuvasta vasta-aineesta peräisin olevat täydennys- ja määriteosat. Sitoutuminen johtaa solujen IgE-reseptorien (FcεRI) ilmenemisen vähenemiseen soluissa. Ei ole täysin tiedossa, miten tämä lievittää kroonisen spontaanin urtikarian oireita.
Farmakodynaamiset vaikutukset
Kliinisissä tutkimuksissa kroonista spontaania urtikariaa sairastavilla potilailla vapaan IgE:n maksimisuppressio havaittiin 3 päivän kuluttua ensimmäisestä ihon alle annetusta annoksesta. Kun valmistetta annettiin toistuvasti kerran 4 viikon välein, antoa edeltävä vapaan IgE:n pitoisuus seerumissa pysyi vakaana 12‒24 hoitoviikon ajan. Omalitsumabin käytön lopettamisen jälkeen vapaan IgE:n pitoisuus suureni kohti hoitoa edeltävää tasoa 16 viikon hoidottoman seurantajakson aikana.
Kliininen teho ja turvallisuus
Allerginen astma
Aikuiset ja vähintään 12-vuotiaat nuoret
Omalitsumabin tehokkuus ja turvallisuus osoitettiin 28 viikkoa kestäneessä kaksoissokkoutetussa plasebokontrolloidussa tutkimuksessa (tutkimus 1), johon osallistui 419 potilasta, joilla oli vaikea allerginen astma. Potilaat olivat 12‒79-vuotiaita, heillä oli heikentynyt keuhkojen toiminta (FEV1 40‒80 % normaalista) ja heidän astmaoireensa pysyivät huonosti hallinnassa siitä huolimatta, että he käyttivät suuria annoksia inhaloitavia kortikosteroideja ja pitkävaikutteista beeta2-agonistia. Tutkimukseen sopivilla potilailla oli ollut useita astman pahenemisvaiheita, jotka olivat vaatineet systeemistä kortikosteroidihoitoa, tai he olivat joutuneet sairaalahoitoon tai ensiapuun vaikean astman pahenemisen takia edellisen vuoden aikana siitä huolimatta, että he saivat jatkuvasti suuria annoksia inhaloitavia kortikosteroideja ja pitkävaikutteista beeta2-agonistia. Omalitsumabia tai plaseboa annettiin ihon alle lisälääkkeenä >1 000 mikrog beklometasonidipropionaatin (tai vastaavan) ja pitkävaikutteisen beeta2-agonistin kanssa. Sallittuja ylläpitohoitoja olivat suun kautta otettavat kortikosteroidit (22 % potilaista), teofylliini (27 % potilaista) ja leukotrieeninsalpaajat (35 % potilaista).
Ensisijainen päämuuttuja oli systeemistä kortikosteroidihoitoa vaativien astman pahenemisvaiheiden esiintyvyys. Omalitsumabi vähensi sitä 19 % (p = 0,153). Muita muuttujia, jotka osoittivat omalitsumabin tilastollisesti merkitsevästi paremmaksi (p<0,05), olivat vaikeiden pahenemisvaiheiden (joissa potilaan keuhkojen toiminta oli alle 60 % potilaan parhaasta arvosta ja vaati hoitoa systeemisillä kortikosteroideilla) väheneminen, astmaan liittyvien päivystyskäyntien (sairaalahoito, ensiapu ja lääkärikäynnit ilman ajanvarausta) väheneminen sekä lääkärin yleisarvion hoidon tehokkuudesta, astmaan liittyvän elämänlaadun (AQL), astman oireiden ja keuhkojen toiminnan paraneminen.
Alaryhmäanalyysissä omalitsumabihoidosta oli enemmän kliinisesti merkitsevää hyötyä potilaille, joiden kokonais-IgE oli ennen hoidon aloittamista ≥76 IU/ml. Näissä potilaissa omalitsumabi vähensi tutkimuksessa 1 astman pahenemisvaiheiden esiintymistä 40 % (p = 0,002). Sen lisäksi potilaille, joiden kokonais-IgE oli ≥76 IU/ml, saatiin useammin kliinisesti merkitsevä vaste omalitsumabille vaikean astman hoidossa. Taulukossa 6 on esitetty tutkimuksen 1 tulokset.
Taulukko 6 Tutkimuksen 1 tulokset
| Tutkimuksen 1 koko populaatio | ||
Omalitsumabi n=209 | Plasebo n=210 | |
| Astman pahenemisvaiheet | ||
| 28 viikon jaksoa kohti | 0,74 | 0,92 |
| vähenemisprosentti, esiintyvyyssuhde p-arvo | 19,4 %, p = 0,153 | |
| Vaikeat astman pahenemisvaiheet | ||
| 28 viikon jaksoa kohti | 0,24 | 0,48 |
| vähenemisprosentti, esiintyvyyssuhde p-arvo | 50,1 %, p = 0,002 | |
| Käynnit päivystyspoliklinikalla | ||
| 28 viikon jaksoa kohti | 0,24 | 0,43 |
| vähenemisprosentti, esiintyvyyssuhde p-arvo | 43,9 %, p = 0,038 | |
| Lääkärin yleisarvio | ||
| Hoitoon vastanneet (%) | 60,5 % | 42,8 % |
| p-arvo** | <0,001 | |
| AQL-pisteiden paraneminen | ||
| Potilaat (%), joilla pisteet paranivat ≥0,5 | 60,8 % | 47,8 % |
| p-value | 0,008 | |
* oireet paranivat selvästi tai saatiin hallintaan täysin
** arvioinnin kokonaisjakauman p-arvo
Tutkimuksessa 2 arvioitiin omalitsumabin tehokkuutta ja turvallisuutta 312 potilaalla, joilla oli vaikea allerginen astma ja jotka vastasivat tutkimuksessa 1 käytettyä populaatiota. Tässä avoimessa tutkimuksessa omalitsumabi hoito vähensi kliinisesti merkitsevien astman pahenemisvaiheiden määrää 61 % verrattuna tavanomaiseen astman hoitoon.
Omalitsumabin tehokkuutta ja turvallisuutta arvioitiin lisäksi neljässä 28‒52 viikkoa kestäneessä laajassa plasebokontrolloidussa supportiivisessa tutkimuksessa. Niissä oli 1 722 aikuista ja nuorta (tutkimukset 3, 4 5 ja 6), joilla oli vaikea ja jatkuva astma. Useimpien potilaiden oireet eivät olleet riittävästi hallinnassa, mutta he saivat vähemmän samanaikaisia astmahoitoja kuin tutkimuksiin 1 ja 2 osallistuneet potilaat. Tutkimuksissa 3‒5 astman paheneminen oli ensisijainen muuttuja. Tutkimuksessa 6 arvioitiin pääasiassa muutosta inhaloitavien kortikosteroidien tarpeessa.
Tutkimuksissa 3, 4 ja 5 omalitsumabilla hoidetuilla potilailla oli 37,5 % (p = 0,027), 40,3 % (p<0,001) ja 57,6 % (p<0,001) vähemmän astman pahenemisvaiheita plaseboon verrattuna.
Tutkimuksessa 6 merkitsevästi useamman vaikeaa allergista astmaa sairastavan potilaan flutikasoniannos pystyttiin pienentämään tasolle ≤500 mikrog/vrk ilman astmaoireiden hallinnan heikkenemistä omalitsumabiryhmässä (60,3 %) kuin plaseboryhmässä (45,8 %, p<0,05).
Elämänlaadun pisteet laskettiin Juniperin astmaan liittyvällä elämänlaatukyselylomakkeella. Kaikissa kuudessa tutkimuksessa omalitsumabihoitoa saaneiden potilaiden elämänlaatu parani lähtötilanteesta tilastollisesti merkitsevästi plasebo- tai kontrolliryhmien potilaisiin verrattuna.
Lääkärin yleisarvio hoidon tehokkuudesta:
Lääkärin yleisarvio tehtiin viidessä edellä mainituista tutkimuksista. Kyseessä oli hoitavan lääkärin tekemä laaja arvio astmaoireiden hallinnasta. Lääkäri pystyi ottamaan huomioon seuraavat tekijät: uloshengityksen huippuvirtaus (PEF), päivällä ja yöllä esiintyvät oireet, lisälääkkeiden käyttö, spirometria ja pahenemisvaiheet. Kaikissa viidessä tutkimuksessa merkitsevästi suurempi osa omalitsumabihoitoa kuin plaseboa saaneista potilaista sai joko astmaoireiden merkitsevän lievittymisen tai täydellisen hallinnan.
6–12-vuotiaat lapset
Pääasiallista tukea omalitsumabin teholle ja turvallisuudelle 6‑12-vuotiaiden potilasryhmässä on saatu yhdestä satunnaistetusta, kaksoissokkoutetusta, lumelääkekontrolloidusta monikeskustutkimuksesta (tutkimus 7).
Tutkimus 7 oli lumelääkekontrolloitu tutkimus, jossa oli mukana tietty alaryhmä (n=235) tämänhetkisen käyttöaiheen mukaan valittuja potilaita, joita hoidettiin suuriannoksisella inhaloitavalla kortikosteroidilla (flutikasoni ≥500 mikrog/päivä) ja pitkävaikutteinen beeta-agonisti.
Kliinisesti merkitsevä paheneminen määriteltiin astmaoireiden pahenemisena, minkä tutkijalääkäri arvioi kliinisesti ja joka vaati alkutilanteen inhaloitavan kortikosteroidiannoksen kaksinkertaistamista vähintään 3 vuorokauden ajaksi tai akuuttihoitona annettavan systeemisen (suun kautta otettavan tai laskimoon annettavan) kortikoidilääkityksen käyttöä vähintään 3 päivän ajan.
Tietyssä alaryhmässä, jossa potilaita hoidettiin suuriannoksisella inhaloitavalla kortikosteroidilla, esiintyi astman pahenemisvaiheita tilastollisesti merkitsevästi vähemmän omalitsumabi-ryhmässä kuin lumelääkeryhmässä. Viikolla 24 hoitoryhmien välinen ero esiintyvyydessä vastasi 34 %:n vähenemistä omalitsumabipotilailla suhteessa lumelääkkeeseen (esiintyvyyssuhde 0,662, p = 0,047). Toisen 28 viikon kaksoissokkoutetun jakson aikana hoitoryhmien välinen esiintyvyysero vastasi 63 %:n vähenemistä omalitsumabipotilailla suhteessa lumelääkkeeseen (esiintyvyyssuhde 0,37, p<0,001).
52 viikon mittaisen, kaksoissokkoutetun hoitojakson aikana (sisältäen 24 viikon kiinteäannoksisen steroidijakson ja 28 viikon sopeutetun annoksen steroidijakson) hoitoryhmien pahenemisvaiheiden esiintyvyydessä havaittiin 50 %:n suhteellinen väheneminen omalitsumabipotilailla (esiintyvyyssuhde 0,504, p<0,001).
52 viikon mittaisen hoitojakson lopussa todettiin beeta-agonisti-kohtauslääkkeen käytön vähentyneen enemmän omalitsumabiryhmässä verrattuna lumeryhmään, joskin ero hoitoryhmien välillä ei ollut tilastollisesti merkitsevä. Kun 52 viikkoa kestäneen, kaksoissokkoutetun hoitojakson lopussa suoritettiin hoidon tehon kokonaisarviointi vaikeaa astmaa sairastavien potilaiden alaryhmässä, jotka olivat saaneet suuriannoksista inhaloitavaa kortikosteroidia yhdistettynä pitkävaikutteiseen beeta-agonistiin, oli ”erinomaisen” hoitotehon saavuttaneiden potilaiden lukumäärä suurempi, ja ”kohtuullisen” tai ”huonon” hoitotehon saavuttaneiden potilaiden lukumäärä pienempi omalitsumabiryhmässä verrattuna lumeryhmään. Ryhmien välinen ero oli tilastollisesti merkitsevä (p<0,001). Potilaiden omakohtaisessa elämänlaatuarvioinnissa ei puolestaan ollut eroa omalitsumabi- ja lumeryhmän välillä.
Krooninen rinosinuiitti, johon liittyy nenäpolyyppeja
Omalitsumabin turvallisuutta ja tehoa arvioitiin kahdessa satunnaistetussa, kaksoissokkoutetussa ja lumekontrolloidussa tutkimuksessa potilailla, joilla oli krooninen rinosinuiitti, johon liittyi nenäpolyyppeja (Taulukko 8). Potilaat saivat omalitsumabia tai lumelääkettä ihonalaisesti joka toinen tai joka neljäs viikko (ks. kohta Annostus ja antotapa). Kaikki potilaat saivat taustahoitona nenään annettavaa mometasonia koko tutkimuksen ajan. Tutkimukseen pääsyyn ei vaadittu aikaisempaa sinonasaalista leikkausta tai aikaisempaa systeemisten kortikosteroidien käyttöä. Potilaat saivat omalitsumabia tai lumelääkettä 24 viikon ajan, jonka jälkeen seurasi neljän viikon seurantajakso. Demografiset ominaisuudet ja lähtötilanne, mukaan lukien allergiset komorbiditeetit, on kuvattu taulukossa 7.
Taulukko 7 Nenäpolyyppitutkimusten demografiset ominaisuudet ja lähtötilanne
| Parametri | Nenäpolyyppitutkimus 1 n = 138 | Nenäpolyyppitutkimus 2 n = 127 |
| Ikä, keskiarvo (vuotta) (keskihajonta) | 51,0 (13,2) | 50,1 (11,9) |
| % miehiä | 63,8 | 65,4 |
| Potilaat, joilla systeeminen kortikosteroidi käytössä edeltävänä vuonna (%) | 18,8 | 26,0 |
| Bilateraalinen endoskooppinen nenäpolyyppiarvo (NPS): keskiarvo (keskihajonta), asteikko 0–8 | 6,2 (1,0) | 6,3 (0,9) |
| Nenän tukkoisuusarvo (NCS): keskiarvo (keskihajonta), asteikko 0–3 | 2,4 (0,6) | 2,3 (0,7) |
| Hajuaistia mittaava arvo: keskiarvo (keskihajonta), asteikko 0–3 | 2,7 (0,7) | 2,7 (0,7) |
| SNOT-22-arvo: keskiarvo (keskihajonta), asteikko 0–110 | 60,1 (17,7) | 59,5 (19,3) |
| Veren eosinofiilit (solua/mikrol): keskiarvo (keskihajonta) | 346,1 (284,1) | 334,6 (187,6) |
| Kokonais-IgE IU/ml: keskiarvo (keskihajonta) | 160,9 (139,6) | 190,2 (200,5) |
| Astma (%) | 53,6 | 60,6 |
| Lievä (%) | 37,8 | 32,5 |
| Keskivaikea (%) | 58,1 | 58,4 |
| Vaikea (%) | 4,1 | 9,1 |
| Asetyylisalisyylihapon pahentama hengitysteiden sairaus (AERD) (%) | 19,6 | 35,4 |
| Allerginen nuha | 43,5 | 42,5 |
SNOT-22 = Sino-Nasal Outcome Test 22 -kysely; IgE = immunoglobuliini E; IU = kansainvälinen yksikkö (international unit). Suuret NPS-, NCS- ja SNOT-22-arvot viittaavat suurempaan tautiaktiivisuuteen.
Ensisijaiset päätetapahtumat olivat bilateraalinen nenäpolyyppiarvo (NPS) ja keskimääräinen päivittäinen nenän tukkoisuusarvo (NCS) viikolla 24. Molemmissa nenäpolyyppitutkimuksissa 1 ja 2 potilailla, jotka saivat omalitsumabia, havaittiin tilastollisesti merkitsevästi suurempi paraneminen lähtötasosta viikolla 24 NPS-arvossa ja NCS:n viikoittaisessa keskiarvossa, kuin potilailla, jotka saivat lumelääkettä. Nenäpolyyppitutkimusten 1 ja 2 tulokset esitetään taulukossa 8.
Taulukko 8 Kliinisten arvojen muutos lähtötasosta viikolla 24 nenäpolyyppitutkimuksesta 1, nenäpolyyppitutkimuksesta 2 ja yhdistetyt tiedot
| Nenäpolyyppi- tutkimus 1 | Nenäpolyyppi- tutkimus 2 | Nenäpolyypit yhdistetyt tulokset | ||||
| lumelääke | omalitsumabi | lumelääke | omalitsumabi | lumelääke | omalitsumabi | |
| n | 66 | 72 | 65 | 62 | 131 | 134 |
| Nenäpolyyppiarvo | ||||||
| Lähtötason keskiarvo | 6,32 | 6,19 | 6,09 | 6,44 | 6,21 | 6,31 |
| Pienimmän neliösumman (LS) keskiarvon muutos viikolla 24 | 0,06 | -1,08 | -0,31 | -0,90 | -0,13 | -0,99 |
| Muutos (95 % luottamusväli) | -1,14 (-1,59; -0,69) | -0,59 (-1,05; -0,12) | -0,86 (-1,18; -0,54) | |||
| p-arvo | < 0,0001 | 0,0140 | < 0,0001 | |||
| Nenän tukkoisuuden 7 päivän keskiarvo | ||||||
| Lähtötason keskiarvo | 2,46 | 2,40 | 2,29 | 2,26 | 2,38 | 2,34 |
| Pienimmän neliösumman (LS) keskiarvon muutos viikolla 24 | -0,35 | -0,89 | -0,20 | -0,70 | -0,28 | -0,80 |
| Muutos (95 % luottamusväli) | -0,55 (-0,84; -0,25) | -0,50 (-0,80; -0,19) | -0,52 (-0,73; -0,31) | |||
| p-arvo | 0,0004 | 0,0017 | < 0,0001 | |||
| Nenäoirearvojen yhteispisteet (TNSS) | ||||||
| Lähtötason keskiarvo | 9,33 | 8,56 | 8,73 | 8,37 | 9,03 | 8,47 |
| Pienimmän neliösumman (LS) keskiarvon muutos viikolla 24 | -1,06 | -2,97 | -0,44 | -2,53 | -0,77 | -2,75 |
| Muutos (95 % luottamusväli) | -1,91 (-2,85; -0,96) | -2,09 (-3,00; -1,18) | -1,98 (-2,63; -1,33) | |||
| p-arvo | 0,0001 | < 0,0001 | < 0,0001 | |||
| SNOT-22 | ||||||
| Lähtötason keskiarvo | 60,26 | 59,82 | 59,80 | 59,21 | 60,03 | 59,54 |
| Pienimmän neliösumman (LS) keskiarvon muutos viikolla 24 | -8,58 | -24,70 | -6,55 | -21,59 | -7,73 | -23,10 |
| Muutos (95 % luottamusväli) | -16,12 (-21,86; -10,38) | -15,04 (-21,26; -8,82) | -15,36 (-19,57; -11,16) | |||
| p-arvo | < 0,0001 | < 0,0001 | < 0,0001 | |||
| (MID = 8,9) | ||||||
| UPSIT | ||||||
| Lähtötason keskiarvo | 13,56 | 12,78 | 13,27 | 12,87 | 13,41 | 12,82 |
| Pienimmän neliösumman (LS) keskiarvon muutos viikolla 24 | 0,63 | 4,44 | 0,44 | 4,31 | 0,54 | 4,38 |
| Muutos (95 % luottamusväli) | 3,81 (1,38; 6,24) | 3,86 (1,57; 6,15) | 3,84 (2,17; 5,51) | |||
| p-arvo | 0,0024 | 0,0011 | < 0,0001 | |||
LS = least-square; TNSS = Total nasal symptom score; SNOT-22 = Sino-Nasal Outcome Test 22 ‑kysely; UPSIT = Pennsylvanian yliopiston hajujen tunnistustesti; MID = minimal important difference (pienin merkittävä muutos).
Kuva 1 Nenän tukkoisuusarvon keskimuutos lähtötasosta ja nenäpolyyppiarvon keskimuutos lähtötasosta hoitoryhmittäin nenäpolyyppitutkimuksissa 1 ja 2
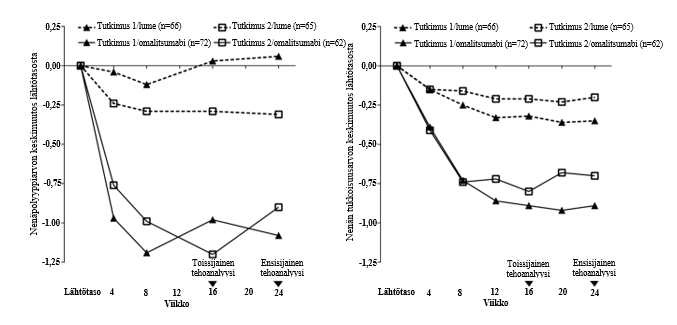
Ennakkoon määritellyssä lisähoidon käyttöä (systeeminen kortikosteroidi ≥ 3 peräkkäisenä päivänä tai nenäpolyypin poistoleikkaus) 24 hoitoviikon aikana koskeneessa yhdistetyssä analyysissä havaittiin, että pienempi osuus omalitsumabihoitoa saaneista potilaista tarvitsi lisähoitoa (2,3 %) verrattuna lumelääkettä saaneisiin potilaisiin (6,2 %). Ristitulosuhde lisähoidon käyttämiselle omalitsumabiryhmässä vs. lumelääkeryhmässä oli 0,38 (95 % luottamusväli 0,10-1,49). Sinonasaalisia leikkauksia ei ilmoitettu kummassakaan tutkimuksessa.
Omalitsumabin pitkäaikaista tehoa ja turvallisuutta tutkittiin avoimessa jatkotutkimuksessa potilailla, jotka olivat osallistuneet nenäpolyyppitutkimuksiin 1 ja 2. Potilailla oli krooninen rinosinuiitti, johon liittyy nenäpolyyppeja. Tutkimuksesta saadut tulokset viittaavat siihen, että viikolla 24 saavutettu kliininen teho säilyi viikolle 52 asti. Turvallisuustulokset olivat yleisesti ottaen yhdenmukaisia omalitsumabin tunnetun turvallisuusprofiilin kanssa.
Krooninen spontaani urtikaria
Omalitsumabin teho ja turvallisuus osoitettiin kahdessa satunnaistetussa, lumekontrolloidussa vaiheen III tutkimuksessa (tutkimukset 1 ja 2) kroonista spontaania urtikariaa sairastavilla potilailla, joiden oireet eivät olleet hävinneet hyväksyttyjen H1-antihistamiiniannosten käytöstä huolimatta. Kolmannessa tutkimuksessa (tutkimus 3) arvioitiin pääasiassa omalitsumabin turvallisuutta kroonista spontaania urtikariaa sairastavilla potilailla, joiden oireet eivät olleet hävinneet H1‑antihistamiinihoidosta (enintään nelinkertainen hyväksytty annos) ja H2‑antihistamiinihoidosta ja/tai leukotrieenireseptoriantagonistihoidosta huolimatta. Kolmeen tutkimukseen otettiin 975 iältään 12–75-vuotiasta potilasta (ikäkeskiarvo 42,3 vuotta; 39 potilasta 12–17 vuotta, 54 potilasta ≥65 vuotta; 259 miestä ja 716 naista). Kaikilla potilailla oli oltava riittämätön oireiden hallinta viikoittaisilla urtikaria-aktiivisuuspisteillä eli UAS7-asteikolla mitattuna (≥16 asteikolla 0–42) ja kutinan viikoittainen vaikeusastepistemäärä ≥8 (asteikolla 0–21, UAS7-asteikon osa) seitsemän päivän ajan ennen satunnaistamista huolimatta siitä, että he olivat käyttäneet antihistamiinia jo vähintään kahden viikon ajan.
Tutkimuksissa 1 ja 2 kutinan viikoittaisten vaikeusastepisteiden keskiarvo oli lähtötilanteessa 13,7–14,5 ja UAS7-pistekeskiarvo 29,5 tutkimuksessa 1 ja 31,7 tutkimuksessa 2. Turvallisuustutkimuksessa 3 kutinan viikoittaisten vaikeusastepisteiden keskiarvo oli potilailla lähtötilanteessa 13,8 ja UAS7-pistekeskiarvo 31,2. Kaikissa kolmessa tutkimuksessa potilaat ilmoittivat käyttäneensä kroonisen spontaanin urtikarian oireisiin keskimäärin 4–6 lääkettä (myös H1-antihistamiineja) ennen tutkimukseen osallistumista. Potilaille annettiin 75 mg, 150 mg tai 300 mg omalitsumabiannoksia tai lumelääkettä injektiona ihon alle 4 viikon välein 24 viikon ajan tutkimuksessa 1 ja 12 viikon ajan tutkimuksessa 2 ja 300 mg omalitsumabia tai lumelääkettä injektiona ihon alle 4 viikon välein 24 viikon ajan tutkimuksessa 3. Kaikkiin tutkimuksiin kuului 16 viikon pituinen hoidoton seurantajakso.
Ensisijainen päätetapahtuma oli kutinan viikoittaisten vaikeusastepisteiden muutos lähtötilanteesta viikolle 12. Omalitsumabi (300 mg) pienensi pistemäärää 8,55–9,77 pisteellä (p<0,0001) verrattuna 3,63–5,14 pisteen pienenemiseen lumeryhmässä (ks. taulukko 9). Tilastollisesti merkitseviä tuloksia havaittiin myös UAS7≤6 vasteprosenteissa (viikolla 12), jotka olivat suurempia 300 mg ‑hoitoryhmissä (52–66 %, p<0,0001) kuin lumeryhmissä (11–19 %). Täydellisen vasteen (UAS7=0) saavutti 34–44 % (p<0,0001) 300 mg annoksia saaneista potilaista verrattuna lumeryhmiin (5–9%). 300 mg ‑hoitoryhmien potilailla oli keskimäärin eniten angioedeemavapaita päiviä viikoilla 4–12 (91,0–96,1 %; p<0,001) verrattuna lumeryhmiin (88,1–89,2 %). DLQI (Dermatology Life Quality Index) ‑kokonaispistemäärän keskimuutos lähtötilanteesta viikolle 12 oli suurempi 300 mg ‑hoitoryhmissä (p<0,001) kuin lumeryhmissä. Pistemäärä kohentui 9,7–10,3 pisteellä verrattuna 5,1–6,1 pisteeseen vastaavissa lumeryhmissä.
Taulukko 9 Kutinan viikoittaisten vaikeusastepisteiden muutos lähtötilanteesta viikolle 12 tutkimuksissa 1, 2 ja 3 (korjattu hoitoaikomuspopulaatio*)
| Lume | Omalitsumabi300 mg | |
| Tutkimus 1 | ||
| N | 80 | 81 |
| Keskiarvo (keskihajonta) | -3,63 (5,22) | -9,40 (5,73) |
| Pienimmän neliösumman keskiarvojen ero vs. lume1 | - | -5,80 |
| Eron 95 % luottamusväli | - | -7,49, -4,10 |
| P-arvo vs. lume2 | - | < 0,0001 |
| Tutkimus 2 | ||
| N | 79 | 79 |
| Keskiarvo (keskihajonta) | -5,14 (5,58) | -9,77 (5,95) |
| Pienimmän neliösumman keskiarvojen ero vs. lume1 | - | -4,81 |
| Eron 95 % luottamusväli | - | -6,49, -3,13 |
| P-arvo vs. lume2 | - | < 0,0001 |
| Tutkimus 3 | ||
| N | 83 | 252 |
| Keskiarvo (keskihajonta) | -4,01 (5,87) | -8,55 (6,01) |
| Pienimmän neliösumman keskiarvojen ero vs. lume1 | - | ‑4,52 |
| Eron 95 % luottamusväli | - | -5,97, -3,08 |
| P-arvo vs. lume2 | - | < 0,0001 |
*Korjattuun hoitoaikomuspopulaatioon kuuluivat kaikki potilaat, jotka satunnaistettiin ja jotka saivat vähintään yhden annoksen tutkimuslääkettä.
Lähtötilanteen jälkeen mitattuja arvoja käytettiin korvaamaan myöhemmistä mittauskohdista puuttuvia tietoja.
1 Pienimmän neliösumman keskiarvo arvioitiin ANCOVA-mallilla. Ositteet olivat kutinan viikoittaiset vaikeusastepisteet lähtötilanteessa (<13 vs. ≥13) ja paino lähtötilanteessa (<80 kg vs. ≥80 kg).
2 p-arvo perustuu ANCOVA-t-testiin.
Kuvassa 2 esitetään kutinan viikoittaisten vaikeusastepisteiden keskiarvo suhteessa aikaan tutkimuksessa 1. Kutinan viikoittaisten vaikeusastepisteiden keskiarvo pieneni merkitsevästi. Noin viikolla 12 havaittu maksimivaikutus säilyi 24 viikon hoitojakson ajan. Tulokset olivat samaa luokkaa tutkimuksessa 3.
Kaikissa kolmessa tutkimuksessa kutinan viikoittaisten vaikeusastepisteiden keskiarvo suureni vaiheittain 16 viikon hoidottoman seurantajakson aikana samalla, kun oireet uusiutuivat. Seurantajakson lopussa keskiarvot olivat samaa luokkaa kuin lumeryhmässä mutta pienempiä kuin vastaavat lähtökeskiarvot.
Kuva 2 Kutinan viikoittaisten vaikeusastepisteiden keskiarvo suhteessa aikaan tutkimuksessa 1 (korjattu hoitoaikomuspopulaatio)
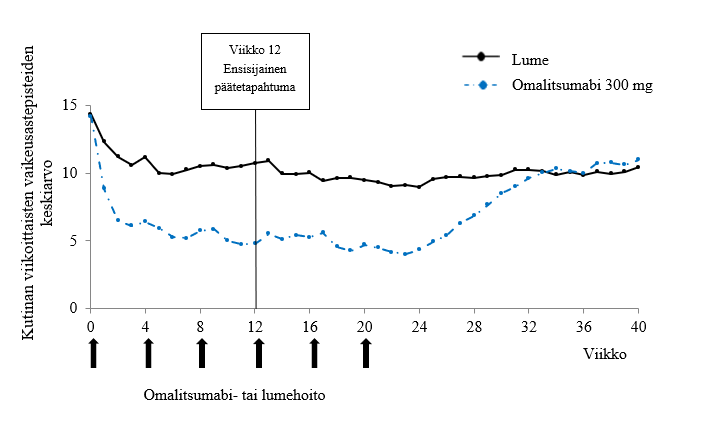
Viikolla 24 havaittujen tehotulosten suuruusluokka oli verrattavissa viikolla 12 havaittuihin tuloksiin:
Kutinan viikoittainen vaikeusastepistemäärä pieneni lähtötilanteesta 300 mg annoksilla keskimäärin 9,8 pistettä tutkimuksessa 1 ja keskimäärin 8,6 pistettä tutkimuksessa 3. Niiden potilaiden osuus, joiden UAS7 oli ≤6, oli 61,7 % tutkimuksessa 1 ja 55,6 % tutkimuksessa 3. Täydellinen vaste (UAS7=0) saatiin 48,1 %:lle potilaista tutkimuksessa 1 ja 42,5 %:lle potilaista tutkimuksessa 3. Kaikissa p oli <0,0001 verrattuna lumelääkkeeseen.
Kliinisten tutkimusten tiedot nuorista (12–17-vuotiaita) koostuivat yhteensä 39 potilaasta, joista 11 sai 300 mg annoksia. Yhdeksän potilaan osalta on tulokset annoksella 300 mg viikon 12 kohdalla ja kuuden potilaan osalta viikon 24 kohdalla. Tulokset näyttävät omalitsumabihoitovasteen olevan samaa luokkaa kuin aikuispopulaatiossa. Kutinan viikoittaisten vaikeusastepisteiden keskiarvon keskimääräinen muutos lähtötilanteesta osoitti 8,25 pisteen vähenemisen viikolla 12 ja 8,95 pisteen vähenemisen viikolla 24. Vastesuhteet olivat: 33 % viikolla 12 ja 67 % viikolla 24 (UAS7=0) ja 56 % viikolla 12 ja 67 % viikolla 24 (UAS7≤6).
48 -viikon pituisessa tutkimuksessa 206 iältään 12–75-vuotiasta potilasta otettiin mukaan 24 ‑viikon pituiseen avoimeen tutkimusjaksoon, jossa hoitona oli 300 mg omalitsumabia joka 4. viikko. Potilaat, jotka saivat hoitovasteen avoimen tutkimusjakson aikana, satunnaistettiin saamaan joko 300 mg omalitsumabia (81 potilasta) tai lumelääkettä (53 potilasta) joka 4. viikko vielä toiset 24 ‑viikkoa.
Potilaista, jotka pysyivät omalitsumabi-hoidolla 48 viikon ajan, 21 % koki kliinistä pahenemista (UAS7 pisteytys ≥12 ainakin 2 peräkkäisen viikon ajan satunnaistamisen jälkeen viikkojen 24 ja 48 välillä). Vastaavasti lumelääkehoidon aikana 60,4 % koki kliinistä pahenemista 48 viikon kohdalla (ero −39,4 %, p<0,0001, 95 % CI: −54,5 %, −22,5 %).
Farmakokinetiikka
Omalitsumabin farmakokinetiikkaa on tutkittu aikuisilla ja nuorilla potilailla, joilla on allerginen astma, aikuisilla potilailla, joilla on krooninen rinosinuiitti, johon liittyy nenäpolyyppeja, sekä kroonista spontaania urtikariaa sairastavilla aikuisilla ja nuorilla. Omalitsumabin yleinen farmakokinetiikka on samanlaista näissä potilaspopulaatioissa.
Imeytyminen
Ihon alle annon jälkeen omalitsumabi imeytyy siten, että sen absoluuttinen biologinen hyötyosuus on keskimäärin 62 %. Kun astmaa tai kroonista spontaania urtikariaa sairastaville aikuisille ja nuorille annettiin ihon alle kerta-annos omalitsumabia, se imeytyi hitaasti, ja huippupitoisuudet seerumissa saavutettiin keskimäärin 6‒8 vuorokaudessa. Astmapotilaista mitatut toistuvasti annetun omalitsumabin AUC-arvot olivat vakaassa tilassa päivän 0 ja päivän 14 välillä jopa kuusinkertaiset verrattuna ensimmäisen annoksen jälkeen mitattuihin arvoihin.
Omalitsumabin farmakokinetiikka on lineaarinen, kun annokset ovat yli 0,5 mg/kg. Neljän viikon välein annettujen 75 mg, 150 mg ja 300 mg annosten jälkeen omalitsumabin minimipitoisuudet seerumissa suurenivat suhteessa annokseen potilaissa, joilla oli krooninen spontaani urtikaria.
Omalitsumabin seerumin pitoisuus/aika-kuvaajat olivat samanlaiset, kun annettiin kylmäkuivattuna tai injektionesteenä valmistettua Xolairia.
Jakautuminen
In vitro omalitsumabi muodostaa IgE:n kanssa pienehköjä komplekseja. In vitro tai in vivo ei ole havaittu sakkautuneita komplekseja eikä molekyylipainoltaan yli miljoonan daltonin komplekseja. Populaatiofarmakokinetiikan perusteella omalitsumabin jakautuminen oli samanlaista allergista astmaa ja kroonista spontaania urtikariaa sairastavissa potilaissa. Ihon alle annon jälkeen näennäinen jakautumistilavuus oli astmapotilaissa 78 ± 32 ml/kg.
Eliminaatio
Omalitsumabi eliminoituu IgG-puhdistumaprosessien kautta sekä sitoutumalla spesifisesti kohdeligandinsa IgE:hen ja muodostamalla komplekseja sen kanssa. IgG eliminoituu maksan kautta siten, että retikuloendoteliaalijärjestelmä ja endoteelisolut hajottavat sen. IgG erittyy myös sellaisenaan sappeen. Astmapotilaissa omalitsumabin eliminoitumisen puoliintumisaika seerumissa oli keskimäärin 26 vuorokautta, ja sen näennäinen puhdistuma oli keskimäärin 2,4 ± 1,1 ml/kg/vrk. Painon kaksinkertaistuminen suurensi näennäisen puhdistuman noin kaksinkertaiseksi. Populaatiofarmakokineettisten simulaatioiden perusteella kroonista spontaania urtikariaa sairastavien potilaiden seerumissa omalitsumabin vakaan tilan eliminaation puoliintumisaika seerumissa oli keskimäärin 24 päivää ja vakaan tilan näennäinen puhdistuma 3,0 ml/kg/vrk, kun potilas painaa 80 kg.
Potilasryhmiin liittyvät tekijät
Ikä, rotu/etninen alkuperä, sukupuoli, painoindeksi
Allergista astmaa tai kroonista rinosinuiittia, johon liittyy nenäpolyyppeja, sairastavat potilaat
Omalitsumabin populaatiofarmakokinetiikka analysoitiin demografisten ominaisuuksien vaikutusten arvioimiseksi. Näiden niukkojen tietojen analyysit viittasivat siihen, ettei annoksen muuttaminen ole tarpeen iän (6–76-vuotiaat potilaat, joilla on allerginen astma; 18–75-vuotiaat potilaat, joilla on krooninen rinosinuiitti, johon liittyy nenäpolyyppeja), rodun tai etnisen alkuperän, sukupuolen tai painoindeksin perusteella (ks. kohta Annostus ja antotapa).
Kroonista spontaania urtikariaa sairastavat potilaat
Demografisten tekijöiden ja muiden tekijöiden vaikutuksia omalitsumabialtistukseen arvioitiin populaatiofarmakokinetiikan perusteella. Myös kovariaattivaikutuksia arvioitiin analysoimalla omalitsumabipitoisuuksien ja kliinisten vasteiden suhdetta. Analyysit viittaavat siihen, että annosmuutokset eivät ole tarpeen kroonista spontaania urtikariaa sairastaville potilaille iän (12–75 vuotta), rodun tai etnisen taustan, sukupuolen, painon, painoindeksin, lähtötilanteen IgE-pitoisuuden, FcεRI-autovasta-aineiden eikä H2-antihistamiinien tai leukotrieenireseptoriantagonistien samanaikaisen käytön perusteella.
Munuaisten ja maksan vajaatoiminta
Farmakokineettisiä ja farmakodynaamisia tietoja ei ole allergista astmaa tai kroonista spontaania urtikariaa sairastavista potilaista, joilla on munuaisten tai maksan vajaatoiminta (ks. kohdat Annostus ja antotapa ja Varoitukset ja käyttöön liittyvät varotoimet).
Prekliiniset tiedot turvallisuudesta
Omalitsumabin turvallisuutta on tutkittu cynomolgus-apinoilla, koska omalitsumabi sitoutuu cynomolgus-apinoiden ja ihmisen IgE:hen samankaltaisella affiniteetilla. Joistakin apinoista havaittiin omalitsumabivasta-aineita, kun lääkettä annettiin toistuvasti ihon alle tai laskimoon. Ilmeistä toksisuutta, kuten immuunikompleksivälitteisiä sairauksia tai komplementista riippuvaa sytotoksisuutta, ei kuitenkaan havaittu. Cynomolgus-apinoista ei havaittu viitteitä syöttösolujen degranulaation aiheuttamiin anafylaktisiin reaktioihin.
Pitkäaikaisesti annettu omalitsumabi aina annoksiin 250 mg/kg asti (vähintään 14-kertainen annos suhteessa suositusannostaulukon mukaiseen suurimpaan suositeltuun kliiniseen annokseen laskettuna milligrammoina/kg) oli hyvin siedettyä kädellisillä (aikuisilla ja nuorilla eläimillä). Poikkeus oli annoksesta ja iästä riippuva verihiutalearvojen lasku, jota havaittiin etenkin nuorissa eläimissä. Seerumin lääkeainepitoisuus, joka pienensi lähtötason verihiutalearvon puoleen aikuisissa cynomolgus-apinoissa, oli noin 4‑20-kertainen suurimpiin odotettavissa oleviin kliinisiin seerumin pitoisuuksiin verrattuna. Lisäksi cynomolgus-apinoissa havaittiin pistoskohdan akuutteja verenvuotoja ja tulehduksia.
Omalitsumabilla ei ole tehty virallisia karsinogeenisuustutkimuksia.
Cynomolgus-apinoilla tehdyissä lisääntymistutkimuksissa ihon alle annetut enintään 75 mg/kg:n annokset/viikko (vähintään 8-kertainen annos suhteessa suurimpaan suositeltuun kliiniseen annokseen laskettuna milligrammoina/kg neljän viikon aikana) eivät olleet toksisia emolle eivätkä sikiölle eikä niillä ollut teratogeenista vaikutusta, kun niitä annettiin koko organogeneesin ajan. Niillä ei myöskään ollut haittavaikutuksia sikiön tai vastasyntyneen kasvuun, kun niitä annettiin tiineyden myöhäisvaiheessa sekä synnytyksen ja imetyksen aikana.
Omalitsumabi erittyy nisämaitoon cynomolgus-apinoissa. Omalitsumabin pitoisuus maidossa oli 0,15 % emon seerumissa havaittavasta pitoisuudesta.
Farmaseuttiset tiedot
Apuaineet
Arginiinihydrokloridi
Histidiinihydrokloridimonohydraatti
Histidiini
Polysorbaatti 20
Injektionesteisiin käytettävä vesi
Yhteensopimattomuudet
Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden kanssa.
Kestoaika
18 kuukautta
Valmistetta voidaan säilyttää korkeintaan 48 tuntia 25 °C:ssa.
Säilytys
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Pakkaukset ja valmisteen kuvaus
Markkinoilla olevat pakkaukset
Resepti
XOLAIR injektioneste, liuos, esitäytetty kynä
300 mg (L:ei) 2 ml (689,16 €)
XOLAIR injektioneste, liuos, esitäytetty ruisku
150 mg (L:ei) 1 ml (esikiinnitetty 27 G neula) (358,47 €)
PF-selosteen tieto
Xolair 150 mg injektioneste, liuos, esitäytetty ruisku (esikiinnitetty 26 G neula, liila ruiskun suojalaite)
Xolair 150 mg injektioneste, liuos, esitäytetty ruisku sisältää 1 ml liuosta tyypin I lasista valmistetussa esitäytetyssä ruiskun runko‑osassa. Ruiskussa on ruostumattomasta teräksestä valmistettu esikiinnitetty 26 G neula, männän pysäytin (tyyppi I) ja neulansuojus.
Pakkauskoot: Pakkauksessa on 1 esitäytetty ruisku ja kerrannaispakkauksissa 4 (4 x 1), 6 (6 x 1) tai 10 (10 x 1) esitäytettyä ruiskua.
Xolair 150 mg injektioneste, liuos, esitäytetty ruisku (esikiinnitetty 27 G neula, liila mäntä)
Xolair 150 mg injektioneste, liuos, esitäytetty ruisku sisältää 1 ml liuosta tyypin I lasista valmistetussa esitäytetyssä ruiskun runko‑osassa. Ruiskussa on ruostumattomasta teräksestä valmistettu esikiinnitetty 27 G neula, männän pysäytin (tyyppi I) ja neulansuojus.
Pakkauskoot: Pakkauksessa on 1 esitäytetty ruisku ja kerrannaispakkauksissa 3 (3 x 1) tai 6 (6 x 1) esitäytettyä ruiskua.
Xolair 300 mg injektioneste, liuos, esitäytetty ruisku
Xolair 300 mg injektioneste, liuos, esitäytetty ruisku sisältää 2 ml liuosta tyypin I lasista valmistetussa esitäytetyssä ruiskun runko‑osassa. Ruiskussa on ruostumattomasta teräksestä valmistettu esikiinnitetty 27 G neula, männän pysäytin (tyyppi I) ja neulansuojus.
Pakkauskoot: Pakkauksessa on 1 esitäytetty ruisku ja kerrannaispakkauksissa 3 (3 x 1) tai 6 (6 x 1) esitäytettyä ruiskua.
Xolair 150 mg injektioneste, liuos, esitäytetty kynä
Xolair 150 mg injektioneste, liuos, esitäytetty kynä sisältää 1 ml liuosta tyypin I lasista valmistetussa esitäytetyssä kynän runko‑osassa. Kynässä on ruostumattomasta teräksestä valmistettu esikiinnitetty 27 G neula, männän pysäytin (tyyppi I) ja neulansuojus.
Pakkauskoot: Pakkauksessa on 1 esitäytetty kynä ja kerrannaispakkauksissa 3 (3 x 1), 6 (6 x 1) tai 10 (10 x 1) esitäytettyä kynää.
Xolair 300 mg injektioneste, liuos, esitäytetty kynä
Xolair 300 mg injektioneste, liuos, esitäytetty kynä sisältää 2 ml liuosta tyypin I lasista valmistetussa esitäytetyssä kynän runko‑osassa. Kynässä on ruostumattomasta teräksestä valmistettu esikiinnitetty 27 G neula, männän pysäytin (tyyppi I) ja neulansuojus.
Pakkauskoot: Pakkauksessa on 1 esitäytetty kynä ja kerrannaispakkauksissa 3 (3 x 1) tai 6 (6 x 1) esitäytettyä kynää.
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Valmisteen kuvaus:
Kirkas tai hieman opaalinhohtoinen, väritön tai haalean ruskeankeltainen liuos.
Käyttö- ja käsittelyohjeet
Esitäytetty ruisku
Kertakäyttöinen esitäytetty ruisku on tarkoitettu yhteen käyttökertaan. Se on otettava jääkaapista esille 30 minuuttia ennen lääkkeen pistämistä, jotta lääke ehtii lämmetä huoneenlämpöiseksi.
Esitäytetty kynä
Kertakäyttöinen esitäytetty kynä on tarkoitettu yhteen käyttökertaan. Se on otettava jääkaapista esille 30 minuuttia ennen lääkkeen pistämistä, jotta lääke ehtii lämmetä huoneenlämpöiseksi.
Hävittämisohjeet
Hävitä käytetty ruisku tai kynä heti laittamalla se pistävälle jätteelle tarkoitettuun astiaan.
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.
Korvattavuus
XOLAIR injektioneste, liuos, esitäytetty kynä
300 mg 2 ml
XOLAIR injektioneste, liuos, esitäytetty ruisku
150 mg 1 ml
- Rajoitettu peruskorvaus lääkärin lausunnolla (40 %). Omalitsumabi: Vaikean ja vaikeahoitoisen allergisen astman sekä vaikean kroonisen spontaanin urtikarian hoito erityisin edellytyksin (344).
- Oikeus käyttää samaa biologista lääkettä (sama kauppanimi) 6 kk ajan.
ATC-koodi
R03DX05
Valmisteyhteenvedon muuttamispäivämäärä
21.05.2025
Yhteystiedot
 NOVARTIS FINLAND OY
NOVARTIS FINLAND OY Revontulenkuja 1
02100 Espoo
010 613 3200
www.novartis.fi
Lääkeinformaatiopalvelu 010 6133 210,
medinfo.nordics@novartis.com
